Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.15 no.2 Bogotá Mayo/Aug. 2010
ECOLOGÍA TÉRMICA Y PATRÓN DE ACTIVIDAD DEL LAGARTO Tropidurus hispidus (SAURIA: TROPIDURIDAE) EN EL ORIENTE DE VENEZUELA.
Thermal Ecology and Activity Pattern Lizard Tropidurus hispidus(Sauria: Tropiduridae) in the East of Venezuela.
JENNIFFER VELÁSQUEZ1, Bióloga; LUIS ALEJANDRO GONZÁLEZ S.1, Biólogo. 1Postgrado en Zoología, Instituto de Zoología Tropical, UniversidadCentral de Venezuela, Caracas, Venezuela. j_v_mendoza@yahoo.es
Presentado 4 de abril de 2009, aceptado 2 de julio de 2009, correcciones 23 de mayo de 2010
RESUMEN
Se estudiaron aspectos de ecología térmica y patrón de actividad del lagarto Tropidurus hispidus en un bosque tropófilo del estado Sucre, Venezuela entre junio de 2007 y mayo de 2008. La temperatura media corporal fue de 35,68±1,4 ºC y con un intervalo entre 32,6 y 37,80 ºC. En hembras el intervalo de temperatura corporal (Tc) en sequía fue 34-38 ºC y en lluvia fluctuó entre 32-38 ºC. En machos el intervalo de temperatura corporal (Tc) en sequía fue 35-37ºC y en lluvia 34-35 ºC. Mediante una regresión lineal, no se encontró relación entre la temperatura del aire (Ta) y sustrato (Ts). La tendencia termorreguladora indica que la especie es termorreguladora activa durante el período de sequía y lluvia. Dividiendo la actividad horaria en tres segmentos: matutino, medio día y vespertino, el patrón de actividad fue bimodal en sequía y unimodal en lluvia. Para relacionar el patrón de actividad con las variables ambientales (aire y sustrato) se utilizó la correlación de Pearson, en sequia se obtuvo una correlación negativa con la temperatura del aire (-0,78) y con el sustrato (-0,65). En lluvia no se relacionó con la temperatura del aire (-0,056) ni con el sustrato (-0,040). La amplitud del nicho térmico se calculó empleando el índice de Levins, no observándose diferencias apreciables entre machos y hembras en ambos períodos y la sobreposición de nicho térmico entre sexos, obtenido mediante el índice de Pianka, fue 0,81 en lluvia y 0,90 en sequía.
Palabras clave: Lagarto, Tropidurus hispidus, termorregulación, actividad, Venezuela.
ABSTRACT
We studied aspects of thermal ecology and activity patterns in the lizard Tropidurus hispidus in a forest tropophic of Sucre State, Venezuela between June 2007 and May 2008. The body temperature was 35.68±1.4 °C from 32.6 to 37.80 °C. Females body temperature (Tb) in drought and rainfall was 34-38 ºC and 32-38 ºC, respectively. In males the range of body temperature (Tb) in drought was 35-37 °C and 34-35 °C. in rain. No relation was found between the air temperature (Ta) and substrate temperature (Ts). Thermoregulatory trend, indicate active thermoregulation in drought and rain. Dividing the activity into three time segments: morning, afternoon and evening and the pattern of activity was bimodal in drought and unimodal in rain. To relate the pattern of activity with environmental variables (air and substrate) using the Pearson correlation in drought was a negative correlation with air temperature (-0.780) and with the substrate (-0.65). Rain was not associated with the air temperature (-0.056) or the substrate (-0.040). The thermal niche breadth was calculated using the Levins index, we did not find significant differences between males and females in both periods and thermal niche overlap between sexes, obtained by the Pianka index was 0.81 in rain and 0.90 in drought.
Key words: Lizard, Tropidurus hispidus, Thermoregulation, Activity, Venezuela.
INTRODUCCIÓN
El desarrollo del período de actividad de los organismos en un ecosistema es una estrategia que ha moldeado la estructura de las comunidades a través de la evolución. La variabilidad de la actividad temporal, diaria y estacional con el uso diferencial del microhábitat, representan los mecanismos termorregulatorios más importantes en ectotermos. Por lo tanto, la actividad de una especie es una respuesta a las características térmicas del ambiente (Labra et al., 2001; Smith y Ballinger, 2001; Hatano et al., 2001). La interacción entre ecología térmica, uso del hábitat y ciclos de actividad es vital en saurios que viven en medios desérticos y semidesérticos, donde existe una menor disponibilidad de temperaturas operantes favorables, trayendo como consecuencia la restricción de la actividad y uso del hábitat (Grant, 1990; Adolph, 1990).
Los lagartos pueden mantener una temperatura corporal relativamente alta haciendo uso de radiación solar (heliotermia) y de la temperatura del sustrato (tigmotermia) (Pianka y Vitt, 2003). Además, desarrollan estrategias termorreguladoras que permiten mantener la temperatura corporal por encima de la temperatura ambiental (termorregulación activa) o incrementando su temperatura conforme aumenta la ambiental (termorregulación pasiva o termoconformismo) (Zug et al., 2001).
Los saurios pertenecientes a la familia Tropiduridae están distribuidos desde las Bahamas hasta Sudamérica. El lagarto Tropidurus hispidus, llamado popularmente -güaripete- o -güaricongo-, se distribuye al noreste de Sudamérica en países como Brasil, Guyana Francesa, Colombia y Surinam (Avila-Pires, 1995). En Venezuela se ubica en los estados Barinas y Portuguesa (Markezich, 2002), en diferentes zonas xerofíticas del estado Sucre (península de Araya, costa del golfo de Cariaco, Carúpano e islas cercanas) (Rivas y Oliveros, 1997; Cornejo y Prieto, 2001; González et al., 2004a). Además, en zonas no xerofíticas de los estados Sucre, Monagas y Bolívar, llanos centrales y orientales.
Debido a la amplia distribución que ha tenido T. hispidus en diferentes zonas del oriente venezolano, algunos autores han estudiado aspectos de su biología (Prieto et al., 1976; González, 1994; González et al., 2004b; Velásquez et al., 2007). En el presente trabajo se reportan datos sobre la ecología térmica y el patrón de actividad de T. hispidus en un bosque tropófilo del estado Sucre, Venezuela.
MATERIALES Y MÉTODOS
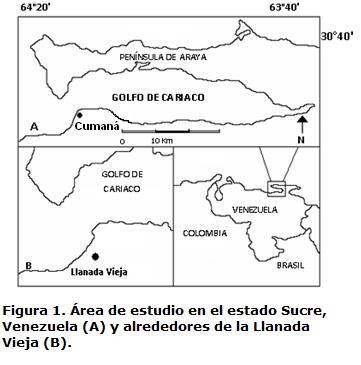
ÁREA DE ESTUDIO
Los muestreos se llevaron a cabo en los alrededores de la Llanada Vieja (10º 23’ N y 64º 10’ O) municipio Sucre, estado Sucre, Venezuela (Fig. 1). La zona se caracteriza por presentar precipitaciones anuales irregulares menores a 300 mm, con una temperatura promedio anual que varía entre 23 y 29 °C (Foghin-Pillin, 2002) y por ser un bosque tropófilo macrotérmico, con una vegetación de carácter deciduo, compuesta por tres estratos: 1. Arbóreo, dominado principalmente por Bourreria cumanensis, Capparis pacchaca, C. linearis, Mimosa arenosa, Cereus griseus, Subpilocereus repandus, Pilosocereus morotzianus, Plumeria alba y Bursera siomaruba. 2. Arbustivo, destacándose Calliandra sp., Opuntia lilae, O. elatior. 3. Herbáceo, constituido por plántulas de diversos árboles y arbustos, Melocactus curvispinus, Evollvulus sp., Convolvulus sp. y Bromelia humilis (Cumana, 2005).
FASE DE CAMPO
Las capturas se realizaron desde junio de 2007 hasta mayo de 2008. Para el patrón de actividad se registró la hora cuando se avistó cada individuo. Se capturaron, aleatoriamente, 38 lagartos (20 hembras y 18 machos) con un rifle de aire calibre 4,5 (los ejemplares capturados también forman parte de un estudio de reproducción). Inmediatamente, se tomó la temperatura corporal (Tc) empleando un termómetro digital rectal de lectura rápida, marca Omron (0,1 ºC) y la temperatura del sustrato (Ts, en el lugar de captura) y aire (Ta, a dos metros de altura de dicho sustrato) con un termómetro ambiental digital, marca Precision (0,5 ºC). Durante la captura se trató de no realizar búsquedas continuas, ya que después de avistar el ejemplar y fallar en el primer intento, la temperatura corporal podría ser alterada y no obtener un registro real. Seguidamente, se registró la hora de captura (hora solar) dividiendo la actividad horaria en tres segmentos: matutino (de 7 a 11 horas), central (de 12 a 14 horas) y vespertino (de 15 a 17 horas).
ANÁLISIS DE LA INFORMACIÓN
Ecología térmica. La variación de temperatura corporal se analizó mediante una gráfica de intervalo de clase, donde se indica el número de lagartos observados en un rango de temperatura determinada (González y Prieto, 1999). Se comparó en una gráfica lineal la temperatura corporal (Tc) con la temperatura del aire (Ta) y sustrato (Ts). Para obtener información de la termorregulación se aplicó un análisis de correlación con Tc sobre Ta y Ts. Las tendencias termorreguladoras o termoconformistas se determinaron a partir del criterio de Huey y Slatkin, 1976, quienes mencionan que una especie presenta una termorregulación activa cuando el valor de la pendiente de la regresión lineal de Tc sobre la temperatura ambiental (Ta o Ts) es 0 o cercano a 0. Mientras que es termoconformista (termorregulación pasiva) cuando el valor de la pendiente es 1 ó cercano a 1. La forma de obtención de calor, se determinó con el valor de la correlación entre Tc y Ta, si esta es mayor con respecto a la correlación de Tc y Ts, existe tendencia a la heliotermia, si ocurre lo contrario es tigmotermia.
Patrón de actividad. Para relacionar el patrón de actividad con las variables ambientales (aire y sustrato) se utilizó la correlación de Pearson (Hernández et al., 2007). La amplitud del nicho térmico indica el espacio que ocupan hembras y machos en cada período, bajo condiciones de temperatura que les permita sobrevivir (Pianka, 1993) y se determinó mediante el índice de Levins estandarizado por Hurlbert (Krebs, 1989).
B=1/Σp2j
Pj=Nj
Bs=B-1/n-1
donde B = índice de Levins, pj = proporción de individuos de un sexo en un período de tiempo j, Nj = número de individuos de un sexo en un período de tiempo j, Y = número total de individuos en la muestra, Bs = índice estandarizado de Levins (escala de 0 = mínima amplitud de nicho a 1 = máxima amplitud de nicho) y n = número total de recursos (horas).
La sobreposición de nicho, que indica la intensidad con que hembras y machos utilizan el espacio durante ambos períodos, fue calculado mediante el método de Pianka (Krebs, 1989), cuya ecuación es:
Ojk=(ΣPij Pik)/(( ΣPij Pik)1/2)
donde: Ojk = índice de solapamiento de nicho de Pianka entre hembras (j) y machos (k), pij = proporción que representa el intervalo de tiempo i del total de intervalos utilizados por hembras, pik = proporción que representa el intervalo de tiempo i del total de intervalos utilizados por machos y n = número total de recursos (horas).
RESULTADOS
ECOLOGÍA TÉRMICA
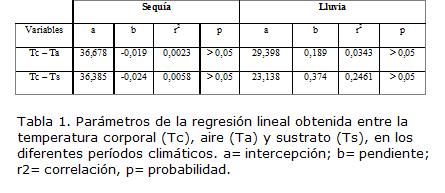
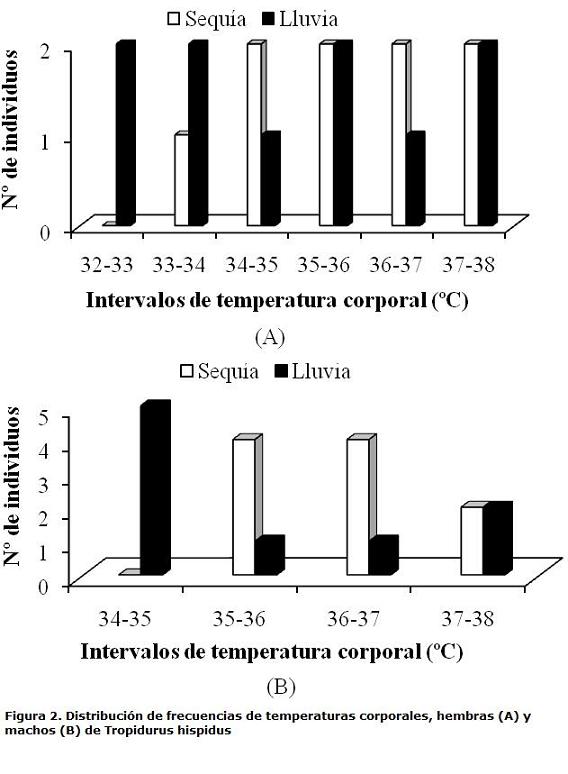
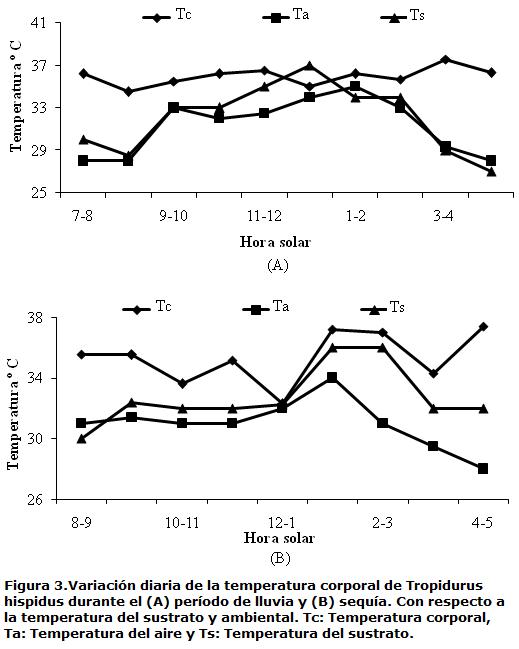
El lagarto T. hispidus mantiene una temperatura media corporal de 35,68±1,40 ºC (32,60-37,80 ºC; n=38) siendo mayor en el período de sequía (36,10ºC±1,07; intervalo 33,50-37,70 ºC; n=19) con respecto al período de lluvia (35,27±1,60 ºC; intervalo 32,60-37,80 ºC; n=19). Al comparar la Tc según los periodos climáticos, no se encontraron diferencias significativas entre las temperaturas (ts=1,89; p<0,05; n=38). Al relacionar la temperatura del microhábitat durante el período de lluvia (aire=31,21 ºC; n=19, suelo=32,45 ºC; n=19) con el período seco (aire=30,63 ºC; n=19, suelo= 31,05 ºC; n=19) no se encontraron diferencias significativas (ANOVA, F3,72=1,69, p<0,001). Se puede observar que el intervalo de temperatura corporal de mayor actividad de hembras durante la sequía fue 34-38 ºC y en lluvia se aprecian fluctuaciones en la temperatura entre 32-38 ºC. En machos, dicho intervalo fue de 35-37 ºC en sequía y 34-35 ºC en lluvia (Figs. 2 A-B), aunque no se presentaron diferencias significativas entre la Tc de los machos (ts=1,43; p<0,05; n=19) y la Tc de las hembras (ts=1,09; p<0,05; n=19) en los periodos climáticos estudiados. La variación diaria de la temperatura corporal sobre la temperatura del aire durante la lluvia, osciló siete grados y en sequía entre seis y ocho grados. Por otro lado, la variación diaria de Tc sobre Ts durante el período lluvioso fluctuó entre cuatro y siete grados y en sequía de tres a siete grados (Figs. 3 A,B). En ambos períodos, Tc se mantuvo por encima de Ts. La ausencia de relación en sequía y lluvia entre Tc con Ta y Ts, indica que los individuos quizás han desarrollado mecanismos de comportamiento para controlar su temperatura corporal. La tendencia termorreguladora indica una termorregulación activa, ya que el valor de la pendiente de la regresión Tc vs. Ta y Tc vs. Ts en el período de lluvia es de 0,2 y 0,4; respectivamente. Mientras que en sequía el valor de la pendiente en ambos análisis fue de -0,02. Con respecto a la forma de obtener calor se encontró que tanto en sequía como en lluvia tiene preferencia hacia la tigmotermia (Tabla 1).
PATRÓN DE ACTIVIDAD
T. hispidus presenta actividad diurna durante todo el día con mayor tendencia a partir de las 7:00 a.m. en sequía y 8:00 a.m. en lluvia. Se observó un patrón bimodal durante la sequía con mayor actividad en el segmento matutino (de 9:00 a.m. a 10:00 a.m.) y en el vespertino (de 4.00 p.m. a 5:00 p.m.). Sin embargo, en lluvias el patrón fue unimodal, presentando mayor actividad matutina (de 9:00 am a 10:00 am), aunque la proporción de individuos fue descendiendo con el avance de la tarde (Fig. 4)
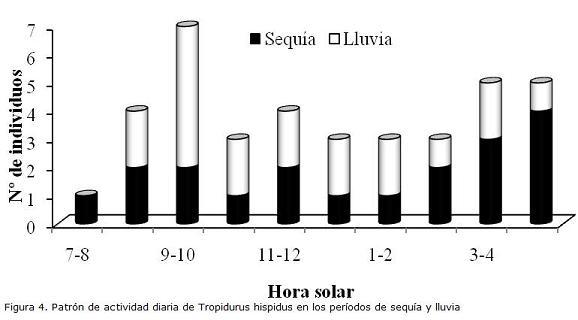
La actividad de los lagartos se correlacionó de forma negativa y no significativa con la temperatura del aire (r = -0,78; P<0,05; n=19) y con la temperatura del sustrato (r = -0,65; P<0,05; n=19) en sequía. Igualmente, durante las lluvias se correlacionó con la temperatura del aire (r = -0,056; P<0,05; n=19) y con la temperatura del sustrato (r = -0,040; P<0,05; n=19). La amplitud del nicho térmico durante la sequía fue mayor en hembras (0,36) que en machos (0,32). Durante las lluvias, fue semejante entre hembras y machos (0,23; 0,22, respectivamente. El solapamiento del nicho térmico entre los sexos en lluvia fue 0,81 y 0,90 en sequía.
DISCUSIÓN
La temperatura corporal media de T. hispidus del presente estudio (35,68 ºC), fue mayor a la señalada (32,2 ºC) por Van Sluys et al., 2004, en afloramientos rocosos en Minas de Gerais, Brasil. Otras investigaciones han reportado rangos de temperaturas corporales desde 32,20 hasta 35,9 ºC en Pernambuco, la Caatinga y afloramientos rocosos en el bosque Amazónico del estado Roraima, señalando que T. hispidus posee una alta temperatura corporal (Vitt, 1995; Vitt et al., 1996). Esta misma característica se presenta en otras especies de la familia Tropiduridae, como es el caso de Tropidurus torquatus en Minas de Gerais en Brasil, donde la temperatura corporal fue de 31,2 3,1 ºC (Ribeiro et al., 2007) y en la costa de la restinga e islas oceánicas del archipiélago de Abrolhos (Bergallo y Rocha, 1993; Texeira-Filho et al., 1996; Gandolfi y Rocha, 1998; Hatano et al., 2001; Rocha et al., 2002; Kiefer et al., 2005).
Rocha, 1995, señala que no sólo las relaciones filogenéticas entre las especies de lagartos influyen en la temperatura corporal aunque vivan en hábitats diferentes, ya que otros factores pueden influir como el patrón de forrajeo, el tiempo que ocupa en una zona y la extensión del área que habitan. Algunas especies de zonas templadas, presentan una temperatura corporal baja con respecto a los ambientes cálidos, siendo esto el resultado de un ajuste de cada población a la temperatura del microhábitat que ocupa (Jáksic y Schwenk, 1983). En zonas tropicales, generalmente, los saurios mantienen una temperatura corporal por encima del sustrato y del ambiente, debido a la gran incidencia solar en estas áreas, permitiéndole salir de sus refugios más temprano en la mañana, mientras que en el bosque húmedo y zonas templadas lo hacen más entrada la mañana (Seva, 1982).
La no diferenciación significativa en la temperatura corporal de hembras y machos entre los períodos climáticos, posiblemente debido a una semejanza en la talla de los lagartos capturados para la realización de este estudio y a las condiciones ambientales donde machos y hembras tienen conductas establecidas que permiten regular la temperatura. Además, algunos autores como Kiefer et al., 2005, han reportado que no hay relación significativa entre la temperatura corporal y el tamaño del cuerpo, sugiriendo que no hay diferencias ontogénicas en la actividad y la temperatura del cuerpo. Sin embargo, esto será estudiado en análisis posteriores.
Con respecto al patrón de actividad, la correlación negativa y no significativa observada de Tc entre Ta y Ts en ambos períodos en el presente estudio, demuestra que T. hispidus ha desarrollado mecanismos de comportamiento conductual que le permite conservar el calor, siendo esta relación diferente a la reportada para T. torquatus en la costa Brasilera (Kiefer et al., 2005; Kiefer et al., 2007). La ausencia de significancia entre la temperatura corporal y la temperatura del microhábitat (aire y sustrato), indica que T. hispidus no mantiene su temperatura corporal de acuerdo a los cambios de temperatura del período ambiental, posiblemente lo hace mediante estrategias conductuales. En efecto, González et al., 2004b, observaron que T. hispidus en días soleados, en las últimas horas de la mañana y a mediados de la tarde, cuando la temperatura ambiental es más alta, el animal levanta sus cuatro extremidades y apoyado en ellas, mantiene el cuerpo y cola separado del sustrato. Esta pauta de comportamiento ha sido señalada como respuesta para regular la temperatura corporal, la eliminación del contacto directo con el sustrato evita un sobrecalentamiento, además permite la circulación con facilidad del aire por la superficie de su cuerpo logrando un enfriamiento más rápido (Greemberg, 1976; Carpenter, 1966). Algunas poblaciones de T. hispidus pasan la mayor parte del día en afloramientos rocosos, permitiéndole mantener una temperatura corporal relativamente constante aunque se muevan entre las áreas asoleadas y sombreadas de las rocas. Durante las primeras horas de la mañana, los lagartos utilizan relativamente las rocas para ganar calor. En las tarde, usan los roquedales que se encuentran en la sombra para disminuir el calor corporal y mantener una temperatura activa (Zug et al., 2001).
Por otra parte, estudios realizados por Bujes y Verrastro, 2006, en Liolaemus occipitalis en costas arenosas Brasileras, demuestran que la temperatura del sustrato actúa como fuente principal de calor para la termorregulación, quedando la temperatura del aire en un segundo lugar. Igualmente, Ribeiro et al., 2007, sugieren que la variación de la temperatura corporal de T. torquatus durante el período de lluvia se relaciona con la temperatura del sustrato, mientras que en sequía es la temperatura del aire la que influye en la termorregulación de este lagarto.
Tropidurus hispidus presentó un patrón de actividad diurna como otras especies de la familia Tropiduridae como: Plica plica, Liolaemus pseudoanomalus y T. torquatus (González et al., 2001; Villavicencio et al., 2002; Ribeiro et al., 2007). Generalmente, el intervalo de tiempo en que los saurios están activos se relacionan con el tipo de clima, intensidad de luz solar, duración del fotoperiodo, temperatura del ambiente y hora de actividad de sus presas (Díaz y Cabezas-Díaz, 2004). Según Pianka, 1993, los cambios estacionales en el tiempo de actividad facilitan la termorregulación, ya que los lagartos pueden encontrar un ambiente térmico adecuado para regular su temperatura de manera eficiente en los diferentes períodos del año.
En el presente trabajo la hora de inicio de actividad y la proporción de individuos activos varió según el período climático, estando relacionado con la temperatura del aire y sustrato, ya que en sequía la especie comienza su actividad mayormente a las 7:00 de la mañana y en lluvia a partir de las 8:00 de la mañana. El aumento progresivo de la temperatura del microhábitat a medida que avanzan las horas del día, determina el orden de aparición de otras especies de lagartos. Aquellos que empiezan su actividad temprano tienden a presentar una temperatura corporal menor a las que aparecen más tarde (Pianka, 1977).
Los valores de amplitud de nicho térmico durante la sequía en hembras en el presente trabajo fueron mayores, posiblemente las altas temperaturas ambientales de este periodo parecen favorecer la rápida adquisición y mantenimiento de las temperaturas corporales óptimas (García-De la Peña et al., 2007). Velásquez et al., 2007, trabajando con T. hispidus en un bosque deciduo del cerro El Tacal en el oriente de Venezuela, sugieren que durante la sequía las hembras se preparan para el inicio del período reproductivo, por lo tanto tienden a presentar un mayor desplazamiento en busca de alimento, tales como: Hymenoptera, larvas de Lepidoptera y Diptera, Annelida y en algunos casos restos de materia vegetal y lagartos. En efecto, en los lagartos tropicales, el mayor consumo de alimento conduce a una acumulación de lípidos, que pueden ser utilizados durante el proceso de ovoposición en el período de lluvia (Derickson, 1976; Prieto et al., 1976). En el presente estudio, las hembras y machos en lluvia presentaron un valor de amplitud semejante, posiblemente esto se deba a que ellas disminuyen su actividad, como consecuencia de que algunas se encuentran ovadas evitando salir de sus refugios para no gastar sus reservas energéticas acumuladas en el organismo (Velásquez et al., 2007). Del mismo modo, González et al., 2001, comentan que las hembras de P. plica presentaron un volumen mayor de contenido estomacal que los machos, y que esto se podría deber a una preparación fisiológica para la época reproductiva, la cual se podría efectuar durante la época lluviosa, aprovechando la mayor proporción de insectos en el bosque y de esta manera garantizar los recursos alimentarios a las futuras crías.
En conclusión T. hispidus es una especie tigmotermia que regula su temperatura corporal a través de mecanismos conductuales, durante los períodos de sequía y lluvia. Por lo tanto, la temperatura corporal y ambiental son los factores que parecen determinar los patrones de actividad de la especie e inclusive de la familia Tropiduridae.
AGRADECIMIENTOS
BIBLIOGRAFÍA
ADOLPH S. Influence of behavioral thermoregulation on microhábitat use by Sceloporus lizards. Ecology. 1990;71:315-327.
[ Links ]AVILA-PIRES T. Lizards of Brasilian Amazonia (Reptilia: Squamata). Zool Verh. 1995;299:1-706.
[ Links ]BERGALLO H, ROCHA C. Activity patterns and body temperaturas of two sympatric lizards (Tropidurus torquatus and Cnemidophorus ocellifer) with different foraging tactics in southeastern Brazil. Amphibia-Reptilia. 1993;14:312-315.
[ Links ]BUJES C, VERRASTRO L. Thermal biology of Liolaemus occipitalis (Squamata: Tropiduridae) in the coastal sand dunes of Rio Grande Do Sul, Brazil. Brazil J Biol. 2006;66:945-954.
[ Links ]CARPENTER CH. Comparative behavior of the Galapagos lava lizards (Tropidurus). En: Browman R, editor. The Galapagos: Proceedings of the Galapagos International Scientific Project. Univ., California Press, Berkeley; 1966. p. 269-273.
[ Links ]CORNEJO P, PRIETO A. Inventario de reptiles en dos zonas semiáridas del noreste de la península de Araya. Estado Sucre, Venezuela. Acta Cient Venez. 2001;52:265-271.
[ Links ]CUMANA L. Lista de familias y número de géneros y especies de angiospermas del parque Nacional Mochima, estados Anzoátegui y Sucre. Fontus. 2005;12-13:15-33.
[ Links ]DERICKSON W. Lipid storage and utilization in reptiles. AmZool. 1976; 16: 711-723.
[ Links ]DÍAZ J, CABEZAS-DÍAZ S. Seasonal variation in the contribution of different behavioural mechanism to lizard thermoregulation. Funct Ecol. 2004;18:867-875.
[ Links ]FOGHIN-PILLIN S. Tiempo y clima en Venezuela. Universidad Pedagógica Libertador, Venezuela; 2002.
[ Links ]GANDOLFI S, ROCHA C. Orientation of thermoregulating Tropidurus torquatus (Sauria: Tropiduridae) on termite mounds in an open of south-eastern Brazil. Amphibia-Reptilia. 1998;19:319-323.
[ Links ]GARCÍA-DE LA PEÑA C, GADSDEN H, CONTRERAS-BALDERAS A, CASTAÑEDA G. Ciclos de actividad diaria y estacional de un gremio de saurios de las dunas de arena de Viesca, Coahuila, México. Rev Mex Biodiv. 2007;78:141-147.
[ Links ]GONZÁLEZ L. Algunas notas sobre la biología de este fascinante reptil (Tropidurus hispidus). Natura. 1994;99:48-51.
[ Links ]GONZÁLEZL,PRIETOA.Aspectossobrelatermorregulaciónyreproduccióndella-gartoAmeivaameivamelanocephalaBabouryNoble,1915(Sauria:Teiidae),enunbosque húmedo del estado Miranda, Venezuela. Mem Soc Cienc Nat La Salle. 1999; 59:3-17.
[ Links ]GONZÁLEZ L, PRIETO A, CANDIA R. Notas sobre los hábitos alimentarios del lagarto Plica plica (Linnaeus, 1758), en un bosque húmedo del estado Miranda, Venezuela. Acta Biol Venez. 2001;21:51-57.
[ Links ]GONZÁLEZ L, PRIETO A, MOLINA C, VELÁSQUEZ J. Los reptiles de la península de Araya, estado Sucre, Venezuela. Interciencia. 2004a;29:428-433.
[ Links ]GONZÁLEZ L, PRIETO A, OJEDA G. Área de actividad y comportamiento del lagarto Tropidurus hispidus (Spix 1825) (Sauria-Tropiduridae) en cerro Colorado. Cumaná, estado Sucre, Venezuela. Saber. 2004b;16:95-103.
[ Links ]GRANT B. Trade-offs in activity time and physiological performance for thermoregulating desert lizards, Sceloporus merriami. Ecology. 1990;71:2323-2333.
[ Links ]GREEMBERG N. An ethogram of the blue spiny lizard, Sceloporus cyanogeny (Sauria-Iguanidae). J Herpetol. 1976;11(2):177-195.
[ Links ]HATANO F, VRCIBRADIC D, GALDINO C, CUNHA-BARROS M, ROCHA C, VAN SLUY M. Thermal ecology and activity patterns of the lizards community of the Restinga of Jurabatiba, Macaé, R. J Rev Brasil Biol. 2001;61:287-294.
[ Links ]HERNÁNDEZ R, FERNÁNDEZ C, BAPTISTA P. Fundamentos de metodología de la investigación. McGraw-Hill/Interamericana de España, Madrid; 2007.
[ Links ]HUEY R, SLATKIN M. Costs and benefits of lizard thermoregulation. Q Rev Biol. 1976;51:363-384.
[ Links ]JAKSIC F, SCHWENK K. Natural history observations on Liolaemus magellanicus, the sourthernmost lizard in the world. Herpetologica. 1983;39:457-461.
[ Links ]KIEFER M, VAN SLUYS M, ROCHA C. Body temperatures of Tropidurus torquarus (Squamata: Tropiduridae) from coastal populations: Do body temperatures vary along their geographic range? J Thermal Biol. 2005;30:449-456.
[ Links ]KIEFER M, VAN SLUYS M, ROCHA C. Thermoregulatory behaviour in Tropidurus torquatus (Squamata, Tropiduridae) from Brazilian coastal populations: an estimate of passive and active thermoregulation in lizards. Acta Zool. 2007;88(1): 81-87.
[ Links ]KREBS C. Ecological Methodology. Harper & Row, Publisher, Inc. New York; 1989.
[ Links ]LABRA A, SOTO-GAMBOA M, BOZINOVIC F. Behavioral and physiological thermoregulation of Atacama desrt-dwellingLiolaemuslizards.Ecoscience.2001;8:413-420.
[ Links ]MARKEZICH A. New distribution records of reptiles from westhern Venezuela. Herpetol Rev. 2002;31:69-74.
[ Links ]PIANKA E. Reptilian species diversity. En: Gans C, Tinkle D, editors. Biology of Reptilia, Academic Press, New York; 1977. p. 1-34.
[ Links ]PIANKA E. The many dimensions of a lizard ecological niche. En: Valakos E, Bohme W, Pérez-Mellado V, Maragous P, editors. Lacertids of the Mediterranean Regon Heelenic. Zoological Society, Athens; 1993. p. 121-154.
[ Links ]PIANKA E, VITT L. Lizards: Windows to the Evolution of Diversity. University of California Press; 2003.
[ Links ]PRIETO A, LEÓN J, LARA O. Reprodution in tropical lizard Tropidurus hispidus (Sauria: Iguanidae). Herpetologica. 1976;32:318-323.
[ Links ]RIBEIRO L, GOMIDES S, SANTOS A, SOUSA B. Thermoregulatory behavior of the saxicolous lizard, Tropidurus torquatus (Squamata: Tropiduridae) in a rocky outcrop in minas Gerais, Brasil. Herpetol Conserv Biol. 2007;3:63-70.
[ Links ]RIVAS G, OLIVEROS O. Herpetofauna del estado Sucre, Venezuela: lista preliminar de reptiles. Mem Soc Cienc Nat La Salle. 1997;52:67-80.
[ Links ]ROCHA C. Growth of the tropical sand lizard Liolaemus lutzae in Southeastern Brazil. Amphibia-Reptilia. 1995;16:257-264.
[ Links ]ROCHA C, DUTRA G, VRCIBRADIC D, MENEZES V. The terretrial reptile fauna of the Albrolhos archipiélago: species list and ecological aspects. Brazil J Biol. 2002; 62: 285- 291.
[ Links ]SEVA E. Taxocenosis de lacértidos en un arenal costero alicantino. Pub. Univ. De Alicante; 1982.
[ Links ]SMITH G, BALLINGER R. The ecological consequences of habitat and microhabitat use in lizards: A review. Contemp Herpetol. 2001;3:1-37.
[ Links ]TEXEIRA-FILHO P, ROCHA C, RIBAS S. Aspectos da ecología termal e uso do hábitat por Cnemidophorus ocellifer (Sauria: Teiidae) na Restinga da Barra do Marica, RJ. Oecologia brasiliensis. 1996;1:155-165.
[ Links ]VAN SLUYS M, ROCHA C, VRCIBRADIC D, GALDINO C, FONTES A. Diet, activity and microhabitat use of two syntopic Tropidurus species (Lacertilia: Tropiduridae) in Minas Gerais, Brazil. J Herpetol. 2004; 38: 606-611.
[ Links ]VELÁSQUEZ D, GONZÁLEZ L, PRIETO A, VELÁSQUEZ J, FERRER H. Hábitos alimentarios del lagarto Tropidurushispidus (Spix,1825)(Sauria:Tropiduridae)enelcerroelTacal, Parque Nacional Mochima, estado Sucre, Venezuela. Acta Biol Venez. 2007; 27(1):9-18.
[ Links ]VILLAVICENCIO J, ACOSTA J, CANOVAS M, MARINERO J. Patrones de actividad temporal, diaria y estacional de Liolaemus pseudoanomalus (Squamata: Tropiduridae) en el centro-oeste de Argentina. Multequina. 2002;11:51-60.
[ Links ]VITT L. The ecology of tropical lizards in the caatinga of northeast Brazil. Occas Pap Oklahoma Museum Nat Hist. 1995;1:1-29.
[ Links ]VITT L, ZANI P, CALDWELL J. Behavioural ecology of Tropidurus hispidus on isolated rock outcropin Amazonia. J Trop Ecol. 1996;12:81-101.
[ Links ]ZUG G, VITT L, CALDWELL J. Herpetology: An introductory biology on amphibians and reptiles. Academic Press; 2001.
[ Links ]













