Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.15 no.3 Bogotá Sept./Dec. 2010
DEFENSINAS DE PLANTAS Y SU USO POTENCIAL COMO CONTROLADORES DE PLAGAS EN LA AGRICULTURA
Plant Defensins and Their Potential Use as Pest Control in Agriculture
ADRIANA CAROLINA ROJAS ARIAS1, HUMBERTO MIGUEL ZAMORA ESPITIA1
1Grupo de investigación en bioquímica fitopatológica y evolución molecular, Departamento de Química, Universidad Nacional de Colombia - Sede Bogotá. Carera 30 # 45-03, Ciudad Universitaria, edificio 451, laboratorio 318. Bogotá D.C., Colombia. acrojasa@unal.edu.co
Presentado 11 de agosto de 2009, aceptado 25 de noviembre de 2009, correcciones 25 de noviembre de 2009.
RESUMEN
Las plantas, al igual que todos los organismos de la naturaleza, poseen elaborados sistemas de defensa contra patógenos, que pueden ser físicos y químicos, y producirse de forma constitutiva e inducida. Dentro de las barreras químicas inducidas se encuentra el grupo de proteínas de bajo peso molecular denominadas péptidos antimicrobianos (AMPs), al cual pertenecen las defensinas, péptidos con peso molecular entre 5 a 7 kDa, punto isoeléctrico de 9, y longitud de 45 a 55 aminoácidos; que tienen la capacidad de inhibir efectivamente el crecimiento de microorganismos fitopatógenos, en su mayoría hongos, y además, generan resistencia a condiciones abióticas de estrés en plantas. Este texto pretende realizar una descripción clara y actual de las características e investigaciones recientes con relación a las defensinas de plantas y sus más destacados usos en el control de patógenos en cultivos de importancia económica. Se plantea además la necesidad de profundizar en el conocimiento de dichas proteínas para su uso en estrategias de control tales como la producción de plantas y microorganismos transgénicos.
Palabras clave: defensinas de plantas, péptidos antimicrobianos, resistencia a fitopatógenos, transgénicos.
ABSTRACT
Plants, as all organisms in nature, have elaborate systems of defense against pathogens; which can be physical or chemical and produced in a constitutive and induced way. Among the induced chemical barriers, there is a group of low molecular weight proteins, known as antimicrobial peptides (AMPs). These peptides include defensins, which are peptides with a molecular weight about 5 to 7 kDa, isoelectric point of 9, and length of about 45 to 55 amino acids. Likewise, they have the ability to avoid the growth of phytopathogenic microorganisms, mainly funguses. Moreover, these peptides create resistance to abiotic conditions of stress in plants. This manuscript seeks to make a clear and current description about the recent characteristics and researches related to plant defensins and their most significant uses in pathogens management in crops of economical relevance. It also intends to go deep into the study of such proteins in order to use them as a control strategy, such as production of transgenic plants and microorganisms.
Key words: plant defensins, antimicrobial peptides, plant resistance, transgenic.
INTRODUCCIÓN
Todos los organismos vivos, desde los microorganismos hasta las plantas y los animales, tienen mecanismos que les son útiles para defenderse contra el ataque de patógenos, con los cuales han coevolucionado. Los mecanismos más sofisticados de defensa consisten en la producción de anticuerpos y células asesinas naturales, que reconocen y eliminan invasores específicos respectivamente, y que componen la denominada inmunidad adaptativa, exclusiva de los vertebrados superiores (Thomma et al., 2002). Por otra parte, existe la inmunidad innata, mucho más antigua y distribuida entre los organismos que, a diferencia de la inmunidad adaptativa, carece de la especificidad de reconocimiento de antígenos, pero es capaz de exhibir actividad diferencial contra diferentes tipos de invasores y es el principal sistema de defensa encontrado en las plantas (Tavares et al., 2008).
Las plantas emplean complejos sistemas de defensa físicos y químicos para resistir o evadir los ataques de patógenos. Estos sistemas de defensa se pueden clasificar, de acuerdo al momento de su expresión, en constitutivos, si están presentes durante todo el ciclo de vida de la planta; e inducidos, si su expresión se evidencia en mayor proporción ante la presencia de un patógeno (Sels et al., 2008). A su vez, estas barreras pueden ser físicas o químicas (Chehab et al., 2008). Dentro de las barreras constitutivas físicas se encuentran la cutícula, depósitos de lignina, tricomas y pared celular secundaria entre otros; y como ejemplo de barrera constitutiva química podemos citar sustancias tóxicas tales como las fitoanticipinas (Pedras, 2008; Sels et al., 2008). En conjunto, estas estrategias constitutivas, también denominadas preformadas, componen la primera línea de defensa de la planta y pueden prevenir eficientemente la invasión de muchos microorganismos (Sels et al., 2008; Tavares et al., 2008).
Sin embargo, esta primera barrera resulta insuficiente contra ciertos patógenos de mayor agresividad, contra los cuales la planta exhibe defensas inducidas, que funcionan por medio de mecanismos directos, como la producción de proteínas catabólicas o antidigestivas y químicos tóxicos o repelentes; y mecanismos indirectos a través de la producción y liberación de compuestos orgánicos volátiles para señalizar a los enemigos naturales del fitopatógeno que su presa se encuentra cerca (Chehab et al., 2008). Algunos de estos son: la producción de especies oxígeno reactivas (ROS) como respuesta de hipersensibilidad que inducen la apoptosis en las células infectadas, óxido nítrico, reforzamiento de la pared celular, la acumulación de fitoalexinas, taninos y compuestos fenólicos, señalización por ácido salicílico y ácido jasmónico, acumulación de fitohormonas y la producción de las denominadas proteínas relacionadas con patogénesis (PR) (Chehab et al., 2008; De Paula et al., 2008; Odintsova et al., 2008; Sels et al., 2008; Tavares et al., 2008).
Se ha encontrado que las proteínas PR se expresan en mayor proporción en tejidos vegetales parasitados con respecto a los sanos y que sus pesos oscilan entre 5 a 75 kDa. Así, las de pesos inferiores a 10 kDa se denominan péptidos PR, también conocidos como péptidos antimicrobianos (AMPs, por el término inglés antimicrobial peptides). Los AMPs son componentes de la inmunidad innata y una estrategia de defensa ampliamente usada, no solo por plantas, sino también por muchos otros organismos (De Oliveira y Moreira, 2009; Thevissen et al., 2004; Thomma et al., 2002). Se han descrito defensinas en hongos (Zhu, 2008; Mygind et al., 2005), bacterias (Gao et al., 2009; Zhu, 2007), moluscos (González et al., 2007; Zhao et al., 2007), artrópodos (Neira et al., 2009; Saito et al., 2009; Waniek et al., 2009; Yamage et al., 2009), nemátodos (Minaba et al., 2009), peces (Casadei et al. 2009; Falco et al., 2008), aves (Kannan et al., 2009; Soman et al., 2009), reptiles (Stegemann et al., 2009; Chattopadhyay et al., 2006) y mamíferos (incluyendo al humano) (Chen et al., 2010; Droin et al., 2009; Sang y Blecha, 2009; Looft et al., 2006) entre otros.
Los AMPs no reconocen antígenos específicos, pero como ventaja, son producidos simplemente por la transcripción y traducción de un gen, se liberan relativamente rápido luego de la infección con un gasto reducido de energía y biomasa (Thomma et al., 2002). Hacen parte de este grupo de proteínas las beta-1,3-glucanasas, quitinasas, endoproteasas, peroxidasas, oxalato oxidasas, transferasas de lípidos, tioninas y defensinas, entre otras (De Paula et al., 2008; Sels et al., 2008). En este documento se destacará la importancia de las defensinas como un elemento importante en la resistencia vegetal a patógenos.
CARACTERÍSTICAS GENERALES DE LAS DEFENSINAS DE PLANTAS
Las defensinas pertenecen a una amplia familia de AMPs, y se descubrieron inicialmente en los macrófagos y granulocitos de conejos, seguido de su identificación en moscas. Son moléculas muy comunes en la naturaleza, con una sorprendente conservación estructural y funcional entre especies (De Oliveira y Moreira, 2009; Thevissen et al., 2004; Thomma et al., 2002). Tal es la cantidad y diversidad de este tipo de proteínas que llevó a que Seebah et al., 2007, desarrollaran una base de datos de defensinas (Defensins Knowledgebase: http://defensins.bii.a-star.edu.sg/) que incluye secuencias de proteína y ADN, literatura, estudios aplicados y patentes, entre otros, descritos en una gran cantidad de organismos, con enlaces a los recursos relacionados en otros sitios como el National Center for Biotechnology Information (NCBI), Protein Data Bank (PDB) o Swiss Prot. En plantas, las defensinas se describieron inicialmente en semillas de trigo y cebada, y se clasificaron erróneamente como un subgrupo de las tioninas (gammationinas), debido a que estas dos clases de péptidos (defensinas y tioninas) comparten las características de tamaño molecular (5 kDa), secuencia de aminoácidos y número de cisteínas que contienen (ocho); pero estudios posteriores las reclasificaron como un grupo separado, basados en su conformación estructural, muy similar a defensinas descritas anteriormente en mamíferos e insectos, estabilizada por cuatro puentes disulfuro, nombradas también como familia de proteínas PR-12 (De Oliveira y Moreira, 2009; Odintsova et al., 2008; Sels et al., 2008; Thomma et al., 2002).
Se han identificado defensinas vegetales a partir de diferentes tejidos (semillas, tallo, raíces, hojas y flores) de plantas como el rábano (Raphanus sativus), Dalia (Dahlia merckii), tabaco (Nicotiana tabacum), arabidopsis (Arabidopsis thaliana), caña de azúcar (Saccharum officinarum), maíz (Zea mays), sorgo (Sorghum vulgare), entre otras (De Paula et al., 2008; Sels et al., 2008; Swathi et al., 2008). Más de 300 secuencias tipo defensina han sido identificadas en los genomas de A. thaliana y Mendicago truncatula, mientras que en arroz solo se han identificado 92; el Institute for Genomic Research identificó 1.100 genes de defensinas en 26 especies de plantas, lo que indica la necesidad de la redundancia para proteger a la planta contra una gran cantidad de patógenos (Graham et al., 2008; Odintsova et al., 2008).
Los primeros aislamientos de defensinas de plantas se hicieron a partir de extractos de semillas de trigo y rábano y posterior purificación utilizando cromatografía (Sels et al., 2008). En rábano, por ejemplo, las defensinas representan el 0,5% del total de proteínas de la semilla y el 30% de proteínas liberadas luego de generar lesiones mecánicamente, produciendo aproximadamente 1 µg, cantidad suficiente para inhibir el crecimiento de hongos. Así, las defensinas contribuyen a la protección de las semillas y embriones contra el ataque de patógenos edáficos, incrementando su probabilidad de germinación y supervivencia (De Oliveira y Moreira, 2009; Thomma et al., 2002). En tejidos vegetativos, como el tallo, hojas, flores, frutos, etc., igualmente se ha evidenciado la expresión de AMPs, inducidos tras el ataque de un microorganismo patógeno, y además, algunos de forma constitutiva en bajas concentraciones, con una alta efectividad en el control de enfermedades vegetales infecciosas (De Oliveira y Moreira, 2009; Thomma et al., 2002). La expresión de las defensinas en las plantas es, en algunos casos, específica en cada tejido con variación en los niveles de producción (Vijayan et al., 2008).
Para detectar las defensinas en tejidos vegetales se han empleado técnicas como inmunofluorescencia (Van Der Weerden et al., 2008; Lobo et al., 2007), cromatografías de exclusión por tamaño seguida de intercambio iónico sobre extractos vegetales (Kovaleva et al., 2009; Odintsova et al., 2008, Riaño y Zamora, 2005) aprovechando su bajo peso molecular y carga neta positiva, caracterización molecular por espectrometría de masas MALDI-TOF y Q-TOF (Kovaleva et al., 2009; De Paula et al., 2008; Odintsova et al., 2008). Por otra parte, cuando lo que se desea descubrir son las secuencias codificantes de defensinas, las estrategias más empleadas por los investigadores del tema han sido: Northern y Southern blot (Van Den Heuvel et al., 2001), screening de librerías de cADN (Kovaleva et al., 2009; Van Den Heuvel et al., 2001) y la técnica de RT - PCR (transcripción reversa) seguido de clonación, secuenciación y expresión de los insertos (De Paula et al., 2008; Solis et al., 2007).
Todos los genes de defensinas en las plantas tienen en común que codifican un polipéptido que puede ser dividido en dos partes: un péptido señal amino terminal que dirige el péptido al espacio extracelular; y un segundo dominio que codifica el péptido maduro. Algunas defensinas de plantas con flores exhiben además un dominio carboxiterminal (De Oliveira y Moreira, 2009; Aerts et al., 2008). En la secuencia de ADN codificante de una defensina, generalmente entre la región del péptido señal y la de defensina activa se encuentra un intrón (Graham et al., 2008). En el genoma vegetal, los genes tipo defensina suelen presentarse de forma individual o formando grupos (clusters) de aproximadamente 2 a 14 genes, en regiones de 100 kb, lo que puede evidenciar que se producen duplicaciones de los genes dentro del mismo cluster (Graham et al., 2008). Su evolución se ha dado por procesos de recombinación heteróloga, duplicación y selección (Graham et al., 2008).
El péptido señal N-terminal generalmente es ácido, y dentro de sus funciones, además de dirigir el péptido para su secreción, se encuentra el mitigar el efecto biológico de la defensina madura hasta cuando es necesario (De Oliveira y Moreira, 2009). El péptido maduro de las defensinas de plantas es básico, con un punto isoeléctrico de 9 aproximadamente, su longitud comprende entre 45-55 residuos de aminoácidos, resultando en una molécula pequeña con masa de 5 a 7 kDa. Tiene ocho residuos de cisteína estrictamente conservados, involucrados en la formación de cuatro puentes disulfuro, responsables de la estabilización de la estructura tridimensional del péptido, con un motivo estructural de alfa hélice-beta lámina estabilizado por cisteína (CS αβ), el cual ha sido documentado para diferentes péptidos con actividad antimicrobiana como las defensinas de insectos y toxinas de escorpiones y arañas (De Oliveira y Moreira, 2009; Graham et al., 2008; Jha et al., 2009; De Paula et al., 2008; Swathi et al., 2008; Tavares et al., 2008; Thevissen et al., 2004; Thomma et al., 2002). El dominio C-terminal, presente en algunas defensinas de flores, generalmente es ácido e hidrofóbico y tiene una longitud de 27-33 aminoácidos. Su función aún no es clara, pero su carga negativa neutraliza la carga del dominio defensina, lo que sugiere que bloquea su actividad tóxica durante el transporte celular y también contribuye en la señalización del péptido hacia la vacuola (De Oliveira y Moreira, 2009; Tavares et al., 2008)
Entre especies vegetales se observa una gran diversidad de secuencia de aminoácidos en las defensinas (a excepción de las ocho cisteínas y el dominio péptido señal) (Graham et al., 2008). Esta característica es una consecuencia probable del hecho que los AMPs son moléculas que han evolucionado rápidamente como necesidad de supervivencia ante la competición y especialización de los patógenos y la co-evolución de huéspedes y patógenos (De Oliveira y Moreira, 2009). Varias estructuras terciarias experimentales, obtenidas por resonancia magnética nuclear o cristalografía de rayos x, de defensinas han sido descritas y almacenadas en la base de datos de proteínas PDB (www.rcsb.org) presentando un modelo general conservado. Por ejemplo, el análisis de la estructura tridimensional, de la defensina Rs-AFP1 de R. sativus, ha permitido determinar que las defensinas de plantas tienen una distribución globular compacta conformada por tres beta láminas antiparalelas y una alfa hélice, sostenidas por cuatro puentes disulfuro que enlazan la alfa hélice y la beta lámina 3 (Fig. 1) (De Oliveira y Moreira, 2009; Thomma et al., 2002).
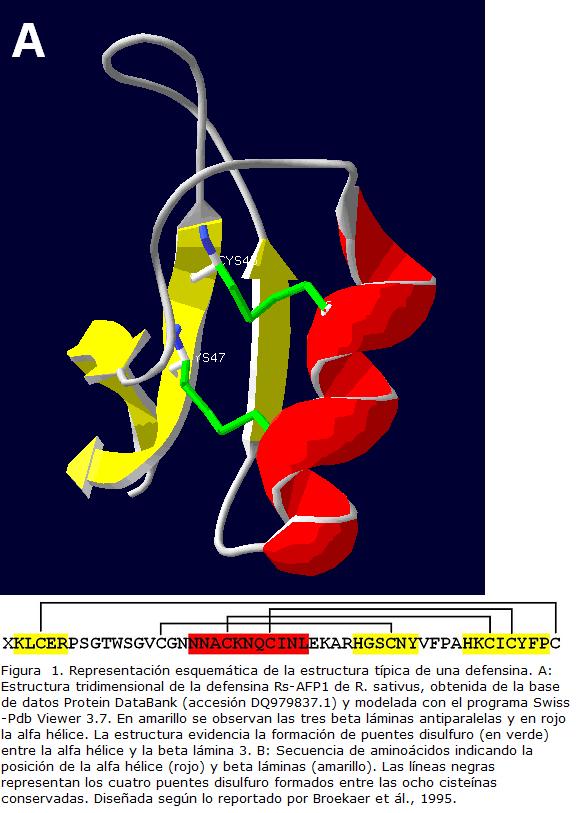
ACTIVIDAD BIOLÓGICA
En vegetales las defensinas están implicadas en la respuesta a estrés abiótico (por condiciones difíciles físicas o químicas del entorno) y biótico (tales como los que generan los hongos o las bacterias) (Graham et al., 2008). Su actividad biológica va desde la inhibición de proteasas y amilasas, bloqueo de canales iónicos e inhibición de la síntesis de proteínas, hasta efectos citotóxicos sobre células vegetales y animales (Graham et al., 2008; Odintsova et al., 2008). Pueden inhibir el crecimiento de un amplio rango de microorganismos e insectos fitopatógenos, incluso han mostrado actividad antibiótica sobre patógenos humanos como Candida albicans y Aspergillus sp., lo que las hace buenas candidatas para su uso terapéutico (Graham et al., 2008; Swathi et al., 2008).
La primera actividad biológica reportada para las defensinas de plantas fue su habilidad para inhibir la traducción de proteínas en un sistema extracelular, probablemente por fosforilación de la subunidad alfa del factor 2 de iniciación de cadena polipeptídica eucariota (eIF-2α) por activación de la IF-2α quinasa, lo que interfiere en el correcto procesamiento del sistema de traducción en los pasos de iniciación y elongación (De Oliveira y Moreira, 2009). Se ha descrito que tienen actividad inhibidora de alfa-amilasas de insectos y mamíferos, lo que interfiere en la digestión de animales herbívoros, impidiendo la obtención de energía derivada de la degradación del almidón y por consiguiente, generando disminución en el crecimiento del individuo que consume la planta (De Oliveira y Moreira, 2009; Graham et al., 2008; Odintsova et al., 2008; Thomma et al., 2002). Se ha propuesto que esta inhibición se debe al bloqueo del sitio activo de la alfa-amilasa por parte de alguno de los bucles (loops) de la defensina (De Oliveira y Moreira, 2009). Estos péptidos también inhiben proteasas con los mismos fines, aunque la forma exacta de inhibición aún es incierta (De Oliveira y Moreira, 2009; Odintsova et al., 2008).
En cuanto a la actividad antimicrobiana de las defensinas, descrita desde 1990, se ha observado que principalmente se dirige a la inhibición de hongos, aunque esto también se ha descrito para bacterias grampositivas en menor proporción y con poca información respecto al modo de acción (Marquès et al., 2009); sin embargo se especula que tiene relación con la interacción de las defensinas, de carga positiva, con moléculas de carga negativa en las membranas bacterianas, tales como el ácido teicoico, lipopolisacáridos o fosfolípidos (De Oliveira y Moreira, 2009; Odintsova et al., 2008; Thomma et al., 2002). El efecto más destacado de la actividad antimicrobiana de las defensinas es la inhibición del crecimiento en hongos filamentosos y levaduras (Aerts et al., 2008; Sels et al., 2008). Se ha observado que las defensinas son activas en hongos fitopatógenos como Botrytis cinerea, Alternaria brassicola, A. longipes, Fusarium culmorum, Verticillium dahliae, Rhizoctonia solani, Neurospora crassa, Magnaporthe oryzae y levaduras como C. albicans (Jha et al., 2009; Sels et al., 2008). En hongos, se han reportado valores de concentración letal 50 (CL50) de defensinas en rangos muy variados, entre 1,5 a 500 �g/ml. Morfológicamente, las defensinas de plantas generan dos tipos de distorsiones sobre las hifas, lo que las clasifica en dos grupos: las defensinas morfogénicas, que reducen la tasa de elongación de la hifa y generan distorsiones morfológicas significativas, que incluyen incremento en las ramificaciones e inflamación; y las defensinas no morfogénicas, que a diferencia de las anteriores, reducen la tasa de elongación de la hifa sin generar distorsiones morfológicas y algunas tienen efecto inhibitorio sobre bacterias (De Oliveira y Moreira, 2009; Aerts et al., 2008; Thomma et al., 2002). La acción de las defensinas sobre hongos produce un incremento en la toma de Ca+2 y expulsión de K+, cambios de potencial de membrana y alcalinización del medio, lo que afecta directamente el gradiente de Ca+2, factor fundamental en la elongación de las hifas (De Oliveira y Moreira, 2009; Marquès et al., 2009; Aerts et al., 2008; Tavares et al., 2008).
En general, los AMPs exhiben una organización anfipática con una cara hidrofílica cargada positivamente. Se sugiere que la interacción entre un AMP y su microorganismo objetivo ocurre inicialmente por interacciones electrostáticas entre los AMPs básicos y estructuras de carga opuesta presentes en la superficie del microorganismo; después de esta interacción inicial, la región hidrofóbica de los AMPs se insertan en la membrana por interacción hidrofóbica (De Oliveira y Moreira, 2009). La actividad de las defensinas es fuertemente influenciada por los iones presentes en el medio, ya que estos iones pueden llegar a competir por la unión a las moléculas cargadas de la membrana, por ejemplo, se observa una disminución de la capacidad fungicida si el medio es suplementado con iones o cationes metálicos, especialmente cationes divalentes como el Ca+2 y el +2 (De Oliveira y Moreira, 2009; Thomma et al., 2002). Además, se ha demostrado que algunos cationes como el K+ y el Mg+2 están relacionados con la generación de cambios estructurales en la molécula de defensina que la inactivan (De Oliveira y Moreira, 2009; Aerts et al., 2008).
Aparte de la actividad inmune de las defensinas en las plantas, se ha encontrado también que contribuyen como mediadores de tolerancia al zinc, reducción del dehidroascorbato para producir ácido ascórbico, y bloqueo canales iónicos (De Oliveira y Moreira, 2009; Marquès et al., 2009; Mirouze et al., 2006). También se ha evidenciado la expresión de estos péptidos como respuesta al estrés por frío y por lesiones mecánicas en las plantas (Graham et al., 2008; Carvalho et al., 2006). Incluso, gracias a análisis genómicos, se han encontrado evidencias de que las defensinas podrían estar involucradas en fenómenos de autoesterilidad, generando que las plantas no reconozcan su propio polen (Graham et al., 2008).
Existen receptores de defensinas en la membrana celular muy específicos, que en el caso de las defensinas de planta con la membrana celular de los hongos, se plantea que son los esfingolípidos, uno de los tres tipos de lípidos más abundantes en las membranas eucariotas, junto con los esteroles y fosfoglicerolípidos, que además de su función estructural, son importantes moléculas señalizadoras para la regulación, crecimiento y respuestas a estrés en la célula (Aerts et al., 2008; De Paula et al., 2008; Jha et al., 2009; Thevissen et al., 2004). No todas las defensinas reconocen el mismo tipo de esfingolípidos, por ejemplo, DmAMP1 de dalia (Dahlia merckii) reconoce la manosildiinositolfosforilceramida, en cambio, RsAFP2 de rábano (R. sativus) reconoce glucosilceramidas (Aerts et al., 2008). Aquellos hongos que carecen del esfingolípido receptor por deficiencias en alguna de las enzimas involucradas en la vía metabólica de producción del mismo, presentan resistencia a las defensinas (Aerts et al., 2008; Thevissen et al., 2004).
Pero si los esfingolípidos son abundantes en las membranas eucariotas, ¿sería posible que las defensinas, además de atacar células de hongos también tengan efecto citotóxico sobre células de mamíferos como el humano, o incluso de otras plantas? La respuesta es quizas. Aunque las defensinas reconocen específicamente esfingolípidos de membranas fúngicas, que se encuentran co-localizados con ergosterol formando las denominadas -balsas lipídicas- altamente enriquecidas con proteínas de membrana ancladas a glicosilfosfatidilinositol (GPI) (Aerts et al., 2008), existe evidencia que avala posible actividad biológica sobre otros organismos, como es el caso de un cultivo de arroz modificado genéticamente con el gen codificante de la defensina BrD1 de Brassica rappa, lo cual le causo resistencia hacia el insecto-plaga Nilaparvata lugens (Choi et al., 2009).
USOS DE LAS DEFENSINAS EN AGRONOMÍA
En las décadas pasadas, para prevenir pérdidas importantes en las cosechas de los cultivos, las plagas y patógenos agrícolas se controlaban usando pesticidas químicos. Hoy en día es evidente que aquellas prácticas no son sostenibles en el tiempo, ya que generan resistencia en los patógenos, son tóxicas para el ser humano y otras especies animales y contaminan el medio ambiente; motivo por el cual, la investigación de nuevas estrategias para prevenir las pérdidas en los cultivos es de vital importancia, lo que requiere la comprensión de los aspectos bioquímicos de las interacciones entre las plantas y sus patógenos (Pedras, 2008; Huang et al., 2003). Ya en algunas especies vegetales de importancia económica se ha ensayado el empleo de la ingeniería genética como opción para el control de enfermedades y depredadores sin recurrir al uso de compuestos químicos tóxicos. Tal es el caso de los cultivos Bt de arroz, maíz, algodón y vegetales, que al ser transformados con genes cry de la bacteria Bacillus thuringiensis desarrollan resistencia en campo a insectos plaga (Huang et al., 2003). En países como China, la introducción de este tipo de cultivos modificados genéticamente ha demostrado reducir dramáticamente el uso de pesticidas tóxicos en los cultivos, lo que a su vez, reduce el número de casos de intoxicaciones con dichos productos, mejorando los niveles de salubridad en los agricultores y consumidores, y también contribuye en la descontaminación del suelo (Huang et al., 2003).
La actividad biológica que han mostrado las defensinas las hace unas moléculas atractivas para uso en biotecnología en las áreas de ingeniería de proteínas y producción de plantas transgénicas de cultivos económicamente importantes en los cuales se necesita combatir plagas que los ataquen (De Oliveira y Moreira, 2009). Ya se han adelantado investigaciones en las cuales, al transformar plantas susceptibles a cierta enfermedad con un gen de defensina que ataque a su agente patógeno se genera en ellas resistencia. Cabe destacar la transformación genética de cereales económicamente importantes como el arroz, al cual se le transfirió el gen de defensina Rs-AFP2 de rábano, confiriéndole resistencia a M. oryzae y R. solani (Jha y Chattoo, 2009). La expresión de la defensina Dm-AMP1 de dalia en plantas de arroz (Oryza sativa L. sp. indica cv. Pusa basmati) las hace resistentes a la invasión de R. solani y M. oryzae, causantes de las enfermedades de tizón de la vaina y piricularia respectivamente (Jha et al., 2009). Esta última enfermedad también se ha logrado controlar transformando plantas de O. sativa cv. Sasanishiki con genes defesina de wasabi (Wasabia japonica), lo que las hace igualmente resistentes (Kanzaki et al., 2002). La transformación de maní y tabaco con el gen de la defensina de mostaza BjD, generaron protección en hojas hacia F. moniliforme y Phytophthora parasitica pv. nicotianae en el tabaco, y contra Pheaoisariopsis personata y Cercospora arachidicola en maní (Swathi et al.,2008). Plantas de papaya (Carica papaya) transformadas con el gen de defensina DmAMP1 de dalia presentan resistencia al ataque por P. palmivora (Zhu et al., 2007). Se ha logrado también la expresión de defensinas animales en plantas para conferir resistencia, por ejemplo, la defensina denominada -galerimicina- de la polilla grande de la cera (Galleria mellonella) expresada por plantas de tabaco (N. tabacum cv. Xanthi-nc), las hace resistentes a los hongos Erysiphe cichoracearum y Sclerotinia minor, causantes del oídio o mildeo polvoso y el tizón o podredumbre respectivamente (Langen et al., 2006). Al transformar plantas de A. thaliana con el gen de la beta defensina 2 humana, se genera en la planta resistencia al ataque por B. cinerea (Aerts et al., 2007). El método de trans formación más utilizado ha sido el mediado por Agrobacterium tumefasciens con promo tores como el del virus del mosaico de la coliflor (CaMV35S), del citocromo c de arroz o Ubiquitina de maíz (Ub1), de expresión constitutiva (Choi et al., 2009; Jha y Chatoo, 2009; Zhu et al., 2007).
Las defensinas pueden trabajar junto a otros compuestos antimicrobianos confiriendo o reforzando la resistencia, así como se ven implicadas en adaptaciones a estrés abiótico (Tavares et al., 2008; Mirouze et al., 2006), lo que significa que las defensinas no solamente contribuyen a la defensa contra patógenos en las plantas, sino que también generan adaptaciones a condiciones difíciles, característica que las hace aún más atractivas para utilización en mejoramiento de variedades vegetales.
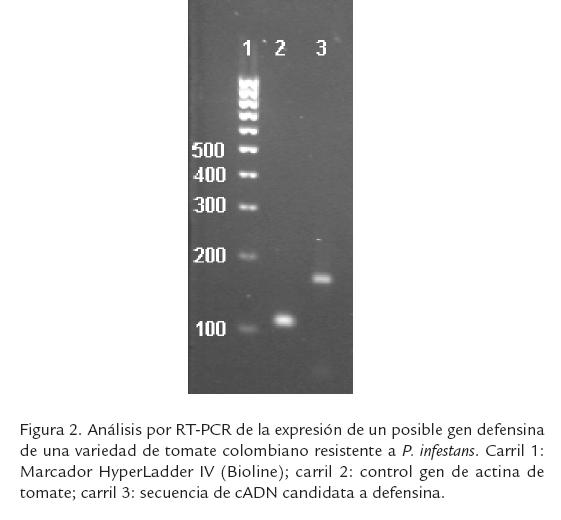
Recientemente, en nuestro laboratorio hemos acumulado evidencia experimental de la presencia y significado biológico de las defensinas en una variedad colombiana de tomate (Solanum licopersicum var. cerasiforme) resistente a la enfermedad de tizón tardío (en inglés: late blight) causado por el hongo fitopatógeno P. infestans (Riaño y Zamora, 2005). Mediante análisis bioquímicos, especialmente usando pruebas cromatográficas, del líquido de lavado intercelular de esta variedad de tomate, nuestro grupo aisló un péptido catiónico de 5,2 kDa que presentó actividad antifúngica in vitro sobre P. infestans (Riaño y Zamora, 2005). Además, después de infectar esta variedad resistente con el hongo fitopatógeno con posterior extracción de RNA mensajero y síntesis de cADN, conseguimos identificar la expresión constitutiva de un fragmento de aproximadamente 160 pb mediante PCR utilizando oligonucleótidos basados en secuencias de defensinas presentes en otras solanáceas (Fig. 2). Este hallazgo puede sentar bases para la generación de resistencia al tizón tardío en variedades susceptibles de tomate, utilizando la metodología de transgénesis, como ya se mencionó, o para su expresión en otros sistemas útiles para el control de plagas. Los microorganismos también podrían ser empleados en el control de enfermedades vegetales transformándolos genéticamente con genes de defensinas, bien para aplicación directa o para producción de las proteínas recombinantes en escalas industriales. Por ejemplo, se ha logrado la expresión de defensinas vegetales en sistemas microbianos tales como Saccharomyces cerevisiae (Jha et al., 2009), Pichia pastoris (Chen et al., 2004; Cabral et al., 2003) y Escherichia coli (Kovalskaya y Hammond, 2009; Marquès et al., 2009; De Paula et al., 2008; Vijayan et al., 2008; Da-Hui et al., 2007), lo que sugiere que sería posible emplear genes codificantes de defensinas para transformar microorganismos que actualmente se usan como biocontroladores o biopesticidas, e incrementar su capacidad controladora de enfermedades.
Otra de las ventajas que ofrecen las defensinas es el hecho que una sola de ellas es capaz de inhibir varios hongos fitopatógenos. Como ejemplo podemos citar la defensina RsAFP2 de rábano que inhibe hongos patógenos como Colletotrichum lindemuthianum, Fusarium culmorum, F. oxysporum, Nectria haematococca, B. cinerea, V. dahliae y Mycosphaerella fijiensis, a concentraciones desde 1 a 3 µg/ml (de Oliveira y Moreira, 2009).
CONCLUSIONES
Aún falta mucho por explorar en el campo de las defensinas, especialmente en el análisis de sus mecanismos de acción, lo que contribuiría enormemente en el desarrollo de nuevos antibióticos y estrategias de control de fitopatógenos. Falta igualmente ampliar en el análisis estructuras tridimensionales, en una mayor cantidad de defensinas y la realización de mutagénesis sitio-dirigida (Tavares et al., 2008). Es de resaltar que la estructura estabilizada por puentes disulfuro y carga catiónica que presentan las defensinas, las hace unas moléculas muy estables, característica fundamental para la elaboración de productos biotecnológicos basados en ellas (Tavares et al., 2008). Comprender en mayor medida los mecanismos de la inmunidad innata de las plantas en el contexto de los actuales desarrollos en ingeniería genética y de proteínas, representa una herramienta poderosa para el desarrollo de nuevos cultivos con resistencia incrementada contra plagas, así como nuevos productos farmacéuticos vegetales, que mitigarían los problemas asociados con el cultivo, cosecha, almacenamiento y procesamiento de alimentos y demás productos vegetales, incrementando la producción agrícola y la disponibilidad de alimentos (Tavares et al., 2008). A la fecha se han hecho numerosos ensayos insertando genes defensina activos en plantas susceptibles a una enfermedad, resultando en la generación de resistencia a la misma, pero aún falta mayor información acerca de sus usos potenciales o posibles riesgos asociados a su baja especificidad, en la producción a gran escala de biocontroladores y biopesticidas, además de la generación de plantas resistentes disponibles comercialmente.
BIBLIOGRAFÍA
AERTS AM, THEVISSEN K, BRESSELEERS SM, SELS J, WOUTERS P, CAMMUE BP, et al. Arabidopsis thaliana plants expressing human beta-defensin-2 are more resistant to fungal attack: functional homology between plant and human defensins. Plant Cell Rep. 2007;26(8):1391-1398.
[ Links ]AERTS AM, FRANÇOIS IEJA, CAMMUE BPA, THEVISSEN K. The mode of antifungal action of plant, insect and human defensins. Cell Mol Life Sci. 2008;65:2069-2079.
[ Links ]CABRAL KM, ALMEIDA MS, VALENTE AP, ALMEIDA FC, KURTENBACH E. Production of the active antifungal Pisum sativum defensin 1 (Psd1) in Pichia pastoris: overcoming the inefficiency of the STE13 protease. Protein Expr Purif. 2003;31:115-122.
[ Links ]CARVALHO AO, FILHO GA, FERREIRA BS, BRANCO AT, OKOROKOVA-FAÇANHA AL, GOMES VM. Cloning and characterization of a cDNA encoding a cowpea seed defensin and analysis of its expression. Protein Pept Lett. 2006;13(10):1029-1036.
[ Links ]CASADEI E, WANG T, ZOU J, GONZÁLEZ VECINO JL, WADSWORTH S, SECOMBES CJ. Characterization of three novel �-defensin antimicrobial peptides in rainbow trout (Oncorhynchus mykiss). Mol Immunol. 2009;46(16):3358-3366.
[ Links ]CHATTOPADHYAY S, SINHA NK, BANERJEE S, ROY D, CHATTOPADHYAY D, ROY S. Small cationic protein from a marine turtle has beta-defensin-like fold and antibacterial and antiviral activity. Proteins. 2006;64(2):524-531.
[ Links ]CHEHAB EW, KASPI R, SAVCHENKO T, ROWE H, NEGRE-ZAKHAROV F, KLIEBENSTEIN D, et al. Distinct Roles of Jasmonates and Aldehydes in Plant-Defense Responses. PLoS One. 2008;3(4):e1904.
[ Links ]CHEN JJ, CHEN GH, HSU HC, LI SS, CHEN CS. Cloning and Functional Expression of a Mungbean Defensin VrD1 in Pichia pastoris. J Agric Food Chem. 2004;52:2256-2261.
[ Links ]CHEN J, QI S, GUO R, YU B, CHEN D. Different messenger RNA expression for the antimicrobial peptides beta-defensins between Meishan and crossbred pigs. Mol Biol Rep. 2010;37(3):1633-1639.
[ Links ]CHOI MS, KIM YH, PARK HM, SEO BY, JUNG JK, KIM ST, et al. Expression of BrD1, a Plant Defensin from Brassica rapa, Confers Resistance against Brown Planthopper (Nilaparvata lugens) in Transgenic Rices. Mol Cells. 2009;28:131-137.
[ Links ]DA-HUI L, GUI-LIANG J, YING-TAO Z, TIE-MIN A. Bacterial expression of a Trichosanthes kirilowii defensin (TDEF1) and its antifungal activity on Fusarium oxysporum. Appl Microbiol Biotechnol. 2007;74:146-151.
[ Links ]DE OLIVEIRA CARVALHO A, MOREIRA GOMES V. Plant defensins - Prospects for the biological functions and biotechnological properties. Peptides. 2009;30:1007-1020.
[ Links ]DE PAULA VS, RAZZERA G, MEDEIROS L, MIYAMOTO CA, ALMEIDA MS, KURTENBACH E, et al. Evolutionary relationship between defensins in the Poaceae family strengthened by the characterization of new sugarcane defensins. Plant Mol Biol. 2008;68:321-335.
[ Links ]DROIN N, HENDRA JB, DUCOROY P, SOLARY E. Human defensins as cancer biomarkers and antitumour molecules. J Proteomics. 2009;72(6):918-927.
[ Links ]FALCO A, CHICO V, MARROQUÍ L, PEREZ L, COLL JM, ESTEPA A. Expression and antiviral activity of a beta-defensin-like peptide identified in the rainbow trout (Oncorhynchus mykiss) EST sequences. Mol Immunol. 2008;45(3):757-765.
[ Links ]GAO B, RODRÍGUEZ MC, LANZ MENDOZA H, ZHU S. AdDLP, a bacterial defensin-like peptide, exhibits anti-Plasmodium activity. Biochem Biophys Res Commun. 2009;387(2):393-398.
[ Links ]GONZALEZ M, GUEGUEN Y, DESSERRE G, DE LORGERIL J, ROMESTAND B, BACHÈRE E. Molecular characterization of two isoforms of defensin from hemocytes of the oyster Crassostrea gigas. Dev Comp Immunol. 2007;31(4):332-339.
[ Links ]GRAHAM MA, SILVERSTEIN KAT, VANDENBOSCH KA. Defensin-like Genes: Genomic Perspectives on a Diverse Superfamily in Plants. Crop Sci. 2008;48:S3-S11.
[ Links ]HUANG J, HU R, PRAY C, QIAO F, ROZELLE S. Biotechnology as an alternative to chemical pesticides: a case study of Bt cotton in China. Agric Econ Res. 2003;29:55-67.
[ Links ]JHA S, CHATTOO BB. Expression of a plant defensin in rice confers resistance to fungal phytopathogens. Transgenic Res. 2010;19(3):373-384.
[ Links ]JHA S, TANK HG, PRASAD BD, CHATTOO BB. Expression of Dm-AMP1 in rice confers resistance to Magnaporthe oryzae and Rhizoctonia solani. Transgenic Res. 2009;18:59-69.
[ Links ]KANNAN L, LIYANAGE R, LAY JO JR, RATH NC. Evaluation of beta defensin 2 production by chicken heterophils using direct MALDI mass spectrometry. Mol Immunol. 2009;46(15):3151-3156.
[ Links ]KANZAKI H, NIRASAWA S, SAITOH H, ITO M, NISHIHARA M, TERAUCHI R, et al. Overexpression of the wasabi defensin gene confers enhanced resistance to blast fungus (Magnaporthe grisea) in transgenic rice. Theor Appl Genet. 2002;105:809-814.
[ Links ]KOVALEVA V, KIYAMOVA R, CRAMER R, KRYNYTSKYY H, GOUT I, FILONENKO V, et al. Purification and molecular cloning of antimicrobial peptides from Scots pine seedlings. Peptides. 2009;30(12):2136-2143.
[ Links ]KOVALSKAYA N, HAMMOND RW. Expression and functional characterization of the plant antimicrobial snakin-1 and defensin recombinant proteins. Protein Expr Purif. 2009;63:12-17.
[ Links ]LANGEN G, IMANI J, ALTINCICEK B, KIESERITZKY G, KOGEL KH, VILCINSKAS A. Transgenic expression of gallerimycin, a novel antifungal insect defensin from the greater wax moth Galleria mellonella, confers resistance to pathogenic fungi in tobacco. J Biol Chem. 2006;387:549-557.
[ Links ]LOBO DS, PEREIRA IB, FRAGEL-MADEIRA L, MEDEIROS LN, CABRAL LM, FARIA J, et al. Antifungal Pisum sativum defensin 1 interacts with Neurospora crassa cyclin F related to the cell cycle. Biochemistry. 2007;46(4):987-996.
[ Links ]LOOFT C, PAUL S, PHILIPP U, REGENHARD P, KUIPER H, DISTL O, et al. Sequence analysis of a 212 kb defensin gene cluster on ECA 27q17. Gene. 2006;376(2):192-198.
[ Links ]MARQUÈS L, OOMEN RJFJ, AUMELAS A, LE JEAN M, BERTHOMIEU P. Production of an Arabidopsis halleri foliar defensin in Escherichia coli. J Appl Microbiol. 2009;106:1640-1648.
[ Links ]MINABA M, UENO S, PILLAI A, KATO Y. Evolution of ASABF (Ascaris suum antibacterial factor-type antimicrobial peptides in nematodes: putative rearrangement of disulfide bonding patterns. Dev Comp Immunol. 2009;33(11):1147-1150.
[ Links ]MIROUZE M, SELS J, RICHARD O, CZERNIC P, LOUBET S, JACQUIER A, et al. A putative novel role for plant defensins: a defensin from the zinc hyper-accumulating plant, Arabidopsis halleri, confers zinc tolerance. Plant J. 2006;47:329-342.
[ Links ]MYGIND PH, FISCHER RL, SCHNORR KM, HANSEN MT, SÖNKSEN CP, LUDVIGSEN S, et al. Plectasin is a peptide antibiotic with therapeutic potential from a saprophytic fungus. Nature. 2005;437(7061):975-980.
[ Links ]NEIRA OVIEDO M, RIBEIRO JM, HEYLAND A, VANEKERIS L, MOROZ T, LINSER PJ. The salivary transcriptome of Anopheles gambiae (Diptera: Culicidae) larvae: A microarray-based analysis. Insect Biochem Mol Biol. 2009;39(5-6):382-394.
[ Links ]ODINTSOVA TI, ROGOZHIN EA, BARANOV Y, MUSOLYAMOV AK, YALPANI N, EGOROV TA, et al. Seed defensins of barnyard grass Echinochloa crusgalli (L.) Beauv. Biochimie. 2008;90:1667-1673.
[ Links ]PEDRAS MSC. The Chemical Ecology of Crucifers and Their Fungal Pathogens: Boosting Plant Defenses and Inhibiting Pathogen Invasion. Chem Rec. 2008;8:109-115.
[ Links ]RIAÑO LD, ZAMORA HM. Proteínas antifúngicas contra P. infestans en los espacios intercelulares de hojas de tomate (Lycopersicon esculentum cerasiforme) posibles defensinas de plantas. Revista Colombiana de Química. 2005;34(1):7-23.
[ Links ]SAITO Y, KONNAI S, YAMADA S, IMAMURA S, NISHIKADO H, ITO T, et al. Identification and characterization of antimicrobial peptide, defensin, in the taiga tick, Ixodes persulcatus. Insect Mol Biol. 2009;18(4):531-539.
[ Links ]SANG Y, BLECHA F. Porcine host defense peptides: expanding repertoire and functions. Dev Comp Immunol. 2009;33(3):334-343.
[ Links ]SEEBAH S, SURESH A, ZHUO S, CHOONG YH, CHUA H, CHUON D, et al. Defensins knowledgebase: a manually curated database and information source focused on the defensins family of antimicrobial peptides Nucleic Acids Res. 2007;35:D265-D268.
[ Links ]SELS J, MATHYS J, DE CONINCK B, CAMMUE B, DE BOLLE M. Plant pathogenesis-related (PR) proteins: A focus on PR peptides. Plant Physiol Biochem. 2008;46:941-950.
[ Links ]SOLIS J, MEDRANO G, GHISLAIN M. Inhibitory effect of a defensin gene from the Andean crop maca (Lepidium meyenii) against Phytophthora infestans. J Plant Physiol. 2007;164:1071-1082.
[ Links ]SOMAN SS, ARATHY DS, SREEKUMAR E. Discovery of Anas platyrhynchos avian beta-defensin 2 (Apl_AvBD2) with antibacterial and chemotactic functions. Mol Immunol. 2009;46(10):2029-2038.
[ Links ]STEGEMANN C, KOLOBOV A JR, LEONOVA YF, KNAPPE D, SHAMOVA O, OVCHINNIKOVA TV, et al. Isolation, purification and de novo sequencing of TBD-1, the first beta-defensin from leukocytes of reptiles. Proteomics. 2009;9(5):1364-1373
[ Links ]SWATHI ANURADHA T, DIVYA K, JAMI SK, KIRTI PB. Transgenic tobacco and peanut plants expressing a mustard defensin show resistance to fungal pathogens. Plant Cell Rep. 2008;27:1777-1786
[ Links ]TAVARES LS, SANTOS MO, VICCINI LF, MOREIRA JS, MILLER RNG, FRANCO OL. Biotechnological potential of antimicrobial peptides from flowers. Peptides 2008;29:1842-1851.
[ Links ]THEVISSEN K, WARNECKE DC, FRANÇOIS IEJA, LEIPELT M, HEINZ E, OTT C, et al. Defensins from Insects and Plants Interact with Fungal Glucosylceramides. J Biol Chem. 2004;279(6):3900-3905.
[ Links ]THOMMA BPHJ, CAMMUE BPA, THEVISSEN K. Plant defensins. Planta. 2002;216:193-202.
[ Links ]VAN DEN HEUVEL KJ, HULZINK JM, BARENDSE GW, WULLEMS GJ. The expression of tgas118, encoding a defensin in Lycopersicon esculentum, is regulated by gibberellin. J Exp Bot. 2001;52(360):1427-1436.
[ Links ]VAN DER WEERDEN NL, LAY FT, ANDERSON MA. The plant defensin, NaD1, enters the cytoplasm of Fusarium oxysporum hyphae. J Biol Chem. 2008;283(21):14445-14452.
[ Links ]VIJAYAN S, GURUPRASAD L, KIRTI PB. Prokaryotic expression of a constitutively expressed Tephrosia villosa defensin and its potent antifungal activity. Appl Microbiol Biotechnol. 2008;80(6):1023-1032.
[ Links ]WANIEK PJ, CASTRO HC, SATHLER PC, MICELI L, JANSEN AM, ARAÚJO CA. Two novel defensin-encoding genes of the Chagas disease vector Triatoma brasiliensis (Reduviidae, Triatominae): gene expression and peptide-structure modeling. J Insect Physiol. 2009;55(9):840-848.
[ Links ]YAMAGE M, YOSHIYAMA M, GRAB DJ, KUBO M, IWASAKI T, KITANI H, et al. Characteristics of novel insect defensin-based membrane-disrupting trypanocidal peptides. Biosci Biotechnol Biochem. 2009;73(7):1520-1526.
[ Links ]ZHAO J, SONG L, LI C, NI D, WU L, ZHU L, et al. Molecular cloning, expression of a big defensin gene from bay scallop Argopecten irradians and the antimicrobial activity of its recombinant protein. Mol Immunol. 2007Jan;44(4):360-368.
[ Links ]ZHU S. Evidence for myxobacterial origin of eukaryotic defensins. Immunogenetics. 2007;59:949-954.
[ Links ]ZHU S. Discovery of six families of fungal defensin-like peptides provides insights into origin and evolution of the CS alfa-beta defensins. Mol Immunol. 2008;45:828-838.
[ Links ]ZHU YJ, AGBAYANI R, MOORE PH. Ectopic expression of Dahlia merckii defensin DmAMP1 improves papaya resistance to Phytophthora palmivora by reducing pathogen vigor. Planta. 2007; 226:87-97.
[ Links ]













