Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.15 no.3 Bogotá Sept./Dec. 2010
BIOLOGÍA REPRODUCTIVA DEL LISO Rhamdia quelen (PISCES: HEPTAPTERIDAE) EN EL RÍO SINÚ, COLOMBIA
Reproductive Biology of Liso Rhamdia quelen (Pisces: Heptapteridae) in the Sinu River, Colombia
CHARLES W. OLAYA-NIETO1, M.Sc.; DAVID F. HERNÁNDEZ ROSSO1, EDGAR AYARZA PÉREZ1
1 Laboratorio de Investigación Biológico Pesquera-LIBP. Departamento de Ciencias Acuícolas. Universidad de Córdoba, Lorica, Colombia. Carrera 23 # 2A-20, piso 2. charles_olaya@hotmail.com, davidhernandez1707@hotmail.com, ayarza_perez@hotmail.com
Presentado 22 de febrero de 2010, aceptado 18 de agosto de 2010, correcciones 19 de agosto de 2010.
RESUMEN
Se estudió la biología reproductiva del Liso (Rhamdia quelen) en el río Sinú. Los peces fueron colectados entre enero y diciembre del 2005, con tallas y pesos entre 15,5 -37 cm de longitud total (LT) y 28 -486 g de peso total. Las gónadas se conservaron en solución Gilson, se utilizó la escala de Vazzoler y se estimó proporción sexual, índices de madurez sexual, época de desove, talla media de madurez sexual, diámetro de ovocitos y fecundidad. Se evaluaron 207 hembras, 130 machos y un indiferenciado, con proporción sexual hembra: macho de 1,6:1, diferente a lo esperado. La talla media de madurez fue estimada en 24 cm LT para sexos combinados, el diámetro promedio de los ovocitos fue de 963 µm y la fecundidad promedio fue estimada en 26.305 ovocitos, con ecuación de mejor ajuste F=2960,61 WG 0,88, r=0,94, n=125. El Liso es un pez con tipo de desarrollo ovocitario asincrónico en más de dos grupos, con desoves parciales durante todo el año.
Palabras clave: Liso, fecundidad, biología reproductiva, época de desove.
ABSTRACT
The reproductive biology of Liso (Rhamdia quelen) in the Sinu river was studied. The fishes were collected between January and December 2005, with lengths ranging 15,5 -37 cm of total length (TL) and 28 - 486 g of total weight. The gonads were placed in Gilson solution, the Vazzoler scale was applicated and sexual proportion, sexual maturity index, spawning season, the length at first maturity, ovocites’s diameter and fecundity were estimated; 207 females, 130 males and 1 undifferentiated were evaluated, with sexual proportion female: male of 1,6:1, different from expected. The length at first maturity was estimated in 24 cm TL for combined sexes; average ovocites’s diameter was 963 mm and average fecundity was estimated in 26.305 ovocites, with better equation F=2960,61 0,88, r=0,94, n=125. The Liso is a fish with asynchronous oocyte development in more than two groups, with partial spawning throughout the year.
Key words: Liso, Fecundity, Reproductive biology, Spawning season.
INTRODUCCIÓN
El Liso (Rhamdia quelen (Quoy y Gaimard, 1824)) es un pez de cuero que conforma la familia Heptapteridae (Bockmann y Guazzelli, 2003), alcanza 35 cm de longitud estándar (LS), y su aspecto es bastante similar al Nicuro (Pimelodus blochii Valenciennes, 1840), especie de la cual se diferencia fácilmente por su cráneo liso y su aleta adiposa más larga (Dahl, 1971), hocico achatado, aleta dorsal y pectoral con espinas débiles y poco punzantes (Arias y Aya, 2004).
Rhamdia quelen se encuentra en América, desde México hasta Argentina (Bockmann y Guazzelli, 2003). En Colombia, se encuentra en las cuencas de los ríos Atrato, Magdalena y Sinú (Miles, 1947; Dahl, 1971; Silfvergrip, 1996) y presenta hábitos nocturnos (Gomes et al., 2000). En el río Sinú se determinó el contenido de su dieta alimentaria, encontrándose que el grupo Peces fue el grupo más frecuente (69,9%), abundante (45,5%) y con mayor composición en peso (76,8%), conformado por Cachana (Cynopotamus atratoensis (Eigenmann, 1907)), Cocobolo (Aequidens pulcher (Gill, 1858)), Mayupa (Sternopygus macrurus (Bloch y Schneider, 1801)) y Sardina (Astyanax sp.), siendo considerado como un pez de hábitos alimentarios carnívoros con tendencia piscívora (Olaya-Nieto et al., 2007; Pacheco y Ochoa, 2008).
En la mayoría de las especies del género Rhamdia Bleeker, 1858 la primera maduración gonadal se presenta al final del primer año de vida, coincidiendo con la estación lluviosa (Gomes et al., 1999; Ortega-Lara et al., 2002). El Liso no presenta cuidado parental y desova en lugares con agua limpia, calmada y fondo pedregoso (Pereira et al., 2006). Excepto por el trabajo de Clavijo-Ayala y Arias (Clavijo-Ayala y Arias, 2004), es notoria la escasez de información sobre la biología reproductiva de esta especie en Colombia. El conocimiento sobre los cambios que ocurren en las gónadas de los peces, la determinación del sexo y su proporción, talla de madurez sexual, tipo, número y época de desove y la fecundidad es de suma importancia porque permite comprender la biología reproductiva de una especie, factor fundamental en el proceso de evaluación de una población (Tresierra y Culquichicón, 1993).
Por lo tanto, el objetivo de este trabajo fue estudiar su biología reproductiva en el río Sinú, Colombia, como contribución al estado del conocimiento de la especie, a su preservación en el ambiente natural y al ordenamiento de su pesquería.
MATERIALES Y MÉTODOS
La investigación se realizó en el Bajo río Sinú, entre enero y diciembre del 2005. El río Sinú tiene una longitud de 380 km, se extiende desde el nudo de Paramillo en el departamento de Antioquia hasta el delta de Tinajones en el mar Caribe, en el departamento de Córdoba, y su cuenca tiene una superficie de 13.700 km2. En su parte media y baja se encuentran la ciénaga Grande de Betancí, la ciénaga Grande de Lorica, las ciénagas de la margen izquierda y otras de menor tamaño. Presenta una temperatura promedio anual de 28 ºC, que en épocas de lluvia cuando las aguas inundan los planos cenagosos, disminuye a 27 ºC (Bustamante, 2000).
El área de estudio presenta pluviosidad media anual de 1.200 mm/año, con un régimen bimodal de precipitaciones, períodos lluviosos en abril-junio y agosto-octubre. El principal período seco se prolonga desde noviembre a marzo, con uno de menor proporción en julio-agosto (IDEAM, 1998).
Para la identificación taxonómica de la especie se siguió a Dahl, y Bockmann y Guazzelli (Dahl, 1971; Bockmann y Guazzelli, 2003), colectándose 338 individuos, a quienes se les tomó longitud total (LT), longitud horquilla (LH) y longitud estándar (LS) al milímetro más cercano con un ictiómetro graduado, y el peso total (WT) al gramo más cercano con una balanza eléctrica Ohaus con capacidad de 1.500 g (±0,01). Todos los peces fueron eviscerados y las gónadas se separaron del resto de órganos, registrándose fecha, sitio de captura, arte de pesca utilizado, peso eviscerado, sexo, peso de las gónadas, número de la muestra y estado de madurez sexual de acuerdo con la escala de Vazzoler, 1971: I, Inmaduro o Virgen; II, En maduración; III, Maduro y IV, Vacío o desovado.
La proporción sexual total se calculó con la ecuación de Wenner, 1972: % machos=100 * (Nm/Nt), en donde Nm es el número de machos y Nt el número total de individuos. La proporción sexual a la talla se determinó con la técnica de Holden y Raitt, 1975, utilizando intervalos de clase de 2 cm. El Índice gonadosomático (IGS1) y el Índice gonadosomático corregido (IGS2) se estimaron con las ecuaciones de Vazzoler et al., 1989: IGS1=100 * (WG/WT), en donde WG es el peso de las gónadas y WT es el peso total del pez; (IGS2)= 100 * (WG/WE), en donde WE es el peso eviscerado del pez. También se obtuvo el Índice gonadal (IG) Vazzoler, 1996: IG = 104 * WG/LTb, en donde LT es la talla total del pez y b es el coeficiente de crecimiento de la regresión longitud-peso. El factor 104 se utilizó para efectos de cálculos y comparación con IGS1 e IGS2.
La talla de madurez sexual se estimó utilizando la metodología propuesta por Sparre y Venema, 1995, estudiándose 166 hembras y 115 machos en estados de madurez sexual II y III, respectivamente. Con un ocular micrométrico se midió el diámetro a 1.222 ovocitos procedentes de diferentes muestras de todos los meses del año, seleccionadas al azar, a quienes se les estableció su distribución de frecuencia de diámetro para observar y seleccionar la correspondiente a los de mayor diámetro, es decir, a los ovocitos maduros lo cual está asociado con los estados de madurez sexual.
Para estimar la fecundidad total o absoluta (F), se analizaron 125 muestras de hembras en estado III, tomándose tres submuestras (0,15-0,25 g) de cada una de las gónadas, izquierda y derecha. Se utilizó el método gravimétrico (Laevastu, 1980) con la siguiente ecuación: F=nG/g, en donde n es el número de ovocitos maduros en la muestra, G es el peso de todos los ovocitos y g es el peso de la muestra. También se estimaron las ecuaciones de fecundidad, longitud total-fecundidad, peso total-fecundidad y peso de gónadas-fecundidad, y la fecundidad relativa con respecto a la talla, peso del pez y peso de las gónadas.
Se utilizó estadística descriptiva y las variables fueron expresadas como promedio ± desviación estándar. Para comprobar si la proporción sexual estimada se ajustaba a la esperada, se aplicó el test estadístico Chi-cuadrado (Zar, 1996). Se aplicó el análisis de varianza de una vía para evaluar los cambios de los índices estimados para hembras y machos en cada estado de madurez durante el ciclo reproductivo. Cuando se encontraron diferencias estadísticas significativas (p< 0,05) se aplicó la prueba de comparaciones múltiples de Tukey-Kramer.
RESULTADOS
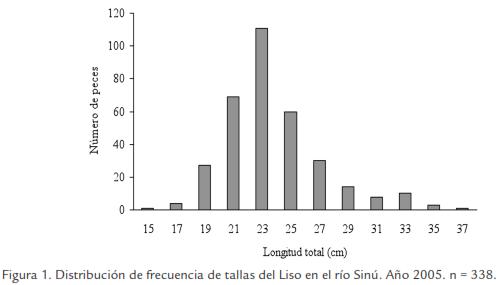
Se estudiaron 338 individuos colectados entre enero-diciembre 2005, con tallas y pesos que oscilaron entre 15,5-37,0 (23,6 ± 3,4) cm LT y 28,0-486,0 (139,5 ± 70,9) g de peso total, de los cuales 207 fueron hembras, 130 machos y un indiferenciado. La talla mínima y máxima fueron registradas en abril; el menor peso fue registrado en abril y el mayor en junio. La distribución de frecuencias de tallas presenta una curva con intervalos de clase entre 15,0 y 37,0 cm LT y talla media de captura de 23,8 cm LT (Fig. 1).
La proporción sexual total hembra: macho encontrada fue 1,6:1, diferente a lo esperado 1:1 (X2: 17,593; p: 0,05; 1 gl). Al analizarla mensualmente se observan diferencias estadísticas significativas en febrero (2,7:1), julio (2,2:1), agosto y septiembre (2,3:1). La proporción sexual hembra: macho a la talla es diferente a lo esperado en los intervalos intermedios (23,0-25,0, 25,0-27,0, 27,0-29,0) cm LT.
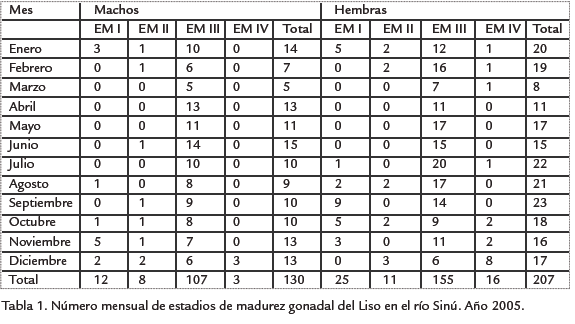
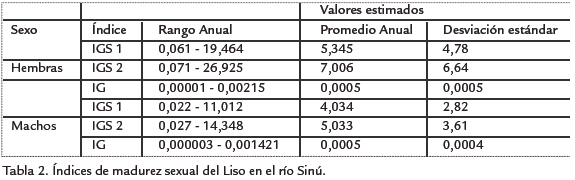
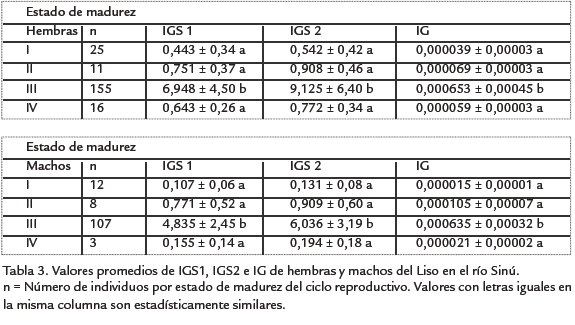
La composición mensual y anual de los estadios de madurez gonadal se presenta en la Tabla 1, en donde se observa que la mayor parte de la muestra estuvo conformada por individuos maduros, estado de madurez III, tanto para hembras (n =155, 74,9%) como para machos (n =107, 82,3%), estado de madurez presente en todos los meses del año. En la Tabla 2 se presentan los rangos y el promedio anual de los tres índices de madurez obtenidos: Índice gonadosomático 1 (IGS1), Índice gonadosomático 2 (IGS2) e Índice gonadal (IG) para hembras (0,061-19,464, 0,071-26,925 y 0,00001-0,00215) y machos (0,022-11,012, 0,027-14,348 y 0,000006-0,001421), respectivamente; mientras que en la Tabla 3 se muestran los valores promedios de dichos índices por sexo y estado de madurez.
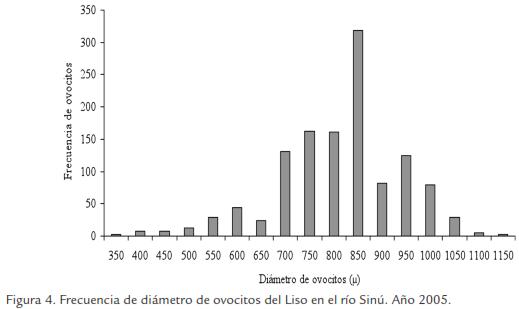
La talla de inicio de madurez sexual encontrada fue 17,9 y 15,5 cm LT para hembras y machos, respectivamente, la talla media de madurez sexual fue estimada en 24,1, 23,6 y 24,0 cm LT para hembras (Fig. 2), machos (Fig. 3) y sexos combinados, respectivamente, y el diámetro de los ovocitos maduros osciló entre 901 y 1.126 µm, con promedio de 963 (± 71) µm.
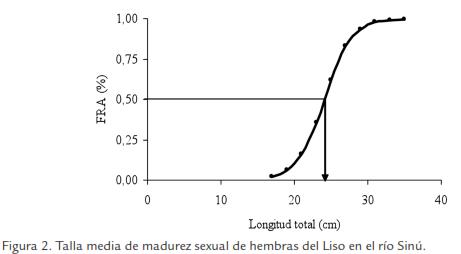
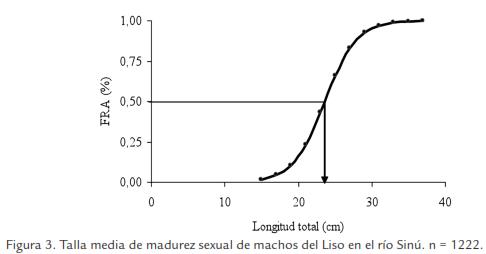
La época de desove se estimó teniendo en cuenta el análisis macroscópico de las gónadas (hembras y machos), los índices de madurez sexual, las diferencias estadísticas significativas encontradas entre los cuatro estados de madurez sexual asignados para hembras y machos, la colecta de individuos hembras y machos en estado de madurez III en todo los meses del año de estudio y el diámetro de los ovocitos maduros, observándose varios lotes de ovocitos en las gónadas: los de reserva y los que están en diferentes fases de desarrollo, es decir un asincronismo en más de dos lotes (Fig. 4), lo que significa que el Liso es un pez con desoves parciales a lo largo del año.
Analizando los índices de madurez sexual de hembras y machos en el tiempo, se observa un comportamiento similar en las curvas para cada sexo, con una prolongada época de desove que muestra picos reproductivos en mayo, julio y noviembre para hembras y en abril, septiembre y diciembre para machos.
Las tallas, pesos totales y pesos de gónadas de los 125 peces usados en la estimación de la fecundidad oscilaron entre 18,4 y 35,0 (24,5±3,2) cm LT, 66,0 y 448,0 (158,0±69,9) g y 2,12 y 43,09 (12,02±8,5) g. Mientras que las tallas son homogéneas (Coeficiente de variación (CV=12,9%), el peso total y peso de las gónadas no lo son (CV > 30,0%), lo que explica en parte la dispersión en las estimaciones de fecundidad de las diferentes muestras analizadas (CV = 70,6%).
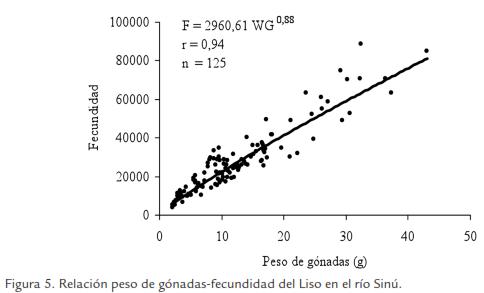
La fecundidad promedio por desove fue estimada en 26.305 ± 17.408 ovocitos. Las ecuaciones de fecundidad fueron: F=44,96 LT 1,93, r=0,35, n=125; F=564,86 WT 0,73, r=0,42, n=125 y F=2960,61 WG 0,88, r=0,94, n=125 (Fig. 5). Aunque la última curva es la que presenta mejor ajuste, todas muestran coeficientes de correlación altos y estadísticamente significativos al 95% de confianza. Las fecundidades relativas promedio fueron 1.056±631 ovocitos/cm LT, 174±95 ovocitos/g de peso total y 2.331±577 ovocitos/g de gónada.
DISCUSIÓN
Además de encontrarse individuos maduros durante todo el año de estudio, también se observó que los valores máximos mensuales para los índices de madurez sexual son
altos; por ejemplo, el Índice gonadosomático 1 (IGS1) osciló entre 7,366 (febrero) y 19,464 (mayo). Investigaciones realizadas en Brasil reportan que el Índice gonadosomático un máximo de hembras maduras de R. quelen alcanzó 10,17% (Machado-Fracalossii et al., 2004) y 20,7% (Sampaio y Sato, 2006) y que, en general, en las especies de Rhamdia el IGS de hembras maduras varía entre 7 y 20% (Narahara, 1983; Vazzoler, 1996; Suzuki, 1998; Sato, 1999); lo que concuerda con los resultados obtenidos en este trabajo.
Como era de esperarse, los índices de madurez sexual alcanzaron sus valores más altos en el estado de madurez gonadal III, encontrándose diferencias estadísticas significativas (p < 0,05) entre este estado con los otros tres en el Índice gonadosomático 1, el Índice gonadosomático 2 y el Índice gonadal, tanto para hembras como machos (Tabla 3). Con respecto a las tallas de madurez, las tallas de inicio de madurez sexual encontrada en este trabajo para hembras (17,9 cm LT, 14,0 cm LS) y machos (15,5 cm LT, 12,5 cm LS) son mucho menores que las reportadas para la especie en Brasil por Narahara et al., 1985, quienes afirman a partir de los 17,5 y 16,5 cm LS hembras y machos están potencialmente aptos para su reproducción, y por Nakatani et al., 2001, quienes reportan que la primera maduración sexual ocurre cerca de 16,5 cm LS para hembras y 13,4 cm LS para machos.
Como la talla mínima de captura para el Liso no ha sido establecida aún en el país por la entidad estatal responsable, ni se conocen registros sobre tallas medias de capturas en la cuenca del río Sinú, ni en las cuencas del Atrato, Cauca, San Jorge y Magdalena, solo se cuenta con la información obtenida en este trabajo. Se observa que la talla media de madurez sexual es similar a la talla media de captura para hembras (24,1 cm LT), pero ligeramente mayor en machos (23,6 y 23,3 cm LT) y sexos combinados (24 y 23,8 cm LT). Además, el 66,9, 60,9 y 62,7% de los individuos se capturó por debajo de las citadas tallas medias de madurez sexual, lo que permite inferir que hay una sobrepesca de la especie que amerita medidas de regulación y ordenamiento pesquero por parte de la entidad estatal competente.
En Colombia, Clavijo-Ayala y Arias-Castellanos, 2004, registraron un diámetro promedio de 930,4±25,2 µm para ovocitos recién desovados por inducción hormonal. En Brasil, los diámetros observados para ovocitos recién desovados de la especie en estudio varían entre 1.000-1.300 µm (Gomes et al., 2000), 1.472±48 µm (Sampaio y Sato, 2006) y 796-1.163 µm (Gomiero et al., 2007). Cabe anotar la semejanza de lo estimado en este trabajo (963±71) µm con lo reportado por Clavijo-Ayala y Arias-Castellanos, 2004, Gomes et al., 2000, y Gomiero et al., 2007, a pesar de que los primeros autores realizaron reproducción inducida, y los dos últimos utilizaron muestras obtenidas del medio natural, tal y como se hizo en este estudio.
El tipo de desarrollo gonadal observado en este trabajo concuerda con Narahara, 1983, Gomes et al., 2000, y Esquivel, 2005, quienes registraron un desarrollo gonadal asincrónico por grupos con desove parcial a lo largo de la época de lluvias, y Nakatani et al., 2001, Rissato y Ferreira, 2003, y Gomiero et al., 2007, quienes encontraron desove parcial, con dos picos reproductivos por año, uno en verano y otro en primavera. Otros autores también observaron que su época reproductiva se limita a la primavera y verano (Narahara et al., 1985; Silveira et al., 1985; Gomes et al., 2000; Baldisserotto y Radünz Neto, 2004; Oyakawa et al., 2006). Silva, 1997, y Cassini, 1998, encontraron que en el Alto Uruguay el desove se produce durante todo el año, aunque con mayor intensidad en primavera y especialmente en los afluentes.
La época de desove prolongado ocurre en ambientes relativamente estables; por otro lado, en ambientes en donde la estacionalidad reproductiva es pronunciada ocurren mayores fluctuaciones en la disponibilidad de alimento o en la competencia interespecífica por áreas de desove (Kramer, 1978). Según diferentes autores, dicha época y los picos de desarrollo gonadal pueden variar cada año y de un lugar a otro (Bossemeyer, 1976; Paula-Souza, 1978; Mardini et al., 1981; Rossi y Luchini, 2005).
La fecundidad estimada en este estudio se ubica dentro del promedio ± intervalo de confianza al 95% (34.768±11.142), de acuerdo con los registros de Santos, 2002; Sato et al., 2003; Sampaio y Sato, 2006; Gomiero et al., 2007. Siendo similar a la registrada por Gomiero et al., 2007, para la especie en los ríos Paraibuna y Grande (Brasil), tal y como se presenta en la Tabla 4.
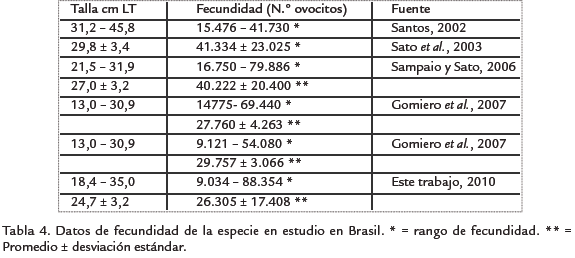
La fecundidad es una adaptación específica a las condiciones variables o cambiantes, especialmente para la mortalidad, que se altera primariamente en respuesta a la oferta de alimento y este es uno de los mecanismos básicos para ajustar la tasa de reproducción a los cambios en las condiciones ambientales, cambios que se reflejan en las diferentes fecundidades entre poblaciones y entre especies (Galvani y Coleman, 1998), las cuales están asociadas –además– al aumento proporcional de la fecundidad debido a los incrementos en longitud y peso de los peces (Lowe-McConnell, 1999).
Además, la fecundidad, la época y el tipo de desove, son características específicas esenciales para el mantenimiento de cualquier tipo de peces (Vazzoler, 1996), por lo que el conocimiento de las tácticas y estrategias de reproducción es un elemento indispensable para orientar las medidas de administración, manejo y preservación de la ictiofauna frente a los impactos causados por las actividades antrópicas como la pesca y la disminución o pérdidas de áreas de desove y crianza de los peces (Vazzoler y Menezes, 1992).
Por todo lo anterior, se concluye que el Liso es un pez que presenta proporción sexual H:M de 1,6:1, tipo de desarrollo ovocitario asincrónico en más de dos lotes, lo que se traduce en desoves parciales con una época o periodo de desove prolongado, talla media de ma-durez sexual de 24 cm LT, con ovocitos de mediano tamaño y alta fecundidad de acuerdo con Musick, 1999, la cual está fuertemente asociada al peso de las gónadas (r=0,94).
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a los pescadores y comercializadores de pescado de la ciénaga Grande de Lorica y de la cuenca baja del río Sinú y a los tesistasinvestigadores involucrados en el proyecto de investigación -Estimación de los parámetros biológicos básicos de peces comerciales del río Sinú–Fase II-, Código FMV-01-04, del cual hace parte este trabajo. A la Universidad de Córdoba, por la financiación recibida. Finalmente, a los tres revisores anónimos por sus comentarios y aportes.
BIBLIOGRAFÍA
ARIAS CJA, AYA BE. Estudios preliminares sobre la piscicultura de Rhamdia sebae c.f. Villavicencio: Memorias II Congreso Colombiano de Acuicultura. Universidad de los Llanos; 2004. p. 15-18. [ Links ]
BALDISSEROTTO B, RADÜNZ NETO J, Editores. Criação de Jundiá. Santa Maria: Editora da Santa Maria, Universidade Federal de Santa Maria; 2004.
[ Links ]BOCKMANN FA, GUAZZELLI GM. Family Heptapteridae (Heptaterids). In: Reis RE, Kullander SO, Ferraris CJ Jr, editors. Checklist of the freshwater fishes of South and Central America. Porto Alegre: Editora da Pontifícia Universidade Católica do Rio Grande do Sul-EDIPUCRS; 2003. p. 406-431.
[ Links ]BOSSEMEYER IMK. Mudanças morfológicas no ovário de Rhamdia sapo (Pimelodidae) relacionadas com o ciclo reprodutivo. (Dissertação Mestrado em Zootecnia). Santa Maria: Universidade Federal de Santa Maria; 1976.
[ Links ]BUSTAMANTE ID. Los suelos de la cuenca del río Sinú y el Proyecto Urrá I. Temas Agrarios 2000;9:15-28.
[ Links ]CASSINI CA. Estrutura da população e distribuição espacial do pintado amarelo, Pimelodus maculatus, do jundiá, Rhamdia quelen e da voga, Schizodon aff. nasutus, no alto rio Uruguai, Brasil. (Dissertação de mestrado). Florianópolis: Universidade Federal de Santa Catarina; 1998.
[ Links ]CLAVIJO-AYALA JA, ARIAS CJA. Desarrollo embrionario de Rhamdia sebae c.f. Villavicencio: Memorias II Congreso Colombiano de Acuicultura. Universidad de los Llanos; 2004. p. 41-42.
[ Links ]DAHL G. Los peces del norte de Colombia. Bogotá: Inderena; 1971.
[ Links ]ESQUIVEL B. Produção do Jundiá (Rhamdia quelen) em áreas de entorno do parque estadual da serra do tabuleiro em Paulo Lopes-SC. (Tese Doutorado em Engenharia de Produção). Florianópolis: Universidade Federal de Santa Catarina; 2005.
[ Links ]GALVANI AP, COLEMAN RM. Do parental convict cichlids of different sizes value the same brood number equally? Anim Behav. 1998;56:541-546.
[ Links ]GOMES LC, GOMES ARC, GOLOMBIESKI JI, BALDISSEROTTO B. Rhamdia quelen (Pimelodidae), espécie promissora para a piscicultura do sul do Brasil-uma revisão. São Carlos: XIII Encontro Brasileiro de Ictiologia; 1999.
[ Links ]GOMES LC, GOLOMBIESKI JI, GOMES ARC, BALDISSEROTO B. Biologia do jundiá Rhamdia quelen (Telostei, Pimelodidae). Ciência Rural 2000;30(1):179-185.
[ Links ]GOMIERO LM, SOUZA UP, BRAGA FMS. Reprodução e alimentação de Rhamdia quelen (Quoy & Gaimard, 1824) em rios do Núcleo Santa Virgínia, Parque Estadual da Serra do Mar, São Paulo, SP. Biota Neotropica. 2007;7(3):127-133.
[ Links ]HOLDEN MJ, RAITT DFS. Manual de ciencias pesqueras. Parte 2. Métodos para investigar los recursos y su aplicación. FAO Doc Téc Pesca. 1975;115:1-211.
[ Links ]IDEAM. Base de datos. Barranquilla: IDEAM; 1998.
[ Links ]KRAMER DL. Reproductive seasonality in the fishes of a tropical stream. Ecology. 1978;59(5):976-985.
[ Links ]LAEVASTU T. Manual de métodos de biología pesquera. Zaragoza: Editorial Acribia; 1980.
[ Links ]LOWE-MCCONNELL RH, editor. Estudos ecológicos de comunidades de peixes tropicais. São Paulo: EDUSP; 1999.
[ Links ]MACHADO-FRACALOSSI D, MEYER G, SANTAMARIA FM, WEINGARTNER M, ZANIBONI FE. Desempenho do jundiá, Rhamdia quelen, e do dourado, Salminus brasiliensis, em viveiros de terra na região sul do Brasil. Acta Sci Ani Sci. 2004;26(3):345-352.
[ Links ]MARDINI CV, SILVEIRA MA, BARENHO DHL. Técnica de indução da desova em jundiá (Rhamdia quelen) empregada na Estação Experimental de Piscicultura da Lagoa dos Quadros. Secretaria da Agricultura do Rio Grande do Sul, Porto Alegre. Documento ocasional. 4;1981:1-14.
[ Links ]MILES C. Peces del río Magdalena. Bogotá: Sección de Piscicultura, Pesca y Caza, Ministerio de Economía Nacional; 1947.
[ Links ]MUSICK JA. Criteria to define extinction risk in marine fishes. Fisheries. 1999;24:6-14.
[ Links ]NAKATANI K, AGOSTINHO AA, BAUMGARTNER G, BIALETZKI A, SANCHES PV, et al. Ovos e larvas de peixes de água doce: desenvolvimento e manual de identificação. Maringá: Editora da Universidade Estadual de Maringá-EDUEM; 2001.
[ Links ]NARAHARA MY. Estructura de população e reprodução de Rhamdia hilarii (Valenciennes, 1840), (Osteichthyes, Siluriformes, Pimelodidae). (Tese de Doutorado). São Paulo: Universidade de São Paulo; 1983.
[ Links ]NARAHARA MY, GODINHO HM, ROMAGOSA E. Estrutura da população de Rhamdia hilarii (Valenciennes, 1840) (Osteichthyes, Siluriformes, Pimelodidae). Bol Inst Pesca. 1985;12(3):123-137.
[ Links ]OLAYA-NIETO CW, SEGURA-GUEVARA FF, TORDECILLA-PETRO G, APPELDOORN RS. Estimación de los parámetros biológicos básicos de peces comerciales del río Sinú-Fase II. (Informe final). Lorica: Laboratorio de Investigación Biológico Pesquera-LIBP, Programa de Acuicultura, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba; 2007.
[ Links ]ORTEGA-LARA A, AGUIÑO A, SÁNCHEZ GC. Caracterización de la ictiofauna nativa de los principales ríos de la cuenca alta del río Cauca en el departamento del Cauca. Informe presentado a la Corporación Autónoma Regional del Cauca, CRC. Popayán: Fundación para la Investigación y el Desarrollo Sostenible-Funindes; 2002.
[ Links ]OYAKAWA OT, AKAMA A, MAUTARI KC, NOLASCO JC. Peixes de riachos da Mata Atlântica. São Paulo: Editora Neotropica; 2006.
[ Links ]PACHECO L, OCHOA J. Hábitos alimenticios del Liso (Rhamdia quelen Quoy & Gaimard, 1824) en el Bajo río Sinú, Colombia. (Trabajo de pregrado). Lorica: Programa de Acuicultura, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba; 2008.
[ Links ]PAULA-SOUZA G. Reprodução de Rhamdia branneri (Pisces, Siluriformes) e suas relações com fatores abióticos. (Dissertação Mestrado em Zoologia). Curitiba: Universidade Federal do Paraná; 1978.
[ Links ]PEREIRA CR, BARCELLOS LJG, KREUTZ LC, QUEVEDO RM, RITTER F, SILVA LB. Embryonic and larval development of jundiá (Rhamdia quelen, Quoy & Gaimard, 1824, Pisces, Teleostei), a South American catfish. Braz J Biol. 2006;66(4):1057-1063.
[ Links ]RISSATO FV, FERREIRA LI. Estudo do ciclo reprodutivo de Rhamdia quelen no reservatório de Juqueri, na barragem Engenheiro Paulo de Paiva Castro. Campinas: Resumos VIII Encontro de Iniciação Científica da Pontifícia Universidade Católica de Campinas; 2003.
[ Links ]ROSSI F, LUCHINI L. Tecnologías para cultivo del -Randia- (Rhamdia quelen) para fomento de su producción comercial, en clima templado a templado-calido. Santa Ana: Centro Nacional de Desarrollo Acuícola (CENADAC), Dirección de Acuicultura Argentina; 2005.
[ Links ]SAMPAIO EV, SATO Y. Biologia reprodutiva e desova induzida de duas espécies de bagre (Osteichthyes: Siluriformes) da bacia do rio São Francisco. Acta Sci Biol Sci. 2006;28(3):263-268.
[ Links ]SANTOS GO. Fecundidade do jundiá, Rhamdia quelen (Quoy & Gaimard, 1824) parasitados por Argulus sp. em tanques de terra (Teleostei: Pimelodidae). Comum Mus Ciênc Tecnol Ser Zool. 2002;15(1):113-136.
[ Links ]SATO Y. Reprodução de peixes da bacia do rio São Francisco: indução e caracterização de padrões. (Tese Doutorado em Ecologia e Recursos Naturais). São Carlos: Universidade Federal de São Carlos; 1999.
[ Links ]SATO Y, FENERICH-VERANI N, NUÑER APO, GODINHO, VERANI JR. Padrões reprodutivos de peixes da bacia do São Francisco. In: Godinho HP, Godinho AL, editores. Águas, peixes e pescadores do São Francisco das Minas Gerais. Belo Horizonte: Pontifícia Universidade Católica de Minas Gerais; 2003. p. 229-274.
[ Links ]SILFVERGRIP AMC. A systematic revision of the Neotropical catfish genus Rhamdia (Teleostei, Pimelodidae). Stockholm: Swedish Museum of Natural History; 1996.
[ Links ]SILVA EB. Ciclo reprodutivo e histologia gonadal do jundiá, Rhamdia quelen na região do alto rio Uruguai. (Monografia de conclusão do curso de biologia). Florianópolis: Universidade Federal de Santa Catarina; 1997.
[ Links ]SILVEIRA WF, KAVAMOTO ET, NARAHARA MY. Avaliação da qualidade e criopreservação em forma de -pellets- do sêmen do bagre, Rhamdia hilarii (Valenciennes, 1840). Bol Inst Pesca. 1985;12(4):7-11.
[ Links ]SPARRE P, VENEMA SC. Introducción a la evaluación de recursos pesqueros tropicales. Parte 1. Manual. FAO Doc Téc Pesca. 1995; 306/1(rev.1):1-420.
[ Links ]SUZUKI HI. Estratégias reprodutivas de peixes relacionadas ao sucesso na colonização em dois reservatórios do rio Iguaçu, PR, Brasil. (Tese Doutorado em Ecologia e Recursos Naturais). São Carlos: Universidade Federal de São Carlos; 1998.
[ Links ]TRESIERRA AE, CULQUICHICÓN ZG. Biología pesquera. Trujillo: Concytec. 1993.
[ Links ]VAZZOLER AEA DE M. Diversificação fisiológica e morfológica de Micropogonias furnieri (Desmarest, 1822) ao sul do Cabo Frio, Brasil. Bol Inst Oceanogr. 1971;20(2):1-20.
[ Links ]Acta biol. Colomb., Vol. 15 N.º 3, 2010 73
VAZZOLER AEA DE M. Biología da reproduçâo de peixes teleósteos: teoría e práctica. São Paulo: Editora da Universidade Estadual de Maringá-EDUEM; 1996.
[ Links ]VAZZOLER AEA DE M, MENEZES NA. Síntese de conhecimentos sobre o comportamento reprodutivo dos Characiformes da América do Sul (Teleostei, Ostariophysi). Rev Brasil Biol. 1992;52(4):627-640.
[ Links ]VAZZOLER AEA DE M, CARACIOLO-MALTA MC, AMADIO SA. Aspectos biológicos de Peixes amazônicos. XII. Indicadores quantitativos do período de desova das espécies da gênero Semaprochilodus (Characiformes, Prochilodontidae) do baixo rio Negro, Amazonas, Brasil. Rev Brasil Biol. 1989;49(1):175-181.
[ Links ]WENNER AM. Sex ratio as a function of size in marine crustacea. Amer Not. 1972;186:321-351.
[ Links ]ZAR JH. Biostatistical analysis. New Jersey: Prentice Hall Inc; 1996.
[ Links ]













