Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.15 n.3 Bogotá set./dez. 2010
APLICACIÓN DE SALES DE TETRAZOLIO DE NUEVA GENERACIÓN (XTT) PARA LA ESTIMACIÓN DE LA DENSIDAD DE MICROORGANISMOS DEGRADADORES DE HIDROCARBUROS EMPLEANDO LA TÉCNICA DEL NÚMERO MÁS PROBABLE
Application of the New Generation Tetrazolium Salt (XTT) for the Enumeration of Hydrocarbon Degrading Microorganisms Using the Most Probable Number Method
VICTORIA EUGENIA VALLEJO1,2, M.Sc.; HABIB YANINE1, FABIO AUGUSTO ROLDÁN.1 Ph. D.
1Centro de Investigaciones y Estudios en Biodiversidad y Recursos Genéticos – CIEBREG. Laboratorio de Unidad de Saneamiento y Biotecnología Ambiental – USBA, Facultad de Ciencias. Pontificia Universidad Javeriana. Carrera 7 # 43-82, Bogotá D.C., Colombia. 2Correspondencia: vvallejo@javeriana.edu.co
Presentado 6 de agosto de 2009, aceptado 28 de enero de 2010, correcciones 1 de septiembre de 2010.
RESUMEN
El presente estudio evaluó el desempeño de dos sales de tetrazolio, una tradicional: INT y una de nueva generación: XTT, para estimar la densidad de microorganismos degradadores de hidrocarburos (HCs) en suelos empleando la técnica del Número Más Probable (NMP). Se analizaron 96 muestras de suelo provenientes de la Ecorregión Cafetera de Colombia. Los microorganismos fueron recuperados en agar mínimo de sales en atmósfera saturada de HCs y la capacidad degradadora fue confirmada por repiques sucesivos utilizando diesel como fuente de carbono. No se observaron diferencias significativas en los recuentos de microorganismos degradadores obtenidos con las dos sales (t de Student, p < 0,05), pero el XTT permitió mejor visualización de los pozos positivos dada la solubilidad del producto reducido, mientras que el INT produjo precipitación, debido al formazán insoluble generado, dificultando su lectura. Se obtuvo un mayor porcentaje de aislamientos empleando XTT (67%), lo cual podría indicar que el tipo de sal es determinante en la viabilidad de estas bacterias. Adicionalmente, se evaluó el límite de detección celular, las condiciones óptimas de concentración de XTT y el tiempo de incubación necesario para la detección de actividad degradadora utilizando la cepa Acinetobacter sp. El aumento en la concentración de XTT de 0,5 mM a 2 mM y el tiempo de incubación tuvieron un efecto inhibitorio y favorable respectivamente, en la recuperación de células viables, adicionalmente, límite de detección de la técnica fue de 102 UFC/ml.
Palabras clave: INT, XTT, NMP, microorganismos degradadores de hidrocarburos, sales de tetrazolio.
ABSTRACT
The objective of this study was to evaluate the performance of two tetrazolium indicators: a traditional one: INT and a new generation one: XTT, for the estimation of hydrocarbon (HC) degrading microorganism s density using the Most Probable Number Technique (MPN). Ninety six composite soil samples were taken and analyzed from Ecorregión Cafetera Colombiana. Degrading microorganisms were recovered in minimum salt medium with saturated HC atmosphere. Degrading HC capacity of the microorganisms was confirmed by successive subcultures in the same medium using diesel as only carbon source. Counts obtained with the two salts were not significantly different (Student t test, p < 0,05) but XTT allowed an easier visualization of positive wells due to product solubility of the reduce product. A greater percentage of isolates was obtained using XTT (67%), which suggests that salt type is relevant for recovering of these microorganisms. Additionally, cell detection limit, optimal conditions of XTT concentration and incubation times for detection of activity were evaluated. This evaluation was performed by means of microplate format for hydrocarbon degrading microorganisms using Acinetobacter sp. An inhibitory effect was observed in the recovering of cultivable cells when XTT concentrations increased from 0,5 mM to 2 mM. Incubation time favored this recovering. Detection limit of this technique was established at 102 UFC/ml. Production of the XTT-formazan was positively related with initial cell concentration and negatively with incubation time.
Key words: INT, XTT, MPN, hydrocarbon degrading microorganisms, tetrazolium salts.
INTRODUCCIÓN
La biorremediación es el proceso en el cual se emplean organismos para resolver problemas de contaminación ambiental, tales como la presencia de hidrocarburos totales de petróleo (TPHs) en ecosistemas marinos y terrestres. Este proceso se basa en la biodegradación, que es el fenómeno mediante el cual contaminantes como los hidrocarburos (HCs) se mineralizan hasta CO2 y agua al ser utilizados por los microorganismos como fuente de carbono y energía (Hamme et al., 2003).
La estructura y composición de las comunidades microbianas presentes en ambientes naturales son las que determinan la velocidad a la cual se puede llevar a cabo el proceso de biodegradación (Gaskin y Bentham, 2005). Es por esto, que la estimación de la densidad bacteriana ha sido importante para describir, caracterizar y comparar la diversidad de comunidades bacterianas capaces de degradar diferentes tipos de HCs en distintos ambientes (Maila et al., 2006). La identificación de estos microorganismos ha sido relevante en biotecnología debido a su posible aplicación en el desarrollo de estrategias de biorremediación como la bioaumentación.
Uno de los métodos más empleados en el monitoreo de los procesos de biorremediación de TPHs es la cuantificación de estas bacterias degradadoras de HCs. Numerosos estudios han utilizado la técnica de Número Más Probable (NMP) para estimar la densidad de microorganismos degradadores de HCs en sedimentos y muestras de suelo (Brown y Braddock, 1990; Roldán, 2002; Maldonado, 2004, Vallejo et al., 2005; Gaskin y Bentham, 2005). Esta técnica se convierte en un procedimiento alternativo al método de recuento en placa para la determinación de microorganismos viables. Con la técnica del NMP se han comparado el so de diferentes fuentes de HCs (p.e., kerosene, diesel, hidrocarburos policíclicos aromáticos-PAHs y crudo) en placas de 24, 60 y 96 pozos. Adicionalmente, se han empleado diferentes formas para visualizar la actividad metabólica de los microorganismos, como C14 radioactivo, pruebas de reducción con sales de tetrazolio o simplemente la aparición de turbidez en las diluciones (Wrenn y Venosa, 1996 y Haines et al., 1996).
Las sales de tetrazolio permiten medir la actividad respiratoria asociada a la cadena transportadora de electrones. Estas sales presentan la ventaja de ser reducidas por la mayoría de los sistemas de deshidrogenasas, y de requerir cortos periodos de tiempo para su reducción y consecuente cambio de color (Gabrielson et al., 2002). Una de las sales más empleadas en estudios de biorremediación ha sido el INT (2-(4-iodofenil)-3-(4-dinitrofenil)-5-feniltetrazolio cloruro), que facilita la visualización de la actividad microbiana a pesar de utilizar sustratos insolubles como los HCs. El INT compite con el O2 en la cadena transportadora de electrones y en su forma reducida (INT-formazán) genera un precipitado rosado-rojo (Haines et al., 1996; Wrenn y Venosa, 1996). Sin embargo, el empleo de esta sal ha generado inconvenientes relacionados con la interpretación de los resultados, debido principalmente a la generación de formazán insoluble, lo cual podría subestimar la actividad del sistema transportador de electrones o causar un aumento en la lisis de las células bacterianas debido a un excesivo depósito de cristales intracelulares. Por esta razón se han desarrollado sales solubles o también llamadas de nueva generación como el XTT (2,3-bis(2-metoxi-4-nitro-5-sulfofenil)-2H-tetrazolio-5-carboxanilida), MTS y WST-1 (McCluskey et al., 2005).
Las sales solubles incorporan en sus estructuras grupos sulfonatos, por lo cual el formazán que se genera es soluble en agua y se difunde fácilmente en las células facilitando su cuantificación y visualización (Bensaid et al., 2000). Las investigaciones realizadas con este tipo de sales se han enfocado en su empleo como posibles indicadores de viabilidad/proliferación y/o ensayos de citotoxicidad en células eucariotas (Goodwinet al., 1995 y Berridge et al., 1996). Otros estudios se han enfocado en determinar la concentración óptima o concentración a la cual no se generan efectos tóxicos en algunos procariotas, y en evaluar la actividad respiratoria de microorganismos como Pseudomonas putida, Escherichia coli, Bacillus subtilis y Pseudomonas fluorescens en lodos activados y aguas subterráneas (Roslev y King, 1993; Hatzinger et al., 2003 y McCluskey et al., 2005).
A pesar de las numerosas ventajas que presentan las sales de tetrazolio para la evaluación de actividad metabólica son escasos los estudios no solo en Colombia si no también a nivel mundial que han comparado la efectividad del uso de sales solubles e insolubles para la estimación de la densidad de microorganismos degradadores de hidrocarburos empleando técnicas como el NMP. El objetivo del presente estudio fue comparar el desempeño de dos sales de tetrazolio para la estimación de la densidad de microorganismos degradadores de HCs en suelos provenientes de la Ecorregión Cafetera, teniendo en cuenta criterios operativos y la viabilidad de los microorganismos. El presente estudio proporciona una oportunidad única de evaluar y estandarizar la técnica del NMP empleando una sal de nueva generación (XTT), y de compararla con una sal tradicional (INT), la cual ha sido empleada en numerosos estudios de biorremediación, para determinar actividad microbiana activa de microorganismos degradadores de HCs. Es así, como se determinó cuál de las sales permitían recuperar una mayor densidad de bacterias degradadoras, lo cual es fundamental en el desarrollo y estandarización de técnicas dependientes de cultivo. Estos resultados permitirán el empleo del NMP en posteriores estudios de diversidad de este grupo funcional, el cual, además de cumplir un papel fundamental en el ciclaje de carbono, puede ser utilizado en posteriores estudios biotecnológicos.
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
El estudio se realizó en la Ecorregión Cafetera de Colombia en los departamentos de Valle, Risaralda y Quindío. Se tomaron como unidades macro del muestreo las dos ventanas correspondientes a la cuenca del río La Vieja y Otún en dicha Ecorregión. Estas ventanas fueron seleccionadas con criterios de heterogeneidad espacial, gradiente altitudinal y estructuras de paisaje de acuerdo a estudios previos realizados por el CIEBREG (Centro de Investigaciones y Estudios en Biodiversidad y Recursos Genéticos). Una vez definidas las ventanas, se tomaron como siguiente nivel de muestreo los sistemas productivos que correspondían a conjuntos de propiedades que reflejan un tipo particular de aprovechamiento y/o uso del suelo. En cada sistema productivo se identificaron las coberturas vegetales (bosque secundario, guadual, cultivo de café asociado a plátano, monocultivo de cebolla, pastizal para ganadería y plantaciones forestales) más representativas y con al menos diez años de establecimiento Las muestras de suelo fueron colectadas en 16 fincas, ocho en cada cuenca hidrográfica.
TOMA DE MUESTRA
En cada una de las coberturas de las dos cuencas se delimitaron tres cuadrantes representativos (2,5 m x 2,5 m), ubicados al menos a 30 m de los bordes de la cobertura. En cada cuadrante se tomaron cinco submuestras (vértices y centro) para formar una muestra compuesta (~15 cm de profundidad) utilizando un barreno de torsión. Se tomaron 500 g de muestra, las cuales se depositaron en bolsas whirlpack resellables, estériles, debidamente rotuladas (fecha, hora, tipo de cobertura, nombre de la finca y número de cuadrante) y se conservaron en refrigeración a 4 °C hasta su análisis. Se realizó un evento de muestreo en junio y otro en septiembre de 2006, tomándose en total 96 muestras compuestas de suelo.
EXTRACCION DE LOS MICROORGANISMOS DEL SUELO
Se diluyeron 10 g de suelo en 90 ml de solución salina estéril previamente filtrada por una membrana de acetato de celulosa de 0,22 µm. La mezcla fue agitada durante 15 min a 160 rpm en una plataforma de agitación orbital (LaTorre, 2007). A partir de esta dilución se realizaron diluciones seriadas con base 10 hasta 10-6, las cuales serían empleadas posteriormente en la técnica de NMP.
TÉCNICA DEL NMP (INT/XTT) PARA MICROORGANISMOS DEGRADADORES DE HCS
El recuento de microorganismos degradadores de HCs se realizó mediante el método de NMP en placas de 96 pozos, empleando los indicadores INT y XTT (Polysciences, Warrington PA) (Hainnes et al., 1996; Wrenn y Venosa, 1996., Roslev y King, 1993; Hatzinguer et al., 2003 y McCluskey et al., 2005). El medio empleado para el desarrollo de la técnica fue Bushnell-Haas (BH) (KH2PO4(0,01%), K2HPO4 (0.01%), FeCl3.H2O (0,005%), NH4NO3(0,01%), CaCl2 (0,002%), MgSO4.7H2O(0,02%)), 5µl de diesel comercial previamente filtrado como fuente única de carbono y 20 µl de cada dilución del suelo; se realizaron cinco repeticiones por dilución. Después de incubación por 15 días a 22±1,2 ºC se añadieron los dos indicadores (50 µl de cada uno) preparados a las siguientes concentraciones: INT: 5,9 mM y XTT: 2 mM. Las placas fueron incubadas a 22±3 °C en agitación orbital a 150 rpm y protegidas de la luz durante 16 a 18 h, condiciones que incrementan la generación de formazán y la solubilidad de esta sal (Hatzinger et al., 2003; McCluskey et al., 2005). Después de este tiempo los pozos que mostraron coloración rosado-rojo (INT) y naranja (XTT) fueron considerados como positivos. Una combinación de pozos positivos/negativos de las cinco diluciones realizadas se analizó en el programa Most Probable Number Calculator (EPA v4.04, 1996). Los resultados fueron expresados como NMP/gps.
AISLAMIENTO Y RECUPERACIÓN DE BACTERIAS DEGRADADORAS DE HCS
Las bacterias degradadoras fueron aisladas de los pozos positivos de las diluciones más altas obtenidas con el NMP (Wrenn y Venosa, 1996; Margesin et al., 2003). Para su recuperación se realizó siembra por agotamiento en agar BH (descrito anteriormente, con 1% de agar bacteriológico 1%). Con el objetivo de simular una atmósfera de HC’s se colocaron discos de papel Whatman N.º 40 impregnados con diesel (20µL) en la tapa de la caja de Petri y se incubaron las cajas a temperatura ambiente por cinco días. Para confirmar que las cepas seleccionadas poseían la capacidad de degradar los HC’s, se hicieron pases sucesivos cuatro veces bajo las mismas condiciones. Esta prueba se realizó para evitar contaminación cruzada con compuestos orgánicos. Finalmente las cepas fueron caracterizadas macro y microscópicamente.
TIEMPO DE REDUCCIÓN A FORMAZÁN CON XTT
La generación de formazán soluble fue monitoreada durante 24 h por medio de la producción de color (naranja) haciendo uso de un espectrofotómetro para placas Multiskan MCC/340 (Versión 2.33) a 492 nm. Durante este periodo se realizaron mediciones espectrofotométricas cada dos horas.
EFECTO DE LA CONCENTRACIÓN DE XTT, CONCENTRACIÓN CELULAR Y TIEMPO DE INCUBACIÓN
Debido a que algunos autores han reportado la toxicidad celular de las sales de tetrazolio (Bensaid, et al., 2000, McCluskey et al., 2005) es necesario determinar, además de la concentración óptima de XTT, el tiempo de incubación que permita una mayor recuperación de organismos degradadores así como la concentración mínima de células a la cual pueda ser detectada actividad (límite de detección) cuando se utiliza esta sal para el recuento de NMP en placas de 96 pozos.
Para ello se realizó un montaje en microplacas de 96 pozos (esterilizadas con luz UV por una hora) y se adicionaron 20 µl de dilución de células de la cepa Acinetobacter sp., PUJ-M-Bio-USBA-98 y 50 µl de XTT. Para el ensayo se definió un diseño factorial de tres factores (concentración de XTT, concentración de Unidades formadoras de colonia y tiempo de incubación), con cuatro niveles por factor. Las diluciones de células evaluadas fueron 1x102, 1x103, 1x104 y 1x105 UFC/ml, equivalentes a 2, 20, 200 y 2.000 UFC/ pozo respectivamente (determinadas mediante una curva de calibración que relacionaba absorbancia del cultivo y UFC/ml); las concentraciones de XTT evaluadas fueron 0,5, 1, 1,5 y 2 mM. Como control se mantuvieron las mismas condiciones anteriores excepto la adición de células. Las microplacas fueron selladas con papel Press’n Seal para minimizar la volatilización del diesel y protegidas de la luz. Para maximizar la formación de XTT-formazán las microplacas fueron puestas en agitación a 130 rpm a 27±2 ºC durante 12, 14, 16 y 18 h. Cumplido cada periodo de incubación se retiró una microplaca y se midió la absorbancia de los pozos en lector Multiskan MCC/340 a 492 nm. Se estableció como punto de corte para las lecturas positivas el valor promedio más siete desviaciones estándar de las lecturas de absorbancia de los controles; se tomaron como positivas todas las lecturas superiores a este valor. Para evaluar la recuperación de microorganismos degradadores se realizó en forma paralela una siembra en superficie en agar nutritivo (AN) de las diluciones mas altas correspondientes a la concentración celular 1x103UFC/ml, posteriormente, las cajas fueron incubadas a 22±1.2 ºC por 24h.
ANÁLISIS ESTADÍSTICO
El ajuste de los datos a una distribución normal se determinó por medio de la prueba de de bondad de ajuste de Shapiro-Wilk (p<0.05) empleando el paquete estadístico Statistix 8 (2003). Los datos fueron transformados cuando fue necesario empleando logaritmo con base 10. Se realizaron pruebas de hipótesis de igualdad de medias utilizando análisis de varianza (ANAVA) por medio del paquete estadístico SPSS 10.05 y pruebas de comparación de pares de medias utilizando la prueba t de Student. Con el fin de validar la inspección visual como medio para determinar los pozos positivos para actividad microbiana los resultados de la inspección visual se compararon con los de espectrofotometría mediante la prueba de concordancia Kappa. La relación entre la producción de formazán y las concentraciones iniciales de XTT y UFC/ml se determinó por medio de una correlación lineal con la prueba Rho de Spearman. Todos los ensayos fueron realizados al menos por triplicado. El nivel de confianza para todas las pruebas fue del 95% (α=0,05).
RESULTADOS Y DISCUSIÓN
COMPARACIÓN DE LAS DOS SALES DE TETRAZOLIO
Debido a que no se observaron diferencias significativas entre los recuentos de degradadores para las diferentes coberturas vegetales evaluadas, así como no se observaron diferencias de acuerdo al evento de muestreo utilizando las dos sales de tetrazolio, se muestra la Figura 1 como un promedio de las 96 muestras de suelo (t Student, p < 0,05; n=96). Estos resultados podrían indicar que cualquiera de las dos sales puede ser empleada para la determinación de la densidad de degradadores. Sin embargo, como se observa en la Figura 2 la precipitación de la sal en los pozos con el INT muchas veces impidió realizar lecturas adecuadas, las cuales estuvieron más sujetas a error y dependieron del criterio de cada investigador a la hora de tomar un pozo como positivo o negativo. Para el caso del XTT el color fue siempre uniforme proporcionando resultados más precisos y confiables.
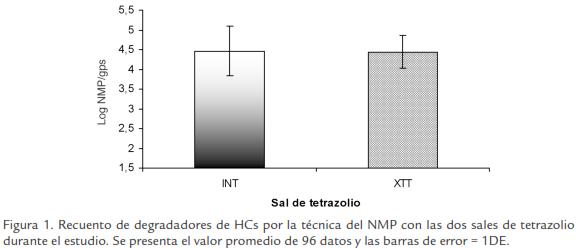
Por esta razón, la comparación de las dos se realizó con base en criterios operativos como facilidad de preparación de la sal y visualización, costos, uniformidad de color generado, porcentaje de recuperación de bacterias y rapidez en la reducción de la sal.
El empleo de estos indicadores permite establecer el uso de las tasas de respiración como una medida óptima para determinar la actividad microbiana y como indicador de la actividad del sistema transportador de electrones (McCluskey et al., 2005). El uso de indicadores como el INT presenta el inconveniente de generar productos de formazán insolubles, lo cual requiere la adición de solventes orgánicos para su disolución y/o extracción. Además, la acumulación de depósitos de formazán intracelular durante el análisis puede afectar y/o alterar la actividad celular (Roslev y King, 1993). Estudios recientes han demostrado la toxicidad de las sales de tetrazolio en la recuperación de bacterias viables (Hatzinger et al., 2003); por esta razón es importante evaluar y comparar distintas concentraciones para minimizar el efecto tóxico durante los ensayos (Margesin et al., 2000).
El INT ha sido ampliamente empleado como indicador de microorganismos viables en previos estudios en nuestro laboratorio (Vallejo et al., 2004) debido principalmente a que requiere de cortos periodos de incubación (entre 18-24 h) para su visualización en relación a otras sales insolubles como el CTC, evitando además, el empleo de sustratos radiactivos. Sin embargo, presenta algunas desventajas, observadas en este estudio como por ejemplo: después de 20 horas de incubación con la sal se observó la formación de un precipitado de color rojo insoluble, que dificulta la visualización e interpretación de los pozos positivos. A diferencia del precipitado coloreado que se forma con el INT, el XTT generó una sal soluble de color naranja uniforme, que sólo varía en intensidad. Esto facilitó el registro del número de pozos positivos/negativos en la placa.
La reducción biológica del XTT ha sido previamente correlacionada con la actividad de la cadena transportadora de electrones. Algunos autores han demostrado que el XTT provee información directa acerca de esta actividad después de 90 min de incubación (Bensaid et al., 2005). Se ha establecido que la producción de formazán es dependiente de la tasa de crecimiento del cultivo bacteriano y que es altamente sensible a factores como temperatura y tiempo de incubación, pH del medio, tipo de microorganismo y concentración de la sal. A pHs bajos (< 5) se inhibe la reducción de INT a la correspondiente sal de formazán. Por lo tanto es importante considerar cada una de estas variables cuando se emplean estas sales como indicadoras de la actividad respiratoria de una comunidad bacteriana particular (Roslev y King, 1993; Griebe et al., 1997).
TIEMPO DE REDUCCIÓN DEL XTT A FORMAZÁN SOLUBLE
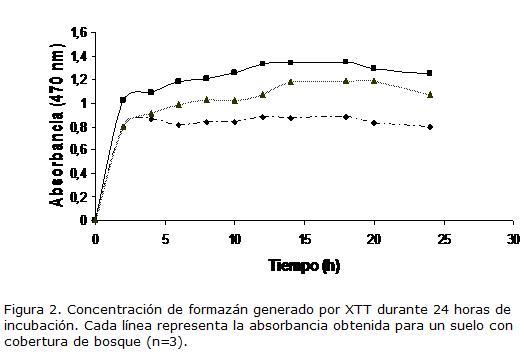
Durante el monitoreo de la reducción de XTT durante 24 h, se determinó que después de 15 h de incubación la concentración de formazán se estabiliza, es decir que el empleo de sales de nueva generación permitieron la visualización óptima del producto en un tiempo inferior que el INT o CTC. Los resultados permiten sugerir 12-18 horas como tiempo óptimo de incubación empleando este tipo de indicador (Fig. 3). Es importante resaltar que este análisis fue independiente del tipo de suelo o cobertura analizada pues aunque se muestra solo una grafica para la cobertura de bosque, el análisis fue hecho para guadal y pastizal observándose la misma tendencia de estabilización después de 12 horas (datos no mostrados).
AISLAMIENTO Y RECUPERACIÓN DE BACTERIAS DEGRADADORAS DE HCS
A pesar de la toxicidad que han demostrado tener ciertas sales de tetrazolio sobre algunos grupos particulares de microorganismos, en el presente estudio se aislaron 173 cepas degradadoras. Sin embargo, 113 de las cepas fueron aisladas con XTT y 60 con INT, lo cual indica que el tipo de sal podría ser determinante en la recuperación de algunos tipos de bacterias y concuerda con lo observado por Hatzinguer et al. (2003), quien reportó que el XTT fue reducido por el 91% de los aislamientos usados para evaluar viabilidad celular y no presentó toxicidad. La mayor cantidad de bacterias aisladas de las coberturas vegetales evaluadas corresponde a bacterias Gram positivas (62%). Algunos autores han reportado que los géneros más representativos de este tipo de bacterias degradadoras corresponden a Rhodococcus sp., Arthrobacter sp., Staphylococcus sp., Micrococcus sp., Corynebacterium sp. y Actinomicetes sp. Estas bacterias han demostrado tener una alta capacidad degradadora, incluyendo compuestos de difícil degradación como los PAH (hidrocarburos policíclicos aromáticos) (Gaskin y Bentham, 2005; La Rosa et al., 2006).
EFECTO DE LA CONCENTRACIÓN DE XTT, CONCENTRACIÓN CELULAR Y TIEMPO DE INCUBACIÓN
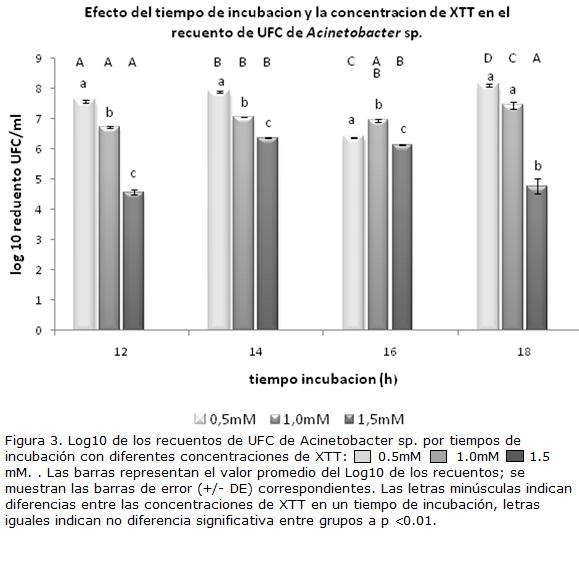
Con base en los resultados iniciales de recuento con XTT mediante la técnica de NMP se decidió evaluar el efecto de factores como la concentración de XTT, el tiempo de incubación y los límites de detección de la técnica en la recuperación de bacterias degradadoras de HCs. Como se observa en la Figura 3, existe una tendencia a la obtención de menores recuentos (UFC/ml) de Acinetobacter sp. a medida que aumenta la concentración de XTT. Estas concentraciones resultaron ser significativamente diferentes para cada uno de los tiempos de incubación (ANAVA, p<0,05, n=24). Es importante mencionar que en la Figura 4 y la Tabla 2 no se incluyeron los resultados para 2 mM de XTT dado que, aunque presentaban valores de absorbancia, mostraron recuentos de UFC/ml por debajo del nivel de detección cuando se hizo la siembra a partir de los pozos con 1x10 3 UFC/ml.
Aunque estos resultados pueden indicar un efecto citotóxico de la concentración y el tiempo de incubación con XTT, los datos presentados aquí no pueden ser concluyentes ya que no se incluyó un control de recuperación (sin adición de XTT como sugiere Hatzinguer et al., 2003). Efectos inhibitorios similares son reportados por Roslev y King (1993), y Bensaid et al. (2000) pero a concentraciones de XTT superiores a 8 mM y 3 mM respectivamente, límites que pueden ser dependientes del tipo de organismo evaluado. Debemos aclarar que, dado que se tuvieron en cuenta las UFC y no la biomasa, se puede generar una inadecuada estimación en los conteos e inconsistencias en los resultados de producción de formazán.
Una fuente de error importante al realizar la técnica de recuento NMP en en placas de 96 pozos, es la inspección visual de los pozos como positivos o negativos debido a la subjetividad inherente a este proceso. Según la Tabla 1, en que se muestran los índices de concordancia Kappa, a las 12 h de incubación hay una consistencia entre los valores observados por inspección visual y los que se obtienen a partir de la absorbancia. El hecho de que esta consistencia disminuya a niveles inaceptables al aumentar el tiempo de incubación puede indicar que con el tiempo, pequeños cambios detectados por el espectrofotómetro no son detectables visualmente.
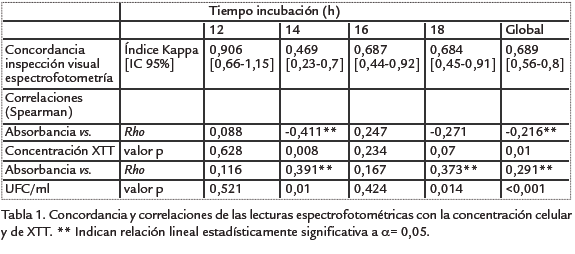
Otro aspecto importante a tener en cuenta es que los valores promedio de las absorbancias fueron menores a la unidad (1,0) en todas las absorbancias (Tabla 2), lo cual indica que los tiempos de incubación evaluados en este estudio son aceptables para la interpretación de resultados, aunque sean inferiores a los tiempos de incubación reportados por Roslev y King, 1993, y McCluskey et al., 2005. Sin embargo, estos investigadores utilizaron agentes acopladores de electrones como la fenazina metosulfato, que incrementa en ocho veces la tasa de reducción de las sales de tetrazolio.
Se observaron diferencias entre la cantidad de XTT-formazán producido con distintas concentraciones iniciales de células (Tukey p=0,005, n=142), (Tabla 2) y una relación lineal directa entre estos factores (Rho de Spearman, Rho=0,291, p< 0,005, n=142), (Tabla 1) lo que concuerda con la relación entre biomasa y producción de formazán reportada por Roslev y King (1993) y McCluskey et al. (2005). Sin embargo, estos factores no presentan un grado de relación tan alto como el reportado por estos autores, debido posiblemente a que en nuestro estudio solamente se tuvieron en cuenta las células viables formadoras de colonia y no el peso seco (biomasa), que puede contener también membranas de células no viables o muertas capaces de reducir la sal de tetrazolio. Se observaron también diferencias en los valores de absorbancia entre concentraciones de XTT (Kruskall-Wallis, p=0.003, n=142), y una relación lineal negativa entre la absorbancia y la concentración de XTT (Rho de Spearman, Rho=-0,216, p=0,05, n=142) (Tabla 1). Esta relación podría indicar en parte los efectos inhibitorios observados por la sal, en contraposición a lo reportado por Roslev y King (1993), MacCluskey et al. (2005) y Hatzinger et al. (2003), quienes encontraron una relación lineal positiva entre concentraciones de 0,5 mM y 3 mM, y de orden cero a concentraciones superiores a 5 mM.
Como se observa en la Tabla 2 la absorbancia promedio para concentraciones bajas de XTT y UFC/ml es muy similar y en algunos casos superior a las obtenidas a concentraciones altas; así podemos establecer que el límite de detección de esta técnica es de 100 UFC/ml iniciales, lo que equivale a 2UFC/pozo, aún utilizando una concentración varios órdenes de magnitud menor a la utilizada en nuestro laboratorio.
En cuanto a tiempo de incubación, un periodo de 12 h constituye la mejor opción ya que permite obtener una buena recuperación de células, sin diferencias significativas con las obtenidas en periodos más extensos (Tabla 2). Adicionalmente, se observa una buena concordancia entre la inspección visual y la espectrofotométrica, así como niveles altos de absorbancia, lo cual garantiza la reducción de falsos negativos debida a un posible uso de la sal o su producto reducido como sustrato por parte de los microorganismos. Además, un periodo de 12 h permitirá no sólo un ahorro en gastos operativos, sino la posibilidad de procesar un mayor numero de muestras de suelo en un día.
Adicionalmente, mencionamos que el producto XTT-formazán resultó ser estable a 4 ºC hasta por una semana vs. El INT (dos días), lo cual constituye una ventaja cuando se desea verificar los resultados, evaluar la reproducibilidad entre operarios y analizar un gran número de muestras de suelo por periodos más prolongados (> 2 días) con una cantidad de producto previamente preparada. Aunque en nuestro estudio sólo se realizaron pruebas con una cepa especifica, los resultados son prometedores en términos de un ahorro de tiempo y reactivos sin reducción significativa de la recuperación celular. Sin embargo, vale la pena evaluar el desempeño de estas sales para otros tipos de bacterias degradadoras de HC, o incluso para diferentes consorcios.
CONCLUSIONES
Las dos sales de tetrazolio pueden ser utilizadas para la determinación de la densidad de microorganismos degradadores de HC en muestras de suelo por la técnica de NMP en placas de 96 pozos. Sin embargo, aunque no se presentaron diferencias significativas en los recuentos obtenidos, el XTT permitió una mayor recuperación de bacterias degradadoras de HCs (> % de aislamientos viables) y presentó además la ventaja de ser soluble, de rápida reducción (12 h), y fácil visualización y preparación frente al INT. Lo cual permite proponer el uso de esta sal (XTT) de nueva generación como una verdadera alternativa para determinar actividad de microorganismos degradadores empleando la técnica del NMP.
Por factores no determinados en este estudio el incremento en la concentración de la sal de tetrazolio XTT ejerce un efecto inhibitorio en el crecimiento, lo cual resulta en una reducción de la recuperación de células viables de Acinetobacter sp. Finalmente, la inspección visual es un sistema fiable de valoración de resultados para ensayos de recuento por NMP en microplacas en tiempos de incubación que no superen las 12 h con la sal indicadora XTT. El límite de detección de actividad bacteriana para ensayos de recuento de Acinetobacter sp. por NMP usando la sal indicadora XTT en formato de microplacas fue de 100 UFC/ml o 2 UFC/pozo.
De manera general, un tiempo de incubación de 12 h con la sal XTT para detección de actividad de degradación de hidrocarburos en formato de microplacas resulta adecuado en términos de confiabilidad en la interpretación de resultados, recuperación de células viables y reducción de costos operativos. Se observó que un incremento en la (XTT) causó un efecto inhibitorio, evidenciado como una reducción en la absorbancia y menor recuperación de bacterias degradadotas vs. El INT. Por otro lado, a una mayor concentración celular inicial se produjo mayor absorbancia (crecimiento celular) durante el ensayo.
AGRADECIMIENTOS
Los autores agradecen a los entes financiadores, CIEBREG y COLCIENCIAS. También, y muy especialmente, a la Vicerrectoría Académica de la Pontificia Universidad Javeriana (PUJ). A Viviana Gutiérrez por su colaboración en los análisis de laboratorio.
BIBLIOGRAFÍA
BENSAID A, THIERIE J, PENNINCKX Y. The Use of the Tetrazolium Salt XTT for the Estimation of Biological Activity of Activated Sludge Cultivated under Steady-state and Transient Regimes. J Microbiol Meth. 2000;40(3):255-263.
[ Links ]BERRIDGE M, TAN A, MCCOY K, WANG R. The Biochemical and Cellular Basis of Cell Proliferation Assays that Use Tetrazolium Salts. Biochemica. 1996;4:15-20.
[ Links ]BROWN E, BRADDOCK J. Sheen Screen, a Miniaturized Most-Probable Number Method for Enumeration of Oil-Degrading Microorganisms. Appl Environ Microb. 1990;56:3895-3896.
[ Links ]GABRIELSON J, HART M, JARELÖV A, KÜHN I, MCKENZIE, MÖLLBY R. Evaluation of Redox Indicators and the Use of Digital Scanners and Spectrophotometer for Quantification of Microbial Growth in Microplates. J Microbiol Meth. 2002; 50(1):63-73.
[ Links ]GASKIN S, BENTHAM R. Comparison of Enrichment Methods for the Isolation of Pyrene Degrading Bacteria. Int Biodeter Biodegr. 2005;56(2):80-85.
[ Links ]GOODWIN C, HOLT S, DOWNES S, MARSHALL N. Microculture Tetrazolium Assays: a Comparison between Two New Tetrazolium Salts: XTT y MTS. J Microbiol Meth. 1995;179(1):95-103.
[ Links ]GRIEBE T, SCHAULE G, WUERTZ S. Determination of Microbial Respiratory and Redox Activity in Activated Sludge. J Ind Microbiol Biot. 1997;19(2):118-122.
[ Links ]HAINES J, WRENN B, HOLDER E, STROHMEIER K, HERRINGTON R, VENOSA A. 1996. Measurement of Hydrocarbon-Degrading Microbial Populations by a 96-Well Plate Most-Probable-Number Procedure. J Ind Microbiol Biot. 1996;16(1):36-41.
[ Links ]HAMME J, SING A, WARD O. Recent Advances in Petroleum Microbiology. Microbiol Mol Biol R. 2003;67(4):503-549.
[ Links ]HATZINGER P, PALMER P, SMITH R, PEÑARRIETA C, YOSHINARI T. Applicability of Tetrazolium Salts for the Measurement of Respiratory Activity and Viability of Groundwater Bacteria. J Microbiol Meth. 2003;52(1):47-58.
[ Links ]JOHNSEN A, BENDIXEN K, KARLSON U. Detection of Microbial Growth on Polycyclic Aromatic Hydrocarbons in Microtiter Plates by Using the Respiration Indicator WST-1. Appl Environ Microb. 2002;68(6):2683-2689.
[ Links ]LA ROSA G, DE CAROLIS E, SALI M, PAPACCHINI M, RICCARDI C, MANSI A, et al. Genetic Diversity of Bacterial Strains Isolated from Soils, Contaminated with Polycyclic Aromatic Hydrocarbons, by 16S rRNA Gene Sequencing and Amplified Fragment Length Polymorphism Fingerprint. Microbiol Res. 2006;161(2):150-157.
[ Links ]LA TORRE N. Comparación de medios de cultivo altos y bajos en nutrientes para la recuperación de microorganismos heterótrofos totales en la Ecorregión Cafetera-Colombia. (Tesis de pregrado) Bogotá: Programa de Microbiología Industrial, Facultad de Ciencias, Pontificia Universidad Javeriana; 2007.
[ Links ]MACCLUSKEY C, QUINN J, MCGRATH J. An evaluation of Three New-generation Tetrazolium Salts for the Measurements of Respiratory Activity in Activate Sludge Microorganisms. Microb Ecol. 2005;49(3):379-387.
[ Links ]MAILA M, RANDIMA P, DRØNEN K, CLOETE T. Soil Microbial Communities: Influence of Geographic Location and Hydrocarbon Pollutants. Soil Biol Biochem. 2006;38(2):303-310.
[ Links ]MALDONADO C. Evaluación de la atenuación natural de hidrocarburos del petróleo utilizados como supresores de polvo en carreteras sin pavimentar. (trabajo de pregrado). Bogotá: Programas de Biología y Microbiología, Facultad de Ciencias, Universidad de Los Andes; 2004.
[ Links ]MARGESIN R, ZIMMERBAUER A, SCHINNER F. Monitoring of Bioremediation by Soil Biological Activities. Chemosphere. 2000;40(4):339-346.
[ Links ]MARGESIN R, LABBÉ D, SCHINNER F, GREER C, WHYTE L. Characterization of Hydrocarbon-Degrading Microbial Populations in Contaminated and Pristine Alpine Soils. Appl Environ Microb. 2003;69(6):3085-3092.
[ Links ]ROLDÁN, F. Evaluation of the Effects of Addition of Oxygen (O2) and Nitrate (NO3-) Terminal Electron Acceptors to the Enhanced in situ Bioremediation of an Oil Contaminated Salt Marsh. (tesis doctoral). New Hampshire: College of Engineering and Physical Sciences, New Hampshire University; 2002.
[ Links ]ROSLEV P, KING G. Application of a Tetrazolium Salt with a Water Soluble Formazan as an Indicator of Viability in Respiring Bacteria. Appl Environ Microb. 1993;59(9):2891-2896.
[ Links ]VALLEJO V, SALGADO L, ROLDÁN F. Evaluación de la bioestimulación en la biodegradación de TPHs en suelos contaminados con petróleo. Rev Colomb Biotec. 2005;7(2):67-78.
[ Links ]WRENN B, VENOSA A. Selective Enumeration of Aromatic and Aliphatic Hydrocarbon Degrading Bacteria by Most Probable Number Procedure. Can J Microbiol. 1996;42(3):252-258.
[ Links ]













