Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.15 n.3 Bogotá set./dez. 2010
CARACTERIZACIÓN SEROLÓGICA Y MOLECULAR DE POTYVIRUS ASOCIADOS A LA VIROSIS DEL TOMATE DE ÁRBOL EN ANTIOQUIA (COLOMBIA)
Serological and Molecular Characterization of Potyvirus Associated to the Viral Disease of Tamarillo in Antioquia (Colombia)
MARILUZ AYALA VÁSQUEZ1, M.Sc.; PAOLA GONZÁLEZ JAIMES2, Ph. D.; PABLO ANDRÉS GUTIÉRREZ3, Ph. D.; JOSÉ MIGUEL COTES4, Ph. D.; MAURICIO MARÍN MONTOYA1, Ph. D.
1Laboratorio de Biología Celular y Molecular, Facultad de Ciencias. Universidad Nacional de Colombia, Sede Medellín, Colombia. mayalavasquez@gmail.com - mamarinm@unal.edu.co 2Laboratorio de Sanidad Vegetal, Facultad de Ciencias Agrarias. Politécnico Colombiano Jaime Isaza Cadavid. Medellín, Colombia. epgonzalez@elpoli.edu.co 3Laboratorio de Microbiología Industrial, Facultad de Ciencias. Universidad Nacional de Colombia. Sede Medellín, Colombia. paguties@unal.edu.co 4Departamento de Ciencias Agronómicas, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia. Sede Medellín, Colombia. jmcotes@unal.edu.co Correspondencia: Prof. Mauricio Marín Montoya, Departamento de Biociencias, Facultad de Ciencias, Universidad Nacional de Colombia. Sede Medellín, Colombia. A.A. 3840. Fax: (57 4) 430 93 32. mamarinm@unal.edu.co
Presentado el 20 de abril de 2010, aceptado el 3 de octubre de 2010, correcciones 15 de noviembre de 2010.
RESUMEN
El tomate de árbol (Solanum betaceum) es una fruta andina altamente nutritiva, con propiedades organolépticas únicas para el procesamiento industrial y el mercado internacional. En Antioquia, Colombia, este cultivo presenta diferentes problemas fitosanitarios, siendo especialmente limitante la Virosis, causada por un complejo viral del que hacen parte entre otras, especies del género Potyvirus. En este trabajo se evaluaron mediante pruebas de ELISA los niveles de incidencia de este grupo viral en cultivos de siete zonas del departamento de Antioquia y se determinó la identidad taxonómica de dos de los potyvirus asociados al cultivo. Las pruebas serológicas muestran la presencia de potyvirus en seis de las siete zonas evaluadas, alcanzando niveles superiores al 80% de incidencia, siendo la excepción los cultivos del municipio de Jardín (8%). Pruebas serológicas con anticuerpos específicos para PVY, identificaron a este virus como uno de los presentes en algunas de las muestras sintomáticas colectadas; mientras que análisis de secuencias de amplicones obtenidos mediante RT-PCR, detectaron un nuevo potyvirus, para el que se propone el nombre Tamarillo Leaf Malformation Virus (TaLMV), aunque es necesario completar la secuencia de su genoma para confirmar la validez de esta hipótesis taxonómica. Esta investigación representa un avance importante en el conocimiento que se tiene en Colombia sobre los agentes causales virales del tomate de árbol. Sin embargo, es necesario profundizar en aspectos como los mecanismos de transmisión de estos virus y los efectos individuales y de su interacción sobre las variedades de este cultivo en el país.
Palabras clave: ELISA, Potyvirus, PVY, RT-PCR, Tamarillo.
ABSTRACT
Tomato tree (Solanum betaceum) is an andean fruit which, due to its high nutricious value and unique organoleptic properties, has very good potential for industrial processing and international marketing. In Antioquia, Colombia, this crop faces several phytosanitary problems, of which viral infections by species of the Potyvirus genus are the most limiting. In this work, potyvirus incidence levels was evaluated in seven regions of the Antioquia province using the ELISA assay. The taxomical identity of two potyvirus associated with this crop was also determined. Serological tests demonstrate the overall presence of potyvirus in six regions, with incidence levels above 80%. The only exception was the municipality of Jardin with an incidence of only 8%. Serological test specific to PVY virus, revealed its presence in many of the infected plants. DNA sequencing of RTPCR amplicons also showed the presence of a new potyvirus for which we propose the name Tamarillo Leaf Malformation Virus (TaLMV). However, to corroborate this taxonomical hypothesis it is necessary to complete the genome sequence of TaLMV. This research represents an important advance in the knowledge of viruses infecting tomato tree. However, future investigations are required to deepen further into the individual effects of each virus as well as the transmission mechanisms and interactions with different varieties of tomato tree.
Key words: ELISA, Potyvirus, PVY, RT-PCR, Tamarillo.
INTRODUCCIÓN
El cultivo del tomate de árbol se ha constituido en una de las opciones productivas más importantes para la región andina de Colombia, al punto que para el año 2004 su producción alcanzó 118.226 tm, es decir el 4,1% de la producción de frutas frescas del país, sin contar el banano. Se cultiva en 18 departamentos, aunque dos terceras partes de la producción se originan en los departamentos de Antioquia (50%) y Cundinamarca (14%). En el caso de Antioquia el cultivo ocupa 2.668 ha distribuidas en 19 municipios, aunque su producción se concentra en las subregiones Norte (2.048 ha), Oriente (385 ha) y Suroeste (180 ha), obteniéndose rendimientos de 32 tm/ha, valor superior al promedio nacional que es del orden de 18 tm/ha (Ministerio de Agricultura y Desarrollo Rural, 2006; Gobernación de Antioquia, 2008). Uno de los factores que ha incentivado la siembra masiva de este frutal en Colombia, ha sido su alto potencial para el procesamiento industrial, debido a sus excelentes características organolépticas y a su contenido en vitaminas A y C, minerales y bajo nivel de calorías. Sin embargo, la presencia de diferentes problemas fitosanitarios entre los cuales se destacan los relacionados con la antracnosis (Colletotrichum gloeosporioides) y la Virosis, vienen afectando drásticamente los planes de expansión del cultivo, a tal punto que sólo en Antioquia en el año 2007 se perdieron 1.260 ha y se erradicaron 273 ha (Gobernación de Antioquia, 2008).
Los problemas virales del tomate de árbol se han detectado en Colombia desde inicios de la década de 1980, cuando se reportó en Boyacá la presencia del Virus de la necrosis anular del tomate de árbol (Sánchez de Luque, 1982a) y en Antioquia el Mosaico del tomate de árbol (Tamayo, 1990); las cuales no representaban mayor daño económico. Esta situación cambió cuando a partir de 1991 comienza la aparición en el norte antioqueño de una nueva enfermedad denominada como Virosis, cuyo efecto motivó la erradicación de un alto número de plantas en los municipios de Entrerríos y Santa Rosa de Osos (Tamayo, 1996). En la actualidad el problema continua expandiéndose en el país, tal como se demuestra en los reportes de Betancourth et al. (2003) y Rodríguez (2010) en Nariño; Cruz (2005) y Cuspoca (2007) en Cundinamarca; Jaramillo (2009) y Gil et al. (2009) en Antioquia.
Los estudios de enfermedades virales en cultivos de tomate de árbol en Colombia se han asociado con la presencia de virus de partículas alargadas y flexuosas, de aproximadamente 750 - 800 nm de largo y de transmisión mecánica y por áfidos, por lo cual se ha sugerido que su identidad corresponde a un miembro del género Potyvirus (Potyviridae), aunque no se han realizado estudios de secuenciación que establezcan la identidad a nivel de especie de este agente causal (Sánchez de Luque, 1982a, b; Maldonado y Sánchez de Luque, 1984; Sañudo y Orellana, 1989; Tamayo, 1990; Saldarriaga y Bernal, 1994; Tamayo, 1996; Saldarriaga et al., 1997; 1998; Betancourth et al., 2003).
Adicionalmente, existen reportes basados en microscopía electrónica de la presencia de virus con partículas isométricas de 30 nm de diámetro en muestras de tomate de árbol con síntomas de mosaicos en sus hojas (Tamayo et al., 1999), detectándose mediante RT-PCR con cebadores específicos, un posible cucumovirus y un polerovirus en cultivos de Cundinamarca, Nariño y Antioquia (Cruz, 2005; Jaramillo 2009; Rodríguez, 2010). El patrón general de síntomas de la enfermedad incluye la ocurrencia de mosaicos, engrosamiento de nervaduras, ampollas y deformación foliar, amarillamientos, manchas aceitosas o concéntricas, defoliación y la reducción dramática tanto en la producción de frutos como en la longevidad de las plantas. En los frutos verdes se presentan manchas moradas que cambian a diferentes tonalidades rojizas con la maduración, además es frecuente encontrar frutos deformes y daños en la calidad de la pulpa (Tamayo, 1996; Betancourth et al., 2003; Gil et al., 2009; Jaramillo 2009). Ayala et al. (2009) han propuesto agrupar todo el síndrome viral del tomate de árbol bajo la denominación de Virosis. A nivel mundial, los únicos reportes de Virosis en tomate de árbol se han realizado en Nueva Zelanda y Ecuador. En el primer país se han identificado seis virus (Eagles et al., 1994), entre los cuales se encuentran: Virus del mosaico del tamarillo (TaMV, Potyvirus), que causa síntomas como moteado y bandeamiento de venas en las hojas y manchas oscuras en los frutos (Brunt et al., 2009); Virus del mosaico del pepino (CMV, Cucumovirus), con síntomas en hojas y frutos en forma de manchas y anillos; Virus del mosaico aucuba de la papa (PAMV, Potexvirus), que aparentemente es dependiente del TaMV para la transmisión por áfidos; Virus del mosaico de la alfalfa (AMV, Alfamovirus) que causa un mosaico amarillo brillante y bandeamiento de venas, pero al parecer no afecta el fruto (Fletcher, 1987); Virus del mosaico de la arabis (ArMV, Nepovirus), un virus transmitido por nemátodos, que ha sido aislado de frutos que exhibían anillos necróticos superficiales y finalmente, Virus del marchitamiento moteado del tomate (TSWV, Tospovirus) que se ha asociado a necrosis del fruto. En Ecuador, se han estudiado las enfermedades virales del tomate de árbol especialmente en los valles de la provincia de Pichincha, encontrándose que prevalecen el Virus del enrollamiento foliar de la papa (PLRV, Polerovirus), Virus de la mancha anular del tomate (ToRSV, Nepovirus), Virus Y de la papa (PVY, Potyvirus), Virus del mosaico del tomate (ToMV, Tobamovirus), CMV, AMV y TSWV (Vizuete et al., 1990; Ochoa e Insuasti, 2005).
A pesar del alto número de virus reportados en el cultivo, diversos estudios han demostrado que potyvirus como el TaMV y PVY, aparentemente representan desde el punto de vista económico, los más importantes agentes causales virales en este cultivo (Vizuete et al., 1990; Eagles et al., 1994; Tamayo, 1996; Betancourth et al., 2003; Gil et al., 2009). Los potyvirus hacen parte de la familia Potyviridae cuyo nombre se deriva de la especie tipo PVY. Muchos de ellos causan pérdidas económicas en diversos cultivos y generalmente inducen síntomas de mosaicos y moteados foliares. Son transmitidos predominantemente por áfidos de forma no persistente, al igual que de forma mecánica (Riechmann et al., 1992) y ocasionalmente por semilla o por polen (Gibbs y Mackenzie, 1997). Los miembros de la familia Potyviridae constituyen el grupo de virus de plantas más numeroso, con al menos 180 miembros que representan aproximadamente el 30% de todos los virus vegetales (Ward y Shukla, 1991; Van-Regenmortel et al., 2000); cuenta con siete géneros, destacándose el género Potyvirus (143 especies), por el efecto negativo que causan algunos de sus miembros en plantas de importancia agrícola mundial (ICTV, 2010).
Los potyviurs se caracterizan por presentar varillas flexuosas de 650 a 900 nm de longitud y 11 a 13 nm de ancho. Su genoma es de ARN de cadena sencilla positiva con un tamaño de aproximadamente 9-10 kpb, poliadenilados en su extremo 3’ y asociados a una proteína unida covalentemente al extremo 5’ (VPg) (Gibbs y Mackenzie, 1997; Van-Regenmortel et al., 2000; Hsu et al., 2005). El genoma de los miembros del género Potyvirus codifica para una poliproteína precursora de 350 kDa (Riechmann, et al., 1992, 1995) que es subsecuentemente procesada por tres proteasas en siete proteínas pequeñas: P1, componente asistente; P3, inclusión cilíndrica (CI); inclusión nuclear a (NIa); inclusión nuclear b (NIb); proteína de cápside (Cp) y dos proteínas putativas conocidas como 6K1 y 6K2 (Riechmann et al., 1992). Las tres proteasas de origen viral son: la proteinasa P1 y la proteinasa del componente asistente (HC-pro), que catalizan sólo reacciones autoproteolíticas en los extremos C-terminal (Verchot et al., 1991; Verchot y Carrington, 1995) y la proteína de inclusión nuclear (NIa-Pro), un homólogo de la proteinasa del picornavirus 3C, que realizar los clivajes restantes por mecanismos trans y autoproteolíticos. El procesamiento y función de todas estas proteínas es aún controversial, pero se cree que muchas de ellas son multifuncionales (Riechmann et al., 1992; Verchot y Carrington, 1995).
Shukla et al. (1994), indican que la región más frecuentemente utilizada en estudios de taxonomía y diversidad genética de potyvirus ha sido el gen que codifica para la cápside (Cp), debido principalmente a su posición en el extremo 3’-terminal del genoma, lo que ha facilitado su secuenciación medinate el uso de cebadores del tipo oligo-dt. Adams et al. (2005), buscando definir los criterios moleculares que más se ajustaban a la delimitación de géneros y especies dentro de la familia Potyviridae, realizaron múltiples comparaciones a partir de las secuencias disponibles en las bases de datos moleculares para cada gen, para las regiones UTR y para todo el genoma de los miembros de esta familia. Sus resultados indicaron que la mayoría de las especies dentro del mismo género, presentaron niveles de identidad en sus ORFs del 50 al 55%, aunque en algunas especies cercanas, dicho nivel alcanzó valores tan altos como el 76% en nt y 82% en aa. Los rangos basados en genes individuales para la delimitación de especies variaron entre el 58% (para el gen P1) y el 78% (para el gen CI). Las comparaciones de las secuencias completas de los genomas, identificaron como criterio para separar géneros un valor del 46% de identidad en nt, aunque este criterio no permitió la separación de los géneros Rymovirus y Potyvirus. Finalmente, estos estudios indicaron que cuando se utilizan secuencias de la cápside viral para los estudios taxonómicos en potyvirus, la base para demarcar especies debería corresponder a un nivel de identidad del 76-77% en su secuencia de nt.
A pesar de la creciente problemática viral en los cultivos de tomate de árbol del país, el nivel de conocimiento que se tiene de los agentes causales de la Virosis es limitado, especialmente en lo referente a la identificación a nivel de especie de dichos virus, información fundamental para el desarrollo de herramientas de diagnóstico y para el diseño de programas de manejo integrado de esta enfermedad. Esta investigación se planteó con el objetivo de identificar los potyvirus asociados a la Virosis del tomate de árbol en Antioquia y adicionalmente evaluar su incidencia en siete regiones del departamento cultivadoras de este frutal.
MATERIALES Y MÉTODOS
OBTENCIÓN DE MUESTRAS Y EVALUACIÓN VISUAL DE SÍNTOMAS
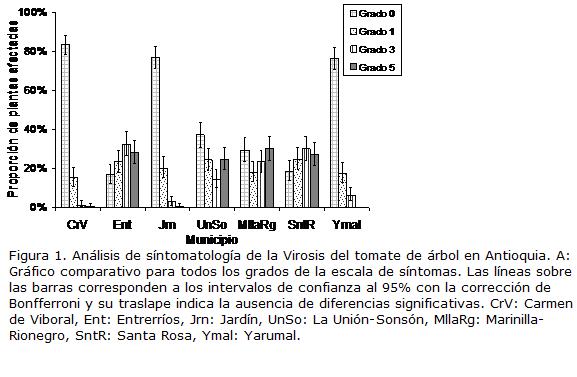
Se colectaron hojas de plantas de tomate de árbol en estado de producción (12 a 24 meses) con síntomas de Virosis en siete zonas productoras de tomate de árbol de Antioquia: Zona 1: Carmen de Víboral; Zona 2: Entrerríos; Zona 3: Jardín; Zona 4: La Unión-Sonsón; Zona 5: Marinilla-Rionegro; Zona 6: Santa Rosa de Osos; Zona 7: Yarumal. En cada colección se describía la sintomatología en tejido foliar, frutos, flores y estado general de la planta (presencia de enanismos, defoliaciones, etc.). Con base en estas observaciones y en las realizadas por Gil et al. (2009), se estableció una escala de evaluación visual de síntomas que contempla cuatro grados de acuerdo al aspecto general del área foliar del árbol: Grado 0: plantas aparentemente sanas, sin presencia de síntomas; Grado 1: plantas con síntomas virales en 25% de su follaje; Grado 3: plantas con síntomas virales entre el 25 y el 50% de su follaje; Grado 5: plantas con síntomas virales en más del 50% de su follaje. Para el análisis del estado de las plantas en cada zona evaluada, se siguió la escala indicada y se calcularon los intervalos de confianza por el método exacto de Fisher para las proporciones de individuos en cada una de las categorías, calculándose las diferencias significativas entre zonas, con base en la longitud de los intervalos con un nivel de significancia del 95%, ajustado por el método de Bonferroni para comparaciones múltiples (Zar, 1999).
NIVEL DE INCIDENCIA
En cada una de las siete zonas de estudio, se tomaron diez lotes de cultivo con diferentes estados de desarrollo y dentro de cada lote se colectaron en 30 plantas seleccionadas al azar, cuatro hojas completamente expandidas. Las 30 muestras colectadas fueron evaluadas mediante pruebas de ACP-ELISA de la compañía Agdia (Indiana, EE. UU.), que utiliza anticuerpos monoclonales desarrollados por USDA Florist and Nursery Crops Laboratory (Beltsville, Maryland, EE. UU.) y el anticuerpo monoclonal PTY 1 conjugado a la enzima Fosfatasa alcalina para detección, que reconoce un criptotipo de la cápside viral conservado en todas las especies de potyvirus transmitidas por áfidos (Jordan y Hammond, 1991). Paralelamente al muestreo, se realizó la evaluación de sintomatología en cada una de las plantas, siguiendo la escala anteriormente indicada.
Adicionalmente, se colectaron en cada zona, cinco muestras de plantas que se presentaban como asintomáticas, con el fin de evaluar la presencia de potyvirus mediante pruebas de ELISA, así como plantas con síntomas particulares que permitieran asociar dichos síntomas con la ocurrencia de este grupo viral.
Los resultados de las pruebas de ELISA, fueron evaluados en un equipo Multiscan (Labsystem, Finlandia) y cada prueba incluyó un control positivo (suministrado por el fabricante en forma liofilizada) y un control negativo. Los pozos con reacción positiva fueron aquellos en los cuales las lecturas de absorbancia a 405 nm presentaron un valor mínimo del doble de la lectura obtenida en el control negativo, siguiendo el criterio planteado por Matthews (1993). Los resultados se analizaron a través de un modelo lineal generalizado aleatorio, considerando una distribución binomial para la variable incidencia y utilizando una función de ligamiento logit. Los efectos aleatorios fueron: zona, lotes de cultivo dentro de zonas y plantas dentro de lotes de cultivo. Para el análisis estadístico se utilizó el procedimiento GLIMMIX de SAS v. 9.1.3 (SAS Institute Inc., 2006).
ANÁLISIS SEROLÓGICO DE PVY
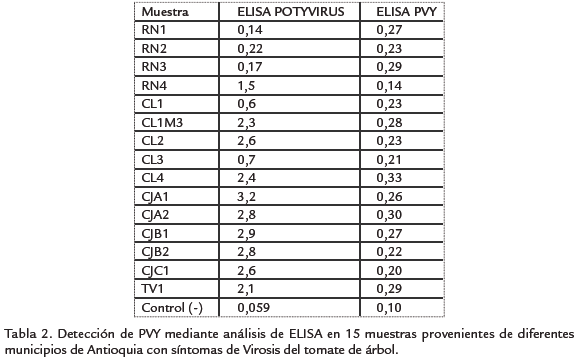
Una vez realizados los análisis serológicos con anticuerpos genéricos para potyvirus, se evaluó si entre los potyvirus detectados se encontraba PVY, ya que este virus se ha reportado previamente asociado a enfermedades virales en cultivos de tomate de árbol (Vizuete et al., 1990; Eagles et al., 1994). Para esto, se tomaron 15 muestras frescas de plantas de cuatro municipios de Antioquia (Rionegro, Carmen de Víboral, La Ceja y Entrerríos), y se realizó una prueba de TAS ELISA específica para PVY que utiliza anticuerpos policlonales para la captura y anticuerpos monoclonales para la detección, que reconocen epítopes conservados en la cápside viral de las diferentes variantes de PVY (Ellis et al., 1996).
IDENTIFICACIÓN MOLECULAR
Extracción de ácidos nucleicos totales. Se utilizó el procedimiento descrito por Gibbs y Mackenzie (1997), que parte de la maceración de 100 mg de tejido foliar y el empleo de 0,6 ml de buffer de extracción CTAB (CTAB 2% p/v, NaCl 2 M, Tris-HCl 0,1 M, EDTA 1 mM, 0,5% β-mercaptoetanol). Posteriormente, se realizó la separación de la fase orgánica mediante adición de 0,3 ml de cloroformo:alcohol isoamílico (24:1) y la precipitación de los ácidos nucleicos con acetato de amonio 7,5 M y 1 vol. de isopropanol. Finalmente, el precipitado generado se lavó con 300 µL de etanol al 70% y se resuspendió en 50 µL de agua destilada ésteril.
Extracción de ARN total. Se realizó mediante el empleo del kit RNeasy plant mini kit (Qiagen, California, EE. UU.). Para este procedimiento se maceraron 100 mg de tejido foliar, utilizando 450 µL de buffer RLT y 10 µL de β-mercaptoetanol, siguiendo las instrucciones del fabricante. Al finalizar el procedimiento, el ARN obtenido fue resuspendido en 30 µL de agua destilada estéril libre de ARNasas.
RT-PCR. Las reacciones de RT-PCR se realizaron con el fin de amplificar una región comprendida entre el extremo 3’ del gen NIb y el 5’ del gen de la cápside viral, ampliamente utilizada en estudios taxonómicos del género Potyvirus (Adams et al., 2005). Para esto se empleó el kit Qiagen OneStep RT-PCR (California, EE. UU.) incluyendo 5 µL de ácidos nucleicos totales o ARN total, 0,6 µM de cada cebador específico, PCPR1: 5’-GGG GAG GTG CCG TTC TC(AGT) AT(AG) CAC CA-3’ y PN1BF1: 5’-GG(GCT) AA(CT) AAT AGT GG(AGCT) CAA CC-3’ (Hsu et al., 2005), buffer 1X del kit Qiagen OneStep RT-PCR, 400 µM de dNTPs y 2 µL de mezcla de enzimas Qiagen (transcriptasa reversa Omniscript, transcriptasa reversa Sensiscript y Polimerasa de ADN HotStarTaq). El programa de amplificación consistió de una fase inicial de síntesis de la primera cadena a 50 °C por 30 min, seguido de la activación de la Taq polimerasa HotStar a 95 °C por 15 min y 35 ciclos a 94 °C por 1 min, 52 °C por 1 min, 72 °C por 1,30 min y una extensión final de 10 min a 72 °C. Los productos amplificados fueron separados por electroforesis en gel de agarosa al 1,5% suplementado con 4 µL de bromuro de etidio (10 mg/mL), visualizados utilizando un transiluminador UV (Biometra, Göttingen, Alemania) y su tamaño verificado por comparación con el marcador de peso molecular Generuler 100 pb DNA ladder (Fermentas, Vilnius, Lituania).
RFLPs. De cada zona muestreada, se obtuvieron al menos dos amplicones de RT-PCR de la región NIb-Cp de cepas del potyvirus asociado a la Virosis del tomate de árbol, para el estudio de su variabilidad genética en Antioquia. Esta evaluación se realizó inicialmente a partir de la metodología de RFLPs con seis enzimas de restricción (MspI, TaqI, Hind6I, BamHI, CfoI, Eco321). Cada reacción consistió de 2 µL de buffer 10X de enzima, 0,1 µL de cada enzima, 8 µL de producto de RT-PCR, incubándose a 37 °C por 24 h. La separación de los fragmentos de restricción se realizó por medio de electroforesis en gel de agarosa al 2%, 70 V y 2 h. Para cada patrón de restricción se determinó el número de bandas generadas y su tamaño aproximado por comparación con el marcador de peso molecular Generuler 100 pb DNA ladder (Fermentas).
Análisis filogenético. Los amplicones del tamaño esperado para potyvirus, se purificaron directamente mediante el kit QIAquick PCR Purification Kit (Qiagen), aunque en algunas ocasiones cuando no era posible eliminar la presencia de bandas inespecíficas, se realizó la purificación de los fragmentos a partir de su corte en los geles mediante el kit QIAquick Gel Extraction (Qiagen). Posteriormente, los productos purificados fueron secuenciados utilizando los mismos cebadores del RT-PCR en un secuenciador ABI Prism 3.730 xl (PE Applied Biosystems) de la compañía Macrogen (Corea del Sur).
Las secuencias obtenidas con cada cebador fueron editadas mediante el software BioEdit 6.0.6 y Chromas 1.45, construyéndose secuencias consenso y confirmándose su identidad con genes virales por comparación con las bases de datos moleculares, mediante el pro-grama BLAST (http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi). Estas secuencias se alinearon mediante el software Clustal W con aquellas de diferentes potyvirus reportados en plantas de tomate de árbol y depositadas en el GenBank, y la matriz generada fue utilizada para obtener un árbol filogenético mediante el método de Máxima Parsimonia con búsqueda heurística, utilizando el software PAUP 4.0b10 (Swofford, 1998). El soporte de la topología interna de los dendrogramas fue determinado por análisis de bootstrap con 1.000 remuestreos (Felsenstein, 1985).
RESULTADOS
EVALUACIÓN VISUAL DE SÍNTOMAS
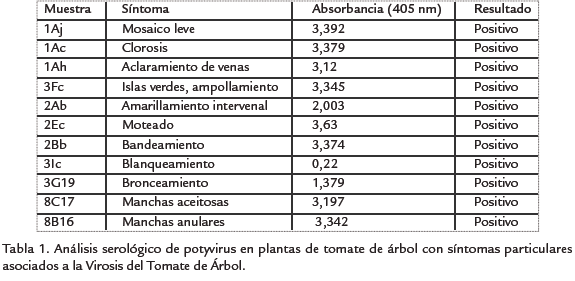
Las observaciones en el campo indicaron que la Virosis del tomate de árbol en Antioquia se manifesta principalmente por mosaicos rugosos acompañados de la deformación de las hojas, el engrosamiento de venas, la reducción en la calidad y cantidad de frutos y el decaimiento general de la planta. Se observaron también, al menos otros 15 síntomas diferentes que incluyen: clorosis, bandeamiento de nervaduras principales, amarillamiento de venas secundarias, islas verdes, manchas aceitosas, anillos necróticos en hojas y frutos, bronceamiento de tejido foliar, aclaramiento de venas, amarillamiento intervenal, defoliación, aborto de flores, proliferación de brotes, cambios en la coloración de flores y frutos, endurecimiento de pulpa de frutos, deformación de frutos y grabados en frutos.
Con respecto a la sintomatología y estado general de los cultivos en las zonas de muestreo, las evaluaciones de la escala de síntomas indicaron diferencias estadísticas en el análisis de proporciones. Se presentó un primer grupo correspondiente a los cultivos ubicados en las zonas de Marinilla-Rionegro, Entrerríos, Santa Rosa y La Unión-Sonsón, que presentaron una alta proporción de plantas con niveles de síntomas correspondientes al grado 5 (25-27%) y al grado 3 (14-32%), mientras que en El Carmen de Víboral, Jardín y Yarumal, la mayoría de las plantas muestreadas se clasificaron en grado 0, es decir, no presentaron síntomas, con proporciones de 83, 77 y 76%, respectivamente; siendo muy baja la presencia de plantas que se registraron con grado 5 de síntomas (menos del 0,3% para los tres municipios). De este último grupo, Yarumal tuvo el mayor número de plantas en grado 3 con el 6% y Jardín en grado 1 con el 20%. La proporción de plantas clasificadas en grado 1, no presentó diferencias significativas entre las zonas analizadas (Fig. 1).
NIVEL DE INCIDENCIA
Los análisis de ELISA utilizando anticuerpos universales para la detección de potyvirus, indicaron la ocurrencia de al menos una especie viral de este género asociada a la Virosis del tomate de árbol. Los valores de absorbancia obtenidos para los controles positivos se presentaron en el rango de 1,62 a 3,67, mientras que los controles negativos arrojaron absorbancias inferiores a 0,109. Cuando se analizaron mediante ELISA las plantas asintomáticas obtenidas en cada zona de colección, se encontró que del total de 35 plantas analizadas (cinco plantas por zona), 28 plantas resultaron positivas para la presencia de potyvirus, mientras que solamente siete plantas procedentes principalmente de Jardín (cuatro plantas) resultaron negativas, lo que sugiere que no necesariamente la falta de síntomas refleja la ausencia de potyvirus en las plantas de tomate de árbol, y que para determinar la infección por el virus es necesario realizar pruebas de laboratorio (ej: ELISA, RT-PCR, hibridación, inoculación mecánica, etc.).
El análisis serológico para las plantas con síntomas particulares confirmó la presencia de potyvirus en todas las muestras analizadas. Sin embargo, esto no indica una relación directa entre la totalidad de los síntomas y la infección por potyvirus (Tabla 1), siendo posible que los síntomas observados se deban a la presencia de otros virus no considerados en este trabajo.
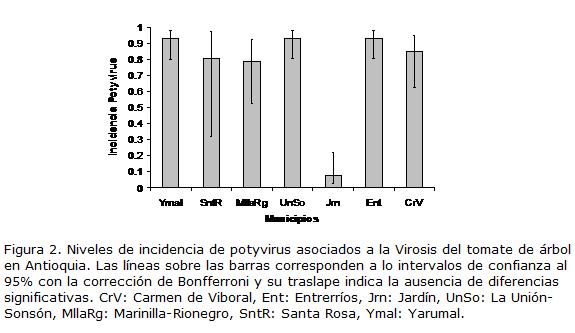
Con respecto a los resultados de incidencia de potyvirus asociados a la Virosis del tomate de árbol mediante pruebas de ELISA, se encontró que la presencia de potyvirus es considerablemente alta en la mayoría de cultivos de las zonas evaluadas, ya que entre el 80 y el 93% de los grupos procedentes de seis de las zonas analizadas resultaron positivos, siendo el municipio de Jardín la excepción, al detectarse este grupo de virus en el 8% de las muestras (Fig. 2).
ANÁLISIS SEROLÓGICO DE PVY En 14 de las 15 muestras seleccionadas para determinar sí uno de los potyvirus detectados mediante los anticuerpos universales correspondía a la especie PVY, se obtuvieron resultados positivos para este virus. Sin embargo, los valores de absorbancia obtenidos en las pruebas de ELISA fueron muy bajos en comparación con el control positivo y con los resultados de las pruebas para potyvirus con anticuerpos generales que se obtuvieron para algunas de estas muestras (Tabla 2).
IDENTIFICACIÓN MOLECULAR
RT-PCR. A partir de ambos moldes (ARN total y ácidos nucleicos totales), fue posible obtener amplificaciones de RT-PCR con los tamaños de banda esperados (~1.080 pb) en diferentes muestras de tejido de tomate de árbol, previamente confirmadas mediante ELISA como infectadas por potyvirus. Sin embargo, la presencia de inhibidores de las reacciones de síntesis de cDNA y PCR fue evidente en el tejido de tomate de árbol, ya que no se logró obtener amplicones en todas las muestras positivas para ELISA, especialmente cuando éstas se realizaban varios días después de su colección.
RFLPs. Al menos dos de los productos de RT-PCR obtenidos de cada municipio fueron digeridos con las enzimas de restricción MspI, TaqI, Hind6I, BamHI, CfoI, Eco321 y su perfil analizado para determinar la posible variación entre cepas para la región del genoma NIb-Cp. Los resultados indicaron que la enzima BamHI no presenta sitios de corte en la región amplificada, las enzimas Eco321, CfoI y MspI presentaron un sitio de corte y las enzimas Hind6I y TaqI tuvieron dos y tres sitios de corte, respectivamente.
Todos los aislamientos evaluados presentaron los mismos patrones de restricción con las seis enzimas utilizadas, lo que indica un alto nivel de identidad entre sus secuencias para la región bajo análisis, pudiendo corresponder a cepas de la misma especie, aunque se requiere la secuenciación de otras regiones del genoma para confirmar esta hipótesis (Fig. 3).
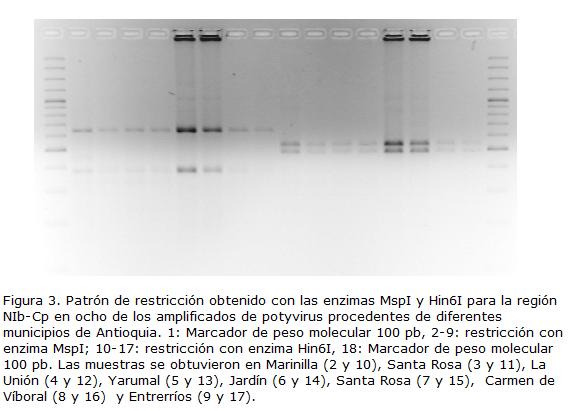
Análisis filogenético. Los resultados de las pruebas de RFLP no permitieron inferir diferencias en las secuencias de la región NIb-Cp de las cepas de potyvirus evaluadas, razón por la cual la selección de aislamientos a secuenciar se basó en su zona de procedencia. Una vez obtenidas las secuencias consenso, las comparaciones con las bases de datos moleculares indicaron que efectivamente las secuencias están asociadas con la región NIb-CP de potyvirus, presentándose en la búsqueda 110 entradas distribuidas entre 27 especies de este género viral. Las entradas que presentaron los máximos valores de identidad (70%) y menores valores e (2 x 10-90 a 2 x 10-97) corresponden a secuencias de la región NIb-Cp de diferentes variantes del Colombian Datura virus (CDV), obtenidas en hospedantes como Brugmansia sp., S. lycopersicum y N. tabacum; las demás secuencias de potyvirus, presentan altos valores de identidad, aunque tienen bajos porcentajes de cobertura y de valores e.
Cuando se realizaron los análisis de identidad basados en alineamiento múltiple incluyendo secuencias de diferentes especies de potyvirus reportadas afectando cultivos de tomate de árbol, así como aquellas del CDV, se encontraron niveles de identidad muy altos (entre 0,99 y 1) entre todas las cepas del potyvirus detectado en diferentes municipios de Antioquia, pero no entre éstas y CDV, PVY, PVA y TaMV, con las cuales compartieron niveles de 67, 54, 36 y 36%, respectivamente.
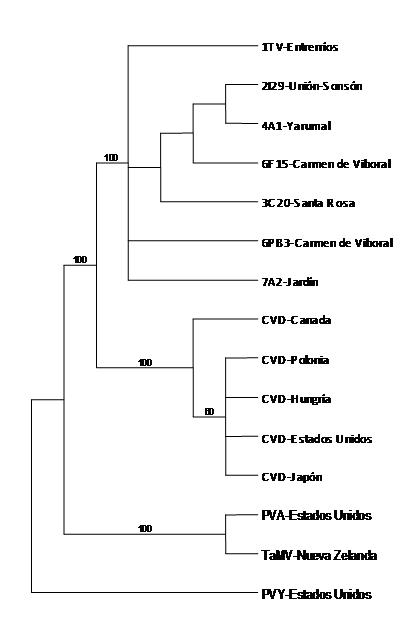
El análisis filogenético basado en máxima parsimonia para secuencias de la región NIb-Cp, se realizó con 889 caracteres, de los cuales 150 fueron constantes, 120 variables pero no informativos y 619 informativos. El árbol generado separó las cepas del potyvirus asociado a la Virosis del tomate de árbol en Antioquia de las otras especies de potyvirus reportadas en este cultivo en el mundo, siendo dicha separación soportada por valores de bootstrap del 100%. Los índices de Consistencia, Retención y Homoplasia para el árbol más parsimonioso fueron de 0,93; 0,96 y 0,06, respectivamente (Fig. 4).
DISCUSIÓN
La Virosis del tomate de árbol se evidencia como una de las limitantes más importante en los cultivos en Antioquia. La gravedad del síndrome es indiscutible cuando se observan cultivos abandonados o devastados por la enfermedad y otros relativamente jóvenes con importantes niveles de afectación. Esta situación amenaza los programas de expansión de los cultivo en la región andina de Colombia y ha conducido a un cambio en los sistemas de producción del tomate de árbol, pasando de ser un cultivo semiperenne de cuatro a cinco años realizado por pequeños agricultores con menos de 1 ha, a explotaciones de tamaños considerables (10 a 20 ha) desarrolladas por empresarios agrícolas, que generalmente participan en su comercialización directa en los centros urbanos y po-seen el capital necesario para renovar sus cultivos en periodos no superiores a tres años. Cuando recién se detectó la problemática viral de este cultivo en Antioquia (1991), se consideraba que estaba asociada a dos enfermedades diferentes denominadas genéricamente como Virosis y Mosaico del tomate de árbol. La primera de ellas se caracterizaba por inducir síntomas que causan deformación de tejidos foliares y brotes, además de engrosamiento de venas, ampollas y cambios en la apariencia de flores y frutos (Saldarriaga et al., 1997; Tamayo et al., 1999) y estaba asociada con la presencia de partículas virales flexuosas posiblemente del género Potyvirus; mientras que el Mosaico era causado por virus isométricos no identificados y cuyo efecto en las plantas se reducía a mosaicos suaves. En estas dos enfermedades, no se registró la presencia de síntomas como anillos concéntricos y necróticos como los descritos por Sánchez de Luque et al. (1981a; b) en Boyacá o de manchas aceitosas como las reportadas en cultivos de tomate de árbol del departamento de Nariño (Betancourth et al., 2003; Rodríguez, 2010). Sin embargo, en este trabajo la diversidad de síntomas encontrados en el campo fue tan amplia que no fue posible diferenciar a partir de observaciones un tipo de enfermedad en particular, sino más bien que correspondía a un síndrome, que incluye además de los mosaicos rugosos típicos acompañados del decaimiento general de la planta, al menos 15 síntomas particulares como el bandeamiento de venas, la presencia de manchas anulares de diferentes tipos y el bronceamiento de tejidos foliares. Por esta razón, en esta investigación se optó por denominar este síndrome viral en términos genéricos como Virosis del tomate de árbol, tal como lo había sugerido Ayala et al. (2009).
Cuando se realizó el análisis de sintomatología de la Virosis en los cultivos presentes en las siete zonas muestreadas en el departamento de Antioquia, se encontraron diferencias significativas en los niveles de síntomas presentes en las zonas de Marinilla-Rionegro, Entrerríos, Santa Rosa y La Unión-Sonsón con relación a las plantaciones de los municipios de El Carmen de Viboral, Jardín y Yarumal. Estas diferencias se manifestaron en la ocurrencia de una mayor proporción de plantas con niveles de síntomas en los grados 3 y 5 para el primer grupo de municipios; en contraste con el segundo grupo que tuvo una mayor cantidad de plantas asintomáticas. Dicha situación no sorprende, dado que las regiones Norte (Entrerríos y Santa Rosa) y del Oriente cercano (Marinilla-Rionegro), corresponden a zonas en donde comenzó la siembra masiva de cultivos de tomate de árbol en Antioquia en la década de los años 80 e inicio de los 90, y más adelante por efecto de la Virosis y otras enfermedades como la antracnosis, se redujeron paulatinamente, desplazándose a nuevas zonas, como el Suroeste, Santo Domingo y Yarumal. Los análisis de ELISA con anticuerpos universales para potyvirus, permitieron detectar la presencia de al menos un miembro de este grupo asociado a cultivos de tomate de árbol con la Virosis en Antioquia. Los niveles de incidencia detectados fueron muy altos en seis de las zonas muestreadas, con valores que oscilaron entre 80 y 93%, siendo el municipio de Jardín la excepción, con tan sólo 8% de muestras positivas para este grupo de virus. De esta forma, a pesar de que en los municipios de Carmen de Víboral y Yarumal los niveles de síntomas en los cultivos fueron bajos, la presencia de potyvirus en las plantas fue generalizada. Esta misma situación se evidenció cuando se evaluó la presencia de potyvirus en 35 plantas aparentemente sanas procedentes de las diferentes zonas muestreadas, encontrándose que 28 de las muestras arrojaron resultados positivos para potyvirus. De esta forma, es claro que las evaluaciones de los niveles de sanidad viral de los cultivos de tomate de árbol deben apoyarse en la realización de pruebas de laboratorio de diferente índole (ej. serológicas, moleculares, biológicas) y que es necesario profundizar en los estudios de transmisión de estos grupos de virus en tomate de árbol, que expliquen la rápida expansión de la enfermedad viral a las nuevas zonas de siembra. Algunos avances se han realizado en el país sobre este aspecto, Betancourth et al. (2003) determinaron que un virus flexuoso (posiblemente un potyvirus) presente en cultivos de tomate de árbol en Nariño era transmitido mecánicamente y por áfidos de la especie Myzus persicae de forma no persistente, mientras que Saldarriaga et al., (1998) indican que los virus asociados al Mosaico y la Virosis del tomate de árbol presentan una alta eficiencia en su transmisión mecánica. En ambos reportes se indica que estos virus no son transmitidos por semilla sexual.
Cuando se analizaron mediante pruebas de ELISA muestras de tejidos de plantas con síntomas particulares, se encontró que todas ellas resultaron positivas para potyvirus, independientemente del tipo de síntoma presente; de esta forma no fue posible descartar la ocurrencia de algún síntoma particular de la asociación con este grupo de virus. Sin embargo, la gran diversidad de síntomas encontrados, conduce a plantear la hipótesis de sí además de los potyvirus reportados en esta investigación y sugeridos como asociados a enfermedades virales del tomate de árbol en Colombia por otros autores (Maldonado y Sánchez de Luque, 1984; Tamayo et al., 1999; Betancourth et al., 2003), era posible que otros virus podrían estar presentes simultáneamente en las plantas afectadas, más aún cuando la presencia de complejos virales asociados a enfermedades del tomate de árbol había sido reportada por Vizuete et al., (1990) e Eagles et al., (1994) en Ecuador y Nueva Zelanda, respectivamente. En este sentido, Jaramillo (2009) con base en análisis serológicos y moleculares de muestras con síntomas de Virosis, detectó la ocurrencia de al menos otros seis virus en cultivos de diferentes departamentos de Colombia, incluyendo miembros de los géneros Polerovirus, Cucumovirus, Alfamovirus, Tobamovirus, Tospovirus y Nepovirus. Ya que cada uno de estos virus presenta mecanismos de transmisión, tropismos y ciclos de infección particulares, es necesario plantear estudios futuros que permitan su separación, con el fin de evaluar el efecto que cada uno induce en el síndrome viral del tomate de árbol y las interacciones que entre ellos se presentan. Estudios de este tipo se han realizado con el complejo viral que afecta los cultivos de papa (PLRV, PVY, PVA, PVX, PVS y PYVV) (Arciniegas, 2003). Así por ejemplo, la infección simultánea de PVA y PVX pueden llegar a destruir completamente el cultivo de papa, aunque su infección individual generalmente no ocasiona pérdidas económicas (Arciniegas, 2003; Zapata, 2004). De manera similar, estudios realizados en la variedad de papa ICA-Puracé, determinaron que inoculaciones individuales de los virus PVX y PVY en plantas sanas no ocasionaron disminuciones significativas en el desarrollo y rendimiento del cultivo; sin embargo su inoculación conjunta, condujo a pérdidas del orden del 61% (Guerrero-Guerrero y Martínez-López, 1980).
La presencia de potyvirus en tejidos de tomate de árbol afectados con Virosis y confirmada mediante RT-PCR, indicó además que las cepas secuenciadas compartian niveles de identidad superiores al 99%, lo que sugería que hacen parte de la misma especie. Al realizar comparaciones de estas secuencias con las bases de datos moleculares, la especie más relacionada correspondió al CDV, aunque los niveles de identidad, no superaron el 70%. De igual manera, los análisis utilizando secuencias de los potyvirus PVY, PVA y TaMV previamente reportados en cultivos de tomate de árbol (Vizuete et al., 1990; Eagles 1994; Rajamäki et al., 1997) arrojaron bajos niveles de identidad con las secuencias del potyvirus detectado en este estudio, siendo las especies TaMV y PVA las más disímiles con valores de tan sólo el 36%. Esta situación se reflejó en el árbol filogenético, que agrupó en un clado los aislamientos obtenidos en tomate de árbol en Antioquia, separándolos claramente de CDV y de los otros potyvirus incluidos en el análisis. Estos resultados no permiten asociar a este potyvirus con una especie particular de este género, y en cambio conducen a plantear la hipótesis que este virus posiblemente represente una nueva especie, para la cual se propone el nombre Tamarillo leaf malformation virus (TaLMV). Sin embargo, la validez taxonómica de esta propuesta depende de la posibilidad de completar la secuenciación del genoma viral, ya que en la actualidad se acepta como base para la diferenciación de especies del genéro Potyvirus el porcentaje de identidad de la secuencias de todo el genoma (Adams et al., 2005). De esta forma, se acepta que los miembros de una especie potyviral comparten niveles de identidad de su ORF completo superiores al 76% y 82%, en la secuencia de nt y aa, respectivamente (Adams et al., 2005; Zheng et al., 2008). Así mismo es necesario que trabajos futuros logren la purificación del virus y su inoculación sobre plantas sanas de tomate de árbol, de manera que se evalúen los Postulados de Koch y se determine la sintomatología particular asociada a esta especie viral.
La complejidad en cuanto a sintomatología e infecciones simultaneas de diferentes grupos virales asociadas a la Virosis del tomate de árbol, hace necesario el emprender estudios relacionados con los mecanismos de transmisión de cada uno de estos virus, su efecto individual y en conjunto sobre las variedades de tomate de árbol disponibles en el mercado colombiano y mundial, y evaluar la utilidad de tratamientos para obtener material libre de virus, de tal manera que sea posible generar un conjunto de estrategias de control de esta enfermedad, tendientes a que nuevamente este cultivo sea una alternativa rentable para los pequeños agricultores y empresarios agrícolas de la región andina del país.
CONCLUSIONES
Esta investigación permitió un avance considerable en el conocimiento de la naturaleza de la Virosis del tomate de árbol que afecta los cultivos de esta fruta en Antioquia, identificándose por lo menos dos especies del género Potyvirus como asociados a la enfermedad: PVY, que ya había sido previamente reportado en Ecuador (Vizuete et al., 1990), y TaLMV, una posible nueva especie de este género. Las evaluaciones de incidencia basadas en el uso de anticuerpos universales para potyvirus detectaron la distribución generalizada de este grupo viral en cultivos afectados por Virosis en seis de las siete regiones de Antioquia muestreadas. Sin embargo, la presencia de otros grupos virales, dificultan el poder establecer una asociación clara entre los niveles de severidad de la enfermedad y la incidencia de potyvirus. Estas situaciones afectan en gran medida las recomendaciones dirigidas a los programas de manejo de la Virosis del tomate de árbol, ya que no se conocen los mecanismos de transmisión que operan en este cultivo para cada uno de los virus, ni el efecto de las interacciones entre éstos, que pudieran conducir al aumento de la agresividad de la infección.
AGRADECIMIENTOS
Esta investigación fue financiada por el proyecto COLCIENCIAS Código 1118-405-20317 Contrato 408-2007 y por la Universidad Nacional de Colombia, Sede Medellín a través del proyecto DIME BICENTENARIO 2008-2009: 20101007745. Se agradece a los productores de tomate de árbol del departamento de Antioquia que hicieron posible la colección de las muestras y a los integrantes del Laboratorio de Biología Celular y Molecular, por su colaboración durante el procesamiento de las muestras para las pruebas de ELISA.
BIBLIOGRAFÍA
ADAMS MJ, ANTONIW JF, FAUQUET CM. Molecular criteria for genus and species discrimination within the family Potyviridae. Arch. Virol. 2005;150:459-479.
[ Links ]ARCINIEGAS N. Técnicas de diagnóstico y evaluación de resistencia al virus del Amarillamiento de las Nervaduras de la papa (PYVV) en accesiones de la Colección Central Colombiana de Solanum phureja. (Tesis de Maestría). Bogotá: Facultad de Agronomía. Universidad Nacional de Colombia; 2003.
[ Links ]AYALA M, JARAMILLO M, COTES JM, GUTIÉRREZ P, GONZÁLEZ P, MARÍN M. Caracterización de una nueva especie de Potyvirus infectando cultivos de tomate de árbol en Antioquia. XXIX Congreso Nacional de Fitopatología ASCOLFI. Medellín, Colombia; 2009.
[ Links ]BETANCOURTH C, GOYES R, BRAVO DA. Caracterización biológica de un virus del tomate de árbol (Solanum betaceum (Cav.) Sendt) en el departamento de Nariño. Fitopatol. Colomb. 2003;27:7-10.
[ Links ]BRUNT A, CRABTREE K, DALLWITZ MJ, GIBSS AJ, WATSON L, ZURCHER EJ. Plant virus online: Descriptions and lists from the VIDE Database. (Citado Junio de 2009); Disponible: www.agls.uidaho.edu/ebi/vdie/refs.htm.
[ Links ]CRUZ J. Identificación de virus en Solanum betaceum. (Trabajo de grado). Bogotá: Facultad de Agronomía. Universidad Nacional de Colombia; 2005.
[ Links ]CUSPOCA J. Evaluación de virus de tomate de árbol (Solanum betaceum) en plantas indicadoras y su detección por PCR. (Trabajo de grado). Bogotá: Facultad de Agronomía. Universidad Nacional de Colombia; 2007.
[ Links ]EAGLES RM, GARDNER RC, FORSTER RLS. Incidence and distribution of six viruses infecting tamarillo (Cyphomandra betacea) in New Zealand. N. Z. J. Crop Hortic. Sci. 1994;22:453-458.
[ Links ]ELLIS P, STACE-SMITH R, BOWLER G, MACKENZIEL DJ. Production of monoclonal antibodies for detection and identification of strains of potato virus Y. Can. J. Plant Pathol. 1996;18:64-70.
[ Links ]FELSENSTEIN J. Confidence limits on phylogenies: an approach using the bootstrap. Evolution. 1985;39:783-791.
[ Links ]FLETCHER JD. New plant diseases records in New Zealand: Additional hosts of alfalfa mosaic virus and cucumber mosaic virus. New Zeal. J. Agr. Res. 1987;30:505-06.
[ Links ]GIBBS A, MACKENZIE A. A primer pair for amplifying part of the genome of all potyvirids by RT-PCR. J. Virol. Methods. 1997;63:9-16.
[ Links ]GIL JF, AYALA ML, MARÍN M, GONZÁLEZ, P. Identificación de potyvirus en cultivos de tomate de árbol (Solanum betaceum cav.) en Antioquia mediante detección serológica. Rev. Politécnica. 2009;5:112-120.
[ Links ]GOBERNACIÓN DE ANTIOQUIA. 2008. Anuario Estadístico Agropecuario Año 2007: Estadísticas agropecuarias por consenso. (Citado Junio de 2008); Disponible en: www.antioquia.gov.co.
[ Links ]GUERRERO-GUERRERO O, MARTINEZ-LÓPEZ G. Evaluación de pérdidas ocasionadas en la variedad de papa ICA-Puracé por los virus -Potato Virus X-, -Potato Virus Y- y -Potato Leafroll Virus-. Fitopatol. Colomb. 1980;9:3-40.
[ Links ]HSU YC, YEH TJ, CHANG YC. A new combination of RT-PCR and reverse dot blot hybridization for rapid detection and identification of potyviruses. J. Virol. Methods. 2005;128:54-60.
[ Links ]ICTV. Virus Taxonomy (Citado Febrero de 2010); Disponible en: http://www.ictvonline.org/virusTaxonomy.asp.
[ Links ]JARAMILLO M. Análisis serológico y molecular de virus asociados al cultivo de tomate de árbol (Solanum betaceum) en Colombia. (Tesis de Maestría). Medellín: Facultad de Ciencias. Universidad Nacional de Colombia; 2009.
[ Links ]JORDAN R, HAMMOND J. Comparison and differentiation of potyvirus isolates and identification of strain, virus, subgroup-specific and potyvirus group-common epitopes using monoclonal antibodies. J. Gen. Virol. 1991;72:25-36.
[ Links ]MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL. Observatorio agrocadenas Colombia. (Citado diciembre de 2006); Disponible en: http://www.docstoc.com/docs/3250497/MINISTERIO-DE-AGRICULTURA-Y-DESARROLLO-RURAL-OBSERVATORIO-AGROCADENAS-COLOMBIA-Cacao.
[ Links ]MALDONADO C, SÁNCHEZ DE LUQUE C. Caracterización, purificación y serología del virus de la nécrosis anular del tomate de árbol (Cyphomandra betacea send.). VI Congreso Asociación Colombiana de Fitopatología ASCOLFI. Santa Marta, Colombia; 1984.
[ Links ]MATTHEWS REF. Diagnosis of plant virus diseases. New Zealand: CRC Press; 1993.
[ Links ]OCHOA LJ, INSUASTI AM. Estudios agronómicos, fitopatológicos y entomológicos de frutales nativos andinos. Informe Técnico Annual-INIAP-. Ecuador: Instituto Nacional de Investigaciones Agropecuarias; 2005. p. 1-4.
[ Links ]RAJAMÄKI M, MERITS A, RABENSTEIN F, ANDREJEVA J, PAULIN L, KEKARAINEN T, et al. Biological, serological and molecular differences among isolates of potato A Potyvirus. Phytopathology 1997;88:311-321.
[ Links ]RIECHMANN JL, LAIN S, GARCIA JA. Highlights and prospects of potyvirus molecular biology. J. Gen. Virol. 1992;73:1-16.
[ Links ]RIECHMANN JL, CERVERA MT, GARCIA JA. Processing of the plum pox virus polyprotein at the P3-6K1 junction is not required for virus viability. J. Gen. Virol. 1995;76:951-956.
[ Links ]RODRÍGUEZ V. Identificación serológica y molecular de los agentes causales asociados a enfermedades virales del tomate de árbol (Solanum betaceum) en cultivos del municipio de Córdoba (Nariño). (Trabajo de grado). Pasto: Facultad de Ciencias Exactas y Naturales. Universidad de Nariño; 2010.
[ Links ]SALDARRIAGA A, BERNAL J. Virus en tomate de árbol (Cyphomandra betacea Sendt). XV Congreso Asociación Colombiana de Fitopatología ASCOLFI. Santafé de Bogotá, Colombia; 1994.
[ Links ]SALDARRIAGA A, BERNAL J, TAMAYO P. Virosis del tomate de árbol. En: Boletín técnico CORPOICA. Enfermedades del cultivo de árbol en Antioquia: Guía de reconocimiento y control. 1997.
[ Links ]SALDARRIAGA A, ZAPATA JL, BERNAL J. Evaluación de la transmisión del virus del tomate de árbol. Informe final (proyecto CORPOICA-PRONATTA). 1998.
[ Links ]SANCHEZ DE LUQUE C. Estudios de hospedantes de un nuevo virus en el tomate de árbol (Cyphomandra betacea Cav. Sendt). V Congreso Asociación Colombiana de Fitopatología ASCOLFI. Cali, Colombia; 1982a.
[ Links ]SÁNCHEZ DE LUQUE C. Presencia de virus en tomate de árbol (Cyphomnadra betacea (Cav) Sendt) en Colombia. V Congreso Asociación Colombiana de Fitopatología ASCOLFI. Cali, Colombia; 1982b.
[ Links ]SAÑUDO B, ORELLANA G. Un virus afectando tomate de árbol (Cyphomandra betacea) en Valle del Sibundoy, Putumayo. ASCOLFI Informa. 1989;15:24.
[ Links ]SAS INSTITUTE INC. The GLIMMIX Procedure - Junio de 2006; Disponible en: http://support.sas.com/rnd/app/da/glimmix.html.
[ Links ]SHUKLA DD, WARD CW, BRUNT AA. The Potyviridae. Wallingford: CAB International; 1994. p. 448.
[ Links ]SWOFFORD DL. PAUP: Phylogenetic analysis using parsimony (* and other methods). Version: 4. Sunderland, USA: Sinauer Associates. 1998.
[ Links ]TAMAYO PJ. Mosaico del tomate de árbol. ASCOLFI Informa. 1990;16:54-55.
[ Links ]TAMAYO PJ. Enfermedades virales del tomate de árbol (Cyphomandra betacea (Cav.) Sendt. en Colombia. ASCOLFI Informa. 1996;22:26-29.
[ Links ]TAMAYO PJ, ZAPATA JL, SALAZAR LF. El mosaico y la virosis del tomate de árbol en el altiplano norte de Antioquia. Rev. Fac. Nal. Agr. Medellín. 1999;52:781-785.
[ Links ]VAN-REGENMORTEL MHV, FAUQUET CM, BISHOP DHL, CARSTENS EB, ESTES MK, LEMON SM, et al. Virus taxonomy. Seventh report of the International Committee on taxonomy of viruses. San Diego: Academic Press; 2000.
[ Links ]VERCHOT J, KOONIN EV, CARRINGTON JC. The 35-kDa protein from the N-terminus of the potyviral polyprotein functions as a third virus-encoded proteinase. Virology. 1991;185:527-535.
[ Links ]VERCHOT J, CARRINGTON JC. Debilitation of plant potyvirus infectivity by P1 proteinase-inactivating mutations and restoration by second site modifications. J. Virol. 1995;69:1582-1590.
[ Links ]VIZUETE B, INSUASTI ML, OCHOA J, ELLIS YM. Biological and serological characterization of tree tomato virus diseases in Ecuador. INIAP-Ohio State University; 1990.
[ Links ]WARD CW, SHUKLA DD. Taxonomy of potyviruses: current problems and some solutions. Intervirology. 1991;32:269-296.
[ Links ]ZAPATA JL. Algunos aspectos sobre los virus de la papa en Colombia. En: CEVIPAPA (Centro Virtual de Investigación de la Cadena Agroalimentaria de la Papa). Memorias, I Taller Nacional sobre Patógenos del Suelo, Virus e Insectos Plagas diferentes a Tecia solanivora. Bogotá, Colombia. 2004.
[ Links ]ZAR J. H. Bioestatistical Analysis. 4 ed. New Jersey: Prentice Hall. 1999.
[ Links ]ZHENG L, WAYPER PJ, GIBBS AJ, FOURMENT M, RODONI BC, GIBBS MJ. Accumulating variation at conserved sites in Potyvirus genomes is driven by species discovery and affects degenerate primer design. PLoS ONE. 2008;3:1-8.
[ Links ]













