Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.16 n.1 Bogotá jan./abr. 2011
EFECTO DE LA ADMINISTRACIÓN INTRACEREBRAL DE MK-801 Y (-) NICOTINA EN LAS CONCENTRACIONES EXTRACELULARES DE GLU Y GABA EN EL NÚCLEO PEDUNCULOPONTINO DE RATAS
Effect of the Mk801 and (-) Nicotine Intracerebral Administration on Glu and Gaba Extracellular Concentration in the Pedunculopontine Nucleus from Rats
Lic. LISETTE BLANCO LEZCANO1, M.Sc., Ph. D.; Lic. LOURDES DEL CARMEN LORIGADOS PEDRE1, Ph. D.; Dra. MARÍA ELENA GONZÁLEZ FRAGUELA1; Dra. TERESA SERRANO SÁNCHEZ1; Dra. NANCY PAVÓN FUENTES1, Ph. D.; Dra. VIVIAN BLANCO LEZCANO2, M.Sc.; Lic. LILIANA FRANCIS TURNER3, M.Sc., Ph. D. 1 Centro Internacional de Restauración Neurológica (CIREN), Avenida 25 # 15805 e/ 158 y 160, Playa, CP: 11300, Ciudad Habana, Cuba. 2 Centro Comunitario de Salud Mental. Calle 1.a # 19606 e/ 10 y 12. Boyeros, Ciudad Habana, Cuba. 3 Grupo de Investigación Modelos Experimentales para las Ciencias ZooHumanas. Universidad del Tolima, 546. PBX: 264 42 19. Barrio Santa Elena, Ibagué, Tolima, Colombia. Autor de Correspondencia: Lisette Blanco Lezcano, Ph. D. Centro Internacional de Restauración Neurológica (CIREN). Departamento de Neurofisiología Experimental. Laboratorio de Biomodelos. Avenida 25 # 15805 e/158 y 160, Playa, CP: 11300, Habana, Cuba. Teléfono: (53) 7 271 68 41. Fax: (53) 7 273 24 20, lisette.blanco@infomed.sld.cu - lblanco@neuro.ciren.cu
Presentado 10 de septiembre de 2010, aceptado 15 de octubre de 2010, correcciones 3 de febrero de 2011.
RESUMEN
Aunque la manipulación farmacológica de los sistemas glutamatérgico y colinérgico se ha tratado en modelos experimentales de enfermedad de Parkinson (EP), pocos autores han realizado estudios de esta temática a nivel del núcleo pedunculopontino (NPP). El presente trabajo aborda los cambios en las concentraciones extracelulares (CE) de glutamato (Glu) y ácido δ-amino butírico (GABA) en el NPP de ratas hemiparkinsonizadas por inyección de 6-hidroxidopamina (6-OHDA) y sometidas a infusión local de MK-801 (10 µmol/L) o (-) nicotina (10 mM). La infusión se realizó mediante microdiálisis cerebral y la determinación de CE de neurotransmisores se realizó a través de cromatografía líquida de alta resolución acoplada a detección de fluorescencia. La infusión de MK-801 en el NPP produjo disminución significativa de CE de Glu (p< 0,01) y de GABA (p < 0,01) en ratas hemiparkinsonizadas y controles. La infusión de (-) nicotina mostró un incremento significativo de CE de Glu (p < 0,001) y GABA (p< 0,001) en el NPP de ratas hemiparkinsonizadas y controles. El bloqueo local de receptores NMDA por MK-801 facilita la interacción de Glu con sus receptores metabotrópicos que participan en mecanismos de inhibición presináptica y bloquean la liberación de neurotransmisores. Mientras que la infusión de nicotina en el NPP suma los efectos de activación de los receptores nicotínicos a los cambios conocidos en la neurotransmisión glutamatérgica y gabaérgica en el NPP en parkinsonismo. La infusión de fármacos glutamatérgicos y colinérgicos en el NPP, impone un reajuste a la neurotransmisión a este nivel que se añade a los cambios neuroquímicos asociados a denervación dopaminérgica.
Palabras clave: MK-801, nicotina, núcleo pedunculopontino, glutamato, GABA.
ABSTRACT
Although the pharmacological manipulation of the glutamatergic and cholinergic systems have been studied in animal models of Parkinson´s disease (PD), only some authors have done work on this topic at the pedunculopontine nucleus (PPN). The present work studied the changes in glutamate (Glu) and δ-aminobutyric acid (GABA) extracellular concentrations (EC) in the PPN from hemiparkinsonian rats by 6hydroxydopamine injection. The rats were locally perfused by MK-801 (10 µmol/L) or (-) nicotine (10 mM) solutions by cerebral microdyalisis. The biochemical studies were carried out through high performance liquid chromatography coupled to fluorescence detection. MK-801 infusion induced a significant decrease of Glu (p< 0.01) and GABA (p< 0.01) EC in PPN. On the other hand (-) nicotine infusion induced a significant increase of Glu (p< 0.001) and GABA (p< 0.001) EC in PPN from hemiparkinsonian rats. The local blockade of NMDA receptors by MK-801 infusion facilitates the interaction between Glu and their metabotropic receptors that take part in presynaptic inhibition mechanisms and interfere with neurotransmitters release. Meanwhile, the nicotine infusion sums the effects of nicotinic receptor activation with the glutamatergic and gabaergic neurotransmission changes produced in the PPN in the parkinsonian condition. The cholinergic and glutamergic drug infusion in PPN impose a new adjustment to the neurotransmition at this level that is added to the neurochemical changes associated to dopaminergic denervation.
Key words: MK-801, Nicotine, Pedunculopontine nucleus, Glutamate, GABA.
INTRODUCCIÓN
La enfermedad de Parkinson (EP) se caracteriza por la muerte de neuronas dopaminérgicas de la substantia nigra pars compacta (SNpc) que inervan el striatum (Obeso et al., 2000; Wolters y Bosboom, 2007). La terapia farmacológica más efectiva es la administración de L-dihydroxifenilalananina (L-DOPA) un precursor de dopamina que atraviesa la barrera hemotoencefálica e incrementa las concentraciones intracerebrales de este neurotransmisor (Cenci, 2007; Nagatsu y Sawada, 2009). A pesar de los notables avances en este campo, la terapia convencional basada en fármacos dopaminérgicos no frena ni enlentece de modo significativo el curso progresivo de la EP. Además, este curso se ve afectado por una serie de efectos adversos de naturaleza motora y psiquiátrica (Wolters y Bosboom, 2007). Adicionalmente se conoce que aunque la EP es una enfermedad predominantemente motora y dopaminérgica, también se afectan otros sistemas de neurotransmisores (colinérgico, serotoninérgico, glutamatérgico, gabaérgico, noradrenérdico y peptidérgico; Linazasoro et al., 2009). El carácter multisistémico de esta entidad puede ser responsable de la aparición de ciertos síntomas y signos resistentes a la terapia dopaminérgica (Linazasoro et al., 2009).
Se conoce que la muerte de células de la SNpc resulta en una serie de cambios neurofisiológicos que conducen a hiperactividad de la “vía indirecta” de los ganglios basales (GB) resultando en excitación patológica del núcleo subtalámico (NST; Hamani et al., 2003; Parent y Parent, 2007). El incremento en la actividad subtalámica conduce a un aumento en la liberación de glutamato (Glu) en los núcleos eferentes de los GB (globus pallidus interno, GPi; susbtantia nigra pars reticulata, SNpr) los cuales expresan ácido γ-aminobutírico (GABA; Obeso et al., 2000). Al mismo tiempo se incrementa la liberación de Glu en el núcleo pedunculopontino (NPP) conectado recíprocamente con el NST (Breit et al., 2001; Groenewegen y Dongen, 2007).
Aunque se conoce la participación del NPP en la fisiopatología de la EP, el interés por esta estructura ha sido creciente a partir de la reciente demostración del beneficio terapéutico de la estimulación de este núcleo para tratar los síntomas axiales de la EP, refractarios a otros tratamientos quirúrgicos (Lozano y Snyder, 2008; Zrinzo et al., 2008). El NPP envía proyecciones colinérgicas y glutamatérgicas a la SNpc (Jenkinson et al., 2009). Al mismo tiempo este núcleo proyecta a la red de interneuronas de la médula espinal que a su vez hacen sinapsis sobre motoneuronas que inervan la musculatura axial (Lee et al., 2000). La distribución anatómica y funcional de estas proyecciones hace del NPP un núcleo de relevo de la función motora esencial para comprender los trastornos motores asociados a la EP (Ferraye et al., 2009).
Asimismo se ha estudiado en modelos experimentales la participación del NPP en circuitos relacionados con la conducta de reforzamiento y recompensa tomando en cuenta sus eferencias colinérgicas al área tegmental ventral la cual forma parte del sistema mesolímbico, esencial en el procesamiento de este tipo de información (Corrigall et al., 2001). Otros autores han evaluado el efecto de la activación de receptores kainato expresados en neuronas colinérgicas del NPP sobre el desarrollo de fases de sueño REM en roedores (Bandyopadhya et al., 2006).
La manipulación farmacológica de los sistemas glutamatérgico y colinérgico ha sido un tema abordado en modelos experimentales de EP con vistas a definir alternativas farmacológicas encaminadas a la neuroprotección de células dopaminérgicas (Koutsilieri y Riederer, 2007; Singh et al., 2007; Youdim et al., 2007). Así, se ha evaluado la disminución de la hiperactividad glutamatérgica a través de la administración sistémica o intracerebral de antagonistas de receptores glutamatérgicos N-metil-D-aspartato (NMDA) (Hallet y Standaert, 2004).
Al mismo tiempo se ha señalado el papel neuroprotector potencial de nicotina sobre la actividad dopaminérgica, el cual puede cursar a través de mecanismos dependientes e independientes de receptores nicotínicos centrales (Quik, 2004; Quik et al., 2007).
Este efecto neuroprotector ha sido estudiado tanto en sujetos fumadores como en animales de experimentación (Riggs, 1992; Quik et al., 2007).
Conociendo el carácter multisistémico de la EP en cuanto a los diferentes sistemas de neurotransmisores que modifican su funcionamiento y los cambios en el funcionamiento del NPP en modelos experimentales de EP, el propósito del presente trabajo fue evaluar el efecto de la administración intracerebral de un antagonista no competitivo de receptores glutamatérgicos NMDA, MK-801 y de (-) nicotina sobre las concentraciones extracelulares (CE) de Glu y GABA en el NPP de ratas hemiparkinsonizadas por inyección de la neurotoxina 6-hidroxydopamina (6-OHDA) en la SNpc.
MATERIALES Y MÉTODOS
SUJETOS EXPERIMENTALES
El estudio fue realizado en ratas macho adultas Wistar Rattus norvergicus pesando entre 200 a 250 g suministrados por el centro para la producción de animales de laboratorio (CENPALAB, Habana, Cuba). Se mantuvieron tres ratas por caja durante todo el experimento. Los animales fueron mantenidos con ciclos de 12 horas de luz-oscuridad así como acceso libre a agua y alimentos. Durante toda la investigación, se realizaron esfuerzos máximos para minimizar sufrimiento animal y el trabajo experimental cumplió con las guías para el cuidado, uso y reproducción de animales de laboratorio (Guías CENPALAB, 2000). Los experimentos fueron aprobados por el comité de Ética del CIREN y cumplieron además con las normas dictadas por el National Institute of Health Guide for the Care and Use of laboratory Animals (NIH Publications # 80-23).
PROCEDIMIENTO QUIRÚRGICO
La mesa quirúrgica y el equipo de cirugía estereotáctica fueron desinfectados con soluciones alcohólicas y acuosas de Betadina. Las ratas fueron anestesiadas por medio de la administración intraperitoneal (i.p) de una solución de hidrato de cloral (420 mg/kg de peso) y seguidamente se colocaron en un equipo de cirugía estereotáctica para roedores (Stoelting, USA). Cada rata recibió 3 µL de una solución que contenía 8 µg de 6-OHDA (Sigma, St. Louis, USA) en 3 µL de solución salina fisiológica al 0,9% (SSF) + 0,5 mg/mL de ácido ascórbico, a razón de 1 µL/min. La inyección se realizó en las coordenadas (mm) correspondientes a la SNpc derecha de acuerdo al atlas de Paxinos y Watson: AP = –4,9, ML = 1,7, DV = 8,1 (referentes a Bregma; Paxinos y Watson, 1998). La aguja de la jeringuilla fue mantenida en el sitio durante tres minutos después de finalizada la inyección para prevenir el reflujo de solución de 6-OHDA. Se administró SSF con el mismo volumen y en las mismas coordenadas para conformar un grupo control de ratas con lesión falsa.
Se organizaron dos diseños experimentales independientes para la infusión de las siguientes drogas: MK-801 (Sigma, St. Louis, USA) y (-) nicotina (Sigma, St. Louis, USA). En cada diseño se incluyeron tres grupos experimentales: ratas sanas (n = 15), ratas con lesión de la SNpc por inyección de 6-OHDA (n=14) y ratas con falsa lesión de la SNpc (n = 14). Las ratas con lesion de la SNpc por inyección de 6-OHDA y las lesionadas falsas fueron aleatoriamente asignadas a cada uno de los diseños experimentales.
ACTIVIDAD ROTATORIA
Para comprobar la efectividad de la lesión neurotóxica, un mes después de la inyección de 6-OHDA se estudió la actividad rotatoria inducida por D-anfetamina (5 mg/kg peso, i.p) de acuerdo al procedimiento descrito previamente (Blanco et al., 2008). En el estudio sólo se incluyeron ratas que mostraron como mínimo siete giros completos ipsilaterales a la lesión en 1 min lo que se corresponde con 90% aproximadamente de denervación dopaminérgica (datos no mostrados). Esta variable y el sentido de giro se determinaron en 90 minutos mediante un multicontador electrónico LE 3806 acoplado a sensores LE 902 (PanLab, Barcelona, España).
CÁNULAS DE MICRODIÁLISIS
Las cánulas de microdiálisis empleadas en el estudio fueron similares a las descritas por Robinson y Camp, 1991. Se emplearon para su construcción tubos de acero inoxidable (DI: 0,12 mm DE: 0,22 mm) (Small Parts Inc., USA) y membrana de diálisis, esta última a base de un copolímero de poliacrilonitriclo (Hospal Industrie Meyzie, Lyon, France) con poro de corte de 41 KDa.
MICRODIÁLISIS in vivo
El implante quirúrgico de la cánula guía se realizó un mes después de la inyección de 6OHDA. Empleando técnicas estereotácticas estándar una cánula guía de acero inoxidable fue cementada al cráneo en las coordenadas (mm) estereotáxicas correspondientes al NPP derecho ipsilateral a la inyección de 6-OHDA: AP = -8,00, ML = 1,9, DV = 4,82 (ajustado a la longitud de la membrana de diálisis).
A las ratas se les permitió recuperarse y tres días después de la cirugía de implante de la cánula guía, una cánula de microdiálisis fue gentilmente introducida a través de la cánula guía después de retirar el estilete protector. La rata se acopló a un sistema de bomba de infusión de microdiálisis cerebral (CMA 100, CMA Microdialysis, Estocolmo, Suecia) y las cánulas se infundieron continuamente con una solución de líquido cefalorraquídeo artificial (LCRa): NaCl 125 mM, KCl 2,5 mM, NaH2PO4 0,5 mM, Na2HPO4 5 mM, MgCl. 6H2O 1 mM, CaCl2 1,2 mM, ácido ascórbico 1,2 mM, pH 7,4 -7,6 a un flujo de 2 µL/min. Los experimentos se hicieron con las ratas despiertas y en movimiento libre, de acuerdo a los pasos descritos en la literatura (Blanco et al., 2009).
Después de un período de estabilización de 2 h los dializados fueron recolectados manualmente cada 20 minutos. Previo al inicio de la infusión de las drogas estudiadas se recolectaron seis dializados. El valor promedio de las concentraciones de aminoácidos neurotransmisores en estos dializados se consideró como valor basal al tiempo cero. A continuación el fluido de perfusión fue cambiado a LCRa conteniendo MK-801 (10 µmol/L) o (-) nicotina (100 µM; 10 mM) durante 1h y los dializados se recolectaron igualmente cada 20 minutos durante este período. Finalmente, el fluido fue cambiado a LCRa sin fármacos y los dializados fueron recolectados cada 20 minutos durante 2 h. En todos los experimentos de microdiálisis las muestras fueron inmediatamente conservadas a -80 °C para su análisis posterior.
EVALUACIÓN BIOQUÍMICA
Las concentraciones de aminoácidos en los dializados fueron determinadas por cromatografía líquida de alta resolución (HPLC, del inglés high performance liquid crhomatography) acoplado a un detector de fluorescencia y usándose derivatización con o-ftaldialdehído (OPA).
Se mezclaron 10 µL de muestra con 10 µL del agente derivatizante OPA (10 mM de OPA disueltos en buffer de tetraborato de sodio 0,1 mol/l que contenía 77 mM de ácido 3-mercaptopropiónico y metanol 10% pH 9,3). La mezcla se agitó en vórtex durante 15 s y la reacción se detuvo con ácido acético 5% a los 45 s. De esta mezcla se inyectaron 20 µL al cromatógrafo con una jeringuilla Hamilton. Los aminoácidos derivatizados se hicieron pasar por una columna de fase inversa (HR-80, de 8 cm de longitud y 4,6 mm de diámetro interno, ESA), con una precolumna de fase estacionaria similar, mediante una bomba cromatográfica isocrática (Philips PU 4100) y se detectaron mediante un detector de fluorescencia con λ excitación = 340 nm y λ emisión = 460 nm (Philips PU 4027). El registro de los cromatogramas se realizó mediante el programa CHROMATEPC versión 4.24 (Philips). Para la separación de los aminoácidos se utilizó una fase móvil compuesta por NaH2PO4 0,1 mol/l y metanol 20%.
ESTUDIOS HISTOLÓGICOS
Al concluir los estudios in vivo, las ratas recibieron una dosis mayor de hidrato de cloral (i.p.; 480 mg/kg) y se perfundieron a través de la aorta ascendente con 500 mL de NaCl 0,9% y 500 mL de una solución fijadora (paraformaldehído 4% en buffer fosfato de sodio 0,1 M pH 7,4). Los cerebros fueron removidos y se obtuvieron cortes coronales con un vibrátomo con el propósito de verificar la localización de la cánula de microdiálisis cerebral. Las ratas con cánulas fuera del área de estudio o que mostraran hemorragia intracraneal fueron excluidas del estudio.
ANÁLISIS DE DATOS
Se evaluaron distribución normal y homogeneidad de varianzas de los datos por medio de las pruebas de Kolmogorov-Smirnov y de Bartlett respectivamente. Para cada tratamiento farmacológico por separado se realizó la comparación de CE de Glu y GABA entre grupos experimentales y tiempos de recolección de los dializados mediante análisis de varianza bifactorial con medidas repetidas seguido de una prueba de Bonferroni. Se trabajó con un nivel de significación de 0,05 y para el análisis de los datos se empleó el software SPSS v. 15.1 para Windows. Los datos son presentados como X ± EEM
RESULTADOS
ESTUDIO HISTOLÓGICO
El trazo de las cánulas guías se verificó en la región del NPP situado en la parte dorsolateral del tegmento mesopontino. Se localizó el pedúnculo cerebeloso superior como guía anatómica en cortes coronales y seguidamente se siguió la huella de la cánula de microdiálisis en sentido anteroposterior desde su emergencia hasta que dejó de visualizarse la misma (Fig. 1A; Fig. 1B). Fueron eliminadas del estudio dos ratas en las que se observaron evidencias de daño morfológico provocado por el procedimiento de implante de la cánula guía.
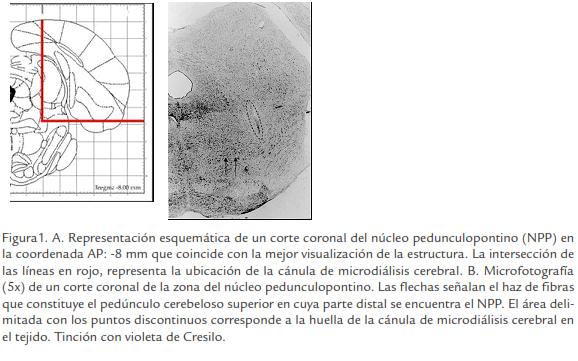
EFECTO DE LA INFUSIÓN INTRACEREBRAL DE MK-801
La infusión de MK-801 (10 µM) produjo disminución significativa de CE de Glu (F(9, 186)=11,2 p< 0,01) y de GABA (F(9, 135) = 9,22 p< 0,01) en el NPP tanto en el grupo de ratas con lesión de la SNpc como en los grupos controles (Fig. 2A; Fig. B). Esta disminución comenzó a partir de los primeros 20 minutos de iniciada la infusión del fármaco y se prolongó durante los restantes 40 minutos que duró la infusión en los tres grupos experimentales. Los grupos control recuperaron paulatinamente los valores de sus CE de Glu y GABA mientras que en el grupo de ratas hemiparkinsonizadas estas concentraciones se conservaron significativamente disminuidas (p< 0,01) 120 minutos después de finalizada la infusión del fármaco.
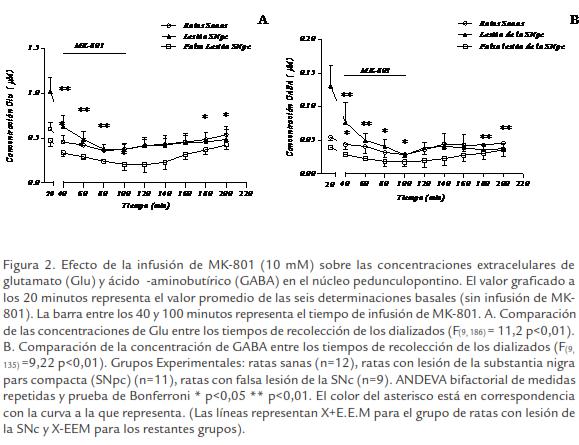
EFECTO DE LA INFUSIÓN INTRACEREBRAL DE (-) NICOTINA
La infusión de (-) nicotina (100 µM) en el NPP promovió un incremento ligeramente significativo de las CE de Glu (p< 0,01) y GABA (p< 0,05) en el grupo de ratas hemiparkinsonizadas. En los grupos control no se observaron cambios significativos en el comportamiento de esta variable para ninguno de los neurotransmisores de interés (p>0,05). Por otra parte la infusión de (-) nicotina (10 mM) produjo incremento sostenido y significativo de CE de Glu (F(6, 162) = 25,67 p< 0,001) y GABA (F(9, 156) = 18,75 p< 0,001) en el NPP con respecto a CE basales antes de infundir el fármaco en todos los grupos experimentales (Fig. 3A; Fig. B). Adicionalmente el incremento de CE de Glu y GABA en el NPP en el grupo de ratas con lesión de la SNpc fue significativamente diferente y de mayor magnitud con respecto a los grupos control (Para Glu: p< 0,001, para GABA: p< 0,01). Las CE de Glu se incrementaron dos veces y mantuvieron este comportamiento hasta 120 minutos después de concluida la infusión de (-) nicotina. Por su parte las CE de GABA mostraron una ligera tendencia a la recuperación aunque permanecieron incrementadas 60 minutos después finalizada la infusión del fármaco.
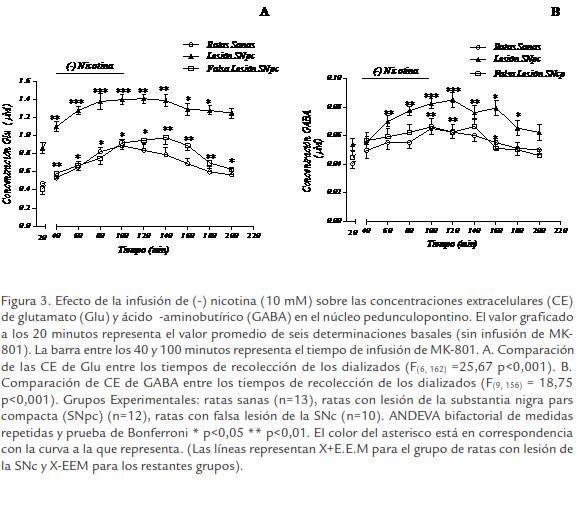
DISCUSIÓN
Los presentes resultados revelan el efecto de la infusión intracerebral de MK-801 y (-) nicotina en el NPP de ratas. La infusión del antagonista glutamatérgico promueve una disminución significativa de las CE de los aminoácidos neurotransmisores mientras que la infusión del agonista colinérgico induce un incremento significativo y sostenido de las CE de dichos aminoácidos a nivel del NPP. Estos cambios se enfatizan en las ratas hemiparkinsonizadas por inyección intracerebral de 6-OHDA.
CE DE GLU Y GABA EN EL NPP BAJO EL EFECTO DE LA INFUSIÓN INTRACEREBRAL DE MK-801
Numerosos trabajos han abordado el efecto de la administración sistémica de antagonistas de receptores glutamatérgicos con vistas a revertir el incremento del tono glutamatérgico presente en modelos experimentales de EP (Bezards y Gross, 1998). No obstante, no se conocen trabajos previos que aborden el efecto del bloqueo local de la neurotransmisión glutamatérgica sobre las CE de Glu y GABA en el NPP, por lo cual nuestros hallazgos constituyen un aporte al conocimiento de la neurotransmisión en esta estructura en el modelo de 6-OHDA.
En el NPP convergen las proyecciones subtálamo pontinas y nigro pontinas que expresan diferentes tipos de receptores glutamatérgicos y gabaérgicos (Erro y Giménez-Amaya, 1999). La literatura señala la presencia de receptores glutamatérgicos metabotrópicos (mGluR) del grupo III con localización presináptica en las terminales antes mencionadas (Fig. 4A; Marino et al., 2003). La infusión de MK-801 en el NPP bloquea receptores glutamatérgicos del tipo NMDA que se expresan en este núcleo. En esta condición experimental el Glu liberado por las terminales subtálamopontinas actúa fundamentalmente sobre los receptores de localización presináptica descritos anteriormente.
Este grupo de receptores glutamatérgicos participa en mecanismos de inhibición presináptica cuya puesta en marcha bloquea o reduce significativamente la transmisión sináptica glutamatérgica excitatoria (Mitchell y Silver, 2000). Se ha señalado, que la activación de mGluR del grupo III produce inhibición de canales de Ca++ dependientes de voltaje cuya activación es indispensable para la exocitosis de neurotransmisor (Marino et al., 2002, 2003, Valenti et al., 2003a). En consecuencia se produce disminución drástica de la liberación de Glu en la terminal sináptica a nivel pontino (Valenti et al., 2003b). A este efecto se añade la evidencia que estos receptores se comportan como heteroceptores bloqueando simultáneamente la liberación de GABA y por ende la transmisión gabaérgica inhibitoria en el sistema nervioso central (Marino et al., 2003). Alternativamente, en la disminución de las CE de Glu en el NPP, posterior a la infusión local de MK-801, pudiera participar el efecto de este fármaco mejorando la recaptura del neurotransmisor por una regulación al alza del transportador de los aminoácidos excitatorios (Boeck et al., 2005). En consecuencia, menor cantidad de Glu escaparía de la hendidura sináptica y alcanzaría el espacio extracelular donde está ubicada la cánula de microdiálisis cerebral.
En el caso de ratas hemiparkinsonizadas que poseen un desbalance entre sus sistemas de neurotransmisores y cambios en la actividad de receptores dopaminérgicos, el bloqueo de receptores glutamatérgicos NMDA en el NPP, añade nuevas modificaciones a la neurotransmisión a nivel del tegmento mesopontino (Fig. 4B; Fig. 4C). La actividad dopaminérgica y de sus receptores modula de forma muy fina el funcionamiento de mGluR, a partir de vías de señalización intracelular comunes a ambos neurotransmisores (Wittman et al., 2002).
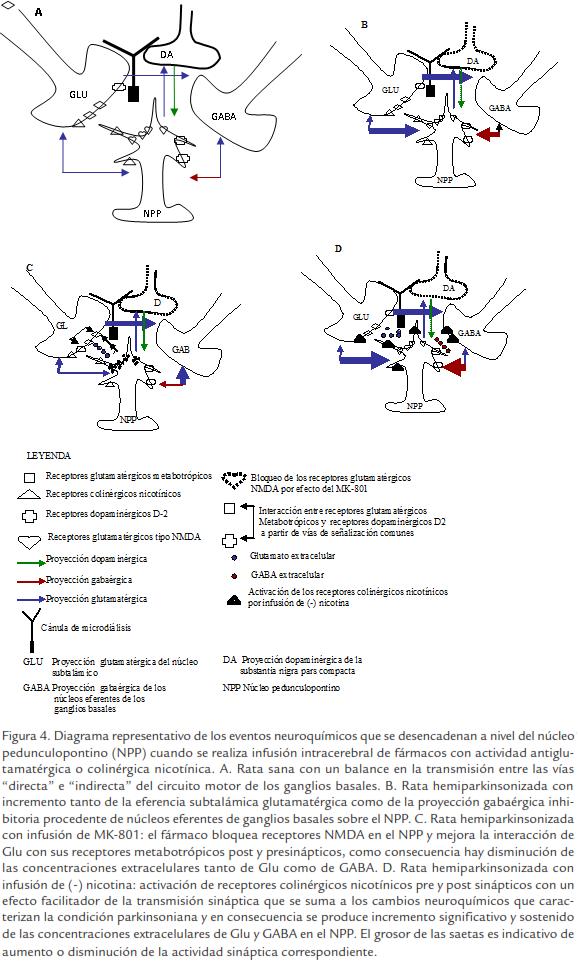
Los resultados publicados atribuyen cambios en la farmacología de mGluR siguiendo la deficiencia de DA (Rouse et al., 2000; Valenti et al., 2003b). Para ratas hemiparkinsonizadas, la actividad del Glu sobre sus receptores mGluR presinápticos localizados en la sinapsis NST-NPP, puede verse potenciada por la regulación al alza de receptores dopaminérgicos D2 expresados en esta misma terminal (Shen et al., 2003). Este subtipo de receptor dopaminérgico produce inhibición de la cascada dependiente del AMPc, lo que interfiere a su vez con la activación de determinadas proteínas quinasas encargadas de fosforilar las subunidades proteicas de mGluR (Neve et al., 2004). En estado desfosforilado se produce acoplamiento del receptor mGluR con la proteína G correspondiente y activación de sus sistemas efectores, entre ellos determinados sustratos proteicos que inactivan el proceso de exocitosis de neurotransmisor (Sánchez-Prieto et al., 1996).
CE DE GLU Y GABA EN EL NPP BAJO EL EFECTO DE LA INFUSIÓN INTRACEREBRAL DE (-) NICOTINA
El sistema colinérgico en general ha sido muy bien estudiado en la búsqueda de alternativas farmacológicas que restablezcan el balance fisiológico entre acetil colina y DA que resulta dramáticamente comprometido en condición parkinsoniana (Meshul et al., 2002). Con la nicotina en particular, diferentes estudios han evaluado su posible papel neuroprotector sobre la actividad dopaminérgica a partir de la menor incidencia de EP entre sujetos fumadores (Picciotto y Zoli, 2008). Así se ha postulado que en modelos experimentales de EP la administración sistémica de esta sustancia, puede activar múltiples mecanismos que aislados o actuando de forma concomitante, ejercen efecto neuroprotector que enlentece o detiene el proceso de muerte de células dopaminérgicas asociado a esta entidad (Quik et al., 2007). Sin embargo, no existen referencias anteriores del efecto de la administración intracerebral de nicotina a nivel del NPP sobre la neurotransmisión glutamatérgica y gabaérgica en el modelo de hemiparkinsonismo en ratas, por lo que nuevamente los presentes resultados constituyen el primer reporte al respecto. Nuestros resultados avalan un incremento significativo de CE de Glu y GABA en el NPP asociado a la infusión de (-) nicotina a este nivel, incremento que es de mayor magnitud en ratas hemiparkinsonizadas.
El NPP localizado en la parte dorsolateral del tegmento pontomesencefálico está formado por una parte compacta constituida por neuronas predominantemente colinérgicas y una parte dissipata constituida por neuronas colinérgicas y glutamatérgicas (Anderson et al., 2010). En ambas porciones se expresan receptores colinérgicos nicotínicos, cuya activación por el ligando ((-) nicotina) modula de forma muy fina la actividad del propio sistema colinérgico y de otros como el glutamatérgico y el gabaérgico que se expresan igualmente a este nivel (Segovia et al., 2009). Acetil colina o nicotina actuando a través de receptores colinérgicos nicotínicos centrales inducen despolarización neuronal y cambio en las señales de calcio intracelulares (Picciotto y Zoli, 2008). La magnitud de este cambio es determinante en el incremento o disminución de la excitabilidad neuronal y en la puesta en marcha de cascadas neuroproetectoras o excitotóxicas (Giniatullin et al., 2005; Picciotto y Zoli, 2008).
El incremento de CE de Glu y GABA inducido por la administración intracerebral de (-) nicotina en el presente estudio, concuerda con lo señalado por otros autores que han descrito este mismo efecto en hipocampo (Paradiso y Steinbach, 2003; Bancila et al., 2009). La literatura sugiere que (-) nicotina modifica la actividad del sistema nervioso actuando sobre sus receptores nicotínicos pre sinápticos y por ende modulando procesos de liberación de neurotransmisor (Wonnacott, 1997). Los subtipos específicos de receptores nicotínicos involucrados en mejorar la liberación de neurotransmisores excitatorios e inhibitorios difieren (Wonnacott, 1997; Wonnacott, 2005). Estudios recientes han sustentado que los procesos de desensibilización de los subtipos de receptores nicotínicos expuestos a altas concentraciones de (-) nicotina puede resultar en un cambio más o me-nos fino en el balance entre inhibición y excitación de redes neurales (Welsby et al., 2006). El NPP está conectado de forma recíproca a través de vías (lazos) monosinápticas con el NST y los núcleos eferentes de los GB de los cuales recibe una proyección glutamatérgica y gabaérgica respectivamente (Breit et al., 2001). Estas relaciones anatomofuncionales pueden justificar que un incremento de la actividad nicotínica en el NPP se transmita hacia el NST y el complejo GPe/SNpr y de regreso al NPP con una mayor liberación de Glu y GABA sobre este (Fig. 4B).
Por otra parte se conoce que ratas hemiparkinsonizadas muestran incremento significativo de CE de Glu y GABA en el NPP (Blanco et al., 2009). Este incremento ha sido explicado por hiperactividad de la “vía indirecta” del circuito motor y de la proyección gabaér gica desde los núcleos eferentes de GB al NPP (Blanco et al., 2009). Otros autores han señalado incremento en la tasa de descarga de neuronas pontinas de ratas hemiparkinsonizadas (Breit et al., 2001; Zhang et al., 2008). Estos cambios neuroquímicos junto a la organización anatomofuncional de las proyecciones aferentes y eferentes del NPP pueden en parte explicar el incremento sostenido y de mayor magnitud de las CE de Glu y GABA en el NPP de ratas hemiparkinsonizadas sometidas a la infusión de (-) nicotina (Fig. 4D). A estos efectos pudiera añadirse el papel estimulador de (-) nicotina sobre la liberación de neurotransmisor y transmisión sináptica en general (Picciotto y Zoli, 2008).
Este incremento contrasta con la disminución de CE de Glu y GABA en el NPP de ratas hemiparkinsonizadas tratadas sistémicamente con (-) nicotina publicada por nuestro grupo (Blanco et al., 2008). La administración sistémica de (-) nicotina se realizó antes de la inyección intracerebral de 6-OHDA y en el curso del mes que se describe como tiempo mínimo para obtener el efecto neurotóxico máximo e irreversible de esta sustancia (Blanco et al., 2008). En ese caso se atribuyó la disminución al efecto en neuroprotector general de (-) nicotina no dependiente de la activación de receptores colinérgicos nicotínicos (Quik et al., 2007). Este efecto neuroprotector sobre células dopaminérgicas de la SNpc parece haber atenuado la disfunción que se establece en los sistemas glutamatérgico y gabaérgico en condición parkinsoniana con una repercusión particular sobre la actividad de estos neurotransmisores a nivel del NPP (Blanco et al., 2008).
CONCLUSIONES
La convergencia en el NPP de proyecciones dopaminérgicas nigrales, glutamatérgicas subtalámicas y gabaérgicas procedentes de núcleos eferentes de GB facilita la interacción funcional entre estos y otros sistemas de neurotransmisores (Rolland et al., 2009). Esta interacción funcional se pierde en condición parkinsoniana al igual que sucede en elstriatum donde convergen múltiples sistemas de neurotransmisores. La infusión de fármacos glutamatérgicos y colinérgicos en el NPP impone un nuevo ajuste a la neurotransmisión a este nivel que se añade a los cambios neuroquímicos asociados a la denervación dopaminérgica.
AGRADECIMIENTOS
A las siguientes instituciones: Centro Internacional de Restauración Neurológica, Cuba Centro Comunitario de Salud Mental, Habana, Cuba, Universidad del Tolima.
BIBLIOGRAFÍA
ANDERSON DR, BJÖRNSSON E, BERGQUIST F, NISSBRANDT H. Motor activity-induced dopamine release in the substantia nigra is regulated by muscarinic receptors. Exp Neurol. 2010;221:251-259.
[ Links ]BANCILA V, CORDEIRO JM, BLOC A, DUNANT Y. Nicotine-induced and depolarisation-induced glutamate release from hippocampus mossy fibre synaptosome: two distinct mechanisms. J Neurochem. 2009;110:570-580.
[ Links ]BANDYOPADHYA R, DATTA S, SAHA S. Activation of pedunculopontine tegmental protein kinase A: Mechanism for rapid eye movement sleep generation in the freely moving rat. J Neuroschem. 2006;26(35):8931-8942.
[ Links ]BLANCO L, LORIGADOS L, MARTÍNEZ L, PAVÓN N, SERRANO T, GONZÁLEZ ME, ROCHA L. Alterations in the density of gabaergic BDZ, mu opioid and muscarinic receptors of the pedunculopontine nucleus in a 6-hydroxydopamine hemiparkinsonian rat model. J Bio Res - Thessaloniki. 2008;9:35-43.
[ Links ]BLANCO L, LORIGADOS L, OROZCO S, ROCHA L, PAVÓN N, GONZÁLEZ ME, BLANCO V, FRANCIS L. Changes in Glu and GABA extracellular concentrations and cell death process in the pedunculopontine nucleus of hemiparkinsonian rats. J Bio Res-Thessaloniki. 2009;11:3-11.
[ Links ]BEZARDS E, GROSS CH. Compensatory Mechanisms in Experimentl and Human parkinsonism: towards a dynamic approach. Prog Neurobiol. 1998;55:93-116.
[ Links ]BOECK CR, KROTH E, BRONZATTO MJ, JARDIM FM, SOUZA DO, VENDITE D. Effects of glutamate transporter and receptors ligands on neuronal glutamate uptake. Neurosc Res. 2005;53:77-83.
[ Links ]BREIT S, BOUALI-BENAZZOUZZ R, BENABID A, BENAZZOUZZ A. Unilateral lesion of the nigrostriatal pathway induces an increase of neuronal activity of the pedunculopontine nucleus, which is reversed by the lesion of the subthalamic nucleus in the rat. Eur J Neurosci. 2001;14:1833-1842.
[ Links ]CENCI A. L-DOPA-induced dyskinesia: cellular mechanisms and approaches to treatment. Park - Rel Disord. 2007;13:S263-268.
[ Links ]CORRIGALL W, COEN K, ZHANG J, ADAMSON K. GABA mechanisms in the pedunculopontine tegmental nucleus infleunce particular aspects of nicotina-self administration selectively in the rat. Psychopharmacology. 2001;158:190-197.
[ Links ]ERRO E, GIMÉNEZ-AMAYA JM. El núcleo tegmental pedunculopontino. Anatomía, consideraciones funcionales e implicaciones fisiopatológicas. An Sist Sanit Navar. 1999;22(2):189-201.
[ Links ]FERRAYE MU, DEBB, FRAIX V, GOETZ L, ARDOUIN C, YELNIK J, LAGRANGEHENRY C, SEIGNEURET E, PIALLAT B, KRACK P et al. Effects of pedunculopontine nucleus areas stimulation on gait disorders in Parkinson s disease. Brain. 2009 1(1-10). doi:10.1093/brain/awp229
[ Links ]GINIATULLIN R, NISTRI A, YAKEL JR. Desensitization of nicotinic ACh receptors: shaping cholinergic signalling. Trends Neurosci. 2005;28(7):371-378.
[ Links ]GROENEWEGEN HJ, DONGEN YC. Role of the basal ganglia. En. Wolters, Van Laar, Berendse, editors. Parkinsonism and Related Disorders. Amsterdam: VU University Press; 2007. p. 21-51.
[ Links ]GUÍAS CENPALAB. Guías para el cuidado, uso y reproducción de animales de laboratorio. Centro para la Producción de Animales de Laboratorio (CENPALAB, Habana, Cuba) Ed. 02-2000:100.
[ Links ]HALLET PJ, STANDAERT DG. Rationale for and use of NMDA receptor antagonists in Parkinson s disease. Pharmacol Therap. 2004;102:155-174.
[ Links ]HAMANI C, SAINT-CYR JA, FRASER J, KAPLIT M, LOZANO A. The subthalamic nucleus in the context of movement disorders. Brain. 2003;7:1-17.
[ Links ]JENKINSON N, NANDI D, MUTHUSAMY K, RAY JN, GREGORY R, STEIN JF, AZIZ TZ. Anatomy, Physiology and Pathophysiology of the Pedunculopontine Nucleus. Movement Disord. 2009;24(3):319-328.
[ Links ]KOUTSILIERI E, RIEDERER P. Excitotoxicity and new antiglutamatergic strategies in Parkinson s disease and Alzheimer s disease. Parkinsonism Relat D. 2007;13:S329-332.
[ Links ]LEE SM, RINNE JO, MARSDEN CD. The pedunculopontine nucleus: Its role in the genesis of movement. Yosei Med J. 2000;41(2):167-184.
[ Links ]LINAZASORO G, SESAR A, VALLDERIOLA F, COMPTA Y, HERRERO MT, MATNEZ-CASTRILLO JC, et al. Neuroprotección en la enfermedad de Parkinson: análisis a través de la metodología de informadores clave. Neurología. 2009;24(2):113-124.
[ Links ]LOZANO A, SNYDER B. Deep Brain Stimulation for Parkinsonian gait disorders. J Neurol. 2008;255 (Suppl. 4):30-31.
[ Links ]MARINO MJ, AWAD H, POISIK O, WITTMANN M, CONN PJ. Localization and physiological roles of metabotropic glutamate receptors in the direct and indirect pathways of the basal ganglia. Amino Acids. 2002;23:185-191.
[ Links ]MARINO MJ, VALENTI O, CONN PJ. Glutamate receptors and Parkinson s disease: opportunities for interventions. Drugs Aging. 2003;20:377-397.
[ Links ]MESHUL CK, KAMEL D, MOORE C, KAY TS, KRENTZ L. Nicotine alters striatal glutamate function and decreases the apomorphine - induced contralateral rotations in 6-OHDA-Lesioned rats. Exp Neurol. 2002;175:257-274.
[ Links ]MITCHELL JS, SILVER RA. Glutamate spillover suppresses inhibition by activating presynaptic mGluRs. Nature. 2000;404:498-501.
[ Links ]NAGATSU T, SAWADA M. L-dopa theraphy for Parkinson s disease: Past, present, and future. Parkinsonism Relat D. 2009; 15 (Suppl 1) S3-S8.
[ Links ]NEVE KA, SEAMANS J, TRANTHAM-DAVIDSON H. Dopamine Receptor Signaling. J. Recept and Signal Transduct Res. 2004;24(3):165-205.
[ Links ]OBESO JA, RODRÍGUEZ-OROZ MC, RODRÍGUEZ M, LANCIEGO JL, ARTIEDA J, GONZALO N, OLANOW W. Pathophysiology of the basal ganglia in Parkinson s disease. Trends Neurosci. 2000;23(10):3-18.
[ Links ]PARADISO KG, STEINBACH JH. Nicotine is highly effective at producing desensitization of rat 42 neuronal nicotinic receptors J Physiol. 2003;553(3):857-871.
[ Links ]PARENT M, PARENT A. The microcircuitry of primate subthalamic nucleus. Parkinsonism Relat D. 2007;13:S292-296.
[ Links ]PAXINOS G, WATSON C. The Rat Brain in Stereotactic Coordinates. NY: Academic Press; 1998
[ Links ]PICCIOTTO M, ZOLI M. Neuroprotection via nAChRs: the role of nAChRs in neurodegenerative disorders such as Alzheimer s and Parkinson s disease. Front Biosci. 2008;13:492-504.
[ Links ]QUIK M. Smoking, nicotine and Parkinson s disease. TINS 2004;27(9):561-568.
[ Links ]QUIK M, O NEILL M, PÉREZ X. Nicotine neuroprotection against nigrostriatal damage. Importance of the animal model. Trends Pharmacol Sci 2007;28(5):229-235.
[ Links ]RIGGS JE. Cigarrette Smoking and Parkinson s disease: The illusion of a neuroprotective effect. Clin Neuropharmacol. 1992;15(2):88-89.
[ Links ]ROBINSON TE, CAMP DM. The feasibility of repeated microdialysis for within subjects design experiments: studies on the mesostriatal dopamine system. En: Houston JP, Robinson TE, Justice JB editores. Techniques in the behavioral and neural sciences. Amsterdam, London, New Cork: Elsevier; 1991. p. 449-452.
[ Links ]ROLLAND AS, TANDÉ D, HERRERO MT, LUQUIN RM, VÁZQUEZ-CLAVARIE M, KARACHI C, HIRSCH E, FRANCOIS CH. Evidence for a dopaminergic innervation of the pedunculopontine nucleus in monkeys, and its drastic reduction after MPTP intoxication. J Neurochem. 2009;110:1321-1329.
[ Links ]ROUSE ST, MARINO MJ, BRADLEY SR, AWAD H, WITTMANN M, CONN PJ. Distribution and roles of metabotrópico glutamate receptors in the basal ganglia motor circuit: implications for treatment of Parkinson s disease and related disorders. Pharmacol Therapeut. 2000;88:427-435.
[ Links ]SÁNCHEZ-PRIETO J, BUDD DC, HERRERO I, VÁZQUEZ E, NICHOLLS DG. Presynaptic receptors and the control of glutamate exocitosis. Trends Neurosci. 1996;19:235-239.
[ Links ]SEGOVIA JM, MICKLEM BR, ROBERTS-NAIR RG, UNGLESS MA, BOLAM JP. GABAergic Neuron Distribution in the Peduculontine Nucleus defines functional subterritories. J Comp Neurol. 2009;515:397-408.
[ Links ]SINGH N, PILLAY V, CHOONARA E. Advances in the treatment of Parkinson s disease. Prog Neurobiol. 2007;81:29-44.
[ Links ]SHEN KZ, ZHU ZT, MUNHALL A, JOHNSON SW. Dopamine receptor supersensitivity in rat subthalamus after 6-OHDA. Eur J Neurosci. 2003;18:2967-2974.
[ Links ]VALENTI O, MARINO MJ, CONN PJ. Modulation of Excitatory Transmission onto Midbrain Dopaminergic Neurons of the Rat by Activation of Group III Metabotropic Glutamate Receptors. Ann NY Acad Sci. 2003a;1003:479-480.
[ Links ]VALENTI O, MARINO MJ, WITTMANN M, LIS E, DILELLA AG, KINNEY GG, CONN PJ. Group III Metabotropic Glutamate Receptors-Mediated Modulation of the Striatopallidal synapse. J Neurosci. 2003b;23(18):7218-7226.
[ Links ]WELSBY P, ROWAN M, ANWYL R. Nicotinic receptor-mediated enhancement of long term potentiation involves activation of metabotropic glutamate receptors and ryanodine-sensitive calcium stores in the dentate gyrus. Eur. J Neurosci. 2006;24:3109-3118.
[ Links ]WITTMANN M, MARINO MJ, BRADLEY SR, CONN J. Dopamine Modulates the function of Group II and Group III Metabotropic Glutamate receptors in the SNpr. J Pharmacol Exp Ther. 2002;302:433-441.
[ Links ]WOLTERS ECH., BOSBOOM JLW. Parkinson s disease. En: Wolters, Van Laar, Berendse Editores. Parkinsonism and Related Disorders. Amsterdam: VU University Press, 2007.143-159.
[ Links ]WONNACOTT S. Presynaptic nicotinic ACh receptors. Trends Neurosci. 1997;20(2):92-98.
[ Links ]WONNACOTT S, SIDHPURA N, BALFOUR D. Nicotine: from molecular mechanisms to behaviour. Curr Opin Pharmacol. 2005;5:53-59.
[ Links ]YOUDIM MBH, GELDENHUYS CJ, SCHYF VD. Why should we use multifunctional neuroprotective and neurorestorative drugs for Parkinson s disease?. Parkinsonism Relat Disord. 2007;13:S281-292.
[ Links ]ZHANG QJ, LIU J, WANG Y, WANG S, WU Z, YAN W, HUI YP, ALI U. The firing activity of presumed cholinergic and non-cholinergic neurons of the pedunculopontine nucleus in 6-hydroxydopamine-lesioned rats: An in vivo electrophysiology study. Brain Res. 2008;1243:152-160.
[ Links ]ZRINZO L, ZRINZO LV, TISCH S, LIMOUSIN PD, YOUSRY T, AFSHAR F, HARIZ M. Stereotactic localization of the human pedunculopontine nucleus: atlas-based coordinates and validation of a magnetic resonance imaging protocol for direct localization. Brain. 2008;131:1588-1598. doi: 10.1093/brain/awn 075.
[ Links ]













