Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.16 n.1 Bogotá jan./abr. 2011
EVALUACIÓN DE LA BIOESTIMULACIÓN (NUTRIENTES) EN SUELOS CONTAMINADOS CON HIDROCARBUROS UTILIZANDO RESPIROMETRÍA
Evaluation of Biostimulation (Nutrients) in Hydrocarbons Contaminated Soils by Respirometry
ERIKA GARCÍA1, Microbióloga; FABIO ROLDÁN1,*, Ph. D. ; LAURA GARZÓN1, Microbióloga. 1Unidad de Saneamiento y Biotecnología Ambiental - USBA, Departamento de Biología, Pontificia Universidad Javeriana, Carrera 7 # 43-82, Ed. 54. Laboratorio 314B. Bogotá, D.C., Colombia.*Profesor Asociado, fabio.roldan@javeriana.edu.co, Teléfono: (57 1) 320 83 20, ext. 4169.
Presentado 28 de noviembre de 2009, aceptado 23 de abril de 2010, correcciones 15 de marzo de 2011.
RESUMEN
Se evaluó el proceso de bioestimulación por nutrientes utilizando fertilizantes inorgánicos compuestos (FIC) N:P:K 28:12:7 y sales inorgánicas simples (SIS) NH4NO3 y K2HPO4 en suelos contaminados con hidrocarburos utilizando respirometría. El suelo fue contaminado con lodos aceitosos a una concentración 40.000 mgTPH/kgps. Para cuantificar el consumo de oxígeno se utilizaron dos respirómetros de medición manométrica HACH® 2173b y OXITOP® PF600 durante ensayos de 13 días (n=3). Se evaluaron dos tratamientos (FIC y SIS) y tres controles (abiótico, sustrato de referencia y sin nutrientes). Se analizaron parámetros físico-químicos (pH, nutrientes y TPH) y microbiológicos (heterótrofos y degradadores) al inicio y al final de cada ensayo. SIS y el control sin nutrientes presentaron las mayores tasas de respiración, en el equipo HACH se obtuvieron valores de 802,28 y 850,72 mgO2kgps-1d-1 respectivamente, y en OXITOP fueron de 936,65 y 502,05 mgO2kgps-1d-1, respectivamente, indicando que los nutrientes de SIS estimularon el metabolismo microbiano. Por otro lado, FIC presentó los recuentos y tasas de respiración más bajas (188,18 y 139,87 mgO2kgps-1d-1 en HACH y OXITOP, respectivamente), esto pudo estar relacionado a un efecto inhibitorio generado por la acumulación de amoniaco, limitando el crecimiento de la población degradadora.
Palabras clave: bioestimulación, hidrocarburos, bacterias degradadoras de hidrocarburos, respirometría, tasas de respiración.
ABSTRACT
The biostimulation process was evaluated in a hydrocarbon contaminated soil by respirometry after amendment with inorganic compound fertilizer (ICF) (N:P:K 28:12:7) and simple inorganic salts (SIS) (NH4NO3 and K2HPO4). The soil was contaminated with oily sludge (40,000 mgTPH/kgdw). The oxygen uptake was measured using two respirometers (HACH® 2173b and OXITOP® PF600) during thirteen days (n=3). Two treatments (ICF and SIS) and three controls (abiotic, reference substance and without nutrients) were evaluated during the study. Physicochemical (pH, nutrients, and TPH) and microbiological analysis (heterotrophic and hydrocarbon-utilizing microorganisms) were obtained at the beginning and at the end of each assay. Higher respiration rates were recorded in SIS and without nutrient control. Results were 802.28 and 850.72-1d-1,mgO2kgps-1d-1 in HACH, while in OXITOP were 936.65 and 502.05 mgO2kgps respectively. These data indicate that amendment of nutrients stimulated microbial metabolism. ICF had lower respiration rates (188.18 and 139.87 mgO2kgps-1d-1 in HACH and OXITOP, respectively) as well as counts, this could be attributed to ammonia toxicity.
Key words: biostimulation, hydrocarbons, hydrocarbon-utilizing microorganisms, respirometry, respiration rates.
INTRODUCCIÓN
La industria del petróleo no sólo representa una fuente de ingresos importante para la economía del país sino también un área en desarrollo. Sin embargo, es considerada como una de los principales contaminantes del ambiente debido a los residuos generados durante procesos de extracción, almacenamiento, transporte y refinamiento del crudo; residuos que según la agencia ambiental de Estados Unidos (EPA, del inglés, Environmental Protection Agency) se clasifican como peligrosos debido a que algunos compuestos tienen propiedades carcinogénicas y mutagénicas, que pueden afectar la vida de plantas, animales y humanos. Consientes de esta problemática, surge la necesidad de implementar soluciones como la biorremediación, una alternativa económica, sencilla y ambientalmente amigable que permite la mineralización completa del contaminante (Cunningham y Philp, 2000; Bento et al., 2005).
Para llevar a cabo un proceso de biorremediación en suelos contaminados con hidrocarburos (HCs), se deben tener en cuenta factores como la presencia de microorganismos degradadores capaces de metabolizar HCs como fuente de carbono y energía para su crecimiento (Eweis et al., 1999; Margesin y Schinner, 2001), condiciones ambientales óptimas (nutrientes, pH, humedad, etc.) y las características físico-químicas de los HCs y su disponibilidad para los microorganismos degradadores (Cunningham y Philp, 2000). Sin embargo, diversos estudios han reportado que suelos contaminados con HCs presentan exceso de carbono, mientras que elementos como nitrógeno y fósforo se encuentran en bajas concentraciones para mantener un balance de nutrientes (C:N:P) limitando el proceso de biodegradación (Graham et al., 1999; Margesin et al., 2000a). Por tal razón, la bioestimulación con adición de nutrientes, es una de las estrategias más empleadas para remediar áreas contaminadas con este tipo de contaminantes (Graham et al., 1999; Margesin et al., 2000a; Brook et al., 2001; Rittman y Mc Carty, 2001; Ruberto et al., 2003; Venosa y Zhu, 2003). Durante la bioestimulación, se pueden utilizar sales inorgánicas simples (SIS) o fertilizantes inorgánicos compuestos (FIC); numerosos estudios han demostrado la efectividad de los dos tratamientos; sin embargo, investigaciones realizadas por Wrenn et al., 1994, Graham et al., 1999 y Vallejo et al., 2005, afirman que el uso de SIS, aunque es costoso, tiene ventajas como su fácil manipulación y ha mostrado efectividad en diferentes procesos de biorremediación. De igual forma, FIC (productos comerciales), al tener mezclas definidas de elementos como N y P, incrementa la biodegradación; sin embargo, su presentación en forma de pellets o fertilizantes encapsulados, aunque garantiza un aporte de nutrientes constante a los microorganismos, tiene en algunos casos problemas de solubilización, limitando su homogenización y biodisponibilidad (Bitton, 2002; Margesin y Schinner, 2001).
Un proceso de biorremediación se puede monitorear a través de medidas directas e indirectas. Las primeras, determinan la concentración de HCs (p.e., mgTPH/kgps) y su disminución a través del tiempo, mientras que las segundas (indirectas) determinan bioconversión de HCs e incluyen: consumo de aceptores de electrones (AE), producción de CO2, aumento de biomasa (p.e., recuento de degradadores) y cambio de pH, entre otros (Hickey, 1995; Govind et al., 1997; Korda et al., 1997; Goudar y Strevelt, 1998; Gernaey et al., 2001). La respirometría es una técnica que cuantifica el consumo de oxígeno y la producción de CO2, por lo tanto permite evaluar el crecimiento y metabolismo activo de microorganismos durante la degradación del contaminante (Tzoris et al., 2002). Así mismo, permite evaluar el impacto de un compuesto sobre comunidades microbianas y determinar la factibilidad de un tratamiento de biorremediación, ya que permite en cortos periodos de tiempo, evaluar tratamientos diferentes en microcosmos antes de su aplicación en campo. Estas ventajas, se deben a que la respirometría permite calcular tasas de respiración y realizar cinéticas de degradación, parámetros importantes para determinar la efectividad de la biorremediación (Reid et al., 2001).
En el presente estudio, se utilizó respirometría (consumo de O2) para evaluar el efecto de la adición de nutrientes (bioestimulación) en forma de sales inorgánicas simples (SIS) y fertilizantes inorgánicos compuestos (FIC) en suelos contaminados con HCs. Adicionalmente, se comparó el consumo de O2 en dos respirómetros: HACH® y OXITOP®, el primero utiliza columnas de mercurio para detectar cambios en la presión, mientras que el segundo, utiliza sensores de presión. Esta comparación se realizó con el fin de calcular las tasas de respiración mediante dos aproximaciones diferentes.
MATERIALES Y MÉTODOS
DISEÑO EXPERIMENTAL
El estudio se realizó por medio de ensayos respirométricos en microcosmos (botellas ámbar de 500 mL) cuantificando el consumo de oxígeno (O2) durante 13 días (n=3). Se utilizaron y compararon dos respirómetros manométricos: HACH® (HACH; 2173b) y OXITOP® (WTW; PF600) bajo condiciones de laboratorio en la unidad de saneamiento y biotecnología ambiental (USBA), Pontificia Universidad Javeriana (PUJ). Se analizaron parámetros fisicoquímicos como pH, humedad, hidrocarburos totales de petróleo (TPH del inglés, total petroleum hydrocarbons), nutrientes (nitratos, amonio y fósforo) y microbiológicos: recuento de heterótrofos totales y degradadores de HCs. Los análisis se realizaron al inicio (t= 0 d) y final (t= 13 d) de cada ensayo por duplicado.
MICROCOSMOS
Para la realización del estudio se utilizó suelo proveniente de carreteras sin pavimentar a las cuales se les adicionan lodos aceitosos para su acondicionamiento y mantenimiento. Las características del suelo son descritas en mayor detalle en Roldán et al., 2010. El suelo tenía la siguiente composición química: nitrato (no detectable); amonio (0,6-2,2 mg/kgps); fósforo (0,05-7,6 mg/kgps); carbono orgánico (0,6-2,4%). Tiene textura arenosa (87,0%), arcilla (4,0%) y limo (9,1%).
El suelo fue contaminado con lodos aceitosos a una concentración de 40,000 mg TPH/ kgps. Esta mezcla se homogenizó dos veces (30 min/microcosmos) al día durante tres días con ayuda de una espátula cubierta con teflón. Adicionalmente, este esfuerzo es necesario para tratar de garantizar la mayor homogenización de los hidrocarburos en la matriz del suelo. Con este procedimiento se buscó distribuir el suelo contaminado bajo condiciones iguales en cada microcosmos. Los microcosmos se mantuvieron a 21 ± 2 °C, y con un porcentaje de humedad del 12%, de acuerdo a las condiciones in situ (Roldán et al., 2010). Se evaluaron dos tratamientos con adición de nutrientes (bioestimulación): FIC (producto comercial) con una relación 28:12:7 (N:P:K) y SIS (NH4NO3 y K2HPO4), ajustando la relación final a 100:10:1 (C:N:P; Avelizapa et al., 2000; Miles y Doucette, 2001; Sabate et al., 2004) Para realizar los cálculos, se asumió que la concentración de carbono en los lodos aceitosos fue de 100% (Margesin et al., 2000b).
Se utilizaron los siguientes controles: a) abiótico (CA) para determinar la degradación TPH y consumo de O2 por procesos abióticos (p.e., volatilización y absorción), para ello, el suelo fue esterilizado con azida de sodio al 1% (p/p; Margesin et al., 2000b; Margesin, 2005b) control de referencia, se utilizó ACPM (diesel) a una concentración 20.000 mg/kgps, este sustrato fue seleccionado por su biodegradabilidad y por ser utilizado en USBA para evaluar la capacidad degradadora de microorganismos en la técnica de número más probable (NMP; Margesin et al., 2000a; Brook et al., 2001; Roldan, 2010); y c) control sin nutrientes (CSN) con suelo y HCs, permitió determinar la biodegradación intrínseca en el suelo.
ANÁLISIS FÍSICO-QUÍMICOS
El pH del suelo fue determinado por el método 9045C (EPA, 1995). Para determinar TPH se utilizó el método estándar para la evaluación de combustible en suelos D 5831-96 (ASTM, 1995). Este método se emplea para la determinación de compuestos aromáticos de combustibles presentes en el suelo y se basa en la extracción de HCs en isopropanol y su cuantificación por espectrofotometría a una longitud de onda de 254 nm. TPH son definidos por el método de análisis empleado más que por la sumatoria de todos los compuestos presentes (Weisman, 1998). Adicionalmente, el método fue seleccionado considerando que los lodos utilizados para el suelo provenían de los fondos de tanques y lagunas de oxidación, por esta razón, su composición es principalmente compuestos aromáticos. Para la cuantificación de nutrientes, se emplearon los métodos HACH 366, 391 y 531, para determinar nitrato, amonio y fósforo total, respectivamente (HACH®, 1994) y se utilizó espectrofotómetro HACH® (DRL-2000) para la lectura de cada análisis. Para determinar el porcentaje de humedad, se pesaron 5,0 g de la muestra de suelo y se secaron durante 12 h a 105 ºC. La diferencia del peso antes y después del secado, permitió obtener la fracción de peso seco (ps) y el porcentaje de humedad (IGAC, 1979).
ANÁLISIS MICROBIOLÓGICOS
Recuento de heterótrofos y degradadores de HCs. Para la cuantificación de heterótrofos y degradadores se realizaron diluciones seriadas de las muestras de suelo en buffer fosfato. Para determinar los heterótrofos se utilizó la técnica de recuento en placa empleando agar infusión suelo (AIS) (ASM, 1986). Por otro lado, para el recuento de microorganismos degradadores de HCs se empleó la técnica de número más probable (NMP) en placas de 96 pozos, utilizando medio mínimo de sales Bushnell-Haas (BH) suplementado con ACPM (diesel) como fuente de carbono y energía (Wrein y Venosa, 1996; Eriksson et al., 2000; Brook et al., 2001). Para evidenciar el metabolismo activo de los microorganismos se utilizó el indicador de oxidoreducción cloruro de yodotetrazolium (INT; 0,3% p/v) (Haines, 1996; Wrein y Venosa, 1996; Roldan, 2010). Las cajas y placas fueron incubadas durante siete días a 22 ± 2 °C.
ANÁLISIS RESPIROMÉTRICO
En cada microcosmos se colocaron 85 g de suelo contaminado y se colocó LiOH en las trampas para remover el CO2 producido durante el proceso de biodegradación (Platen y Wirtz, 1999). Los equipos HACH® y OXITOP® son respirómetros cerrados que miden consumo de O2 por cambio en presión. El equipo HACH realiza esta medición a través de columnas de mercurio conectadas a cada botella, mientas que el equipo OXITOP utiliza sensores electrónicos de presión que están incorporados en la cabeza de cada botella (Platen y Wirtz, 1999). Se realizaron tres ensayos respirométricos, para cada tratamiento y control en cada equipo, y se determinó el consumo de O2 durante 13 días realizando las lecturas diarias por microcosmos.
ANÁLISIS ESTADÍSTICO
Se evaluó la distribución normal de los datos y en caso de no presentarla fueron transformados con logaritmo base 10. Se utilizó la prueba t-student para determinar diferencias significativas de los parámetros evaluados en el tiempo. Se realizó un análisis de varianza (ANDEVA) para determinar el efecto de los tratamientos. Se consideró una diferencia significativa cuando p≤0,05. Para comparar los equipos (HACH vs. OXITOP) se evaluaron las pendientes de las curvas de respirometría utilizando análisis de covarianza. Todos los análisis estadísticos se realizaron utilizando JMP-IN® versión 4.04.
RESULTADOS
ANÁLISIS FÍSICO-QUÍMICO
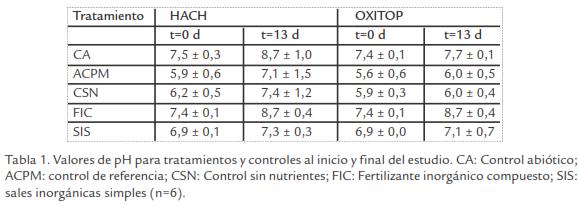
pH. El pH en los tratamientos y controles durante el estudio se mantuvo en un rango ligeramente ácido a alcalino (Tabla 1). El CA y FIC presentaron diferencias significativas en tiempo y en los dos equipos. Así mismo, SIS y CSN mostraron un incremento aunque solo en el equipo HACH® (t-student, p ≤ 0,05). TPH’s. A pesar del esfuerzo realizado durante la mezcla de los lodos aceitosos con el suelo, se presentó alta variabilidad en algunas de las concentraciones observadas. Se observó reducción aunque no fue significativa en los controles y tratamientos evaluados en los dos equipos (Tabla 2; t-student, p ≤ 0,05).
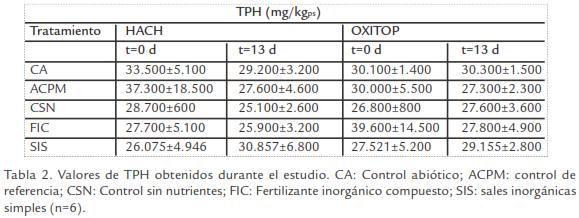
-TPH’s. A pesar del esfuerzo realizado durante la mezcla de los lodos aceitosos con el suelo, se presentó alta variabilidad en algunas de las concentraciones observadas. Se observó reducción aunque no fue significativa en los controles y tratamientos evaluados en los dos equipos (Tabla 2; t-student, p ≤ 0,05).
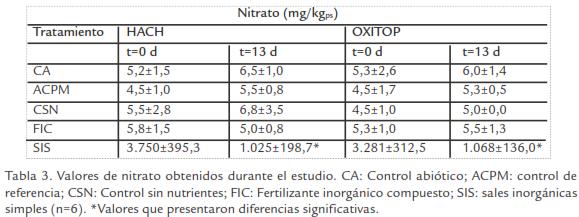
Nutrientes. Las concentraciones iníciales de nutrientes (N-NH4+, N-NO3 y P) fueron bajas en todos los controles (CA, ACPM, CSN) con relación a la concentración de carbono (alta concentración de TPH’s). Al final del estudio, se determinó un aumento significativo de N-NH 4 + en ACPM en los dos equipos, mientras que para CSN se observó en OXITOP (Tabla 3; Tabla 4; Tabla 5; t-student, p ≤ 0,05). Por otro lado, SIS mostró disminución significativa de nutrientes al final del estudio.
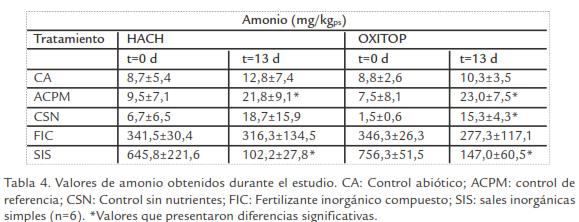
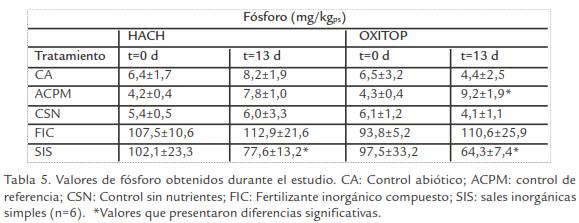
ANÁLISIS MICROBIOLÓGICOS
Los recuentos de degradadores en CA durante el estudio fueron < 1 NMP/g, indicando que azida de sodio tuvo el efecto deseado sobre esta población (Graham et al., 1999; Margesin et al., 2000b). En los recuentos de heterótrofos, se observó aumento significativo en CSN y ACPM en OXITOP, mientras que este incremento fue constante para SIS en los dos equipos. En cuanto a los recuentos de degradadores, se observó disminución significativa para CSN en OXITOP y para FIC en los dos equipos (Fig. 1).
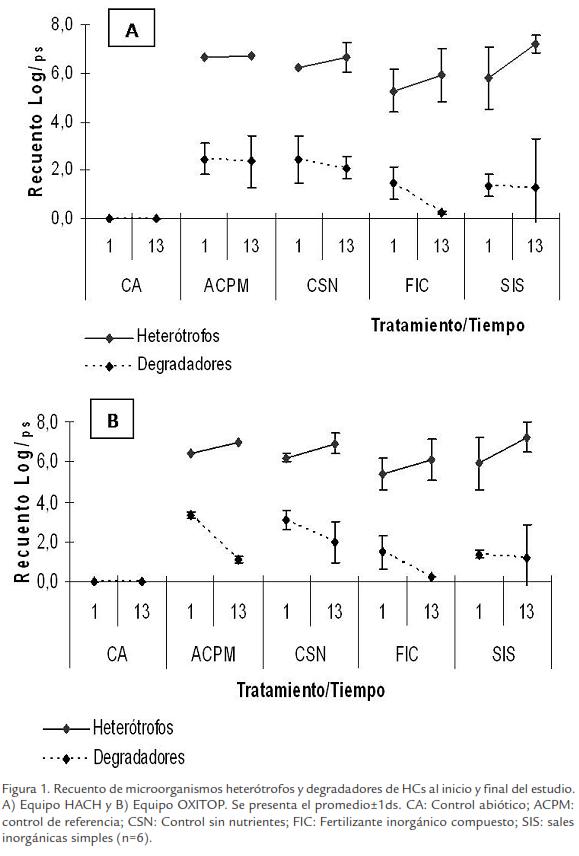
ANALISIS RESPIROMÉTRICO
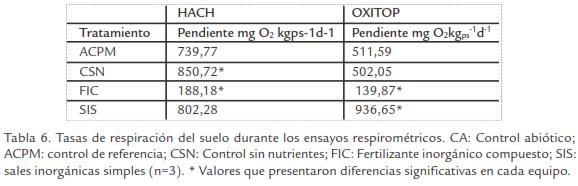
Las curvas de consumo O2 obtenidas durante los ensayos respirométricos para controles y tratamientos fueron similares a las reportadas en la literatura (Uraizee et al., 1998; Reid et al., 2001). Para evaluar el consumo de O2 generado durante la biodegradación, todas las lecturas fueron corregidas con el control abiótico (Miles y Doucette, 2001). Se observó un consumo mínimo al inicio (1-2 d) que corresponde a la fase de adaptación, seguido por un consumo exponencial (2-10 d), y finalmente reducción en el consumo de oxígeno (10-13 d; Fig. 2). Por otro lado, las tasas de respiración se calcularon durante los primeros diez días cuando la mayoría de las curvas se encontraban en fase exponencial (Tabla 6).
DISCUSIÓN
pH. Los valores de pH obtenidos en los tratamientos y controles, se encontraron en un rango ligeramente ácido a alcalino (Tabla 1), posiblemente por la composición química y capacidad buffer del suelo, ya que suelos minerales se caracterizan por presentar pH neutros-alcalinos en comparación a suelos orgánicos (Venosa y Zhu, 2003). En términos generales no se observaron valores de pH extremos que inhibieran total o parcialmente el metabolismo de los microorganismos (Cunnigham y Philp, 2000). Estudios realizados por Dibble y Bartha, 1979, establecieron un rango de pH entre 5,0-7,8 para la mineralización de lodos aceitosos en suelos y Ritter y Scarborough, 1995, determinaron que pHs entre 6,5-8,5 como óptimos para realizar procesod de biorremediación in situ en suelos contaminados con HCs.
TPH’s. Los valores de TPH observados presentaron una alta variabilidad (Tabla 2), a pesar del tiempo (3 días) y esfuerzo empleado para la homogenización de la muestra. Este comportamiento se debe a que los TPH son compuestos líquidos de la fase no acuosa que se caracterizan por ser hidrófobos y formar agregados en el suelo (bolsillos de contaminación), lo cual dificulta su homogenización completa (Eweis et al., 1999; Roldan, 2002). Resultados similares fueron obtenidos por Deni y Penninckx, 1999, en suelos contaminados con TPH donde las concentraciones iniciales variaron en un rango de 2,500 a 4,000 mgTPH/kg debido a la distribución heterogénea de petróleo y a la naturaleza del suelo.
Por otro lado, el tiempo del estudio y el origen de los lodos aceitosos no permitieron evidenciar cambios significativos en la degradación de TPH durante los ensayos. Adicionalmente, el método empleado para la cuantificación de TPH determina compuestos aromáticos, por tal razón, no se cuantificaron hidrocarburos alifáticos que probable-mente proporcionaron una fuente de carbono fácilmente asimilable para los microorganismos. Así lo demuestra un estudio realizado por Coulon et al., 2005, quienes afirman que fracciones de HCs de cadena corta son las que se degradan inicialmente y más rápido, en comparación con fracciones de HCs de cadena larga o compuestos aromáticos, independientemente del grado de contaminación.
Nutrientes. En los controles ACPM y CSN se observó un ligero incremento en las concentraciones de amonio y fosforo; sin embargo, este incremento no fue significativo en comparación a la concentración observada en los tratamientos (Tabla 3; Tabla 4; Tabla 5). Este fenómeno no pudo ser atribuido a ninguna de las condiciones empleadas durante el estudio y no fue considerado relevante porque no proporcionaba la relación C:N:P necesaria para llevarse a cabo la degradación.
De los tratamientos evaluados la bioestimulación con FIC no mostró una reducción significativa en las concentraciones de nutrientes (nitrato, amonio y fósforo). Este con-sumo bajo de nutrientes estuvo correlacionado con recuentos bajos de degradadores y tasas bajas de respiración presentes en este tratamiento. Este comportamiento se debe a que las altas concentraciones de nitrógeno en forma de úrea en el producto comercial, fueron hidrolizadas a amoniaco; esta conversión pudo establecerse por el incremento en los valores de pH (7,4±0,1 a 8,7±0,4) que causaron una alcalinidad en los microcosmos. La presencia de concentraciones de amoniaco altas en asociación al pH observado, probablemente generaron efecto inhibitorio sobre la población microbiana (Havlin et al., 1999). Esto pudo evidenciarse por tajas de respiración bajas, densidad microbiana y olor característico (amoniaco) al final de los ensayos.
Por el contrario, SIS mostró reducción significativa en la concentración de nutrientes en ambos equipos (Tabla 3; Tabla 4; Tabla 5), indicando que las sales adicionadas fueron utilizadas como fuentes de N y P durante la degradación por los microorganismos durante el metabolismo de fracciones de HCs menos complejas presentes en el suelo. Resultados similares han sido reportados por Sabate et al., 2004, con el uso de SIS (NH4NO3y K2HPO4) donde observaron porcentajes de degradación del 54% en suelos contaminados con aceite mineral durante 360d. Así mismo, Vallejo et al., 2005, demostró que la adición de SIS (NH4NO3 y K2HPO4) y FIC (NPK 15:15:15) redujo significativamente la concentración de TPH; sin embargo, la adición de SIS presentó los mayores porcentajes de remoción.
ANÁLISIS MICROBIOLÓGICO
CSN y ACPM presentaron aumento significativo en los recuentos de heterótrofos en OXITOP (1,6±0,1x106 a 8,3±0,5x106 y 2,4±0,6x106 a 1,0±0,4x107, respectivamente), indicando que la población microbiana se encontraba metabólicamente activa, y que ACPM (diesel), es un compuesto de fácil degradación (Margesin et al., 2000a).
En FIC, el recuento de heterótrofos no presentó cambios significativos en HACH y OXITOP, mientras que la población degradadora mostró reducción significativa en el tiempo que posiblemente se presentó por el efecto inhibitorio generado por el amoniaco (Fig. 1). Es importante mencionar que no se han reportado estudios en donde la adición de nutrientes afecte negativamente la población degradadora, por el contrario puede aumentar su densidad o mantener el metabolismo basal de la población (Margesin et al., 2000b; Nikolopoulou et al., 2007).
Por otro lado, el tratamiento con SIS mostró incremento significativo en los recuentos de heterótrofos (Fig. 1; 6,4±1,2x105 a 1,6±0,3x107 y 8,3±1,3x105 a 1,7±0,7x107 en HACH y OXITOP, respectivamente) indicando que los nutrientes fueron utilizados por la población degradadora para metabolizar fracciones de HCs menos complejas, generando subproductos que posiblemente fueron empleados como fuente de carbono por los heterótrofos durante su crecimiento. Comportamientos similares han sido reportados por Venosa y Zhu, 2003, quienes determinaron que la degradación de HCs involucra una serie de reacciones secuenciales, en donde los microorganismos degradadores metabolizan HCs y generan compuestos intermediarios que son posteriormente utilizados por diferentes grupos de microorganismos (p.e., heterótrofos no degradadores). Los recuentos de degradadores no presentaron diferencias significativas durante el estudio (HACH y OXITOP) indicando que las sales adicionadas permitieron mantener el metabolismo basal de esta población, es decir, la presencia de nutrientes en forma de SIS estimuló el metabolismo de los degradadores, aunque no necesariamente aumentó los recuentos o biomasa (Alexander, 1999). De igual forma, en investigaciones desarrolladas por Margesin et al., 2000b, para monitorear un proceso de biodegradación por actividad biológica, encontraron que la presencia o ausencia de nutrientes no tenía efecto significativo en el recuento de degradadores y que otros factores como tipo de contaminante y tiempo de exposición eran mucho más relevantes. Por esta razón, durante este estudio, la naturaleza del contaminante y el tiempo de los ensayos fueron los factores limitantes para el crecimiento de microorganismos degradadores. Este fenómeno ha sido descrito como “umbral” en el cual cantidades pequeñas de sustrato disponible y fácilmente asimilable son metabolizadas con el fin de mantener el metabolismo energético y no incrementar la biomasa (Alexander, 1999).
ANÁLISIS RESPIROMÉTRICO
En términos generales las curvas de consumo O2 en el tiempo obtenidas para los controles y tratamientos presentaron fases similares a las reportadas en la literatura (Fig. 2). Muchos de estos estudios han reportado una fase inicial (adaptación) donde se observan consumos mínimos y constantes durante los primeros tres días en suelos contaminados con aceites minerales sin adición de nutrientes (Uraizee et al., 1998) y suelos contaminados con HCs policíclicos aromáticos (Reid et al., 2001).
Por otro lado, el compuesto utilizado como sustrato de referencia (ACPM) permitió determinar que las condiciones empleadas durante el estudio, así como, el montaje respirométrico fueron adecuados para evaluar el consumo de oxigeno de los tratamientos en el tiempo (Tabla 6). El consumo de O2 de CSN mostró una tasa de respiración en HACH y OXITOP (850,72 y 502,1 mgO2kgps-1d-1, respectivamente), indicando la existencia de una población microbiana nativa degradadora. Este consumo puede deberse a un proceso de biodegradación intrínseca como parte de la atenuación natural (Roldan et al., 2010) y que probablemente otros factores como humedad pueden llegar a ser limitantes durante el proceso de biorremediación.
El consumo de O2 en FIC fue significativamente menor (188,18 y 139,87 mgO2kgps para HACH y OXITOP, respectivamente) en comparación a los tratamientos, este comportamiento estuvo acompañado de recuentos bajos de microorganismos (degradadores y heterótrofos) y consumo de los nutrientes bajo. De otra manera, SIS presentó tasas de respiración significativamente mayores (802,28 y 936,65 mgO2kgps-1d-1, para HACH y OXITOP, respectivamente) que FIC, indicando mayor biodisponibilidad de nutrientes para estimular la degradación de la población degradadora. Las tasas de respiración bajas observadas en FIC confirman el efecto inhibitorio del fertilizante utilizado en el estudio posiblemente causado por la presencia de amoniaco en los microcosmos cerrados.
Estudios realizados por Hollender et al., 2003, en suelos contaminados con BTEX y PHA’s en el que se evaluaba la adición de nutrientes en forma de SIS (NH4Cl y K2HPO4) y glucosa como sustrato inductor para estimular el proceso de biodegradación durante 10 d, reportaron tasas de respiración (1,6 µmolO2/g/h) similares a las tasas de con-sumo de O2 obtenidas durante el presente estudio para SIS (1,04 µmolO2g-1h-1 y 1,22 µmolO2g-1h-1 para HACH y OXITOP, respectivamente), indicando que el uso de este tipo de compuestos puede estimular el metabolismo, ya que son sustratos fácilmente asimilables por la población degradadora.
CONCLUSIONES
La respirometría permitió evaluar la efectividad de un tratamiento de biorremediación, como la bioestimulación, en periodos de tiempo cortos. La adición de nutrientes en forma de sales (SIS) estimuló la población degradadora lo cual se reflejó en tasas de respiración altas obtenidas en OXITOP. Por otro lado, factores como tiempo y presencia de HCs de alto peso molecular fueron limitantes durante el estudio.
AGRADECIMIENTOS
A la Vicerrectoría Académica de la Pontificia Universidad Javeriana por la financiación del proyecto (No. 000288).
BIBLIOGRAFÍA
ALEXANDER M. Biodegradation and Bioremediation. Second Edition. Academic Press; 1999.
[ Links ]ASM. Manual of Industrial Microbiology and Biotechnology. Department of Nutrition and Food Science. Massachusetts Institute of Technology; 1986.
[ Links ]ASTM D. 5831-96. Standard test method for screening fuels in soils. American Society for Testing Materials; 1995.
[ Links ]AVELIZAPA N, VAZQUEZ R, BOHÓRQUEZ S, ALVAREZ P. Effect of C/N/P ratio and nonionic surfactants on polychlorinated biphenyl biodegradation. World J Microb Biot. 2000;16:319-324.
[ Links ]BENTO M, CAMARGO F, OKEKE B, FRANKENBERGER W. Comparative bioremediation of soils contaminated with diesel oil by attenuation, biostimulation and bioaugmentation. Bioresour Technol. 2005;96:1049-1055.
[ Links ]BITTON G. Encyclopedia of Environmental Microbiology. First Edition. United States of America: Wiley-Interscience Publication; 2002. p. 56-97.
[ Links ]BROOK T, WARREN S, ZYTNER R. Biodegradation of diesel fuel in soil under various nitrogen addition regimes. J Soil Contam. 2001;10(5):539-553.
[ Links ]COULON F, PELLETIER E, GOURHANT L, DELILLE D. Effects of nutrient and temperature on degradation of petroleum hydrocarbons in contaminated sub-Antarctic soil. Chemosphere. 2005;58:1439-1448.
[ Links ]CUNNINGHAM C, PHILP J. Comparison of bioaugmentation and biostimulation in ex situ treatment of diesel contaminated soil. Land Contamination & Reclamation. 2000;8(4):261-269.
[ Links ]DENI J, PENINCKX J. Nitrification and autotrophic nitrifying bacteria in a hydrocarbon- polluted soil. Appl Environ. Microbiol. 1999;65(9):4088-4013.
[ Links ]DIBBLE J, BARTHA R. Effect of environmental parameters on the biodegradation of oil Sludge. Appl Environ Microbiol. 1979;37(4):729-739.
[ Links ]EPA -ENVIRONMENTAL PROTECTION AGENCY. Determination of pH (9045c) in soils; 1995(Revisión 4):1-8.
[ Links ]ERIKSSON M, DALHAMMAR G, BORG-KARLSON A. Biological degradation of selected hydrocarbons in an old PAH/creosote contaminated soil from a gas work site. Appl Microbiol Biotechnol. 2000;53:619-626.
[ Links ]EWEIS J, ERGAS S, CHANG D, SCHROEDER E. Principios de Biorrecuperación. Primera Edición. Editorial Mc Graw Hill; 1999.
[ Links ]GERNAEY A, PETERSEN B, OTTOY J, VANROLLEGHEM P. Activated sludge monitoring with combined respirometric titrimetric measurements. Water Res. 2001;35(5)1280-1294.
[ Links ]GOUDAR C, STREVELT K. Comparison of relative rates of BTEX biodegradation using respirometry. J Ind Microbiol Biotechnol. 1998;21:11-18.
[ Links ]GOVIND R, GAO C, LAI L, TABAK H. Continuous, automated and simultaneous measurement of oxygen uptake and carbon dioxide evolution in biological systems. Water Environ. Res. 1997;69(1):73-80.
[ Links ]GRAHAM D, SMITH V, CLELAND D, LAW P. Effects of nitrogen and phosphorus supply on hexadecane biodegradation in soil systems. Water Air Soil Pollut. 1999;111:1-18.
[ Links ]HACH DRL/2000. Spectrophotometer Handbook. HACH, Company. Procedures Manual. USA; 1994.
[ Links ]HAINES J, WRENN B, HOLDER E, STROHMEIER K. Measurement of hydrocarbon degrading microbial population by 96-well plate most probable number procedure. J Ind Microbiol. 1996;16:36-41.
[ Links ]HAVLIN J, BEATON J, TISDALE S, NELSON W. Soil Fertility and Fertilizers. Sixth Edition. Ed. Prentice Hall; 1999.
[ Links ]HICKEY W. In situ respirometry: Field methods and implications for hydrocarbon biodegradation in subsurface soils. J Environ Qual. 1995;24:583-588.
[ Links ]HOLLENDER J, ALTHOFF K, MUNDT M, DOTT W. Assessing the microbial activity of soil samples, its nutrient limitation and toxic effects of contaminants using a simple respiration test. Chemosphere. 2003;53:269-275.
[ Links ]IGAC -INSTITUTO GEOGRÁFICO AGUSTIN CODAZZI. Métodos analíticos de laboratorio de suelos, subdirección agrológica. Ministerio de Hacienda y Crédito Público. Cuarta edición. Bogotá: Instituto Geográfico Agustin Codazzi; 1979. p. 61-67.
[ Links ]KORDA A, SANTAS P, TENENTE A, SANTAS R. Petroleum hydrocarbon bioremediation: Sample and analytical techniques, in situ treatments and commercial microorganisms currently used. Appl Microbiol Biotechnol. 1997;48:677-686.
[ Links ]MARGESIN R, SCHINNER F. Bioremediation (Natural attenuation and biostimulation) of diesel oil contaminated soil in an Alpine Glacier glacier skiing area. Appl Environ Microbiol. 2001;67(7):3127-3133.
[ Links ]MARGESIN R, WALDER G, SCHINNER F. The impact of hydrocarbon remediation (diesel oil and polycyclic aromatic hydrocarbon) on enzyme activities and microbial properties of soil. Acta Biotechnol. 2000a;20(3-4):313-333.
[ Links ]MARGESIN R, ZIMMERBAUER A, SCHINNER F. Monitoring of bioremediation by soil biological activities. Chemosphere. 2000b;40:339-346.
[ Links ]MARGESIN R. Comunicación Personal. Institut fur Mikrobiologie. Leopold-Franzes-Universitat. Innsbruck-Austria; 2005.
[ Links ]MILES R, DOUCETTE W. Assessing the aerobic biodegradability of 14 hydrocarbons in two soils using a simple microcosm/respiration method. Chemosphere. 2001;45:1085-1090.
[ Links ]NIKOLOPOULOU M, PASADAKIS N, KALOGERAKIS N. Enhanced bioremediation of crude oil utilizing lipophilic fertilizers. Desalination. 2007;211:286-295.
[ Links ]PLATEN H, WIRTZ A. Measurement of the respiration activity of soils using the OxiTop® Control measuring system. Manual WTW Fachhochschule Giessen Friedberg; 1999(1-3).
[ Links ]REID B, MAC LEOD C, LEE P, MORÍS A, STOKES J, SEMPLE K. A simple 14Crespirometric method for assessing microbial catabolic potential and contaminant bioavailability. Microbial Letters. 2001;196:141-146.
[ Links ]RITTER W, SCARBOROUGH J. A review of bioremediation of contaminated soil and groundwater. J Environ Sci. 1995;30(2):333-347.
[ Links ]RITTMAN B, MC CARTY C. Biotecnología del medio ambiente: Principios y Aplicaciones. Sexta edición. Mc. Graw Gill; 2001.
[ Links ]ROLDAN F. Oxygen and Nitrate Enhanced in situ Bioremediation of an Oil Contaminated Salt marsh [Tesis Doctoral]. USA: Department of Civil Engineering, University Hampshire; 2002.
[ Links ]ROLDAN F, MALDONADO C, GUEVARA C, CUBILLOS A. Natural Attenuation of Oily Sludge Used the Maintenance of an Unpaved Road Arauca (Colombia). Bioremediat J. 2010;14(2):81-91.
[ Links ]RUBERTO L, VAZQUEZ S, MAC CORMARCK W. Effectiveness of the natural bacteria flora, biostimulation and bioaugmentation on the bioremediation of a hydrocarbon contaminated Antarctic soil. Int. Biodeterior. Biodegradation. 2003;52:115-125.
[ Links ]SABATE J, VIÑA S , SOLANAS A. Laboratory-scale bioremediation experiments on hydrocarbon-contaminated soils. Int. Biodeterior. Biodegradation. 2004:54:19-25.
[ Links ]TZORIS A, CANE D, MAYNARD P, HALL E. Tuning the parameters for fast respirometry. Anal Chim Acta. 2002;460:257-270.
[ Links ]URAIZEE F, VENOSA A, SUIDAN M. A model for diffusion controlled bioavailability of crude oil components. Biodegradation. 1998;8:287-296.
[ Links ]VALLEJO V, SALGADO L, ROLDAN F. Evaluación de la bioestimulación en la biodegradación de TPHs en suelos contaminados con petróleo. Rev. Colomb. Biotecnol. 2005;(2):67-78.
[ Links ]VENOSA A, ZHU X. Biodegradation of crude oil contaminating marine shorelines and freshwater wetlands. Spill Science & Technology. 2003;8(2):63-178.
[ Links ]WEISMAN W. Analysis of Petroleum Hydrocarbons in Environmental Media. Volumen 1. Total Petroleum Hydrocarbon Criteria Working Group Series. Amherst, Massachusetts: Amherst Scientific Publishers; 1998. p. 18-34.
[ Links ]WREN B, HAINES J, VENOSA A, KADKHODAYAN M, SUIDAN M. Effects of nitrogen source on crude oil biodegradation. J Ind Microbiol Biotechnol. 1994;3:79-283.
[ Links ]WREIN B, VENOSA A. Selective enumeration of aromatics and aliphatic hydrocarbons degrading bacteria by most probable number procedure. Can. J. Microbiol. 1996;42:252-258.
[ Links ]













