Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.16 n.2 Bogotá maio/ago. 2011
PARÁMETROS FISICOQUÍMICOS PARA LA SÍNTESIS DE ÁCIDO LÁCTICO O ETANOL DE LA BACTERIA (Corynebacterium glutamicum)
Physico-Chemical Parameter for Production of Lactic Acid or Ethanol of (Corynebacterium glutamicum) Bacteria
ANGÉLICA CASTELLANOS1,4, cPh. D. Biomedicina; LINA MARCELA GARCIA2,4, Ingeniera Química; MYRIAM ASTUDILLO1,4, MSc. Microbiología; JORGE ENRIQUE LÓPEZ GALÁN2,4, Pos Doc. Ingeniería Química; LUZ MARINA FLOREZ PARDO3,4, Pos Doc Ingeniería Química
1 Universidad del Valle, Facultad de Salud, Departamento de Microbiología, Laboratorio de Bacteriología. Calle 4B # 36 - 00, edificio de Microbiología, oficina 316. Cali, Colombia.
2 Universidad del Valle, Facultad de Ingeniería Química. Cali, Colombia.
3 Universidad Autónoma de Occidente, Facultad de Ingenierías, Laboratorio de Bioprocesos. Calle 25 # 115-85, km 2, vía Cali - Jamundí, Colombia.
4 Grupo Interinstitucional en Investigaciones en Biocombustibles GRUBIOC. Cali, Colombia. Correspondencia: Angélica Castellanos, ancastellanosan@gmail.com, Carrera 97 # 45-100. Cali, Colombia.
Presentado 25 de julio de 2010, aceptado 17 de febrero de 2011, correcciones 9 de junio de 2011.
RESUMEN
El interés por obtener productos para la industria de biocombustibles a partir de desechos agrícolas, conduce a la búsqueda de nuevos sistemas biotecnológicos resistentes y costo-efectivos. Corynebacterium glutamicum, es un microorganismo usado para producir amino-ácidos que crece en gran variedad de sustratos y es resistente durante la fermentación, a variaciones de pH, temperatura, presión osmótica y acumulación de alcohol, características que lo hacen candidato a ser mejorado para la síntesis de ácido láctico y etanol. Aún se desconocen aspectos de su fisiología que aumenten su eficiencia en convertir azúcares (C5 y C6) en estos dos metabolitos. Por tanto, este trabajo buscó identificar los parámetros fisicoquímicos que tuvieron un mayor efecto sobre crecimiento bacteriano y síntesis de ácido láctico o etanol en un sistema por lotes. Para lograr este objetivo, ocho variables fueron evaluadas en un modelo estadístico producido en erlenmeyer; con los resultados obtenidos, se hallaron las mejores condiciones que fueron puestas a prueba en un cultivo en biorreactor. La temperatura, concentración de biotina y azúcar fueron las variables de mayor impacto (p< 0,05). Usando las mejores condiciones, 36 °C; 6,1 mg/L de biotina y 50 g/L de glucosa, se obtiene una µmax de 0,394 h-1, 16 g/L de ácido láctico a las 15 h del proceso con un rendimiento del 32%; observándose un mayor consumo de sustrato durante el crecimiento y poca disponibilidad para la fermentación, sugiriendo una alimentación del cultivo al final de la fase exponencial que aumente los rendimientos de producción.
Palabras clave: fermentación; Corynebacterium glutamicum; cultivo discontinuo; ácido láctico.
ABSTRACT
The interest to obtain products for the bio-fuel industry from renewable resources has directed research to find resistant and costs-effective biotechnological systems. Corynebacterium glutamicum, is a microorganism used to produce amino acids, that grows in wide variety of substrates and its resistance during fermentation to pH, temperature, osmotic pressure variations and alcohol aggregate, renders this organism a suitable candidate to improve by genetic modifications lactic acid and ethanol synthesis. However, some aspects of its physiology remain unknown, such us increase lactic acid and ethanol production from C5 and C6 sugars. For this reason, the main aim in our work was to identify the most important variables with impact on culture and the best culture conditions to produce lactic acid or ethanol in batch culture. To achieve this objective, eight variables were tested in culture using a statistical model. The best culture conditions were obtained and tested in a bacth biorreactor system. Temperature, biotin and glucose concentration were the variables with most impact (p< 0.05) in culture. Using optimal conditions, 36 °C; 6.1 mg/L of biotin and 50 g/L of glucose; a µmax of 0.394 h-1, 16 g/L of lactic acid was obtained after 15 h of culture with an efficiency of 32%. High glucose consumption was observed during bacterial growth, which leads to low concentration of substrate for the production process; this suggests a culture feeding at the end of exponential growth phase, which can increase the production yield.
Key words: Fermentation; Corynebacterium glutamicum; Batch culture; Lactic acid.
INTRODUCCIÓN
El incremento en el consumo de productos derivados del petróleo para atender las necesidades energéticas de la humanidad ha conducido a la industria e investigadores a unir esfuerzos en busca de alternativas de obtención industrial que sean innovadoras y amigables con el medio ambiente. El uso de la energía solar en forma de biomasa, representada en residuos agrícolas, permitirá hallar parte de la solución.
Aunque se ha acentuado la discusión mundial por el impacto de los biocombustibles de primera generación por su efecto sobre bosques, el uso del suelo y el precio de los alimentos (IEA, 2007); la comunidad científica, entidades gubernamentales y la sociedad civil están enfocadas en buscar fuentes alternativas de biocombustibles que disminuyan dichos impactos y la dependencia de los recursos fósiles a partir de desechos agro-industriales (Moore, 2008). En Colombia líneas de investigación en producción de biocombustibles de segunda generación, son apoyadas por entidades mixtas como Corpoica, Ministerio de Agricultura, Colciencias, programas como el de Ecopetrol-ICP y a través de convocatorias de investigación y esfuerzos internos de las universidades.
Una de las alternativas es la producción biotecnológica costo efectiva de productos químicos en masa a partir de recursos renovables. En particular el Valle del Cauca enfoca sus investigaciones en la recuperación de productos químicos de interés para la industria de bio refinerías a partir de residuos de cosecha de la caña de azúcar.
El ácido láctico es un químico con una amplia aplicación en nutrición, cosmética, farmacéutica, industria de cueros y textil. Tiene además una reciente atención en la fabricación de plásticos biodegradables a partir de poli lactiácidos, con propiedades similares a las del polietileno, con ventajas para su uso en biomedicina, por su biocompatibilidad, baja citotoxicidad y fácil bioreabsorción permitiendo su aplicación en ortopedia, odontología, cirugía cardiovascular y gastrointestinal.
Otro metabolito bacteriano, el etanol es una de las alternativas para aliviar la dependencia a recursos fósiles; su ventaja radica en que el CO2 generado en su combustión constituye alimento para plantas sin comprometer el ciclo natural de CO2 atmosférico y recientemente, planteado como recurso para la producción de biocombustibles de tercera generación como otra alternativa de energía del futuro (Brennan et al., 2010). La síntesis de metabolitos de interés se puede hacer por procesos químicos; teniendo la fermentación ventajas como la reducción de subprocesos adicionales que incrementan los costos de producción, los impactos negativos sobre el medio ambiente y la eficiencia encontrada con el empleo de microorganismos.
Tradicionalmente las fermentaciones han sido utilizadas en el campo de la nutrición y la farmacología para la producción de ácidos orgánicos, alcoholes, vitaminas y medicamentos. La síntesis de etanol y ácido láctico, es posible gracias a la acción de microorganismos como levaduras y lacto bacterias (Sacharomices cerevisiae, Schizosaccharomyces pombe, Pichia stipidis, Z. mobilis, E. coli, Klebsiella oxytoca, Lactobacillus, etc.; Bauban et al., 2010). Sin embargo, las propiedades metabólicas de estos microorganismos, como periodos largos de crecimiento, baja viabilidad y fragilidad a condiciones rústicas de cultivo, han conducido a la búsqueda de microorganismos que produzcan grandes cantidades de etanol o ácido láctico en corto tiempo y a bajo costo de producción. Este trabajo aborda en principio, la búsqueda de los mejores parámetros físico-químicos de crecimiento en Corynebacterium glutamicum para la síntesis de ácido láctico o etanol bajo el sistema de cultivo en lote; que a futuro puedan ser aplicados a nivel industrial con desechos agrícolas provenientes de la caña de azúcar.
MATERIALES Y MÉTODOS
ESTRUCTURA METODOLOGICA Y DISEÑO DE EXPERIMENTOS
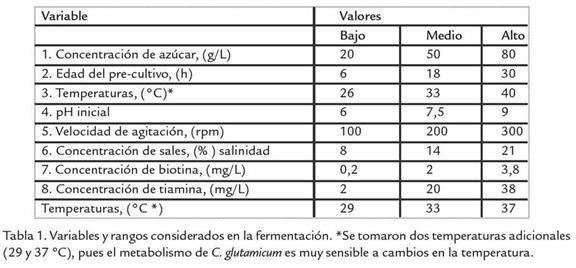
Pruebas para la identificación de las condiciones del cultivo. Ocho condiciones o variables de cultivo, con sus respectivos rangos de trabajo fueron seleccionadas teniendo en cuenta la revisión bibliográfica (Delaunay et al., 2002; Dominguez et al., 1993; Dominguez et al., 1997, Okino et al., 2008), enfocada al estudio metabólico de C. glutamicum para la síntesis de glutamato y lisina, con el objetivo de escoger tres que tuvieran los impactos más significativos sobre síntesis de biomasa, ácido láctico y etanol. Al rango de trabajo de cada una de las variables en estudio se les asignó un valor alto, medio y bajo (Tabla 1). Mientras una variable asumió su valor alto o bajo, las demás se mantuvieron en su valor medio. Cada una de las variables fue evaluada en un sistema de fermentación dividido en dos fases, de reproducción y síntesis en donde la bacteria creció a una máxima velocidad específica (µmáx) con un rendimiento de biomasa (YX/S; gramos de biomasa producidos por gramos de sustrato consumidos) propio de cada ensayo y seguido de una fase de producción. Adicionalmente, se hicieron cinco ensayos en donde todas las variables tomaron su valor medio (Tabla 1). Para cada cultivo, se hizo un seguimiento durante la fase de reproducción (aerobiosis) de 8 h. Luego, los erlenmeyers fueron sellados para continuar la fermentación por 40 h más. Una vez realizadas las pruebas, se graficaron los datos de concentración de biomasa y ácido láctico en el tiempo.
Búsqueda de las mejores condiciones de crecimiento bacterial. Este estudio se hizo para determinar las mejores condiciones de cultivo que rindieran en una alta cantidad y velocidad de síntesis de biomasa durante la fase de crecimiento antes de la fase de producción. Se tomó como criterio para desarrollar esta metodología el buscar una dosis de microorganismos en el menor tiempo posible durante la fase de reproducción, para garantizar disminución en costos energéticos por tiempo, en el uso de equipos y de nutrientes, que incrementen la eficiencia en la obtención del producto en un sistema por lotes. Las tres variables escogidas en las pruebas de identificación, fueron evaluadas aplicando un diseño factorial 23 con cinco puntos centrales y puntos estrella para determinar su influencia sobre las variables de respuesta (máxima velocidad de crecimiento y máxima biomasa obtenida al final de la fase exponencial). De acuerdo con los resultados de identificación de variables de cultivo se eligieron los siguientes factores con sus respectivos niveles, para desarrollar el diseño factorial de experimentos: temperatura a 30,0 y 36,0 ± 0,1 °C, concentración inicial de glucosa: 20 g/L y 50 g/L y concentración inicial de biotina: 0,02 mg/L y 4 mg/L; con valores para punto central de 33,0 °C, 34 g/L de glucosa y 2,01 mg/L de biotina. Luego de aplicar el análisis del diseño factorial, la superficie de respuesta encontrada, condujo un rango de valores más estrecho para la aplicación de un diseño Box-Behnken (BBD) para aproximar las mejores condiciones de las variables de respuesta.
Los resultados del diseño factorial, determinaron que las tres variables tenían un fuerte impacto sobre el cultivo y se halló una superficie aproximada para encontrar las mejores condiciones de crecimiento bacteriano. A partir de éstos resultados, se realizó una estimación del error y verificación de los efectos cuadráticos. Posteriormente, fue aplicado el BBD, obteniendo una superficie de respuesta de segundo orden. Para verificar la curvatura de los efectos de segundo orden, cinco puntos centrales se agregaron al BBD. Las variables de respuesta de BBD fueron, µ y D.O al final de la fase exponencial. El BBD fue aleatorizado y cada prueba se hizo por triplicado. Los valores máximos y mínimos para cada factor del diseño fueron ajustados según los datos obtenidos del diseño factorial. Luego, se construyó un modelo de superficie de respuesta y se determinaron las condiciones óptimas para maximizarlas. Seguidamente, las condiciones fueron ensayadas en un biorreactor y ajustadas a las ecuaciones de cinética más adecuadas. Dado que el diseño BBD no contiene ningún punto en los vértices de la región cúbica creada por los límites superiores e inferiores de cada variable, resulta en un diseño económico y más eficiente que el diseño rotacional central compuesto por lo que fue seleccionado para encontrar las mejores condiciones de las variables (Ferreira et al., 2007).
CEPA BACTERIAL Y COMPOSICIÓN DEL MEDIO
La cepa usada en este estudio fue C. glutamicum 2262, proveída por el Laboratorio de Ciencias Genéticas y Químicas, Escuela Nacional Superior de Agronomía y de Industrias Alimentarias, Universidad de Nancy. El medio empleado para mantener la cepa fue MCGC (Medium Corynebacterium glutamicum culture) descrito previamente por Delaunay et al., 1999a. En este estudio, la glucosa fue usada como fuente de carbono para los inóculos a una concentración de 34 g/L y xilosa, sacarosa o glucosa para cada uno de los ensayos a desarrollar a una concentración que osciló entre 20-80 g/L.
VALIDACIÓN DEL PROCESO DE FERMENTACIÓN EN ERLENMEYER
Previo a la identificación de variables, se realizó una validación del proceso, usando un multímetro detector de oxígeno (HACH HQd), para constatar la saturación y consumo durante la fase de reproducción de C. glutamicum, en un erlenmeyer bafleado de tres aristas marca Kimble® y servido con 10% de su capacidad volumétrica con medio de cultivo MCGC modificado (Delaunay et al., 1999a). Posteriormente el recipiente fue sellado con un tapón de algodón, cubierto con papel aluminio y papel parafilm para asegurar anaerobiosis durante la fase de producción. Para está validación, se consideró una velocidad de agitación de 200 rpm en un incubador de agitación orbital (ShelLab, Alemania) a 33 ºC.
CONDICIONES DE FERMENTACIÓN
Para la preparación de inóculos, crioviales con 1,5 mL de la cepa se descongelaron y pusieron en 25 mL de medio MCGC en erlenmeyer bafleado de 250 mL a 33 ºC, 200 rpm y 7,5 de pH inicial, por 6, 18 o 30 h. Para las pruebas de identificación de condiciones de cultivo; fue necesario primero elegir entre glucosa, sacarosa o xilosa, la fuente de carbono que produjera el mayor rendimiento de biomasa; siendo la glucosa el azúcar seleccionado. Después, las ocho variables fueron ensayadas con sus respectivas réplicas para un valor mínimo, medio y máximo en erlenmeyers de 500 mL con 50 mL de medio (Tabla 1). Cada cultivo, fue inoculado con 10% v/v de bacterias provenientes del precultivo; con seguimiento cada 2 h en las primeras 8 h de cultivo y al final de la fermentación (48 h). Una vez identificadas las tres variables con mayor impacto sobre el cultivo, se realizaron fermentaciones para las mejores condiciones de las variables de respuesta, siguiendo un diseño factorial 23 y BBD. Posteriormente, fueron confirmadas las mejores condiciones obtenidas en el modelo estadístico en un escalamiento a 1,5 L de medio en biorreactor, (INFORS HT, Minifors Benchtop) alimentado con 5 L/h de aire, mezclado a 1.200 rpm durante las primeras 8 h para µ y 12 h para la máxima D.O. y a 300 rpm, después de la suspensión de aire, durante la fase de producción a un pH de 7,5.
DETERMINACIÓN DE BIOMASA Y PRODUCTOS EXTRACELULARES
Durante el seguimiento de los cultivos en erlenmeyer, se tomaron muestras cada 2 h durante la fase de reproducción y una al final de la fermentación. Para el caso de los cultivos en biorreactor se realizó seguimiento al inicio del cultivo, previo a la suspensión de aire e inicio de la fermentación y cada 2 h durante la fase de producción; para determinar la concentración de biomasa, ácido láctico y azúcar residual.
Cuantificación de biomasa celular. La biomasa fue determinada por espectrofotometría a 570 nm (ThermoSpectronic modelo Génesis 20). La absorbancia obtenida dentro del rango de la curva de calibración, fue ajustada en g/L usando un factor de conversión, previamente establecido por gravimetría celular o peso seco/mL de medio después de una filtración con membrana de 0,45 m. (Delaunay et al., 1999b). Además, al inicio de cada cultivo se realizó un recuento de células viables en agar BHI (Brain Heart Infusion) al 2,5%, después de 48 h de incubación a 33 °C (Madigan et al., 2004).
Cuantificación de azúcares, ácido láctico y etanol. 3 mL de cultivo se centrifugaron a 4.000 x g (micro centrífuga Beckman®) por diez minutos; los sobrenadantes obtenidos fueron congelados a -20 ºC previo a su análisis. Luego, cada sobrenadante descongelado fue tratado para retirar las impurezas de las muestras antes de su análisis por cromatografía líquida o HPLC (High Performance Liquid Cromatography) usando un cromatógrafo Shimadzu; LC Solution; Kioto-Japón y una columna de exclusión iónica (Shodex SH 1011), operada a 60 ºC con H2SO4 (0,01 N) como fase móvil a 0,6 mL por minuto. Los azúcares fueron leídos por una celda de índice de refracción y el ácido láctico a 190 nm. La integración para detección y la cuantificación de los azúcares y ácido láctico se realizó mediante la comparación de curvas estándar que fueron analizadas en el software LC Solution de Shimadzu.
Para detectar el alcohol en el sobrenadante, se utilizó el método de Winnick (Winnick, 1942). La reacción de óxido-reducción de etanol con dicromato de potasio, fue determinada por titulación con tiosulfato de sodio 0,1 N y almidón usado como indicador. Los mililitros gastados de solución de titulación se compararon con la curva de calibración, donde muestras de concentración conocida de etanol fueron tituladas con la misma solución.
ANÁLISIS DE LA INFORMACIÓN
Previo al análisis de la concentración de biomasa, consumo de azúcar y síntesis de ácido láctico durante la fermentación; y con el fin de observar la reproducibilidad de los experimentos, se evaluaron las diferencias estadísticas entre los datos de réplicas y ensayos mediante una prueba t-Student. Posteriormente, se realizó un análisis de regresión lineal a cada una de las curvas de concentración de biomasa, para determinar la pendiente o velocidad específica de crecimiento (µ). Se calcularon los rendimientos de biomasa (YX/S) y de síntesis de ácido láctico (YP/S) durante la fermentación; usando las ecuaciones descritas por Aiba et al., 1973.
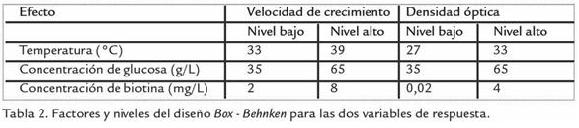
Un análisis de varianza (ANOVA) fue realizado usando una base de datos que fue corrida en el paquete estadístico STATGRAPHICS Centurion XV.II de StatPoint Technologies, Inc., 2008; a fin de determinar las diferencias significativas entre cada uno de los valores con un intervalo de confianza de 95%. Para esto, se compararon los valores medios para los tres niveles de la variable a analizar. La prueba F en el ANOVA determinó si había diferencias significativas entre las medias con un intervalo de confianza de 95%. En los casos en los que se encontraron diferencias, se usó una prueba de rango múltiple para decidir cuáles medidas eran significativamente diferentes de otras. Para este análisis, se establecieron como variables independientes temperatura, pH inicial, edad del precultivo, velocidad de agitación y concentración de: sales, sustrato, biotina y tiamina. Como variables de respuesta se establecieron, µ y los rendimientos para producción de biomasa y ácido láctico. En los diseños experimentales (factorial 23 y Box Behnken) se establecieron en el ANOVA como variables independientes temperatura, concentración de biotina y glucosa. Y como variables de respuesta, la µ, y D.O. obtenida al final de la fase exponencial de crecimiento (Tabla 2).
RESULTADOS
IDENTIFICACIÓN DE LAS CONDICIONES DEL CULTIVO
Con el fin de realizar un tamizaje de las variables que afectaran el crecimiento bacteriano y su velocidad de formación y que repercutieran en un efecto sobre la producción de ácido láctico en cultivos en lote; se realizaron un serie de ensayos que se resumen en la tabla 3, en donde se registran los valores promedio de réplicas por triplicado de velocidad específica de crecimiento (µ), concentración final de ácido láctico, el rendimiento de síntesis de ácido láctico y biomasa. Aunque se hizo la determinación de etanol por el método de Winnick, no se detectaron concentraciones dentro del rango de sensibilidad de la prueba (2% etanol) por tanto no fueron reportadas. La concentración de células al inicio de los cultivos (t = 0 h) osciló entre 2,8 g/L (1,92 x 109 unidades forma-doras de cultivo por mL o UFC mL), excepto para el precultivo a 6 h de crecimiento que contó con 0,40 g/L de biomasa (2,1 x 107 UFC/mL). Los coeficientes de correlación para las velocidades de crecimiento específicas variaron entre 0,96 y 0,99.
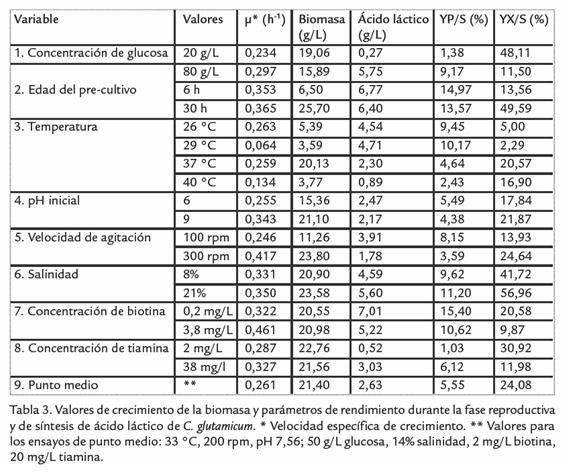
Como resultados importantes se encontró que cuando C. glutamicum creció en medio con glucosa a 80 g/L, se incrementó más la µ que cuando creció en glucosa a 20 g/L. Sin embargo, a 80 g/L se observaron 2 h de latencia y una disminución de la cantidad de biomasa al final de la fase exponencial. La baja síntesis de ácido láctico en el cultivo de menor concentración de glucosa, fue atribuida a una limitación de sustrato durante la fase de producción.
De otro lado, en cultivos con inóculos jóvenes (6 h); aunque la µ fue una de las más altas (0,35 h-1) la biomasa obtenida al final de la fase exponencial fue mínima (6,5 g/L), y a pesar que la bacteria siguió creciendo durante la fase anaeróbica, esto no fue suficiente para superar la biomasa obtenida en los otros ensayos (16,4 g/L a las 48 h de fermentación), la baja cantidad de biomasa, producto de una baja concentración de células inoculadas al inicio de cultivo, no afectó la síntesis de ácido láctico, que fue una de las mayores en esta fase de la investigación y casi igual al obtenido en la prueba que usó un inóculo de 30 h de cultivo; en donde se invirtió casi la mitad de glucosa, para la reproducción y mantenimiento celular. A temperaturas bajas (26-29 ºC), el tiempo de latencia del cultivo fue más largo (8 a 6 h respectivamente) con una baja síntesis de biomasa. De otro lado, a 33 ºC (pruebas en el punto medio) y 37 °C, las bacterias crecieron con una µ adecuada (0,26 h-1) y sin latencia, lo que condujo a una alta concentración de biomasa. La síntesis de ácido láctico fue mayor a temperaturas bajas (2629 ºC), con una disminución del consumo de glucosa para producción de biomasa, contando con más cantidad de sustrato para la fase de producción.
Un pH inicial bajo o alto parece no tener impacto sobre la síntesis de ácido láctico de C. glutamicum (Tabla 3). En tanto que la velocidad específica de crecimiento, mostró una tendencia a aumentar a medida que el pH inicial del cultivo se incrementa. Cuando el pH inicial fue seis, las bacterias estuvieron 2 h en fase de latencia, mientras que cuando el cultivo inició con un pH de 7,56 o de 9, la fase exponencial comenzó inmediatamente se hizo el inóculo.
Como era de esperarse, una velocidad de agitación mayor aumentó la saturación y disponibilidad de oxígeno en el medio de cultivo, lo que aceleró el crecimiento y provocó una mayor cantidad de biomasa, con una menor disponibilidad de sustrato en la fase productiva y muy poca síntesis de ácido láctico.
Los cambios en la concentración de biotina, afectaron tanto la concentración y velocidad específica de formación de biomasa como la síntesis de ácido láctico. Algo similar se observó en el caso de tiamina, en donde a una concentración alta o baja se obtuvo mayor velocidad específica de crecimiento y mayor cantidad de biomasa, que la obtenida con una concentración intermedia. Sin embargo, la concentración baja de tiamina disminuyó la síntesis de ácido láctico y favoreció la síntesis de otros subproductos, los cuales fueron evidenciados en el análisis de perfiles cromatográficos. Aunque estos no fueron cuantificados, se compararon los tiempos de retención con los datos teóricos de fermentación obtenidos en la columna Shodex 1011 y reportados por la casa comercial los cuales sugieren tiempos de retención para ácido succínico y ácido acético.
Para determinar cuáles variables afectan más el crecimiento de C. glutamicum, se hizo primero un análisis de correlación entre las variables de respuesta, indicando que cada una de ellas eran independientes, con un grado de asociación <0,6. Luego, se realizó un análisis de varianza (ANOVA) entre el valor bajo, medio y alto de cada variable. Las variables con p <0,05 fueron consideradas significativas para velocidad específica de crecimiento (µ), concentración de biomasa y ácido láctico, los rendimientos en producción de biomasa (YX/S) y producto (YP/S). Se encontró que temperatura, concentración de biotina y glucosa tienen el mayor impacto sobre crecimiento y fermentación.
Variaciones en temperatura y concentración de biotina mostraron cambios significativos en la mayoría de las variables de respuesta. Debido a que la velocidad de agitación afecta positivamente la velocidad de crecimiento y cantidad de biomasa, se optó por dejarla constante en un valor máximo de 250 rpm para los siguientes experimentos, valor que permite una estabilidad en el rotor del equipo de incubación (ShelLab, Alemania). De igual manera, se decidió tomar la concentración inicial de glucosa como otra variable influyente; ya que, al realizar cultivos en lotes, de ésta depende la cantidad de sustrato disponible para ser convertido en el producto de interés. Las demás variables se consideraron de menor influencia; por tanto, se dejaron constantes en su valor medio para los experimentos siguientes. Estas variables seleccionadas fueron tomadas para realizar un diseño factorial y luego un BBD que evaluara la posible influencia sobre el crecimiento con impacto sobre la producción de ácido láctico en el establecimiento de los mejores parámetros físicoquimicos en el cultivo.
ESTABLECIMIENTO DE LAS MEJORES PARÁMETROS FÍSICO-QUÍMICOS DE CRECIMIENTO EN CULTIVO POR LOTES
La figura 1 muestra los efectos de las tres variables analizadas. La temperatura indicó que tiene un efecto positivo sobre la velocidad específica de crecimiento; a medida que se incrementa la temperatura se obtienen velocidades de crecimiento más altas pero de corta duración (de 4 a 8 h), resultando en concentraciones de biomasa menores que los cultivos que se realizaron a baja temperatura y que crecieron a velocidades menores pero con tiempos de cultivo más largos (de 10 a 12 h).
Lo contrario fue observado con densidad óptica (D.O.), al final de la fase exponencial, donde la temperatura tiene un efecto negativo sin ser significativo por sí solo; sin embargo cuando se analiza su interacción con concentración de glucosa y biotina, éstos actúan negativamente sobre la respuesta. La principal influencia sobre la concentración de bacterias o D.O., se encuentra dada por la concentración de glucosa, ya que a un valor mayor se obtuvo mayor cantidad de biomasa, pero con una velocidad de formación más lenta resultando en fases exponenciales largas (aproximadamente 12 h). De otro lado, el efecto de la concentración de glucosa sobre la velocidad de crecimiento no es significativo sobre esta respuesta; pero cobra importancia su significancia con efecto positivo en su interacción con la concentración de biotina (Fig. 1).
Para determinar los mejores valores de las variables de respuesta, se hizo un diseño de experimentos cuadrático, tomando los mismos factores del diseño factorial, pero con diferentes valores para cada una de las variables de respuesta (Tabla 3).
Según los resultados del diseño factorial 23, la producción de biomasa se favorece a temperaturas cercanas a 30 ºC y concentraciones de biotina de 0,02 mg/L y la µ aumenta a temperaturas un poco más altas (36 ºC) con mayores concentraciones de biotina (4 mg/L). Por esto, se decidió tomar intervalos diferentes de temperatura y concentración de biotina para cada una de las variables de respuesta.
Los resultados promedio, de ANOVA, se ajustaron a un modelo cuadrático o BBD basado en la ecuación 1, donde i representa la variable de respuesta en unidades de h-1 para la velocidad específica de crecimiento y absorbancia para la densidad óptica, A la temperatura en °C, B la concentración de glucosa en g/L y C la concentración de biotina en mg/L. Los coeficientes de regresión y de correlación se consignan en la tabla 4.
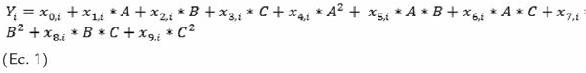
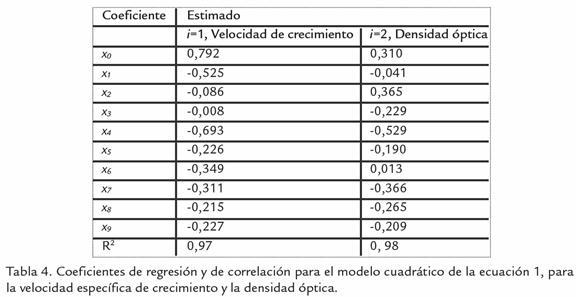
El mayor valor absoluto de coeficientes de regresión para µ es el obtenido por el intercepto, lo cual explica que otros factores o condiciones no incluidas en el diseño podrían tener mayor impacto sobre esta respuesta. A pesar de esto, en términos de valores absolutos, el coeficiente que acompaña a la variable temperatura (A), podría indicar que los cambios en temperatura tuvieron alguna influencia y pudieran ser más representativos sobre µ que las otras dos variables o sus interacciones. Para la densidad óptica, la variable que mayor efecto tuvo fue la concentración de glucosa. Al graficar las superficies de respuesta que representan la ecuación 1 (Fig. 2), se observa que los planos tienen diferentes ángulos de inclinación, esto es consistente con lo observado experimentalmente, donde a medida que se variaban condiciones para aumentar velocidad de crecimiento, la biomasa al final de la fase de reproducción iba disminuyendo, pues la duración de dicha fase se hacía más corta. Adicionalmente, los coeficientes de correlación de cada modelo estadístico cercanos al 0,98 explican que los efectos en las variables de respuesta, en particular para la concentración de microorganismos, están explicadas experimentalmente por la concentración de glucosa y que para el caso de la velocidad específica de crecimiento, podrían otras variables no estudiadas en el modelo tener un impacto sobre esta respuesta, considerando a la temperatura con sus interacciones como un parámetro de cultivo a tener en cuenta.
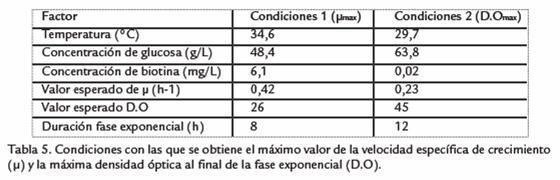
Usando el paquete estadístico Statgraphics Centurion XV, se halló un conjunto de mejores condiciones para cada variable de respuesta. Condiciones uno: se obtiene el máximo valor de velocidad específica de crecimiento (µ = 0,396 h-1). Condiciones dos: se obtiene el máximo valor de densidad óptica al final de la fase exponencial (D.O = 45,18). Comparando los resultados máximos de µ y D.O obtenidos en las mejores condiciones de las variables con los resultados esperados según las pruebas preliminares y el diseño factorial (Tabla 5), se observó que son similares, lo que permite afirmar que el diseño estadístico es una buena aproximación matemática de los datos reales.
ESTUDIO DE LA CINÉTICA DE FERMENTACIÓN
Con las condiciones de cultivo encontradas en el análisis de los diseños estadísticos se hicieron cultivos en lotes a dos condiciones de trabajo (condiciones uno: 35°C, 50 g/L de glucosa y 6,1 mg/L de biotina y condiciones dos: 30 °C, 65 g/L de glucosa y 0,02m mg/L de biotina) en un biorreactor de 5 L con 1,5 L de volumen de trabajo. Las variaciones en la concentración de: glucosa, biomasa, oxígeno y ácido láctico, se observan en las figura 3 y figura 4 y los valores de algunos parámetros cinéticos se encuentran resumidos en la tabla 6.
Para las condiciones de cultivo 1 (Fig. 3), la entrada de oxígeno se interrumpió a las 7,1 h de cultivo y en aproximadamente 0,3 h adicionales, la saturación de oxígeno llegó al 0%. Inmediatamente fue suspendido el oxígeno, se inició la síntesis de ácido láctico hasta las 15 h de cultivo, tiempo en el cual se agotó la glucosa. A pesar de la limitación de sustrato, no hubo un reconsumo del producto.
En el cultivo realizado bajo las condiciones 2 (Fig. 4), la alimentación de oxígeno se mantuvo hasta las 12 h, sin embargo una concentración alta de bacterias reflejó un elevado consumo de oxígeno durante las primeras 8 h de cultivo disminuyendo su saturación a un 6,4% y hasta un 0% en las 10 h de cultivo, previo a la suspensión de aire programada (12 h); tiempo en el cual se observó un pico de síntesis de ácido láctico. Pese al inicio de producción, éste fue afectado por el consumo absoluto del sustrato durante la fase reproductiva frenando la actividad bacteriana y por ende la fase de producción del cultivo.
DISCUSIÓN
Aunque, cinéticamente se ha descrito el crecimiento de C. glutamicum en un medio definido; éstos estudios han sido orientados a mejorar la síntesis de glutamato y lisina (Khana et al., 2005; Bona y Moser, 1997; Dominguez et al., 1997) y aun no se han reportado los efectos de las variaciones en el microambiente bacteriano, que mejoren la síntesis de ácido láctico o etanol de C. glutamicum. En este estudio, estamos reportando los mejores valores para crecimiento o fase de reproducción en cultivo en lote hallados mediante un método estadístico a pequeña escala y experimentalmente ensayado en biorreactor para la síntesis de ácido láctico.
Variaciones en temperatura, concentración de glucosa y biotina mostraron cambios significativos en las variables de respuesta, encontrando que, el cultivo de C. glutamicum 2262 a valores óptimos de: 36 °C, 50 g/L, de glucosa inicial y 6,1 mg/L de biotina, se logra la mayor µ (0,394 h-1) con la mayor concentración de ácido láctico (16 g/L) en 15 h del cultivo y sin reconsumo de metabolito.
Investigaciones realizadas con C. glutamicum 2.262 recombinante para ldhA/pCRB201 de Lactobacillus delbruekii (Okino et al., 2008) alcanzaron los 120 g/L de ácido láctico obtenidos en 100 mL de medio; sin establecer los valores de cultivo para biorreactor que aseguren estabilidad genética y crecimiento de la bacteria. Valores cercanos a los obtenidos por nosotros con la misma cepa fueron obtenido por choque térmico a 40 ºC, pero con un re-consumo del metabolito en el tiempo (Delaunay et al., 2002).
Aunque la identificación de las variables para este estudio fue obtenida en un diseño experimental a pequeña escala, las aproximaciones estadísticas y los resultados obtenidos en erlenmeyer fueron similares a los encontrados en el biorreactor, a pesar que el tipo de agitación y el control de pH fueron diferentes. Menor síntesis de ácido láctico se obtuvo en erlenmeyer atribuida probablemente a disminución de pH en el tiempo, propia de la fermentación y que no pudo ser controlada bajo este sistema.
Por otra parte, parece existir un efecto de la dosis bacteriana sobre el rendimiento del producto relacionado con la disponibilidad de sustrato y saturación de oxígeno en el medio. Debido en parte a la velocidad de agitación del cultivo durante la fase de reproducción que tuvo un efecto positivo sobre la velocidad de crecimiento y la cantidad de biomasa obtenida previa a la fermentación. No obstante, un aumento en la velocidad de crecimiento o una alta densidad bacteriana disminuyen considerablemente la disponibilidad de azúcar para el proceso de fermentación impactando negativamente sobre la producción.
La concentración inicial de glucosa juega un papel importante al realizar cultivos en lotes, de esta depende la cantidad de sustrato disponible para ser convertido en producto. A pesar de obtenerse una cantidad suficiente de ácido láctico a concentraciones de 80 g/L, los valores óptimos que condujeron a una mayor producción se encontraron entre 60 y 50 g/L. Tal vez, por un aumento en osmolaridad del medio cuando se incrementa la concentración y a una limitación en el sustrato a medida que la concentración disminuye.
A 34 ºC las corinebacterias empezaron síntesis de ácido láctico 2 h después de haber iniciado fermentación. Una reducción importante en la producción se vio comprometida con incremento de temperatura, contrario a lo reportado por Delaunay et al., 2002, con la misma cepa; que logró obtener ácido láctico a temperaturas superiores de 40 ºC. Lo que sugiere una bipartición del proceso en reproducción (34 a 37 ºC) y de síntesis de ácido láctico (menores a 34 ºC). La temperatura adecuada para el crecimiento de bacterias mesófilas está entre 30 y 37 ºC. A una temperatura de 40 °C se perturba la actividad de las enzimas de C. glutamicum en un 40%, principalmente de aquellas que intervienen en la síntesis de biomasa, ocasionando daños en la pared celular y desviando su actividad a la reparación, disminuyendo notablemente la producción de biomasa y productos de la fermentación (Delaunay et al., 2002). A una temperatura inferior a 34 ºC se aumenta la latencia, se retarda la fase exponencial, pero se logra mantener velocidad de crecimiento y obtener buena cantidad de bacterias para la producción. De otro lado, aumento en la concentración de biotina parece favorecer el flujo de carbono que incrementa síntesis de biopolímeros importantes en crecimiento celular.
Aunque fueron estudiadas algunas de las variables que pudieran tener mayor impacto sobre el cultivo, se encontró que los mejores valores para maximizar las dos variables de respuesta fueron distintos y podrían ser explicadas por otros factores. A medida que se variaban las condiciones para aumentar la velocidad de crecimiento, se iba disminuyendo la biomasa al final de la fase de reproducción y dicha fase se hacía más corta (8 horas). En tanto que para alcanzar una máxima densidad de biomasa fue necesario aumentar la concentración de glucosa, disminuir temperatura y concentración de biotina; aumentando la duración de la fase exponencial (12 h).
Aunque es importante identificar de los factores con mayor impacto sobre el cultivo de C. glutamicum para producción de metabolitos; lo es aún más el estudio de sus interacciones. Estas interacciones ha permitido comprender fenómenos fisiológicos bacterianos como el uso de vías anapleuróticas para la obtención de subproductos, que llevarán al desarrollo del plano metabólico de la cepa para el establecimiento de condiciones de cultivo que puedan ser utilizadas con sustratos como hidrolizados provenientes de residuos agrícolas o de mayor oferta industrial como melaza, jugo de caña o jugos de proceso, ya sea en sus concentraciones originales o diluidas. En donde sea posible determinarse si existe el efecto de elementos presentes en el sustrato que resulten inhibidores de crecimiento. Así mismo continuar con aproximaciones metodológicas que permitan utilizar pentosas en mezclas con diferentes proporciones de hexosas, ya que por transporte facilitado es posible la asimilación de este tipo de sustratos.
Durante este estudio no se logró establecer los parámetros físicoqumicos o condiciones de cultivo para la síntesis de alcohol. Lo cual depende de estudios bioquímicos y moleculares que logren identificar la expresión enzimas como alcohol deshidrogenasa (ADH), aldolasas y acetolasas y den cuenta de su actividad.
CONCLUSIONES
La conclusión o aporte más importante de este trabajo, lo constituye la herramienta metodológica que permitió evaluar y reportar los mejores parámetros físico-químicos del cultivo para aumentar el rendimiento en la concentración de bacterias que tienen un efecto sobre la síntesis de ácido láctico a través de la explicación de datos experimentales en biorreactor para la síntesis de ácido láctico en un cultivo por lotes.
Se concluyó además que, un pH inicial bajo o alto parece no tener un impacto sobre la síntesis de ácido láctico por parte de C. glutamicum; lo que significa que, en futuras fermentaciones ácido-lácticas, donde el pH tiende a disminuir, no se verá afectada la producción por acidificación del medio.
Encontramos que las condiciones que más influyen en el crecimiento y la síntesis de ácido láctico en un cultivo por lote son: la temperatura y la concentración de glucosa.
AGRADECIMIENTOS
Los autores agradecen a la doctora Cristina Ramírez y al ingeniero Jairo Salcedo por sus contribuciones académicas y técnicas, al personal técnico y profesional de laboratorio de bacteriología del departamento de microbiología de la Universidad del Valle por su apoyo incondicional en la parte profesional e infraestructura.
Los autores declaran no tener ningún conflicto de interés con la comunidad científica, económica, comercial o industrial.
Este trabajo fue financiado por Vicerrectoría de investigaciones de la Universidad del Valle a través de convocatoria interna proyecto código: CI: 614, A LA UNIVERSIDAD AUTONOMA DE OCCIDENTE mediante convocatoria interna, resolución 6414 del 20/12/06.
BIBLIOGRAFÍA
AIBA S, HUMPHREY A, MILLIS N. Biochem Eng J. 2nd ed. New York, Academic Press; 1973.
[ Links ]BAUBAN B, INOUE H, YANO S, TANAPOGPIPAT S, RUANGLEK V, CHAMPREDA V et al. Bioethanol production from ball milled bagasse using an on-site produced fungal enzyme cocktail and xylose-fermenting Pichia stipitis. J Biosci Bioeng. 2010;110(1):18-25.
[ Links ]BONA R, MOSER A. Modelling of the L-glutamic acid production with Corynebacterium glutamicum under biotin limitation. Bioprocess Eng. 1997;17:139-142.
[ Links ]BRENNAN L, OWENDE P. Biofuels from microalgae. A review of technologies for production, processing, and extractions of biofuels and co-products. Renew and Sust Energ Rev. 2010;14(2):557-577.
[ Links ]DELAUNAY S, GOURDON P, LAPUJADE P, MAILLY E, ORIOL E, ENGASSER J, et al. An improved temperature-triggered process for glutamate production with Corynebacterium glutamicum. Enzyme Microb Tech. 1999a;25:762-768.
[ Links ]DELAUNAY S, LAPUJADE P, ENGASSER J, GOERGEN J. Flexibity of the metabolism of Corynebacterium glutamicum 2262, a glutamic acid-producing bacterium, in response to temperature upshocks. J Ind Microbiol Biotechnol. 2002;28:333-337.
[ Links ]DELAUNAY S, UY D, BAUCHER M, ENGASSER M, GUYONVARCH A, GOERGEN J. Importance of Phosphoenolpyruvate carboxylase of Corynebacterium glutamicum during the themperature triggered glutamic acid fermentation. Metab Eng. 1999b;1:334-343.
[ Links ]DOMINGUEZ H, COCAING-BOUSQUET M, LINDLEY N. Simultaneous consumption of glucose and fructose from sugar mixtures during batch growth of Corynebacterium glutamicum. Appl Microbiol Biotechnol. 1997;47:600-603.
[ Links ]DOMINGUEZ H, NEZONDET C, LINDLEY M, COCAIGN M. Modified carbon flux during oxygen limited growth of Corynebacterium glutamicum and the consequences for amino acid overproduction. Biotechnol Lett. 1993;15:449-454.
[ Links ]FERREIRA S, BRUNS R, FERREIRA H, MATOS G, DAVID J, BRAND G, et al. Box-Benhken: An alternative for the optimization of analytical methods. Anal Chim Acta. 2007; 597:179-186.
[ Links ]IEA. IEA. technology essentials -biofuel production. International Energy Agency; 2007.
[ Links ]KHAN N, MISHRA I, PRASAD B. Modeling the growth of Corynebacterium glutamicum under product inhibition in L-glutamic acid fermentation. Biochem Eng J. 2005;25:173-178.
[ Links ]MADIGAN M, MARTINKO J, PARKER, J. Biología de los Microorganismos. Madrid: Prentice Hall; 2004.
[ Links ]MOORE A. Biofuels are dead: long live biofuels(?)-part one. New Biotechnol. 2008;25(1):6-12.
[ Links ]OKINO S, SUDA M, KEITARO F, INUI M, YUKAWA H. Production of D-lactic acid by Corynebacterium glutamicum under oxygen deprivation. Appl Microbiol Biotechnol. 2008; 78:449-454.
[ Links ]WINNICK T. Determination of ethyl alcohol by microdiffusion. Ind Eng Chem Anal. Ed. 1942;14 (6):523-525.
[ Links ]













