Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.16 n.2 Bogotá maio/ago. 2011
EFECTO DE BORDE SOBRE EL PROCESO DE DESCOMPOSICIÓN DE HOJARASCA EN BOSQUE NUBLADO
Edge Effect on the Decomposition Process of Leaf Litter in Cloud Forest
MAURICIO ROMERO-TORRES1, M.Sc.; AMANDA VARELA RAMÍREZ1, Ph. D.
1 Unidad de Ecología y Sistemática (UNESIS), Departamento de Biología, Pontificia Universidad Javeriana. Bogotá, Colombia. Carrera 7 # 43-82, Edificio 53, Laboratorio 406 B. Teléfono: 57 (1) 320 83 20, ext. 4171. Research ID: A-9086-2009. mauricio_romero@javeriana.edu.co, avarela@javeriana.edu.co
Presentado 20 de septiembre de 2010, aceptado 24 de marzo de 2011, correcciones 5 de abril de 2011.
RESUMEN
Los fragmentos de bosque están delimitados por bordes y rodeados de matriz circundante. La interacción entre estas comunidades disímiles en estructura y composición, se define como efecto de borde. Este fenómeno genera localmente cambios abióticos y bióticos alterando procesos ecosistémicos del suelo. Para determinar la existencia de este efecto sobre la descomposición de hojarasca y sus factores de control, se seleccionaron dos fragmentos de bosque nublado en la Sabana de Bogotá. En cada fragmento se trazaron transectos con longitud de 64 m en dirección oriente-interior y occidente-interior, donde se dispusieron en siete distancias desde el borde experimentos de descomposición de hojarasca con duración de 90 y 180 días. En cada transecto y distancias se estimaron el porcentaje de descomposición y humedad de hojarasca, densidad de vegetación, densidad de hongos anamorfos y relación carbono:nitrógeno. Se determinaron la distancia máxima del efecto de borde sobre la descomposición y su interacción con la orientación, distancia y factores reguladores. Se evidenció un efecto de la orientación cardinal del borde sobre la descomposición y sobre sus factores reguladores. En las zonas de borde oriental se presentó un efecto de borde marcado sobre la humedad de hojarasca hasta los 7 m y sobre la densidad de vegetación hasta los 30 m. En los fragmentos de bosque la descomposición fue regulada por la humedad y la relación C:N de la hojarasca. La poca penetración del borde sugiere efectos menores sobre el ciclaje de nutrientes, proporcionando un valor adicional a la conservación de fragmentos pequeños.
Palabras clave: bosque tropical, regulación, fragmentación, humedad, orientación.
ABSTRACT
Forest fragments are physically delimited by edges and encircled by a surrounding matrix. The interaction between these communities dissimilar in structure and composition is defined as the edge effect. This occurrence generates local abiotic and biotic changes altering soil ecosystem processes. To determine the existence of the effect on leaf litter decomposition and its control factors, two fragments of cloud forest in the southwest region of the Bogotá Savannah were selected. Within each, two 64 m long transects were laid out bearing east and west from edge to center respectively, a leaf litter decomposition experiment of a 90 to 180 day duration was set up at seven distances measured from the starting point of each transect. The percentage of leaf litter moisture and decomposition, vegetation density, anamorphic fungi density and carbon:nitrogen ratio were estimated at each point. The maximum distance of the edge effect on the decomposition was determined, and the interaction between orientation, distance and the regulating factors of the decomposition process were ascertained. The results established an effect of the cardinal orientation of the edge on the decomposition and its regulating factors. Marked edge effects on leaf litter moisture extending up to 7 m and up to 30 m on vegetation density were displayedin Eastern border areas. In forest areas, decomposition was regulated by leaf litter moisture and its C:N ratio. The limited penetration of edge effect suggests minor effects regarding nutrient cycles and provides justification and additional value to the use of small fragments.
Key words: tropical forest, regulation, fragmentation, moisture, orientation.
INTRODUCCIÓN
Debido a la expansión de la frontera agrícola y de los sistemas urbanos se estima que en Colombia 70% de los bosques montanos han sido transformados en un mosaico de remanentes de bosque llevando a la pérdida y fragmentación de hábitat natural (Etter y Van Wyngaarden, 2000; Etter et al., 2006) con importantes consecuencias sobre la generación de bienes y servicios ambientales (Foster, 2001; Ruizet al., 2008). La fragmentación como proceso, ocurre a escala de paisaje y genera modificaciones en la estructura y función del hábitat original, ocasionando su separación en unidades de paisaje (fragmentos o parches) diferentes en tamaño y estructura, en mayor número y más aislados respecto a una condición anterior (Fahrig, 2003). Los fragmentos están físicamente delimitados por sus bordes, espacio donde interactúan con la matriz que les rodea (Fernandez et al., 2002). El gradiente de cambios abióticos y bióticos que ocurre en esta zona de contacto o transición entre comunidades que difieren en estructura vegetal y biota, se define como efecto (Williams-Linera, 1990; Murcia, 1995) o influencia de borde (Harperet al., 2005). Los bordes son zonas críticas en el manejo para la conservación, especialmente en áreas protegidas (Fernandez, et al., 2002). Los bordes interactúan e inducen una variedad de cambios ambientales para los fragmentos (Laurance y Curran, 2008) al influir negativa o positivamente sobre las comunidades y procesos del ecosistema, por la alteración de flujos de materia y energía (permeabilidad) entre fragmentos y la matriz circundante (Fahrig, 2003). Entre los cambios bióticos más importantes están la simplificación en estructura y función vegetal, dinámica de plantas invasoras, reducción de la captura de carbono y vulnerabilidad al fuego (Laurance, 2004; Laurance y Curran, 2008).
El efecto de borde es un fenómeno bien estudiado en ecología del paisaje y teoría de metapoblaciones de zonas templadas y tropicales. Es una constante que en diferentes estudios se determine la distancia máxima (hacia el interior del fragmento respecto al borde) donde ocurren cambios significativos de la respuesta ecológica de variables estructurales y funcionales (Ries et al., 2004) y cómo sobre éstas influye la orientación, edad y tipo de vegetación del fragmento (Murcia, 1995; Harper, et al., 2005). Por ejemplo, en zonas tropicales el cuerpo de conocimiento más consistente proviene del trabajo desarrollado por dos décadas en remanentes del Amazonas. En este conjunto de fragmentos se ha monitoreado la respuesta a la fragmentación y efecto de borde de diversos organismos, particularmente de vertebrados, artrópodos y plantas; así como de procesos ecológicos, presentando respuestas positivas, negativas o neutras y dependientes al organismo o proceso estudiado (Laurance et al., 2002; Laurance et al., 2006).
Sin embargo, otros procesos igualmente relevantes que involucran la interrelación del suelo con el componente autótrofo del ecosistema y su interacción con el disturbio derivado del efecto de borde, no han sido abordados frecuentemente (Davies, 2002; Laurance, et al., 2002). El cambio local del entorno biótico y microclima suponen la alteración de los factores que regulan procesos ecosistémicos como la descomposición de materia orgánica (Powers et al., 2009) y el almacenamiento de carbono en suelo (Didham, 1998; Vasconcelos y Laurance, 2005; Pereira et al., 2008).
El efecto de borde modifica los factores que regulan el proceso de descomposición de materia orgánica mediante cambios en el ambiente físicoquímico (Kapos, 1989; Camargo y Kapos, 1995) calidad del recurso (Laurance, et al., 2002) y biota descomponedora (Luczaj y Sadowska, 1997; Davies, 2002). La biota del suelo tiene efectos positivos, negativos o neutrales sobre la tasa de descomposición (Hattenschwiler y Gasser, 2005) y existe evidencia que la pérdida y fragmentación de hábitat influyen sobre la riqueza, diversidad y biomasa de termitas y escarabajos (Fonseca de souza y Brown, 1994; Davies, 2002; Vasconcelos y Laurance, 2005). Sin embargo, la respuesta de la microbiota, como los hongos descomponedores, ha sido poco explorada (Luczaj y Sadowska, 1997), a pesar de su reconocido papel en descomposición (Berg y Mcclaugherty, 2008). Los hongos anamorfos son particularmente sensibles a modificaciones del microclima y disponibilidad del recurso, y los cambios en la humedad pueden tener efecto sobre su distribución, abundancia y actividad (Schimel et al., 1999; Mclean y Huhta, 2000).
Como consecuencia de su estado fragmentado y continua presión antrópica debido a su cercanía a grandes centros urbanos, los remanentes de bosques de niebla en el costado occidental de la Sabana de Bogotá, han sido un escenario ideal para comprender el cambio de procesos ecológicos bajo escenarios de intervención antrópica. Por más de una década, sobre estos bosques remanentes se ha estudiado estructura, composición y función de grupos de organismos como aves (Trujillo y Ahumada, 2005; Echeverry-Galvis et al., 2006), anfibios y reptiles (Urbina-Cardona y Perez-Torres, 2002), mamíferos, artrópodos y plantas vasculares (Perez-Torres, 2004), mostrando globalmente que en fragmentos pequeños (< 20 ha) respecto a otros de mayor tamaño, ocurren efectos deletéreos para la mayoría de estos grupos. Así mismo, sobre algunos de estos fragmentos, se compararon algunos procesos de importancia edáfica como la nitrificación entre pastizales y fragmentos (González et al., 1999), así como la descomposición de hojarasca entre bordes y zonas del interior de bosque (Varela et al., 2002). Estos estudios determinaron la ausencia de diferencias en los procesos estudiados, no así, en algunas variables del microclima, como la humedad de hojarasca. Con base en esta evidencia se planteó el uso de diseños de muestreo complementarios para probar otras hipótesis asociadas al fenómeno del efecto de borde, entre ellas, la importancia de la orientación y microclima de los bordes en los fragmentos (Varela, et al., 2002).
Con base en lo anterior, se planteó como hipótesis que el efecto de borde influiría sobre la descomposición de hojarasca al modificar sus factores reguladores. De tal manera, el presente trabajo tuvo como objetivos: (i) determinar la existencia de un efecto de borde sobre el proceso de descomposición de hojarasca y sobre sus factores reguladores (humedad de la hojarasca, densidad de la vegetación, relación Carbono:Nitrógeno del sustrato y micobiota descomponedora) y (ii) determinar los factores generales que regulan la descomposición en los fragmentos de bosque estudiados.
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
En el sur-occidente de la Sabana de Bogotá, Colombia (Fig 1), se seleccionaron dos fragmentos de bosque húmedo de niebla (F1 4°45’66,7’’ N y 74°23’54,3’’ W) y (F2 4°38’53,8’’ N y 74°19’28’’W), con un área aproximada de 3 y 15 ha, respectivamente. Los criterios de selección de los fragmentos fueron su similitud en altitud, pendiente, orientación, forma, posición sobre la vertiente de la cordillera y baja perturbación. Adicionalmente, fueron criterios importantes el acceso y factibilidad logística para realizar el estudio (Varela, 2004) y la existencia de información base (Mendoza y Etter, 2002). Los fragmentos están a una altitud promedio de 2.800 m, poseen una temperatura media anual de 12 °C y una precipitación media anual de 2.700 mm, con dos periodos de lluvia de marzo a mayo y de octubre a noviembre (IDEAM, 2001). En la zona predominan los suelos del orden de los Andisoles e Inceptisoles encontrándose suelos de la formación Guadalupe, asociación Tribuna, del tipo Typic Dystrandept y Andic Humitropept, los cuales son de textura franca y franco-arenosa, respectivamente (Varela, 2004). Por el origen y la situación geográfica de esta formación, predominan paisajes ondulados y pendientes (Espinal y Montenegro, 1963). Los fragmentos tienden a tener una forma elipsoidal; sus bordes se encuentran cercados con postes y alambre que los separa de pastizales para ganadería semiintensiva y hacen abrupto el límite entre la vegetación boscosa y el pastizal. Se estima, fueron fragmentados y cercados hace al menos 60 años (Mendoza y Etter, 2002).
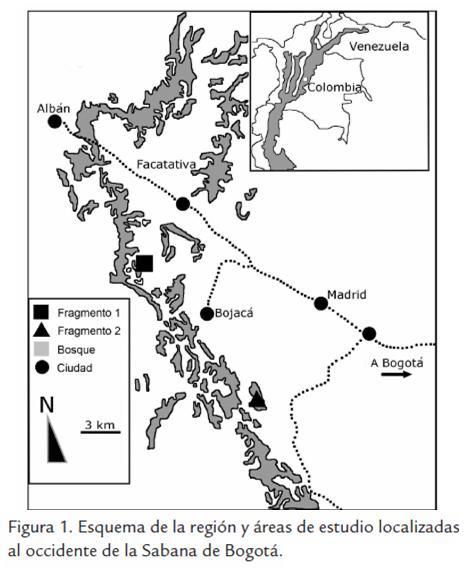
DISEÑO DEL MUESTREO Y VARIABLES AMBIENTALES
Se planeó un diseño de muestreo de bloques con parcelas divididas (Split plot) (Federer et al., 2010). Entre marzo y agosto de 2000 en cada fragmento de bosque se trazaron desde los bordes hacia el interior, dos transectos con orientación oriente-interior y occidente-interior. Siguiendo a Williams-Linera et al., 1998 asumimos como borde a los primeros 20 m de bosque, enfatizando sobre esta zona el muestreo. Sobre los transectos se establecieron siete puntos de muestreo desde el borde en las distancias 0, 2, 4, 8, 16, 32 y 64 m. Empleando cinta plástica de color, en cada distancia se delimitaron transectos perpendiculares con dirección norte-sur (paralelos al borde) de 15 m de largo y 1 m de ancho, sobre los cuales, se midió la humedad de la hojarasca, la densidad de la vegetación y se dispuso el experimento de descomposición. La humedad de hojarasca se estimó mensualmente entre marzo y agosto, recolectando en cada distancia cinco muestras de hojarasca superficial arrojando aleatoriamente un cuadrante metálico de 25 x 25 cm. Las muestras se almacenaron en bolsas de polipropileno y en el laboratorio se estimó gravimétricamente su porcentaje de humedad (ver métodos en experimento de descomposición). Así mismo, en cada distancia desde el borde se midió aleatoriamente el porcentaje de densidad de la vegetación a un metro de altura del suelo empleando un densiómetro esférico convexo a intervalos de 3 m de distancia entre cada punto de medición. Se consideraron como bloques aleatorios a los fragmentos (F1 y F2), como unidad completa a los transectos (dos niveles: oriente y occidente) y como subunidades a las distancias desde el borde (con siete niveles).
EXPERIMENTO DE DESCOMPOSICIÓN
En el inicio del estudio, también se recolectó aleatoriamente en cada distancia desde el borde una muestra entre 500 a 1.000 g de hojarasca recién caída. Para cada distancia (sin mezclar entre distancias), la muestra se homogenizó en una bolsa plástica y posteriormente se utilizó como sustrato en el experimento de descomposición. Varela, 2004 y Trujillo y Ahumada, 2005 describieron para estos transectos que la vegetación predominante correspondía a las familias Amaryllidaceae (Bomarea sp.), Araceae (Anthurium sp.), Asteraceae, Chlorantheaceae (Hedyosmum sp.), Ericaceae (Cavendishia sp. y Macleania sp.), Guttiferaceae (Clusia sp.), Melastomataceae (Miconia sp., Tibouchina sp., y Bucquetia sp.), Rubiaceae (Palicourea sp.) y Winteraceae (Drymis sp.).
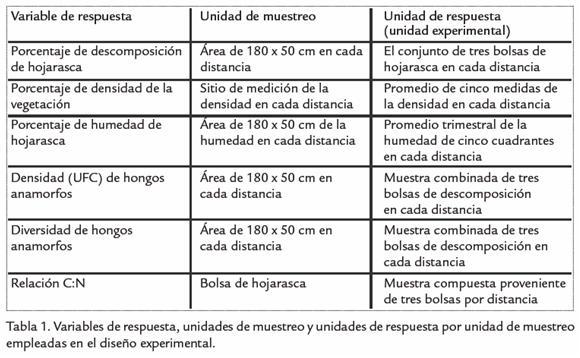
De la mezcla de hojarasca recolectada en cada distancia, se tomaron seis muestras de 50 a 60 g (peso fresco). Utilizando el método de bolsas de malla (Berg y Mcclaugherty, 2008), esta se confinó en bolsas de malla plástica de forma circular con 30 cm de diámetro y 2,25 mm2 de ojo de malla. Adicionalmente, se tomaron por cada distancia tres muestras control de la mezcla de hojarasca para estimar por gravimetría peso seco inicial (PSI) colocado en campo (Berg y Mcclaugherty, 2008). Posteriormente, las bolsas de hojarasca se ubicaron en cada distancia paralelamente al borde (siguiendo una línea con dirección norte-sur) con un espacio entre ellas de 5 cm. Las bolsas se colocaron sobre el suelo desnudo y se cubrieron levemente con hojarasca circundante. Se ubicaron un total de 168 bolsas con hojarasca (6 bolsas x 7 distancias x 2 transectos x 2 fragmentos); sin embargo, se consideró como unidad de respuesta al promedio de descomposición de tres bolsas por cada distancia, resultando en total 28 unidades de respuesta independientes por trimestre (Tabla 1). Después de 90 días de descomposición, en cada distancia se recogieron tres bolsas, y después de 180 días las restantes tres. En cada evento de recolección las muestras se empacaron en bolsas plásticas estériles con el fin de transportarse y almacenarse a 4 °C en el laboratorio para su posterior procesamiento. Se estimó el promedio de pérdida de peso de tres bolsas por cada trimestre como la unidad de respuesta independiente.
En el laboratorio, sobre un plato plástico estéril cada bolsa de hojarasca descompuesta se limpió retirando raíces y material vegetal extraño. Cada una de las tres muestras por distancia se fragmentó y mezcló manualmente, tomando de cada muestra una sub-muestra aleatoria con peso conocido, las cuales se mezclaron paraformar una sola muestra compuesta (Osono et al., 2002) por cada distancia, transecto, periodo de tiempo y fragmento. Sobre la muestra remanente de hojarasca descompuesta, se estimaron su peso fresco final (PFF) y después de un secado en horno a 60 °C por 72 h, su peso seco final (PSF). Utilizando la diferencia entre los valores del PSI y el PSF se calculó el por-centaje de descomposición (1 – (PSF / PSI) * 100) y su porcentaje de humedad como la relación entre el peso seco (PS) y peso fresco (PF) a través de la fórmula (1 – (PS / PF) * 100; Berg y Laskowski, 2005). Utilizando las muestras finales de hojarasca seca, también se midió el contenido y proporción relativa de carbono y nitrógeno final (rela-ción C:N) por unidad de masa seca, análisis realizado por el Laboratorio de Suelos del Instituto Geográfico Agustín Codazzi (IGAC) a través de la técnica de espectrofoto-metría infrarroja y conductividad térmica.
DENSIDAD Y DIVERSIDAD DE HONGOS ANAMORFOS
En condiciones de laboratorio, de cada muestra combinada de hojarasca descompuesta se registró en peso fresco, equivalente a un gramo en peso seco (previos cálculos gravimétricos), el cual se maceró en un medio estéril con 99 mL de agua destilada (Cornejo et al., 1994). A partir del macerado se realizó análisis micológico de anamorfos empleando la técnica de dilución y siembra en placa profunda (Gams et al., 1987; Bettucci et al., 2002) con diluciones seriadas 1:10 hasta un factor de 1:10000. Alícuotas de 1 mL de esta última dilución se sembraron por triplicado en agar rosa de Bengala (Difco) y en agar extracto malta (Oxoid), adicionando cloranfenicol (50 mg.L-1) y ampicilina (40 mg.L-1) de marca comercial.
Tras su incubación a 22 °C en oscuridad durante siete días se realizó el recuento del número de unidades formadoras de colonia (UFC g-1) totales y por morfotipo,de acuerdo con su morfología macro y microscópica (Kuter, 1986; Bills y Polishook, 1994; Bettucci, et al., 2002). Los morfotipos se identificaron hasta género con base en Ellis, 1971, Domsch et al., 1972 y Barnett y Hunter, 1998.
ANÁLISIS ESTADÍSTICO
Se realizó análisis de varianza al diseño de parcelas divididas con el fin de evaluar la interacción de bloques, unidad completa y subunidades sobre las variables de respuesta independientes (descomposición de hojarasca, humedad de hojarasca, densidad de la vegetación, relación C:N de la hojarasca y densidad y diversidad de hongos anamorfos). Utilizando el programa Statistica (Statsoft, 2004) se ajustó un modelo lineal general para aplicar un ANDEVA empleando la suma de cuadrados Tipo I (secuenciales). Para realizar comparaciones entre las medias de las variables de respuesta, se empleó una prueba de Tukey. Las densidades de hongos anamorfos se transformaron a log10 (Sokal y Rohlf, 2000) para estimar su diversidad por medio de los índices de Shannon y Simpson (Krebs, 1989; Cabello y Arambarri, 2002). Por otra parte, para determinar la existencia de un efecto de borde y estimar su distancia máxima de penetración sobre las variables de respuesta, se ajustaron modelos de regresión lineal por partes (Toms y Lesperance, 2003), utilizando el programa Statistica (Statsoft, 2004). En todos los casos se tuvo encuenta el cumplimiento de sus supuestos (εi independientes N (0, σ2)) y un nivel de confianza del 95%.
Con el fin de establecer los factores generales que regulan la descomposición en los fragmentos de bosque, se realizó un análisis preliminar por medio de correlaciones lineales de Spearman entre el porcentaje de descomposición y las demás variables de respuesta (humedad de hojarasca, densidad de la vegetación, densidad y diversidad de hongos anamorfos y relación C:N de la hojarasca). Posteriormente, se realizó un análisis confirmatorio con el fin de establecer la relación de dependencia lineal entre el cambio promedio del porcentaje de descomposición y las variables seleccionadas, por medio de una regresión lineal múltiple. Las regresiones emplearon suma de cuadrados Tipo I (secuenciales), se consideró el cumplimiento de supuestos de una regresión (εi independientes N (0, σ2)) y los valores de colinealidad (Chatterjee y Hadi, 2006). En todos los casos se utilizó un nivel de confianza del 95% utilizando el programa Statistica (Statsoft, 2004).
RESULTADOS
EFECTO DE BORDE SOBRE LA DESCOMPOSICIÓN DE HOJARASCA Y FACTORES REGULADORES
No se encontró efecto del factor tiempo (diferencias entre 90 y 180 días) sobre todas las variables estudiadas, por esta razón se consideraron todos los datos como una sola muestra. En el porcentaje de descomposición de hojarasca existió interacción entre los fragmentos y la orientación de los transectos (bloques x unidad completa; F = 7,39; gl = 1; p < 0,05), así como entre la orientación y distancia (unidad completa x subunidad; F = 9,61; gl = 6; p < 0,01). En los transectos occidentales ocurrió una mayor descomposición que en los orientales (MSE = 101,67; gl = 40; p < 0,01), diferencias causadas localmente por menor descomposición en las distancias 2, 4 y 16 m de los transectos orientales. Se encontró correlación positiva (rs = 0,50; p< 0,01) débil entre el aumento de la distancia y el aumento del porcentaje de descomposición en los transectos orientales (Fig 2); sin embargo, el modelo de regresión por partes no se ajustó al modelo esperado para determinar una distancia máxima del efecto de borde.
Sobre la humedad de hojarasca (Fig 3A) se evidenció un efecto de interacción de los factores distancia y orientación (F = 10,42; gl = 6; p <0,05). El efecto de la orientación se explica debido a que la humedad en los transectos orientales fue significativamente menor y más variable (CV = 38%) que en los transectos occidentales (CV = 8%). Así mismo, en los transectos orientales la humedad fue menor en las distancias 0, 2 y 4 m (MSE = 93,84; gl = 40; p < 0,01), que en los occidentales, donde no fueron evidentes las diferencias. Se encontró que, respecto a la densidad de la vegetación existió un patrón similar, presentándose una interacción entre distancia y orientación (F = 13,67; gl = 6; p <0,01), donde los transectos orientales tuvieron significativamente menor densidad de la vegetación respecto a los occidentales. En tal sentido, en los transectos orientales, las distancias 0,2 y 4 m desde el borde presentaron significativamente menor densidad de la vegetación que las demás (MSE = 1,93; gl = 40; p < 0,01; Fig 3B).
Los patrones de cambio tanto de la humedad de hojarasca (Fig. 3A), como de densidad de la vegetación (Fig. 3B), se ajustaron al modelo de regresión lineal por partes, exclusivamente en los transectos orientales. De tal manera, se determinó la existencia de un efecto de borde sobre el porcentaje de humedad de la hojarasca hasta aproximadamente 7 m de distancia desde el borde (R = 0,94; n = 28; varianza explicada = 79,80 %) y para el porcentaje de densidad de la vegetación hasta 30 m (R = 0,91; n = 28; varianza explicada = 82,85 %). En los transectos occidentales los datos no se ajustaron al modelo mencionado (R < 0,3; n = 28; p >0,05) en todos los casos.
Por otra parte, respecto a la relación final C:N de la hojarasca descompuesta, sus valores medios fueron para el transecto occidental 42,35 (DE = 19,50) y para el oriental 79,90 (DE = 19,50); sin embargo, no existieron interacciones o diferencias entre transectos o distancias (F = 1,01; gl = 40; p = 0,42; Fig 3C). La ausencia de diferencias se originó por la alta variabilidad de los datos en los transectos occidental (CV = 46%) y oriental (CV = 57%).
Por último, en el ensamblaje de hongos anamorfos se identificaron 7.045 UFC en 72 unidades taxonómicas. El ensamblaje estuvo dominado por la presencia de géneros de la clase artificial Deuteromycetes, particularmente del género Penicillium con 55,7% de las colonias aisladas; por el Phyllum Zygomycota, y en menor medida, por cepas con micelio estéril. Los valores medios de densidad total (log10) para el transecto oriental fueron de 5,66 (DE = 0,28) y en el occidental de 5,73 (DE = 0,31); no obstante, no existió interacción entre la orientación o distancia sobre la densidad total y diversidad de hongos anamorfos (p>0,05 en todos los casos; Fig. 3D). Los valores de diversidad de Shannon oscilaron entre 0,23 a 2,1 bits. El índice de dominancia de Simpson presentó valores entre 0,11 y 1,12. Finalmente, la respuesta de densidad y diversidad de hongos anamorfos no se ajustó al modelo de regresión por partes (R< 0,3; n = 28; p >0,05) en ninguno de los casos.
REGULACIÓN DE LA DESCOMPOSICIÓN EN LOS FRAGMENTOS DE BOSQUE
Se consideró como un todo al conjunto de datos para buscar patrones emergentes. Se obtuvieron valores promedio para el porcentaje de descomposición (24,89%; DE = 15,41), humedad de hojarasca, (67,06%; DE = 19,57) densidad de vegetación (93,57%; DE = 3,31), relación C:N (61,12; DE = 39,82), densidad de hongos anamorfos 24,89 %; DE = 15,41, diversidad de hongos anamorfos (Shannon = 1,50; DE = 0,59 y Simpson = 0,73; DE = 0,27) respectivamente. En este conjunto de datos, el análisis exploratorio encontró correlaciones positivas entre porcentaje de descomposición y humedad de hojarasca (rs = 0,51; n = 56; p < 0,01), densidad de la vegetación (rs = 0,41; n = 56; p < 0,05) y correlación negativa con la relación C:N (rs = -0,49; n = 56; p < 0,01) (Fig. 4).También, la densidad de la vegetación estuvo correlacionada positivamente con el porcentaje de humedad de la hojarasca (rs = 0,78; n = 56; p < 0,01).
El análisis de regresión múltiple mostró que la descomposición de hojarasca dependió lineal, aunque débilmente de la humedad de hojarasca y de la relación C:N (R2ajustado = 0,26; n = 55; p < 0,05), mas no de la densidad o diversidad de hongos anamorfos (p> 0.01). No se tuvo en cuenta el porcentaje de densidad de la vegetacióndebido a valores de colinealidad altos (VIF> 10; Chatterjee y Hadi, 2006). El porcentaje de descomposición se predijo por la ecuación D = 13,235 + 0,339 % Humedad – 0,25 C:N.
DISCUSIÓN
El estudio estableció que la distancia desde el borde y su orientación influyeron sobre el porcentaje de descomposición de hojarasca y sus factores reguladores; así mismo, se indicó que éstos interactuaron con los fragmentos, sugiriendo alguna influencia de las características locales de cada fragmento sobre la descomposición. El porcentaje de descomposición fue menor en los transectos orientales, respecto a los occidentales. En éstos últimos, existieron condiciones homogéneas de alta humedad y cobertura vegetal, que indujeron mayor descomposición y ausencia de diferencias entre distancias. Por otra parte, en los transectos orientales aunque no fue posible estimar una distancia máxima de penetración del efecto borde sobre la descomposición, los datos sugieren que esta se redujo significativamente desde los 0 m hasta los 16 m.
La descomposición involucra un conjunto de procesos regulados por factores físicos, químicos y biológicos que actúan sobre una variedad de sustratos orgánicos, los cuales en sí mismos están en constante cambio (Agren y Bosatta, 1996). En hábitats fragmentados, el efecto de borde supone la alteración de estos factores reguladores, que en interacción con factores locales, causan respuestas variables sobre la magnitud y distancia del efecto de borde. Entre estos factores locales, son determinantes la estructura y composición de la vegetación (Mcintyre y Hobbs, 1999; Ries, et al., 2004), la orientación (Chen et al., 1993; Ries, et al., 2004) y edad del borde, así como la historia de manejo del fragmento (Murcia, 1995). También se ha documentado la importancia de la latitud y atributos temporales como el momento del día y la estación climática (Didham y Lawton, 1999) y de forma similar, (Arango-Caro 2002) mencionó la relevancia de la topografía en bosques de montaña, como factor que añade complejidad al fenómeno.
En el presente trabajo fueron relevantes la orientación y edad de los bordes, así como la historia de manejo de los fragmentos. La orientación interactúa localmente con la cobertura vegetal y el clima (dirección de los vientos). Los resultados mostraron menor humedad de hojarasca en los bordes orientales debido a disminución en la cobertura vegetal. Esta menor cobertura vegetal, aunque permiten mayor entrada de lluvia al suelo, maximiza la pérdida de humedad por una mayor exposición al viento y luz solar (Camargo y Kapos, 1995; Mesquita et al., 1998; Hylander, 2005). Esta interacción entre los cambios del porcentaje de cobertura vegetal y la humedad edáfica, está acorde con trabajos realizados sobre bordes de fragmentos de bosque tropical de la Amazonía central (Didham, 1998), Panamá (Camargo y Kapos, 1995) y bosques montanos de India (Jose et al., 1996). Sin embargo, en estos trabajos la respuesta de la humedad en el gradiente borde-interior, presentó comportamientos lineales y no lineales, por lo cual no es posible una generalización, sugiriendo que la respuesta al efecto de borde es específica de sitio (Mcintyre y Hobbs, 1999).
Por otra parte, en contraste a los transectos orientales, las zonas de borde occidentales evidenciaron alta humedad de hojarasca y cobertura vegetal. Sobre esta zona se registró constante desplazamiento y choque de neblina en dirección occidente-oriente (Varela, 2004), evento que induce niveles elevados de humedad atmosférica e incrementa entrada de agua al suelo (Bruijnzeel y Veneklaas, 1998; Tanner et al., 1998), favoreciendo localmente el establecimiento y tasas de crecimiento de la vegetación. Por otra parte, aunque en el gradiente de distancias borde-interior existieron condiciones particulares de humedad y cobertura de la vegetación, la temperatura del suelo no se afectó por la cercanía al borde, porque no existieron diferencias entre bordes e interiores (Varela, 2004).
Así mismo, la historia de manejo y antigüedad de los bordes permitió la interpretación de los resultados obtenidos. En la zona de estudio, Mendoza y Etter, 2002 estimaron que los fragmentos se crearon hace al menos 60 años, época desde la cual han tenido pocos cambios, porque sus propietarios por razones ecológicas y estéticas los han conservado. Esto sugeriría que en estos fragmentos, acciones de manejo como uso continuo de una cerca con postes y alambre que separa a los pastizales del bosque, han minimizado el efecto de borde al ocurrir una recuperación efectiva de la vegetación sobre los bordes. Esta recuperación descrita entre otros, por Forero y Finegan, 2002, en bordes de bosque húmedo de Costa Rica tras 20 años de fragmentación, funcionaría como barrera contra los efectos de la penetración del viento y de luz solar.
Por otra parte, no se encontraron efectos de la orientación ni de la distancia sobre la composición química de la hojarasca debido a una alta variabilidad en las observaciones. La importancia de la química de la hojarasca ha sido extensamente explorada como uno de los principales factores reguladores de la descomposición (Agren y Bosatta, 1996; Adair et al., 2008; Cusack et al., 2009), donde relaciones altas de C:N se asocian con concentraciones elevadas de celulosa o lignina, y con menor disponibilidad de nitrógeno en los tejidos vegetales, características que limitarían la tasa de descomposición de la hojarasca (Berg y Mcclaugherty, 2008; Austin y Ballaré, 2010). La alta variabilidad en la calidad de la hojarasca por los valores extremos (e.g. C:N = 150) ocurridos sobre las zonas de borde orientales, sugiere que el recurso que entra al suelo posee características químicas altamente heterogéneas, atributo que es inherente a la hojarasca de bosques de niebla (Cavelier y Goldstein, 1989) y acorde con lo planteado por Powers, 2009 y Zech, 1997, quienes plantearon que la calidad del recurso es un factor relevante para explicar las diferencias en la descomposición de materia orgánica a escala local. Aunque las condiciones en campo buscaban simular las condiciones naturales del proceso de descomposición, esta heterogeneidad en la calidad del sustrato empleado en el estudio de descomposición, lleva a sugerir se controle en futuros trabajos la composición química de la hojarasca empleando un sustrato de características químicas homogéneas. En cuanto al ensamblaje de hongos anamorfos, se esperaba un patrón de cambio en la densidad y diversidad desde los bordes hacia el interior de los fragmentos; sin embargo, alta variabilidad entre distancias y transectos, así como ausencia de asociación con la humedad y calidad de la hojarasca, no permitieron detectar un patrón de cambio a lo largo del borde, o la comprensión de su variabilidad. La estructura y composición de hongos anamorfos sobre la filósfera es inherentemente variable a micro escala (e.g. competencia interespecífica en una hoja), meso escala (e.g. crecimiento micelial entre hojas contiguas), así como entre periodos cortos de tiempo (e.g. influencia del microclima; Kinkel, 1997), e influida también por las propiedades fisicoquímicas de la cutícula (Knoll y Schreiber, 2000), que en conjunto dificultan la compresión de la dinámica del ensamblaje de microhongos (Frankland, 1998). De esta forma, se sugiere que los índices de diversidad de Shannon o Simpson no fueron medidas apropiadas para describir el problema estudiado. Otras aproximaciones que hagan énfasis en el papel funcional de los organismos, más que en su taxonomía, como la medición de la actividad enzimática o detección de genes que codifican para enzimas de importancia en procesos ecológicos (Deacon et al., 2006; Hirsch et al., 2010), son deseables para dar una mejor aproximación a la relación de la micobiota y la descomposición de materia orgánica.
Se evidenciaron patrones emergentes en el conjunto de datos de este estudio respecto al proceso de descomposición de hojarasca. Para los fragmentos de bosque, se observó que el promedio total de la pérdida de peso de hojarasca (24,89%), fue menor respecto a otros bosques tropicales montanos ubicados en un rango altitudinal similar, con metodologías y tiempos de descomposición equivalentes. Por ejemplo, en bosques montanos de Costa Rica la pérdida de peso fue de 75% (Clark et al., 1998); en bosque tropical lluvioso de Nueva Guinea 85% (Edwards, 1977) y en las mismas áreas de estudio del presente trabajo utilizando un sustrato diferente, Varela et al., 2002, describieron un porcentaje de pérdida de peso entre 38 y 41%. Estos valores inferiores de descomposición respecto a otros trabajos están asociados, además de la calidad de la hojarasca (C:N final = 72), con la baja temperatura promedio del suelo, la cual, osciló entre 10,3 y 12,3°C (Varela, 2004).
Así mismo, los datos agrupados también determinaron que el porcentaje de descomposición fue predicho por la humedad y relación C:N de la hojarasca. Lavelle et al., 1993, plantearon que en las zonas húmedas del trópico la descomposición es más rápida y completa que en otro tipo de ecosistemas por el efecto combinado de temperatura, humedad y organismos del suelo, proponiendo una jerarquía de factores que regulan el proceso de descomposición (clima > mineralogía de arcillas > nutrientes del suelo > calidad del recurso > organismos del suelo), predominando el efecto del componente biótico sobre el abiótico al presentarse condiciones abióticas uniformes. No obstante, la regulación de la descomposición puede ser mediada principalmente por factores individuales.
Recientemente, varios modelos regionales y globales de predicción de ladescomposición en zonas tropicales, han planteado la predominancia de factores como el clima y calidad del recurso (Wall et al., 2008), la precipitación media anual (Powers, et al., 2009), el índice climático de descomposición (Cusack, et al., 2009) y atributos funcionales de las hojas (Santiago, 2007; Cornwell et al., 2008; Wieder et al., 2009). Evidencia de lo anterior, se ha reportado en algunos bosques de la Amazonía de Perú y Brasil (Palm y Sanchez, 1990; Vasconcelos y Laurance, 2005; Cusack, et al., 2009) donde la calidad del recurso fue el principal factor regulador; en bosques húmedos de Panamá (Wiedery Wright, 1995) resaltando el papel de la humedad; como también, en un gradiente altitudinal de vegetación natural de Venezuela, donde fue importante el efecto de la temperatura sobre la fracción lábil y recalcitrante de la materia orgánica en descomposición (Couteaux et al.,2002). Debido a que nuestro modelo de descomposición presentó una alta varianza no explicada, no se apoya o niega la jerarquía propuesta por Lavelle et al., 1993. Nuestra evidencia sugiere que el control de la descomposición en estos fragmentos ocurrió por pocos factores, sin olvidar que el error residual podría decrecer al controlarse la calidad del recurso empleado en las bolsas de descomposición, al considerar variables como el contenido y tipo de arcillas, así como el papel de la fauna del suelo.
CONCLUSIONES
Se estableció que la existencia del efecto de borde sobre los fragmentos fue determinada por la orientación cardinal, presentándose este efecto solo en los transectos orientales, con una distancia máxima de penetración sobre la descomposición, humedad de la hojarasca y densidad de la vegetación de 16, 7 y 30 m, respectivamente. En el costado occidental de los fragmentos se evidenció mayor de descomposición, humedad de hojarasca y cobertura vegetal, consecuencia del ingreso adicional de agua por el choque directo de la neblina. Por otra parte, no se detectó efecto de borde sobre la relación C:N de la hojarasca, ni sobre la densidad y diversidad de hongos anamorfos debido a alta variabilidad estadística. Para estos fragmentos de bosque, la evidencia sugirió que la descomposición se reguló principalmente por la humedad y por la relación C:N de la hojarasca, sin existir un efecto detectable de la micobiota a través de las técnicas utilizadas.
En términos generales, en los fragmentos de bosque existieron condiciones de interior para la humedad de hojarasca y densidad de la vegetación. Factores como edad de los fragmentos, estimada en 60 años, uso de cercas y el interés de conservación por parte de sus propietarios, minimizaron el efecto de borde sobre las variables estudiadas, lo cual, proporciona una justificación y valor adicional a la conservación de fragmentos pequeños. Con el fin de diseñar estrategias adecuadas de conservación de los mismos, en escenarios de fragmentación de hábitat, efecto de borde y cambio climático regional, deben ser evaluados otros atributos ecológicos de los fragmentos como la vegetación y el papel de la edafofauna presente, así mismo, considerar fragmentos de otros tamaños para determinar hasta qué grado los fragmentos estudiados conservan características estructurales y funcionales. Bajo el contexto de los procesos ecológicos edáficos y variables estudiados, se sugiere realizar acciones de manejo, como el uso de cercas, el favorecimiento de barreras de vegetación en los bordes y la educación ambiental a propietarios de bosques fragmentados respecto a sus beneficios ecológicos y estéticos.
AGRADECIMIENTOS
Los autores agradecen por el apoyo financiero y logístico a la Fundación para la Promoción de la Investigación y la Tecnología del Banco de la República (Proyecto 864) y a la Pontificia Universidad Javeriana. También al Programa de Becas de Investi-gación sobre Biodiversidad de la Fundación FES, Wildlife Conservation Society y el Instituto Alexander von Humboldt.
BIBLIOGRAFÍA
ADAIR EC, PARTON WJ, GROSSO SJD, SILVER WL, HARMON ME, HALL SA, et al. Simple three-pool model accurately describes patterns of long-term litter decomposition in diverse climates. Glob Chang Biol. 2008;14(11):2636-2660.
[ Links ]AGREN G, BOSATTA E. Theoretical Ecosystem Ecology -Understanding Element Cycles, Cambridge: Cambridge University Press; 1996.
[ Links ]ARANGO-CARO S. Edge-effects on tree regeneration in the Colombian Andes. [ Tesis de Doctorado]. St Louis, University of Missouri; 2002.
[ Links ]AUSTIN AT, BALLARÉ CL. Dual role of lignin in plant litter decomposition in terrestrial ecosystems. Proc Natl Acad Sci U S A. 2010;107(10):4618-4622.
[ Links ]BARNETT HL, HUNTER BB. Illustrated Genera of Imperfect Fungi, Fourth ed, St. Paul: American Phytopathological Society; 1998.
[ Links ]BERG B, LASKOWSKI R. Methods in Studies of Organic Matter Decay. En: Laskowski R, Berg B, Yiqi L, editores. Litter Decomposition: A Guide to Carbon and Nutrient Turnover. Academic Press; 2005. p. 291-331.
[ Links ]BERG B, MCCLAUGHERTY C. Plant Litter. Decomposition, Humus Formation, Carbon Sequestration, Second ed, Berlin Heidelberg: Springer-Verlag; 2008.
[ Links ]BETTUCCI L, ALVAREZ IM, DUPONT J, BURY E, ROQUEBERT MF. Paraná river delta wetlands soil microfungi. Pedobiologia. 2002;46(6):606-623.
[ Links ]BILLS GF, POLISHOOK JD. Abundance and diversity of microfungi in leaf litter of a lowland rainforest in Costa Rica. Mycologia. 1994;86(2):187-198.
[ Links ]BRUIJNZEEL LA, VENEKLAAS EJ. Climatic conditions and tropical montane forest productivity: The fog has not lifted yet. Ecology. 1998;79(1):3-9.
[ Links ]CABELLO M, ARAMBARRI A. Diversity in soil fungi from undisturbed and disturbed Celtis tala and Scutia buxifolia forests in the eastern Buenos Aires province (Argentina). Microbiol Res. 2002;157:115-125.
[ Links ]CAMARGO JL, KAPOS V. Complex edge effects on soil moisture and microclimate in central Amazonian forest. J Trop Ecol. 1995;11:205-221.
[ Links ]CAVELIER J, GOLDSTEIN G. Leaf anatomy and water relations in tropical elfin cloud forest tree species. En: Kreb KH, Ritcher H, Hincley TM, editores. Structural and functional responses to environmental stresses. The Hague, The Netherlands. Academic Publishing; 1989. p. 243-253.
[ Links ]CHATTERJEE S, HADI AS. Regression Analysis by Example, Fourth ed, Hoboken, New Jersey, John Wiley & Sons, Inc; 2006.
[ Links ]CHEN JQ, FRANKLIN JF, SPIES TA. An empirical-model for predicting diurnal airtemperature gradients from edge into old-growth douglas-fir forest. Ecol Model. 1993;67(2-4):179-198.
[ Links ]CLARK DL, NADKARNI NM, GHOLZ HL. Growth, net production, litter decomposition, and net nitrogen accumulation by epiphytic bryophytes in a tropical montane forest. Biotropica. 1998;30(1):12-23.
[ Links ]CORNEJO FH, VARELA A, WRIGHT J. Tropical forest litter decomposition under seasonal drought: Nutrient release, fungi and bacteria. OIKOS. 1994;70:183-190.
[ Links ]CORNWELL WK, CORNELISSEN JH, AMATANGELO K, DORREPAAL E, EVINER VT, GODOY O, et al., Plant species traits are the predominant control on litter decomposition rates within biomes worldwide. Ecol Lett. 2008;11(10):1065-1071.
[ Links ]COUTEAUX MM, SARMIENTO L, BOTTNER P, ACEVEDO D, THIERY JM. Decomposition of standard plant material along an altitudinal transect (65-3968 m) in the tropical Andes. Soil Biol Biochem. 2002;34(1):69-78.
[ Links ]CUSACK DF, CHOW WW, YANG WH, HARMON ME, SILVER WL. Controls on long-term root and leaf litter decomposition in neotropical forests. Glob Change Biol. 2009;15(5):1339-1355.
[ Links ]DAVIES RG. Feeding group responses of a Neotropical termite assemblage to rain forest fragmentation. Oecologia. 2002;133(2):233-242.
[ Links ]DEACON LJ, PRYCE-MILLER EJ, FRANKLAND JC, BAINBRIDGE BW, MOORE PD, ROBINSON CH. Diversity and function of decomposer fungi from a grassland soil. Soil Biol Biochem. 2006;38(1):7-20.
[ Links ]DIDHAM RK. Altered leaf-litter decomposition rates in tropical forest fragments. Oecologia. 1998;116(3):397-406.
[ Links ]DIDHAM RK, LAWTON JH. Edge structure determines the magnitude of changes in microclimate and vegetation structure in tropical forest fragments. Biotropica. 1999;31(1):17-30.
[ Links ]DOMSCH K, GAMS W, ANDERSON T. Compendium of Soil Fungi, Vol. I, New York, USA, Academic Press; 1972.
[ Links ]ECHEVERRY-GALVIS M, CÓRDOBA-CÓRDOBA S, PERAZA CA, PIEDAD BAPTISTE M, AHUMADA JA. Body weights of 98 species of Andean cloud-forest birds. BULL B CO. 2006;126(4):291.
[ Links ]EDWARDS PJ. Studies of mineral cycling in a montane rain forest in New Guinea: II. the production and disappearance of litter. J Ecol. 1977;65:971-992.
[ Links ]ELLIS MB. Dematiaceous Hyphomycetes, Kew, Surrey, England: Commonwealth Mycological Institute; 1971.
[ Links ]ESPINAL LS, MONTENEGRO E. Formaciones vegetales de Colombia. Memoria explicativa sobre el mapa ecológico, Bogotá D.C., Colombia: Instituto Geográfico Agustín Codazzi; 1963.
[ Links ]ETTER A, MCALPINE C, WILSON K, PHINN S, POSSINGHAM H. Regional patterns of agricultural land use and deforestation in Colombia. Agr Ecosyst Environ. 2006;114(2-4):369-386.
[ Links ]ETTER A, VAN WYNGAARDEN W. Patterns of Landscape Transformation in Colombia, with Emphasis in the Andean Region. Ambio. 2000;29(7):432-439.
[ Links ]FAHRIG L. Effects of habitat fragmentation on biodiversity. Annu Rev Ecol Evol Syst. 2003;34:487-515.
[ Links ]FEDERER WT, KING F, PETER XKS, FERREIRA MAR, LEE HKH, CHANG MH, et al., Variations on split plot and split block experiment designs. TECHNOMETRICS. 2010;52(2):258.
[ Links ]FERNANDEZ C, ACOSTA FJ, ABELLA G, LOPEZ F, DIAZ M. Complex edge effect fields as additive processes in patches of ecological systems. Ecol Model. 2002;149(3):273-283.
[ Links ]FONSECA DE SOUZA OF, BROWN VK. Effects of habitat fragmentation on Amazonian termite communities. J Trop Ecol. 1994;10:197-206.
[ Links ]FORERO A, FINEGAN B. Efectos de borde en la vegetación de remanentes de bosque muy húmedo tropical en el norte de Costa Rica, y sus implicaciones para el manejo y la conservación. Rev Forest Centroam. 2002;38:39-43.
[ Links ]FOSTER P. The potential negative impacts of global climate change on tropical montane cloud forests. Earth-Sci. Rev. 2001;55(1-2):73-106.
[ Links ]FRANKLAND J. Fungal succession -unravelling the unpredictable. Mycol Res. 1998;102(1):1-15.
[ Links ]GAMS W, VAN DER A H, VAN DER PLAATS-NITERINK A, SAMSON R, STALPERS J. CBS Course of Micology, Third ed, Baarn, The Netherlands: Institute of the Royal Netherlands Academy of Arts and Sciences. Centraalbureau voor Schimmelcultures; 1987.
[ Links ]GONZÁLEZ X, GONZÁLEZ L, VARELA A, AHUMADA JA. Incidencia de la cobertura vegetal sobre poblaciones de bacterias nitrificantes autótrofas en un fragmento de bosque andino. Suelos Ecuatoriales. 1999;29(1):83-88.
[ Links ]HARPER KA, MACDONALD SE, BURTON PJ, CHEN J, BROSOFSKE KD, SAUNDERS SC, et al., Edge Influence on Forest Structure and Composition in Fragmented Landscapes. Conserv Biol Ser. 2005;19(3):768-782.
[ Links ]HATTENSCHWILER S, GASSER P. Soil animals alter plant litter diversity effects on decomposition. Proc Natl Acad Sci U S A. 2005;102(5):1519-1524.
[ Links ]HIRSCH PR, MAUCHLINE TH, CLARK IM. Culture-independent molecular techniques for soil microbial ecology. Soil Biol Biochem. 2010;42(6):878-887.
[ Links ]HYLANDER K. Aspect modifies the magnitude of edge effects on bryophyte growth in boreal forests. J Appl Ecol. 2005;42(3):518-525.
[ Links ]IDEAM. Datos de precipitación y temperatura estación Acapulco (No. 2120828). Bogotá, D.C. Colombia; 2001.
[ Links ]JOSE S, GILLESPIE AR, GEORGE SJ, KUMAR BM. Vegetation responses along edge-to-interior gradients in a high altitude tropical forest in peninsular India. Forest Ecol Manag. 1996;87(1-3):51-62.
[ Links ]KAPOS V. Effects of isolation on the water status of forest patches in the Brazilian Amazon. J Trop Ecol. 1989;5:173-185.
[ Links ]KINKEL LL. Microbial population dynamics on leaves. Annu Rev Phytopathol. 1997;35:327-347.
[ Links ]KNOLL D, SCHREIBER L. Plant microbe interactions: wetting of ivy (Hedera helix L.) leaf surfaces in relation to colonization by epiphytic microorganisms. Microb Ecol. 2000.
[ Links ]KREBS C. Ecological Methodology, New York. USA: Harper y Row; 1989.
[ Links ]KUTER G. Microfungal populations associated with the decomposition of sugar maple leaf litter. Mycologia. 1986;78(1):114-126.
[ Links ]LAURANCE WF. Forest-climate interactions in fragmented tropical landscapes. Phil Trans R Soc B. 2004;359(1443):345-352.
[ Links ]LAURANCE WF, CURRAN TJ. Impacts of wind disturbance on fragmented tropical forests: A review and synthesis. Austral Ecol. 2008;33(4):399-408.
[ Links ]LAURANCE WF, LOVEJOY TE, VASCONCELOS HL, BRUNA EM, DIDHAM RK, STOUFFER PC, et al., Ecosystem decay of Amazonian forest fragments: A 22-year investigation. Conserv Biol. 2002;16(3):605-618.
[ Links ]LAURANCE WF, NASCIMENTO HEM, LAURANCE SG, ANDRADE A, RIBEIRO J, GIRALDO JP, et al., Rapid decay of tree-community composition in Amazonian forest fragments. Proc Natl Acad Sci U S A. 2006;103(50):19010-19014.
[ Links ]LAVELLE P, BLANCHART E, MARTIN A, MARTIN S, SPAIN A, TOUTAIN F, et al., Hierarchical model for decomposition in terrestrial ecosystems: application to soils of the humid tropics. Biotropica. 1993;25(2):130-150.
[ Links ]LUCZAJ L, SADOWSKA B. Edge effect in different groups of organisms: Vascular plant, bryophyte and fungi species richness across a forest-grassland border. Folia Geobot Phytotax 1997;32(4):343-353.
[ Links ]MCINTYRE S, HOBBS R. A Framework for Conceptualizing Human Effects on Landscapes and Its Relevance to Management and Research Models. Conserv Biol. 1999;13(6):1282-1292.
[ Links ]MCLEAN MA, HUHTA V. Temporal and spatial fluctuations in moisture affect humus microfungal community structure in microcosms. Biol Fert Soils. 2000;32(2):114-119.
[ Links ]MENDOZA JE, ETTER A. Multitemporal analysis (1940-1996) of land cover changes in the southwestern Bogota highplain (Colombia). Landscape Urban Plan. 2002;59(3):147-158.
[ Links ]MESQUITA RD, WORKMAN SW, NEELY CL. Slow litter decomposition in a Cecropia-dominated secondary forest of central Amazonia. Soil Biol Biochem. 1998;30(2):167-175.
[ Links ]MURCIA C. Edge effects in fragmented forests: implications for conservation. Trends Ecol Evol. 1995;10(2):62.
[ Links ]OSONO T, HOBARA S, FUJIWARA S, KOBA K, KAMEDA K. Abundance, diversity, and species composition of fungal communities in a temperate forest affected by excreta of the Great Cormorant Phalacrocorax carbo. Soil Biol Biochem. 2002;34(11):1537-1547.
[ Links ]PALM CA, SANCHEZ PA. Decomposition and Nutrient Release Patterns of the Leaves of Three Tropical Legumes. Biotropica. 1990;22(4):330-338.
[ Links ]PEREIRA MG, DE MENEZES LFT, SCHULTZ N. Litter deposition and decomposition in a fragment of atlantic forest in the island of Marambaia, Mangaratiba, Rj, Brazil. Cienc Florest. 2008;18(3-4):443-454.
[ Links ]PEREZ-TORRES J. Dinámica del ensamblaje de murciélagos en respuesta a la fragmentación en bosques nublados: un modelo de ecuaciones estructurales [ Tesis de Doctorado]. Bogotá, D.C.: Departamento de Biología, Facultad de Ciencias, Pontificia Universidad Javeriana; 2004.
[ Links ]POWERS JS, REBECCA A. MONTGOMERY, E. CAROL ADAIR, FRANCIS Q. BREARLEY, SAARA J. DEWALT, CAMILA T. CASTANHO, et al. Decomposition in tropical forests: a pan-tropical study of the effects of litter type, litter placement and mesofaunal exclusion across a precipitation gradient. J Ecology. 2009;97(4):801-811.
[ Links ]RIES L, FLETCHER RJ, BATTIN J, SISK TD. Ecological responses to habitat edges: Mechanisms, models, and variability explained. Annu Rev Ecol Evol S. 2004;35:491-522.
[ Links ]RUIZ D, MORENO HA, GUTIÉRREZ ME, ZAPATA PA. Changing climate and endangered high mountain ecosystems in Colombia. Sci Total Environ. 2008;398(1-3):122-132.
[ Links ]SANTIAGO LS. Extending the leaf economics spectrum to decomposition: Evidence from a tropical forest. Ecology. 2007;88(5):1126-1131.
[ Links ]SCHIMEL JP, GULLEDGE JM, CLEIN-CURLEY JS, LINDSTROM JE, BRADDOCK JF. Moisture effects on microbial activity and community structure in decomposing birch litter in the Alaskan taiga Soil Biol Biochem. 1999;31:831-838.
[ Links ]SOKAL R, ROHLF J. Biometry: The Principles and Practice of Statistics in biological research, New York, USA: W.H. Freeman and Company; 2000.
[ Links ]STATSOFT. STATISTICA (Data Analysis Software System), Versión 7; 2004.
[ Links ]TANNER EVJ, VITOUSEK PM, CUEVAS E. Experimental investigation of nutrient limitation of forest growth on wet tropical mountains. Ecology. 1998;79(1):10-22.
[ Links ]TOMS JD, LESPERANCE ML. Piecewise regression: A tool for identifying ecological thresholds. Ecology. 2003;84:2034-2041.
[ Links ]TRUJILLO G, AHUMADA JA. Artificial nest experiments in a fragmented neotropical cloud forest. Ornitol Neotrop. 2005;16(1):53-63.
[ Links ]URBINA-CARDONA JN, PEREZ-TORRES J. Dynamics and habitat preferences in two Eleutherodactylus species (Anura:Leptodactylidae) inhabiting Andean forest in Colombia. En: Jaramillo CA, Castano-Uribe C, Hincapie FA, Rodriguez JV, Duran CL, editores. World Meeting of Moors (Paramos). Bogota, Colombia; 2002. p. 278-288.
[ Links ]VARELA A. Efecto de la fragmentación sobre la producción y descomposición de hojarasca en bosque altoandino nublado: patrones, mecanismos y modelos [ Tesis de Doctorado]. Bogotá, D.C.: Departamento de Biología, Facultad de Ciencias, Pontificia Universidad Javeriana; 2004.
[ Links ]VARELA A, BARRIGA P, AHUMADA JA. Comparación de factores abióticos relacionados con la descomposición de hojarasca entre fragmentos y no fragmentos de bosque altoandino nublado (Sabana de Bogotá, Colombia). Ecotropicos. 2002;15(2):185-193.
[ Links ]VASCONCELOS HL, LAURANCE WF. Influence of habitat, litter type, and soil invertebrates on leaf-litter decomposition in a fragmented Amazonian landscape. Oecologia. 2005;144(3):456-462.
[ Links ]WALL DH, BRADFORD MA, JOHN MGS, TROFYMOW JA, BEHAN-PELLETIER V, BIGNELL DDE, et al. Global decomposition experiment shows soil animal impacts on decomposition are climate-dependent. Glob Change Biol. 2008;14(11):2661-2677.
[ Links ]WIEDER RK, WRIGHT SJ. Tropical forest litter dynamics and dry season irrigation on Barro Colorado Island, Panama. Ecology. 1995;76(6):1971-1979.
[ Links ]WIEDER WR, CLEVELAND CC, TOWNSEND AR. Controls over leaf litter decomposition in wet tropical forests. Ecology. 2009;90(12):3333-3341.
[ Links ]WILLIAMS-LINERA G, DOMÍNGUEZ-GASTELÚ V, GARCÍA-ZURITA ME. Microenvironment and Floristics of Different Edges in a Fragmented Tropical Rainforest. Conserv Biol. 1998;12(5):1091-1102.
[ Links ]WILLIAMS - LINERA G. Vegetation structure and environmental conditions of forest edges in Panamá. J Ecol. 1990;78:356-373.
[ Links ]ZECH W, SENESI N, GUGGENBERGER G, KAISER K, LEHMANN J, MIANO TM, et al. Factors controlling humification and mineralization of soil organic matter in the tropics. Geoderma. 1997;79(1-4):117-161.
[ Links ]













