Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.16 no.3 Bogotá Sept./Dec. 2011
VACINAS: PROGRESSOS E NOVOS DESAFIOS PARA O CONTROLE DE DOENÇAS IMUNOPREVENÍVEIS
Vacunas: progresos y nuevos retos para el control de enfermedades prevenibles
Vaccines: Progress and Challenges for the Control of Preventable Diseases
EDUARDO FONSECA PINTO1, Ph. D.; NUBIA ESTELA MATTA2, Ph. D.; ALDA MARIA DA-CRUZ1, Ph. D. 1 Lab Interdisciplinar de Pesquisas Médicas, Instituto Oswaldo Cruz, Fundação Oswaldo Cruz, Rio de Janeiro, Brasil. 2 Departamento de Biologia, Faculdad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, Colombia. Correspondencia: Eduardo Fonseca Pinto. eduardo@ioc.fiocruz.br
Presentado 8 de marzo de 2011, aceptado 28 de junio de 2011, correcciones 1 de julio de 2011.
RESUMO
Há mais de 200 anos a vacinação tem sido uma ferramenta muito efetiva na prevenção de doenças infecciosas e juntamente com o saneamento básico, o efeito prático da vacinação pode ser considerado o maior benefício à saúde pública do século XX. No entanto, o desenvolvimento de vacinas permanece um objetivo importante no campo da imunologia e na última década observa-se uma mudança em direção a uma abordagem mais racional, baseada em uma compreensão molecular da patogenicidade microbiana, na utilização de novas tecnologias recombinantes e no desenvolvimento de sistemas de liberação de vacinas mais efetivos. Este trabalho descreve o progresso no desenvolvimento de vacinas a partir dos primeiros relatos das práticas de vacinação, passando pelo estado atual de desenvolvimento de vacinas, pelas novas estratégias vacinais e pelo impacto da vacinação no controle das doenças imunopreveníveis.
Palavras chave: doenças imunopreveníveis, novas estratégias, vacinas.
RESUMEN
Desde hace más de 200 años la vacunación ha sido una herramienta efectiva en la prevención de enfermedades infecciosas junto con el saneamiento ambiental. El efecto práctico de la vacunación puede ser considerado como el mayor beneficio para la salud pública del siglo XX. Sin embargo, el desarrollo de vacunas sigue siendo un objetivo importante en inmunología y en la última década ha habido un cambio hacia un enfoque más racional, basada en los hallazgos moleculares de patogenia microbiana, el uso de nuevas tecnologías recombinantes y el desarrollo de sistemas de suministro de las vacunas más eficaces. En este trabajo se describen los progresos en el desarrollo de vacunas, partiendo de los primeros informes de prácticas de vacunación, hasta el estado actual del desarrollo de vacunas, las nuevas estrategias de vacunas y el impacto de la vacunación en el control de enfermedades prevenibles.
Palabras clave: enfermedades prevenibles, nuevas estrategias, vacunas.
ABSTRACT
For over 200 years, vaccination has been a very effective tool to prevent infectious diseases along with sanitation. In practical terms, it can be considered the greatest public health benefit of the twentieth century. However, vaccine development remains as a developing domain in the field of immunology and in the last decade there has been a shift towards a more rational approach in vaccination design, based on a molecular understanding of microbial pathogenesis, the use of new recombinant technologies and the development of more effective delivery systems for vaccines. This paper describes the progress in vaccine development from the first reports of vaccination practices, through the current state of vaccine development, the new vaccine strategies and the impact of vaccination in the control of preventable diseases.
Key words: New strategies, preventables diseases, vaccines.
INTRODUÇÃO
Uma estratégia inicial para se obter imunidade a um agente infeccioso era causar deliberadamente uma infecção leve com o patógeno não-modificado e esta infecção era seguida por uma proteção duradoura contra a reinfecção. Com base nestes relatos que existiam desde a antiguidade e que culminaram nos trabalhos de Jenner, o objetivo da vacinação de populações, a erradicação de doenças, foi conseguido em relação a varíola. A poliomielite é o próximo alvo e doenças como tétano, rubéola e difteria já são raras em alguns países. Assim, o efeito prático da vacinação, juntamente com o saneamento básico, pode ser considerado o maior benefício à saúde pública do século XX (van Ginkel et al., 2000).
O desenvolvimento de vacinas permanece um objetivo importante no campo da Imunologia e, desde o final do século XX, observa-se uma mudança em direção a uma abordagem mais racional, baseada no uso dos recursos da bioinformática, na utilização de novos recursos tecnológicos para obtenção e purificação de candidatos vacinais e no desenvolvimento de sistemas de liberação de vacinas mais efetivos (Daar et al., 2002).
Algumas das doenças infecciosas presentes na rotina diária das classes populares latino americanas, como a diarréia, verminoses intestinais, catapora, otites e pneumonia, são evitáveis através de medidas simples, como por exemplo, a lavagem apropriada das mãos, cuidados com o consumo de água, descarte adequado de lixo; ou através de vacinas, as doenças chamadas de imunopreveníveis. Este trabalho descreve o progresso no desenvolvimento de vacinas a partir dos primeiros relatos, passando pelo estado atual de desenvolvimento, as novas estratégias e o impacto da vacinação no controle das doenças infecciosas imunopreveníveis.
1. HISTÓRICO
Havia a observação, já há vários séculos, que algumas doenças infecciosas, como as chamadas viroses comuns da infância (caxumba, rubéola, sarampo, varicela) e mesmo a varíola, causavam doença uma única vez nas pessoas, pois os sobreviventes a uma primeira infecção se tornavam resistentes (imunes) àquela doença. Segundo relato atribuído a Tucídides (um grande historiador da Guerra do Peloponeso -ano 430 a.C.), esse conhecimento fazia com que os sobreviventes da praga que assolou Atenas fossem chamados para cuidar das pessoas infectadas (Gross e Sepkowitz, 1998; Cunha, 2004). Ao redor do ano 1000 d.C. começou a ser usado na China um método que consistia na inalação de pó feito à partir de crostas de lesões de indivíduos infectados pelo vírus da varíola e também na inalação de algodão embebido com o conteúdo das lesões. Há indícios também de que havia, em diferentes partes do mundo, a prática de se fazer pequenas incisões na pele de pessoas saudáveis, para inocular, com uma fina haste, material líquido proveniente das pústulas de doentes de varíola. Esses procedimentos conferiam imunidade contra a varíola humana (Gross e Sepkowitz, 1998).
Este procedimento denominado de variolização foi praticado na África, Índia e China por muito tempo antes de sua introdução na Europa no século XVIII. A inoculação do material contaminado proveniente de pústulas de um indivíduo infectado no tecido subcutâneo de indivíduos que nunca entraram em contato com a doença fazia com que a pessoa inoculada, na maioria dos casos, desenvolvesse uma doença branda e se curasse espontaneamente adquirindo imunidade. Apesar do procedimento apresentar uma mortalidade entre 1 e 3%, muito alta para os padrões atuais, e poder transmitir muitas outras doenças, como a sífilis, ele tinha grande vantagem quando comparado com a mortalidade de 20 a 40% que ocorria com a transmissão natural do vírus (Gross e Sepkowitz, 1998; Daniel-Ribeiro e Martins, 2009).
No século XVIII, a variolização chegou a Inglaterra graças aos esforços de Lady Mary Wortley Montagu (1689-1762), esposa do embaixador britânico na Turquia e ganhou força maior com o exemplo dado pelo príncipe e pela princesa de Gales em 1722, que permitiram que seus próprios filhos fossem inoculados. Um conhecimento comum na Inglaterra era que ordenhadeiras infectadas pelo vírus da varíola bovina (cowpox) desenvolviam uma doença branda e se tornavam imunes à varíola humana (smallpox). Há indícios que Benjamin Jesty (1737-1816) vacinou sua mulher e filhos para varíola humana inoculando material de pústulas provenientes de vacas infectadas com varíola bovina em 1774, sendo a primeira pessoa registrada na história que utilizou racionalmente a vacinação (Pead, 2003).
Estas observações abriram caminho para os trabalhos pioneiros do médico inglês Edward Jenner (1749-1823) que lançou as bases da vacinologia. Para provar a hipótese de que a infecção por varíola bovina conferia imunidade específica contra varíola humana, em 14 de maio de 1796, Jenner inoculou o garoto James Phipps, na época com oito anos de idade, com o fluido obtido das lesões presentes nas mãos da ordenhadeira Sarah Nelmes que havia sido infectada pelo vírus da varíola bovina. Em 01 de julho de 1796, Jenner inoculou o menino com o vírus da varíola humana e ele não desenvolveu nenhum sinal da doença, conforme Jenner previa. O trabalho de Jenner é considerado como o fundador da Imunologia como ciência e foi sua pesquisa e devoção ao procedimento que o popularizou na Inglaterra e, posteriormente, no mundo.
Posteriormente coube ao químico francês Louis Pasteur (1822-1895) lançar as bases metodológicas do preparo de vacinas. A partir dos experimentos com a bactéria causadora da cólera aviária e dos experimentos de cultivo e passagem do vírus da raiva em cérebro de coelho, Pasteur estabeleceu o princípio da atenuação para o desenvolvimento de vacinas. Sucessivamente, vários novos produtos foram sendo descritos, como a vacina contra cólera aviária, raiva e carbúnculo, pelo próprio Pasteur, e a vacina contra a difteria, por Roux e Yersin, esta última utilizando não a bactéria total, mas sim a toxina por ela produzida, e que em laboratório era tornada nãopatogênica por ação de agentes químicos como o formol. No final do século dezenove, foram obtidas ainda as vacinas contra a febre tifóide, peste e cólera.
2. BASES CONCEITUAIS EM VACINOLOGIA
As vacinas são preparações imunogênicas compostas por um grupo de substâncias (antígeno, adjuvante, preservativo veículo, etc.) que ao serem administradas a indivíduos imunocompetentes induzem um estado específico de proteção contra os efeitos nocivos do agente relacionado.
O termo adjuvante é utilizado para designar uma substância que, usada em combinação com um antígeno, resulta em resposta imune maior do que aquela produzida pelo antígeno administrado isoladamente. Entretanto, os efeitos dos adjuvantes não se restringem apenas ao aumento da imunogenicidade já que também podem promover a diminuição do período necessário para a indução da resposta imune, o aumento da duração da resposta de memória imunológica; a indução de imunidade em mucosas e a modulação da resposta imune, tanto celular como humoral (Simões e Ferreira, 2001). No desenvolvimento de uma vacina bem sucedida, o objetivo é alcançar uma formulação ideal que seja segura, que atue em dose única, produza imunidade protetora em uma proporção muito alta dos indivíduos, gere memória imunológica prolongada, tenha baixo custo por dose, tenha estabilidade biológica e seja de fácil administração.
Dentre os fatores que contribuem para relevância da pesquisa em vacinas estão: o desbalanço entre a velocidade do aparecimento de resistência microbiana aos novos antibióticos e o tempo para o desenvolvimento destes, a dificuldade no controle de vetores, o surgimento de novas ferramentas para o estudo dos patógenos (engenharia genética, uso de anticorpos monoclonais , genômica e proteômica), o aparecimento de doenças emergentes e reemergentes, a globalização e a facilidade de deslocamento das pessoas, as mudanças climáticas, ecológicas e sociais e o risco aumentado de epidemias e pandemias, o relato de sucessos crescentes da imunoterapia , o crescente conhecimento científico acerca do sistema imune e seu controle e o aumento do mercado relacionado as vacinas.
3. TIPOS DE VACINAS
O desenvolvimento de vacinas no inicio do século XX seguiu dois caminhos empíricos: primeiro, o uso de microorganismos atenuados, ou seja, com virulência reduzida; segundo, o desenvolvimento de vacinas baseadas em microorganismo morto ou inativado e terceiro, as vacinas baseadas em componentes purificados dos microorganismos.
- Vacinas vivas atenuadas. As vacinas com microorganismos vivos atenuados são obtidas pelo cultivo do microorganismo e posterior atenuação por aquecimento, passagens em cultura ou por deleção gênica. As vacinas com microorganismos atenuados disponíveis atualmente são as vacinas virais contra o sarampo, caxumba, rubéola, poliomielite (vacina Sabin), catapora e febre amarela e as vacinas bacterianas são a BCG e a vacina oral contra febre tifóide.
As vacinas vivas apresentam algumas vantagens importantes sobre as vacinas inativadas. A principal delas é que com a multiplicação do microorganismo atenuado no organismo do vacinado, há o envolvimento de todos os componentes do sistema imune no desenvolvimento da imunidade contra a partícula vacinal íntegra. Com isso a resposta imune é completa e mantém-se por longos períodos. As vacinas vivas, em geral, também apresentam menor custo de produção.
Entre as desvantagens das vacinas vivas destaca-se a possibilidade de efeitos adversos, devido a características individuais do hospedeiro e pela possibilidade de reversão da atenuação. Além disso, não devem ser administradas em pessoas imunodeficientes e exigem maior cuidado na estrutura de transporte e armazenamento (Schatzmayr, 2003). - Vacinas inativadas. As vacinas inativadas são utilizadas rotineiramente na prevenção de inúmeras doenças virais, como a gripe, poliomielite (vacina Salk), raiva e hepatite A e doenças bacterianas como a cólera e a peste. Os microorganismos são inativados por vários métodos químicos, em particular com o uso de formol ou detergente.
As vacinas inativadas oferecem como grande vantagem mais segurança, pois não há a multiplicação do agente no organismo do vacinado, porém, tendem a induzir uma imunidade menos duradoura e a exigir, com isso, a aplicação de mais de uma dose no esquema de imunização, bem como a repetição das imunizações ao longo dos anos. Este fato significa um custo mais alto na utilização desses produtos (Schatzmayr, 2003). - .Vacina com antígenos purificados (subunidades) 1.Vacinas utilizando polissacarídeos. A virulência de muitas bactérias depende da capacidade antifagocítica de sua cápsula, composta entre outras moléculas, por polissacarídeos. Como o revestimento da cápsula com anticorpos e/ou proteínas do sistema complemento aumentam a capacidade fagocítica de macrófagos e neutrófilos, houve o interesse para o uso de vacinas de polissacarídeos capsulares purificados (Goldsby et al., 2004).
A vacina atual para o Streptococcus pneumoniae, que causa pneumonia pneumocócica, consiste de 23 polissacarídeos capsulares antigenicamente diferentes. Uma outra vacina composta por polissacarídeos purificados é a vacina para Neisseria meningitidis. Como os polissacarídeos induzem respostas predominantemente independentes de linfócitos T, elas podem ser artificialmente acopladas a proteínas imunogênicas e convertidas em antígenos T-dependentes, elas são chamadas vacinas conjugadas. Com isso a imunogenicidade dos polissacarídeos pode ser potencializada e um exemplo destas vacinas conjugadas foi produzida contra o Haemophylus influenzae.
3.3.2. Vacinas com toxóides. Muitas doenças causadas por microorganismos dependem de toxinas secretadas, entre as quais a difteria e o tétano. Vacinas contra estas doenças foram obtidas com a purificação e a inativação destas toxinas. As toxinas inativadas, chamadas de toxóides, ainda retém atividade imunogênica suficiente para induzir a produção de anticorpos que se unem e neutralizam a toxina nativa. A vacina tríplice bacteriana (DTP) inclui os toxóides do tétano e da difteria e a vacina contra a coqueluche que poderá conter uma preparação inativada da bactéria Bordetella pertussis ou apenas subunidades, sendo então denominada acelular, de melhor qualidade, porém de maior custo (Goldsby et al., 2004). 3.3.3.Vacinas recombinantes. Dentre as múltiplas aplicações da tecnologia do DNA recombinante, surgida no início dos anos 70, a produção de vacinas atraiu o interesse de pesquisadores, e, em relativamente pouco tempo, obteve-se a expressão do antígeno de superfície do vírus da hepatite B (HBsAg) em leveduras. Esta proteína purificada veio a constituir a primeira vacina recombinante aprovada para uso em humanos.
4. VIAS DE IMUNIZAÇÃO
A maioria das vacinas utilizadas hoje em dia é administrada por via parenteral com seringa e agulha. Essa via tem duas desvantagens, a primeira de ordem prática, e a segunda imunológica. As injeções são dolorosas e caras, requerendo agulhas, seringas e um profissional treinado. O problema imunológico é que a injeção não é via usual de entrada da maioria dos patógenos contra os quais a vacinação é dirigida. Várias são as doenças causadas por patógenos que entram no organismo através de uma superfície mucosa como o trato gastro-intestinal ou respiratório e entre elas estão as meningites bacterianas e virais; a tuberculose, diarréias infecciosas, febre tifóide e a poliomielite. As mucosas têm associado a elas um sistema imunológico grande e complexo, anatômica e funcionalmente distinto daqueles encontrados em outras regiões do corpo no que se refere a processos especializados para captação, transporte, processamento e apresentação de antígenos, bem como mecanismos imunes efetores especializados, como a produção local de IgA secretória.
Grande parte das vacinas convencionais são eficazes na prevenção de doenças infecciosas que necessitam de anticorpos séricos circulantes (por exemplo, o tétano, a difteria e a coqueluche, assim como algumas doenças virais como febre amarela, hepatite A e B e caxumba). Entretanto, essas vacinas são incapazes de gerar resposta imune local, isto é, a produção de sIgA em mucosas, o que explica, em parte, a dificuldade de se desenvolver vacinas eficazes contra a AIDS e doenças entéricas. Para que uma resposta imune local seja gerada, a vacina deve ser administrada preferencialmente no sistema imune de mucosas e deve ser preparada de preferência com microrganismos atenuados capazes de se replicarem nos tecidos do hospedeiro. A vacina oral contra a pólio (Sabin) é um exemplo bem sucedido de vacina de mucosas. Atualmente, além da vacina contra pólio também são administradas por via oral as vacinas para febre tifóide, cólera e rotavírus (Simões e Ferreira, 2001). Além disso, vacinas de mucosas também são capazes de ativar respostas imunológicas sistêmicas, o que as tornam instrumentos valiosos para a proteção imunológica contra inúmeros patógenos.
Como exemplo do uso experimental das vias de mucosas na ativação de resposta imune sistêmica e eficaz contra uma doença por protozoário, resultados no modelo murino demonstraram que o lisado total de promastigotas de Leishmania amazonensis (LaAg) sem adjuvantes quando administrado pela via oral (Pinto et al., 2003) e também pela via nasal (Pinto et al., 2004) é capaz de induzir proteção em camundongos BALB/c infectados com a mesma espécie do parasito. Além do candidato vacinal LaAg, também foi observado no modelo murino a eficácia da vacinação nasal com DNA plasmidial codificando o antígeno denominado LACK (LACK-DNA) na leishmaniose cutânea (Pinto et al., 2004) e visceral (Gomes et al., 2007). Embora as vacinas orais ou nasais apresentem uma série de vantagens em relação às vacinas de administração parenteral, o número de vacinas de mucosas atualmente disponíveis ainda é muito limitado.
5. NOVAS ESTRATÉGIAS DE VACINAÇÃO
Na última década, os avanços no desenvolvimento de vacinas permitiram a introdução de novas estratégias para a obtenção e produção de antígenos, assim como foram desenvolvidas vias alternativas de administração e apresentação desses antígenos para as células do sistema imune (Illum et al., 2001).
O desenvolvimento de vacinas seguiu em direção a uma abordagem mais racional, baseada em uma compreensão molecular detalhada da patogenicidade microbiana, na utilização de novas tecnologias recombinantes e no desenvolvimento de sistemas de liberação de vacinas mais efetivos (Daar et al., 2002).
Dentre as novas estratégias no desenvolvimento de vacinas estão: a vacinologia reversa, as vacinas gênicas, as vacinas comestíveis, o desenvolvimento de sistemas de liberação controlada de vacinas e as vacinas imunoterapêuticas (Fig. 1; Rappuoli, 2004).
- Vacinologia reversa. A mais moderna tecnologia aplicada na produção de vacinas é a denominada vacinologia reversa. É feito o seqüenciamento do genoma do agente, a análise de suas proteínas, previstas através da bioinformática. Finalmente é avaliada sua capacidade teórica de induzir resposta imune. Os peptídeos selecionados podem, então, ser sintetizados ou expressos em vetores para a comprovação de sua real capacidade de induzir imunidade em animais (Ferreira e Porco, 2008).
Essa tecnologia tende a substituir os métodos tradicionais de preparo de vacinas, com a eliminação da necessidade de que os agentes sejam inicialmente cultivados ou os componentes potencialmente imunogênicos de vírus e bactérias sejam isolados e purificados previamente, antes dos testes de indução resposta imune em animais (Rappuoli, 2000). - Vacinas gênicas. Nas chamadas vacinas gênicas ou vacinas de DNA, os genes que codificam antígenos potencialmente imunizantes são inseridos em plasmídeos. As vantagens das vacinas de DNA são a sua capacidade de codificar proteínas com estrutura e conformação similares ou idênticas às das proteínas selvagens, capacidade de gerar respostas humorais e celulares mais prolongadas e de permitir a combinação de diversos imunógenos em uma preparação única. Estas características facilitam a imunização simultânea contra doenças diversas, além de trazer vantagens econômicas pela tecnologia do DNA recombinante, o que torna mais fácil a elaboração e a produção de grandes quantidades da vacina, além também da facilidade de armazenamento e distribuição devido à alta estabilidade do DNA em relação às proteínas diminuindo a necessidade de manter uma cadeia de frio (Damme et al., 1992; Weiner e Kennedy, 1999).
Existem ainda outras vantagens da imunização com plasmídeos em relação às imunizações com proteínas recombinantes. Os plasmídeos apresentam seqüências nucleotídicas específicas que têm papel crítico na imunogenicidade das vacinas: as seqüências Citosina-fosfato-Guanosina Oligodeoxinucleotídeo (CpG ODN) flanqueadas por regiões compostas de duas purinas em 5 e duas pirimidinas em 3 (Gurunathanet al., 2000). Tais seqüências se ligam ao receptor tipo Toll -9 (TLR-9) presente em macrófagos e em células dendríticas (Medzhitov, 2001) o que permite que elas ajam como importantes adjuvantes nos processos de vacinação que visam o direcionamento de resposta Th2 para Th1, pois elas induzem a produção de IFN-g e IL-12 e o decréscimo de produção de IL-5 (Klinman et al., 1996).
Esta é uma das estratégias investigadas atualmente para a geração de vacinas para câncer. Foi demonstrado recentemente em pacientes com câncer de próstata que a imunização com um antígeno de membrana específico de próstata codificado em um plasmídeo induz a produção de anticorpos específicos, que não foram detectados em pacientes não imunizados (Todovora et al., 2005).
Uma série de considerações relativas à segurança das vacinas de DNA devem ser feitas, como a possibilidade de integração ao genoma do hospedeiro (aumentando o risco de malignidade por ativação de oncogenes ou inativação de genes supressores de tumor) e de indução de respostas contra as células transfectadas (levando ao estabelecimento de doenças auto-imunes) (Gurunathan et al., 2000). - Vacinas Comestíveis. Nos últimos anos, plantas têm sido transformadas com subunidades antigênicas de patógenos objetivando a produção de vacinas contra doenças humanas e animais. Uma abordagem inovadora sobre a produção de vacinas em plantas foi dada por Charles Arntzen no início dos anos 90 quando introduziu o conceito de vacinas comestíveis. Segundo esta idéia, plantas comestíveis transgênicas que expressem antígenos, poderiam ser administradas oralmente desencadeando uma resposta imune protetora (Mason et al., 1992). Através deste método produzir-se-iam vacinas mais baratas, seguras, facilmente administradas e acessíveis em todas as partes do mundo. A partir dessa idéia, diversos grupos vêm utilizando esta estratégia objetivando a produção de vacinas. Testes clínicos demonstraram que porcos ao serem alimentados com uma vacina comestível produzida em milho, ficaram protegidos contra o vírus da gastroenterite (TGEV) (Giddings et al., 2000). Em voluntários humanos, foi demonstrado que o antígeno HbSAg do vírus da hepatite B produzido em batata e administrado oralmente foi capaz de aumentar os níveis de anticorpos específicos (Thanavala et al., 2005).Uma grande vantagem da utilização de vacinas comestíveis é que pode não ser necessária a purificação da proteína recombinante, diminuindo acentuadamente o custo das vacinas. Porém a concentração da proteína recombinante deve ser padronizada para que cada dose possua a mesma concentração da proteína recombinante. Assim, poderia se fazer extratos das plantas transgênicas, padronizando as concentrações das proteínas recombinantes (De Wild et al., 2000).
- Vacinas vetorizadas em partículas. Como é de conhecimento dos profissionais da área de saúde, um dos grandes problemas ligados ao sucesso de uma campanha de vacinação está relacionado às dificuldades de se desenvolver programas efetivos para as vacinações de reforço, principalmente em países em desenvolvimento. Os sistemas de liberação controlada permitiriam a aplicação da vacina em dose única onde, dada a degradação seletiva dos polímeros, são veiculadas de uma só vez a dose de ataque e as doses de reforço.
Além disso a utilização destes sistemas apresenta outras vantagens, pois protege os antígenos de ações degradativas do meio, possibilitando o uso de doses menores; mais de um antígeno pode ser encapsulado em um único sistema, facilitando o desenvolvimento de novas formulações que possam imunizar o indivíduo contra mais de uma doença ou contra vários epítopos do mesmo ou de diferentes patógenos.
Os sistemas mais bem caracterizados para vetorização de antígenos são lipossomas catiônicos (Wang et al., 2004), nano e microparticulas poliméricas de PLGA [Poly (DL-lactic-co-glycolic acid)] (Cui et al., 2003) e de quitosana (Iqbal et al., 2003). Lipossomas são nanovesículas simples ou multilamelares, compostas de uma ou mais membranas lipídicas envolvendo um compartimento aquoso, constituídos de fosfolipídios que vêm sendo usadas como sistemas de liberação de fármacos em produtos já disponíveis no mercado. Uma variedade de formulações lipossomais têm sido estudadas como adjuvantes ou sistemas de entrega de antígenos. Estas vesículas podem entrar nas células por fagocitose, mas possuem a vantagem de também poderem se fundir com a membrana celular, devido a sua constituição fosfolipídica e desta maneira liberarem o antígeno diretamente no citoplasma celular (O Hagan, 2001).
As micropartículas podem ser constituídas de poli-ésteres dos ácidos láctico e glicólico que no organismo são hidrolisados e uma vez degradados liberam os ácidos láctico e glicólico que são substratos naturais inócuos aos organismos (Bazile et al., 1992). As potenciais vantagens das micropartículas de PLGA como veículo para liberação de vacinas são: a biocompatibilidade, não é afetada pela passagem através do estômago, a estabilidade das biomoléculas encapsuladas, o direcionamento às células do sistema fagocitário mononuclear contribuindo para o desencadeamento da resposta imune, a possibilidade do uso de doses menores, levando à diminuição da probabilidade de efeitos colaterais indesejáveis.
No desenvolvimento de vacinas de mucosa, especial atenção tem também sido dada à quitosana, um copolímero catiônico derivado da deacetilação da quitina, a qual está presente no exoesqueleto de insetos, crustáceos e parede celular de fungos. O uso de quitosana no desenvolvimento de sistemas de liberação controlada tem sido muito investigado devido à sua biocompatibilidade, ausência de toxicidade dos seus produtos de degradação e da sua propriedade mucoadesiva que proporciona o aumento da capacidade de penetração do antígeno através da mucosa desencadeando respostas locais e sistêmicas aumentadas (van Der Lubben et al., 2001). - Vacinas imunoterapêuticas contra o câncer. O desenvolvimento de uma vacina contra o câncer é um desafio científico desde o início dos anos 50. As células cancerígenas têm a capacidade de escapar aos mecanismos de vigilância do sistema imune e alterar a regulação de supressores imunes. Nos últimos anos tem se dado grande importância a estratégias imunoterapêuticas contra o câncer que podem ser classificadas em: passivas (adotivas) que consistem na administração de anticorpos monoclonais gerados ex vivo ou células, respectivamente, e ativas, representadas por vacinas que estimulam uma resposta imune contra antígenos específicos de tumor. A estimulação do sistema imune tem vantagens como a possibilidade de gerar memória imunológica, enquanto que uma das principais dificuldades no desenvolvimento de vacinas é a falta de antígenos específicos de tumor e a deficiente resposta contra eles, pois usualmente são reconhecidos como antígenos próprios (Vergati et al., 2010).
Até o momento os melhores exemplos de vacinas contra o câncer são vacinas profiláticas contra agentes infecciosos que também causam câncer no homem, como a vacina contra o vírus da hepatite B. Essa vacina se tornou também a primeira vacina anticâncer desenvolvida, uma vez que expressiva porção dos portadores crônicos de hepatite B evolui para o carcinoma primário do fígado. Em um estudo publicado recentemente, após 20 anos de acompanhamento em Taiwan, foi demonstrado que a vacinação reduziu o risco de desenvolvimento de carcinoma hepatocelular em 70% (Chang et al., 2009). Outro exemplo é a vacina contra o vírus do papiloma humano (HPV) que é responsável por cerca de 500 mil casos de câncer cervical, 60 mil casos de câncer anal, genital e de garganta no mundo. Duas vacinas com características semelhantes estão no mercado, são elas: Gardasil® desenvolvida pela Merck Sharp & Dohme (Estados Unidos) e Cervarix® desenvolvida pela GlaxoSmithKline (Bélgica). As duas vacinas aprovadas pela FDA têm demonstrado considerável eficácia na prevenção de infecção pelos tipos de HPV 16 e 18, presentes em 70% dos casos de câncer de colo do útero. (Eisenstein, 2011). Recentemente foi realizado um ensaio clínico de fase 1 com um candidato vacinal contra Helicobacter pylori, que é uma bactéria responsável de 600 mil casos de câncer de estômago no mundo (Malfertheiner et al., 2008).
Uma outra estratégia contra o câncer é a utilização de vacinas compostas por células do próprio individuo denominadas vacinas autólogas. Esta estratégia tem como base inicial a diferenciação e ativação de células dendríticas ou seus precursores in vitro com citocinas/fatores de crescimento, posteriormente as células dendríticas são pulsadas com as proteínas de interesse e readministradas ao paciente (Palena et al., 2006). A primeira vacina autóloga para tratar câncer (Sipuleucel-T, Provenge ®) aprovada pela FDA em 2010, estende a sobrevida de homens com câncer de próstata avançada por mais de quatro meses (Kantoff et al., 2010).
Entre as mais recentes estratégias imunoterapêuticas contra o câncer está a vacinação antiidiotípica. Idiotipo é o conjunto de determinantes antigênicos presentes na região hipervariável de uma imunoglobulina e define a clonalidade desta imunoglobulina. Quando o linfócito B é neoplásico, o idiotipo da imunoglobulina presente na superfície deste linfócito é um antígeno tumor específico, um dos poucos encontrados em humanos, que pode ser usado na vacinação terapêutica. Entre as neoplasias de células B mais estudadas para a aplicação da vacinação antiidiotípica estão o linfoma folicular e o mieloma múltiplo (Bendandi, 2009).
A obtenção da proteína idiotípica foi baseada durante muito tempo na técnica de fusão celular que permite a geração in vitro do mesmo idiotipo tumor específico. Para isso, uma suspensão de células de linfonodos do paciente é obtida, expandida e posteriormente é promovida a sua fusão com uma linhagem de mieloma. Os hibridomas produtores de imunoglobulinas tumorais são selecionados e a imunoglobulina secretada é purificada, associada a adjuvantes e inoculada no paciente para estimular sua resposta imune (Rodríguez Calvillo et al , 2004).
As vacinas antiidiotipos foram as primeiras vacinas contra o câncer a apresentar evidências de eficácia clínica e biológica assim como benefícios clínicos em humanos. No entanto, três ensaios clínicos randomizados, independentes e de grande escala realizados recentemente falharam. Algumas razões não relacionadas à vacina podem ter comprometido o sucesso destes ensaios e novos estudos utilizando vacinas antiidiotipos continuam em andamento (Inogés et al, 2011).
6. SITUAÇÃO EPIDEMIOLÓGICA DAS DOENÇAS IMUNOPREVENÍVEIS
O programa expandido de imunização (EPI) foi estabelecido em 1974 com o objetivo de expandir os serviços de imunização para as crianças de países em desenvolvimento. Seis vacinas para doenças imunopreveníveis foram incluídas no EPI: difteria, sarampo, coqueluche, poliomielite, tétano e tuberculose. Durante os anos 90 outras duas vacinas foram incluídas, contra febre amarela em países em risco e hepatite B. Todas as vacinas do EPI podem ser administradas simultaneamente, isto simplifica a rotina de imunização (Galazka, 1991). Para as doenças imunopreveníveis, as estimativas de mortalidade indicam o número de mortes que poderiam ser evitadas se as vacinas existentes fossem utilizadas em seu pleno potencial. Estas estimativas podem ser utilizadas para priorizar as intervenções de saúde pública.
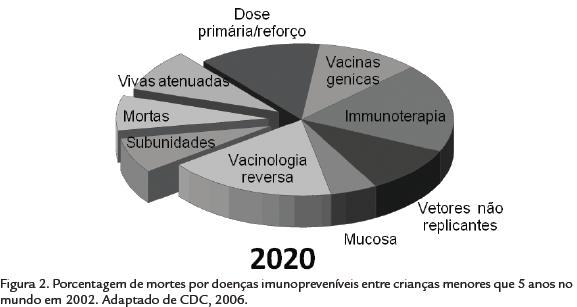
Em 2002, entre as doenças para as quais as vacinas são universalmente recomendadas, a Organização Mundial da Saúde estimou que 1.000 crianças menores de 5 anos morreram de poliomielite, 4.000 crianças morreram de difteria; 15.000 crianças morreram de febre amarela, 198 mil crianças morreram de tétano, 294 mil crianças morreram de coqueluche; 386 mil crianças morreram de doenças relacionadas ao Haemophilus influenzae tipo b (Hib) e 540 mil crianças morreram de sarampo (Fig. 2; CDC, 2006). Em relação a outras doenças que podem ser prevenidas por vacinas mas que não são universalmente recomendadas pela OMS, o maior número de mortes entre crianças menores de 5 anos foram atribuídos à doença pneumocócica (716.000) e a infecção por rotavírus (402.000; Fig. 2). No mesmo ano foi estimado que de 10,5 milhões de mortes de crianças menores que 5 anos em todo o mundo, cerca de 2,5 milhões foram por doenças imunopreveníveis e cerca de 1,9 milhões (76%) destas mortes ocorreu na África ou no sudeste da Ásia (CDC, 2006).
7. O IMPACTO DA VACINAÇÃO NAS DOENÇAS IMUNOPREVENÍVEIS NO BRASIL
O acesso universal e gratuito a vacinas eficazes, seguras e de qualidade vem permitindo importante impacto sobre doenças imunopreveníveis, resultando em mudanças no padrão de adoecimento e morte da população brasileira, especialmente a população infantil, com destaque para a queda da mortalidade por doenças infecciosas, refletindo de forma bastante positiva nos índices de mortalidade infantil (Ministério da Saúde, 2006).
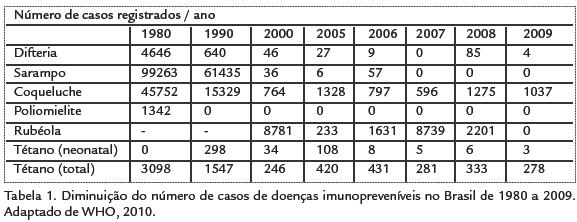
O Brasil tem apresentado êxitos significativos na redução de grande número de doenças transmissíveis para as quais dispõe de instrumentos eficazes de prevenção e controle, motivo pelo qual as mesmas estão em flanco declínio. A poliomielite foi erradicada em 1989; a transmissão do sarampo foi interrompida desde o final de 2000 e a difteria e a coqueluche são outras doenças transmissíveis com tendência ao declínio. Tem-se também observado significativa redução na ocorrência da meningite causada por H. influenzae tipo B (Tabela. 1; WHO, 2010).
Um programa de vacinação efetivo fornece imunidade grupal. Com a redução do número de membros suscetíveis de uma população, o reservatório natural de indivíduos infectados diminui, reduzindo a probabilidade de transmissão da infecção. Assim, mesmo os membros não-vacinados de uma população podem ser protegidos da infecção, se a maioria for vacinada. O programa adotado no Brasil, denominado Programa Nacional de Imunizações (PNI), constitui peça importante no controle das doenças transmissíveis que podem ser prevenidas mediante vacinação. O modelo tecnológico adotado no controle dessas doenças combina uma série de elementos: a vacinação de rotina, os dias nacionais de vacinação, as campanhas periódicas e a vigilância epidemiológica (Ministério da Saúde, 2006).
A vacinação de rotina consiste no estabelecimento de um calendário nacional de vacinações que deve ser aplicado a cada indivíduo a partir de seu nascimento, visando garantir, no âmbito individual, a prevenção específica das doenças imunopreveníveis; e, no âmbito coletivo, a indução da imunidade de massa, responsável pela interrupção da transmissão. A vigilância epidemiológica constitui estratégia complementar para o controle dessas doenças, uma vez que, a partir de um caso suspeito, serão desencadeadas ações com o objetivo de impedir o aparecimento de novos casos -ou seja, interromper a cadeia de transmissão.
CONCLUSÕES
Com o progresso conseguido desde os primeiros relatos das práticas de vacinação até as novas estratégias vacinais e o impacto da vacinação na redução do número de casos de doenças imunopreveníveis durante os anos, espera-se que o controle ou até a erradicação de várias doenças possa estar perto de ser alcançado em um futuro próximo.
BIBLIOGRAFIA
BAZILE DV, ROPERT C, HUVE P, VERRECHIA T, MARLARD M, FRYDMAN A, et al. Body Distribution of Fully Biodegradable 14C-poly (Lactic Acid) Nanoparticles Coated with Albumin after Parenteral Administration to Rats. Biomaterials. 1992;13:1093-1102.
[ Links ]BENDANDI M. Idiotype Vaccines for Lymphoma: Proof-of-principles and Clinical Trial Failures. Nat Rev Cancer. 2009;9:675-681.
[ Links ]CENTERS FOR DISEASE CONTROL AND PREVENTION (CDC). Vaccine Preventable Deaths and the Global Immunization Vision and Strategy, 2006-2015; 2006. Citado em 01 de março de 2011. Disponível em: URL: http://www.cdc.gov/mmwr
[ Links ]CHANG MH, YOU SL, CHEN CJ, LIU CJ, LEE CM, LIN SM, et al. Decreased Incidence of Hepatocellular Carcinoma in Hepatitis B Vaccines: A 20-year Follow-up Study.Taiwan Hepatoma Study Group. J Natl Cancer I. 2009;101:1348-1355.
[ Links ]CUI Z, MUMPER RJ. Microparticles and Nanoparticles as Delivery Systems for DNA Vaccines. Crit Rev Ther Drug. 2003;20:103-137.
[ Links ]CUNHA BA. The Cause of the Plague of Athens: Plague, Typhoid, Typhus, Smallpox, or Measles? Infect Dis Clin North Am. 2004;18(1):29-43.
[ Links ]DAAR AS, THORSTEINSDÓTTIR H, MARTIN DK, SMITH AC, NAST S, SINGER PA. Top ten Biotechnologies for Improving Health in Developing Countries. Nat Genet. 2002;32:229-232.
[ Links ]DAMME VP,CRAMM M, SAFARY A, VANDEPAPELIERE P, MEHEUS A. Heat Stability of a Recombinant DNA Hepatitis B Vaccine. Vaccine. 1992;10:366-367.
[ Links ]DANIEL-RIBEIRO CT e MARTINS YC. Uma (não tão) breve história da imunologia cognitiva: mecanismos de geração e manutenção da diversidade do repertório imune. Neurociências. 2009;5(4):189-211.
[ Links ]DE WILD C, HOUDTH HV, DE BUCK S, ANGENON G, DE JAEGER G, DEPICKER A. Plants as Bioreactors for Protein Production: Avoiding the Problem of Transgenic Silencing. Plant Mol Biol. 2000;43:347-359.
[ Links ]EISENSTEIN M. Know your Enemy. Nature. 2011;471:S8-S9.
[ Links ]FERREIRA J, PORCO A. Vacunas derivadas del análisis de los genomas: vacinología inversa. INCI. 2008;33:353-358.
[ Links ]GALAZKA A. Simultaneous Administration of Vaccines. Document EPI/RD/9l/WP.7/APR/Rev.l. Geneva: World Health Organization; 1991.
[ Links ]GIDDINGS G, ALLISON G, BROOKS D, CARTER A. Transgenic Plants as Factories for Biopharmaceuticals. Nat Biotechnol. 2000;18:1151-1155.
[ Links ]GOLDSBY RA, KINDT TJ, OSBORNE BA. Kuby J. Vacines. No Inmunologia. 5a Ed. Editora Mc Graw Hill; 2004. p. 437-454.
[ Links ]GOMES DCD, PINTO EF, DE MELO LDB, LIMA WP, LARRAGA V, LOPES UG et al., The Intranasal Delivery of Naked DNA Encoding the LACK Antigen Leads to Protective Immunity Against Visceral Leishmaniasis in Mice. Vaccine. 2007;25:2168-2172.
[ Links ]GROSS CP, SEPKOWITZ KA. The Myth of the Medical Breakthrough: Smallpox, Vaccination, and Jenner Reconsidered. Int J Infect Dis. 1998;3:54-60.
[ Links ]GURUNATHAN S, KLINMAN DM, SEDER RA. DNA Vaccines: Immunology, Application, and Optimization. Annu Rev Immunol. 2000;18:927-974.
[ Links ]ILLUM L, JABBAL-GILL I, HINCHELIFFE M, FISHER AN, DAVIS SS. Chitosan as a Novel Nasal Delivery System for Vaccines. Adv Drug Deliv Rev. 2001;51:81-96.
[ Links ]INOGÉS S, LÓPEZ-DÍAZ DE CERIO A, VILLANUEVA H, SORIA E, PASTOR F, BENDANDI M. Idiotype Vaccines for Lymphoma Therapy. Expert Rev Vaccines 2011;10:801-809.
[ Links ]IQBAL M, MAO HQ, JABBAL-GILL I, DAVIS SS, STEWERT MW, ILLUM L. Nasal Delivery of Chitosan-DNA Plasmid Expressing Epitopes of Respiratory Syncytial Virus (RSV) Induces Protective CTL Responses in BALB/c Mice. Vaccine. 2003;21:1478-1485.
[ Links ]KANTOFF PW, HIGANO CS, SHORE ND, BERGER ER, SMALL EJ, PENSON DF, et al. Sipuleucel-T Immunotherapy for Castration-resistant Prostate Cancer. N Engl J Med. 2010;363:411-422.
[ Links ]KLINMAN DM, YI AK, BEAUCAGE SL, CONOVER J e KRIEG AM. CpG Motifs Present in Bacteria DNA Rapidly Induce Lymphocytes to Secrete Interleukin 6, Interleukin 12, and Interferon Gamma. Proc Natl Acad Sci U S A. 1996,93:2879-2883.
[ Links ]MALFERTHEINER P, SCHULTZE V, ROSENKRANZ B, KAUFMANN SH, ULRICHS T, NOVICKI D, et al. Safety and Immunogenicity of an Intramuscular Helicobacter pylori Vaccine in Noninfected Volunteers: A Phase I Study. Gastroenterology. 2008;135:787-95.
[ Links ]MINISTÉRIO DA SAÚDE - Doenças infecciosas e parasitárias: guia de bolso. 6ª Edição, Brasília-DF: Ministério da Saúde: Secretaria de Vigilância em Saúde, 2006.
[ Links ]MASON HS, LAM, DMK e ARNTZEN CJ. Expression of Hepatitis B Surface Antigen in Transgenic Plants. Proc Natl Acad Sci U S A. 1992;89:11745-11749.
[ Links ]O HAGAN DT. Recent Developments in Vaccine Delivery Systems. Curr Drug Targets. 2001;1:273-286.
[ Links ]PALENA C, ABRAMS SI, SCHLOM J, HODGE JW. Cancer Vaccines: Preclinical Studies and Novel Strategies. Adv Cancer Res. 2006;95:115-145.
[ Links ]PEAD PJ. Benjamin Jesty: New Light in the Drawn of Vaccination. Lancet. 2003;362:2104-2109.
[ Links ]PINTO EF, CORTEZIA MM, ROSSI-BERGMANN B. Interferon-gamma - Inducing Oral Vaccination with Leishmania amazonensis Antigens Protects BALB/c and C57BL/6 Mice Against Cutaneous Leishmaniasis. Vaccine. 2003;21:3534-3541.
[ Links ]PINTO EF, PINHEIRO RO, RAYOL A, LARRAGA V, ROSSI-BERGMANN B. Intranasal Vaccination Against Cutaneous Leishmaniais Using a Particulated Leishmanial Antigen or LACK-DNA. Infect Immun. 2004;72:4521-4527.
[ Links ]RAPPUOLI R. Reverse Vaccinology. Curr Opin Microbiol. 2000;3:445-450.
[ Links ]RAPPUOLI R. From Pasteur to genomics: Progress and Challenges in Infectious Diseases Nat Méd. 2004;10:1177-1185.
[ Links ]RODRÍGUEZ CALVILLO M, INOGÉS S, LÓPEZ DÍAZ DE CERIO A, ZABALEGUI N, PANIZO C, HERNÁNDEZ M, PÉREZ CALVO J, et al. Pasado, presente y futuro de la vacunación anti-idiotipo. Rev Med Univ Navarra. 2004;48:14-23.
[ Links ]SCHATZMAYR HG. Novas perspectivas em vacinas virais. História, Ciências, Saúde - Manguinhos. 2003;10:655-669.
[ Links ]SIMÕES MA, FERREIRA LCS. Adjuvantes de Mucosas. Aliados na busca de vacinas orais mais eficazes. Biotecnologia, Ciência e Desenvolvimento. 2001;19:32-35.
[ Links ]THANAVALA Y, MAHONEY M, PAL S, SCOTT A, RICHTER A., NATARAJAN N. et al., Immunogenicity in Humans of an Edible Vaccine for Hepatitis B. Proc Natl Acad Sci U S A. 2005;102:3378-3382.
[ Links ]TODOROVA K, IGNATOVA I, TCHAKAROV S, ALTANKOVA I, ZOUBAK S, KYURKCHIEV S, et al. Humoral Immune Response in Prostate Cancer Patients After Immunization with Gene-based Vaccines that Encode for a Protein that is Proteasomally Degraded. Cancer Immun. 2005;11:5:1-8.
[ Links ]VAN DER LUBBEN IM, VERHOEF JC, BORCHARD G, JUNGINGER HE. Chitosan for Mucosal Vaccination. Adv Drug Deliv Rev. 2001;52:139-144.
[ Links ]VAN GINKEL FW, NGUYEN HH, McGHEE JR. Vaccines for Mucosal Immunity to Combat Emerging Infectious Diseases. Emerg Infect Dis 2000;6:123-132.
[ Links ]VERGATI M, INTRIVICI C, HUEN NY, SCHLOM J, TSANG KY. Strategies for Cancer Vaccine Development. J Biomed Biotechnol. 2010;596432:1-12.
[ Links ]WANG D, CHRISTOPHER ME, NAGATA LP, ZABIELSKI MA, LI H, WING, JP et al., Intranasal Immunization with Liposome-encapsulated Plasmid DNA Encoding Influenza Virus Hemagglutinin Elecits Mucosal, Cellular and Humoral Immune Responses. J Clin Virol. 2004;31:99-106.
[ Links ]WEINER DB, KENNEDY RC. Genetic Vaccines. Sci Am. 1999;281:50-57.
[ Links ]WHO. Vaccine-preventable diseases: monitoring system 2010 global summary. 2010. Citado em 01 de março de 2011. Disponível na URL:http://whqlibdoc.who.int/hq/2010/WHO_IVB_2010_eng_p32-R242.pdf
[ Links ]













