Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.17 n.1 Bogotá jan./abr. 2012
HÁBITOS ALIMENTARIOS DEL BARBUL DE PIEDRA (Ariopsis sp.) EN EL RÍO SINÚ, COLOMBIA
Feeding Habits of Barbul de Piedra (Ariopsis sp.) in the Sinu River, Colombia
CHARLES W. OLAYA-NIETO1, M.Sc.; JOHN J. ARELLANO-PADILLA1, Profesional en Acuicultura; ANGEL L. MARTÍNEZ-GONZÁLEZ1, Profesional en Acuicultura
1 Laboratorio de Investigación Biológico Pesquera-LIBP. Departamento de Ciencias Acuícolas. Universidad de Córdoba. Lorica, Colombia. Carrera 23 # 2A-20, piso 2. Telefax: 57 4 773 72 65 charles_olaya@hotmail.com; arpa07@hotmail.com; anmago1416@hotmail.com
Presentado 20 de febrero de 2010, aceptado 3 de marzo de 2011, correcciones 17 de julio de 2011.
RESUMEN
Se estudiaron los hábitos alimentarios del barbul de piedra en el río Sinú. El contenido estomacal se evaluó con el coeficiente de vacuidad, grado de digestión, frecuencia de ocurrencia, frecuencia numérica, gravimetría, índice de importancia relativa y relación longitud intestinal-longitud total. Solo 18,8% de los estómagos se encontró vacío, la mayoría de las presas estaban medio digeridas y se identificaron cinco grupos alimentarios: crustáceos, peces, material vegetal, moluscos y otros. Crustáceos fue el grupo más frecuente, abundante y con mayor composición en peso. El índice de importancia relativa indicó que crustáceos y peces son grupos de importancia relativa secundaria, mientras que restos vegetales, moluscos y otros fueron ocasionales o circunstanciales. Los resultados alcanzados en este trabajo muestran que el barbul de piedra es un pez que mantiene sus hábitos alimentarios a medida que va creciendo y a lo largo del ciclo hidrológico, aunque muestra preferencia carnívora, especialmente por los Crustáceos.
Palabras clave: Barbul de piedra, Ariopsis sp., Alimentación, río Sinú, Colombia.
ABSTRACT
The feeding habits of Barbul de piedra in the Sinu river were studied. The stomach content was analyzed using the proportion of empty stomachs, grade of digestion, frequency of occurrence, numerical frequency, gravimetry, relative importance index and the gut length-total length relationship. Only 18.8% of stomachs were empty, most of preys were half-digested and five food groups were identified: Crustaceans, fishes, vegetable rests, molluscs and others. Crustaceans were the most frequent, abundant and greater weight composition group. The relative importance index indicated that crustaceans and fishes were secondary relative importance groups and vegetable rests, molluscs and others were occasional or circumstantial groups. The results achieved in this work indicate that Barbul de piedra is a fish that keeps your feeding habits as they grow and along the hydrological cycle, although shows carnivorous preference, especially by Crustaceans.
Key words: Barbul de piedra, Ariopsis sp., Food, Sinu river, Colombia.
INTRODUCCIÓN
El barbul de piedra (Ariopsis sp.), o chivo cabezón, como se conoce en la ciénaga Grande de Santa Marta, Colombia y sus alrededores, es una especie de bagre prácticamente endémica de la costa Caribe colombiana, que -debido a dicho endemismo y a la fuerte presión pesquera artesanal a que es sometida en dicha ciénagaes considerada especie amenazada por la IUCN (Acero, 2002).
Presenta cabeza redondeada, ligeramente aplanada arriba, hocico redondeado transversalmente, boca inferior, dientes villiformes en el palatino en dos pares de parches y rastrillos branquiales en los dos primeros arcos (Acero, 2002). Se distribuye geográficamente en la costa noroeste de Colombia y Venezuela (Acero, 2002), aunque Cervigón, 1991 y Cervigón et al., 1992, no la reportan como nativa del último país.
Ocurre en aguas turbias sobre fondos fangosos de las áreas bajas de arroyos, estuarios y lagunas rodeadas de manglar, restringido a aguas dulces y salobres alimentándose principalmente de cangrejos; los juveniles consumen básicamente copépodos (Acero, 2002). Presenta dimorfismo sexual a la talla (Chaparro et al., 2002), cuidado parental en las primeras fases del desarrollo embrionario (Breder y Rosen, 1966), en donde los machos realizan incubación oral de los ovocitos fecundados (Castellano y Angulo, 2011), por lo ellos están impedidos para ingerir alimento durante dicho periodo de incubación según Galvis, 1984.
Presenta talla media de madurez sexual de 36,2 cm de longitud total para sexos combinados, desoves parciales, periodo de reproducción desde enero a diciembre, ovocitos muy grandes con diámetro promedio de 1,4 cm y baja fecundidad estimada en 49 ovocitos (Castellano y Angulo, 2011). No es reportado en los estudios de monitoreo pesquero del Convenio INPA-Urrá como un pez de interés comercial, observándose que se tiene poca información biológica básica con respecto a su crecimiento, mortalidad, hábitos alimentarios y biología reproductiva. Sin embargo, es muy importante en la seguridad alimentaria de los pescadores y sus familias en el bajo Sinú.
El objetivo de este trabajo fue estudiar los hábitos alimentarios del barbul de piedra en la cuenca baja del río Sinú, Colombia, aportando información biológica básica que incremente el estado del conocimiento de la especie de cara a su aprovechamiento pesquero y acuícola en la cuenca del río Sinú.
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
Esta investigación se realizó en el bajo río Sinú. El río Sinú tiene una longitud de 380 km, extendiéndose desde el nudo de Paramillo en el departamento de Antioquia hasta el mar Caribe, en el departamento de Córdoba. Recibe los caudales de los ríos Verde, Esmeralda, Manso, Tigre y de numerosas quebradas. Su cuenca tiene una superficie de 13.700 km². En su parte media y baja se encuentran la ciénaga Grande de Betancí, la ciénaga Grande de Lorica, las ciénagas de la margen izquierda y otras de menor tamaño. Presenta una temperatura promedio anual de 28 °C, que en épocas de lluvias cuando las aguas inundan los planos cenagosos, disminuye a 27 °C (Bustamante, 2000).
La pluviosidad en las zonas altas alcanza hasta 2.000 mm/año en el embalse de Urrá y 5.000 mm/año en las estribaciones del nudo de Paramillo, mientras en las zonas bajas los valores medios anuales son de 1.200 mm/año. Se presenta un régimen bimodal de precipitaciones, con periodos lluviosos en abril-junio y agosto-octubre. El principal periodo seco se prolonga desde noviembre a marzo, con uno de menor proporción en julio-agosto (IDEAM, 1998).
MUESTRAS
Para la identificación taxonómica de la especie se siguió a Miles, 1945 y Acero, 2002, recolectándose 335 individuos con línea de mano y atarraya entre enero y diciembre 2005, a los cuales se les tomó longitud total (LT), longitud horquilla (LH) y longitud estándar (LS) al milímetro más cercano con un ictiómetro graduado en mm, y peso total (WT) al gramo más cercano con una balanza eléctrica Ohaus con capacidad de 5.000 g (±1 g).
Aplicando las técnicas de Laevastu, 1980, y Marrero, 1994, una vez efectuada la disección de los peces, se ubicaron las diferentes partes del tubo digestivo (esófago, estómago, intestino, ciegos pilóricos). Luego se procedió a retirar los estómagos para conservarlos en frascos plásticos de 250 y 500 mL que contenían formol a 10% bufferado. A los estómagos muy grandes se les inyectó formol para detener la actividad enzimática. Todos los frascos fueron rotulados, indicando especie, número de la muestra y fecha. En un formato se anotó la información citada arriba más sitio de captura, arte de pesca, talla, peso y sexo.
El contenido estomacal se colocó en una caja Petri y se examinó por microscopía de luz (estereoscopio y microscopio), separando, identificando y enumerando el alimento o presas presentes. La identificación se efectuó hasta el nivel taxonómico permitido por el grado de digestión del alimento, ordenándose en grupos, ítems o presas, pesándose en una balanza eléctrica Ohaus de 1.500 (± 0,01 g) de capacidad. El material animal que estaba totalmente digerido se identificó por los fragmentos, en lo posible (Lugo, 1989). El coeficiente de vacuidad (CV) se estimó con la técnica de Windell, 1971: CV = 100* n.° estómagos vacíos / n.° total de estómagos analizados (1)
El grado de digestión (GD) se evaluó con la escala de Laevastu, 1980, la cual clasifica el estado de las presas así: fresco, medio digerido y digerido.
Se utilizaron 3 métodos para cuantificar contenido estomacal, expresado en valores promedios mensuales y anuales: frecuencia de ocurrencia (FO), frecuencia numérica (FN) y gravimetría (G) (Windell, 1971; Windell y Bowen, 1978; Silva y Stuardo, 1985): FO = 100* Ocurrencia de presas del ítem A/n.° total de estómagos con alimento (2) FN = 100* n.° de presas del ítem A/No. total de presas (3) G = 100* Peso de las presas del ítem A/Peso de todas las presas (4)
Para establecer la importancia de cada presa en la composición de la dieta se estimó el índice de importancia relativa (IIR) de Yáñez-Arancibia et al., 1976, modificado por Olaya-Nieto et al., 2003. En este índice, la relación matemática es la siguiente: IIR = F*G/1OO (5) en donde, IIR representa índice de importancia relativa, F porcentaje de frecuencia de ocurrencia y G porcentaje gravimétrico. Esta expresión presenta un rango de 0 a 100, en donde el rango de 0 a 10% representa grupos tróficos de importancia relativa baja, de 10 a 40% grupos de importancia relativa secundaria y 40 a 100% grupos de importancia relativa alta.
Para analizar las preferencias alimentarias de acuerdo con las tallas que presenta la especie en estudio y con el ciclo hidrológico del río Sinú, los ejemplares recolectados se agruparon en siete intervalos de talla desde 17,5-22,5 hasta 47,5-52,5 cm LT, tal y como se realizó para la distribución de frecuencia de tallas. El ciclo hidrológico anual del río Sinú presenta cuatro épocas bien definidas, aguas bajas (diciembre, enero, febrero), aguas ascendientes (marzo, abril, mayo), aguas altas (junio, julio, agosto) y aguas descendentes (septiembre, octubre, noviembre).
También se estableció la relación longitud intestinal-longitud total de acuerdo con la escala de Brusle, 1981, la cual plantea lo siguiente: 0,5 a 0,7, planctófagos; 0,5 a 2,4, carnívoros; y 3,7 a 6,0, herbívoros.
Se utilizó estadística descriptiva, expresando las variables como media ± desviación estándar. Se estimó el coeficiente de correlación (r) a la relación longitud intestinallongitud total.
RESULTADOS
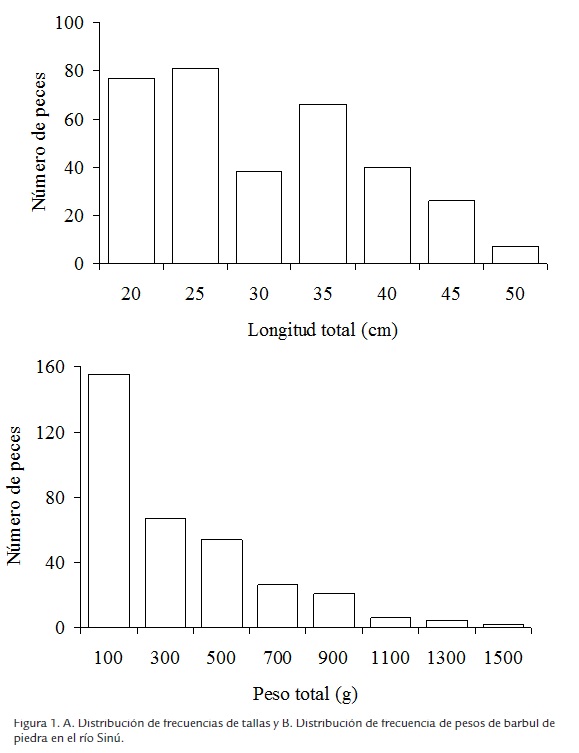
La talla mínima registrada fue 18,0 cm LT (enero), la máxima 50,0 cm LT (abril); mientras que el menor peso fue 46,0 g (febrero), y el mayor 1528,0 g (abril). Aunque la talla media de captura fue 30,3 cm LT, la distribución de frecuencias de tallas (Figura 1A) mostró que 47,2 % (n =158) de los peces capturados corresponden a tallas menores de 27,5 cm LT. Algo similar ocurrió con el peso medio de captura, estimado en 341,8 g, puesto que la distribución de frecuencias de pesos (Figura 1B) presentó una frecuencia modal de 100,0 g, lo que indica que casi la mitad de los individuos (46,3%) fueron capturados con este peso. De los estómagos analizados durante el año, solo 18,8% se encontró vacío, destacándose los meses de julio (CV =52,2%) y agosto (CV =40,6%), en donde alcanzó sus máximos valores. El coeficiente de vacuidad fue 18,3% para hembras y 28,0% para machos, lo cual sugiere diferencias estadísticas significativas entre sexos. En este trabajo se encontraron cuatro machos incubantes con embriones y larvas en la cavidad oral y sin contenido estomacal. El 12,6% de las presas se encontró fresco, el 66,0% medio digerido y el 21,4% digerido, observándose que en todos los meses del año se presentaron los tres grados de digestión, aunque el estado medio digerido siempre fue el mayor.
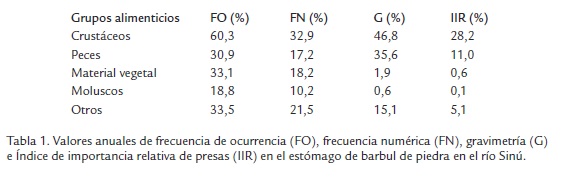
Se identificaron 5 grupos alimentarios: crustáceos, peces, material vegetal, moluscos y otros, los cuales mostraron la siguiente frecuencia de ocurrencia anual (Tabla 1): Crustáceos, el más frecuente (60,3%) constituido por camarón y restos de crustáceos; Otros (33,5%), conformado por anélidos, trozo de polietileno, carbón vegetal, Daphnia, detritos, restos de cigarrillo, huesos, guijarros, restos de aves, restos de insectos, restos de anfibio; material vegetal (33,1%) constituido por semillas, ramas, hojas y restos vegetales; peces con (30,9%) conformado por cocobolo (Andinoacara pulcher), moncholo (Hoplias malabaricus), sardina (Astyanax sp.), chipe (Hoplosternum magdalenae) y raspa canoa (Lamonticthys sp.) y moluscos con (18,8%). Todos los ítems estuvieron presentes durante todos los meses del año de estudio, excepto moluscos en el mes de julio. e Índice de importancia relativa de presas (IIR) en el estómago de barbul de piedra en el río Sinú.
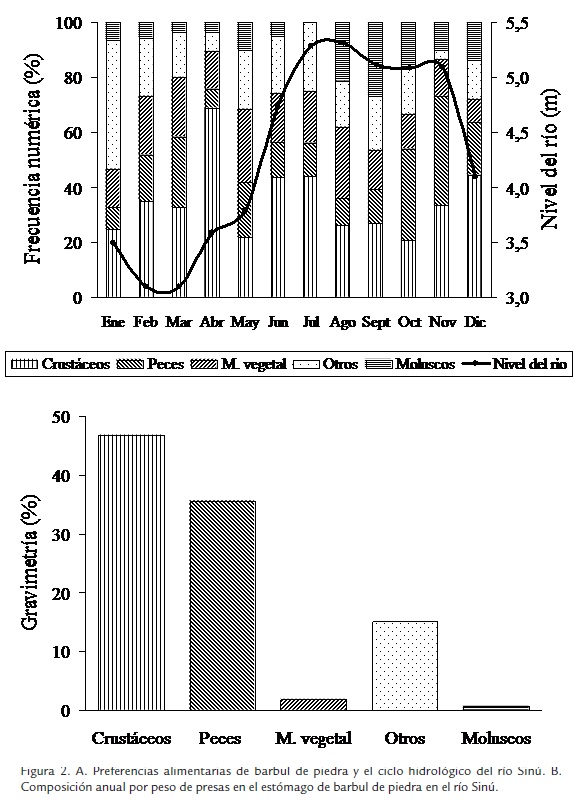
Crustáceos (32,9%) fue el ítem más abundante seguido por otros (21,5%), material vegetal (18,2%), peces (17,2%) y moluscos (10,2%; Tabla 1). En la composición mensual se observa que crustáceos también es la presa más importante en aguas altas (Figura 2A). 46,8% del peso de las presas ingeridas correspondió a crustáceos, seguido por peces (35,6%), otros (15,1%), material vegetal (1,9%) y moluscos (0,6%; Tabla 1; Figura 2B). Crustáceos siempre alcanzó la mayor composición en peso en casi todos los meses muestreados, excepto mayo, octubre y noviembre, en donde prevaleció peces y julio, en donde primó otros.
De acuerdo con los datos obtenidos en este trabajo crustáceos (IIR =28,2) y peces (IIR =11,0) son clasificadas como presas de importancia relativa secundaria, mientras que material vegetal (IIR =0,6), Otros (IIR =5,1) y moluscos (IIR =0,1) son presas circunstanciales o incidentales y de baja importancia relativa.
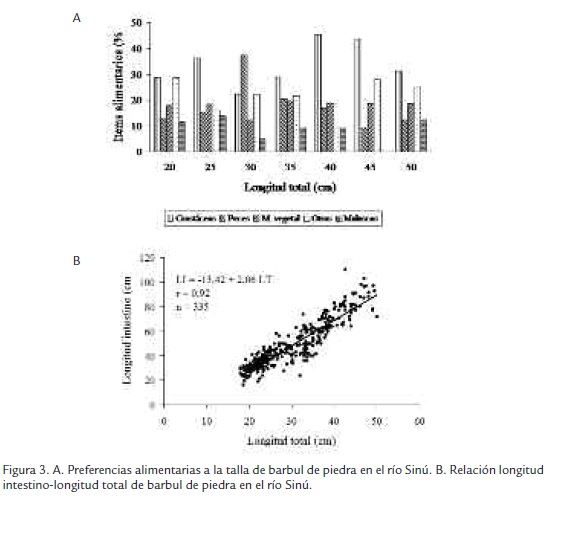
En las preferencias alimentarias, se observó que los hábitos alimentarios se mantuvieron a medida que iban creciendo con excepción del penúltimo intervalo (42,5-47,5) en el cual no se registra el consumo de moluscos. Crustáceos es la presa principal (28,8, 36,3, 28,9, 45,3, 43,8 y 31,3%) en casi todos los intervalos de clase, excepto en el tercer intervalo (27,5-32,5 cm LT), en donde lo es peces con 37,5%. Peces participa con apenas el 9,4 hasta el 20,6% en los demás intervalos, material vegetal es la segunda presa en importancia en dos ocasiones (22,5-27,5 y 37,5-42,5 cm LT) con 18,5 y 18,9%, otros es la segunda presa en el resto de intervalos (17,5-22,5, 27,5-32,5, 32,5-37,5, 42,5-47,5 y 47,5-52,5 cm LT) con 28,8, 22,5, 21,6, 28,1 y 25,0%, respectivamente; y moluscos registra los menores valores en todos los intervalos, fluctuando entre 0,0 y 13,7% (Figura 3A). En cuanto a los peces consumidos, el registro fue el siguiente: entre 17,5-22,5 cm LT, 1 raspa canoa; entre 27,5-32,5 cm LT 1 cocobolo y 1 sardina; entre 32,5-37,5 cm LT, 2 cocobolo, 1 sardina y 1 moncholo; 37,5-42,5 cm LT, 1 chipe; 47,5-52,5 cm LT, 1 cocobolo. Las tallas de las presas oscilaron entre 4,4 cm LT (raspa canoa) y 9,5 cm LT (cocobolo). Se encontró que crustáceos fue la presa más consumida durante el ciclo hidrológico, siendo superada por peces solo en aguas descendentes. En cuanto a restos vegetales, otros y moluscos su consumo no se vio influenciado por la variación del nivel del río (Figura 2A).
La relación longitud intestinal-longitud total fue estimada en 1,6, la cual confirma a la especie en estudio como carnívora de acuerdo con la escala de Brusle, 1981, con coeficiente de correlación de 0,92, el cual es significativo a 95% de confianza de acuerdo con los valores críticos establecidos (Figura 3B).
DISCUSIÓN
El coeficiente de vacuidad anual (CV =18,8%) de este trabajo es menor que el reportado para Ariopsis caerulescens (38,3%) en el sistema lagunar Huizache-Caimanero (México) (Díaz y Soto, 1988). Varios factores pueden explicar esto: el fenómeno de la regurgitación, que es la expulsión parcial o total del contenido estomacal para eliminar presas indeseables o indigeribles (Zavala-Camin, 1996) o como un mecanismo de defensa para facilitar el escape (Anzola, 1977; Pérez-Chaparro et al., 2001). Prejs y Colomine, 1981, señalan que dicho fenómeno puede ser estimulado por el uso de anzuelos y redes agalleras en la captura de los peces estudiados, por lo que no recomiendan su uso.
El proceso reproductivo también pudo haber afectado el coeficiente de vacuidad en los meses de julio (52,2%) y septiembre (28,6%) debido a que el barbul de piedra presenta cuidado parental en las primeras fases del desarrollo embrionario (Breder y Rosen, 1966), en donde los machos realizan incubación oral de los ovocitos fecundados (Olaya-Nieto et al., 2007; Castellano y Angulo, 2011). El haber encontrado machos incubantes con embriones y larvas en la cavidad oral y sin contenido estomacal, confirma lo reportado por Galvis, 1984, en cuanto a la inhabilidad en la ingestión de alimento durante la incubación oral, por lo cual posiblemente almacenaron energía antes de este evento. Cabe anotar que la especie en estudio es un pez con desove prolongado entre enero y diciembre, tal y como lo afirman Castellano y Angulo, 2011.
Lagler et al., 1984, afirman que los peces carnívoros poseen estómagos evolucionados que segregan ácidos para digerir carnes, huesos y escamas de las presas ingeridas y tiene el intestino mucho más corto que las especies herbívoras, por lo que su digestión es más rápida. Lo anterior permite inferir que el pez ya había digerido el alimento al momento de su captura, lo cual también afecta el coeficiente de vacuidad. La evacuación del tracto digestivo de los peces depende de la digestibilidad del alimento; los peces que consumen moluscos u otros peces tienen una rápida digestión y evacuación gástrica, a diferencia de los que consumen vegetales y crustáceos que pueden demorar el doble de tiempo en digerirlos (Rotta, 2003), como se observó en este trabajo, en donde la mayoría de las presas se encontraron en estado medio digerido.
Los resultados obtenidos en este trabajo son similares a los reportados por Vega, 1990, en México, quien encontró para Ariopsis felis una frecuencia de ocurrencia similar conformada por crustáceos (57,2%), peces (11,0%), moluscos (7,7%) y material vegetal (2,2%); y para Cathorops melanopus crustáceos (37,2%), peces (19,6%), moluscos (4,3%) y material vegetal (4,2%). También reporta que para Ariopsis felis el alimento más abundante en su dieta son crustáceos y peces con 38,8% y 38,0%, respectivamente, seguidos de moluscos (5,6%) y material vegetal (1,2%); y para Cathorops melanopus crustáceos (41,0%), peces (25,2%), seguidos por material vegetal (6,3%) y moluscos (3,3%). Al analizar los espectros tróficos de dichos bagres se observa que consumen básicamente ítems alimentarios similares.
La información sobre la estructura de comunidades de peces con suficiente cobertura espacial y temporal proporciona herramientas importantes para su monitoreo. Es así como el conocimiento de los procesos ambientales que influyen en la relaciones de las especies con el ambiente, en especial el acuático, se constituye en un enfoque eficiente para la mejor comprensión de la composición y estructura de las comunidades de peces (Júlio Jr et al., 2003). La alimentación es uno de los factores biológicos más importantes y su abundancia y variedad influyen en la estructura y composición de poblaciones de peces (Aranha et al., 2000), debido a que la ecología trófica o alimenticia es uno de los factores que determinan el éxito de una especie en su medio ambiente (Almeida, 2003). Analizando los diferentes métodos de los contenidos estomacales: frecuencia de ocurrencia, frecuencia numérica y gravimetría (Tabla 1), se observa que los grupos alimentarios crustáceos y peces son los más consumidos por el barbul de piedra, lo que indica que su dieta es carnívora, con preferencia por crustáceos. Sin embargo, al agrupar peces, crustáceos y moluscos se obtiene un IIR de 73,5%, lo que significa que la carne es el alimento principal y con alta importancia relativa en la dieta de la especie en estudio, confirmándola como carnívora, lo que concuerda con lo reportado por Santos-Acevedo y Blanco, 2003, para la especie en la ciénaga Grande de Santa Marta, Colombia, quienes la describen como una especie carnívora especialista en consumir regularmente crustáceos, peces y restos de insectos y material vegetal de manera ocasional.
En cuanto a la relación longitud intestinal-longitud total estimada (1,6) que corresponde a un pez carnívoro. Rotta, 2003, reporta que los peces carnívoros presentan un intestino corto porque la cantidad de alimento ingerido es menor y la calidad superior, por lo tanto el tránsito es más lento siendo este aspecto importante para favorecer la difusión de los nutrientes; además, la longitud del intestino parece estar relacionada con la cantidad de material indigerible de alimento que con su origen animal y/o vegetal. Los resultados alcanzados en este trabajo muestran que el barbul de piedra es un pez que mantiene sus hábitos alimentarios a medida que va creciendo y a lo largo del ciclo hidrológico, aunque muestra preferencia carnívora, especialmente por crustáceos.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a los pescadores y comercializadores de pescado de la cuenca baja del río Sinú y a los tesistas-investigadores involucrados en el proyecto de investigación "Estimación de los parámetros biológicos básicos de peces comerciales del río Sinú-Fase II", Código FMV-01-04, del cual hace parte este trabajo. A la Oficina de Investigación y Extensión de la Universidad de Córdoba, por la financiación recibida.
BIBLIOGRAFÍA
ACERO A. Order Siluriformes, Family Ariidae. In: Carpenter KE, editor. The living marine resources of the Western Central Atlantic. Volume 2: Bony fishes part 1 (Acipenseridae to Grammatidae). Rome: FAO Species Identification Guide for Fishery Purposes and American Society of Ichthyologists and Herpetologists Special Publication No. 5. FAO; 2002. p. 831-852. [ Links ]
ALMEIDA PR. Feeding ecology of Liza ramada (Risso, 1810) (Pisces, Mugilidae) in a south-western estuary of Portugal. Estuar Coast Shelf Sci. 2003;57:313-323. [ Links ]
ANZOLA E. Contribución al conocimiento biológico del Blanquillo (Sorubim lima Bloch, 1801) [trabajo de pregrado]. Bogotá: Facultad de Biología Marina, Universidad Jorge Tadeo Lozano; 1977. [ Links ]
ARANHA JMR, GOMES JHC, FOGACA FNO. Feeding of two sympatric species of Characidium, C. lanei and C. pterostictum (Characidiinae) in a coastal stream of Atlantic forest (Southern Brazil). Braz Arch Biol Technol. 2000;43(5):527-531. [ Links ]
BREDER C, ROSEN D. Modes of reproduction in fishes. Neptune City: Tropical Fish Hobbyist Publications Inc; 1966. [ Links ]
BRUSLE J. Food and feeding in grey mullet. In: Oren OH, editor. Aquaculture of Grey mullet. Cambridge: Cambridge University Press; 1981. p. 185-217. [ Links ]
BUSTAMANTE ID. Los suelos de la cuenca del río Sinú y el Proyecto Urrá I. Temas Agrarios 2000;9:15-28. [ Links ]
CASTELLANO Y, ANGULO DJ. Biología reproductiva del Barbul de piedra (Ariopsis sp.) en el río Sinú, Colombia. [Trabajo de pregrado]. Lorica: Programa de Acuicultura, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba; 2011. [ Links ]
CERVIGÓN F. Los peces marinos de Venezuela. Vol I. Caracas: Fundación Científica Los Roques; 1991. [ Links ]
CERVIGÓN F, CIPRIANI R, FISCHER W, GARIBALDI L, HENDRICKX M, LEMUS AJ, et al., editores. Fichas FAO de identificación de especies para los fines de la pesca. Guía de campo de las especies comerciales marinas y de aguas salobres de la costa septentrional de Sur América. Roma: FAO; 1992. [ Links ]
CHAPARRO N, GAITÁN S, HERNÁNDEZ. Incubación, larvicultura y alevinaje del bagre estuarino Ariopsis bonillai (Miles, 1945) en cautiverio, Santa Marta, Caribe colombiano. Informe técnico. Santa Marta: Universidad del Magdalena-Colciencias; 2002. [ Links ]
DÍAZ G, SOTO LA. Hábitos alimenticios de peces depredadores del sistema lagunar Huizache-Caimanero, Sinaloa, México. An Inst Cienc del Mar y Limnol Univ Nal Auton México. 1988;15(1):97-123. [ Links ]
GALVIS O. Estimación del crecimiento y mortalidad del chivo cabezón Ariopsis bonillai (Miles, 1945) (Pisces: Siluriformes: Ariidae), en la ciénaga Grande de Santa Marta, Colombia. An Inst Inv Mar Punta Betín. 1984;14:67-83. [ Links ]
IDEAM. Base de datos. Barranquilla. 1998. [ Links ]
JÚLIO HF JR., CUNICO AM, GUBIANI EA, FERNANDES F, DIAS RM, DA GRAÇA WJ, et al. Ictiofauna. In: Agostinho AA, Thomaz SM, Rodrigues L, Gomes LC, editores. A planicie de inundação do Alto rio Paraná. Maringá: Núcleo de Pesquisas em Limnologia, Ictiologia e Aqüicultura-Nupelia, Universidade Estadual de Maringá; 2003. p. 77-99. [ Links ]
LAEVASTU T. Manual de métodos de biología pesquera. Zaragoza: Editorial Acribia; 1980. [ Links ]
LAGLER KF, BARDACH JE, MILLER RR, MAY-PASSINO DR. Ictiología. México DF: AGT; 1984. [ Links ]
LUGO RL. Determinación de hábitos, madurez sexual y desove en tres especies íctícas de la cuenca del río Tomo (Vichada) y consideraciones para el mantenimiento de los padrotes. Villavicencio: Universidad Tecnológica de los Llanos Orientales-IIOC n.° 2; 1989. [ Links ]
MARRERO C. Métodos para cuantificar contenidos estomacales en peces. Guanare: Museo de Zoología, Programa de Recursos Naturales Renovables, Vicerrectorado de Producción Agrícola, Universidad Nacional Experimental de los Llanos Ezequiel Zamora-Unellez; 1994. [ Links ]
MILES C. Some newly recorded fishes from the Magdalena river system. Caldasia 1945;3(15):453-464. [ Links ]
OLAYA-NIETO CW, TOBÍAS-ARIAS AJ, SEGURA-GUEVARA F, BRÚ-CORDERO SB, TORDECILLA-PETRO G. Modificación del índice de importancia relativa (IIR) de Yáñez-Arancibia, Curiel-Gómez y Leyton (1976). [Documento de trabajo]. Lorica: Laboratorio de Investigación Biológico Pesquera-LIBP, Departamento de Acuicultura, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba; 2003. [ Links ]
OLAYA-NIETO CW, SEGURA-GUEVARA FF, TORDECILLA-PETRO G, APPELDOORN RS. Estimación de los parámetros biológicos básicos de peces comerciales del río Sinú-Fase II. [Informe final]. Lorica: Laboratorio de Investigación Biológico Pesquera-LIBP, Programa de Acuicultura, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba; 2007. [ Links ]
PÉREZ-CHAPARRO L, AJIACO-MARTÍNEZ R, RAMÍREZ-GIL H. Aspectos biológicos de algunas especies de peces de interés ornamental en la baja Orinoquía colombiana: Pimelodus pictus Steindachner, 1876. En: Ramírez-Gil H, Ajiaco-Martínez RE, editores. La pesca en la baja Orinoquía colombiana: una visión integral. Bogotá: Instituto Nacional de Pesca y Acuicultura-INPA; 2001. p. 203-205. [ Links ]
PREJS A, COLOMINE G. Métodos para el estudio de los alimentos y las relaciones tróficas de los peces. Caracas: Universidad Central de Venezuela; 1981. [ Links ]
ROTTA MA. Aspectos gerais da fisiología e estructura do sistema digestivo dos peixes relacionados á piscicultura. Embrapa Pantanal Documentos. 2003;53:1-48. [ Links ]
SANTOS-ACEVEDO M, BLANCO J. Hábitos alimentarios de cuatro especies de peces de la Ciénaga Grande de Santa Marta y el complejo de Pajarales. En: Olaya-Nieto CW, Atencio-García VJ, editores. Montería: Memorias VII Simposio Colombiano de Ictiología; 2003. [ Links ]
SILVA M, STUARDO J. Alimentación y relaciones tróficas generales entre algunos peces demersales y el bentos de bahía Coliumo (Provincia de Concepción, Chile). Gayana Zool. 1985;49(3-4):77-102. [ Links ]
VEGA ME. Interacción trófica entre los bagres Arius melanopus (Agassiz, 1829) y Arius felis (Linnaeus, 1766) en las costas de Celestún, Yucatán, Mexico. An Inst Cienc del Mar y Limnol Univ Nal Auton Mexico. 1990;17(2):271-285. [ Links ]
WINDELL JT. Food analysis and rate of digestion. In: Ricker WE, editor. Methods for assessment of fish production in fresh waters. 2nd edition. Oxford: Blackwell Scientific Publications; 1971. p. 215-226. [ Links ]
WINDELL JT, BOWEN SH. Methods for study of fish diets based on analysis of stomach contents. In: Bagenal T, editor. Methods for assessment of fish production in fresh waters. 3rd edition. Oxford: Blackwell Scientific Publications; 1978. p. 219-226. [ Links ]
YÁÑEZ-ARANCIBIA A, CURIEL-GÓMEZ J, LEYTON V. Prospección biológica y ecología del bagre marino Galeichthys caerulescens (Günther) en el sistema lagunar costero de Guerrero, México (Pisces: Ariidae). An Centro Cienc del Mar y Limnol Univ Nal Autón México. 1976;3(1):125-180. [ Links ]
ZAVALA-CAMIN L. Introdução aos estudos sobre alimentação natural em peixes. Maringá: Editora da Universidade Estadual de Maringá-EDUEM; 1996. 128 [ Links ]