Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. v.17 n.1 Bogotá jan./abr. 2012
EVOLUCIÓN DE LA SOCIALIDAD, ESTRATEGIAS ALIMENTARIAS Y ANATOMÍA CRÁNEODENTAL EN LA SUBFAMILIA CANINAE
Evolution of Sociality, Diet, and Craniodental Anatomy in the Subfamly Caninae
JOAO MUÑOZ-DURÁN1, Ph. D.; JESUALDO ARTURO FUENTES1, M.Sc.
1 Departamento de Biología, Universidad Nacional de Colombia, Sede Bogotá. Carrera 30 # 45-03, Edificio 421, Oficina 221, Bogotá, D.C., Colombia. jvmunozd@unal.edu.co
Presentado 19 de mayo de 2011, aceptado 13 de diciembre de 2011, correcciones 15 de diciembre de 2011.
RESUMEN
Los carnívoros sociales afectan parámetros poblacionales, ecología, comportamiento, y probabilidades de especiación y extinción de presas y otros carnívoros simpátricos. Así, los carnívoros sociales pudieron influenciar la evolución de la estructura y organización de las comunidades ancestrales y modernas de mamíferos. Por tanto, es importante identificar qué especies de carnívoros fósiles pudieron ser sociales y establecer cuándo, dónde y bajo qué contexto ecológico evolucionaron. Para esto se requiere determinar si existe alguna asociación entre la variación en rasgos morfológicos, susceptibles de ser preservados en el registro fósil, y diferencias en niveles de socialidad en carnívoros actuales. El objetivo de este trabajo fue establecer si existe alguna asociación entre la variación de la conformación y propiedades mecánicas cráneodentales con diferencias en niveles de socialidad, hábitos alimentarios y sexo en cánidos modernos. Para esto utilizamos una muestra de 972 especímenes de 33 especies de cánidos. Los resultados indican que los cánidos sociales e hipercarnívoros presentan conformaciones y propiedades mecánicas que los diferencian del resto de especies de cánidos actuales, y que la variación morfológica de las regiones analizadas no está asociada con el sexo. Estos resultados sirven de base para determinar qué especies fósiles de la subfamilia Caniane pudieron ser sociales e hipercarnívoras. Los resultados también sugieren que la evolución de la sociabilidad está asociada con relaciones filogenéticas y depende de factores ecológicos, entre los últimos están abundancia de presas de gran tamaño y existencia de carnívoros simpátricos competidores.
Palabras clave: comportamiento social, hipercarnivoría, cánidos actuales, morfometría geométrica, morfometría tradicional.
ABSTRACT
Social carnivores affect population parameters, ecology, behavior and speciation and extinction rates of their prey and other sympatric carnivores. Therefore, social carnivores may have influenced the evolution of the structure and organization of ancestral and modern mammal communities. Thus, it is important to identify what extinct carnivore species may have been social and to determine when, where and under which environmental contexts they evolved. The first step is to establish if there is an association between morphological traits, susceptible of being preserved in the fossil record, and differences in the degree of sociality of present day carnivores. The aim of this research was to establish if there is an association between variation in shape and variables related to mechanical properties of the skulls, and differences in sociality level, diet and sex in modern canids. The sample included 972 specimens of 33 canid species. We analyzed the shape of the lateral side of the cranium, zygomatic arch, dentary bone and mandibular corpus, as well as 20 variables related to mechanical properties of the skull. Results suggest that hypercarnivorous social canids have shapes and mechanical properties that are different from other modern canids. We found that morphological variation is not affected by sex. Results may be used to identify extinct Caninae species that were social and hypercarnivorous. Results also suggest that the evolution of sociality is dependent on phylogenetic relationships and ecological context, particularly the abundance of large prey and the presence of sympatric carnivores.
Key words: Social behavior, hypercarnivory, extant canids, geometric morphometrics, traditional morphometrics.
INTRODUCCIÓN
Comparados con otros mamíferos, las especies de carnívoros sociales afectan notoriamente parámetros poblacionales, variables de historia de vida, patrones de uso del hábitat, ecología y comportamiento de una gran diversidad de especies en sus respectivas comunidades (Muñoz-Durán, 2009). Este efecto se evidencia en escalas de tiempo ecológico y, a largo plazo, influye sobre las probabilidades de especiación y extinción de sus presas y de otras especies de carnívoros (Maier, 2001; Muñoz-Durán, 2002; van Valkenburgh et al., 2003; Muñoz-Durán, 2009). Por tanto, la evolución de la socialidad en los carnívoros pudo ser un factor que moldeó la estructura y organización de comunidades ancestrales y modernas de mamíferos.
La evolución de los linajes de carnívoros sociales actuales está relacionada con la expansión de praderas y con el incremento en el comportamiento de manada de los ungulados durante el Mioceno tardío en Norteamérica (subfamilia Caninae) y Eurasia (Hyaenidae; Muñoz-Durán, 2002). La evidencia disponible sugiere que la socialidad en carnívoros modernos evolucionó como una estrategia para depredar sobre ungulados gregarios de gran tamaño y para mejorar las ventajas de competición intragremiales (MacDonald, 1983; Martin, 1989; Fanshawe y Fitzgobbon, 1993; Muñoz-Durán, 2002). Los beneficios que conlleva vivir en un grupo de animales que cooperan incluyen el cuidado y protección de juveniles y adultos incapacitados, la transferencia de información relevante mediante interacciones de enseñanza y aprendizaje, una mejor capacidad de defensa de recursos y del territorio, y colonización de ambientes adversos (MacDonald, 1983; Andersson, 1984; Avil, a; Maier, 2001; Muñoz-Durán, 2002; Muñoz-Durán, 2010). No obstante, los carnívoros sociales también son más propensos a procesos de extinción local debido al efecto combinado de la fuerte competencia intragremial, el efecto Allee y tamaños efectivos de población reducidos (Muñoz-Durán, 2002). Otros factores propuestos que pueden afectar negativamente las probabilidades de sobrevivencia de carnívoros sociales, pero que aún deben ser probados de manera formal, son la especialización trófica y posiblemente mayor probabilidad de dispersar enfermedades y parásitos (MacDonald, 1979; Courchamp et al., 1999; van Valkenburgh, 1999).
Entre carnívoros, los cánidos son un grupo adecuado para avanzar en el estudio de la evolución de la socialidad y los efectos macroevolutivos de este rasgo. Las especies actuales de cánidos sociales (subfamilia Caninae) se caracterizan por vivir en grupos numerosos de individuos que pueden o no estar emparentados. Entre éstos, se establece una jerarquía de dominancia estricta, en la que macho y hembra alfa monopolizan la actividad reproductiva y los individuos de menor rango permanecen en el grupo como ayudadores no reproductivos. Estas manadas o clanes ocupan territorios que son activamente defendidos y además cazan, alimentan y refugian en grupo. La socialidad es un rasgo común entre los cánidos actuales y posiblemente también lo fue en los linajes extintos (Muñoz-Durán, 2002).
La familia Canidae se originó durante el Eoceno medio y su historia se ha caracterizado por tres radiaciones sucesivas que dieron lugar a tres subfamilias: Hesperocyoninae, Borophaginae y Caninae (Wang, 1994; Tedford, 1995; Wang et al., 1999). En la evolución de cada una de las tres subfamilias de cánidos se observa una tendencia a la aparición tardía de especies de tamaño grande con adaptaciones para hipercarnivoría y durofagia (Munthe, 1998; Wang et al., 1999; van Valkenburgh et al., 2003). Se ha sugerido que esta tendencia evolutiva podría estar asociada con la evolución de altos niveles de socialidad en la familia Canidae (van Valkenburgh et al., 2003).
Las razones que sustentan la anterior afirmación derivan de la comparación de la anatomía y estrategias de cacería de félidos y cánidos hipercarnívoros. Los félidos poseen antebrazos largos, fuertes, flexibles y con garras recurvadas, afiladas y retráctiles, lo que les permite aferrarse y derribar a sus presas. Los félidos también poseen rostros cortos que les confieren ventajas mecánicas para la mordida y caninos redondeados que son utilizados para matar aplicando una única mordida profunda y contundente. Esto los capacita para la cacería de presas grandes en solitario y mediante estrategias de emboscada. En contraste, los cánidos poseen extremidades anteriores menos fuertes y con articulación radioulnar que no les permite supinar antebrazos. Además, los cánidos tienen garras romas, derechas y no retráctiles. Así, las extremidades de los cánidos resultan útiles en carreras prolongadas para perseguir presas, pero no para derribarlas y aferrarse a ellas (Gonyea y Ashworth, 1975; Bekoff et al., 1984; Wang, 1993; van Valkenburgh et al., 2003; Wang y Tedford, 2007; Polly, 2008; Slater et al., 2009). Los cánidos deben capturar, sostener y matar a sus presas utilizando únicamente las mandíbulas (Gonyea y Ashworth, 1975; Bekoff et al., 1984; Van Valkenburgh et al., 2003; Slater et al., 2009). En este aspecto los cánidos también presentan limitaciones comparados con los félidos, pues sus caninos angostos y comprimidos, y sus rostros alargados conllevan a ventajas mecánicas reducidas. Es por esto que los cánidos que depredan sobre vertebrados más grandes que ellos mismos (hipercarnívoros) cazan mediante persecuciones prolongadas y aplican múltiples mordidas desgarrantes (Radinsky, 1982; Bekoff et al., 1984; van Valkenburgh y Ruff, 1987; van Valkenburgh y Koepfli, 1993; Maier, 2001; van Valkenburgh et al., 2003). Sin duda, esta estrategia resulta más efectiva con el trabajo coordinado de un grupo que coopera. La variabilidad de estrategias alimentarias de los cánidos actuales puede ser evaluada a través de su morfología craneal, en esta región se concentra la mayoría de presiones selectivas relacionadas con la captura y procesamiento del alimento (Radinsky, 1981; Slater et al., 2009). Así, las especies hipercarnívoras deben presentar adaptaciones morfológicas que les permitan resistir estrés mecánico que sobre el cráneo y los dientes imponen la cacería de presas grandes. Entre estas adaptaciones morfológicas están las mandíbulas profundas, músculos masticadores anchos, incisivos y caninos alargados, molares con superficies de maceración reducidas y bordes cortantes relativamente largos en las muelas carniceras. De las relaciones supuestas entre socialidad e hipercarnivoría se han derivado tres estudios en los que se ha utilizado morfología craneal (van Valkenburgh y Koepfli, 1993), el tamaño corporal grande e inhabilidad de supinar el extremo distal de las extremidades anteriores (van Valkenburgh et al., 2003; Andersson, 2005) como indicadores de niveles de socialidad altos en cánidos actuales y extintos. Sin embargo, estos trabajos no han podido establecer una asociación directa entre características anatómicas y nivel de socialidad. Por un lado, el uso de rasgos cráneo-dentales para determinar hipercarnivoría y establecer el nivel de socialidad en cánidos extintos tiene una limitación importante: la dificultad de diferenciar entre cánidos sociales y especies solitarias con hábitos carroñeros (van Valkenburgh et al., 2003). Desde el punto de vista de la anatomía funcional estos dos grupos presentan adaptaciones similares en términos de la morfología cráneo-dental (van Valkenburgh et al., 2003). Por otro lado, la comparación de la anatomía cráneo-dental y la articulación del codo entre especies de cánidos pequeñas que se asumen no sociales y especies grandes supuestamente sociales arrojan resultados equívocos (Andersson, 2005). Esto se debe a la variación morfológica y ecológica observada al interior de la subfamilia Caninae. Dos especies rompen la regla entre la relación tamaño y socialidad: la primera es Chrysocyon brachyurus, una especie de gran tamaño y de extremidades con marcada elongación distal, que a la vez es solitaria y de hábitos omnívoros con fuerte tendencia a la insectivoría. La segunda es Speothos venaticus, una especie de tamaño mediano, con extremidades proporcionalmente más cortas de todos los cánidos actuales, pero que además es marcadamente social e hipercarnívora. van Valkenburgh et al., 2003, sugieren que las especies de carnívoros con capacidad de supinar sus extremidades anteriores, como lo hacen todos los felinos, no serían sociales porque tendrían mayor destreza y ventaja para sujetar y manipular presas, lo que suprime la necesidad de trabajo en grupo. Esta es otra generalización para la cual existen excepciones marcadas; entre ellas la existencia de félidos de gran tamaño, con capacidad de supinar sus extremidades anteriores y que además viven en grupos sociales (Pantera leo; Andersson, 2005).
Es de resaltar que en trabajos previos (van Valkenburgh y Koepfli, 1993; Andersson, 2005) no se incluyó un muestreo taxonómico completo de las especies de cánidos actuales. En particular, se excluyeron especies con rasgos morfológicos, ecológicos y comportamentales que podrían reducir la probabilidad de encontrar las asociaciones entre rasgos cráneodentales e hipercarnivoría sugeridos por van Valkenburgh y Koepfli, 1993. En estos trabajos no se menciona ninguna justificación para excluir a Canis simensis, Chrysocyon brachyurus y Speothos venaticus de los análisis. En los tres trabajos mencionados sobre el tema, otros sesgos se pudieron introducir debido al bajo número de individuos por taxón que se incluyeron en la muestra y que además no fueron separados por categorías de sexo o edad. En estas condiciones se asume, aunque no explícitamente, que no hay variabilidad al interior de las especies, que el dimorfismo sexual no juega un papel importante en la organización social de carnívoros y que el efecto de las alometrías observadas durante el desarrollo ontogenético no es importante. Estas son suposiciones que deben ser probadas. Dado lo anterior, se requiere una evaluación más rigurosa y exhaustiva de la asociación entre variabilidad morfológica y socialidad en cánidos modernos que sirva de punto de partida para la exploración de patrones macroevolutivos relacionados con la evolución de la socialidad. El objetivo de este trabajo es determinar si existe alguna asociación entre características de la anatomía cráneodental, niveles de socialidad y hábitos alimentarios en especies actuales de cánidos. También exploramos si la anterior asociación puede estar influenciada por el sexo. En este trabajo incluimos un muestreo taxonómico completo de la subfamilia Caninae, un tamaño de muestra notablemente mayor al empleado en trabajos anteriores y se consideró un número mayor de variables cráneodentales. Además, solo se incluyeron especímenes adultos.
MATERIALES Y MÉTODOS
MUESTRA
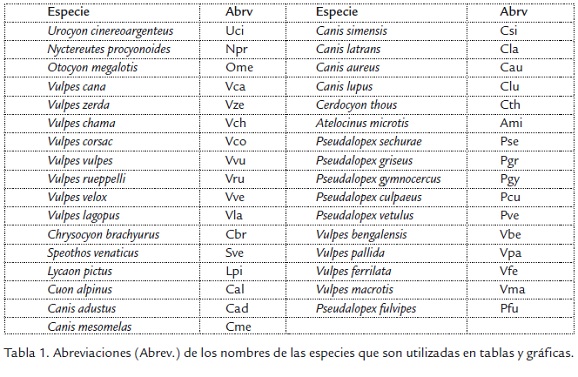
Los análisis de morfometría geométrica y tradicional se efectuaron sobre imágenes bidimensionales de la región lateral del cráneo y el dentario de 972 especímenes pertenecientes a 33 especies de cánidos actuales. La lista de especímenes analizados, incluyendo los números de colección y el museo donde se encuentran está a disposición de los interesados mediante solicitud a los autores. La lista de abreviaciones de los nombres de las especies incluidas en este análisis aparece en la Tabla 1.
Las fotografías fueron tomadas por un solo miembro del grupo de Ecología Evolutiva de la Universidad Nacional de Colombia, esto para evitar sesgos relacionados con imprecisiones entre observadores. Todas las fotografías fueron tomadas con una cámara Canon Rebel XTi instalada sobre un trípode y conectada a un computador, lo que permitió la obturación del lente de manera remota para evitar trepidación, descartar imágenes inadecuadas y repetir fotos subóptimas. Aunque se cuidó que la distancia focal se mantuviera cercana a 40 cm, se utilizó el zoom en ocasiones debido a que los cráneos tenían diferente tamaño, es decir, en todos los casos se intentó que el cráneo ocupara la mayor área posible de la fotografía. La cámara permaneció en un ángulo de tiro constante y los cráneos fueron alineados mediante el uso de una regleta cuadriculada.
Cada fotografía estuvo acompañada de una medida de referencia que fue utilizada para establecer la escala de la imagen. Estas medidas de referencia fueron estimadas directamente sobre las estructuras con un pie de rey digital con resolución de 0,01 mm. En las fotos también se incluyó una regleta, especialmente importante en especímenes en mal estado de preservación sobre los cuales no se podía tomar la medida de referencia. Las siguientes fueron las medidas de referencia para cada región anatómica estudiada: Lateral del cráneo. Altura del arco zigomático medida como la distancia máxima dorsoventral desde el borde dorsal sobre el punto de fusión entre el yugal y el escamoso, siguiendo una línea perpendicular hasta el borde ventral. La regleta fue ubicada a nivel del temporal. Dentario. Longitud antero-posterior máxima, medida entre la margen anterior del canino hasta el borde posterior del cóndilo mandibular. La regleta fue ubicada a nivel de la superficie de la cara expuesta del dentario.
DIGITALIZACIÓN DE LANDMARKS
Se seleccionaron varios puntos de referencia topológica o landmarks que fueron convertidos a coordenadas en un plano bidimensional con el programa tpsDig2 (Rohlf, 2006). Este programa también se utilizó para establecer la escala de las imágenes a partir de las medidas de referencia. Los landmarks se escogieron de tal manera que representaran estructuras homólogas desde el punto de vista biológico y que tuvieran significado funcional respecto de propiedades biomecánicas del cráneo. También se procuró que los landmarks cubrieran toda la estructura de la superficie lateral del cráneo y del dentario. Sin embargo, puesto que es posible que la variación entre diferentes grupos de organismos se concentre en regiones particulares de estas estructuras, también ensayamos conjuntos de landmarks que cubrían secciones particulares y relevantes desde el punto de vista funcional. De esta manera se analizaron dos conjuntos de landmarks para la vista lateral del cráneo, uno que representa la conformación general de la región lateral (Lateral 1) y otro que da información sobre la conformación del arco zigomático (Lateral 2). Para el dentario también examinamos dos grupos de landmarks: uno que representa la estructura global del dentario (Dentario 1) y otro que refleja la conformación del corpus mandibular (Dentario 2; Figura 1A).
En este análisis se procuró usar tantos landmarks tipo I como fuera posible. No obstante, la cantidad de este tipo de estructuras en los cráneos es limitada y fue necesario recurrir a landmarks tipo II y tipo III, que son menos rigurosos y por ende pueden añadir más variación (van der Molen et al., 2007). Para evaluar el impacto de esta variación se hicieron exploraciones en la vista lateral, tratando algunos de estos puntos como semilandmarks. Con esta aproximación, el punto marcado como semi-landmark se desplaza sobre una tangente definida por otros dos puntos de referencia (que deben ser landmarks tipo I) para capturar algo de la variabilidad del punto, rescatando en cierta medida su homología posicional. En el análisis Lateral 1, el punto 5 fue marcado como semi-landmark, empleando como referencia los puntos 3 y 4; en el análisis Lateral 2 los puntos 11 y 6 fueron marcados como semi-landmarks, empleando como referencia los puntos 7 y 10 para el 11, y los puntos 4 y 7 para el 6. La comparación de matrices conformacionales de landmarks y semi-landmarks se llevó a cabo mediante inspección gráfica de los análisis de deformaciones relativas, llevados a cabo con PAST.
La matriz de coordenadas crudas resultante de la digitalización de landmarks fue procesada mediante análisis generalizado de Procrustes (GPA) utilizando el programa tpsRelw (Rohlf, 2007). El resultado de este procedimiento es una matriz de variables de tamaño y conformación. Las últimas fueron utilizadas para los análisis morfológicos posteriores.
ANÁLISIS DE REPRODUCIBILIDAD Y PRUEBA DE SUPUESTOS
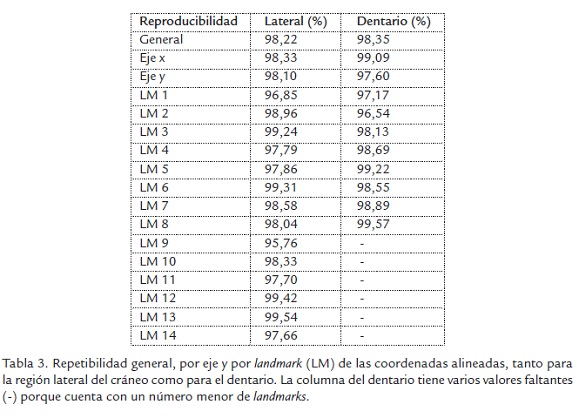
Con el objeto de estimar el grado de precisión con el que fueron digitalizados los landmarks se realizaron pruebas de reproducibilidad. Para esto se seleccionó una submuestra aleatoria de 50 individuos para cada región del cráneo y se hizo un reposicionamiento de todos los landmarks con los mismos criterios utilizados en la digitalización original. De esta manera se obtuvieron matrices de coordenadas para los landmarks originalmente asignados y también para los reposicionados. Estas matrices fueron transformadas y concatenadas con el programa TET (Dujardin, 2002c). Se corrió un GPA sobre los archivos ensamblados, lo que permitió hacer una exploración gráfica de reproducibilidad tanto para las coordenadas alineadas como para las variables de tamaño. Los archivos de coordenadas alineadas obtenidos con MOG fueron procesados con el programa VAR (Dujardin, 2003) con el que se realizaron las pruebas de reproducibilidad. La prueba se consideró aprobada cuando la reprodicibilidad era mayor a 90%.
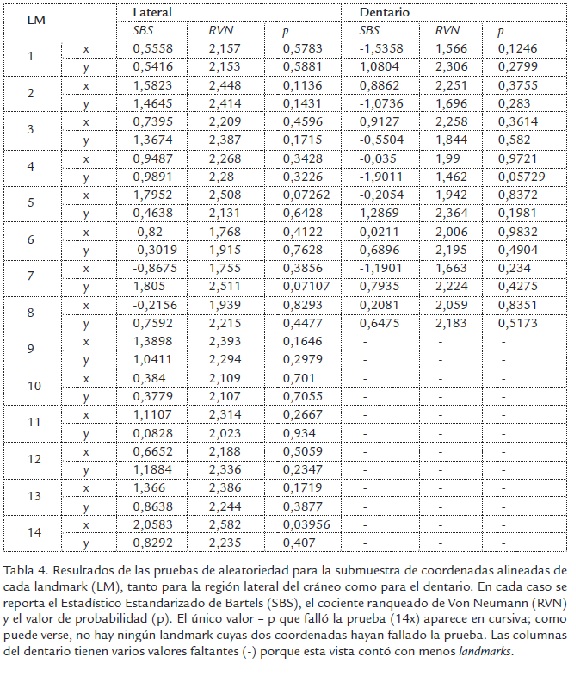
La reproducibilidad es prueba suficiente de que los datos pueden ser utilizados en análisis morfogeométricos posteriores, no obstante, dado que el procedimiento exige una submuestra aleatoria y que varias pruebas estadísticas parten del supuesto de aleatoriedad, se corrieron pruebas de Bartels para los componentes de cada eje en las coordenadas alineadas. Para esto se utilizó el paquete Lawstat (Noguchi et al., 2009) para el programa R (R DevelopmentCoreTeam, 2009).
ANÁLISIS DE LA CONFORMACIÓN
Se hicieron análisis de deformaciones relativas sobre las matrices de pesos transformadas que contienen la información sobre los componentes uniformes y no-uniformes de la conformación. Este análisis se efectuó sobre los consensos de cada especie utilizando el programa BAC (Dujardin, 2002a) y no sobre los 972 especímenes de la muestra porque es difícil detectar patrones en las nubes densas de puntos resultantes. En cada análisis de este tipo se aplicaron 1000 iteraciones de Bootstrap cuyos resultados fueron presentados en el primer componente principal, para dar mayor soporte a la distribución de los datos en la ordenación. La evaluación gráfica en las rejillas de conformación y la comparación de taxones con diferentes niveles de socialidad y hábitos alimentarios se hicieron con el programa tpsRelw (Rohlf, 2007).
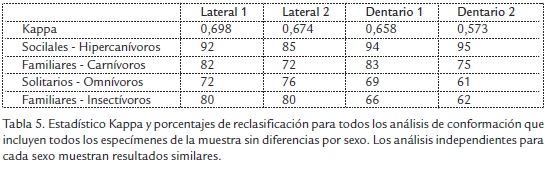
Se hizo un análisis discriminante basado en distancias de Mahalanobis. La significancia estadística fue computada por medio de pruebas de permutación no paramétricas. En cada análisis se utilizaron 1000 permutaciones para probar si las distancias de Mahalanobis de los grupos reconocidos en los análisis de deformaciones relativas eran producto del azar. Las comparaciones fueron corregidas por Bonferroni. Estas distancias fueron usadas para construir dendrogramas mediante el algoritmo UPGMA, reflejando las similitudes de las estrategias alimentarias en términos de la conformación craneal. También se hicieron análisis de reclasificación mediante chequeo de clasificación cruzado sobre todos los especímenes (no los consensos) utilizando el módulo PAD (Dujardin, 2002b) del programa CLIC (versión 35), que a su vez incorpora al programa PHYLIP (Felsenstein, 2005) para la construcción de los dendrogramas. La solidez de las clasificaciones propuestas fue contrastada con las reclasificaciones mediante el estadístico Kappa, haciendo uso del paquete irr (Gamer et al., 2009) para el programa R (R Development CoreTeam, 2009). El estadístico Kappa fue interpretado a partir de una escala de valoración estándar (Landis y Koch, 1977).
MORFOMETRÍA TRADICIONAL
Se recalcularon los índices utilizados por van Valkenburgh et al., 2003, pero utilizando una tamaño de muestra marcadamente mayor al utilizado por estos autores y que incluyó datos para todos los 972 especímenes en la muestra y las 33 especies. Adicionalmente incluimos cuatro índices que reflejan propiedades mecánicas cráneo-dentales. La descripción de estos índices, la información correspondiente al tamaño de la muestra y los valores de los índices para las especies incluidas en el análisis se muestra en la Tabla 2. Los índices y las variables sobre las cuales estos fueron calculados fueron revisados para todos los especímenes en cada especie utilizando diagramas de cajas y de tallos-y-hojas con el fin de identificar datos atípicos. La normalidad se probó mediante la prueba de Shapiro-Wilk y la igualdad de varianzas con la prueba de Levene. Dado el elevado tamaño de la muestra para la gran mayoría de especies, y para evitar que valores extremos en las colas de distribución de los datos pudieran afectar la estimación de los promedios, se calcularon promedios podados a 5%. Las propiedades mecánicas de cánidos con diferentes niveles de socialidad y hábitos alimentarios fueron comparadas mediante un análisis componentes principales. Estos análisis estadísticos se hicieron utilizando el programa SPSS versión 15 (SPSS, 2006).
RESULTADOS ANÁLISIS DE REPRODUCIBILIDAD Y PRUEBA DE SUPUESTOS
Los resultados de las pruebas de reproducibilidad aparecen en la Tabla 3. El menor porcentaje de reproducibilidad fue de 95,70% para el landmark 9 de la región lateral del cráneo. Lo anterior indica que los landmarks fueron digitalizados con un elevado nivel de precisión. Esta conclusión también es apoyada por el alto nivel de superposición que se observa (Figura 1B) entre los contornos de los consensos para la muestra original y la remuestreada para las dos estructuras analizadas. Las pruebas de aleatoriedad también indican que las submuestras de coordenadas alineadas fueron extraídas de manera aleatoria (Tabla 4).
ANÁLISIS DE CONFORMACIÓN
Las exploraciones con semi-landmarks no reportaron mejoras considerables en los análisis de deformaciones relativas de las combinaciones de puntos anatómicos en la región lateral del cráneo. En términos generales la aproximación con landmarks tradicionales ofreció mejor estructuración de los datos en términos de los grupos comparados y, como cabe esperar, los semi-landmarks presentaron mayor dispersión -los resultados de la comparación no se muestran pero están disponibles mediante solicitud a los autores. Debido a que este incremento en la variabilidad de los datos no representó ganancias considerables en la estructura de las agrupaciones, los análisis subsiguientes se concentraron sobre las matrices derivadas de landmarks tradicionales.El tamaño de la muestra (33 especies) para los análisis de conformación fue suficiente,porque para los análisis más exigentes que incluían 7 landmarks (Lateral 1 y Dentario 1) el requerimiento mínimo fue de 28 puntos de comparación.
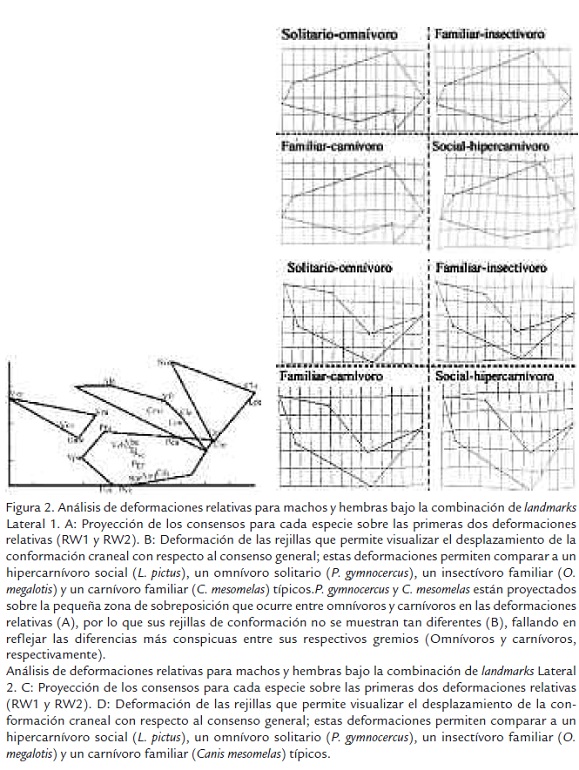
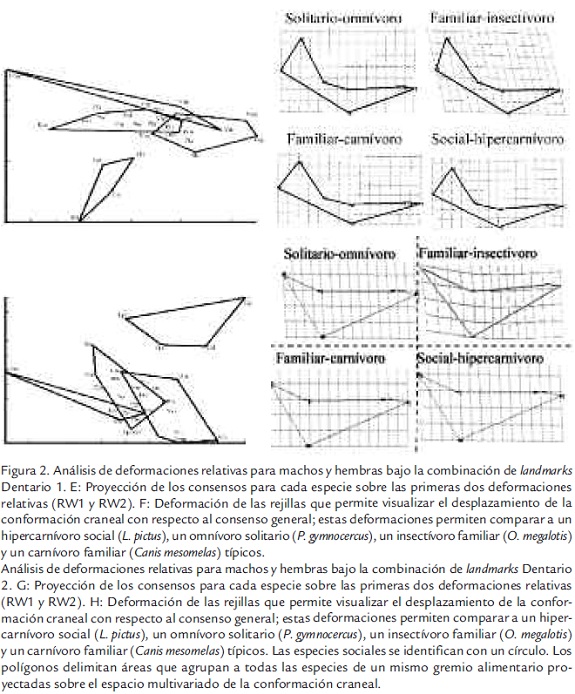
La conformación global de la región lateral del cráneo (Lateral 1) presenta buena correspondencia con hábitos alimentarios, aunque las conformaciones de algunas especies omnívoras y carnívoras tienden a sobreponerse (Figura 2A). Se observa que no existe una conformación característica para las especies sociales. Es así como las conformaciones de Lycaon pictus (Lpi), Cuon alpinus (Cal), Speothos venaticus (Sve), y Canis lupus (Clu) corresponden a conformaciones hipercanívoras, mientras que la conformación de Canis simensis se ubica a un extremo y en la región de superposición entre las conformaciones carnívoras y omnívoras. También se observa (Figura 2B) que las conformaciones hipercarnívoras son Especie N RDiastL DiastDp RBLDiast RBL m1BS IXp4 IXm2 MAT MAM HMFRD RUGA P4P I2 I3 RCrWZa C1C1 RRWPal PWPal DIA c1 las que más se diferenciaron del resto, y tienden a ser más acortadas, con rostros robustos y tendencias de ensanchamiento hacia el arco zigomático. En contraste los insectívoros tienden a comprimir esta región del arco zigomático, los omnívoros a elongarla y los carnívoros a ensanchar levemente la robustez del rostro.
La conformación del arco zigomático (Lateral 2) se corresponde con hábitos dietarios de las especies, aunque con unas pocas, pero interesantes excepciones (Figura 2C). Los resultados indican que las especies hipercarnívoras muestran arcos zigomáticos más robustos y compactos, seguidas de las carnívoras y las omnívoras. Las especies insectívoras tienden a presentar un arco zigomático comprimido y delgado (Figura 2D). En este análisis, al igual que el correspondiente a la conformación global de la región lateral del cráneo, se observa que no existe una conformación característica para las especies sociales. Las conformaciones de L. pictus (Lpi), C. alpinus (Cal), S. venaticus (Sve), y C. lupus (Clu) corresponden a conformaciones hipercanívoras. C. simensis, a pesar de ser considerada social y carnívora, exhibe un arco zigomático relativamente débil, cuya conformación se agrupa con la de las especies omnívoras. Es de resaltar que Chrysocyon brachyururs, una especie que vive en grupos familiares pequeños, forrajea en solitario y es considerada omnívora, presenta una conformación del arco zigomático que es más robusta de lo esperado, agrupándose con especies hipercarnívoras y mostrando alto grado de semejanza con la conformación observada en C. alpinus.
Los dos análisis de conformación del dentario también muestran correspondencia con hábitos alimentarios, donde las especies sociales, a excepción de C. simensis presentan conformaciones hipercarnívoras (Figura 2E; Figura 2G). Se observa que los dentarios de las especies sociales e hipercarnívoras son los más robustos. Como se puede observar en las rejillas de deformación (Figura 2F; Figura 2H), estas especies poseen dentarios cortos en el sentido antero-posterior y con un corpus mandibular marcadamente profundo. Estos atributos son menos desarrollados en las especies que viven en solitario o en grupos familiares pequeños y que tienen hábitos carnívoros u omnívoros. Incluso se observa que existen coincidencias entre la conformación general del dentario de los cánidos sur americanos Pseudalopex culpaeus, Pseudalopex griseus y Pseudalopex fulvipes, que son familiares y omnívoros, y la de los chacales africanos Canis aureus y Canis mesomelas considerados familiares pero carnívoros (Figura 2E). La conformación del corpus mandibular también es semejante entre los cánidos suramericanos C. brachyurus, P. culpaeus y P. fulvipes, todos ellos familiares y omnívoros, y la observada en Canis latrans y C. mesomelas, clasificados como familiares y carnívoros.
Las especies insectívoras presentan las conformaciones más delicadas, con dentarios alargados anteroposteriormente y corpus mandibulares poco profundos (Figura 2F; Figura 2H). Sin embargo llama la atención que Vulpes rueppelli presenta un dentario cuya conformación se agrupa con la de especies carnívoras y que Otocyon megalotis presenta la conformación del dentario más extrema.
Análisis de deformaciones relativas para machos y hembras bajo la combinación de landmarks Lateral 2. C: Proyección de los consensos para cada especie sobre las primeras dos deformaciones relativas (RW1 y RW2). D: Deformación de las rejillas que permite visualizar el desplazamiento de la conformación craneal con respecto al consenso general; estas deformaciones permiten comparar a un hipercarnívoro social (L. pictus), un omnívoro solitario (P. gymnocercus), un insectívoro familiar (O. megalotis) y un carnívoro familiar (Canis mesomelas) típicos.
Análisis de deformaciones relativas para machos y hembras bajo la combinación de landmarks Dentario 2. G: Proyección de los consensos para cada especie sobre las primeras dos deformaciones relativas (RW1 y RW2). H: Deformación de las rejillas que permite visualizar el desplazamiento de la conformación craneal con respecto al consenso general; estas deformaciones permiten comparar a un hipercarnívoro social (L. pictus), un omnívoro solitario (P. gymnocercus), un insectívoro familiar (O. megalotis) y un carnívoro familiar (Canis mesomelas) típicos. Las especies sociales se identifican con un círculo. Los polígonos delimitan áreas que agrupan a todas las especies de un mismo gremio alimentario proyectadas sobre el espacio multivariado de la conformación craneal.
Las diferencias en la conformación sugeridas por los análisis exploratorios, para las cuatro regiones del cráneo estudiadas, fueron corroboradas por los resultados de los análisis clasificatorios aplicados sobre todos los especímenes de la muestra (Tabla 5). Los resultados fueron similares cuando se analizaron machos y hembras por separado. Las distancias de Mahalanobis permutadas muestran que las agrupaciones de cánidos por nivel de socialidad y hábito alimentario tienen conformaciones de la región lateral del cráneo que son significativamente diferentes (p<0,0001, para todos las comparaciones entre grupos de socialidad y gremio alimentario, para las cuatro regiones del cráneo, para los análisis de todos los especímenes agrupados y, para machos y hembras considerados de manera independiente). Los resultados del chequeo cruzado tuvieron un acuerdo sustancial con los anteriores resultados en todos los casos (ver valores del estadístico Kappa, Tabla 5). Estos resultados sugieren que las diferencias entre la conformación global de la región lateral del cráneo, del arco zigomático, el dentario y el corpus madibular, para las cuatro agrupaciones por nivel de socialidad y gremios alimentarios, son más fuertes de lo que se esperaría por efecto del azar. Canis simensis es la única especie que sistemáticamente tiende a quedar reclasificada morfológicamente como omnívora, a pesar de que sus hábitos alimentarios son carnívoros. Por ejemplo, para las regiones lateral del cráneo y del arco zigomático, esta especie quedó reclasificada como omnívora con una frecuencia de 77% y 54% respectivamente.
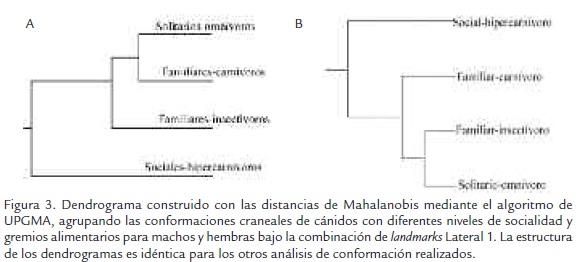
Las distancias de Mahalanobis indican que las conformaciones de las especies sociales e hipercarnívoras son las más distintas entre los cánidos actuales. También se observa que las conformaciones craneales de las especies familiares-carnívoras y solitarias-omnívoras son las más parecidas para la región lateral del cráneo (Figura 3A). Para el dentario las conformaciones más parecidas son las de los solitarios-omnívoros y familaresinsectívoros (Figura 3B).
Los resultados indican que el sexo no afecta la variación conformacional de las regiones estudiadas del cráneo. Los análisis independientes para los dos sexos muestran los mismos patrones de conformación para especies sociales y gremios alimenticios que los obtenidos con ambos sexos estudiados de manera conjunta. Lo anterior aplica para los análisis de deformaciones relativas sobre los consensos por especie, así como para los análisis de clasificación, chequeo cruzado y agrupación realizados sobre todos los especímenes en cada categoría de sexo. Las gráficas y tablas correspondientes no se incluyen, pero pueden ser solicitadas a los autores.
MORFOMETRÍA TRADICIONAL
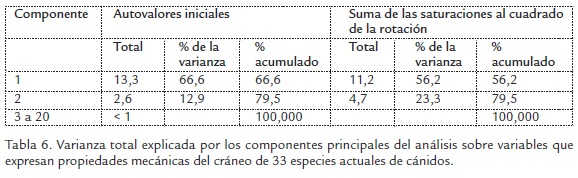
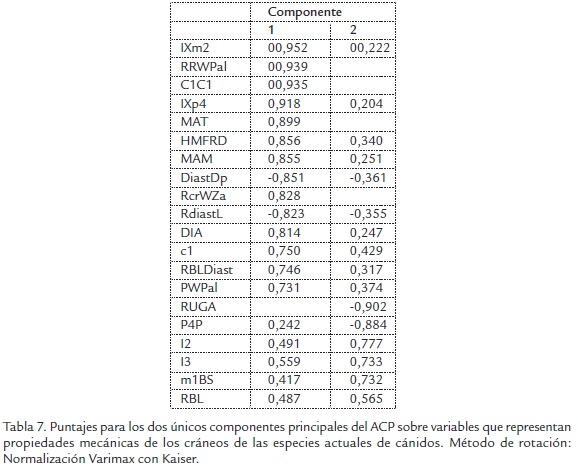
La Figura 4 muestra la distribución de las especies a lo largo de los ejes de los dos primeros componentes principales resultantes del análisis de las variables que expresan atributos mecánicos del cráneo de las especies actuales de cánidos. Estos dos componentes principales tienen Eigen values (Autovalores) mayores a 1 y explican el 79,5% de la variación total después de la rotación mediante normalización varimax con Kaiser (Tabla 6). El resto de componentes (del 3 al 20) tienen Eigen values menores a 1. La Tabla 7 muestra el nivel de asociación de las variables originales con cada uno de estos componentes.
Los resultados muestran que las especies de cánidos sociales e hipercarnívos que se caracterizan por poseer un talón cortante (L. pictus, C. alpinus y S. venaticus) ocupan una posición extrema en la sección positiva del eje del primer componente principal. Comparados con el resto de especies de cánidos actuales, estas tres especies presentan mayor resistencia al doblamiento en las regiones localizadas entre tercero y cuarto premolar, y entre el primero y segundo molar. Estas especies también exhiben un diastema relativamente corto comparado con la profundidad del dentario, lo que también evidencia una mayor resistencia del dentario al estrés mecánico producido durante la mordida. El diastema en estas especies también es relativamente corto con respecto a la longitud del dentario, lo que disminuye la distancia entre el punto en el que se ejerce la fuerza de mordida y la articulación de la mandíbula con el cráneo. El resultado de este rasgo anatómico es el incremento en la fuerza de mordida a nivel de los caninos inferiores, por tanto una mayor eficiencia en la sujeción y perforación de tejidos blandos de las presas. Este atributo mecánico que confiere ventajas durante la cacería se ve aún más acentuado dado al tamaño relativamente grande del canino inferior. Adicionalmente, estas tres especies presentan ventajas mecánicas superiores para los músculos masetero y temporal, lo que redunda en una mayor fuerza de mordida. Con respecto a las propiedades mecánicas del cráneo estas tres especies muestran rostros y cráneos relativamente más anchos, lo que indica un potencial para ejercer mayores presiones de mordida y músculos temporales más voluminosos y por tanto más fuertes.
Los resultados de ACP indican que C. lupus presenta una tendencia menos acentuada respecto de las propiedades mecánicas observadas en los cráneos de L. pictus, C. alpinus y S. venaticus y se ubica en una posición intermedia entre las especies sociales e hipercarnívoras y las que viven en grupos familiares pequeños y poseen dieta carnívora. Sin embargo, C. lupus presenta una tendencia más pronunciada en el eje positivo del segundo componente principal. Esto indica que la evolución de la hipercarnivoría en este linaje operó sobre rasgos diferentes a los de las demás especies sociales e hipercarnívoras. Comparado con el resto de cánidos, el lobo gris presenta menor superficie de maceración en su dentición superior, un cuarto premolar que es más estrecho y largo, segundo y tercer incisivos superiores más grandes y una cuchilla cortante más larga en el primer molar inferior. Así, aunque la fuerza de mordida y la resistencia del dentario y cráneo de C. lupus es inferior a la de los demás cánidos sociales e hipercarnívoros, esta especie presenta las adaptaciones más desarrolladas para cortar tejidos blandos y sostener presas con los incisivos entre todos los cánidos actuales. Otocyon megalotis, una especie que vive en grupos familiares pequeños y de hábitos insectívoros, y Pseudalopex fulvipes, una especie solitaria y omnívora, presentan rasgos cráneodentales opuestos a los descritos para C. lupus.
La especie social restante, pero que exhibe hábitos carnívoros y no hipercarnívoros, C. simensis, muestra una ubicación sobre la sección negativa del primer componente principal. Aunque el valor para este componente no es marcadamente alto, se puede decir que esta especie presenta un dentario relativamente frágil y capacidades mecánicas reducidas para depredar sobre presas de gran tamaño.
DISCUSIÓN
Los resultados de los análisis de morfometría geométrica y tradicional son concordantes y complementarios. Estos resultados indican que existe una relación estrecha entre las conformaciones de la región lateral del cráneo, el arco zigomático, el dentario (vista general), el corpus de la mandíbula y las propiedades mecánicas cráneodentales con las categorías de socialidad y gremio alimentario en la subfamilia Caninae. Esta asociación es más estrecha de lo que se esperaría por efecto del azar como lo demuestran análisis en los que se introduce una corrección de tipo filogenético (Fuentes y Muñoz-Durán, observaciones no publicadas). Las especies de cánidos actuales que viven en grupos sociales y que poseen hábitos alimentarios hipercarnívoros presentan cráneos cortos y compactos. Esto se relaciona con reducciones de la dentadura postcarnasial, diastemas reducidos y premolares que se apiñan, lo que es ventajoso para cazadores de presas grandes pues los caninos quedan más cerca de la articulación mandibular, reduciendo la longitud de la palanca externa e incrementando la ventaja mecánica de los músculos oclusores de la mandíbula. Estas especies además poseen conformaciones robustas de la mandíbula y arco zigomático, y rostros altos. Tales características conformacionales son reforzadas por la presencia de rostros y cráneos anchos, mandíbulas profundas y con sección transversal gruesa. Estos atributos le confieren mayor resistencia a estrés mecánico que se produce durante la sujeción y mordida de presas grandes. Los rostros anchos y altos permiten mayor desarrollo de los turbinales maxilonasales y, por tanto, mayor eficiencia en la refrigeración de la sangre que irriga el cerebro, lo que se relaciona con las demandas metabólicas que impone la persecución prolongada de presas (Wang y Tedford, 2007). Adicionalmente estas especies poseen rasgos que les permiten perforar, rasgar y cortar músculos y otros tejidos blandos de manera más eficiente, comparadas con otros cánidos actuales. Así, al interior de la subfamilia Caninae, las especies de cánidos sociales e hipercarnívoros se diferencian por presentar rasgos cráneodentales que les confieren mayores ventajas mecánicas para sostener, derribar y procesar presas de gran tamaño, las cuales cazan de manera cooperativa, mediante la aplicación de numerosas mordidas y sin la intervención de las extremidades anteriores para otras funciones diferentes a las de proporcionar tracción.
Los rasgos anatómicos sobre los que se basan las anteriores conclusiones son susceptibles de ser conservados durante los procesos de fosilización. Por tanto, los resultados de este análisis sugieren que es posible identificar especies extintas pertenecientes a la subfamilia Caniane que pudieran haber sido sociales e hipercarnívoras. Estas especies podrían presentar rasgos craneodentales hipercarnívoros semejantes a los observados en L. pictus, S. venaticus, C. alpinus y C. lupus. La inferencia podría ser hecha mediante el uso de análisis discriminantes sobre las matrices de datos de deformaciones parciales o relativas de cualquiera de las regiones del cráneo analizadas. Estos análisis también pueden ser hechos sobre los componentes principales derivados de la matriz de variables de mecánica cráneodental, dependiendo del estado de conservación y número de variables que puedan ser medidas en los especímenes fósiles.
Los resultados también sugieren que la diversidad de especies sociales en el registro fósil de los Caninae podría ser subestimada, porque no es posible identificar especies sociales mesocarnívoras, como C. simensis, pues estas no tendrían rasgos anatómicos distintivos. Como indican los resultados, las conformaciones carnívoras y omnívoras fueron muy semejantes, con hocicos alargados, arcos zigomáticos levemente ensanchados y mandíbulas moderadamente robustas. Esto se corresponde con la presencia de diastemas largos y premolares pequeños y dispersos sobre la región anterior del dentario. Estas especies también poseen propiedades mecánicas cráneodentales muy semejantes que les confieren una capacidad reducida de generar fuerza para la mordida, pero les permite contar con mayor velocidad para la oclusión mandibular. Esta adaptación es ventajosa para depredadores que cazan presas pequeñas de locomoción rápida (Slater et al., 2009). Así, los cráneos de las especies carnívoras y omnívoras extintas de la subfamilia Caninae, independientemente de su nivel de socialidad, no podrían ser diferenciados bajo esta aproximación.
Por otro lado, es probable que la diversidad de especies sociales e hipercarnívoras al interior de la subfamilia Caninae nunca haya sido muy alta en las comunidades ancestrales de mamíferos. El registro fósil más antiguo para esta subfamilia se remonta al Oligoceno temprano (34 millones de años (ma) aproximadamente; Tedford et al., 2009). Desde su origen y hasta el Mioceno medio (Barstoviano temprano, 15 ma aproximadamente) esta subfamilia coexistió en Norte América con cánidos de las subfamilia Hesperocyoninae (Tedford et al., 2009). La convivencia con cánidos de la subfamilia Borophaginae en ese continente se extendió por un período aún mayor, hasta finales del Pleistoceno (Tedford et al., 2009). Durante un período de tiempo de aproximadamente 29 ma, desde su origen hasta finales del Plioceno, la diversidad de especies de la subfamilia Caninae permaneció en niveles relativamente bajos. Lo anterior pudo ser el resultado de un proceso de supresión competitiva ejercido por linajes simpátricos físicamente superiores, no solo pertenecientes a las otras dos subfamilias de cánidos, sino a otros grupos de carnívoros como Nimravidae, Hyanenidae y Felidae. Incluso durante el Pleistoceno y el Holoceno, después de la extinción de muchos linajes de carnívoros competidores, la diversidad de especies sociales e hipercarnívoras al interior de los Caninae es reducida. La distribución geográfica actual de este grupo muestra que solo existe una especie de cánido hipercarnívoro en cada comunidad de mamíferos: C. lupuses holártico, L. pictus africano, S. venaticuses suramericano y C. alpinus asiático. En el presente ninguna de estas especies coexiste, exceptuando una leve superposición entre el lobo gris C. lupusy C. alpinus en Asia. Esto puede ser el resultado de competición intragremial intensa que limita el número de grandes hipercarnívoros sociales en comunidades de mamíferos (Palomares y Caro, 1999; van Valkenburgh, 2001; Muñoz-Durán, 2002; Wang et al., 2004).
Los resultados también indican que la socialidad y las adaptaciones hipercarnívoras en la subfamilia Caninae pudieron evolucionar por múltiples vías, dependiendo del contexto ecológico, las relaciones evolutivas entre los linajes y la variabilidad fenotípica disponible. Los resultados observados para C. simensis son particularmente significativos desde el punto de vista ecológico y evolutivo. Esta es la única especie de cánido moderna que siendo social no es hipercarnívora. Más aún, es la única especie en este estudio cuya conformación craneal fue sistemáticamente agrupada en un gremio alimentario que no corresponde con sus preferencias tróficas de tipo carnívoro. En los análisis exploratorios y clasificatorios C. simensis quedó reclasificada como omnívora. La explicación de esta observación podría residir en la reducida área de distribución geográfica actual e histórica de esta especie, así como a la escasa disponibilidad de presas de gran tamaño en esta área. C. simensis es un depredador que se encuentra confinado a las tierras altas de Etiopía, usualmente por encima de 3000 msnm, donde se alimenta fundamentalmente de roedores, y ocasionalmente caza de manera cooperativa corderos y antílopes juveniles (Moehlman y Hofer, 1997; MacDonald et al., 2004; Sillero-Zubiri, 2004). La abundancia de presas pequeñas puede generar condiciones que estimulan la evolución de socialidad (Bekoff et al., 1984; MacDonald et al., 2004), y con ella la aparición de preferencias carnívoras se hace más probable. Sin embargo, una dieta basada primordialmente en roedores no genera suficientes presiones de selección para el desarrollo de rasgos cráneodentales como los observados en otras especies carnívoras y oportunistas como por ejemplo chacales (C. mesomelas, C. aureus y C. adustus) o coyotes (C. latrans); mucho menos como las que poseen las cuatro especies hipercarnívoras. Por tanto, dado el contexto ecológico en el que ha evolucionado C. simensis, esta especie puede preservar características morfológicas omnívoras sin que esto afecte sus preferencias tróficas carnívoras o su estilo de vida grupal.
Otro ejemplo del efecto de las condiciones y oportunidades ecológicas en las cuales puede evolucionar la socialidad lo ilustra el caso del coyote, C. latrans. Aunque esta especie vive en grupos familiares, también presenta una estructura social que es bastante flexible, y que puede variar de una población a otra y a lo largo de la vida de los individuos, desde una condición solitaria y nómada, pasando por grupos familiares, hasta la formación de grupos y clanes (Fox, 1975; Moehlman, 1986; Allen et al., 1987; Berta, 1987; Bowyer, 1987; Sheldom, 1992; Geffen et al., 1996; Gese et al., 1996; Gese y Ruff, 1997; Nowak, 1999; Peyton, 1999; Wilson y Ruff, 1999; Gese y Bekoff, 2004). Curiosamente, los análisis de morfometría geométrica revelaron tendencias conformacionales hipercarnívoras en el coyote. Una tendencia semejante se observa en los resultados de morfometría tradicional, en los que el coyote aparece con valores ligeramente altos en el eje positivo del componente principal 2, ubicándose en un espacio de adaptaciones similar al exhibido por el lobo gris (C. lupus). Lo anterior sugiere que el coyote, potencialmente, podría presentar hábitos cooperativos y preferencias carnívoras más conspicuas. La distribución geográfica histórica de coyotes presenta superposición con la distribución del lobo gris. Esto indica que, además de su cercanía filogenética, la evolución de estos dos linajes podría estar mediada por su interacción. Entre las especies de carnívoros simpátricos se establece una jerarquía de dominancia basada en diferencias de tamaño corporal y grupal, donde las especies sociales de mayor tamaño son dominantes (Eaton, 1979; Palomares y Caro, 1999; van Valkenburgh, 2001; Muñoz-Durán, 2002). Este patrón de competición al interior del gremio de carnívoros es común a lo largo de un amplio rango de hábitats (Palomares y Caro, 1999; van Valkenburgh, 2001). Dado esto, es probable que un patrón de competición semejante haya caracterizado las interacciones de competición entre poblaciones ancestrales de carnívoros modernos (van Valkenburgh, 2001). Así, los coyotes pudieron haber sido excluidos del nicho hipercarnívoro debido a efectos de competición con el lobo gris, una especie social de mayor tamaño.
La correspondencia observada entre socialidad e hipercarnivoría en Caninae también está influenciada por la historia de relaciones de tipo evolutivo. Aunque se ha discutido que el talón cortante de L. pictus, S. venaticus y C. alpinuses el resultado de una convergencia funcional (van Valkenburgh, 1999), las numerosas y diversas semejanzas en la conformación y propiedades mecánicas craneodentales entre estas tres especies abren la posibilidad de que hayan podido derivar de un ancestro común. Esta posibilidad tiene soporte en la topología de cladogramas más parsimonisos resultantes de análisis combinado de datos morfológicos y moleculares (Muñoz-Durán, 2011) y de la combinación de datos morfológicos, comportamentales, ecológicos, de historia de vida, cariológicos y de nueve secuencias moleculares (Fuentes y Muñoz-Durán, observaciones no publicadas). La hipótesis alterna de evolución independiente y convergencia de la conformación de las cuatro regiones del cráneo y de los 20 atributos mecánicos analizados entre estos tres linajes es menos probable. Por otro lado, aunque la conformación del cráneo de C. lupus es semejante a la de las otras tres especies sociales e hipercarnivoras, las gráficas de deformaciones relativas muestran que en general la conformación de C. lupus es la más próxima al resto de especies que viven en grupos familiares pequeños y que son de hábitos carnívoros. Esto, sumado a la observación de que C. lupus presenta propiedades mecánicas cráneodentales diferentes a las de L. pictus, S.venaticus y C. alpinus, sugiere que socialidad e hipercarnivoría evolucionaron independientemente en C. lupus. Esta observación es apoyada por la topología de todos los cladogramas disponibles para la subfamilia Caninae. La asociación entre socialidad y conformación craneal también puede estar afectada por procesos de inercia filogenética. Este podría ser el caso de C. brachyurus, una especie suramericana que vive en pequeños grupos familiares, forrajea en solitario y es considerada omnívora con una dieta compuesta fundamentalmente por roedores y frutas; incluso se considera que tiene tendencias insectívoras (Bekoff et al., 1984; Dietz, 1985; Asa, 1997; Moehlman y Hofer, 1997; MacDonald et al., 2004). Sin embargo, esta especie es de gran tamaño y presenta rasgos cursoriales acentuados, lo que es común en cánidos sociales e hipercarnívoros. La conformación de su dentario es más semejante a la de cánidos con hábitos carnívoros, y la de su arco zigomático es aún más impresionante en tanto que se asemeja a la de especies hipercarnívoras. C. brachyurus deriva de un ancestro migrante de Norte América (Muñoz-Duran, 2002) cuyo registro fósil más antiguo data de 4.7 ma de las Tunas, Nuevo México (Berta, 1987; Berta, 1988; Munthe, 1989). Lo anterior abre la posibilidad de que C. brachyurus derive de un ancestro con hábitos predadores más marcados que habitó en ambientes en los que las presas de gran tamaño eran más abundantes y diversas. La distribución geográfica presente de C. brachyurus corresponde a un ambiente en el que las presas de mediano y gran tamaño son escasas, lo que pudo haber estimulado un cambio en el comportamiento de esta especie hacia la omnivoría. De esta manera la presencia de un arco zigomático robusto, su tamaño corporal y adaptaciones cursoriales pueden ser consideradas características ancestrales mantenidas mediante un proceso de inercia filogenética.
A pesar de que el dimorfismo sexual en términos de tamaño corporal es común en los cánidos actuales (Fuentes y Muñoz-Durán, observaciones no publicadas), en este análisis no se encontraron diferencias de conformación craneal en las regiones estudiadas relacionadas con el sexo. Las especies sociales de cánidos presentan dimorfismo sexual que varía entre 14% (S. venaticus) y 24% (C. lupus), siendo los machos de mayor de tamaño corporal que las hembras. Dado lo anterior y las relaciones propuestas entre tamaño corporal e hipercarnivoría que sugieren que tamaños corporales mayores presentan ventajas para la cacería de presas de gran tamaño (van Valkenburgh et al., 2003; Wang et al., 2004; Finarelli, 2007), podría esperarse que los machos de las especies sociales desempeñaran un papel más activo durante eventos de cacería cooperativa. Por tanto, los machos deberían estar sometidos a presiones de selección más intensas para el desarrollo de rasgos anatómicos relacionados con la producción de fuerza y la resistencia al estrés mecánico. Los resultados de este estudio no brindan apoyo a la anterior predicción y sugieren que las diferencias en el tamaño corporal entre machos y hembras de las especies actuales de cánidos sociales no afectan su comportamiento predatorio. Machos y hembras desempeñan papeles equivalentes durante los eventos de cacería cooperativa y están sometidos a las mismas presiones selectivas que median esta interacción ecológica.
Los resultados también sugieren que se debe ser prudente con la comparación de grupos lejanos filogenéticamente bajo las presunciones de convergencia en características anatómicas que median la interacción depredador-presa y de una correlación fuerte entre socialidad e hipercarnivoría en carnívoros sin la habilidad de supinar los antebrazos. Estas presunciones no parecen estar bien justificadas. Incluso la comparación de especies estrechamente relacionadas como las de la subfamilia Caninae muestran que las adaptaciones a hipercarnivoría pueden concentrase en regiones anatómicas diferentes. Así, mediante efectos funcionales diferentes se puede lograr el mismo objetivo: mejorar la capacidad de procesar presas. Esto lo ilustran las diferentes adaptaciones que se observan en especies que han desarrollado talón cortante (L. pictus, C. alpinus y S. venaticus) que enfatizan variables biomecánicas asociadas con el primer componente principal y C. lupus que enfatiza variables asociadas con el segundo componente principal.
Asumir que diferentes grupos taxonómicos de mamíferos carnívoros son análogos desde el punto de vista morfológico, funcional y ecológico puede conducir a inferencias erróneas. Por ejemplo, no existen felinos con trompas alargadas y cánidos con trompas cortas independientemente de su nivel de socialidad y del tipo de dieta hipo, meso o hypercarnívora que puedan tener (Radinsky, 1981). Así mismo, los leones (Panthera leo) son los felinos de mayor tamaño, poseen todos los rasgos cráneodentales hipercarnivoros típicos de felino, tienen extremidades anteriores fuertes, con garras recurvadas, filosas y retráctiles, y además tienen antebrazos con la habilidad de supinar; aún así, los leones viven en grupos sociales y cazan de manera cooperativa. Especies extintas de félidos con características similares a las de los leones podrían ser categorizadas como hipercarnívoros solitarios en ausencia de evidencia diferente a la anatómica. Así, hay que ser cautos al proponer inferencias sobre la evolución de caracteres que, como la socialidad, no dejan un registro fósil directo, y restringir las comparaciones a grupos taxonómicos monofiléticos que muestran patrones claros de asociación entre rasgos comportamentales y anatómicos.
CONCLUSIONES
Existe relación estrecha entre las conformacionesde la región lateral del cráneo, el arco zigomático, el dentario (vista general), el corpus de la mandíbula y las propiedades mecánicas cráneodentales con las categorías de socialidad y gremio alimentario en la subfamlia Caninae. Las especies de cánidos actuales que viven en grupos sociales y que poseen hábitos alimentarios hipercarnívoros presentan una conformación craneal, anatomía dental y propiedades mecánicas que los diferencian claramente del resto de las especies de cánidos actuales. Estas características morfológicas son susceptibles de ser preservadas en el registro fósil, lo que abre la posibilidad de identificar especies extintas de la subfamilia Caninae que vivían en grupos sociales y cazaban de manera cooperativa. Sin embargo, basados en los rasgos anatómicos en los que se centró este análisis, no será posible identificar especies extintas al interior de la subfamilia Caninae que fueron sociales pero con hábitos alimenticios diferentes a hipercarnívoría.
La socialidad y adaptaciones hipercarnívoras en la subfamilia Caninae pudieron evolucionar por múltiples vías, dependiendo del contexto ecológico, las relaciones evolutivas entre linajes y variabilidad fenotípica disponible en poblaciones ancestrales. Entre los factores ecológicos más relevantes que influyen sobre la evolución de socialidad en cánidos están disponibilidad de presas y presencia de especies simpátricas competidoras. Para las regiones anatómicas estudiadas no hay variación conformacional relacionada con el sexo, lo que sugiere que el comportamiento depredador de machos y hembras de las especies de cánidos sociales modernas es similar y, por tanto, los dos sexos están afectados por presiones de selección comparables.
AGRADECIMIENTOS
Los autores agradecemos a los integrantes del grupo de Ecología Evolutiva del Departamento de Biología Evolutiva de la Universidad Nacional de Colombia por su colaboración con la digitalización de landmarks, sus comentarios y sugerencias. En particular estamos en deuda con Carlos Morantes, quien además dedicó muchas horas a la edición de tablas y figuras. Queremos reconocer y agradecer el apoyo de las siguientes instituciones y los directores de las colecciones de mamíferos que nos brindaron acceso a los ejemplares de cánidos: National Museum of Natural History - Smithsonian Institution, Washington, D. C.; American Museum of Natural History, Nueva York; The Field Museum, Chicago; Museum of Comparative Zoology, Harvard; Muséum National d'Histoire Naturelle, Paris; British Museum of Natural History, Londres; Zoologisches Museum Berlin, Berlín; Museo de Vertebrados Jorge Ignacio Hernández Camacho del Instituto Von Humboldt, Villa de Leiva. Gracias a los evaluadores de este artículo por su lectura cuidadosa y valiosas sugerencias. Agradecemos el apoyo financiero del Departamento Administrativo de Ciencia, Tecnología e Innovación (COLCIENCIAS contrato 192-2007) y de la División de Investigaciones de la Sede Bogotá (DIB, Proyecto 8373).
BIBLIOGRAFÍA
ALLEN SH, HASTINGS JO, KOHN SC. Composition and stability of coyote families and territories in North Dakota. Prairie Nat. 1987;19(2):107-114. [ Links ]
ANDERSSON K. Were There Pack-Hunting Canids in the Tertiary, and How Can We Know? Paleobiology. 2005;31(1):56-72. [ Links ]
ANDERSSON M. The evolution of eusociality. Ann Rev Ecol Syst.1984;15:165-189. [ Links ]
ASA CS. Hormonal and experiental factors in the expression of social and parental behaviors in canids. En: Solomon NG, and French JA, editores. Cooperative breeding in mammals. Cambridge: Cambridge University Press; 1997. p. 129-149. [ Links ]
AVIL L. Cooperation and non linear dynamics: An ecological perspective on the evolution of sociality. Evol Ecol Res. 1999;1:459-477. [ Links ]
BEKOFF M, DANIELS TJ, GITTLEMAN JL. Life History Patterns and the Comparative Social Ecology of Carnivores. Ann Rev Ecol Syst. 1984;15(1):191-232. [ Links ]
BERTA A. Origin, diversification, and zoogeography of the South American Canidae. Fieldiana Zoology. 1987;39:455-472. [ Links ]
BERTA A. Quaternary evolution and biogeography of the large South American Canidae (Mammalia: Carnivora). Univ Calif Publ Geol Sci. 1988;132:1-160. [ Links ]
BOWYER T. Coyote group size relative to predation on mule deer. Mammalia. 1987;51(4):515-426. [ Links ]
COURCHAMP F, CLUTTON-BROCK T, GRENFELL B. Inverse density dependence and the Allee effect. Trends Ecol Evol. 1999;14(10):405-410. [ Links ]
DIETZ JM. Chrysocyon brachyurus. Mamm species. 1985;234:1-4. [ Links ]
DUJARDIN JP. BAC. Institut de Recherches pour le Développement. 2002a. Disponible en: URL: www.mpl.ird.fr/morphometrics/, France. [ Links ]
DUJARDIN JP. PAD. Institut de Recherches pour le Développement. 2002b. Disponible en: URL:http://www.mpl.ird.fr/morphometrics/clic/index.html, France. [ Links ]
DUJARDIN JP. TET. Institut de Recherches pour le Développement. 2002c. Disponible en: URL:www.mpl.ird.fr/morphometrics/, France. [ Links ]
DUJARDIN JP. VAR. Institut de Recherches pour le Développement. 2003. Disponible en: URL:www.mpl.ird.fr/morphometrics/, France. [ Links ]
EATON RL. Interference competition among carnivores: a model for the evolution of social behavior. Carnivore. 1979;2:9-16. [ Links ]
FANSHAWE JH, FITZGOBBON CD. Factors influencing the hunting success of an African wild dog pack. Anim Behav. 1993;45(3):479-490. [ Links ]
FELSENSTEIN J. PHYLIP (Phylogeny Inference Package). 2005. Department of Genome Sciences, University of Wasshington, Seattle.Disponible en: URL: http://evolution.genetics.washington.edu/phylip.html. [ Links ]
FINARELLI JA. Mechanisms behind Active Trends in Body Size Evolution of the Canidae (Carnivora: Mammalia). Am Nat. 2007;170(6):876-885. [ Links ]
FOX MW. Evolution of social behaviour in canids. En: Fox MW, editor. The wild canids. New York, USA: Van Nostrand Reinhold Company; 1975. p. 429-460. [ Links ]
GAMER M, LEMON J, FELLOWS I. 2009. in: Various Coefficients of Interrater Reliability and Agreement. Disponible en: URL:http://CRAN.R-project.org/package=irr. [ Links ]
GEFFEN E, GOMPPER ME, GITTLEMANN JL, LUH H-K, MACDONAL DW, WAYNE RK. Size, life-history traits, and social organization in the Canidae: a reevaluation. Am Nat. 1996;147(1):140-160. [ Links ]
GESE EM, BEKOFF M. Coyote (Canis latrans). En: Sillero-Zubiri C, Hoffmann M, and Macdonald DW, editores. Canids: foxes, wolves, jackals and dogs. Status survey and conservation action plan. Gland, Switzerland & Cambridge, UK: IUCN/SSC Canid Specialist Group; 2004. p. 81-87. [ Links ]
GESE EM, RUFF RL. Scent-marking by coyotes, Canis latrans: the influence of social and ecological factors. Anim Behav. 1997;54(5):1155-1166. [ Links ]
GESE EM, RUFF RL, CRABTREE RL. Social and nutritional factors influencing the dispersal of resident coyotes. Anim Behav. 1996;52(5):1025-1043. [ Links ]
GONYEA W, ASHWORTH R. The form and function of retractile claws in the Felidae and other representative carnivorans. J Morph. 1975;145(2):229-238. [ Links ]
LANDIS R, KOCH GG. The measurement of observer agreement for categorical data. Biometrics. 1977;33(1):159-174. [ Links ]
MACDONALD DW. Helpers in fox society. Nature. 1979;282(5734):69-71. [ Links ]
MACDONALD DW. The ecology of carnivore social behaviour. Nature. 1983;301:379-384. [ Links ]
MACDONALD DW, CREEL S, MILLS MGL. Canid society. En: Macdonald DW, Sillero-Zubiri C, editores. The biology and conservation of wild canids. Oxford: Oxford University Press; 2004. p. 85-106. [ Links ]
MAIER R. Comportamiento animal: Un enfoque evolutivo y ecológico. 1 ed. Madrid: McGraw Hill Interamericana; 2001. [ Links ]
MARTIN LD. Fossil history of the terrestrial Carnivora. En: Gittleman JL, editor. Carnivore behavior, ecology, and evolution. Ithaca: Comstock Publishing Associates; 1989. p. 536-568. [ Links ]
MOEHLMAN PD. Ecology of cooperation in canids. En: Rubenstein DI, Wrangam RW, editores. Ecological aspects of social evolution. Princeton, NJ, USA: Princeton Univerity Press; 1986. p. 64-86. [ Links ]
MOEHLMAN PD, HOFER H. Cooperative breeding, reproductive suppression, and body mass in canids. En: Solomon NG, and French JA, editores. Cooperative breeding in mammals. Cambridge: Cambridge University Press; 1997. p. 76-127. [ Links ]
MUNTHE K. The skeleton of the Borophaginae. University of California Publications in Geological Sciences. 1989;133:1-115. [ Links ]
MUNTHE K. Canidae. En: Janis CM, Scott KM, Jacobs LL, editores. Evolution of Tertiary mammals of North America. Cambridge: Cambridge University Press; 1998. p. 124-143. [ Links ]
MUÑOZ-DURÁN J. Correlates of speciation and extinction rates in the Carnivora. Evol Ecol Res. 2002;4(7):963-991. [ Links ]
MUÑOZ-DURÁN J. Sociabilidad en carnívoros: una paradoja evolutiva. En: Zerda LE, editor. Comportamiento Animal y Humano. Bogotá, D.C.: Universidad Nacional de Colombia; 2009. p. 56-66. [ Links ]
MUÑOZ-DURÁN J. Sociabilidad en carnívoros: una paradoja evolutiva. En: Zerda LE, editor. Comportamiento Animal y Humano. Bogotá, D.C.: Universidad Nacional de Colombia; 2010. p. 56-66. [ Links ]
MUÑOZ-DURÁN J. Data set incongruence and insights from the fossil record: the canid phylogeny. Caldasia. 2011;33(2):551-572. [ Links ]
NOGUCHI K, WALLACE HUI WL, GEL YR, GASTWIRTH JL, MIAOW. 2009. lawstat: An R package for biostatistics, public policy, and law Disponible en: URL:http://CRAN.R-Project.org/package=lawstat [ Links ]
NOWAK RM. Walker's mammals of the World. Sixth ed. Baltimore: The Johns Hopkins University Press; 1999. [ Links ]
PALOMARES F, CARO TM. Interspecific killing among mammalian carnivores. Am Nat. 1999;153(5):492-508. [ Links ]
PEYTON B. Spectacled Bear conservation action plan (Tremarctos ornatus). En: Servheen C, Herrero S, Peyton B, editores. Bears: status survey and conservation action plan. Cambridge, UK: IUCN/SSC Bear Specialist Group, IUCN/SSC Polar Bear Specialist Group; 1999. p. 157-198. [ Links ]
POLLY PD. Adaptive zones and the pinniped ankle: a 3D quantitative analysis of the carnivoran tarsal evolution. En: Sargis E, Dagosto M, editores. Mammalian evolutionary morphology: a tribute to Frederick S. Szalay. Dordrecht, The Netherlands: Springer; 2008. p. 167-196. [ Links ]
RADINSKY LB. Evolution of skull shape in carnivores 2. Additional modern carnivores. Biol J Linnean Soc. 1981;16(4):337-355. [ Links ]
RADINSKY LB. Evolution of skull shape in carnivores 3. The origin and early radiation of the modern carnivore families. Paleobiology. 1982;8(3):177-195. [ Links ]
ROHLF FJ. 2006. tpsDig, digitize landmarks and outlines. Department of Ecology and Evolution, SUNY at Stony Brook. Disponible en: URL: http://life.bio.sunysb.edu/morph/index.html [ Links ]
ROHLF FJ. 2007. tpsRelw, relative warps analysis. Department of Ecology and Evolution, SUNY at Stony Brook. Disponible en: URL:http://life.bio.sunysb.edu/morph/ index.html [ Links ]
SHELDOM JW. Wild dogs, the natural history of the nondomestic Canidae. ed. San Diego, CA: Academic Press Inc.; 1992. [ Links ]
SILLERO-ZUBIRI C. Pale fox (Vulpes pallida). En: Sillero-Zubiri C, Hoffmann M, and Macdonald DW, editores. Canids: foxes, wolves, jackals and dogs. Status survey and conservation action plan. Gland, Switzerland & Cambridge, UK: IUCN/SSC Canid Specialist Group; 2004. p. 199-200. [ Links ]
SLATER GJ, DUMONT ER, VAN VALKENBURGH B. Implications of predatory specialization for cranial form and function in canids. J Zoo. 2009;278(3):181-188. [ Links ]
SPSS. SPSS 15.0 for Windows. SPSS Inc, Chicago. 2006. [ Links ]
TEAM RDC. 2009. R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing. Disponible en: URL:http://www.R-project.org. [ Links ]
TEDFORD R. Neogene mammalian biostratigraphy in China: past, present and future. Vert Palas. 1995;33(4):277-289. [ Links ]
TEDFORD RH, WANG X, TAYLOR BE. Phylogenetic systematics of the North American fossil Caninae (Carnivora: Canidae). Bull Am Mus Nat His. 2009;574:1-215. [ Links ]
VAN DER MOLEN S, MARTÍNEZ ABADÍAS N, GONZÁLEZ-JOSÉ R. Introducción a la Morfometría Geométrica. Curso teórico-práctico. 1 ed. Puerto madryn y Barcelona: Editorial FCNyM-UNLP. 2007 [ Links ]
VAN VALKENBURGH B. Major patterns in the history of carnivorous mammals. Ann Rev Earth and Planetary Scs. 1999;27(1):463-493. [ Links ]
VAN VALKENBURGH B. The dog-eat-dog world of carnivores: A review of past and present carnivore community dynamics. En: Craig B, and Bunn HT, editores. Meateating & human evolution. Oxford: Oxford University Press; 2001. p. 101-121. [ Links ]
VAN VALKENBURGH B, KOEPFLI KP. Cranial and dental adaptations to predation in canids. En: Dunstone N, and Gorman ML, editores. Mammals as Predators. Oxford: Oxford University Press; 1993. p. 15-37. [ Links ]
VAN VALKENBURGH B, RUFF CB. Canine tooth strength and killing behaviour in large carnivores. J Zoo. 1987;212(3):379-397. [ Links ]
VAN VALKENBURGH B, SACCO T, WANG X. Pack hunting in Miocene borophagine dogs: evidence from craniodental morphology and body size. Bull Am Mus Nat His. 2003;279:147-162. [ Links ]
WANG X. Transformation from plantigrady to digitigrady: functional morphology of locomotion in Hesperocyon (Canidae, Carnivora). Am Mus Novit. 1993;3069:1-23. [ Links ]
WANG X. Phylogenetic systematics of the Hesperocyoninae (Carnivora, Canidae). Bull Am Mus Nat His. 1994;221:1-207. [ Links ]
WANG X, TEDFORD RH. Evolutionary history of canids. En: Jensen P, editor. The behavioural biology of dogs. Oxford: CABI International; 2007. p. 3-20. [ Links ]
WANG X, TEDFORD RH, TAYLOR BE. Phylogenetic systematics of the Borophaginae (Carnivora: Canidae). Bull Am Mus Nat His. 1999;243:1-391. [ Links ]
WANG X, TEDFORD RH, VAN VALKENBURGH B, WAYNE RK. Phylogeny, classification, and evolutionary ecology of the Canidae. En: Sillero-Zubiri C, Hoffmann M, and Macdonald DW, editores. Canids: foxes, wolves, jackals and dogs. Status survey and conservation action plan. Gland, Switzerland & Cambridge, UK: IUCN/SSC Canid Specialist Group; 2004. p. 20-32. [ Links ]
WILSON DE, RUFF S. The Smithsonian book of North American Mammals. First ed. Singapore: The Smithsonian Institution; 1999. [ Links ]