Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.17 no.2 Bogotá May/Aug. 2012
ABLANDAMIENTO DE FRUTOS DE PITAYA AMARILLA (ACANTHOCEREUS PITAJAYA) A TEMPERATURA AMBIENTE Y EN REFRIGERACIÓN: ACTIVIDAD DE POLIGALACTURONASA, CELULASA Y XILANASA
Yellow Pitaya (Acanthocereus pitajaya) Fruit Softening During its Storage at Room Temperature and on Refrigerated Conditions: Polygalacturonase, Celualase and Xilanase Activities
YENNY MARITZA DUEÑAS GÓMEZ1,2, M.Sc. en Ciencias-Química; CARLOS-EDUARDO NARVÁEZ-CUENCA1, M.Sc. en Ciencias-Química; LUZ PATRICIA RESTREPO SÁNCHEZ1, M.Sc. en Ciencias-Química.
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Carrera 30 # 45-03, Bogotá Colombia.
2 Departamento de Nutrición y Bioquímica, Pontificia Universidad Javeriana, Carrera 7 # 40-62, Bogotá, Colombia. Autor de contacto: cenarvaezc@unal.edu.co
Presentado 4 de noviembre de 2010, aceptado 19 de abril de 2012, correcciones 19 de abril de 2012.
RESUMEN
Una de las mayores causas de pérdidas poscosecha de frutos de pitaya amarilla es su ablandamiento excesivo, el cual ha sido documentado previamente cuando la fruta es almacenada a temperaturas de cosecha o después de refrigeración. Además, tratamientos de choque térmico antes del almacenamiento refrigerado ofrecen control en el ablandamiento de estos frutos. Diferentes experimentos fueron llevados a cabo para evaluar el papel de algunas enzimas degradadoras de pared celular en el ablandamiento de frutos de pitaya amarilla: almacenamiento a 18 °C (TA) y refrigeración con choque térmico previo (ChT-R). Se incluyó también un tratamiento refrigerado control, sin choque térmico (control-R). Si midió el color de la corteza, la firmeza y las actividades de poligalacturonasa (PG), celulasa (CEL) y xilanasa (XIL). La evaluación del color indicó que los frutos almacenados a TA alcanzaron su madurez comercial luego de seis días. Luego de 12 días de almacenamiento a TA el pardeamiento y ablandamiento excesivo afectaron negativamente la calidad de los frutos. El pardeamiento y ablandamiento excesivo fueron detectados también en los frutos control-R cuando se movieron de 2 a 18 °C. Un ligero pardeamieno fue observado en los frutos ChT-R. Estos frutos alcanzaron su madurez comercial luego de 24 días de almacenamiento (nueve días luego de terminado el almacenamiento refrigerado). La actividad de XIL se asoció al ablandamiento en los frutos almacenados a TA y ChT-R. No se observó una clara correlación entre las actividades de PG y el ablandamiento, como tampoco entre CEL y el ablandamiento.
Palabras clave: tratamiento térmico, daños por frío, ablandamiento, pitaya amarilla.
ABSTRACT
One of the major causes of yellow pitaya fruit loss during its marketing is its excessive softening, which has been previously documented when the fruit is stored at harvest temperature or after refrigeration. Furthermore, its excessive softening has been controlled by the application of heat shock treatments before refrigeration. Different experiments were carried out to evaluate the role of cell wall degrading enzymes on yellow pitaya fruit softening: storage at 18 °C (RT) as well as refrigeration with previous heat shock treatment (HS-R). A refrigerated control, without heat shock, was included (control-R). Peel color, firmness, poligalacturonase (PG), celulase (CEL) and xilanase (XIL) activities were measured. RT fruits reached the commercial ripeness after six days, as indicated by the color evaluation. After 12 days of storage at RT browning and excessive softening negatively affected the fruit quality. Browning and excessive softening were also detected in the control-R fruit when moving from 2 to 18°C. Minor browning was found in the HS- R fruit. HS-R fruit was full ripe 24 days of storage (nine days after finishing the refrigerated storage). XIL activity was associated to the softening in the RT and HS-R fruits. No clear correlation was observed between PG and softening neither between CEL and softening.
Key words: heat treatment, chilling injury, softening, yellow pitaya.
INTRODUCCIÓN
El ablandamiento en las frutas ha sido relacionado con cambios en la composición de la pared celular, principalmente de pectina, celulosa y hemicelulosa. Durante la maduración de las frutas, estos componentes sufren diferentes reacciones enzimáticas de des-esterificación y de-polimerización que conducen al ablandamiento (Brummell, 2006). Las enzimas vinculadas a la degradación de estos polisacáridos se pueden clasificar en dos grandes grupos a saber, uno el de las glicanasas, encargadas en general de romper los polímeros y producir cadenas de menor peso molecular y otro, el de las glicosidasas que actúan en cadenas de oligosacáridos de bajo peso molecular (Prasanna et al., 2007). Entre el conjunto de más de 20 enzimas degradadoras de pared celular se ha dedicado durante muchos años especial interés a las glicanasas: poligalacturonasa (PG), celulasa (CEL) y xilanasa (XIL) (Prasanna et al., 2007), enzimas vinculadas con la degradación de pectina, celulosa y hemicelulosa, respectivamente. Diversas investigaciones muestran que la participación de las hidrolasas en la degradación de la pared celular no es siempre la misma. De este modo, la CEL guarda estrecha relación con el ablandamiento en frutos de aguacate (Pesis et al., 1978); en frutos de pimentón se ha encontrado que enzimas como PG, CEL y laminarasa juegan un papel importante en el ablandamiento (Prabha et al., 1998), en tanto que en papaya, enzimas como la glucanasa, XIL y xilosidasa parecen ser las causantes de la pérdida de dureza (Thumdee et al., 2010). En Colombia, diferentes cactáceas son cultivadas y comercializadas como pitaya amarilla, entre las que se encuentran especies como Acanthocereus pitajaya y Selenicereus megalanthus. Estudios previos han mostrado que cuando estos frutos son cosechados en su madurez fisiológica, hay un rápido proceso de maduración que tarda pocos días y que luego de alcanzada la madurez sensorial, el deterioro de los frutos es acelerado, caracterizándose por un pardeamiento y ablandamiento excesivos (Rodríguez et al., 2005; Dueñas et al., 2009). Si bien no existen datos específicos para pitaya amarilla, las pérdidas de frutas durante su producción y comercialización en países en vía de desarrollo oscilan entre 7 y 53 % (Prusky, 2011). Se ha reportado también que los frutos de las especies A. pitajaya y S. megalanthus son susceptibles al frío y que frutos de la primera especie toleran el almacenamiento refrigerado si se exponen previamente a un tratamiento de estrés por alta temperatura, conocido como choque térmico (Dueñas et al., 2009; Rodríguez et al., 2005). En A. pitajaya se ha evidenciado el papel de las enzimas catalasa, peroxidada y polifenoloxidasa durante la maduración en condiciones normales de maduración (Baquero et al., 2005) y en la tolerancia al frío inducida por el choque térmico (Dueñas et al., 2009). Sin embargo, no existen estudios del papel de enzimas degradadoras de pared celular. El objetivo de este trabajo fue estudiar la participación de las enzimas PG, CEL y XIL durante el ablandamiento de frutos de A. pitajaya durante condiciones normales de maduración y durante la exposición al frío, con y sin choque térmico previo.
MATERIALES Y MÉTODOS
MATERIAL VEGETAL
Frutos de pitaya amarilla (A. pitajaya), provenientes del municipio de Miraflores, departamento de Boyacá (Colombia), fueron cosechados con 90 % de color verde y 10 % amarillo en su corteza. Frutos cosechados en este estado han mostrado maduración adecuada a 18 °C (Dueñas et al., 2009). Los frutos, libres de daños mecánicos y visualmente sanos, fueron desinfectados con hipoclorito de sodio 0,1 %, enjuagados con agua, secados a 18 °C y divididos al azar en tres grupos.
ALMACENAMIENTO
Se hicieron dos tipos diferentes de almacenamiento: uno en el que los frutos se almacenaron sin modificar la temperatura y otro en el que los frutos fueron refrigerados. En el primer experimento los frutos fueron almacenados a temperatura ambiente de Bogotá, 18 °C durante 21 días (tratamiento TA). En el segundo experimento, los frutos fueron sometidos a choque térmico por calentamiento a 25 °C durante 24 horas, luego fueron refrigerados a 2 °C durante 15 días y finalmente, almacenados a 18 °C durante 15 días (tratamiento ChT-R); en este segundo experimento se incluyó un control sin choque térmico (tratamiento Control-R). Cada tres días se tomaron al azar tres frutos de cada tipo de almacenamiento e inmediatamente se midió el porcentaje de color amarillo, verde y pardo. En los frutos enteros también se evaluó la dureza. Posteriormente, se retiró la corteza y se realizó la extracción y medida de proteína y de las actividades enzimáticas de PG, CEL y XIL. Las medidas se realizaron por triplicado.
COLOR EN LA CORTEZA
El color en la corteza se determinó por inspección visual con un panel entrenado y se expresó como porcentaje de color amarillo. También se evaluó el deterioro por medida del color pardo. La evaluación de color fue hecha en un cuarto especialmente diseñado para evaluación sensorial, con cubículos separados y luz blanca. En cada sesión siete panelistas evaluaron muestras de pitaya amarilla provenientes de los tratamientos TA, ChT-R y Control-R Cada tratamiento con tres replicaciones y dos frutas por replicado. Cada panelista evaluó el color amarillo en la corteza de los frutos enteros así con cinco niveles de color: 0 = 0 % amarillo; 1 = 25 % amarillo; 2 = 50 % amarillo; 3 = 75 % amarillo; 4 = 100 % amarillo. Los panelistas también evaluaron el color pardo en la corteza con cinco niveles de color: 0 = 0 % pardo; 1 = 25 % pardo; 2 = 50 % pardo; 3 = 75 % pardo; 4 = 100 % pardo. Los colores amarillo y pardo fueron calculados mediante la fórmula %color = ∑ [(nivel de color)x(número de frutas en dicho nivel)]/número total de frutas evaluadas.
DUREZA
Se midió en la zona ecuatorial de los frutos enteros mediante punción con un penetrómetro Fruit Pressure Tester® modelo FT 327, con émbolo de 7,9 mm de diámetro. Los resultados se expresaron en Newton (N).
EXTRACCIÓN Y MEDIDA DE ACTIVIDAD DE PG, CEL Y XI
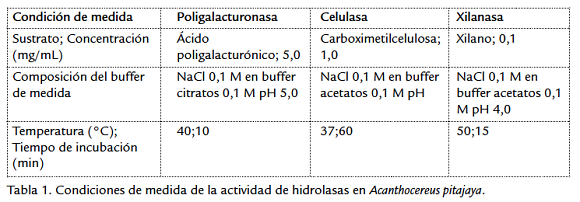
La extracción y medida de actividad de las enzimas se basó en trabajos previos, en los que se dedicó especial interés al estudio de las condiciones óptimas de extracción y medida de actividad de estas enzimas en corteza de A. pitajaya (Rodriguez et al., 2006; Dueñas et al., 2008). Para la extracción, muestras de 5 g de corteza fueron homogenizadas con 25 mL de acetona a 4 °C. El líquido fue removido por filtración y el residuo fue lavado dos veces con acetona fría. Al sólido blanco obtenido se adicionaron 25 mL de buffer fosfatos 20 mM pH 7,0, que contenía NaCl 0,5 M y se agitó durante 24 h a 2 °C. La suspensión obtenida fue centrifugada y el sobrenadante se empleó para la medida de proteína y de actividad enzimática. Los contenidos de proteína en los extractos fueron medidos por la técnica de Bradford modificado por Zor y Sellinger, 1996, con lectura de absorbancia a 450 y 590 nm. La medida de actividad enzimática se basó en la incubación del extracto enzimático con el respectivo sustrato (Rodriguez et al., 2006; Dueñas et al., 2008) y cuantificación de los azúcares reductores generados (Nelson, 1944; Somogy, 1952). La Tabla 1 presenta las condiciones de medida de actividad de cada enzima. Se realizaron blancos de enzima, sustrato. La actividad enzimática se expresó como nmol azúcar reductor/min/mg proteína.
ANÁLISIS DE DATOS
Los datos obtenidos durante el almacenamiento a TA fueron realizados acorde a un diseño completamente al azar. Los experimentos en donde se incluyó refrigeración se llevaron a acabo siguiendo un modelo factorial de dos niveles; las dos fuentes de variación fueron el tiempo de almacenamiento y el tratamiento (Control-R y ChT-R). Las diferencias entre promedios se compararon mediante la prueba de Tukey (p<0,05). Para comparar promedios entre los resultados del experimento TA y del experimento Control-R/ChT-R se empleó el test de Student (p<0,05). Se evaluó la correlación entre variable a través de los coeficientes de correlación de Pearson (p<0,05).
RESULTADOS Y DISCUSIÓN
ALMACENAMIENTO DE PITAYA AMARILLA A TEMPERATURA AMBIENTE
De acuerdo con la figura 1A, los frutos TA alcanzaron el 100 % de color amarillo en su corteza, entre los días 3 y 9 de almacenamiento, indicativo de su madurez sensorial. A partir de ese momento el porcentaje de color amarillo empezó a disminuir, incrementándose la aparición de zonas color marrón, indicativo del proceso de senescencia de los frutos. En los frutos almacenados a TA hubo un descenso en la dureza, con una razón de cambio cuatro veces mayor entre los días 9 a 15 que durante los días 0 a 9 (Fig. 1B). La dureza alcanzó un valor mínimo luego de 15 días de almacenamiento (37 % del valor inicial), sin cambios significativos (test de Tukey) a tiempos posteriores.
Las actividades enzimáticas de los frutos almacenados a TA están representadas en la figura 2. Se presentó un máximo en la actividad de PG hacia el día 3 de almacenamiento, valor que está ubicado en el límite inferior del intervalo de máximo desarrollo de las características sensoriales (días 3 a 9). Aunque entre los días 6 a 15 hubo un mayor ablandamiento, la actividad de PG no fue detectable. Hacia el final del almacenamiento a TA hubo un nuevo incremento en la actividad de esta enzima, que puede estar relacionada con el alto deterioro que caracterizaba al fruto en ese momento y una posible actividad de origen fúngico. Al momento inicial de almacenamiento a TA los frutos tuvieron actividad CEL, sin embargo a lo largo del almacenamiento la actividad fue bastante baja, sin registrarse diferencias estadísticas durante los días 3 a 21. Por otro lado, desde el día tres hasta el final del almacenamiento a TA hubo un incremento continuo en la actividad de XIL. Como se puede ver en la figura 3C, el ablandamiento en los frutos TA estuvo estadísticamente relacionado con la actividad de XIL (test de Pearson); menores valores de dureza obedecieron a mayores valores de actividad de esta enzima. No se encontró correlación entre la actividad de PG y la dureza de pitaya amarilla (Figura 3A). Aunque la actividad de CEL y la dureza no se correlacionó en un modelo lineal (Figura 3B) sí se encontró correlación positiva en un modelo logarítmico (figura no mostrada). Sin embargo, no encontramos explicación para que a mayor dureza haya mayor actividad de CEL.
La falta de correlación entre la actividad de PG y el ablandamiento ha sido descrita durante la maduración de frutos de papaya (Thumdee et al., 2010). De otro lado, en línea con los resultados acá presentados en pitaya amarilla, picos en la actividad de PG han sido encontrados en el carpelo de frutos de pepino, que no coinciden con los intervalos de tiempo de máximo ablandamiento del fruto (Miller et al., 1989). La aparición temprana del pico de actividad de PG observada en pitaya amarilla puede estar relacionada con su actividad como elicitora de la producción de etileno y por tanto con el proceso de maduración (Baldwin y Pressey, 1990). Contrario a estudios que vinculan la actividad de CEL con el ablandamiento de algunos frutos, por ejemplo guayaba (Jain et al., 2001) y pimentón (Prabha et al., 1998), los resultados obtenidos en pitaya amarilla almacenada a TA están de acuerdo con lo descrito para frutos de melón (Lester y Dunlap, 1985), en donde no se encontró relación alguna entre el ablandamiento y la actividad de CEL; hecho que podría indicar que la degradación de celulosa en el fruto en estudio no contribuye de manera importante al ablandamiento. Aunque en el presente trabajo la expresión génica de las enzimas en estudio no fue medida, los incrementos observados en la actividad de XIL durante la maduración de los frutos de pitaya amarilla a TA podrían obedecer al incremento en la expresión de genes para XIL, como ha sido demostrado durante la maduración de frutos de papaya (Manenoi y Paull, 2007). La actividad XIL en pitaya amarilla podría resultar en la de-polimerización de xilano y por tanto, participar activamente en su ablandamiento tal como ha sido evidenciado durante la maduración de frutos de pera (Maramatsu et al., 2004).
ALMACENAMIENTO REFRIGERADO DE PITAYA AMARILLA
La figura 4 representa los cambios en el color de la corteza y la dureza de los frutos refrigerados, Control-R y ChT-R. En los frutos Control-R hubo falla en la maduración normal puesto que nunca se logró el 100 % amarillo en la corteza; el máximo porcentaje de color amarillo se obtuvo entre los días 21 a 24 (50 %), período de tiempo durante el cual el porcentaje de color pardo estuvo alrededor de 40 %. La falla en la maduración normal de frutos durante la exposición al frío, conocida como lesión por frío, ha sido asociada con la pérdida de la integridad de la membrana celular y a la alteración del metabolismo (Vicente et al. 2006; Imahori et al. 2008); en el caso de Hylocereus megalanthus, una de las especies comercializada como pitaya amarilla, las lesiones por frío han sido asociadas con la sobreproducción de especies reactivas de oxigeno (Narváez Cuenca et al., 2011). De otro lado, se evidencia que en los frutos ChT-R hubo maduración satisfactoria, puesto que se lograron valores cercanos al 100 % de color amarillo en la corteza (días 21 a 24). De otro lado, ambos tratamientos, Control-R y ChT-R, generaron un control efectivo del ablandamiento durante el período de refrigeración: la dureza de los frutos luego de 15 días de refrigeración (109±3 N en Control-R y 117±3 N en ChT-R) fue significativamente igual (test de Tukey) a la registrada al inicio del ensayo (111±N en control-R y 115±6 N en ChT-R). Una vez los frutos fueron retirados de la refrigeración a almacenamiento complementario en ablandamiento en los frutos Control- R fue más rápido que en los frutos ChT-R: entre los días 15 a 30 la dureza se ajustó a un modelo lineal, con pendiente negativa (Δdureza/Δtiempo), en el que el ablandamiento fue apro-ximadamente tres veces más rápido en los frutos Control-R con respecto a los ChT-R (linealización no mostrada). La dureza en los frutos 100 % amarillos TA (día 6; 109 ± 2 N) fue significativamente igual (test de Student) a la de los frutos ChT-R (día 24; 106 ± 5 N). La falla de desarrollo de color amarillo en la corteza, junto con el incremento evidente en el pardeamiento de frutos Control-R y la mejora tras el empleo del choque térmico ha sido descrita previamente en frutos de pitaya amarilla (Dueñas et al., 2009). Efectos promisorios en el control del ablandamiento tras el empleo de tratamientos térmicos, por inmersión en agua caliente, antes de la refrigeración han sido reportados en frutos de caqui (Diospyros kaki; Besada et al., 2009) y fresa (Fragaria x ananassa; García et al., 1995).
En los tratamientos Control-R y ChT-R la actividad de PG se inhibió completamente durante el periodo refrigerado y permaneció no detectable incluso durante el almacenamiento complementario (Fig. 5A). La refrigeración también inhibió la actividad de CEL en ambos tratamientos (Fig. 5B); sin embargo, en los frutos Control-R hubo un pico de actividad en el día 9, en tanto que en los frutos ChT-R el pico de actividad se presentó 3 días después de salir de refrigeración (día 18). Finalmente, en ambos tratamientos (Control-R y ChT-R; Fig. 5C) hubo una disminución en la actividad de XIL luego de iniciada la refrigeración, más notoria en los frutos ChT-R; la actividad de XIL en el día 3 en los frutos ChT-R (0,02 ± 0,02 mmol/min/mg prot) representó 4 % del valor obtenido en el día 0 de almacenamiento (0,48 ± 0,07 mmol/min/mg prot), en contraste con la actividad en los frutos Control-R (0,28 ± 0,12 mmol/min/mg prot) que representó 58 %. Mientras que durante el almacenamiento refrigerado (días 3 a 15) en los frutos Control-R no hubo cambios importantes en la actividad de XIL (día 3: 0,28 ± 0,12; día 15: 0,19 ± 0,03 mmol/min/mg prot), en los frutos ChT-R la actividad tendió a incrementarse (día 3: 0,02 ± 0,02; día 15: 0,34 ± 0,09 mmol/min/mg prot). Durante los días 18 a 24 la actividad de XIL en los frutos Control-R no mostró cambios importantes y se hizo no detectable hacia el final del almacenamiento. De otro lado, durante los días 18 a 27 (3 a 12 días luego de salir de refrigeración) la actividad en los frutos ChT-R permaneció constante (0,13 ± 0,01-0,21 ± 0,07 mmol/min/mg prot), para aumentar hacia el final del experimento (día 30: 0,69 ± 0,06 mmol/min/mg prot). Las correlaciones entre las actividades enzimáticas y el ablandamiento de los frutos refrigerados (Fig. 6A-C) no fueron significativas, con una mejor tendencia para los frutos ChT-R (p<0,17). Al evaluar el efecto de la actividad de PG, CEl y XIL sobre el cambio en la dureza se encontró correlación altamente significativa para XIL (Fig. 6D) en los frutos ChT-R, hecho que vincula a la XIL como responsable, al menos parcial, del ablandamiento normal observado en los frutos ChT-R. La disminución de actividad de PG en condiciones de refrigeración también ha sido descrita en tomate y se ha asociado con una disminución en la abundancia de mRNA-PG (Rugkong et al., 2010). El pico de actividad de CEL en los frutos Control-R puede ser el resultado de la alteración del metabolismo como respuesta a la exposición al frío; en tanto que el pico de CEL observado en los frutos ChT-R sucedió antes del máximo desarrollo sensorial y podría estar relacionado con alguna señal temprana para iniciar el proceso de maduración, tal como ha sido descrito previamente en el texto para PG.
Se ha demostrado que el tratamiento térmico de frutos de fresa inhibe la actividad de enzimas relacionadas con la degradación de polisacáridos de la pared celular (Vicente et al., 2005). Algunos autores sugieren que el control del ablandamiento vía aplicación de choque térmico no necesariamente se da por inhibición de las enzimas degradadoras de pared celular, sino también, por incremento en la concentración de Ca2+ endógeno que forma complejos pectato-Ca y por lo tanto se posterga la acción de las enzimas degradadotas de pared celular (Conway et al., 1994). Aunque en el presente trabajo no se midieron contenidos de pectina ni posibles interacciones pectato-Ca, este fenómeno podría explicar la escasa relación observada entre la actividad de PG, CEL y la pérdida de dureza en pitaya amarilla.
CONCLUSIONES
El ablandamiento en los frutos como resultado de la maduración ha sido atribuido en buena medida a la degradación de los componentes de la pared celular. En el presente estudio se encontró que tanto el almacenamiento a temperatura ambiente, como el almacenamiento refrigerado con choque térmico previo conducen a una maduración adecuada del fruto, en el que la enzima XIL guarda estrecha relación con el ablandamiento. Sin embargo, esta enzima no explica el excesivo ablandamiento observado en los frutos refrigerados sin choque térmico previo, por lo que deben haber otras enzimas, además de XIL, responsables del ablandamiento.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Nacional de Colombia por su apoyo económico a través de la Dirección de Investigaciones DIB.
BIBLIOGRAFÍA
BALDWIN EA, PRESSEY R. Exopolygalacturonase elicits ethylene production in tomato. Hort Science. 1990;25:779-780. [ Links ]
BAQUERO DLE, CASTRO RJA, NARVAEZ CCE. Catalasa, peroxidasa y polifenoloxidasa en pitaya amarilla (Acanthocereus pitajaya): maduración y senescencia. Acta Biol Colomb. 2005;2:49-59. [ Links ]
BESADA LAC, SALVADOR A, MARTÍNEZ-JÁVEGA JM. Effect of heat treatments on reducing chilling injury of "Rojo Brillante" persimmon. Acta Hort. 2009;833:239-244. [ Links ]
BRUMMELL DA. Cell wall disassembly in ripening fruit. Funct Plant Biol. 2006;33:103-119. [ Links ]
CONWAY WS, SAMS CE, WANG CY, ABBOTT JA. Additive effects of postharvest calcium and heat treatment on reducing decay and maintaining quality in apples. J Am Soc Hortic Sci. 1994;119:49-53. [ Links ]
DUEÑAS GYM, NARVÁEZ CCE, RESTREPO SLP. Búsqueda de las mejores condiciones para la extracción y medida de actividad de celulasa y xilanasa extraídas de la corteza de pitaya amarilla (Acanthocereus pitajaya). Acta Biol Colomb. 2008;13:217-228. [ Links ]
DUEÑAS GYM, NARVÁEZ CCE, RESTREPO SLP. El choque térmico mejora la aptitud al almacenamiento refrigerado de pitaya amarilla (Acanthocereus pitajaya). Agron Colomb. 2009;27:105-110. [ Links ]
GARCÍA JM, AGUILERA C, ALBI MA. Postharvest heat treatment on Spanish strawberry (Fragaria x ananassa Cv. Tudla). J Agric Food Chem. 1995;43:1489-1492. [ Links ]
IMAHORI Y, TAKEMURA M, BAI J. Chilling-induced oxidative stress and antioxidant responses in mume (Prunus mume) fruit during low temperature storage. Postharvest Biol Technol. 2008;49:54-60. [ Links ]
JAIN N, DHAWAN K, MALHOTRA SP, SIDDIQUI S, SINGH R. Compositional and enzymatic changes in guava (Psidium guajava L.) fruits during ripening. Acta Physiol Plant. 2001; 23:357-362. [ Links ]
LESTER GE, DUNLAP JR. Physiological changes during development and ripening of 'perlita' muskmelon fruits. Sci Hortic. 1985;26:323-331. [ Links ]
MANENOI A, PAULL RE. Papaya fruit softening, endoxylanase gene expression, protein and activity. Physiol Plant. 2007;131:470-480. [ Links ]
MARAMATSU N, TANAKA K, ASAKURA T, TATSUK, M, HAJI T. Isolation and characterization of alkali-soluble pectic polysaccharides in peach (Prunus persica Batsch) fruit. J Jap Soc Hort Sci. 2004;73:541-545. [ Links ]
MILLER AR, DALMASSO JP, KRETCHMAN DW. Developmental variation of cell wall degrading enzymes from cucumber (Cucumis sativus) fruit tissues. Can J Bot. 1989;67:817-821. [ Links ]
NARVÁEZ CUENCA CE, ESPINAL RUIZ M, RESTREPO SÁNCHEZ LP. Heat shock reduces both chilling injury and the overproduction of reactive oxygen species in yellow pitaya (Hylocereus megalanthus) fruits. J Food Quality. 2001;34:327-332. [ Links ]
NELSON N. A photometric adaptation of the Somogyi method for determination of glucose. J Biol Chem. 1944;153:378-380. [ Links ]
PESIS E, FUCHS Y, ZAUBERMAN G. Cellulase activity and fruit softening in avocado. Plant Physiol. 1978;61:416-419. [ Links ]
PRABHA TN, NEELWARNE B, THARANATHAN RN. Carbohydrate changes in ripening Capsicum annuum in relation to textural degradation. Z Lebensm Unters Forsch A. 1998;206:121-125. [ Links ]
PRASANNA V, PRABHA TN, THARANATHAN RN. Fruit ripening phenomena-an overview. Crit Rev Food Sci Nutr. 2007;47:1-19. [ Links ]
PRUSKY D. Reduction of the incidence of postharvest quality losses, and future prospects. Food Sec. 2011;3:463-474. [ Links ]
RODRIGUEZ RDA, PATIÑO GMdP, LASPRILLA DM, FISCHER G, GALVIS VJA. Efecto de dos índices de madurez y dos temperaturas de almacenamiento sobre el comportamiento poscosecha de la pitaya amarilla (Selenicereus megalanthus Haw.) Rev Fac Nal Agr Medellín. 2005;58:2837-2857. [ Links ]
RODRÍGUEZ CJP, NARVÁEZ CCE, RESTREPO SLP. Estudio de la actividad enzimática de la poligalacturonasa en la corteza de pitaya amarilla (Acanthocereus pitajaya). Acta biol Colomb. 2006;11(s):66-77. [ Links ]
RUGKONG A, ROSE JKC, LEE SJ, GIOVANNONI JJ, O'NEILL MA, WATKINS CB. Cell wall metabolism in cold-stored tomato fruit. Postharv Biol Technol. 2010;57:106-113. [ Links ]
SOMOGY M. Notes on sugar determination. J Biol Chem. 1952;195:19-23. [ Links ]
THUMDEE S, MANENOI A, CHEN NJ, PAULL RE. Papaya fruit softening: Role of hydrolases. Tropical Plant Biol. 2010;3:98-109. [ Links ]
VICENTE AR, COSTA ML, MARTÍNEZ GA, CHAVES AR, CIVELLO PM. Effect of heat treatments on cell wall degradation and softening in strawberry fruit. Postharv Biol Technol. 2005;38:213-222. [ Links ] [ Links ]