Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.17 no.2 Bogotá May/Aug. 2012
PRODUCCIÓN DE ANTISUEROS PARA LA DETECCIÓN DE ÁCIDO INDOLACÉTICO EN CULTIVOS DE BACTERIAS PROMOTORAS DEL CRECIMIENTO VEGETAL
Antisera Production to Detect Indoleacetic Acid in Cultures of Plant-Growth Promoting Bacteria
MARCIA M. ROJAS1, Ph. D; ANNIA HERNÁNDEZ1, Ph. D; NAROVIS RIVES2, M. Sc; BERTO TEJERA1, Lic; YANELIS ACEBO1, M.Sc.; MAYRA HEYDRICH1, Ph. D.
1 Departamento de Microbiología y Virología, Facultad de Biología, Universidad de la Habana. Calle 25 #455 e/ J e I Vedado La Habana, Cuba. 2 Departamento de Protección de Plantas, Instituto de Investigaciones de Granos. Carretera km Bauta, La Habana, Cuba. Autor para la correspondencia: marcia@fbio.uh.cuPresentado 29 de septiembre de 2011, aceptado 10 de febrero de 2012, correcciones 29 de febrero de 2011.
RESUMEN
Se obtuvieron antisueros en conejo utilizando como antígeno el AIA adherido a membranas de nitrocelulosa que mostraron un elevado título y especificidad. Mediante la técnica de inmunoadsorción por manchas marcadas con oro coloidal se detectó la producción de esta auxina por cepas de los géneros Gluconacetobacter, Herbaspirillum, Azospirillum, Pseudomonas, Burkholderia y Bacillus empleando como antígenos los sobrenadantes de los cultivos. Para cuantificar la producción de AIA y corroborar los datos obtenidos se empleó la técnica colorimétrica derivada de Salkowski. Los resultados muestran que todos los géneros bacterianos estudiados tienen la capacidad de producir AIA y se demuestra la factibilidad del uso de este antisuero policlonal para la detección de este metabolito. Teniendo en cuenta las potencialidades de estas bacterias, resulta de gran importancia la utilización de antisueros y técnicas serológicas para la detección rápida y sencilla de este tipo de metabolitos en bacterias asociadas a cultivos de interés económico.
Palabras clave: auxinas, antisuero, inmunoadsorción por manchas, PGPB.
ABSTRACT
Rabbit polyclonal antisera against indoleacetic acid (IAA) bound to nitrocellulose membrane were obtained, which exhibited a high titer and specificity. The dot immunobinding technique with colloidal gold was used to detect auxin production by several strains belonging to Gluconacetobacter, Herbaspirillum, Azospirillum, Pseudomonas, Burkholderia and Bacillus genera, using culture supernatants as antigens. Moreover, auxin production was quantified by the Salkowski's method to corroborate the previous results. It was found that that all the studied microorganisms produce IAA and the feasibility of using these antisera to detect the metabolite was confirmed. Taking into account the potentialities of plant growth promoting bacteria as biofertilizers, the use of these antisera for a rapid and easy detection of IAA in bacteria associated with important crops is thus recommended.
Key words: auxins, antiserum, dot-immunobinding, PGPB.
INTRODUCCIÓN
Las bacterias promotoras del crecimiento vegetal (PGPB de sus siglas en inglés: Plant Growth Promoting Bacteria) se encuentran representadas ampliamente en cuanto a géneros microbianos, como son Azospirillum, Enterobacter, Azotobacter, Pseudomonas, Klebsiella, Serratia y Burkholderia. Se ha demostrado su capacidad para estimular el crecimiento de los cultivos, a través de metabolitos entre los que se encuentran los reguladores del crecimiento vegetal (Ona et al., 2005), por lo que resulta de especial interés su estudio en función del mejoramiento de los cultivos agrícolas. Entre los reguladores del crecimiento vegetal, las auxinas, y en especial el ácido indol-3- acético (AIA), son consideradas las de mayor importancia fisiológica (Torres-Rubio et al., 2000), y se ha demostrado que las mismas desempeñan un papel importante en el desarrollo de las raíces de las plantas. De esta manera se logra también aumentar la adsorción de agua y minerales, lo cual contribuye a un mejor crecimiento y desarrollo del cultivo. La detección y cuantificación de compuestos indólicos, en particular el caso del AIA, se ha estudiado mediante técnicas muy disímiles, entre las que se encuentran la cromatografía líquida de alta resolución (Dobrev et al., 2005), la cromatografía en capa delgada (Thakuria et al., 2004) y algunos métodos colorimétricos como el derivado de Salkowski (Glickmann y Dessaux, 1995). Bric et al., 1991, desarrollaron una metodología para detectar colonias productoras de AIA basada también en el reactivo de Salkowski. Se ha informado acerca de la producción de antisueros policlonales contra un conjugado AIA-BSA (seroalbúmina bovina) muy poco utilizado en la detección de esta hormona (Sandberg et al., 1987). Algunos de ellos presentan grandes ventajas en cuanto a su nivel de detección, como la cromatografía líquida de alta resolución, y para otros, como los métodos colorimétricos se ha demostrado que detecta también ácido indolpirúvico e indolacetamida, lo que resulta desventajoso si se analiza el nivel de detección de la técnica. Por otra parte, son caros y engorrosos en cuanto a su metodología y equipamiento. La detección de la producción de AIA en la búsqueda de bacterias promotoras de crecimiento de plantas resulta de gran interés, porque este es uno de los mecanismos de acción directa sobre la planta que ejerce una influencia más marcada en el crecimiento de las raíces y por tanto mejora la salud de la planta en general, por lo que es necesario contar con métodos rápidos, sencillos y confiables para ser utilizados en el diagnóstico de este metabolito. Teniendo en cuenta la importancia que tiene detectar cepas eficientes en la producción de estos metabolitos que permitan estimular el crecimiento y rendimiento de los cultivos agrícolas, se desarrolló este trabajo con el objetivo de obtener un antisuero anti AIA que permita la detección rápida de la producción de auxinas por diferentes géneros bacterianos asociados a cultivos de interés económico.
MATERIALES Y MÉTODOS
OBTENCIÓN DEL INMUNÓGENO
Como inmunógeno se utilizó ácido indolacético calidad reactivo (Sigma-Aldrich) disuelto en etanol a una concentración final de 1 g.L-1, y se adicionó 150 µL a 1 cm2 de membrana de nitrocelulosa permitiendo el secado y posteriormente se maceró en morteros estériles en 1 mL de adyuvante de Freund completo o incompleto, según el caso para las inmunizaciones. En la última se maceró con 1 mL de PBS (NaCl 8 g.L-1; KCl 0,2; KH2PO4 0,2, Na2HPO4 1,15).
OBTENCIÓN DEL ANTISUERO
Se utilizaron cuatro conejos blancos de Nueva Zelandia, hembras, de aproximadamente 2 kg de peso, producidos en el Centro Nacional de Producción de Animales de Laboratorio (CENPALAB), que fueron inmunizados según el esquema que se muestra en la Tabla 1.
Tres días después de la última inmunización se realizó el desangrado final de los animales para la obtención del suero, que se guardó en alícuotas de 1 mL a -20 °C para su posterior utilización
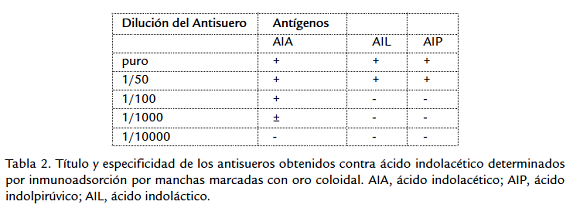
DETERMINACIÓN DEL TÍTULO Y ESPECIFICIDAD DE LOS ANTISUEROS
El título de los antisueros se determinó mediante la técnica de inmunoadsorción por manchas marcadas con oro coloidal (Rojas, 2005). En la realización de este ensayo se empleó una membrana de nitrocelulosa. Se le aplicaron 20 µL de los antígenos, utilizando un control negativo que consistió en leche descremada al 5 %. Se incubó la membrana durante 30 min a temperatura ambiente, después de lo cual se añadió como solución bloqueadora de leche descremada a 5 %, y se incubó durante 1 h, cada cierto tiempo se agitó manualmente. Se lavó con buffer PBS al 1 % durante 15 min. Se le añadieron 20 µL del As anti-AIA e incubó 1 h a temperatura ambiente. Se repitió el lavado con PBS y luego se añadieron 10 µL de proteína A de Staphylococcus aureus marcada con oro coloidal, producida en el Centro de Ingeniería Genética y Biotecnología. Se incubó durante 4 h a temperatura ambiente y luego se lavó 15 min con PBS 1 %, pasado este tiempo se secó la membrana con papel de filtro y se observó un halo de coloración rosada donde hubo reacción Ag-Ac.
La especificidad se determinó mediante esta misma metodología, enfrentando los antisueros obtenidos a soluciones de ácido indoláctico (AIL) y ácido indolpirúvico (AIP) preparados de igual forma que el AIA.
MICROORGANISMOS UTILIZADOS
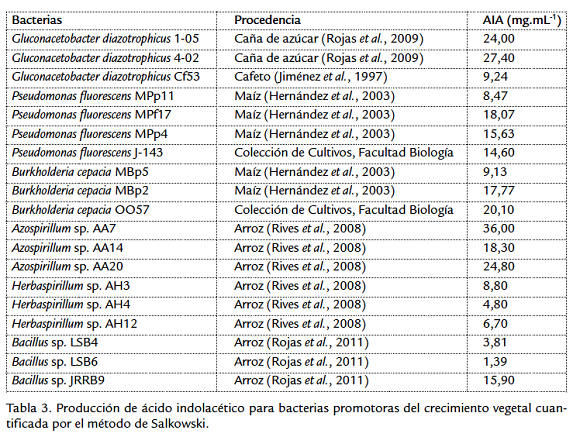
Se utilizaron 19 cepas promotoras del crecimiento vegetal de varios géneros bacterianos, aisladas y conservadas en el Laboratorio de Ecología Microbiana de la Facultad de Biología, de la Universidad de La Habana. Para cada género se utilizó en medio de cultivo adecuado: SYP (Caballero-Mellado y Martínez-Romero, 1994) para Gluconacetobacter, Azospirillum y Herbaspirillum, King B (King et al., 1954) para Pseudomonas y Burkholderia y Caldo Triptona Soya (TSB; Sigma) para Bacillus.
DETERMINACIÓN DE LA PRODUCCIÓN DE AIA POR INMUNOADSORCIÓN POR MANCHAS MARCADAS CON ORO COLOIDAL
Los antígenos se obtuvieron a partir de cultivos líquidos de 24 o 48 h según las bacterias a utilizar, incubadas a 30 °C y 150 rpm, se centrifugó por 5 min a 13000 rpm y se obtuvo el sobrenadante de cada uno. Estos se utilizaron para la realización de la inmunoadsorción por manchas marcadas con oro coloidal, como se describió previamente, técnica serológica que se aplicó para demostrar la producción de AIA por estas cepas. Se utilizó el antisuero anti-AIA obtenido. Esta metodología se repitió hasta los 5 años de obtenido el antisuero bajos las mismas condiciones experimentales.
CUANTIFICACIÓN DE LA PRODUCCIÓN DE AIA POR EL MÉTODO DE SALKOWSKI
Los sobrenadantes obtenidos previamente se utilizaron para cuantificar la producción de AIA mediante el método de Salkowski (Glickmann y Dessaux, 1995). Para esto se tomaron 500 µL de sobrenadante y 500 µL del reactivo de Salkowski (600 mL de H2SO4 con una concentración de 1,8 M, 4,5 g de FeCl3 anhidro se completa hasta 1L de H2O destilada) y se incubó esta mezcla en la oscuridad durante 30 minutos, para hacer la lectura de absorbancia a 535 nm. Este experimento se realizó con tres réplicas por aislado y como blanco se utilizó el medio correspondiente sin inocular. Paralelamente se realizó una curva patrón de AIA sintético utilizando diferentes concentraciones (5, 10, 15, 2, 60, 80 y 100 g.mL-1) de AIA sintético en metanol.
RESULTADOS
En el presente estudio se obtuvieron antisueros hiperinmunes contra AIA con un título frente a los reactivos químicos puros que se encuentra entre 1:100 y 1:1000 para la técnica inmunoquímica inmunoadsorción por manchas marcadas con oro coloidal (Tabla 2). Las comprobaciones realizadas demuestran la estabilidad del antisuero durante al menos 5 años a -20 °C, lo que se comprobó al aplicar la misma metodología con una selección de las cepas probadas. Existen reacciones cruzadas del antisuero obtenido cuando se emplea puro o en concentraciones de 1/50 con otros indoles como el ácido indoláctico (AIL) y el ácido indolpirúvico (AIP). En la dilución 1/100 el atisuero solamente reacciona con el AIA con una coloración rosada fuerte que permite detectar la reacción antígeno anticuerpo.
Los resultados de la técnica inmunoquímica inmunoadsorción por manchas marcadas con oro coloidal para la detección de AIA en sobrenadantes de cultivos bacterianos con el antisuero obtenido, demostraron que las 19 cepas estudiadas producen esta auxina, porque se observó en todos los casos la formación de un halo de coloración rosado alrededor del punto de aplicación de la muestra en la membrana de nitrocelulosa, lo que indica la reacción antígeno-anticuerpo (Fig. 1). Esto coincide con el control positivo de AIA sintético utilizado y difiere del resultado del control negativo. Para corroborar estos resultados se cuantificó la producción de AIA por el método de Salkowski para todas las cepas estudiadas (Tabla 3), las cuales producen cantidades de AIA detectables por este método, que se encuentran en un rango de 1,39 y 36,0 mg.mL-1. Existe un grupo de cepas que sobrepasan los 15 mg.mL-1, donde se encuentran dos cepas de Gluconacetobacter, dos cepas de Pseudomonas, dos cepas de Burkholderia, tres cepas de Azospirillum y una cepa de Bacillus. Por otra parte, se detectó la producción de AIA por debajo de 5 mg.mL-1, correspondiente a cepas de Herbaspririllum y Bacillus.
DISCUSIÓN
La producción de compuestos indólicos para los géneros bacterianos estudiados se ha informado por otros autores, lo que se corresponde con nuestros resultados (Mehnaz y Lazarovits, 2006; Mendes et al., 2007; Swain et al., 2007; Ahmad et al., 2008; Upadhyay et al., 2009).
Se comprobó que el antisuero anti AIA obtenido presenta reacciones cruzadas con el AIP y el AIL, aunque solo a las mayores concentraciones del antisuero probadas. Como plantean De la Providencia et al., 2002, la estandarización de los inmunoensayos conlleva a la optimización de sus reactivos, entre ellos la concentración del antisuero. En el presente trabajo la dilución del antisuero ha permitido eliminar la reactividad cruzada, lo que permite discriminar entre el AIA y otros indoles probados, lo que le confiere alta especificidad al ensayo.
En la técnica de Salkowski también ocurren reacciones cruzadas con otros indoles (Glickmann y Dessaux, 1995), no obstante es empleada por muchos autores con estos fines, porque los derivados halogenados del AIA (ácido 4-clorindol 3 acético y ácido 3 indolbutírico) tienen acción auxínica, así como algunos compuestos intermediarios de la vía de síntesis: indol 3-acetamida, triptifol, indol 3-etanol, entre otros. Los conjugados amida y éster del ácido 3-indolacético son formas de almacenamiento de esta auxina en las plantas (Arshad y Frankenberger, 1998). El método propuesto, elimina esta reactividad cruzada, lo que lo hace ventajoso sobre el método colorimétrico para la detección cualitativa de AIA.
El método serológico inmunoadsorción por manchas marcadas con oro coloidal ha sido utilizado por otros autores para la identificación de bacterias, demostrando ser una técnica rápida, sencilla y efectiva (Rojas, 2005). Por otra parte, presenta una elevada sensibilidad entre las técnicas serológicas modernas, comparable con el ELISA, siendo efectiva por su alta sensibilidad diagnóstica (Chakraborty y Sharma, 2007; Sumi et al., 2009; Shang et al., 2009), lo que queda demostrado al detectar concentraciones de AIA en el medio de cultivo de 1,39 mg.mL-1, correspondiente a cepas de Bacillus sp. Es válido señalar que la técnica inmunoquímica utilizada para la detección de AIA en los sobrenadantes de los cultivos es de gran sencillez y conjuntamente con la conservación del antisuero por un período de cinco años, hace factible que sea utilizada como una técnica de rutina para estos fines.
Como se puede apreciar los resultados obtenidos en la técnica inmunoquímica se corresponden con la posterior cuantificación del AIA por el método de Salkowski, lo que valida los resultados obtenidos y permite la propuesta de este ensayo utilizando el antisuero policlonal anti AIA obtenido en este trabajo para la detección rápida y eficiente de este metabolito en bacterias asociadas a cultivos de interés económico.
BIBLIOGRAFÍA
AHMAD F, AHMAD I, KHAN MS. Screening of freeliving rhizospheric bacteria for their multiple plant growth-promoting activities. Microbiol Res. 2008;163:173-181. [ Links ]
ARSHAD MF, FRANKENBERGER WT. Plant growth-regulating substances in the rhizosphere: microbial production and functions. Adv Agron. 1998;62:45-51. [ Links ]
BRIC JM, BOSTOCK RM, SILVERSTONET SE. Rapid In Situ Assay for Indoleacetic Acid Production by Bacteria Immobilized on a Nitrocellulose Membrana. Appl Environ Microbiol. 1991;57(2):535-538. [ Links ]
CABALLERO-MELLADO JE, MARTÍNEZ-ROMERO E. Limited genetic diversity in the endophytic sugarcane bacterium Acetobacter diazotrophicus. Appl Environ Microbiol. 1994;60(5):1532-1537. [ Links ]
CHAKRABORTY BN, SHARMA M. Serological detection and immunogold localization of cross-reactive antigens shared by Camellia sinensis and Exobasidium vexans. J Appl Microbiol. 2007;103:1669-1680. [ Links ]
DE LA PROVIDENCIA I, FERNÁNDEZ F, PÉREZ E, RODRÍGUEZ Y, FERNÁNDEZ K, DE LA NOVAL B, HERNÁNDEZ MA. Comparación de tres esquemas de inmunización para la obtención de un antisuero policlonal contra Glomus clarum. Cult Trop. 2002;23(4):17-22. [ Links ]
DOBREV PI, HAVLICEK L, V AGNER M, MALBECK J, KAMINEK M. Purification and determination of plant hormones auxin and abscisic acid using solid phase extraction and two-dimensional high performance liquid chromatography. J Chromatography A .2005;2:1-8. [ Links ]
GLICKMANN E, DESSAUX Y. A critical examination of the specificity of the Salkowsky reagent for indolic compounds produced by phytopathogenic bacteria. Appl Environ Microbiol 1995;61:793-796. [ Links ]
HERNÁNDEZ A, A CABALLERO, M PAZOS, R RAMÍREZ, M HEYDRICH. Identificación de algunos géneros microbianos asociados al cultivo del maíz (Zea mayz L.) en diferentes suelos de Cuba. Rev Col Biotecnol. 2003;V(1):45-55. [ Links ]
JIMÉNEZ-SALGADO T, FUENTES-RAMÍREZ LE, TAPIA-HERNÁNDEZ A, MASCARUA-ESPARZA MA, MARTÍNEZ-ROMERO E, CABALLERO-MELLADO J. Coffea arabica L., a new host plant for Acetobacter diazotrophicus, and isolation of other nitrogen- fixing acetobacteria. Appl Environ Microbiol. 1997;63(9):3676-3683. [ Links ]
KING EO, WARD M, RANEY DE. Two simple media for the demonstration of pyocyanin and fluorescein. J Lab Clin Med. 1954;44:30-307. [ Links ]
MEHNAZ S, LAZAROVITS G. Inoculation effects of Pseudomonas putida, Gluconacetobacter azotocaptans and Azospirillum lipoferum on corn plant growth under greenhouse conditions. Microb Ecol. 2006;51:326-335. [ Links ]
MENDES R, PIZZIRANI-KLEINER AA, ARAUJO WL, RAAIJMAKERS JM. Diversity of Cultivated Endophytic Bacteria from Sugarcane: Genetic and Biochemical Characterization of Burkholderia cepacia Complex Isolates. Appl Environ Microbiol. 2007; 73(22):7259-7267. [ Links ]
ONA O, IMPE JV, PRENSEN E, VANDERLEYDEN J. Growth and indole-3-acetic acid biosíntesis of Azospirillum brasilense sp. 245 is environmentally controlled. FEEMS Microbiol Lett 2005; 246: 125-132. [ Links ]
RIVES N, ACEBO Y, GARCÍA JC, RICARDO S, HEYDRICH M, HERNÁNDEZ- RODRÍGUEZ A. Caracterización de la estructura de la comunidad bacteriana asociada al cultivo del arroz (Oryza sativa) var. J-104. Revista Cubana del Arroz 2008;10(2):6. [ Links ]
ROJAS MM. Caracterización de cepas de Gluconacetobacter diazotrophicus aisladas de de variedades de caña de azúcar (Saccharum spp.) cultivadas en Cuba. Tesis de Doctorado en Ciencias Biológicas. La Habana: Facultad de Biología. Universidad de la Habana; 2005. [ Links ]
ROJAS MM, RODRÍGUEZ AJ, TRUJILLO ID, HEYDRICH M. Relationships between nitrogen fixation and auxins production in Gluconacetobacter diazotrophicus strains from different crops. Rev Colom Biotecnol. 2009;XI (1):84-93. [ Links ]
ROJAS, MM, TEJERA B, LARREA JA, MAHILLON J, HEYDRICH M. Aislamiento y caracterización de cepas de Bacillus asociadas al cultivo del arroz (Oryza sativa L.). Rev Bras Agroecol. 2011;6(1):90-99. [ Links ]
SANDBERG G, CROZIER A, ERSTERN A. Indole-3-acetic acid and related compounds. En: The principles and practices of plant hormone analysis (Rivier L., Crozier A, eds.) Academic Press, London; 1987(4). p. 160-299. [ Links ]
SHANG H, XIE Y, ZHOU X, QIAN Y, WU J. Monoclonal antibody-based serological methods for detection of Cucumber green mottle mosaic virus. Virol J. 2009;8:228-236. [ Links ]
SUMI S, MATHAI A, RADHAKRISHNAN VV. Dot-immunobinding assay. Methods Mol Biol. 2009;536:89-93. [ Links ]
SWAIN MR, NASKAR SK, RAY RC. Indole-3-acetic acid production and effect on sprouting of yam (Dioscorea rotundata L.) minisetts by Bacillus subtilis isolated from culturable cowdung microflora. Pol J Microbiol. 2007;56(2):103-110. [ Links ]
THAKURIA D, TALUKDAN NC, GOSWAMIL C, AAZARIKA S, BORO RC, KHAN MR. Characterization and screening of bacteria from rhizosphere of rice grown in acidic soils of Assam. Curr Sci. 2004;86(7):978-985. [ Links ]
TORRES-RUBIO MG, VALENCIA-PLATA SA, BERNAL-CASTILLO J, MARTÍNEZ- NIETO P. Isolation of Enterobacteria, Azotobacter sp. and Pseudomonas sp., Producers of Indol-3-Acetic Acid and Siderophores, from Colombian Rice Rhizosphere. Rev Latinoam de Microbiol. 2000;42:171-176. [ Links ]
UPADHYAY SK, SINGH DP, SAIKIA R. Genetic Diversity of Plant Growth Promoting Rhizobacteria Isolated from Rhizospheric Soil of Wheat Under Saline Condition. Currt Microbiol. 2009;59:489-496. [ Links ]