Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. vol.17 no.2 Bogotá maio/ago. 2012
INFLUENCIA DE LA AIREACIÓN EN LA ACTIVIDAD FERMENTATIVA DE Kloeckera apiculata DURANTE LA FERMENTACIÓN DE JUGO DE MANZANA
Influence of Aeration in the Fermentative Activity of Kloeckera apiculata during Fermentation of Apple Juice
WALDIR D. ESTELA-ESCALANTE1,2, Ph. D; MOJMÍR RYCHTERA1, Ph. D; KAREL MELZOCH1, Ph. D; MANUEL R. GUERRERO-OCHOA3, M.Sc.
1Institute of Chemical Technology Prague. Faculty of Food and Biochemical Technology, Department of Fermentation Chemistry and Bioengineering. Technická 5, 166 28, Praha 6-Dejvice, Czech Republic. Waldir.Desiderio.Estela.Escalante@vscht.cz
2 Universidad Nacional Micaela Bastidas de Apurímac. Escuela de Ingeniería Agroindustrial-Laboratorio de Biotecnología Agroindustrial, Apurímac, Perú.
3 Universidad Nacional Agraria La Molina. Escuela de Posgrado. Instituto de Biotecnología IBT. Lima, Perú.
Presentado el 4 de julio de 2011, aceptado el 5 de marzo de 2012, correcciones el 12 de junio de 2012.
RESUMEN
Se ha estudiado la influencia de la aireación en la actividad fermentativa de Kloeckera apiculata RIVE 9-2-1 con el objetivo de evaluar la producción de metabolitos de la fermentación. Para ello, la cepa se cultivó en frascos Erlenmeyer conteniendo jugo de manzana esterilizado y sin aroma, y los compuestos químicos producidos durante la fermentación en cultivo agitado (200 min-1) y estático (sin agitación) se determinaron. Los resultados mostraron que la agitación del medio de cultivo incrementa la producción de alcoholes superiores (hasta 591,0 mg/L) comparado al cultivo estático, mientras que por el contrario, la producción de ácido acético, etil acetato y glicerol (260,0 ± 11,0 mg/L, 196,0 ± 10,0 mg/L y 2,6 ± 0,2 g/L) resultaron ser mayores que en cultivo agitado (222,0 ± 8,0 mg/L, 96,0 ± 4,5 mg/L y 1,8 ± 0,2 g/L) respectivamente. Cultivos bacth realizados en biorreactor con un flujo de aire de 25 L/h reportaron una tasa de crecimiento (µ) de 0,17 h-1, producción de etanol (12,5 ± 2,0 g/L) y otros compuestos típicamente producidos durante la fermentación alcohólica. La concentración de oxígeno disuelto en el medio de fermentación afecta su metabolismo así, cantidades insuficientes de oxígeno provocaría un metabolismo respirofermentativo. Los mejores resultados en términos de calidad organoléptica de la bebida fermentada en lo referente al aroma, sabor y olor se obtuvieron en la fermentación en cultivo estático. El control de la aireación del medio de fermentación puede ser usado para controlar la síntesis de compuestos químicos de impacto sensorial en la producción de bebidas fermentadas.
Palabras clave: Kloeckera apiculata, fermentación alcohólica, alcoholes superiores, etilo acetato, cultivo por lote.
ABSTRACT
The influence of aireation on the fermentative activity of Kloeckera apiculata RIVE 9-2-1 was studied in order to evaluate the production of metabolites of the fermentation. To achieve this, the strain was cultured in Erlenmeyer flasks containing sterilized and aroma removed apple juice, and the chemical compounds produced during fermentation in shaken (200 min-1) and static (without agitation) cultivation were determined. The results showed that the agitation of the culture medium increases production of higher alcohols (till 591.0 mg/L) compared to static cultivation, whereas on the contrary, the production of acetic acid, ethyl acetate and glycerol (260.0 ± 11.0 mg/L, 196.0 ± 10.0 mg/L y 2.6±0.2 g/L) were higher compared to shaken cultivation (222.0 ± 8.0 mg/L, 96.0 ± 4.5 mg/L and 1.8 ± 0.2 g/L) respectively. Batch cultivations carried out in bioreactor with air flux of 25 l/h reported a growth rate (µ) of 0.17 h-1, production of ethanol (12.5 ± 2.0 g/L) and other compounds typically produced during alcoholic fermentation. The concentration of dissolved oxygen in the fermentation medium affects its metabolism thus; insufficient amounts of oxygen would provoke a respirofermentative metabolism. The best results in terms of organoleptic quality of the fermented beverage regarding to aroma, taste and flavour was obtained when fermented in static cultivation. The control of aeration during fermentation can be used to control the synthesis of chemical compounds of sensory impact in the production of fermented beverages.
Key words: Kloeckera apiculata, alcoholic fermentation, higher alcohols, ethyl acetate, batch cultivation.
INTRODUCCIÓN
Kloeckera apiculata es una levadura que predomina durante los primeros 3-4 días de la fermentación espontánea de mostos llegando a alcanzar poblaciones de hasta 107 u.f.c/mL (Heard y Fleet, 1985). Luego de ello, su actividad fermentativa se inhibe por el incremento de la concentración de subproductos de su metabolismo que actúan como agentes inhibidores como por ejemplo, el etanol (Suarez Valles et al., 2007; Zott et al., 2008). Se considera que las levaduras no-Saccharomyces contribuyen en gran medida al aroma y calidad sensorial de vinos y otras bebidas fermentadas (Fleet y Heard, 1993; Romano et al., 1992). Así, durante los primeros cuatro días de fermentación transforman los constituyentes del mosto en una variedad de subproductos que influyen en la calidad sensorial del producto (Fleet, 1999). El género Kloeckera es considerado el estadio reproductivo asexual (anamorfo) del género Hanseniaspora (estadio reproductivo sexual o teleomorfo). La distinción de géneros se realiza con base en la morfología celular, el tipo de conidiogénesis, la fisiología comparativa, las similitudes de ADN, etc. (Boekhout et al., 1994; Meyer et al., 1978). Así por ejemplo, Kloeckera apiculata es considerado ser el estado imperfecto (anamorfo) de Hanseniaspora uvarum (Meyer et al., 1978; Smith et al., 1977).
METABOLISMO DE AZÚCARES Y PRODUCCIÓN DE COMPUESTOS DE IMPORTANCIA SENSORIAL
Las levaduras Kloeckera apiculata son anaerobias facultativas, presentan un metabolismo respiratorio a condiciones aerobias, y son sensibles a la variación de la concentración de oxígeno en el medio (Venturin et al., 1994; Venturin et al., 1995a). Es una levadura Crabtree negativo, es decir cultivadas en aerobiosis y a concentraciones altas de glucosa, la oxidan en lugar de fermentarla (Rodicio y Heinisch, 2009). Sin embargo, a condiciones aerobias podría observarse la producción de productos de la fermentación como acetato y etanol en bajas concentraciones, esto se debe a que ciertas cepas presentan una baja actividad de acetil-CoA sintetasa, enzima responsable de conducir al piruvato a su oxidación completa en el ciclo de Krebs. La producción de glicerol se debe a la necesidad de equilibrar el balance redox intracelular convirtiendo el exceso de NADH2 en NAD+ generado durante la glucólisis y también como respuesta al estrés osmótico del medio (Prior y Hohmann, 1997). A condiciones anaerobias o semiaerobias sucede la fermentación alcohólica lo que conduce a la producción de etanol y a una serie de compuestos químicos de importancia sensorial. La acumulación de acetato resultaría de la insuficiente actividad de la acetil-CoA sintetasa requerida para su oxidación completa (Mason y Dufour, 2000; Venturin et al., 1995b). Varias veces se ha reportado que estas levaduras producen altas concentraciones de glicerol, de ácido acético, de ésteres y de acetoína (Caridia et al., 1991; Ciani, 1997; Plata et al., 2003; Romano et al., 1997; Rojas et al., 2001) y por el contrario bajas concentraciones de alcoholes superiores (Romano et al., 1992). Sin embargo, Herraiz et al., 1990, por el contrario reportaron que Kloeckera apiculata es capaz de producir altas cantidades de 1-propanol e isobutanol. Estudios biométricos realizados en levaduras apiculatas han demostrado la existencia de una gran diversidad de cepas con diferentes habilidades de producir ácido acético, acetaldeído y etil acetato (Romano et al., 1992; Romano et al., 1997). Por otro lado, el crecimiento de levaduras apiculatas es influenciado por factores como la temperatura y el pH (Heard y Fleet, 1988) y es afectado por la concentración de etanol alrededor de 5-6 % v/v (Kunkee, 1984; Margalith, 1981).
Los ésteres representan el mayor grupo de componentes aromáticos en vinos, en sidras y otras bebidas alcohólicas fermentadas (Suomalainen, 1981; Herraiz y Ough, 1993), y son formados principalmente mediante reacción enzimática dentro de la célula de levadura, la enzima que cataliza la reacción es la acetiltransferasa y/o éster sintasa (Yoshioka y Hashimoto, 1984; Malcorps y Dufour, 1992; Mason y Dufour, 2000). Por otro lado, los alcoholes superiores son formados durante la fermentación alcohólica a partir de los correspondientes a-cetoácidos, los cuales derivan de sus correspondientes aminoácidos (valina, leucina, isoleucina, fenilalanina, etc.) por desaminación a través de la vía de Ehrlich o a partir del metabolismo de la glucosa como precursores en la síntesis de aminoácidos (Ouchi et al., 1980; Eden et al., 2001). En términos generales, la producción de compuestos de importancia sensorial depende de la especie y cepa de levadura y de las condiciones de fermentación (Rojas et al., 2001; Plata et al., 2003; Molina et al., 2007).
El presente estudio descriptivo-experimental se realizó con el objetivo de evaluar la influencia de la aireación en la actividad fermentativa de Kloeckera apiculata RIVE 9-2-1 cultivado estáticamente (sin agitación), en agitación y bajo régimen de aireación en cultivo batch en biorreactor. Así, se determinó la concentración de los metabolitos producidos durante la fermentación de jugo de manzana y su impacto en el perfil sensorial de la bebida fermentada.
MATERIALES Y MÉTODOS
MICROORGANISMO
Se utilizó la cepa Kloeckera apiculata RIVE 9-2-1 adquirido de la colección de levaduras del Instituto de Investigación de Viticultura y Enología, Bratislava-República Eslovaca, y fue mantenido en agar extracto de malta a 7 °C con renovación periódica cada tres meses.
CULTIVO AGITADO Y ESTÁTICO (SIN AGITACIÓN)
Se utilizó jugo de manzana concentrado, esterilizado por ultrafiltración y aroma removido adquirido de Severofrukt a.s., Terezin, República Checa. El concentrado se reconstituyó con agua desionizada estéril hasta una concentración de azúcares totales de 12,8 % w/v y pH 3,8 para utilizarlo como medio de fermentación. Las fermentaciones se realizaron en cultivo agitado y estático en frascos Erlenmeyer de 0,5 L conteniendo 250 mL de medio. En las fermentaciones en cultivo agitado los frascos se agitaron a 200 min-1 durante ocho días y, aquellas en cultivo estático el tiempo de fermentación fue de 15 días. Los tiempos de fermentación se tomaron en cuenta considerando el agotamiento de azúcares fermentables en ambos casos. Todos los experimentos se realizaron a 28 °C y por triplicado. La propagación del inóculo se llevó a cabo en 100 mL de jugo de manzana estéril a 28 °C durante 24 horas, los frascos se agitaron a 200 min-1 en un agitador orbital. Las células se separaron por centrifugación (3000 min-1 durante 10 minutos) y se lavaron tres veces con solución fisiológica estéril. Los medios de fermentación se inocularon con 1,0 ± 0,1 g. de células en peso húmedo, hasta alcanzar una concentración celular inicial de aproximadamente 1x106 células/mL.
CULTIVO BATCH EN BIORREACTOR BAJO RÉGIMEN DE AIREACIÓN
Como medio de cultivo se utilizó jugo de manzana de la variedad Rubin con un contenido de azúcares totales de 13 % w/v y, pH 3,8. Las manzanas fueron adquiridas en la distribuidora de frutas y hortalizas Fruit-CZ, Praga, República Checa. El jugo de manzana fue extraído por presión y luego vertido en frascos de 10 L, se pasteurizó en un termostato a 65-70 °C por 12 horas (incluyendo el tiempo de enfriado) con la finalidad de eliminar la flora microbiana y además todos los compuestos volátiles varietales (El-Nemra et al., 1988; Su y Wiley, 1998). Luego el jugo se suplementó con KH2PO4 1,2 g/L y (NH4)2SO4 1,2 g/L como fuente de fósforo y amonio para promover el crecimiento de las células de levadura. Los cultivos se realizaron en un biorreactor (BIOSTAT-B. Braun International, Alemania) de 2 L conteniendo 1,5 L de medio de cultivo. El biorreactor estuvo conectado a una unidad de regulación y medición micro- DCU-300 y además equipado con un agitador, un medidor de pH, un termómetro y un electrodo de medición de oxígeno disuelto. Los parámetros que se mantuvieron constantes a lo largo del proceso fueron: temperatura 18 °C, frecuencia de agitación 300 min-1 y flujo de aire 25 L/h (0,2 mol O2/h). El tiempo de cultivo se dejó hasta observar el incremento de la concentración de oxígeno disuelto en el medio a su valor inicial.
El inóculo se propagó en 80 mL de medio sintético (5 % v/v) de la siguiente composición: glucosa 8,0 g/L; peptona 10,0 g/L; KH2PO4 1,2 g/L; (NH4)2SO4 1,2 g/L y extracto de levadura 10,0 g/L, el pH se ajustó a 3,6. La propagación de células se llevó a cabo en un agitador orbital a 150 min-1 durante 48 horas a 28 °C. Las células se separaron por centrifugación (3000 min-1 durante 10 minutos), se lavaron tres veces con solución fisiológica estéril y, finalmente se inocularon en el biorreactor.
MÉTODOS ANALÍTICOS
Los compuestos volátiles producidos durante la fermentación (alcoholes superiores y ésteres) se analizaron en un cromatógrafo de gases (Hewlett-Packard 5890II), equipado con una columna HP5 (30 m x 0,32 mm) y un detector FID. Las muestras fermentadas por triplicado se centrifugaron y filtraron en una membrana de microfiltración de 0,45 mm de porosidad, luego se extrajeron los compuestos volátiles mediante el método de microextracción con diclorometano (Ortega et al., 2001). Finalmente, 1 µL de cada extracto se inyectó en el cromatógrafo. El ácido acético, succínico y málico, así como el etanol, glicerol, fructosa y glucosa se analizaron en un HPLC (Bomba LCP 4000), equipado con una columna Watrex 250 x 8 mm (Ostion LGKS 0800 H+) y un detector RID. En el análisis se utilizó 0,005 M de H2SO4 como fase móvil a una velocidad de flujo de 1mL/min. Las muestras fermentadas por triplicado luego de ser filtradas y centrifugadas se diluyeron con agua desmineralizada (1:3) y se inyectaron al equipo.
La biomasa celular se determinó mediante gravimetría. Las células se separaron por centrifugación (3000 min-1 durante 10 minutos), se lavaron tres veces con agua destilada luego se secaron a 110 °C durante dos horas y finalmente se pesaron. Además, se determinaron el coeficiente global de rendimiento de biomasa YX/S, etanol YE/S y, la tasa de crecimiento (µ) respectivamente (van Hoek et al., 1998).
ANÁLISIS SENSORIAL Y ESTADÍSTICO
Se evaluaron atributos como sabor, aroma y olor usando una escala hedónica de 5 puntos (1 = me desagrada extremadamente y, 5 = me gusta mucho). Las muestras fueron evaluadas por un panel entrenado conformado por 10 jueces hombres de entre 25 y 30 años de edad. La evaluación sensorial se realizó de acuerdo a lo propuesto por Meilgaard et al., 1999. Las puntuaciones de los panelistas se presentaron como promedios aritméticos. Luego se utilizó la prueba t-Student estándar para determinar la significancia estadística (P<0,01) de las diferencias observadas entre los resultados de los dos tipos de fermentación (cultivo estático y agitado). El análisis estadístico se realizó ayudado con el software Statistica v. 8,0.
RESULTADOS Y DISCUSIÓN
CULTIVO ESTÁTICO Y EN AGITACIÓN
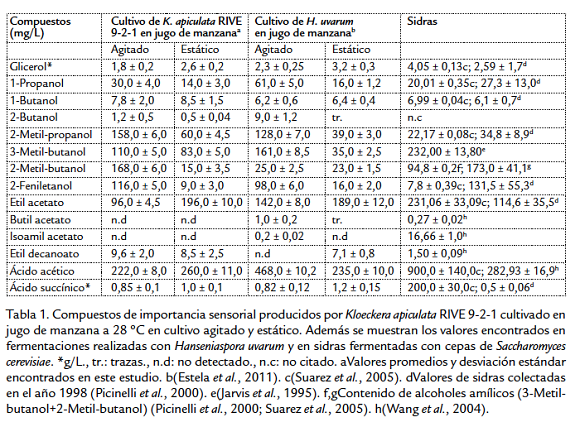
Kloeckera apiculata RIVE 9-2-1 es una levadura que produce bajas cantidades de etanol, aproximadamente 4,48 % v/v. La agitación (200 min-1) y el incremento de temperatura de fermentación mejoran la producción de etanol (resultados de experimentos no mostrados). Así mismo, durante la fermentación se producen una variedad de compuestos químicos los cuales se muestran en la Tabla 1. El glicerol es el compuesto producido en mayor cantidad tanto en cultivo agitado (1,8 ± 0,2 g/L) como en cultivo estático (2,6 ± 0,2 g/L). La menor producción en cultivo agitado (aireado) se debe a que la presencia de oxígeno en el medio promueve la respiración celular disminuyendo la producción de glicerol. Romano et al., 1997, reportó una gran variabilidad de producción de glicerol (desde 1,2 hasta 3,0 g/L) en 48 cepas de Kloeckera apiculata cultivadas estáticamente en medio sintético. Con respecto a la producción total de alcoholes superiores se observó una mayor producción en cultivo agitado (591 mg/L) comparado a lo producido en cultivo estático (190 mg/L). Así, la incorporación de oxígeno al medio durante la agitación influye en la síntesis de los alcoholes superiores. En cultivo estático (condiciones de limitación de oxígeno) estos se producen durante los primeros días de la fermentación cuando en el medio hay todavía oxígeno disponible para el metabolismo celular. En estas condiciones, el consumo de glucosa, de fructosa y de aminoácidos es relativamente alto, lo que conlleva a una mayor formación de cetoácidos los cuales son precursores de la síntesis de alcoholes superiores (Valero et al., 2002). Estudios realizados anteriormente por el autor también reportaron que la agitación (aireación) del medio influye en el incremento de la producción de alcoholes superiores en especies de levaduras no-Saccharomyces (Estela et al., 2002; Estela et al., 2007). Estudios sobre la producción de alcoholes superiores por 48 cepas de K. apiculata realizados por Romano et al., 1992, y Comi et al., 2001 en mostos de uva blanca y negra y en medio sintético mostraron una gran variabilidad en la producción de alcoholes superiores individuales, indicando que la producción de estos compuestos químicos depende en gran medida de la cepa y de la composición del medio de fermentación. Adicionalmente, ha sido demostrado que el incremento de temperatura aumenta la producción de alcoholes superiores principalmente 2-metil butanol y 3-metil butanol (Erten, 2002).
La producción de ésteres depende en gran parte de las condiciones de cultivo y la cepa de levadura. La producción de etil acetato en cultivo agitado disminuyó (96,0 ± 4,5 mg/L) comparado al cultivo estático (196,0 ± 10,0 mg/L), esto indicaría que el oxígeno tiene efecto contrario en la producción de ésteres comparado a la síntesis de alcoholes superiores. La aireación disminuiría la producción de ésteres debido a la reducción de la actividad de la acetiltransferasa y a la oxidación de acetil CoA en el ciclo de Krebs (Yoshioka y Hashimoto, 1984). Así mismo, una elevada producción de etil acetato estaría relacionado con la disponibilidad de ácido acético y etanol necesarios para su síntesis. Comi et al., 2001, reportaron gran variabilidad de producción de etil acetato entre cepas de K. apiculata, e incluso dependiendo del tipo de medio de fermentación, por ejemplo, en fermentaciones realizadas en mosto de uva negra la producción de etil acetato varió entre 27,81 y 430,5 mg/L. Adicionalmente, se observa una mayor producción de ácido acético (260,0 ± 11,0 mg/L) en cultivo estático comparado al cultivo agitado (222,0 ± 8,0 mg/L). La producción de etil acetato esta relacionado con la disponibilidad de ácido acético en el medio de fermentación. Estudios reportaron variabilidad entre cepas en la producción de ácido acético también influenciado por la composición del medio de fermentación (Comi et al., 2001; Romano et al., 1992).
A condiciones de cultivo agitado, Kloeckera apiculata RIVE 9-2-1 presentaría un metabolismo respirofermentativo el cual estaría determinado por la concentración de oxígeno disuelto en el medio de fermentación (Venturin et al., 1995a; Venturin et al., 1995b). A condiciones de limitación de oxígeno experimentaría un comportamiento respirofer- mentativo mixto que se manifiesta en la síntesis de metabolitos de la fermentación alcohólica. El cultivo de Kloeckera apiculata RIVE 9-2-1 en frascos Erlenmeyer agitados a 200 min-1 mostraría un perfil variable de transferencia de masa de oxígeno y así variaciones en su concentración en el medio (Gupta y Rao, 2003). Por otro lado, esta cepa ha mostrado un comportamiento fermentativo similar a Hanseniaspora uvarum (Tabla 1) cultivado bajo condiciones similares (Estela et al., 2011). Sin embargo, la producción de metabolitos de la fermentación depende grandemente del tipo de cepa utilizado.
El análisis estadístico de los resultados de aroma, de sabor y de olor reportaron diferencia significativa (P<0,01) entre los dos tipos de bebidas fermentadas. Los resultados de los jueces han descrito a la bebida fermentada estáticamente de mejor calidad organoléptica y aceptación con base en los atributos evaluados. Sin embargo, a la bebida cultivada en agitación la definieron como "diferente" pero no desagradable. Similar apreciación se obtuvo cuando se evaluaron sensorialmente jugo de manzana fermentado con Hanesniaspora uvarum (Estela et al., 2011). A la bebida fermentada estáticamente la definieron con más cuerpo, ligeramente ácida y picante, probablemente debido a la presencia de etil acetato y ácido acético
CULTIVO BATCH EN BIORREACTOR BAJO RÉGIMEN DE AIREACIÓN
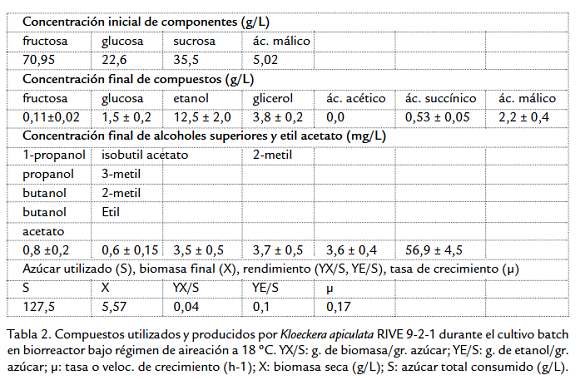
La concentración de oxígeno disuelto en el medio de cultivo es uno de los factores más importantes que influye en el metabolismo de las levaduras Crabtree negativas. Por tal razón, en el presente experimento el objetivo fue evaluar la influencia del suministro constante de aire (oxígeno) en la actividad fermentativa de la cepa estudiada durante 216 horas de cultivo en un medio exento de componentes volátiles. En la figura 1 se observa el transcurso del consumo de oxígeno disuelto, la variación del pH y el crecimiento celular de Kloeckera apiculata RIVE 9-2-1 durante el cultivo en biorreactor. Durante las primeras 10 horas la concentración de oxígeno disuelto disminuyó a valores igual a cero y así permaneció hasta la 32.a hora de cultivo. La disminución del consumo de oxígeno durante este periodo estaría relacionada con el agotamiento de algún substrato, lo que provoca la desaceleración del crecimiento. Luego, el consumo de oxígeno disminuyó durante 44 horas aproximadamente hasta la 72.a hora. Después, el consumo se incrementó y la concentración de oxígeno disuelto permaneció en valores cercanos a cero hacia el final del cultivo. El oxígeno es un inductor de la síntesis de algunas enzimas del ciclo de Krebs, así su funcionamiento conduce a la oxidación completa de la glucosa. El perfil de consumo de oxígeno por esta cepa es similar a lo reportado por Estela et al., 2011, cuando cultivaron Hanseniaspora uvarum bajo condiciones de cultivo similares. Además, se observó un incremento gradual de biomasa y la diaúxia en la 32.a hora de cultivo provocado por el agotamiento de algún substrato específico (glucosa o fructosa) lo que lleva a un corto detenimiento del crecimiento. Luego se observó un corto incremento de biomasa producto de la utilización de un segundo substrato. Aproximadamente, a partir de las 66.a hora de cultivo la población celular entró en la fase estacionaria como consecuencia del agotamiento de la subsiguiente fuente de carbono. Durante este periodo el alto consumo de oxígeno estaría relacionado con el mantenimiento de la población celular. Hacia la 112.a hora la población entró a la fase de muerte celular con la disminución de biomasa. Al final del cultivo, hacia la 212.a hora, el consumo de oxígeno disminuyó. Esta disminución estaría conectada con el agotamiento de la fuente de carbono residual.
Las variaciones de pH implican la asimilación de nitrógeno en el metabolismo respiratorio. En los resultados (Tabla 2), se observa que la velocidad de crecimiento (µ) fue 0,17 h-1 calculado entre la 16.a y la 24.a hora. Valores bajos de µ son generalmente observados en fermentaciones batch con levaduras. La presencia de productos de la fermentación como etanol (12,5 ± 2,0 g/L), glicerol (3,8 ± 0,2 g/L) y etil acetato (56,9 ± 4,5 mg/L) (Tabla 2) indicaría que la población celular bajo estas condiciones experimentó un metabolismo respirofermentativo. Para propiciar un metabolismo enteramente respiratorio debe haber en el medio, suficiente cantidad de oxígeno disuelto que no limite la respiración, para ello es necesario incrementar el flujo de aire de entrada en el biorreactor y/o incrementar la velocidad de agitación de tal manera que se incremente la concentración de oxígeno disuelto. Por otro lado, la síntesis de ácido succínico resulta de la oxidación de azúcares en el ciclo de Krebs inducido por la presencia de oxígeno. También se observó una disminución en la concentración de ácido málico (Tabla 2), esto nos indicaría que Kloeckera apiculata RIVE 9-2-1 utiliza ácido málico como fuente carbono bajo estas condiciones.
La velocidad de crecimiento (µ) es un parámetro importante que indica la velocidad con que una población microbiana se desarrolla en un medio a determinadas condiciones. Así, este valor es constante y máximo en cuanto haya exceso de substrato limitante (glucosa). Los valores bajos de rendimiento Yx/s (0,04 g de biomasa/g de azúcar) y velocidad de crecimiento (0,17 h-1) indicarían que una cantidad considerable del substrato habría sido utilizado en procesos distintos a la generación de biomasa celular, es decir en la producción de compuestos de la fermentación y/o en la producción de energía para mantenimiento (Beeftink et al., 1990). Adicionalmente, se ha realizado el análisis sensorial al producto final, los jueces la definieron como una bebida sin cualidades aromáticas, "vacío" y de sabor desagradable.CONCLUSIÓN
El oxígeno es un factor importante que influye grandemente en el metabolismo y actividad fermentativa de Kloeckera apiculata RIVE 9-2-1. La aireación del medio controla la producción de compuestos de la fermentación como glicerol, alcoholes superiores, ésteres y ácido acético. Así, el oxígeno incrementa la producción de alcoholes superiores pero por otro lado disminuye la producción de etil acetato y glicerol. La síntesis de estos compuestos puede ser controlado ajustando la velocidad de agitación (aireación). Kloeckera apiculata RIVE 9-2-1 muestra ser una cepa sensible a la concentración de oxígeno cuando necesita oxidar completamente la glucosa. Así, la limitación de la transferencia de oxígeno al medio como sucede en frascos agitados a 200 min-1 o el cultivo en biorreactor a frecuencias de agitación de 300 min-1 y flujo de aire 25 L/h (0,2 mol O2/h) no sería suficiente para provocar un metabolismo totalmente respiratorio. Más bien provocaría un metabolismo respirofermentativo con la consecuente producción de etanol, alcoholes superiores y ésteres lo que conduce a la disminución de la velocidad de crecimiento (µ). Así mismo, la cepa en presencia de oxígeno utiliza ácido málico, característica favorable porque disminuiría la acidez total de las bebidas fermentadas. Esta levadura representa un gran potencial para ser utilizada en la producción de bebidas alcohólicas con características sensoriales particulares.
AGRADECIMIENTOS
Los autores agradecen a la colección de levaduras del Instituto de Investigación de Viticultura y Enología, Bratislava, República Eslovaca por proporcionarnos la cepa de levadura estudiada.
BIBLIOGRAFÍA
BEEFTINK HH, VAN DER HEIJDEN RTJM, HEIJNEN JJ. Maintenance requirements: energy supply from simultaneous endogenous respiration and substrate consumption. FEMS Microbiol Lett. 1990;73(3):203-209. [ Links ]
BOEKHOUT T, KURTZMAN CP, O'DONNELL K, SMITH MT. Phylogeny of the yeast genera Hanseniaspora (Anamorph Kloeckera), Dekkera (Anamorph Brettanomyces), and Eeniella as inferred from partial 26s ribosomal DNA nucleotide sequences. Int J Syst Bacteriol. 1994;44(4):781-786. [ Links ]
CARIDIA T, INI V, BENEVELL MI, ZAMBONELLI C. Caratteristiche enologiche di Hanseniaspora guilliermondii. Vini d'Italia. 1991;33:51-57. [ Links ]
CIANI M. Role, oenological properties and potential use of non-Saccharomyces wine yeasts. In: Recent Research Developments in Microbiology ed. Pandalai, S.G. Trivandrum, India: Research Signpost; 1997. p. 317-331. [ Links ]
COMI G, ROMANO P, COCOLIN L, FIORE C. Characterization of Kloeckera apiculata strains from the Friuli region in Northern Italy. World J Microbiol Biotechnol. 2001;17:391-394. [ Links ]
EDEN A, VAN NEDERVELDE L, DRUKKER M, BENVENISTRY N, DEBOURG A. Involvement of branched-chain amino acid aminotransferases in the production of fusel alcohols during fermentation in yeast. Appl Microbiol Biotechnol. 2001;55:296-300. [ Links ]
EL-NEMRA SE, ISMAILA IA, ASKAR A. Aroma changes in mango juice during processing and storage. Food Chemistry. 1988;30(4):269-27. [ Links ]
ERTEN H. Relations between elevated temperatures and fermentation behaviour of Kloeckera apiculata and Saccharomyces cerevisiae associated with winemaking in mixed cultures. World J Microbiol Biotechnol. 2002;18: 373-378. [ Links ]
ESTELA W, MELZOCH K, ONDROUSEK S, HOSNEDL T, SIRISTOVA L, RYCHTERA M. Study and analysis of metabolites of sensorial importance produced by non-Saccharomyces yeasts. En: 27th World Congress on Vine and Wine and 82nd General Assembly of the International Office of Vine and Wine-OIV Bratislava, Slovak Republic, 24th - 28th June; 2002. [ Links ]
ESTELA W, RYCHTERA M, MELZOCH K, EGOAVIL E. Synthesis of compounds of sensory importance by Saccharomyces and non-Saccharomyces yeast during cider fermentation. En: 6.o Simposio internacional de alcoholes y levaduras. Bogotá, Colombia, 20 - 22 junio; 2007. [ Links ]
ESTELA ESCALANTE W, RYCHTERA M, MELZOCH K, HATTA SAKODA B, QUILLAMA POLO E, LUDEÑA CERVANTES Z, SARMIENTO CASAVILCA V, CHAQUILLA QUILCA G. Fermentative activity of Hanseniaspora uvarum and its importance in production of fermented beverages. Rev Soc Ven Microbiol. 2011;31(1): 57-63. [ Links ]
FLEET GH, HEARD GM. Yeasts-growth during fermentation. In: Wine Microbiology and Biotechnology. Fleet GH, editor. Switzerland: Hardwood Academic Publishers; 1993. p. 27-54. [ Links ]
FLEET GH. Microorganisms in food ecosystems. Int J Food Microbiol. 1999;50:101-117. [ Links ]
GUPTA A, RAO G. A study of oxygen transfer in shake flasks using a non-invasive oxygen sensor. Biotechnol Bioeng. 2003;84(3):351-358. [ Links ]
HEARD GM, FLEET GH. Growth of natural yeast flora during the fermentation of inoculated wines. Appl Environ Microbiol. 1985;50:727-728. [ Links ]
HEARD GM, FLEET GH. The effects of temperature and pH on the growth of yeast species during the fermentation of grape juice. J Appl Bacteriol. 1988;65:23-28. [ Links ]
HERRAIZ T, REGLERO G, HERRAIZ M, MARTIN-ALVAREZ PJ, CABEZUDO MD. The influence of the yeast and type of culture on the volatile composition of wines fermented without sulfur dioxide. Am J Enol Vitic. 1990;41:313-318. [ Links ]
HERRAIZ T, OUGH CS. Formation of ethyl esters from amino acids by yeasts during the alcoholic fermentation of grape juice. Am J Enol Vitic. 1993;44:41-48. [ Links ]
JARVIS B, FORSTER MJ, KINSELLA WP. Factors affecting the development of cider flavour. J Appl Bacteriol. 1995;79,5S-18S. [ Links ]
KUNKEE RE. Selection and modification of yeasts and lactic acid bacteria for wine fermentation. Food Microbiol. 1984;1:315-332. [ Links ]
MALCORPS P, DUFOUR JP. Short-chain and medium-chain aliphatic-ester synthesis in Saccharomyces cerevisiae. Eur J Biochem. 1992;210:1015-1022. [ Links ]
MARGALITH PZ. Flavor Microbiology. Springfield, Illinois: Thomas; 1981. [ Links ]
MASON AB, DUFOUR JP. Alcohol acetyltransferases and the significance of ester synthesis in yeast. Yeast. 2000;16(4):1287-1298. [ Links ]
MEILGAARD M, CIVILLE GV, CARR BT. Sensory Evaluation Techniques. Chapter III. 3rd edition. CRC Press, Boca Raton, New York; 1999. p. 22-35. [ Links ]
MEYER SA, SMITH MT, SIMIONE FP. Systematics of Hanseniaspora Zikes and Kloeckera Janke. Antonie van Leeuwenhoek. 1978;4479-4496. [ Links ]
MOLINA AM, SWIEGERS JH, VARELA C, PRETORIUS IS, AGOSIN E. Influence of wine fermentation temperature on the synthesis of yeast-derived volatile aroma compounds. Appl Microbiol Biotechnol. 2007;77:675-687. [ Links ]
ORTEGA C, LOPEZ R, CACHO J, FERREIRA V. Fast analysis of important wine volatile compounds. Development and validation of a new method based on gas chromatography-flame ionization detection analysis of dichloromethane micro extracts. J Chromatogr A. 2001;923:205-214. [ Links ]
OUCHI K, YAMAMOTO Y, TAKAGISHI M, AKIYAMA H. Regulation of isoamyl alcohol formation via Ehrlich pathway in Saccharomyces cerevisiae. J Ferment Technol. 1980;58:301-309. [ Links ]
PICINELLI A, SUAREZ B, MORENO J, RPDRIGUEZ R, CASO-GARCIA LM, MANGAS JJ. Chemical characterization of Asturian cider. J Agric Food Chem. 2000;48:3997-4002. [ Links ]
PLATA C, MILLAN C, MAURICIO JC, ORTEGA JM. Formation of ethyl acetate and isoamyl acetate by various species of wine yeasts. Food Microbiol. 2003;20:217-224. [ Links ]
PRIOR BA, HOHMANN S. Glycerol production and osmoregulation. In: Yeast sugar metabolism. Zimmermann FK, Entian KD, editores. Lancaster: Technomic Publishing; 1997. p. 313-337. [ Links ]
RODICIO R, HEINISH JJ. Sugar Metabolism by Saccharomyces and non-Saccharomyces Yeasts. In: Biology of microorganisms on grapes, in must and in wine. Helmut K, Fröhlich GUJ, editores. Germany: Springer-Verlag Berlin Heidelberg; 2009. p. 115-130. [ Links ]
ROJAS V, GIL JV, PINAGA F, MANZANARES P. Studies on acetate ester production by non-Saccharomyces wine yeasts. Int J Food Microbiol. 2001;70(3):283-289. [ Links ]
ROMANO P, SUZZI G, COMI G, ZIRONI R. Higher alcohols and acetic acid production by apiculate yeasts. J Appl Bacteriol. 1992;73:126-130. [ Links ]
ROMANO P, SUZZI G, COMI G, ZIRONI R, MAIFREDI M. Glycerol and other fermentation products of apiculate wine yeasts. J Appl Microbiol. 1997;82:615-618. [ Links ]
SMITH MTH, SIMIONE FP, MEYER SA. Kloeckera apis st. nov.; the imperfect state of Hanseniaspora guilliermondii Pijper. Antonie van Leeuwenhoek. 1977;43: 219-223. [ Links ]
SU SK, WILEY RC. Changes in apple juice flavour compounds during processing. J Food Sci. 1998;63(4):688-691. [ Links ]
SUAREZ VALLES B, PANDO BEDRINANA R, FERNANDEZ TASCON N, GONZALEZ GARCIA A, RODRIGUEZ MADRERA R. Analytical differentiation of cider inoculated with yeast (Saccharomyces cerevisiae) isolated from Asturian (Spain) apple juice. Lebens Wiss Technol. 2005;38:455-461. [ Links ]
SUAREZ VALLES B, PANDO BEDRINANA R, FERNANDEZ TASCON N, QUEROL SIMON A, RODRIGUEZ MADRERA R. Yeast species associated with the spontaneous fermentation of cider. Food Microbiol. 2007;24:25-31. [ Links ]
SUOMALAINEN H. Yeast esterase and aroma esters in alcoholic beverages. J Inst Brew. 1981;87:296-300. [ Links ]
VAN HOEK P, VAN DIJKEN JP, PRONK JT. Effect of specific growth rate on fermentative capacity of baker's yeast. Appl Environ Microbiol. 1998;64(11):4226-4233. [ Links ]
VALERO E, MOYANO L, MILLAN MC, MEDINA M, ORTEGA JM. Higher alcohols and esters production by Saccharomyces cerevisiae. Influence of the initial oxygenation of the grape must. Food Chemistry. 2002;78:57-61. [ Links ]
VENTURIN C, BOZE H, FAHRASMAEL L, MOULIN G, GALZY P. Effect of glucose and oxygen concentration on the fermentative capacity of Hanseniaspora uvarum K5 (Niehaus). Sciences des aliments. 1994;14(3):321-333. [ Links ]
VENTURIN C, BOZE H, MOULIN G, GALZY P. Influence of oxygen limitation on glucose metabolism in Hanseniaspora uvarum K5 grown in chemostat. Biotechnol Lett. 1995a;17(5):537-542. [ Links ]
VENTURIN C, BOZE H, MOULIN G, GALZY P. Glucose metabolism, enzymatic analysis and product formation in chemostat culture of Hanseniaspora uvarum. Yeast. 1995b;11(4):327-336. [ Links ]
WANG L, XU Y, ZHAO G, LI J. Rapid analysis of flavour volatiles in apple wine using Headspace Solid-Phase microextraction. J Inst Brew. 2004;110(1):57-65. [ Links ]
YOSHIOKA K, HASHIMOTO N. Ester formation by brewers yeast during sugar fermentation. Agric Biol Chem. 1984;48(2):333-340. [ Links ]
ZOTT K, MIOT-SERTIER C, CLAISSE O, LONVAUD-FUNEL A, MASNEUF- POMAREDE I. Dynamics and diversity of non-Saccharomyces yeasts during the early stages in winemaking. Int J Food Microbiol. 2008;125:197-203. [ Links ]