Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.17 no.2 Bogotá May/Aug. 2012
OBTENCIÓN DE BACTERIAS BIOTRANSFORMADORAS DE CARBÓN DE BAJO RANGO A PARTIR DE MICROHÁBITATS CON PRESENCIA DE RESIDUOS CARBONOSOS
Obtaining Low Rank Coal Biotransforming Bacteria from Microhabitats Enriched with Carbonaceos Residues
NELSON VALERO VALERO1, M.Sc.; LUZ NIDIA RODRÍGUEZ SALAZAR1, Bióloga; SANDRA MANCILLA GÓMEZ1, Microbióloga; LEYDIS CONTRERAS BAYONA1, Microbióloga.
1Grupo de Investigación en Microbiología Agrícola y Ambiental, Universidad Popular del Cesar, Cesar, Colombia. nelsonvalero@unicesar.edu.co; nidiarodri@gmail.com
Presentado el 12 de abril de 2011, aceptado el 11 de noviembre de 2011, correcciones el 4 de julio de 2012.
RESUMEN
Se aislaron bacterias con actividad biotransformadora de carbón de bajo rango (CBR) a partir de muestras ambientales con presencia de residuos de carbón en la mina "El Cerrejón". Se aislaron 75 morfotipos bacterianos de los cuales 32 presentaron crecimiento en medio sólido mínimo de sales con carbón a 5 %. Se diseño un protocolo para la selección de los morfotipos con mayor actividad biotransformadora de CBR, el protocolo incluye el aislamiento en un medio selectivo con CBR en polvo, pruebas cualitativas y cuantitativas de solubilización de CBR en medios sólidos y líquido. El mecanismo de solubilización en las cepas que producen mayores valores de sustancias húmicas (SH) estuvo asociado a cambios de pH en el medio, probablemente por la producción de sustancias alcalinas extracelulares. El mayor número de aislamientos y los aislamientos con mayor actividad solubilizadora sobre el CBR provienen de lodo con alto contenido de residuos de carbón y las rizósferas de Typha domingensis y Cenchrus ciliaris que crecen sobre sedimentos mezclados con partículas de carbón, este resultado sugiere que la obtención y capacidad de solubilización de CBR por parte de bacterias puede estar relacionada con el microhábitat donde se desarrollan las poblaciones.
Palabras clave: Solubilización, Typha domingensis, Cenchrus ciliaris, sustancias húmicas, microhábitat.
ABSTRACT
Bacteria capable of low rank coal (LRC) biotransform were isolated from environmental samples altered with coal in the mine "The Cerrejon". A protocol was designed to select strains more capable of LRC biotransform, the protocol includes isolation in a selective medium with LRC powder, qualitative and quantitative tests for LRC solubilization in solid and liquid culture medium. Of 75 bacterial strains isolated, 32 showed growth in minimal salts agar with 5 % carbon. The strains that produce higher values of humic substances (HS) have a mechanism of solubilization associated with pH changes in the culture medium, probably related to the production of extracellular alkaline substances by bacteria. The largest number of strains and bacteria with more solubilizing activity on LRC were isolated from sludge with high content of carbon residue and rhizosphere of Typha domingensis and Cenchrus ciliaris grown on sediments mixed with carbon particles, this result suggests that obtaining and solubilization capacity of LRC by bacteria may be related to the microhabitat where the populations originated.
Key words: Solubilization, TTypha domingensis, Cenchrus ciliaris, humic substances, microhabitat.
INTRODUCCIÓN
Los carbones de bajo rango (CBR) como el subbituminoso y el lignito, se originaron mediante un proceso de carbonificación incompleto; en el cual la lignina procedente de restos vegetales se transformó parcialmente dando como resultado un material con alto contenido de sustancias húmicas (SH) (Schmiers y Ktipsel, 1997), debido a que los factores que producen el proceso de carbonificación son variables, el porcentaje de CBR es distinto en cada veta. Durante la extracción de carbón en minas a cielo abierto el CBR y el material rocoso son removidos y dejados en pilas de almacenamiento, que posteriormente serán usados en el relleno de la hondonada finalizado el proceso de extracción. Existe evidencia que el CBR puede ser biostransformado por acción de diferentes hongos involucrados en la degradación de la lignina (Hofrichter et al.,1999; Fakoussa y Hofrichter, 1999; Yuan et al., 2006); y algunas bacterias como Escherichia freundii, Pseudomonas rathonis, Pseudomonas fluorescens, Streptomyces setoni, Pseudomonas putida, Bacillus, Staphylococcus y Rhodococcus (Laborda et al., 1997; Machnikowska et al., 2002; Pokorny et al., 2005), como producto de la biotransformación se generan sustancias con características similares a las SH extraídas químicamente (Filip y Kubát, 2001). La biotransformación se ha considerado como una alternativa potencial para el aprovechamiento del CBR, con el propósito de generar productos de valor agregado con variadas aplicaciones como la obtención de combustibles líquidos, moléculas para síntesis química y la producción de SH que pueden ser utilizadas como enmiendas orgánicas para el suelo (Gianoulli et al., 2008).
Hasta la fecha, todas las bacterias biotransformadoras de carbón reportadas han sido aisladas directamente de muestras de carbón, tanto en su superficie como el interior (Laborda et al., 1997; Pokorny et al., 2005; Bulankina et al., 2007; Yossifova et al., 2011). El análisis de material rocoso generado en la excavación para la extracción de carbón, mezclado con partículas de lignito, ha demostrado que estas partículas de carbón actúan como la única fuente de materia orgánica y puede ser degradado y utilizado por los microorganismos en el suelo (Waschkies y Hüttl, 1999). En suelos reconstruidos en minas de carbón clausuradas, se demostró que parte del carbono estabilizado en la materia orgánica humificada proviene de residuos del carbón (Dick et al., 2006); Rumpel et al., 2001, demostraron que en suelos rehabilitados en antiguas minas de carbón, además de los aportes de residuos orgánicos provenientes de la vegetación, también los residuos de lignito pueden ser humificados a razón de 0,25 g.kg de suelo-1. Año-1, tras el establecimiento de la comunidad microbiana.
Considerando que la humificación es un proceso mediado por la microbiota (Masciandaro y Ceccanti, 1999), las anteriores evidencias conducen a pensar que en microhábitats influenciados por residuos de la minería de carbón, se han establecido microorganismos con capacidad para aprovechar estos residuos como fuente de carbono, mediante su biotransformación. Bajo el anterior supuesto, se realizo el presente trabajo de carácter exploratorio y descriptivo, cuyo objetivo fue determinar la presencia de bacterias con capacidad para biotransformar CBR en sustratos con alto contenido de carbón, en ambientes influenciados por las actividades de extracción, lavado y almacenamiento de carbón, con el propósito de contribuir con el desarrollo de estrategias de aprovechamiento del carbón residual generado en las minas de carbón, como posible fuente de materia orgánica para la rehabilitación de suelos, mediante su biotransformación in situ.
MATERIALES Y MÉTODOS
MUESTRAS DE CARBÓN Y SUSTANCIAS HÚMICAS
El CBR utilizado se colectó en el manto 40 del frente de extracción denominado "Tajo Patilla" en la mina "El Cerrejón", localizado a 11°05'45,54" latitud norte y 72° 40'66,55" longitud oeste, en el departamento de La Guajira. Las muestras fueron tamizadas para obtener partículas de 2,36 mm y 300 µm y las partículas fueron esterilizadas en autoclave a 121 °C/15 lb por 15 minutos (Pyne et al., 1987).
Para el pretratamiento oxidativo las partículas de CBR se sumergieron en HNO3 (Machinikowska et al., 2002) 10 %, 48 horas, luego fueron lavadas con agua destilada hasta retirar completamente la coloración oscura del sobrenadante y esterilizadas a 121 °C/15 lb por 15 minutos. Para la extracción de las SH del CBR se siguió el protocolo descrito por Sharif, 2002, con modificaciones, usando como extractante NAOH 0,5 M, relación 1/10 p/v y tiempo de reacción de 10 h a 100 °C.
RECOLECCIÓN Y PROCESAMIENTO DE MUESTRAS
Las bacterias fueron aisladas de diferentes zonas influenciadas por la actividad de extracción, beneficio y almacenamiento de carbón en la mina "El Cerrejón", en una zona de vida de bosque seco tropical con temperaturas del suelo entre los 27 y 30 °C. Se colectaron 6 muestras: M1, carbón de bajo rango; M2 suelo del horizonte A colectado a 20 cm de profundidad en un relicto de bosque nativo conservado, adyacente al frente de extracción de carbón; M3 sedimentos carbonosos procedente del lavado del carbón; M4 rizósfera de Typha domingensis, una gramínea que prolifera en áreas de acumulación de los sedimentos carbonosos procedentes del lavado del carbón; M5 rizósfera de Pasto Buffel (Cenchrus ciliaris), que coloniza un sustrato compuesto por restos del material rocoso triturado que se genera en el proceso de excavación, en mezcla con partículas de carbón que se fugan de un patio de almacenamiento de carbón adyacente; M6 agua residual procedente del lavado de carbón. Se colectaron muestras integradas por 3 submuestras de 500 g y se mantuvieron en refrigeración a 4 °C hasta su procesamiento en laboratorio.
AISLAMIENTO DE BACTERIAS CON ACTIVIDAD BIOTRANSFORMADORA DE CBR
Para el aislamiento de las bacterias, las muestras fueron procesadas mediante dos técnicas diferentes, siembra en superficie sin enriquecimiento (SSSE) y siembra en superficie con enriquecimiento previo (SSCE). En la SSSE, a partir de 10g de cada muestra en 90 ml de solución salina (NaCl 0,85 %), se inocularon 100 µl de las diferentes soluciones sobre agar nutritivo (Oxoid; sales g.L-1): Peptona 5,0, NaCl 5,0, extracto de levadura 2,0, adicionado con CBR de tamaño 300 µm al 5 % (ANC5) y se incubaron a 37 °C hasta conseguir el crecimiento del mayor número posible de colonias diferentes. Para la SSCE, a partir de 10 g de cada muestra en 90 ml de solución salina, se inocularon 100 µL en dos medios de enriquecimiento; el medio uno caldo mínimo de sales con CBR a 5 % (CMSC5; sales mg.L-1): NH4NO3 2,5, KH2PO4 1,75, MgSO4 0,75, K2HPO4 0,75, NaCl 0,25, ZnSO4 0,088, FeCl3 0,08, CuSO4 0,016, MnCl2 0,014, MoO3 0,007, Co(NO3)2 0,005, CBR (300 µm) 5 g.L-1); el medio dos fue caldo nutritivo con CBR al 5 % (CN5); los cultivos de enriquecimiento se mantuvieron en agitación a 350 rpm por 8 días a 30 °C; posteriormente se realizaron diluciones seriadas y se sembraron sobre dos medios de cultivo, en ANC5 se sembraron las muestras del enriquecimiento en CN5 y en el medio AMSC5 las muestras del enriquecimiento en CMSC5, se incubaron a 37 °C hasta conseguir el crecimiento del mayor número posible de colonias diferentes. Los diferentes morfotipos bacterianos purificados fueron conservados en medio AMSC5 a 4 °C, para utilizarlos en los ensayos posteriores.
PRUEBA DE SOLUBILIZACIÓN DE CBR EN MEDIO SÓLIDO
Sobre cultivos bacterianos masivos de 24 horas en agar nutritivo, se colocaron partículas de CBR de 2,36 mm sin tratamiento y tratadas con HNO3, se incubaron por 48 horas a 30 °C y se determinó la solubilización midiendo el diámetro del halo de color café oscuro formado alrededor de la partícula de carbón.
SOLUBILIZACIÓN DE CARBON EN MEDIO LÍQUIDO
Se tomaron cultivos bacterianos de 24 horas en caldo nutritivo y se agregaron 10 % (p/v) de partículas de CBR con tamaño menor a 300 µm, tratado y sin tratar con HNO3, los cultivos fueron incubados en agitación por 7 días a 25 °C, se centrifugó a 3.200 rpm por 10 min y se midió la absorbancia del sobrenadante a 465 nm para determinar la presencia de SH producidas por la solubilización del CBR (Oboiren et al., 2008). Se midió el pH inicial y final del medio de cultivo. La pérdida de peso del CBR, se determinó lavando por triplicado el CBR residual en agua destilada y secándolo a 105 °C hasta obtener peso constante. La concentración de las sustancias solubles con absorbancia a 465 nm, producidas a partir del CBR, se determinó mediante una curva de interpolación, elaborada con la absorbancia de soluciones de concentración conocida de las SH obtenidas en un ensayo previo.
RESULTADOS
AISLAMIENTO
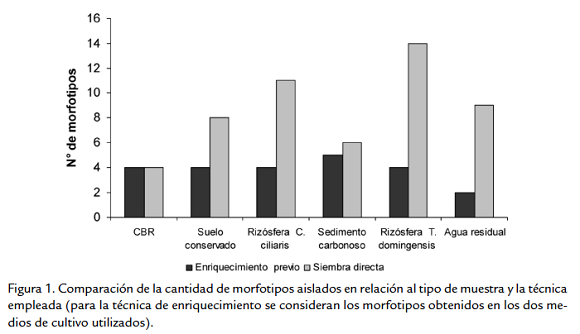
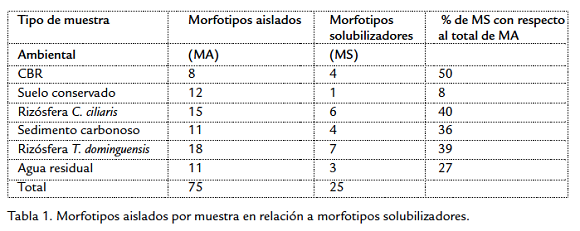
A partir del aislamiento primario se obtuvieron 75 morfotipos que crecieron en medio ANC5, la mejor técnica de aislamiento es la siembra en superficie sin enriquecimiento previo (Fig. 1). De los 75 morfotipos, aislados por la diferentes técnicas, 32 presentaron crecimiento en agar mínimo de sales con CBR al 5 % (AMSC5) como única fuente de carbono. Al comparar el número de aislamientos con su capacidad de solubilizar en medio líquido se encuentra que la mayor cantidad de morfotipos con capacidad solubilizadora fueron aislados de las rizosferas de C. ciliaris y T. dominguensis (Fig. 1; Tabla 1), y la muestra con mayor número de bacterias solubilizadoras con respecto al número total aislado se presentó en la muestra de carbón (Tabla 1).
SOLUBILIZACIÓN DE CBR SOBRE MEDIO SÓLIDO
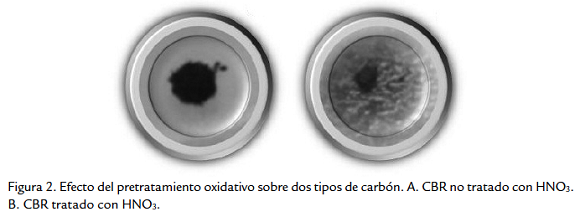
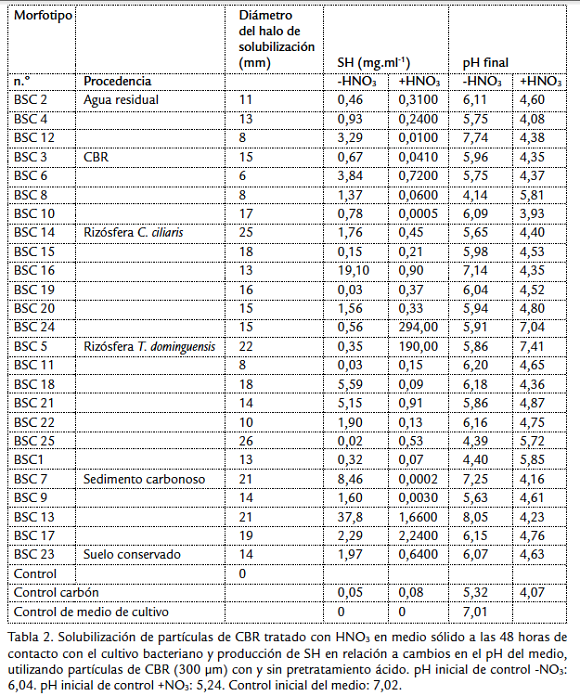
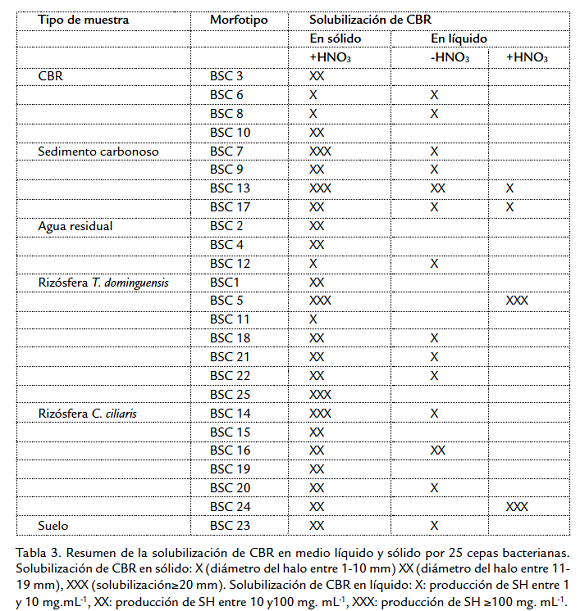
En la prueba cualitativa, de los 32 morfotipos evaluados 25 generaron halo de color café a marrón con CBR tratado y ninguno generó este halo para el CBR sin tratar (Fig. 2a), en el tratamiento de las muestras de CBR con HNO3 se observa solubilización como un halo de color café que rodea la muestra de carbón (Fig. 2b). El diámetro del halo de solubilización de los diferentes aislamientos alcanzó valores entre 6 y 26 mm a las 48 horas, cinco aislamientos fueron los que mejor solubilizaron el CBR, BSC5 y BSC25 procedentes de rizósfera T. dominguensis, BSC14 de rizósfera C. ciliaris, y BSC7 y BSC13 del lodo carbonoso (Tabla 2).
SOLUBILIZACIÓN DE CBR EN MEDIO LÍQUIDO
De las 25 cepas evaluadas 22 presentaron una concentración de SH en el medio mayor que el control, utilizando el carbón sin tratamiento ácido y 18 cepas utilizando el carbón tratado con HNO3, se obtuvieron los mayores valores de producción de SH utilizando el CBR tratado con ácido, y la mayor actividad por dos aislamientos bacterianos aislados de rizósfera, estos fueron BSC24 aislada de C. ciliaris con producción de SH de 294 mg.mL-1 y BSC 5 aislada de T. dominguensis con producción de SH de 190 mg.mL-1 (Tabla 2); sin embargo el 76 % de las cepas producen más SH con el CBR sin tratar, aún cuando los valores son tan altos como para las cepas BSC24 y BSC5, los valores máximos de producción de SH utilizando CBR sin tratar son de 37,8 mg.mL-1 para BSC13 aislada de sedimento carbonoso y 19,1 mg. mL-1 para BSC 16 aislada de rizósfera de C. ciliaris (Tabla 2). Tanto para la prueba con carbón tratado como sin tratamiento ácido, los valores más altos de SH se presentan en los medios con pH finales superiores a 7 utilizando el carbón tratado (Tabla 2). Utilizando CBR sin tratamiento ácido se observa la producción de SH con disminución de pH en el medio por parte de las cepas BSC1 aislada de rizósfera T. dominguensis y BSC8 aislada de CBR con valores de 0,32 y 1,37 mg de SH. mL-1 (Tabla 2).
DISCUSIÓN
La evidencia experimental muestra que el método de siembra directa sin enriquecimiento previo fue en el que se aisló la mayor cantidad de morfotipos con capacidad de biotransfomar carbón, se sabe que las diferencias en el desarrollo de los microorganismos está basado en aspectos nutricionales o en inhibición (Tabacchioni et al., 2000; Mohamed et al., 2005), probablemente la siembra directa es más efectiva, porque previene la selección de poblaciones bacterianas que pueden desarrollarse y competir por nutrientes, inhibiendo el crecimiento de otras poblaciones.
Las bacterias presentan una mejor solubilización en medio sólido, Bumpus, et al. 1998, observaron el mismo fenómeno, lo explican por el hecho de que la difusión de los metabolitos celulares en medio sólido puede ocurrir relativamente lento, aumentando su concentración localmente. Varios experimentos en hongos han demostrado también que la diferencia en la concentración de nutrientes (Bumpus, et al., 1998) o iones como N y Mn (Hofrichter y Fritsche, 1997) influyen en la producción de enzimas solubilizadoras de carbón y se ha visto que la condiciones nutricionales pueden promover la producción de iones oxalato y metales queladores que son conocidos por su efecto solubilizador de carbón (Bumpus et al., 1998), esta evidencia apoya el hecho de empezar la selección con medio sólido para estimar las cualidades de las bacterias.
Se ha reportado que existen bacterias que pueden crecer utilizando carbón como única fuente de carbono (Hofrichter y Fakoussa, 2001), teniendo en cuenta que las características y composición del sustrato sobre el que se desarrollan las poblaciones bacterianas influyen sobre la actividad de los microorganismos que lo habitan, se puede suponer que es mayor la probabilidad de aislar bacterias con capacidad biotransformadora de carbón a partir de este mismo material; probablemente por esta razón se observa una mayor proporción de bacterias solubilizadoras de carbón (50 %) con respecto al total de morfotipos aislados del CBR (Tabla 1), sin embargo, los resultados muestran que la mayor cantidad de cepas solubilizadoras de carbón proceden de la rizosfera de plantas que crecen en ambientes con partículas de carbón; las cepas con mayor actividad (Tabla 3) también proceden de estas muestras y de la muestra de sedimento carbonoso sobre el cual crece T. dominguensis. De los aislamientos procedentes de rizósfera, dos presentan los mayores valores en la producción de SH en medio líquido (Fig. 3), BSC24 (Bacillus mycoides) aislada de C. ciliaris y BSC5 (Enterobacter aerógenes) aislada de T. dominguensis, estos resultados se pueden relacionar con investigaciones que muestran la presencia de mayor actividad enzimática en terrenos con vegetación comparados con terrenos sin vegetación, en áreas rehabilitadas post minería (Tscherko et al., 2004; Baldrian et al., 2008).
Al respecto se ha reportado que en suelos rehabilitados de minas clausuradas, el contenido de nutrientes y biomasa microbiana está relacionada con los cambios en la vegetación (Frouz et al., 2008), se puede explicar esta interacción por el hecho de que las poblaciones de microorganismos del suelo están relacionadas con factores bióticos, como las comunidades de plantas, y abióticos, como la estructura del suelo y sus nutrientes, estos factores aumentan la heterogeneidad y actividad de las poblaciones microbianas (Ettema y Wardle, 2002). También se ha descrito que la solubilización microbiana del carbón a menudo requiere de fuentes de carbono y nitrógeno suplementarias (Hofrichter y Fritsche, 1997; Waschkies y Hüttl, 1999), está documentado que en ambientes limitantes se potencializan las interacciones positivas entre plantas y microorganismos de la rizósfera (Frouz y Novakova, 2005); lo anterior permite sugerir que en el sedimento carbonoso, las raíces de las plantas aportan exudados que favorecen la actividad de los microorganismos rizosféricos para utilizar el carbón del medio y solubilizar SH, a cambio quizá las plantas se beneficien mediante la bioactividad que se ha asociado a las SH, desencadenando efectos similares a los de las auxinas y promueven el desarrollo vegetal (Pasqualoto et al., 2002). Comparando del comportamiento de los aislamientos en todas las pruebas, las cepas con mejores resultados son BSC13 y BSC17 (Tabla 3), las dos cepas son aisladas de lodo carbonoso y aumentan el pH del medio, BSC13 alcaliniza el medio hasta un pH de 8,05 (Tabla 2); aunque el sedimento carbonoso fue uno de los sustratos que aportó menor número de aislamientos, las bacterias aisladas de esta zona tienen una alta capacidad de solubilización, Ettema y Wardle, 2002, explican que los patrones espaciales de la biota del suelo son dinámicos y muestran usualmente grandes fluctuaciones, sin embargo como consecuencia de la movilidad limitada de los microorganismos del suelo y de la complejidad de su matriz cobra importancia la competencia como una fuerza que restringe a pequeña escala los competidores que usan el mismo espacio, estas observaciones se pueden relacionar con los resultados de Felske y Akkermans, 1998, donde muestran que la variabilidad espacial de la actividad metabólica de un tipo bacteriano específico fue mayor que la variabilidad espacial de la abundancia de estas especies.
En cuanto a el posible mecanismo de solubilización de los aislamientos existe una relación entre la alcalinización del medio y la cantidad de SH producidas, la solubilización alcalina de CBR fue el primer mecanismo de biotransformación microbiana de carbón descubierto (Quigley et al., 1988), este tipo de solubilización es atribuido a un alto contenido de grupos carboxílicos en los ácidos húmicos del carbón los cuales pueden ser deprotonados a pH superiores a 8 (Hofrichter y Fakoussa, 2001), en cultivos de Penicillium decumbens se observó que el aumento de pH se relaciona con el aumento en la solubilización de lignito, relacionado con la producción de sustancias alcalinas (Yuan et al., 2006).
Aunque en las bacterias con mayor capacidad de solubilización de CBR el mecanismo parece estar relacionado con la producción de sustancias alcalinas, en varias cepas se observó la solubilización de CBR con disminución de pH; al respecto se ha reportado que existen otros mecanismos de transformación del carbón mediados por enzimas que se producen a pH menores de 6 o a la producción de surfactantes (Hofrichter y Fakoussa, 2001). Sin embargo, el hecho de observar producción de SH con aumento y disminución de pH en el medio, muestra la adaptación de una comunidad microbiana con variados mecanismos para solubilizar CBR en ambientes con alto contenido de residuos de carbón. En otros casos se observó que la concentración de las SH disueltas disminuyó frente al control con y sin aumento de pH, este fenómeno puede ser debido a la depolimerización de las SH que habían sido liberadas del CBR, Ralph y Catcheside, 1997, mostraron que la incubación de macromoléculas solubilizadas del carbón en un medio con peroxidasas de P. chrysosporium promueve la depolimerización y producen una disminución de la absorbancia a 465 nm.
Las bacterias aisladas en este estudio tienen la capacidad de solubilizar el CBR con y sin un tratamiento oxidativo previo con HNO3, este agente oxidante facilita la solubilización debido a la disminución de las relaciones C/H y C/O, que promueven un cambio en la conformación de los ácidos húmicos del carbón, formando unidades más pequeñas que facilitan los procesos de solubilización (Vlckova et al., 2009), sin embargo el hecho de que algunos aislamientos tengan la capacidad de solubilizar el carbón sin oxidación previa con HNO3 es un buen marcador de selección de las mejores cepas (Tabla 3). Los resultados obtenidos muestran que los microorganismos seleccionados se han adaptado y sus poblaciones han proliferado en los ambientes donde el carbón está presente en alta cantidad y que existe relación entre el sustrato evaluado y la detección de bacterias con capacidad de solubilizar carbón, de acuerdo a lo anterior se observa que a partir de la muestra de suelo conservado solo se obtuvo un aislamiento con capacidad biosolubilizadora de carbón pero con baja actividad. Estos resultados demuestran que el microhábitat del cual se aíslan los microorganismos tiene impacto sobre su capacidad y probablemente sobre los mecanismos de solubilización de CBR in vitro; finalmente el hecho de encontrar poblaciones bacterianas que solubilizan carbón en ambientes como la rizósfera, con la producción de SH, permite suponer la posibilidad de biotransformación del carbón en el suelo, especialmente en áreas de rehabilitación de tierras tras el cierre de las minas, como una estrategia para el aprovechamiento de este subproducto de la minería de carbón, con posibles beneficios para el suelo y las plantas, relacionados con los efectos positivos de las SH sobre las propiedades físicas y químicas del suelo y los efectos fisiológicos benéficos sobre las pantas.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a Colciencias, a Carbones del Cerrejón Limited y a la Universidad Popular del Cesar por el financiamiento de la investigación, y a los Laboratorios de Ingeniería Ambiental y Microbiología de la Universidad Popular del Cesar por su cooperación técnica.
BIBLIOGRAFÍA
BALDRIAN P, TRO J, FROUZ J, JAROSLAV S, VENDULA V, MERHAUTOVA V, et al. Enzyme activities and microbial biomass in topsoil layer during spontaneous succession in spoil heaps after brown coal mining. Soil Biol Biochem. 2008;40(9):2107-2115. [ Links ]
BULANKINA M, LYSAK V, ZVYAGINTSEV D. Lignite microorganisms. Biology Bull. 2007 34(2):194-197. [ Links ]
BUMPUS J, SENKO J, LYND G, MORGAN R, STURM K, STIMPSON J, ROE S. Biomimetic solubilization of a low rank coal: Implications for its use in methane- production. Energ Fuel. 1998;12:664-671. [ Links ]
DICK D, KNICKER H, AVILA L, INDA A, GIASSON V, BISSANI E. Organic matter in constructed soils from a coal mining area in southern Brazil. Org Geochem. 2006;37:1537-1545. [ Links ]
ETTEMA C, WARDLE D. Spatial soil ecology. Trends Ecol Evol. 2002;17(4)117-183. [ Links ]
FAKOUSSA R, HOFRICHTER M. Biotechnology and microbiology of coal degradation. Appl Microbiol Biotechnol. 1999;52:25-40. [ Links ]
FELSKE A, AKKERMANS A. Spatial homogeneity of abundant bacterial 16S rRNA molecules in grassland soils. Microb Ecol. 1998;36:31-36. [ Links ]
FILIP Z, KUBÁT J. Microbial utilization and transformation of humic substances extracted from soils of long-term field experiments. Eur J Soil Biology. 2001;37:167-174. [ Links ]
FROUZ J., NOVAKOVA A. Development of soil microbial properties in topsoil layer during spontaneous succession in heaps after brown coal mining in relation to humus microstructure development. Geoderma. 2005;129:54-64. [ Links ]
FROUZ J, PRACH K, PIZL V, HÁN L L, STARÝ J, TAJOVSKÝ K, MATERNA J, BALÍK V, KAL ÍK J, EHOUNKOVÁ, K. Interactions between soil development, vegetation and soil fauna during spontaneous succession in post mining sites. Eur J Soil Biol. 2008;44:109-121. [ Links ]
GIANOULLI A, KALAITZIDIS S, SAVALAS G, ATZIAPOSTALAU A, CHRISTANIS K, PAPAZISIMOU S, et al. Evaluation of Greek low-rank coals as potential raw material for the production of soil amendments and organic fertilizers. Int J Coal Geol. 2008;77(3-4):383-393. [ Links ]
HOFRICHTER M, FAKOUSSA R. Microbial degradation and modification of coal. En: Hofrichter M, Steinbüchel A. (eds) Biopolymers. Vol. 1 - Lignin, Humic Substances and Coal. Wiley-VCH, Weinheim; 2001. p. 393-429. [ Links ]
HOFRICHTER M, FRITSCH A. Depolymerization of low-rank coal by extracellular fungal enzyme systems II. The ligninolytic enzymes of the coal-humic-acid- depolymerizing fungus Nematoloma frowardii b19. Appl Microbiol Biotechnol. 1997;47(4):419-424. [ Links ]
HOFRICHTER M, ZIEGENHAGEN A, SORGE A, ULLRICH A, BUBLITZ A, FRITSCHE W. Degradation of lignite (low-rank coal) by ligninolytic basidiomycetes and their manganese peroxidase system. Appl Microbiol Biotechnol. 1999;52:78-84. [ Links ]
LABORDA F, FERNANDEZ M, LUNA N, MONISTROL Y. Study of the mechanisms by which microorganisms solubililize and/or liquefy Spanish coals. Fuel Process Technol. 1997;52(1-3)35-107. [ Links ]
MACHNIKOWSKA H, PAWELEC A, PODGORSKA A. Microbial degradation of low rank coals. Fuel Process Technol. 2002;(77- 78)17-23. [ Links ]
MASCIANDARO G, CECCANTI B. Assessing Soil Quality in Different Agro- Ecosystems Through Biochemical and Chemico-Structural Properties of Humic Substances. Soil Till Res. 1999;51:129-137. [ Links ]
MOHAMED M, RANJARD L, CATROUX C, CATROUX G, HARTMANN A. Effect of natamycin on the enumeration, genetic structure and composition of bacterial community isolated from soil sand soybean rhizosphere. J Microb Meth. 2005;60:31-40. [ Links ]
OBOIRIEN B, BURTON S, COWAN D, HARRISON S. The effect of the particulate phase on coal biosolubilisation mediated by Trichoderma atroviride in a slurry bioreactor. Fuel Process Technol. 2008;89(2):123-130. [ Links ]
PASQUALOTO L, OLIVARES F, OKOROKOVA-FACANHA A, ROCHA A. Humic Acids Isolated from Earthworm Compost Enhance Root Elongation, Lateral Root Emergence, and Plasma Membrane H -ATPase Activity in Maize Roots. Plant Physiol. 2002;130:1951-1957. [ Links ]
POKORNÝ R, OLEJNÍKOVÁ P, BALOG M, ZIFCÁK P, HÖLKER U, JANSSEN M, et al. Characterization of microorganisms isolated from lignite excavated from the Zahorie coal mine (southwestern Slovakia). Res Microbiol. 2005;156(9):932-943. [ Links ]
PYNE J, STEWART D, FREDRICKSON J, WILSON B. Solubilization of Leonardite by an Extracellular Fraction from Coriolus versicolor. Appl Environ Microb. 1987;53(12):2844-2848. [ Links ]
QUIGLEY D, WEY J, BRECKENRIDGE C, STONER D. The influence of pH on biological solubilization of oxidised low rank coal. Science Direct. 1988;1:163-174. [ Links ]
RALPH J, CATCHESIDE D. Transformations of low rank coal by Phanerochaete chrysosporium and other wood-rot fungi. Appl Microbiol Biotechnol. 1997;52:79-93. [ Links ]
RUMPEL C, GROOTES P, KÖGEL-KNABNER I. Characterization of the microbial biomass in lignite-containing mine soils by radiocarbon measurements. Soil Biol Biochem. 2001;33(14):2019-2021. [ Links ]
SCHMIERS H, KTIPSEL R. Macromolecular structure of brown coal in relationship to the degradability by microorganisms. Fuel Process Technol. 1997;52:109-114. [ Links ]
SHARIF M. Effect of lignitic coal derived humic acid on growth and yield of wheat and maize in alkaline soil. Universidad de Peshawar [Tesis de doctorado]. Pakistan: NWFP Department of soil and enviromental Science. Faculty of crop production Science. Agricultural University Peshawar; 2002. [ Links ]
TABACCHIONI S, CHIARINI L, BEVIVINO A, CANTALE C, DALMASTRI C. Bias caused by using different isolation media for assessing the genetic diversity of a natural microbial population. Microb Ecol. 2000;40:169-176. [ Links ]
TSCHERKO D, HAMMESFAHR U, MARX M, KANDELER E. Shifts in rhizosphere microbial communities and enzyme activity of Poa alpina across an alpine chrono- sequence. Soil Biol Biochem. 2004;36:1685-1698. [ Links ]
VLCKOVA Z, GRASSET L, ANTOSOVA B, PEKAR A M, KUCERIK J. Lignite pretreatment and its effect on bio-stimulative properties of respective lignite humic acids. Soil Biol Biochem. 2009;41:1894-1901. [ Links ]
WASCHKIES C, HÜTTL R. Microbial degradation of geogenic organic C and N in mine spoils. Plant Soil. 1999;213:221-230. [ Links ]
YOSSIFOVA M., VALCEVA S., NIKOLOVA S. Exogenic microbial activity in coals. Fuel Process Technol. 2011;92(4): 825-835. [ Links ]
YUAN H, YANG J, CHEN W. Production of alkaline materials, surfactants and enzymes by Penicillium. Fuel. 2006;85(10-11):1378-1382. [ Links ]