Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.17 no.2 Bogotá May/Aug. 2012
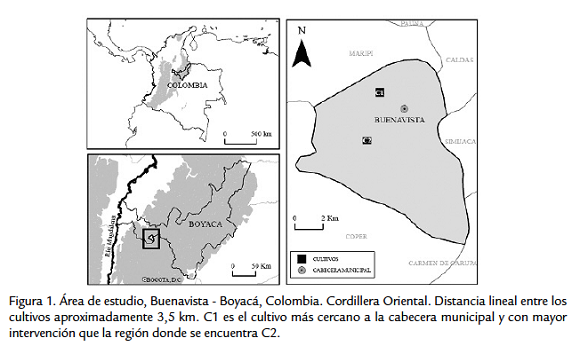
EFECTOS DE LA VARIACIÓN ALTITUDINAL SOBRE LA POLINIZACIÓN EN CULTIVOS DE GULUPA (Passiflora edulis F. edulis)
Effects of Altitudinal Variation on Pollination in Purple Passion Fruit Crops (Passiflora edulis F. edulis)
JULIÁN MEDINA-GUTIÉRREZ1, Biólogo; RODULFO OSPINA-TORRES1, Ph. D; GUIOMAR NATES-PARRA1, M. Sc.
1 Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, Colombia. julianmedina86@gmail.com, rospinat@unal.edu.co, mgnatesp@unal.edu.co. Autor para correspondencia: Guiomar Nates Parra: mgnatesp@unal.edu.co
Presentado el 5 de marzo de 2012, aceptado el 9 de mayo de 2012, correcciones e 7 de mayo de 2011.
RESUMEN
El propósito de este trabajo es reconocer y diferenciar las especies visitantes y los verdaderos polinizadores de dos cultivos de gulupa (Passiflora edulis f. edulis Sims.) ubicados a diferente altitud (2225 msnm y 1657 msnm) en el municipio de Buenavista - Boyacá cordillera Oriental de Colombia. En los dos cultivos se encontraron diferencias en composición, en número de visitantes y en polinizadores. En el cultivo ubicado a 2225 msnm, se registraron siete especies, mientras que en el cultivo ubicado a 1657 msnm, se encontraron 18 especies de visitantes. Se realizaron observaciones del recurso colectado por los visitantes y la estructura floral con la que el visitante entra en contacto. Además, se realizaron cuatro tratamientos experimentales de biología floral: polinización pasiva, polinización natural, polinización manual y eficiencia de polinizadores mediante "visitas únicas", concluyendo que las especies polinizadoras son: en C1 Apis mellifera, y en C2 Xylocopa frontalis, Xylocopa lachnea y Epicharis sp.
Palabras clave: Colombia, Passiflora edulis f. edulis, gulupa, polinización, visitantes florales.
ABSTRACT
The purpose of this paper is to study in two crops of purple passionfruit Passiflora edulis f. edulis harvested at different altitudes (2225 m.a.s.l. and 1657 m.a.s.l.) in the municipality of Buenavista - Boyacá, located in the eastern Mountain range of Colombia, in order to familiarize with visitors and pollinators. This study reveals that in both crops there were differences found in composition, the number of visitors and pollinators. In the crop at 2225 m.a.s.l., 7 species were registered, while 18 species were recorded at the 1657 m.a.s.l. crop. In order to achieve this, collected material by the visitors and the floral structures with which they approach, were observed; at the same time four experiments took place: passive pollination, natural pollination, manual pollination and pollinator's efficiency. These experiments established that pollinator species are: in C1 Apis mellifera, and in C2 and Xylocopa frontalis, Xylocopa lachnea and Epicharis sp.
Key words: Colombia, Passiflora edulis f. edulis, purple passion fruit, pollination, floral visitors.
INTRODUCCIÓN
El género Passiflora es el más importante dentro de la familia Passifloraceae, tanto por el número de especies (530) como por su importancia económica. Este género presenta una distribución principalmente neotropical (Ulmer y MacDougal, 2004) cuyo centro de diversificación son los Andes de Colombia y Ecuador. En Colombia se registran 162 spp. (Ocampo et al., 2007), que se distribuyen desde el nivel del mar hasta los subpáramos y desde el bosque pluvial hasta las zonas semiáridas de la Guajira (Escobar, 1988). Sin embargo, la región Andina concentra la mayor diversidad con el 81 % de las especies (Ocampo et al., 2007).
En Colombia el género es de gran importancia por el consumo de sus frutos y es el país con el mayor número de especies de pasionarias comercializadas, por lo que su estudio es importante para la conservación de recursos genéticos y por lo tanto de especies promisorias (Ocampo et al., 2007). Aunque las flores de todas las pasifloras son muy complejas y tienen semejanzas estructurales, las especies varían en la coloración de las flores, la estructura y la biología reproductiva.
La diversidad en morfología y en el comportamiento de las flores está acompañada por la diversidad de visitantes y polinizadores: especies con flores azules, moradas, rosadas o amarillas, con antesis diurna, fragancia intensa y flores que no sobresalen del follaje son preferentemente polinizadas por abejas, mientras que flores rojas, sin fragancias y que sobresalen del follaje, son atractivas para los colibríes. Por su parte los murciélagos visitan flores con colores blanco o crema, antesis nocturna y con fragancias débiles (Ramírez, 2006). Muchas especies de pasifloras son autoincompatibles y requieren de agentes polinizadores. May y Spears, 1988, demostraron que no hay fructificación en P. incarnata cuando se restringe la visita de polinizadores. Lo mismo demostró Snow, 1982, en P. vitifolia, Garcia y Hoc, 1998, en P. mooreana y Varassin et al., 2001, en P. alata, P. galbana, P. mucronata y P. speciosa. Especies como P. suberosa y P. capsularis (Koschnitzke y Sazima, 1997) y P. foetida (Garcia y Hoc, 1998) mostraron autocompatibilidad y en menor grado P. caerulea (García y Hoc, 1998).
Pero no solo entre especies hay variación de la biología floral, también dentro de las variedades de las especies, por ejemplo, P. incarnata varía el color desde lavanda a blanco y en el movimiento de los estigmas (May y Spears, 1988); P. edulis, especie cultivada, presenta cepas autocompatibles (Gulupa) y autoincompatibles (maracuyá) (Vanderplank, 1991). Además, la especie presenta dos tipos de flores con base en la posición de los estilos, el tipo normal en el que los estilos se curvan hacia abajo y los estigmas quedan enfrentados a las anteras y el tipo recto en que los estilos permanecen erectos y no descienden, este último tipo no produce frutos (Ishihata, 1981). La variación en aspectos de la biología reproductiva de P. lutea se observó en poblaciones localizadas en dos sitios distanciados geográficamente (800 km) y las diferencias detectadas fueron en el tiempo de su movimiento de las partes florales, los diferentes niveles de compatibilidad, el cuajamiento de frutos y el tipo de polinizadores (Holland y Lanza, 2008).
Del conjunto de las demoninadas frutas de la pasión, P. edulis es la especie más conocida en el mundo (Ulmer y MacDougal, 2004) e incluso de toda la familia (Ocampo et al., 2007). Sus frutos comestibles le confieren una gran importancia económica llegando a ser, probablemente, la especie más cultivada del género (Cervi, 1997).
Originaria de Brasil, actualmente se halla en Argentina, Paraguay, Colombia, Ecuador, Perú, Venezuela, Guatemala, Costa Rica, Jamaica, Bermudas, Cuba, Puerto Rico, Martinica, Hawai, Trinidad Australia (Cervi, 1997), Japón, África, India y Malasia (Ulmer y MacDougal, 2004). En general crece mejor en suelos húmedos y bien drenados (Cervi, 1997).
Existe una forma de fruto púrpura, Passiflora edulis f. edulis Sims, conocida en Colombia como gulupa, que es la variedad más tolerante al frío y se reproduce bien en elevaciones entre 600 y 2000 msnm (Ulmer y MacDougal, 2004; Morton, 1987); y otra de fruto generalmente amarillo, Passiflora edulis Sims f. flavicarpa Degener, o maracuyá amarillo. La forma púrpura se encuentra todavía en estado silvestre, mientras que no existe un reporte claro sobre la existencia de la forma amarilla en estado silvestre. Para Beal (revisado por Coppens d'Eeckenbrugge, 2001) las divergencias ecológicas y reproductivas entre ellas dejan dudas sobre su origen común y hasta sobre su pertenencia a una misma especie. En Colombia fue introducida en 1950, crece cultivada o de forma silvestre entre 1100 y 2750 msnm. Es conocida como gulupa en Cundinamarca y curuba redonda en Antioquia, Caldas, Risaralda y Quindío (Ocampo et al., 2007). Se siembra en municipios de Cundinamarca como La Mesa, Fusagasugá y Cachipay, y bajo invernadero en la Sabana de Bogotá (Avendaño y Quevedo, 1989), también en los departamentos del Huila, Caldas, Santander últimamente en el Meta (Alméciga y Herrera, 2008) y Boyacá. Recientemente se han desarrollado investigaciones tendientes a conocer la biología floral y reproductiva de la gulupa (Ángel et al., 2011), su fisiología y ecofisiología (Pinzón, 2007; Ocampo et al., 2012; Pérez y Melgarejo, 2012) y genética (Fonseca et al., 2009; Ortiz, 2010; Ocampo y Urrea, 2012). A pesar de su importancia es poco lo que se conoce en Colombia sobre visitantes florales y polinizadores efectivos de esta especie. Se conocen registros de polinizadores para la variedad flavicarpa (maracuyá) donde se mencionan a Apis mellifera, Xylocopa frontalis, Xylocopa grisescens, Xylocopa suspecta, Eulaema cingulata, Epicharis spp. y avispas de la familia Scoliidae como sus polinizadores (Ruggiero et al., 1976; Camillo, 1996; Camillo, 2003; Ramirez, 2006; Calle et al., 2010). Ishihata, 1981, menciona la necesidad de una polinización manual en cultivos de gulupa en Japón, para el mejoramiento de la productividad por falta de agentes polinizadores. El objetivo de este estudio es conocer los visitantes y polinizadores eficientes en dos cultivos de gulupa ubicados a diferente altitud (2225 msnm y 1657 msnm) en el departamento de Boyacá, Colombia.
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
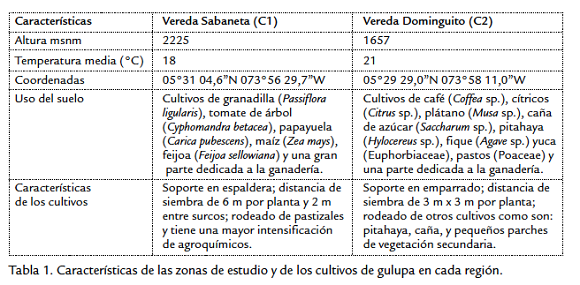
Este estudio se llevó a cabo en el municipio de Buenavista, provincia del occidente del departamento de Boyacá, cordillera Oriental colombiana (Fig. 1), entre mayo y septiembre de 2009. En cada una de las veredas, Dominguito ubicada a 2225 msnm y Sabaneta a 1657 msnm, se seleccionó un cultivo con 700 plantas aproximadamente. Se establecieron dos áreas de muestreo por cultivo, cada área se componía de 10 plantas (21 m2 aprox.), ubicadas en la parte central de los cultivos. Las características del área de estudio se muestran en la tabla 1.
TRATAMIENTOS
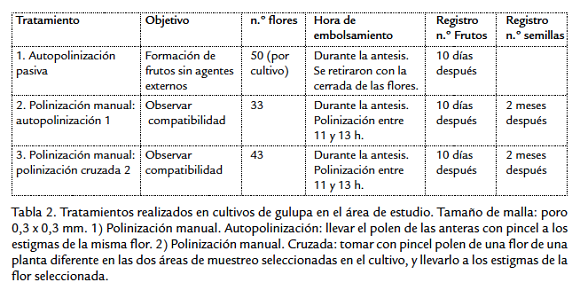
Con el objetivo de determinar la necesidad de agentes polinizadores y verificar la auto-compatibilidad de P. edulis se efectuaron los tratamientos resumidos en la tabla 2.
DIFERENCIACIÓN ENTRE VISITANTES Y POLINIZADORES
Se realizaron observaciones en las áreas de muestreo dos días por mes, y se marcaron, en promedio, 20 flores por día en las cuales se hicieron observaciones constantes entre las 6:30 a. m. y 5:00 p. m., tomando los siguientes datos: especie visitante, hora, recurso colectado y estructura floral con la que el visitante entra en contacto, formación de frutos (10 días después), número de semillas por fruto (dos meses después; Freitas y Paxton, 1998). Se tomaron datos atmosféricos: humedad relativa, temperatura (Hidro- termómetro E.B.C.®) y georefenciación (GPS Garmin e-trex®). Las observaciones se hicieron entre mayo y septiembre de 2009.
EFICIENCIA DE LOS AGENTES POLINIZADORES (VISITAS ÚNICAS)
Se embolsaron flores con malla de tamaño de poro 0,3 x 0,3 mm durante la antesis en los dos cultivos. En el día se permitió el acceso controlado a la flor, que consiste en desembolsar cada flor cuando los estigmas estén a 90° aproximadamente con respecto al androginóforo y esperar a que la visita se realice con una de las especies que se seleccionaron como posibles polinizadores (Spears, 1983). La selección se hizo teniendo en cuenta el tamaño y el comportamiento (regularidad de visitas y el contacto con las estructuras reproductivas de la flor). Después de que el individuo deja la flor se vuelve a embolsar para garantizar una única visita. A los diez días se registró el número de frutos formados y después de dos meses se contaron las semillas. Se realizaron pruebas no paramétricas de Kruskal-Wallis para comparar el número de semillas de los tratamientos efectuados.
RECOLECCIÓN DE ABEJAS VISITANTES
Utilizando una red entomológica se capturaron las abejas visitantes en los cultivos de gulupa entre los meses de mayo y septiembre de 2009. Los individuos capturados se sacrificaron en una cámara letal de cianuro y luego se extrajo el polen de su cuerpo con gelatina-glicerina, para estudios posteriores. Los individuos capturados fueron puestos en envases rotulados para su posterior determinación taxonómica. El material entomológico reposa en la colección de abejas del Laboratorio de Investigaciones en Abejas de la Universidad Nacional de Colombia (LABUN).
RESULTADOS
DETERMINACIÓN DE NECESIDAD DE POLINIZADORES
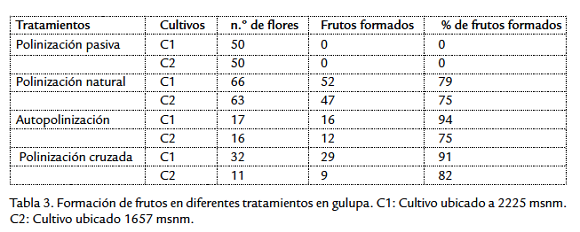
En P. edulis f. edulis la formación de frutos en polinización natural (disponible a cualquier visitante) fue 75 % en C2 y 79 % en C1, mientras la polinización pasiva (flores embolsadas) la formación de frutos fue nula (Tabla 3). Así se muestra la necesidad de vectores para la formación de frutos. En la polinización manual (autopolinización) la formación de frutos fue alta, 94 % en C1 y 75 % en C2, confirmando la autocompatibilidad de esta planta. En el tratamiento de polinización manual cruzada la formación de frutos fue alta (C1: 91 % y C2: 82 %). En estos tratamientos las comparaciones entre el mismo cultivo y entre cultivos no arrojaron una diferencia significativa en su producción de frutos (Kruskal-Wallis P>0,05).
VISITANTES FLORALES
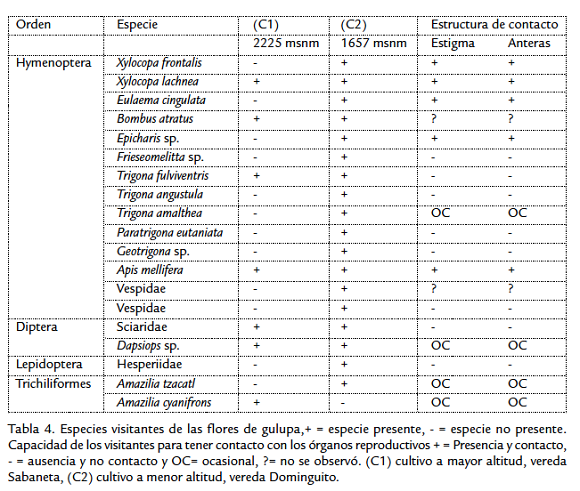
En los dos cultivos se registraron 19 especies de animales visitantes correspondientes a tres órdenes de insectos y un orden de aves, de estos, 14 son del orden Hymenoptera (74 %), dos Dípteros, un Lepidoptera y dos especies de aves de la familia Trochilidae. En los dos cultivos se encontraron diferencias en número de especies visitantes. En el C1 se encontraron siete especies y en el C2, 18 (Tabla 4). De las especies encontradas en el cultivo C1 seis fueron compartidas con el cultivo C2: Trigona fulviventris, Xylocopa lachnea, Bombus atratus, Apis mellifera (Hymenoptera), Dasiops sp. y una especie de la familia Sciaridae (Diptera). El colibrí Amazilia cyanifrons no se encuentra en el cultivo C2. Dasiops sp., conocida como mosca sonsa, es considerada plaga. Tiene su ciclo reproductivo en la flor ocasionando daños en el fruto en formación y se encontró permanentemente en las flores durante los muestreos, por lo cual no se contó como visitante. Otras tres especies (B. atratus y dos Vespidae) se observaron ocasionalmente una vez en todos los muestreos. En los meses de muestreo en el cultivo C1 se observó una predominancia de A. mellifera y en menor grado de A. cyanifrons, las otras cuatro especies que se registraron en el cultivo C1 fueron ocasionales.
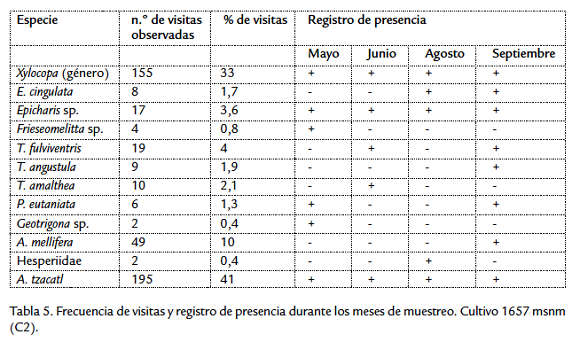
En el cultivo C2 se observaron cambios de los visitantes florales entre los meses de muestreo, donde nueve especies no tuvieron una presencia regular y de estas tres estuvieron presentes en dos meses de muestreo, seis se registraron en un mes y cuatro especies se presentaron durante todos los muestreos realizados, estas especies fueron: el género Xylocopa (X. frontalis, X. lachnea), Epicharis sp. y A. tzacatl (Tabla 5).
CAPACIDAD DE LOS VISITANTES PARA TENER CONTACTO CON LOS ÓRGANOS REPRODUCTIVOS DE LA FLOR
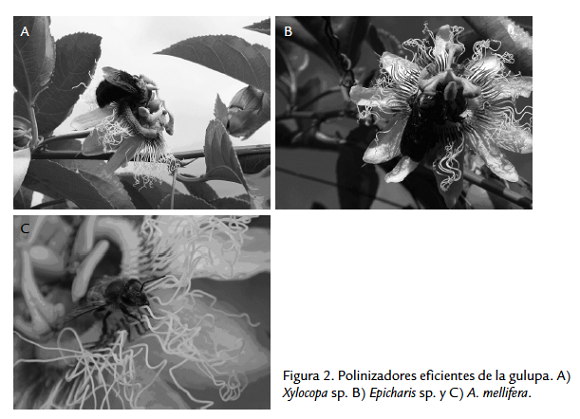
De las 19 especies registradas en los cultivos, cinco especies tienen un contacto frecuente con las partes reproductivas de la flor antera/estigma, X. frontalis, X. lachnea, Epicharis sp., A. mellifera y E. cingulata (Tabla 4). En este trabajo consideramos visitantes de P. edulis f. edulis, a las especies que no tienen contacto con los órganos reproductivos (estigma- antera) y no tienen una presencia constante dentro del cultivo. Entonces, las abejas sin aguijón, los colibríes, las mariposas, las avispas y los dípteros por su comportamiento y su frecuencia no ejercen un impacto estable en la polinización y por lo tanto son considerados como visitantes, mientras que X. frontalis, X. lachnea, A. mellifera y Epicharis sp. son consideradas polinizadores (Fig. 2). E. cingulata no se considera polinizador por la baja frecuencia de visitas y su presencia no permanente en el cultivo (Tabla 5).
ACTIVIDAD DE FORRAJEO
Se tomaron 1251 registros en la actividad de forrajeo en flores de gulupa en los dos cultivos. 78 % de todos los registros correspondió a visitas de abejas. El recurso más colectado por los visitantes fue el néctar con 98 %, mientras que en el 2 % de las visitas se observó recolección de polen. En el cultivo ubicado a mayor altura (C1), 91 % de las visitas observadas fueron de Apis mellifera mientras que en el cultivo a menor altura (C2) se observó que los colibríes son los visitantes más importante con 41 % de visitas, seguido del género Xylocopa con 33 % y Epicharis sp. con 3,6 % (Tabla 5).
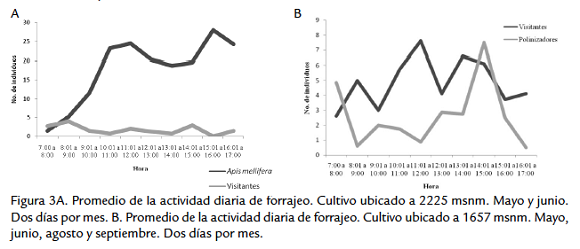
En el cultivo C1 el comportamiento de forrajeo es constante por parte de A. mellifera, con dos picos de actividad, entre las 9:00 y 10:00 a. m. y el otro entre3:00 y 4:00 p. m., con una disminución al medio día (Fig. 3A). En el cultivo (C2) el comportamiento de los visitantes tienen un mayor presencia desde las 8:00 a. m. hasta 2:00 p. m. en comparación con los polinizadores que registran un mayor número desde las 2:00 hasta las 3:00 p. m. (Fig. 3B). Encontramos cuatro especies de visitantes de porte pequeño (tipo Trigona) que no tienen la capacidad de tener un contacto frecuente con las partes reproductivas, pero que por su comportamiento en la flor, donde se ubican en las anteras y después en los estigmas transportando polen, permiten clasificarlos como polinizadores muy ocasionales.
A. mellifera es una abeja de porte medio que no alcanza a tener un contacto directo con las anteras y estigmas de las flores, de manera que, para que sea un buen polinizador es necesario que incremente el número de visitas a la flor, que en promedio en un día soleado alcanza a 9,08 flor/día, lo cual permite una polinización idónea según lo demuestran los experimentos de eficiencia de polinización. En el caso de abejas robustas como en el caso del género Xylocopa, o Epicharis sp. se observó un alto contenido de polen en el tórax de los insectos y un contacto muy amplio y evidente con las partes reproductivas de la flor.
EFICIENCIA DE POLINIZADORES
En los tratamientos de visitas únicas que se realizaron en el cultivo a mayor altitud (C1) A. mellifera generó una formación de frutos del 53 %, mientras que en el cultivo (C2) Xylocopa generó 73 %. Epicharis sp. con siete visitas únicas produjo fruto en todas las opor-tunidades. Los visitas de los colibríes aunque frecuentes, demostraron no ser eficientes con una formación de fruto del 8 % (Tabla 6).
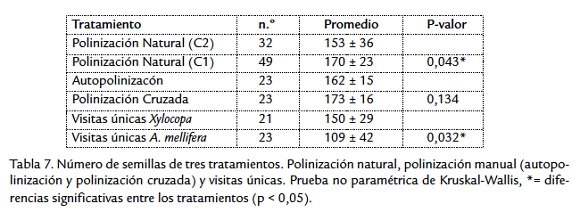
La formación de frutos y el número de semillas en visitas únicas es mayor en Xylocopa (150 ± 29) que en A. mellifera (109 ± 42), teniendo diferencias significativas (Kruskall- Wallis P<0,05) en el número de semillas por fruto. En polinización natural (disponible a cualquier visitante) se encontraron diferencias significativas (Kruskall-Wallis P< 0,05) en el número de semillas entre los cultivos siendo mayor en el cultivo C1 de mayor altitud (Tabla 7). Los tratamientos de polinización manual (cruzada y autopolinización) no tienen diferencia significativa (P>0,05).
DISCUSIÓN
Los resultados de los ensayos de biología floral (polinización natural, polinización manual: autopolinización y polinización cruzada) muestra que P. edulis f. edulis es una planta autocompatible. Sin embargo, en ausencia de agentes polinizadores la producción es nula. Vanderplank, 1991 e Ishihata, 1981, en Japón y Ángel et al., 2011, en Colombia, encontraron resultados similares. Los dos primeros autores destacan la importancia de realizar polinización manual por deficiencia de polinizadores de esta planta neotropical. En los tratamientos de polinización natural (flores disponibles a cualquier visitante) en ambas alturas estudiadas, se formaron más del 75 %, lo cual es un porcentaje relativamente alto, por lo tanto nuestros resultados indican que en las dos situaciones estudiadas hay una adecuada presencia de agentes polinizadores en los cultivos de gulupa del municipio de Buenavista. Este hecho es de gran significado para el manejo agronómico del cultivo, porque se debe tener en cuenta la presencia y la abundancia de agentes polinizadores para asegurar la productividad. Es importante que a partir de este conocimiento de implementen planes de buenas prácticas de manejo del cultivo, especialmente en lo que respecta a la aplicación de pesticidas, para garantizar la permanencia de los polinizadores. Estudios recientes en cultivos de pasifloras en Colombia (Calle et al., 2010) resaltan la necesidad de considerar el valor del servicio de polinización en el planeamiento y puesta en marcha de cultivos.
Las comunidades de los sitios estudiados difieren en la riqueza de especies (C1: 7 y C2:18), encontrando que seis presentes en C1 también fueron halladas en C2. Así mismo, la comunidad del C1 (a mayor altura) puede ser considerada como una parte de la comunidad de C2 (de menor altura) constituida por la especies más adaptables a las condiciones de menor temperatura y mayor intervención antrópica.
En C1 los dos muestreos evidenciaron que A. mellifera era la especie dominante en el cultivo. El estudio de los visitantes durante los cuatro meses del estudio en C2 mostró un cambio en el conjunto de visitantes a lo largo del muestreo pero con una permanencia de los polinizadores efectivos durante todos los meses, lo cual podría generar una competencia entre los visitantes y polinizadores efectivos.
Si bien, A. mellifera presenta una marcada actividad en ambos cultivos, se destaca su presencia en el cultivo de la región a mayor altura (C1) donde además de ser el visitante más frecuente, según los ensayos de biología floral, es el único polinizador efectivo. Como se mencionó anteriormente este cultivo está rodeado de vegetación intervenida como pastizales y otros cultivos. Es importante mencionar que a esa altura podrían presentarse otras abejas más robustas y que tienen características morfológicas más apropiadas para la polinización de esta especie vegetal, como Bombus atratus, Eulaema cingulata, X. frontalis y X. lachnea que pueden llegar hasta 2500 msnm (Gonzalez y Engel, 2004). Sin embargo, en tal altura algunas de estas especies aparecieron solo en calidad de ocasionales. Según Percival, 1974, y Schaffer et al., 1983, A. mellifera es un competidor muy fuerte para los polinizadores nativos porque disminuye considerablemente el volumen de néctar en muchas flores morfológicamente distintas, además puede ser un polinizador no tan efectivo, sobre todo cuando se compara con la fauna nativa (Butz, 1997). De esta manera, la ausencia de las especies grandes de abejas en C1 podría ser explicada por la competencia que ejerce A. mellifera en un clima menos cálido, además de la poca disponibilidad de sitios para nidificación en los alrededores del cultivo. También hay que tener en cuenta la preferencia de las abejas grandes por otras flores, inclusive otras pasifloráceas, por ejemplo, en regiones de la India donde se cultivan cuatro especies de pasifloras en la misma área se registró A. mellifera como el mejor polinizador de la gulupa mientras que abejas del género Xylocopa mostraron una preferencia hacia la flor de maracuyá (Kishore et al., 2010). En la región donde está el cultivo C1 se encuentran cultivos de Passiflora ligularis (granadilla), en el cual Melo, 2007, reportó visitas de Epicharis cf. rustica y X. lachnea las cuales posiblemente tendrían una preferencia por este último cultivo. No solo existen diferencias entre los dos cultivos en cuanto a la composición de la comunidad sino también en el comportamiento de forrajeo de los visitantes y los polinizadores. Mientras en C1 el forrajeo es ejercido por A. mellifera con visitas muy frecuentes (en promedio nueve visitas por flor/día y 91 % de visitas registradas), en el cultivo C2 la mayoría de la visitas que reciben las flores de gulupa están dadas por el colibrí A. tzacatl (44 %), y por las abejas del género Xylocopa (33 %) que, según los ensayos de biología floral, resultaron el polinizador más efectivo del cultivo. Registramos visitas de A. mellifera en el cultivo de menor altitud (C2) solo durante el último muestreo evidenciando que la constancia floral de Xylocopa es mayor a lo largo del año en este sitio.
A diferencia del maracuyá que es autoincompatible (Akamine y Girolami, 1959), la característica de autocompatibilidad de la flor de gulupa facilita la función de A. mellifera como polinizador a pesar de su tamaño, porque efectúa la transferencia de polen viable a los estigmas de la misma flor; ocurre lo contrario en el maracuyá donde A. mellifera restringe la polinización (Ruggiero et al., 1976; Medeiros et al., 2009).
En el comportamiento de forrajeo de las especies polinizadoras del maracuyá (Akamine y Girolami, 1959) y P. mooreana (Garcia y Hoc, 1998) es necesario que estas tengan vuelos largos para evitar la geitonogamia, lo cual disminuye el cuajamiento de los frutos. En gulupa se observó que Xylocopa spp. y Epicharis sp. realizaban vuelos largos visitando flores de diferentes plantas de la especie, mientras que A. mellifera, por sus vuelos cortos dentro del cultivo visitaban varias flores de la misma planta, lo cual por la autocompatibilidad de la gulupa, no influye aparentemente en la producción.
En cuanto al número de semillas por fruto, el comportamiento y la especie de abeja tienen influencia puesto que con una sola visita de Xylocopa se logra el tamaño y número de semillas apropiado en cada fruto (150 semillas aproximadamente), mientras que se necesitan por lo menos dos visitas de Apis mellifera para que el fruto tenga características similares, además, no se encontraron diferencias significativas entre las visitas únicas de Xylocopa y la polinización natural en el cultivo C2 (Kruskall-Wallis P> 0,05). Otros factores que pueden estar relacionados con la diferencia significativa (Kruskal-Wallis P< 0,05) encontrada en el número de semillas por fruto en los dos cultivos bajo polinización natural (170 semillas/fruto en C1 y 153 semillas/fruto en C2) son las condiciones ecofisiológicas o de manejo agronómico del cultivo.
En climas más secos y cálidos las abejas Apis mellifera dejan de ser el elemento dominante de la comunidad de visitantes, como es el caso de los cultivos de gulupa estudiadas donde se observó una mayor cobertura vegetal alrededor de C2 permitiendo una mayor presencia de abejas silvestres más grandes relacionada también con la cercanía a los parches de vegetación nativa (Ricketts et al., 2008).
CONCLUSIONES
P. edulis f. edulis es una especie autocompatible, sin embargo se evidenció la necesidad de agentes polinizadores para la producción de frutos. En la zona de estudio los polinizadores efectivos de esta planta en el cultivo ubicado a 1657 msnm son X. frontalis, X. lachnea y Epicharis sp. y en el de mayor altitud (2225 msnm) es A. mellifera. La comunidad de visitantes de los dos cultivos se diferenció por número y por composición, encontrándose siete especies en el cultivo de mayor altitud (2225 msnm) y 18 especies en el ubicado a 1657 msnm. La única especie fue A. cyanifrons que se encuentra en el cultivo a mayor altitud pero no tiene importancia como polinizador. Las diferencias significativas en las comunidades de visitantes y en los polinizadores de la gulupa en un gradiente de 568 m deja en evidencia que las buenas prácticas de manejo agronómico para este cultivo deben considerar la protección y el fomento de las poblaciones de polinizadores y que estas deben adaptarse también a las variaciones que se presentan en un gradiente altitudinal.
AGRADECIMIENTOS
A la Universidad Nacional de Colombia, especialmente a la Dirección de Investigación de Bogotá (DIB) por la financiación del proyecto DIB-8003251. A los dueños de los cultivos, señores Javier Bogoya y Orlando Villamil, a la comunidad de Buenavista-Boyacá por permitir el desarrollo de esta investigación y a Daniel Melo por su apoyo logístico en la región. A los evaluadores anónimos por sus valiosas sugerencias.
BIBLIOGRAFÍA
AKAMINE E, GIROLAMI D. Pollination and fruit set in the yellow passion fruit. Hawai. Agric. Exper. Stat. Bull. 1959;59:44. [ Links ]
ALMÉCIGA J, HERRERA E. Inventario preliminar de la entomofauna asociada al cultivo de gulupa (Passiflora edulis f. edulis Sims.) en los municipios de Choachí y Ubaque, Cundinamarca, Colombia. Trabajo de grado. Bogotá: Facultad de Agronomia, Universidad Nacional de Colombia; 2008. [ Links ]
ÁNGEL C, NATES-PARRA G, OSPINA R, MELO D, AMAYA M. Biología floral y reproductiva de la gulupa Passiflora edulis sims f. edulis. Caldasia. 2011;33(2):413-431. [ Links ]
AVELDAÑO J, QUEVEDO E. Análisis de la floración y fructificación bajo tres sistemas de soporte en la gulupa. Trabajo de grado. Bogotá: Facultad de Agronomía, Universidad Nacional de Colombia; 1989. [ Links ]
BUTZ H VM. Ecological Impacts of Introduced Honey Bees. Q Rev of Biol. 1997; 72(3):275-329. [ Links ]
CALLE Z, GUARGUATA M, GIRALDO E, CHARÁ J. La producción de maracuyá (Passiflora edulis) en Colombia: perspectivas para la conservación de hábitat a través del servicio de polinización. Interciencia. 2010;35(3):207-212. [ Links ]
CAMILLO E. Polinização do maracujá. Holos Editora, Ribeirão Preto. SP. 2003; p. 44. [ Links ]
CAMILLO E. Utilização de espécies de Xylocopa (Hymenoptera, Anthophoridae) na polinização do maracujá amarelo. En: Encontro Sobre Abelhas. (2, 1996, Ribeirão Preto, BR). Anais. 1996; p. 141-146. [ Links ]
CERVI A. Passifloracea do Brasil. Estudo do gênero Passiflora L., subgênero Passiflora. Fonqueria. 1997;45:1-92. [ Links ]
COPPENS d'EECKENBRUGGE G, BARNEY V.E, JøRGENSEN P.M, MacDOUGAL J. Passiflora tarminiana, a new cultivated species of Passiflora subgenus Tacsonia (Passifloraceae). Novon. 2001;11(1):8-15. [ Links ]
ESCOBAR L. Passifloraceae. Passiflora. Subgéneros : Tacsonia, Rathea, Manicata y Distephana. Bogotá, Universidad Nacional de Colombia; 1988(10). [ Links ]
FONSECA N, MARQUEZ MP, MORENO J, TERÁN W, SCHULER I. Caracterización molecular de materiales cultivados de gulupa (Passiflora edulis f. edulis). Universitas Scientiarum. 2009;14(2-3):134-140. [ Links ]
FREITAS B, PAXTON R. A comparison of two pollinators: the introduced honey bee Apis mellifera and an indigenous bee Centris tartasa on cashew Anarcadium occidentale in its native range of NE Brasil. J Appl Ecol. 1998;35:109-121. [ Links ]
GARCIA MA, HOC PS. Biología floral de Passiflora foetida (Passifloraceae). Rev Biol Trop. 1998;46(2):191-202. [ Links ]
GARCIA MA, HOC PS. Floral biology and reproductive system of Passiflora mooreana (Passifloraceae). Darwiniana. 1998;35:9-27. [ Links ]
GONZÁLEZ V, ENGEL M. The tropical andean bee fauna (Insecta: Hymenoptera: Apoidae), with examples from Colombia. Entomol Abn. 2004;62(1):65-75. [ Links ]
HOLLAND J, LANZA J. Geographic variation in the pollination biology of Passiflora lutea (Passifloraceae). J Ark Acad Sci. 2008;26:32-36. [ Links ]
ISHIHATA K. Studien the morphology of flowering organs and fruit bearing in purple passion fruit, Passiflora edulis Sims. Mem Fac Agr Kagoshima Univ. 1981;31:25-31. [ Links ]
KISHORE K, PATHAK K, SHUKLA R, BHARALI A. Studies on floral biology of passion fruit (Passiflora spp.). Pak J Bot. 2010;42(1):21-29. [ Links ]
KOSCHNITZKE C, SAZIMA M. Biologia floral de cinco espécies de Passiflora L. (Passifloraceae) em mata semidecídua. Rev Bras Bot São Paulo. 1997;20(2):119-126. [ Links ]
MEDEIROS K, PIEDADE L, FEITOSA C, BORGES I, PITOMBEIRA S, ARAUJO E. Ecologia da polinização do maracujá-amarelo, na região do vale do submedio São Francisco. Rev Bras Frutic. 2009;31(1):1-12. [ Links ]
MAY P, SPEARS G. Andromonoecy and variation in phenotypic gender of Passiflora incarnata (Passifloraceae). Am J Bot. 1988;75(12):1830-1841. [ Links ]
MELO D. Diagnóstico para la cría y conservación de abejas polinizadoras de granadilla (Passiflora ligularis juss) en Buenavista, Boyacá, Colombia. Trabajo de Grado, Bogotá: Facultad de Agronomía, Universidad Nacional de Colombia; 2007. [ Links ]
MORTON J. Passionfruit. En: Morton J. editor. Fruit climates. Florida Flair Books. Miami, Florida, Estados Unidos; 1987. [ Links ]
OCAMPO J, MELO D, RENDÓN JS, ARIAS JC, MARIN V. Aspectos fisiológicos de la gulupa. En Ocampo J, Wyckhuys, K. Editores. Tecnología para el cultivo de la gulupa (Passiflora edulis f. edulis Sims) en Colombia. Centro Bio-sistemas Universidad Jorge Tadeo Lozano, Centro Internacional de Agricultura Tropical CIAT y MADR, Bogotá, Colombia. 2012. p. 13-15. [ Links ]
OCAMPO J, URREA R. Recursos genéticos y mejoramiento de la gulupa. En Ocampo J, Wyckhuys K. Editores. Tecnología para el cultivo de la gulupa (Passiflora edulis f. edulis Sims) en Colombia. Centro Bio-sistemas Universidad Jorge Tadeo Lozano, Centro Internacional de Agricultura Tropical CIAT y MADR, Bogotá, Colombia. 2012. p. 16-23. [ Links ]
OCAMPO J, COPPENS D'EECKENBRUGGE G, RESTREPO M, JARVIS A, SALAZAR M, CAETANO C. Diversity of Colombian Passifloraceae: biogeography and an updated list for conservation. Biota Colombiana. 2007; 8(1)1-45. [ Links ]
ORTIZ D. Estudio de la variabilidad genética en materiales comerciales de gulupa (Passiflora edulis f. edulis Sims) en Colombia (tesis de maestría). Bogotá D. C. Facultad de Agronomía, Universidad Nacional de Colombia; 2010. [ Links ]
PERCIVAL MS. Floral Ecology of Coastal Scrub in Southeast Jamaica. Biotropica. 1974;6:104-129. [ Links ]
PÉREZ L, MELGAREJO L. Caracterización ecofisiológica de la gulupa (Passiflora edulis Sims) bajo tres condiciones ambientales en el departamento de Cundinamarca. En Melgarejo L. Editora. Ecofisiología del cultivo de la gulupa (Passiflora edulis Sims). Universidad Nacional de Colombia. Bogotá D. C.; 2012. p. 11-32. [ Links ]
PINZÓN I, FISCHER G, CORREDOR G. Determinación de los estados de madurez del fruto de gulupa (Passiflora edulis Sims.). Agronomía Colombiana. 2007;25:83-95. [ Links ]
RAMIREZ W. Hibridación interespecifica en Passiflora (Passifloraceae), mediante polinización manual, y características florales para la polinización. Lankesteriana. 2006;6(3):123-131. [ Links ]
RICKETTS T, REGETZ J, STEFEFFAN-DEWENTER I, CUNNINGHAM S, KREMEN C, BOGDANSKI A, et al. Landscape effects on crop pollination services: are there general patterns? Ecol Lett. 2008;11:499-515. [ Links ]
RUGGIERO C, BANZATTO D, LAM-SÁNCHEZ A. Studies on natural y controlled pollination in yellow passion fruit (Passiflora edulis f. flavicarpa Deg.). Acta Hortic. 1976;57:121-124. [ Links ]
SNOW A. Pollination intensity and potential seed set in Passiflora vitifolia. Oecologia. 1982;55:231-237. [ Links ]
SCHAFFER WM, ZEH DH, BUCHMANN SL, KLEINHANS M, SCHAFFER MN, ANTRIN J. Competition for nectar between honey bees and native North American bees and ants. Ecology. 1983;64:564-577. [ Links ]
SPEARS E. A direct measure of pollinator effectiveness. Oecologia. 1983;57:196-199. [ Links ]
ULMER T, MACDOUGAL J. Passiflora: passion flowers of the world. Timber Press Portland, Oregon; 2004. [ Links ]
VANDERPLANK J. Passion flowers and passion fruit. Ed. Cassel Publishers Limited, London; 1991. [ Links ]
VARASSIN I, TRIGO J, SAZIMA M. The role of nectar production, flower pigments and odour in the pollination of four species of Passiflora (Passifloraceae) in south-eastern Brazil. Bot J Linn Soc. 2001;136:139-152. [ Links ]