Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.17 no.3 Bogotá Sept./Dec. 2012
EL NÚCLEO PEDUNCULOPONTINO Y SU RELACIÓN CON LA FISIOPATOLOGÍA DE LA ENFERMEDAD DE PARKINSON
The Pedunculopontine Nucleus and its Relationship to the Pathophysiology of Parkinson's Disease
LISETTE BLANCO LEZCANO1, Ph. D.; LOURDES LORIGADOS PEDRÉ1, Ph. D.; TERESA SERRANO SÁNCHEZ1, M.D.; NANCY PAVÓN FUENTES1, Ph. D.; MA. ELENA GONZÁLEZ1, M.D.; LILIANA FRANCIS TURNER2, Ph. D.
1Centro Internacional de Restauración Neurológica (CIREN). Ave. 25, # 15805 e/ 158 y 160, playa, CP: 11300, Habana, Cuba.
2Grupo de Investigación Modelos Experimentales para las Ciencias Zoo Humanas. Universidad del Tolima, 546. PBX: 264 42 19. Barrio Santa Elena, Ibagué, Tolima, Colombia. Correspondencia: Lisette Blanco Lezcano.lisette.blanco@infomed.sld.cu ,lblanco@neuro.ciren.cu. Centro Internacional de Restauración Neurológica (CIREN) Departamento de Neurofisiología Experimental, Laboratorio de Biomodelos. Ave. 25 # 15805 e/ 158 y 160, playa, CP: 11300, Habana, Cuba.
Presentado el 15 de febrero de 2012, aceptado el 23 de julio de 2012, correcciones el 14 de agosto de 2012.
RESUMEN
Varias décadas de investigaciones neuropatológicas e imagenológicas han proporcionado suficientes evidencias acerca de las alteraciones en la neurotransmisión colinérgica que acompañan a la disfunción dopaminérgica en la enfermedad de Parkinson (EP). El núcleo pedunculopontino tegmental laterodorsal (NPP) representa una de las fuentes principales de proyecciones colinérgicas en el cerebro y a su vez es el origen de la única proyección colinérgica que recibe la substantia nigra pars compacta (SNpc). Actualmente el estudio de la participación del NPP en la fisiopatología de la EP toma en cuenta dos vertientes: el impacto de la pérdida temprana de la influencia excitatoria pontina sobre la SNpc asociado a la degeneración temprana del NPP y la estimulación a baja frecuencia del NPP como tratamiento quirúrgico beneficioso para los signos axiales de la EP. El NPP ha emergido como una estructura esencial en la comprensión de la fisiopatología de la EP dado sus relaciones con los núcleos de los ganglios basales, el tálamo, la corteza motora y la médula espinal. La degeneración de algunas de sus poblaciones neuronales en etapas presintomáticas de la EP ha sugerido una relación causa-efecto entre este hallazgo y la muerte de las células dopaminérgicas nigrales. Por otra parte la estimulación del NPP tiene resultados favorables sobre los trastornos posturales y de la marcha, los cuales se presentan en etapas tardías de la EP y son refractarios a otros tratamientos farmacológicos y quirúrgicos.
Palabras clave: núcleo pedunculopontino, proyecciones colinérgicas, substantia nigra pars compacta.
ABSTRACT
Several decades of neuropathologic and imagenologic investigations have provided sufficient evidences about alterations in cholinergic neurotransmission that go together with the dopaminergic dysfunction in Parkinson s disease (PD). The laterodorsal tegmental pedunculopontine nucleus (PPN) represents one of the main sources of cholinergic projections into the brain and at the same time the origin of the only cholinergic projection that substantia nigra pars compacta (SNpc) receives. At present, the study of the PPN participation as part of the physiopathology of PD has two notions: the impact of the lack of pontine excitatory influence on SNpc, associated to the early degeneration of PPN as well as the low frequency stimulation in the PPN as a beneficial surgical treatment for the axial symptoms of PD. PPN has emerged as an essential structure in the comprehension of PD physiopathology, given by its relation with the basal ganglia nuclei, thalamus, motor cortex and the spinal cord. The degeneration of some of its neuronal populations in PD pre symptomatic steps, has suggested a cause- and-effect relation on this finding and the death of nigral dopaminergic cells. On the other hand, PPN stimulation has favorable results on postural and gait disorders, which present themselves in late PD stages and are refractory to other pharmacological and surgical treatments.
Keywords: Cholinergic projections, pedunculopontine nucleus, Substantia nigra pars compacta.
INTRODUCCIÓN
Aunque la enfermedad de Parkinson (EP) ha sido evaluada tradicionalmente como un síndrome motor secundario a la denervación dopaminérgica nigroestriatal ya actualmente esta entidad es concebida como un trastorno multisistémico que abarca estructuras dopaminérgicas y no dopaminérgicas que degeneran progresivamente (Mullers et al., 2006). Varias décadas de investigaciones neuropatológicas e imagenológicas han proporcionado suficientes evidencias acerca de las alteraciones en la neurotransmisión colinérgica que acompañan a la disfunción dopaminérgica en la EP (Bohnen et al., 2009). Existen tres fuentes fundamentales de proyecciones colinérgicas en el cerebro: el complejo del cerebro basal anterior, el núcleo pedunculopontino tegmental laterodorsal (NPP) y la población de interneuronas colinérgicas estriatales (Bohnen y Albin, 2010). Otras pequeñas poblaciones de neuronas colinérgicas se localizan en la corteza cerebral, la habénula medial y parte de la formación reticular (Lecourthier y Nelly, 2007).
Los estudios de Braak (2004) demostraron una acumulación temprana de depósitos de a-sinucleína en las neuronas colinérgicas del cerebro basal anterior aparentemente coincidentes con la presencia de cuerpos de Lewy y la muerte de neuronas de la substantia nigra pars compacta (SNpc) (Braak et al., 2004). Estos hallazgos han sido recientemente corroborados por otros autores (Jellinger, 2011). Adicionalmente, la literatura señala una pérdida significativa de neuronas colinérgicas del cerebro basal anterior en cerebro de pacientes parkinsonianos (Lange et al., 1993). Este hallazgo neuropatológico se acompaña de una disminución de los sitios de binding de los receptores colinérgicos muscarínicos en la SNpc, la corteza y el hipocampo (Lange et al., 1993).
Otros estudios neuropatológicos realizados en cerebros humanos han demostrado que alrededor del 50 % de las grandes neuronas colinérgicas del NPP degeneran en la EP (Zweig et al., 1989). Asimismo se ha reportado la degeneración de otras neuronas pontinas que expresan neuropéptidos como la substancia P (Gai et al., 1991). Recientemente los estudios imagenológicos realizados han demostrando in vivo la disminución de la actividad acetilcolinesterasa (AChE) en núcleos talámicos como el intralaminar en pacientes parkinsonianos con trastornos severos del equilibrio. Este núcleo, el NPP y los ganglios basales (GB) forman una compleja red de circuitos conectados de forma recíproca (Henderson et al., 2000). La pérdida de actividad AChE talámica probablemente refleja disfunción del NPP por ser este núcleo el origen de las proyecciones colinérgicas que alcanzan el tálamo (Bohnen y Albin, 2010).
Los estudios electrofisiológicos han demostrado que la actividad eléctrica de las neuronas pontinas está influenciada por las aferencias glutamatérgicas y gabaérgicas que recibe este núcleo desde: el núcleo subtalámico (NST) y los núcleos eferentes de los GB [globus pallidus medial / substantia nigra pars reticulata, GPi/SNpr] respectivamente (Groenewegen y Dongen, 2007). La literatura señala que estas relaciones anatómicas constituyen la base morfológica de la participación cada vez más reconocida del NPP en el control motor (Groenewegen y Dongen, 2007; Tsang et al., 2010).
Por otra parte se conoce que la SNpc recibe una única proyección colinérgica procedente del NPP y que la misma modula de forma muy fina la actividad dopaminérgica nigral (Rye et al., 1988).
El presente trabajo se propuso revisar el estado del arte actual del conocimiento sobre las relaciones anatómicas y funcionales del NPP con los núcleos que conforman los ganglios basales, así como el impacto de la degeneración pontina en la disfunción nigral y el papel que juega actualmente esta estructura como diana quirúrgica con resultados beneficiosos en la EP.
NÚCLEO PEDUNCULOPONTINO: COMPOSICIÓN Y LOCALIZACIÓN
El NPP, referido por Paxinos y Watson, 1998, como núcleo pedunculopontino tegmental y comúnmente identificado como grupo de células colinérgicas Ch5, es continuo en dirección caudomedial con el núcleo tegmental dorsal lateral o Ch6 (Paxinos y Watson, 1998; Lee et al., 2000). Se extiende desde el borde caudal del núcleo rojo hasta el núcleo parabraquial. En mamíferos, incluyendo los humanos, el NPP es bordeado medialmente por fibras del pedúnculo cerebeloso superior y de la decusación peduncular y lateralmente por el lemnisco medial (Pahapill y Lozano, 2000). Rostralmente, la porción anterior del NPP contacta con la SNpc y es adyacente al área retrorubral. Caudalmente, en su aspecto más dorsal limita con los núcleos cuneiformes y subcuneiforme y en su porción ventral limita con la formación reticular pontina. Su polo más caudal es adyacente al locus coeruleus (Zrinzo et al., 2008) (Figs. 1A y 1B).
El NPP es una estructura muy heterogénea desde el punto de vista neuroquímico y actualmente existe un consenso general de que está formado por tres subtipos celulares diferentes que se entremezclan de forma muy estrecha: neuronas colinérgicas (Mesulam et al., 1983), glutamatérgicas (Clements y Grant, 1990) y gabaérgicas (Clement y Grant, 1990; Wang y Morales, 2009; Mena-Segovia et al., 2009; Barroso-Chinea et al., 2011). Asimismo se conoce que la población de neuronas colinérgicas pontinas sintetizan el neurotransmisor volátil óxido nítrico lo cual ha permitido el uso de la técnica histoquímica para NADPH diaforasa con el propósito de verificar la localización correcta de electrodos y agujas en la zona de NPP (Mesulam et al., 1983).
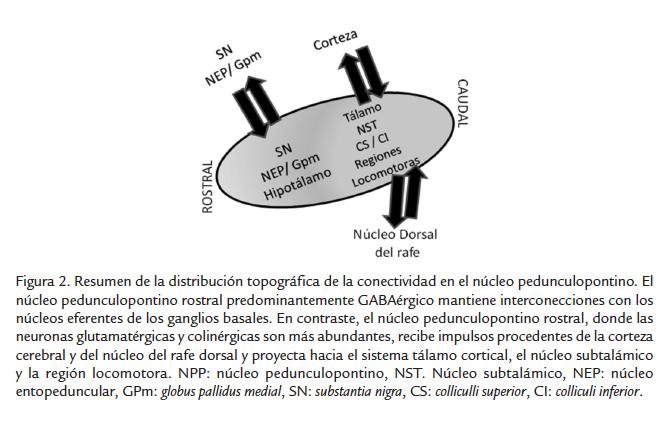
Es bien conocido que el NPP no es homogéneo en términos de su organización celular, originalmente se le dividió en pars dissipata (rostral) y pars compacta (caudal) en base a la densidad de sus neuronas colinérgicas (Pahapill y Lozano, 2000). Recientemente se ha considerado una división rostro caudal que es más apropiada pues toma en cuenta la distribución de todos los fenotipos celulares conocidos presentes en el NPP en vez de solo considerar a las neuronas colinérgicas (Mena-Segovia et al., 2004). Así la porción rostral del NPP contiene significativamente mayor número de neuronas gabaérgicas y es interconectada con los núcleos eferentes de los GB, sugiriendo una estrecha relación funcional con los mismos (Mena-Segovia et al., 2009; Wang y Morales, 2009). Por su parte la porción caudal contiene mayor número de neuronas colinérgicas y glutamatérgicas, recibe impulsos procedentes de la corteza y del núcleo del raphe dorsal y proyecta hacia blancos talámicos y coliculares sugiriendo una estrecha relación con la modulación de los estados atencionales a través de las vías talamocorticales (Kita y Kita, 2011). También la porción caudal del NPP proyecta al NST y a la región locomotora tronco encefálica que participa en el control del tono muscular, la postura y la marcha (Kita y Kita, 2011) (Fig.2). Ambas porciones del NPP son sinápticamente relacionadas por medio de axones colaterales locales de neuronas colinérgicas y no colinérgicas (Kita y Kita, 2011).
Por otra parte, las neuronas pontinas expresan receptores para diferentes neurotransmisores. Ellos incluyen: receptores colinérgicos (muscarínicos y nicotínicos), noradrenérgicos, serotoninérgicos, glutamatérgicos, gabaérgicos, dopaminérgicos y peptidérgicos (Forster y Blaha, 2003; Ikeda et al., 2004). Este mosaico molecular sugiere que las neuronas del NPP están sujetas al control de diferentes sistemas de neurotransmisión (Winn, 2006). En atención a sus relaciones anatomofuncionales, el NPP está conectado con estructuras claves del control motor como son: la corteza prefrontal, los GB, estructuras límbicas, el tálamo, el cerebelo y la médula espinal (Lee et al., 2000; Ferraye et al., 2011).
Al mismo tiempo el NPP proyecta a diferentes núcleos troncoencefálicos entre ellos: los núcleos renales (que participan en el control de la musculatura axial), el núcleo de la oliva ticuloespiinferior, los núcleos motores de los pares craneales y núcleos sensoriales como el del tracto solitario así como también proyecta al grupo de interneuronas de la médula espinal a través del haz reticuloespinal medial (Homma et al., 2002). Una de las funciones más importantes del NPP está relacionada con la locomoción al formar parte de la región locomotora mesencefálica (RLM), una de las zonas del tallo cerebral donde una estimulación eléctrica de muy baja amplitud induce o mejora la locomoción (García-Rill, 1991; Hathout y Bhidayasiri, 2005; García Rill et al., 2011). La RLM no ha sido definida desde el punto de vista anatómico pero sí se sabe que funcionalmente comprende varios núcleos anatómicamente bien definidos, entre ellos el núcleo cuneiforme y las zonas rostral y peribraquial del NPP (Garcia Rill, 1991; García Rill et al., 2011).
La locomoción bípeda humana es diferente de la locomoción en otros mamíferos bípedos en concordancia con los cambios jerárquicos acontecidos en la evolución filogenética (Barton y Harvey, 2000). Los estudios en roedores y primates no humanos han revelado que la evolución de la locomoción cuadrúpeda a bípeda no afectó las diferentes estructuras anatómicas pero sí la conectividad entre estas (Barton y Harvey, 2000). Con respecto al NPP su topografía es probablemente similar en muchos mamíferos no así la distribución de sus circuitos y la proporción de neuronas colinérgicas, glutamatérgicas y gabaérgicas presentes en dicha estructura (Alan et al., 2011).
IMPORTANCIA DE LA RELACIÓN MORFOFISIOLÓGICA ENTRE EL NPP Y LA SNpc APORTE DE LOS MODELOS EXPERIMENTALES DE EP
El NPP y la SNpc están conectados de forma recíproca por medio de proyecciones colinérgicas y glutamatérgicas pontinas que alcanzan la SNpc bilateralmente y una proyección dopaminérgica nigral que llega al NPP (Breit et al., 2006).
Los estudios inmunohistoquímicos han confirmado que los axones colinérgicos del NPP terminan en las neuronas dopaminérgicas de la SNpc y del área tegmental ventral (ATV), estableciendo contactos sinápticos asimétricos con las dendritas y el soma de estas neuronas (Bentivoglio y Morelli, 2005). Células nigrales, un segundo componente lento que implica una reducción por debajo del nivel basal en la liberación de dopamina (Forster y Blaha, 2003). Esta fase es dependiente de receptores colinérgicos muscarínicos de la familia M2 que son receptores metabotrópicos acoplados a la inhibición del sistema de la adenilato ciclasa y se expresan en las células del NPP (Forster y Blaha, 2003). Por último un componente tardío que implica liberación sostenida de dopamina durante aproximadamente 30 min en ratas anestesiadas y que en este caso también está mediada por receptores colinérgicos muscarínicos, pero de la familia M3-M5, acoplados a la activación del sistema de la fosfolipasa y la movilización del calcio intracelular (Forster y Blaha, 2003). Asimismo existen evidencias de que la liberación somatodendrítica de dopamina que facilita la función motora por mecanismos independientes de la actividad dopaminérgica nigroestriatal, es también modulada por la actividad colinérgica mediada por receptores muscarínicos que se expresan en la SNpc (Andersson et al., 2010).
En la última década se ha estudiado extensamente la relación morfofisiológica entre el NPP y la SNpc con un énfasis particular en la participación del NPP en el control motor y en la contribución de la disfunción pontina a la fisiopatología de la enfermedad de Parkinson.
En esta dirección la lesión excitotóxica unilateral del NPP en primates no humanos induce un síndrome parkinsoniano caracterizado por la postura flexionada del tronco e hipocinesia severa contralateral tanto en la extremidad superior como en la inferior (Kojima et al., 1997). Aunque no se han dilucidado completamente los mecanismos que pueden explicar estos efectos, se señala que la lesión del NPP puede reducir la influencia excitatoria que este tiene sobre la red de interneuronas de la médula espinal a través de sus proyecciones descendentes. Alternativamente la interrupción de las proyecciones ascendentes desde el NPP hasta el tálamo o núcleos de los GB puede influenciar directa o indirectamente la actividad talamocortical (Kojima et al., 1997). Un estudio reciente ha demostrado que la lesión bilateral del NPP en primates no humanos resulta en un cuadro de inestabilidad postural y severos trastornos de la marcha que no son corregidos con la administración de agonistas dopaminérgicos (Karachi et al., 2010). Este hallazgo es concomitante con que los síntomas axiales de la EP en etapas tardías de la misma, no responden al tratamiento farmacológico dopaminérgico convencional probablemente debido a que estos síntomas están asociados a la degeneración completa y bilateral de las neuronas colinérgicas pontinas (Karachi et al., 2010).
En esta misma línea de evidencias, la lesión excitotóxica del NPP en ratas sanas induce un incremento significativo de la actividad eléctrica de las neuronas glutamatérgicas del NST y gabaérgicas de la SNpr (Breit et al., 2005). Asimismo este proceder se acompaña de una disminución significativa de la tasa de descarga de potenciales de acción de las neuronas dopaminérgicas nigrales (Breit et al., 2005). Ambos grupos de cambios funcionales son similares a los encontrados en el modelo de hemiparkinsonismo por inyección intracerebral de 6-hidroxidopamina (6-OHDA). Esta similaridad sugiere que la pérdida de la influencia excitatoria del NPP sobre la SNpc después de la lesión del primero pone en marcha una cascada de disfunción eléctrica que se mueve del puente al mesencéfalo y modifica la neurotransmisión en las vías "directa" e "indirecta" del circuito motor (Breit et al., 2005; Breit et al., 2006). Se plantea entonces que la hiperactividad del NST y de la SNpr es mediada por cambios en circuitos polisinápticos que se inician con la pérdida de la influencia excitatoria pontina sobre la SNpc y la subsiguiente disfunción dopaminérgica nigral. Esta evolución tiene puntos de contacto con el curso de los cambios que se suceden posteriores a la lesión neurotóxica de la SNpc (Vila et al., 1997; Vila et al., 2000).
Por otra parte, los estudios en modelos animales de EP han contribuido significativamente al mejor conocimiento de la relación morfofisiólogica entre el NPP y la SNpc. En ratas hemiparkinsonizadas se ha hallado un incremento de la actividad eléctrica de las células pontinas que se revierte con la lesión excitotóxica del NST (Breit et al., 2001). En este mismo modelo de lesión nigral por administración intracerebral de 6-OHDA se ha encontrado un incremento significativo de las concentraciones extracelulares de glutamato y ácido g-aminobutírico en el NPP (Blanco et al., 2009). Este incremento parece estar en concordancia con la hiperactividad glutamatérgica subtalámica y gabaérgica de los núcleos eferentes de los GB (Blanco et al., 2009).
En primates no humanos parkinsonizados por inyección sistémica de 1-metil-4-fenil- 1,2,3,6-tetrahidropiridina (MPTP), el bloqueo farmacológico de la actividad gabaérgica inhibitoria que recibe el NPP, hiperactiva en condiciones de parkinsonismo, produce un efecto cinético en los animales (Nandi et al., 2002a). Este conjunto de resultados junto al mejor conocimiento de la anatomía regional y la fisiología de los núcleos mesencefálicos y pontinos permitió enunciar la siguiente hipótesis: en la EP existe una disfunción en la transmisión desde los núcleos eferentes de los GB al NPP que esencialmente conduce a la hipoactividad del área locomotora mesencefálica y del propio NPP (Pahapill y Lozano, 2000; Nandi et al., 2008). Paralelamente se abrieron nuevas posibilidades al tratamiento quirúrgico de la acinesia-hipocinesia parkinsoniana atenuando la hipoactividad del NPP mediante su estimulación a baja frecuencia (Nandi et al., 2002a; Mazzone et al., 2005).
Al mismo tiempo se conoce la pérdida de inervación dopaminérgica al NPP en monos parkinsonizados por administración de MPTP lo cual pudiera ser parte de la fisiopatología de los trastornos de la postura y de la marcha presentes en las etapas más tardías de la EP (Rolland et al., 2009).
Este resultado concuerda con el hallazgo de una fuerte correlación negativa entre la pérdida de neuronas colinérgicas en el NPP y el mayor puntaje en la escala de Hohen y Yhar en pacientes con EP avanzada caracterizada por la presencia de síntomas axiales de la enfermedad (Rinne et al., 2008).
Los hallazgos descritos anteriormente han sugerido que ambos grupos celulares, las neuronas colinérgicas del NPP y las dopaminérgicas de la SNpc, pudieran ser objeto de mecanismos patogénicos comunes que pueden disparar procesos de muerte celular (Stein, 2009). Entre estos mecanismos se discute el estrés oxidativo con lesiones y anomalías originadas por radicales libres y peroxidación lipídica subsiguiente junto a un deficiente sistema intracelular de defensa antioxidante en el caso de la SNpc (Souza et al., 2007; Ebadi y Sharma, 2003).
Así, en la actualidad el estudio de la participación del NPP en la fisiopatología de la EP toma en cuenta dos vertientes diferentes que tienen puntos de confluencia. La primera de ellas está relacionada con la pérdida temprana de la influencia excitatoria pontina sobre la SNpc. La segunda vertiente ubica la estimulación a baja frecuencia del NPP como tratamiento quirúrgico beneficioso para los signos axiales de la EP, refractarios a otros tratamientos farmacológicos y quirúrgicos y que se presentan en etapas más tardías de esta entidad.
LA DISFUNCIÓN TEMPRANA DEL NPP PUDIERA CONDUCIR A LA DEGENERACIÓN DE LAS NEURONAS DOPAMINÉRGICAS DE LA SNpc
En relación con la primera de las vertientes, como se ha señalado anteriormente, el NPP es la principal fuente de aferencias excitatorias glutamatérgicas y la única fuente de aferencias colinérgicas a la SNpc (Groenewegen y Dongen, 2007). Estas proyecciones parecen ser determinantes en el mantenimiento de la función dopaminérgica y el control dopaminérgico de la actividad estriatal (Giovanni y Shi, 2009). Adicionalmente estas proyecciones tienen la peculiaridad de ser bilaterales por lo que los efectos de la degeneración pontina alcanzan a la SNpc en ambos lados (Breit et al., 2008).
Las enfermedades neurodegenerativas frecuentemente están asociadas a la disfunción de los mecanismos promotores de la supervivencia neuronal (De Sarno et al., 2003). La acumulación de proteínas mal formadas o los insultos tóxicos pueden constituir un desafío para el funcionamiento óptimo de los mismos (Bolaños et al., 1997). Cuando el daño excede las posibilidades de dichos mecanismos o de los sistemas de defensa neuronal, se produce la muerte prematura de las neuronas cuando aún no son evidentes los signos y síntomas clásicos de estas entidades (De Sarno et al., 2003). A largo plazo se produce depoblación neuronal asociada a la disfunción de uno o varios circuitos con los efectos catastróficos ya evidentes en el paciente (De Souza et al., 2007).
Es ampliamente conocido que el establecimiento de contactos sinápticos es un factor crítico para la supervivencia neuronal durante el desarrollo, por lo cual la actividad sináptica también puede ser determinante en el reforzamiento de las defensas celulares frente a insultos tóxicos que puedan disparar o potenciar procesos degenerativos (Tobin y Budd, 2003).
En este sentido, la degeneración temprana del NPP puede ocasionar una alteración en la transmisión sináptica NPP-SNpc mediada por receptores colinérgicos muscarínicos. La literatura señala que la pérdida o disminución de la señalización colinérgica mediada por los receptores colinérgicos muscarínicos puede incrementar la vulnerabilidad de las neuronas a eventos de tipo oxidativo que activen programas de muerte celular (De Sarno et al., 2003) (Figs. 3A). Se sabe que la transmisión colinérgica muscarínica óptima es esencial en la inhibición de las cascadas dependientes de caspasas y que las vías de señalización responsables de este efecto neuroprotector están asociadas a una menor translocación de la proteína Bax, proapoptótica, a la mitocondria neuronal (Giordano et al., 2009). La actividad muscarínica parece estar relacionada con el mantenimiento del balance intracelular entre proteínas proapoptóticas y proteínas antiapoptóticas (Tobin y Budd, 2003; De Sarno et al., 2005) (Figs. 3B).
Por otra parte, se conoce extensamente la importancia del sistema enzimático del glutatión (GSH) el cual juega un rol antioxidante esencial detoxificando a la célula de diferentes compuestos electrofílicos y peróxidos (Townsend et al., 2003). El sistema GSH se encuentra en concentraciones de milimolar en el cerebro y se conoce que este órgano es más susceptible que otros tejidos al daño oxidativo (Townsend et al., 2003). Como parte del metabolismo dopaminérgico se generan especies reactivas de oxígeno (ERO) y la eliminación de estos por la actividad del GSH propicia un mecanismo de protección a las células dopaminérgicas nigrales (De Souza et al., 2007). La disminución de las concentraciones de GSH per se no parece ser suficiente para inducir muerte celular porque el butionín sulfoximide (BSO), un inhibidor de la síntesis de GSH, no es tóxico para las neuronas nigrales (Toffa et al., 1997). Sin embargo, la menor actividad del sistema del glutatión concomitante con la disfunción mitocondrial puede potenciar los eventos disparadores de mecanismos de muerte celular en las neuronas de la SNpc (Ballatori et al., 2009). (Figs. 3B). La habilidad del BSO para disminuir los niveles de GSH es fundamentalmente restringido al citosol donde se localiza la glutamil cisteína sintetasa, una de las dos enzimas que inician la ruta de síntesis de GSH, con poco efecto sobre el grupo mitocondrial de GSH (Townsend et al., 2003). El grupo mitocondrial se mantiene a expensas del citosólico y solo cuando este último resulta extensamente depletado, se produce una afectación a nivel mitocondrial (Toffa et al., 1997). Los efectos de la disminución de la actividad GSH pueden involucrar daño a las macromoléculas inducido por estrés oxidativo junto a una interrupción de la señalización que gobierna el estatus redox de las neuronas dopaminérgicas (Toffa et al., 1997; Han et al., 1999). Estos efectos pueden a largo plazo, converger en procesos deletéreos para las neuronas nigrales (Andersen et al., 1996). En línea con estas evidencias, el curso progresivo de la EP ha sido asociado con una pérdida de la homeostasis del sistema del glutatión junto al consecuente incremento de las ERO en la SNpc (De Souza et al., 2007; Ballatori et al., 2009).
La actividad GSH y la función colinérgica mediada por receptores colinérgicos muscarínicos tienen un punto de convergencia en el mantenimiento de la supervivencia celular (Budd et al., 2004). La tasa de síntesis de GSH es controlada por la expresión y actividad catalítica de la g glutamil cisteína-ligasa (GCL) y la disponibilidad de cisteína (Townsend et al., 2003). Las modificaciones en la neurotransmisión colinérgica mediada por M3 pueden disminuir la actividad GCL y en consecuencia reducir drásticamente los niveles de GSH citosólicos quedando expuesta la célula al efecto deletéreo de las ERO (Giordano et al., 2009) (Figs. 3B).
En estas condiciones pudiera incrementarse la vulnerabilidad de las neuronas a los aminoácidos excitatorios como el glutamato (Glu) actuando sobre sus receptores AMPA/ KA y NMDA (Oja et al., 2000). La activación de estos receptores promueve la salida de GSH al espacio extracelular perpetuándose la disminución de los niveles intracelulares de GSH (Oja et al., 2000).
La concurrencia de eventos intracelulares como la disminución de la actividad de GSH y la mayor concentración de Ca2+ producto de la activación de eventos relacionados con la neurotransmisión glutamatérgica conduce a una producción excesiva de ERO que no pueden ser neutralizados por un deficiente sistema GSH (Kolesnikova y Serebrovskaya, 2003). En este escenario celular y molecular se desencadenan eventos de peroxidación lipídica con la consecuente ruptura de las uniones de membrana y la pérdida de la homeostasis iónica que conducen en el tiempo a la muerte celular neuronal (Kolesnikova y Serebrovskaya, 2003) (Figs. 3B).
Los mecanismos expuestos anteriormente pueden ser parte del sustrato molecular que explique la asociación entre la degeneración temprana del NPP y la degeneración de las neuronas dopaminérgicas de la SNpc.
ESTIMULACIÓN ELÉCTRICA DEL NPP COMO ALTERNATIVA QUIRÚRGICA EN LA EP
El resurgimiento del tratamiento quirúrgico como alternativa terapéutica para la EP está relacionado con el fracaso de la L-Dihidroxifenilalanina (L-DOPA) terapia a largo plazo junto al desarrollo de los sistemas de registro de actividad eléctrica de núcleos profundos del cerebro y las técnicas de imágenes de alta resolución (Rodríguez-Oroz et al., 2001). Distintos signos y síntomas de la EP han sido tratados con técnicas de estimulación en diferentes núcleos de los GB (Kumar et al., 2000; Trošt et al., 2006). Existen evidencias de mejoría significativa de las discinesias, las fluctuaciones motoras, el temblor y la rigidez después de la estimulación del NST o el globus pallidus (Guridi et al., 2000; Nilsson et al., 2008). No obstante, los estudios clínicos posquirúrgicos coinciden en señalar que los síntomas axiales de la enfermedad, permanecen sin responder adecuadamente a la estimulación de estas estructuras a lo que se añade que no existe una comprensión total de la fisiopatología de estos últimos síntomas (Lozano y Snyder, 2008; Okun y Foote, 2010). Los primeros reportes de estimulación a baja frecuencia del NPP datan del año 2005 (Mazzone et al., 2005) y desde entonces hasta la fecha ha habido un número creciente de trabajos que abordan esta alternativa terapéutica (Mazzone et al., 2011).
La localización del NPP como blanco quirúrgico ha revolucionado los métodos convencionales que se utilizaban para localizar con exactitud otras dianas quirúrgicas, lo cual es loable si se tiene en consideración que este territorio neuroquirúrgico no había sido extensamente abordado con anterioridad (Zrinzo et al., 2008; Ferraye et al., 2010). Así, en el caso del NPP se ha desarrollado la obtención de imágenes tomográficas angiocomputarizadas junto a la reconstrucción tridimensional de núcleos y vasos sanguíneos a diferencia de los métodos de localización tradicional basados en puntos de referencia obtenidos a través de la evaluación de la línea intercomisural (Mazzone et al., 2011; Thevathasan et al., 2012).
Desde el punto de vista funcional, el estudio del sustrato neural del control de la marcha reveló una relación clara entre los parámetros de estimulación de diferentes sitios del cerebro, el tronco encefálico y la actividad locomotora (Devos et al., 2010). Asimismo, la inyección de sustancias neuroactivas en la zona conocida como área locomotora mesencefálica, de la cual el NPP forma parte, conduce a un incremento de la actividad de locomoción en animales de experimentación (García Rill y Skinner, 1987).
Los estudios posteriores tanto en modelos experimentales como en pacientes parkinsonianos demostraron que la estimulación del NPP a baja frecuencia (30-70 Hz), tiene un efecto beneficioso sobre los síntomas axiales de la EP (Nandi et al., 2002b; Weinberg et al., 2008; Capozzo et al., 2009; Ferraye et al., 2009; Rauch et al., 2010). Varios mecanismos se discuten para explicar este hallazgo entre ellos está, que este proceder modula la descarga disfuncional de las neuronas glutamatérgicas subtalámicas llevando la misma a un nivel más compatible con su propia fisiología (Androulidakis et al., 2008; Capozzo et al., 2009).
CONCLUSIONES
El NPP ha emergido como una estructura esencial en la comprensión de la fisiopatología de la EP dado sus relaciones con los núcleos de los ganglios basales, el tálamo, la corteza motora y la médula espinal. Por una parte su disfunción temprana ha marcado una pauta en el estudio de la fase presintomática de la EP mientras que el efecto beneficioso de su estimulación a baja frecuencia en las etapas más avanzadas de esta entidad, ha abierto una alternativa terapéutica de tipo quirúrgica a los signos axiales refractarios a otras alternativas de tratamiento quirúrgico y farmacológico. No obstante, múltiples interrogantes persisten aún sobre el funcionamiento de las distintas poblaciones neuronales presentes en el NPP y su relación con la fisiopatología de los trastornos motores.
AGRADECIMIENTOS
A las siguientes instituciones: Centro Internacional de Restauración Neurológica (CIREN), Habana, Cuba y a la Universidad del Tolima, Colombia. El presente artículo científico fue apoyado por el proyecto de estudios de doctorado de la primera autora, Lisette Blanco Lezcano, financiado por la Vicedirección de Ciencia y Tecnología del CIREN.
BIBLIOGRAFÍA
ALAN M, SCHWABE K, KRAUSS JK. The pedunculopontine nucleus area: critical evaluation of interspecies differences relevant for its use as a target for deep brain stimulation. Brain. 2011;134(1):11-23. [ Links ]
ANDERSEN JK, HOM DG, LEE FY, HARNISH P, HAMILL RW, MCNEIL TH. Effect of buthionine sulfoximine, a synthesis inhibitor of the antioxidant glutathione, on the murine nigrostriatal neurons. J Neurochem. 1996;67(5):2164-2171. [ Links ]
ANDERSSON DR, BJÖRNSSON E, BERGQUIST F, NISSBRANDT H. Motor activity-induced dopamine release in the substantia nigra is regulated by muscarinic receptors. Exp Neurol. 2010;221(1):251-259. [ Links ]
ANDROULIDAKIS AG, MAZZONE P, LITVAK V, PENNY W, DILEONE M, DOYLE GAYNOR LMF, TISCH S, DI LAZZARO V, BROWN P. Oscillatory activity in the pedunculo-pontine area of patients with Parkinson's disease. Exp Neurol. 2008;211(1):59-66. [ Links ]
BALLATORI N, KRANZE SM, NOTEMBOON S, SHI S, TIEU K, HAMMOND CL. Glutathione dysregulation and the etiology and progression of human diseases. Biol Chem. 2009;390(3):191-214. [ Links ]
BARROSO-CHINEA P, RICO AJ, CONTE-PERALES L, GÓMEZ V, LUQUIN N, SIERRA S. et al. Glutamatergic and cholinergic pedunculopontine neurons innervate the thalamic parafascicular nucleus in rat: changes following experimental parkinsonism. Brain Struct Funct. 2011;216(4):319-330. [ Links ]
BARTON RA, HARVEY PH. Mosaic evolution of brain structure in mammals. Nature. 2000;405(6790):1055-1058. [ Links ]
BENTIVOGLIO M, MORELLI M. The Organization and circuits of mesencephalic dopaminergic neurons and the distribution of dopamine receptors in the brain. En: Dunnett SB, Bentivoglio M, Björklund A, Hökfelt T, editores. Handbook of Chemical Neuroanatomy. Vol. 21. Dopamine. Amsterdam. Elsevier BV; 2005. p. 1-43. [ Links ]
BLANCO L, LORIGADOS L, OROZCO S, ROCHA L, PAVÓN N, GLEZ MAE, et al. Changes in Glu and GABA extracellular concentrations and cell death process in the pedunculopontine nucleus of hemiparkinsonian rats. J Biol Res-Thessaloniki. 2009;11(1):3-11. [ Links ]
BOHNEN NI, MÜLLER ML, KOEPPE RA, STUDENSKI SA, KILBOURN MA, FREY KA, et al. History of falls in Parkinson disease is associated with reduced cholinergic activity. Neurology. 2009;17(20):1670-1676. [ Links ]
BOHNEN NI, ALBIN RL. The cholinergic system and Parkinson's disease. Behav Brain Res. 2010;221(2):564-573. [ Links ]
BOLAÑOS JP, ALMEIDA A, STEWART V, PEUCHEN S, LAND JM, CLARK JB. Nitric oxide-mediated nitochondrial damage in the brain: mechanisms and implications for neurodegenerative diseases. J Neurochem. 1997;68(6):2227-2240. [ Links ]
BRAAK H, GHEBREMEDHIN E, RÜB U, BRATZKE H, DEL TREDICI K. Stages in the development of Parkinson's disease-related pathology. Cell Tissue Res. 2004;318(1):121-134. [ Links ]
BREIT S, BOUALI-BENAZZOUZ R, BENABID AL, BENAZZOUZ A. Unilateral lesion of the nigrostriatal pathway induces an increase of neuronal activity of the pedunculopontine nucleus, which is reversed by the lesion of the subthalamic nucleus in the rat. Eur J Neurosc. 2001;14(11):1833-1842. [ Links ]
BREIT S, LESSMANN L, BENAZZOUZ A, SCHULZ JB. Unilateral lesion of the pedunculopontine nucleus induces hyperactivity in the subthalamic nucleus and substantia nigra in the rat. Eur J Neurosci. 2005;22(9):2283-2294. [ Links ]
BREIT S, LESSMANN L, UNTERBRINK D, POPA RC, GASSER T, SCHULZ JB. Lesions of the pedunculopontine nucleus reverse hyperactivity of the subthalamic nucleus and substantia nigra pars reticulata in a 6-hydroxidopamine rat model. Eur J Neurosci. 2006;24(8):2275-2282. [ Links ]
BREIT S, MARTIN A, LESSMANN L, CERKEZ D, GASSER T, SCHULZ JB. Bilateral changes in neuronal activity of the Basal Ganglia in the unilateral 6-OHDA rat model. J Neurosc Res. 2008;86(6):1388-1396. [ Links ]
BUDD DC, SPRAGG EJ, RIDD K, TOBIN AB. Signalling of the M3-muscarinic receptor to the anti-apoptotic pathway. Biochem J. 2004;381(Pt.1):43-49. [ Links ]
CAPOZZO A, FLORIO T, CONFALONE G, MINCHELLA D, MAZZONE P, SCARNATI E. Low Frecuency stimulation of the pedunculopontine nucleus modulates electrical activity of subthalamic neurons in the rat. J Neural Transm. 2009;116(1):51-56. [ Links ]
CLEMENTS JR, GRANT S. Glutamate-like immunoreactivity in neurons of the laterodorsal tegmental and pedunculopontine nuclei in the rat. Neurosc Lett. 1990;120(1):70-73. [ Links ]
DE SARNO P, SHESTOPAL SA, KING TD, ZMIJEWSKA A, SONG L, JOPE RS. Muscarinic receptor activation protects cells from apoptotic effects of DNA damage, oxidative stress, and mithocondrial inhibition. J Biol Chem. 2003;278(13):11086-11093. [ Links ]
DE SARNO P, SHESTOPAL SA, ZMIJEWSKA A, SONG L, JOPE RS. Anti-apoptotic effects of muscarinic receptor activation are mediated by Rho kinase. Brain Res. 2005;1041(1):112-115. [ Links ]
DE SOUZA J, SHETTY B, SUDHA K, RAO G. Glutathione and related enzymes in Parkinson s Disease. Biomed Res. 2007;18(2):106-108. [ Links ]
DEVOS D, DEFEBVRE L, BORDET R. Dopaminergic and non dopaminergic pharmacological hypotheses for gait disorders in Parkinson s disease. Fundam Clin Pharmacol. 2010;24(4):407-421. [ Links ]
EBADI M, SHARMA SK. Peroxynitrate and mitochondrial dysfunction in the pathogenesis of Parkinson's disease. Antioxid Redox Signal. 2003;5(3):319-335. [ Links ]
FERRAYE MU, DEBU B, FRAIX V, GOETZ L, ARDOUIN C, YELNIK J, et al. Effects of pedunculopontine nucleus area stimulation on gait disorders in Parkinson's disease. Brain. 2010;133(1):205-214. [ Links ]
FERRAYE MU, DEBÛ B, FRAIX V, KRACK P, CHARBARDES S, SEIGNEURET E, et al. Subthalamic nucleus versus pedunculopontine nucleus stimulation in Parkinson s disease: synergy or antagonism? J Neural Transm. 2011;118(10):1469-1475. [ Links ]
FORSTER GL, BLAHA CD. Pedunculopontine tegmental stimulation evokes striatal dopamine efflux by activation of acetylcholine and glutamate receptors in the midbrain and pons of the rat. Eur J Neurosc. 2003;17(4):751-762. [ Links ]
GAI WP, HALLIDAY GM, BLUMBERGS PC, GEFFEN LB, BLESSING WW. Substance P containing neurons in the mesopontine tegmentum are severely affected in Parkinson's disease. Brain. 1991;114(Pt 5):2253-2267. [ Links ]
GARCÍA-RILL E, SKINNER RD. The mesencephalic locomotor region. Projections to reticulospinal neurons. Brain Res. 1987;411(1):13-20. [ Links ]
GARCÍA-RILL E. The Pedunculopontine Nucleus. Prog Neurobiol. 1991;36(5):363-389. [ Links ]
GARCÍA-RILL E, SIMON CH, SMITH K, KEZUNOVIC N, HYDE J. The pedunculopontine tegmental nucleus: from basic neuroscience to neurosurgical applications. J Neural Transm. 2011;118(10):1397-1407. [ Links ]
GIORDANO G, LI L, WHITE CC, MARIN FM, WILKERSON HW, KAVANAGH TJ, COSTA LG. Muscarinic receptors prevent oxidative stress - mediated apoptosis induced by domoic acid in mouse cerebellar granule cells. J Neurochem. 2009;109(2):525-538. [ Links ]
GIOVANNI GD, SHI WX. Effects of Scopolamine on Dopamine Neurons in the Substantia Nigra: Role of the Pedunculopontine Tegmental Nucleus. Synapse. 2009;63(8):673-680. [ Links ]
GROENEWEGEN HJ, DONGEN YC. Role of the basal ganglia. En: Wolters, Van Laar, Berendse, editores. Parkinsonism and Related Disorders. Amsterdam: VU University Press; 2007. p. 21-27. [ Links ]
GURIDI J, RODRÍGUEZ-OROZ MC, LOZANO A, MORO E, ALBANESE A, NUTTIN B, et al. Targeting the basal ganglia for deep brain stimulation in Parkinson's disease. Neurology. 2000;55(Supl. 6):21-28. [ Links ]
HAN J, CHENG F, YANG Z, DRYURST G. Inhibitors of Mitochondrial Res- piration, Iron (II), and Hydroxyl Radical Evoke Release and Extracellular Hydrolysis of Glutathione in Rat Striatum and Substantia Nigra: Potencial Implications to Parkinson's Disease. J Neurochem. 1999;73(4):1683-1695. [ Links ]
HATHOUT GM, BHIDAYASIRI R. Midbrain Ataxia: An Introduction to the Mesencephalic Locomotor Region and the Pedunculopontine Nucleus. Am J Roentgenol. 2005;184(3):953-956. [ Links ]
HENDERSON JM, CARPENTER K, CARTWRIGHT H, HALLIDAY GM. Loss of thalamic intralaminar nuclei in progressive supranuclear palsy and Parkinson s disease: clinical and therapeutics implications. Brain. 2000;123(Pt.7):1410-1421. [ Links ]
HOMMA Y, SKINNER RD, GARCÍA-RILL E. Effects of Pedunculopontine stimulation on caudal pontine reticular formation neurons in vitro. J Neurophysiol. 2002;87(6):3033-3047. [ Links ]
IKEDA H, AKIYAMA G, MATSUZAKI S, SATO M, KOHHIKAWA N, COOLS AR. GABAA receptors in the pedunculopontine tegmental nucleus play a crucial role in rat shell-specific dopamine mediated, but not shell-specific acetylcholine mediated turning behaviour. Neurosci. 2004;125(3):553-562. [ Links ]
JELLINGER KA. Synuclein deposition and non-motor symtoms in Parkinson disease. J Neurol Sci. 2011;310(1-2):107-111. [ Links ]
KARACHI C, GRABLI D, BERNARD FA, TANDE D, WATTIEZ N, BELAID H. Cholinergic mesencephalic neurons are involved in gait and postural disorders in Parkinson disease. J Clin Invest. 2010;120(8):2745-2754. [ Links ]
KITA T, KITA H. Cholinergic and non-cholinergic mesopontine tegmental neurons projecting to the subthalamic nucleus in the rat. Eur J Neurosc. 2011;33(3):433-443. [ Links ]
KOJIMA J, YAMAJI Y, MATSUMURA M, NAMBU A, INASE M, TOKUNO H, et al. Excitotoxic lesions of the pedunculopontine tegmental nucleus produce contralateral hemiparkinsonism in the monkey. Neurosc Lett. 1997;226(2):111-114. [ Links ]
KOLESNIKOVA EE, SEREBROVSKAYA TV. Parkinson's disease: mechanisms of neuronal death. Neurophysiology. 2003;35(1):54-66. [ Links ]
KUMAR R, LANG AE, RODRÍGUEZ-OROZ MC, LOZANO AM, LIMOUSINE P, POLLAK P, et al. Deep brain stimulation of the globus pallidus pars interna in advanced Parkinson's disease. Neurology. 2000;55(12 Suppl 6):34-39. [ Links ]
LANGE KW, WELLS FR, JENNER P, MARSDEN CD. Altered muscarinic and nicotinic receptor densities in cortical and subcortical brain regions in Parkinson's disease. J Neurochem. 1993;60(1):177-203. [ Links ]
LECOURTHIER L, NELLY PH. A conductor hidden in the orchestra? Role of the habenular complex in monoamine transmission and cognition. Neurosc Beh Rev. 2007;31(5):658-672. [ Links ]
LEE MS, RINNE JO, MARSDEN D. The Pedunculopontine nucleus: its role in the genesis of movement disorders. Yonsei Medical J. 2000;41(2):167-184. [ Links ]
LOZANO A, SNYDER BJ. Deep Brain Stimulation for parkinsonian disorders. J Neurol. 2008;255(Suppl 4):30-31. [ Links ]
MAZZONE P, LOZANO A, STANZIONE P, GALATI S, SCARNATI E, PEPPE A, STEFANI A. Implantation of human pedunculopontine nucleus: A safe and clinically relevant target in Parkinson's disease. Neuroreport. 2005;16(17):1877-1881. [ Links ]
MAZZONE P, SPOSATO S, INSOLA A, SCARNATI E. Commentary: The pedunculopontine nucleus: clinical experience, basic questions and future directions. J Neural Transm. 2011;118(10):1391-1396. [ Links ]
MENA-SEGOVIA J, BOLAM JP, MAGILL PJ. Pedunculopontine nucleus and basal ganglia: Distint relatives or part of the same family? Trends Neurosci. 2004;27(10):585-588. [ Links ]
MENA-SEGOVIA J, MICKLEM BR, NAIR-ROBERTS RG, UNGLESS MA, BOLAM JP. GABAergic neuron distribution in the pedunculopontine nucleus defines functional sub territories. J Comp Neurol. 2009;515(4):397-408. [ Links ]
MESULAM MM, MUFSON EJ, WAINER BH, LEVEY AI. Central cholinergic pathways in the rat: an overview based on an alternative nomenclature (Ch1-Ch6). Neurosci. 1983;10(4):1185-1201. [ Links ]
MULLER T, FUNCHS G, HAHNE M, KLEIN W, SCHAWARZ M. Diagnostic aspects of early Parkinson'sdisease. J Neurol. 2006;253(Suppl. 4):29-31. [ Links ]
NANDI D, AZIZ T, GILADI N, WINTER J, STEIN JF. Reversal of akinesia in experimental parkinsonism by GABA antagonist microinjections in the pedunculopontine nucleus. Brain. 2002a;125(Pt.11):2418-2430. [ Links ]
NANDI D, LIU X, WINTER J, AZIZ T, STEIN JF. Deep brain stimulation of the pedunculopontine region in the normal non-human primate. J Clin Neurosc. 2002b;9(2):170-174. [ Links ]
NANDI D, JENKINSON N, STEIN J, AZIZ T. The pedunculopontine nucleus in Parkinson's disease: primate studies. Brit J Neurosurg. 2008;22(Suppl 1):S4-S8. [ Links ]
NILSSON MH, JARNLO GB, REHNCRONA S. Functional balance performance in patients with Parkinson's disease after long-term treatment with subthalamic nucleus high-frequency stimulation. Parkinsonism Relat Disord. 2008;14(4):291-297. [ Links ]
OJA SS, JANAÂKY R, VARGA V, SARANSAARI P. Modulation of glutamate receptor functions by glutathione. Neurochem Int. 2000;37(2-3):299-306. [ Links ]
OKUN M, FOOTE K. Parkinson s disease DBS: what, when, who and why? The time has come to tailor DBS target. Expert Rew Neurotherapy. 2010;10(12):1847-1857. [ Links ]
PAHAPILL PA, LOZANO A. The pedunculopontine nucleus and Parkinson's disease. Brain. 2000;123(Pt.9):1767-1783. [ Links ]
PAXINOS G, WATSON C. The Rat Brain in Stereotaxic Coordinates. Academic Press, NY; 1998. p. 46-53. [ Links ]
RAUCH F, SCHWABE K, KRAUSS JK. Effect of deep brain stimulation in the pedunculopontine nucleus on motor function in the rat 6-hydroxydopamine Parkinson model. Beh Brain Res. 2010;210(1):46-53. [ Links ]
RINNE JO, YONG S, SIK M, COLLAN Y, RÖYTTÄ M. Loss of cholinergic neurons in the pedunculopontino nucleus in Parkinson's disease is related to disability of the patients. Parkinsonism Relat Disord. 2008;14(7):553-557. [ Links ]
RODRÍGUEZ-OROZ MC, RODRÍGUEZ M, GURIDI J, MEWES K, CHOCKKMAN V, VITEK J, DELONG MR, OBESO JA. The subthalamic nucleus in PD: somatotopic organization and physiological characteristics. Brain. 2001;124(Pt.9):1777-1790. [ Links ]
ROLLAND AS, TANDÉ D, HERRERO MT, LUQUIN MR, VÁZQUEZ-CLAVERIE M, KARACHI C. HIRSCH EC, CHANTAL F. Evidence for a dopaminergic innervation of the pedunculopontine nucleus in monkeys, and its drastic reduction after MPTP intoxication. J Neurochem. 2009;110(4):1321-1329. [ Links ]
RYE D, LEE H, SAPER C, WAINER B. Medullary and spinal efferents of the PPN tegmental nucleus and adyacent mesopontine tegmentum in the rat. J Comp Neurol. 1988;269(3):315-341. [ Links ]
SOUZA J, SHETTY VB, SUDHA K, GAYATHRI MR. Glutathione and related enzymes in Parkinson's Disease. Biom Res. 2007;18(2):106-108. [ Links ]
STEIN JF. Akinesia, motor oscillations and the pedunculopontine nucleus in rats and men. Exp Neurol. 2009;215(1):1-4. [ Links ]
THEVATHASAN W, POGOSYAN A, HYAM JA, JENKINSON N, FOLTYNIE T, LIMOUSIN P. et al. Alpha oscillations in the pedunculopontine nucleus correlate with gait performance in parkinsonism. Brain. 2012;135(Pt.1):148-160. [ Links ]
TOBIN AB, BUDD DC. The anti-apoptotic response of the Gq/11-coupled muscarinic receptor family. Biochem Soc Transactions. 2003;31(6):1182-1185. [ Links ]
TOFFA S, KUNIKOWSKA GM, ZENG BY, JENNER P, MARSDEN CD. Glutathione depletion in rat brain does not cause nigrostriatal pathway degeneration. J Neural Transm. 1997;104(1):67-75. [ Links ]
TOWNSEND DM, TEW KD, TAPIERO H. The importance of glutathione in human disease. Biomed Pharmacother. 2003;57(3-4):145-155. [ Links ]
TROST M, SU S, SU P, YEN EF, TSENG H, BARNES A, et al. Network modulation by the subthalamic nucleus in the treatment of Parkinson s disease. Neuroimage. 2006;31(1):301-307. [ Links ]
TSANG EW, HAMANI C, MORO E, MAZZELLA F, POON YY, LOZANO AM, CHEN R. Involvement of the human peduncupontine nucleus region in voluntary movements. Neurology. 2010;75(11):950-959. [ Links ]
VILA M, LEVY R, HERRERO MT, RUBERG F, FAUCHEUX B, OBESO JA. Consequences of nigrostriatal denervation on the functioning of the basal ganglia in human and non human primates: an in situ hybridization study of cytochrome oxidase subunit I mRNA. J Neurosci. 1997;17(2):765-773. [ Links ]
VILA M, PÉRIER C, FÉGER J, YELNIK J, FAUCHEUX B, RUBERG M, et al. Evolution of changes in neuronal activity in the subthalamic nucleus of rats with unilateral lesion of the substantia nigra assessed by metabolic and electrophysiological measurements. Eur J Neurosci. 2000;12(1):337-344. [ Links ]
WANG HL, MORALES M. Pedunculopontine and laterodorsal tegmental nuclei contain distinct populations of cholinergic, glutametrgic and GABAergic neurons in the rat. Eur J Neurosc. 2009;29(2):340-358. [ Links ]
WEINBERG M, HAMANI C, HUTCHISON WD, MORO E, LOZANO A, DOSTROVSKY J. Pedunculopontine nucleus microelectrode recordings in movement disorder patients. Exp Brain Res. 2008;188(2):165-174. [ Links ]
WINN P. How best to consider the structure and function of the pedunculopontine tegmental nucleus: evidence from animal studies. J Neurol Sci. 2006;248(1-2):234-250. [ Links ]
ZRINZO L, ZRINZO LV, TISCH S, LIMOUSIN PD, YOUSRY T, AFSHAR F, HARIZ MI. Stereotatic localization of the human pedunculopontine nucleus: Atlas - based coordinates and validation of a magnetic resonance imagining protocol for direct localization. Brain. 2008;131(Pt.6):1588-1598. [ Links ]
ZWEIG RM, JANKEL WR, HEDREEN JC, MAYEUX R, PRICE DL. The pedunculopontine nucleus in Parkinson's disease. Ann Neurol. 1989;26(1):41-46. [ Links ]