Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.17 no.3 Bogotá Sept./Dec. 2012
VARIACIÓN DEL CONTENIDO DE AZÚCARES TOTALES Y AZÚCARES REDUCTORES EN EL MUSGO Pleurozium schreberi (HYLOCOMIACEAE) BAJO CONDICIONES DE DÉFICIT HÍDRICO
Variation in Total Sugars and Reductive Sugars in the Moss Pleurozium schreberi (HYLOCOMIACEAE) Under Water Deficit Conditions
LUIS CARLOS MONTENEGRO RUIZ1, Ph. D.; LUZ MARINA MELGAREJO MUÑOZ2; Ph. D.
1Departamento de Biología, Universidad Nacional de Colombia, sede Bogotá. lcmontenegror@unal.edu.co.
2Departamento de Biología, Universidad Nacional de Colombia, sede Bogotá. lmmelgarejom@unal.edu.co
Correspondencia: lcmontenegror@unal.edu.co
Presentado el 13 de junio de 2012, aceptado el 9 de octubre de 2012, correcciones el 19 de septiembre de 2012.
RESUMEN
Los briófitos por su simplicidad estructural se ven expuestos a estrés hídrico con facilidad, por lo que presentan mecanismos fisiológicos y bioquímicos que les permita sobrevivir. En el presente trabajo se evaluó la variación del contenido de azúcares totales solubles y azúcares reductores en relación con el contenido hídrico relativo, en Pleurozium schreberi cuando se enfrenta a contenidos hídricos bajos en el Páramo de Chingaza (Colombia) y bajo condiciones simuladas de déficit hídrico en laboratorio. Se encontró que los azúcares totales aumentan cuando la planta se deshidrata y vuelve a su contenido normal cuando el musgo se rehidra, esto puede ser interpretado como un posible mecanismo de ajuste osmótico de la célula y osmoprotección del contenido celular y de la estructura celular. Los azúcares reductores no presentaron variación significativa, mostrando que los monosacáridos no tienen una función protectora durante la deshidratación.
Palabras clave: estrés hídrico, musgos, osmoprotección, páramo.
ABSTRACT
The structural simplicity of the bryophytes exposed them easily to water stress, forcing them to have physiological and biochemical mechanisms that enable them to survive. This study evaluated the variation of total soluble sugars and reducing sugars in relation to relative water content, in Pleurozium schreberi when faced with low water content in the Páramo de Chingaza (Colombia) and under simulated conditions of water deficit in the laboratory. We found that total sugars increase when the plant is dehydrated and returned to their normal content when re-hydrated moss, this could be interpreted as a possible mechanism of osmotic adjustment and osmoprotection of the cell content and cellular structure. Reducing sugars showed no significant variation, showing that monosaccharides do not have a protective role during dehydration.
Keywords: Moss, osmoprotection, páramo, water stress.
INTRODUCCIÓN
Proctor y Pence, 2002 y Oliver et al., 2005, indican que la tolerancia a la deshidratación es la capacidad que tiene un organismo de perder el contenido hídrico interno en equilibrio con el ambiente y luego recuperar su metabolismo normal cuando se rehidrata. Los briófitos (musgos, hepáticas y antoceros) han desarrollado una capacidad extraordinaria de tolerar la deshidratación, a pesar de ser plantas estructuralmente menos complejas que las plantas vasculares. Por ejemplo, el musgo Tortula ruralis que se conoce como altamente tolerante, puede ser almacenado con un contenido de agua del 5 % y potenciales hídricos inferiores a -150 MPa, y después de ser rehidratado recupera rápidamente sus funciones metabólicas. Además, hay varios registros en herbarios mundiales de especies que han sobrevivido prolongados períodos de tiempo sin agua, por ejemplo, Grimmia pulvinata alcanzó 80 años (Proctor, 2000).
Pleurozium schreberi (Brid) Mitt, es un musgo poiquilohídrico, puede ganar y perder agua rápidamente y no hay control sobre la pérdida de agua debido a la falta de cutícula y sistemas internos de transporte del líquido. Esto obliga al musgo a tener un sistema de tolerancia a la deshidratación que le permita sobrevivir en períodos de escasez de agua (Anicíc et al. 2009).
En las plantas sometidas a estrés por déficit hídrico, el mecanismo más importante de defensa es la disminución del potencial osmótico, por acumulación de iones inorgánicos o por aumento en los niveles de solutos orgánicos (osmorreguladores o solutos compatibles); dicho proceso denominado ajuste osmótico busca impedir la pérdida de turgencia en las células, evitando detener funciones asociadas a la fotosíntesis, al crecimiento celular, etc. (Reigosa y Pedrol, 2004).
De acuerdo con Romero et al., 2004, los osmorreguladores o solutos compatibles son definidos como osmolitos orgánicos responsables del balance osmótico, que son compatibles con el mecanismo celular. Se localizan en el citoplasma y permiten disminuir el potencial osmótico de la célula, sin interferir con las funciones metabólicas, a pesar de alcanzar concentraciones altas. Por lo general son moléculas de bajo peso molecular, altamente solubles en agua y con una gran cubierta hídrica en solución. El mecanismo de ajuste osmótico mediante osmolitos se ha seleccionado a lo largo de la evolución porque permite la adaptación al estrés hídrico temporal de forma más flexible, y minimiza los cambios adaptativos necesarios en las proteínas para funcionar en soluciones intracelulares más concentradas, porque su acumulación no perturba la fisiología celular. Los osmorreguladores, bajo diferentes condiciones de estrés, también pueden actuar estabilizando proteínas y membranas celulares, y captando radicales libres. Dicha habilidad les ha permitido ser llamados osmoprotectores. En estado anhidro los grupos OH- de algunos de ellos remplazan el agua en la formación de puentes de hidrógeno con los residuos polares de proteínas y fosfolípidos (Romero et al., 2004). Los disacáridos cumplen dos importantes papeles en la protección de membranas: reducción de la temperatura de transición de la fase de secado de membrana (Tm) y formación de una "vitrificación del citoplasma" con una alta temperatura de fusión. Aunque ambas características son necesarias, no son suficientes para la protección de membranas en períodos de deshidratación e hidratación. Cuando las membranas están deshidratadas pero hay presencia de estos disacáridos, el modelo sugiere que las moléculas de azúcar detienen el colapso de los lípidos a través de una interacción con las cabezas de los fosfolípidos, de ese modo previenen la elevación de Tm durante la deshidratación. La segunda característica es la vitrificación a bajos contenidos hídricos, los carbohidratos forman un material amorfo que previene los procesos de deterioro tales como fusión de membranas (Oliver et al., 2002).
La sacarosa, (a-D-glucopiranosil(1-2)-b-D-fructofuranósido), es el azúcar osmolito más importante en los briófitos (Smirnoff, 1992). En general, se acepta que los disacáridos (y otros azúcares) tienen un papel esencial en la tolerancia a la deshidratación, pero otros factores deben ser importante (Proctor y Tuba, 2002).
En los páramos húmedos del trópico colombiano se presentan prolongados períodos de lluvia que hacen que los musgos en la mayor parte del año no tengan que enfrentarse a problemas de estrés hídrico, sin embargo durante la época seca los briófitos son los más afectados entre las plantas porque se enfrentan a escasez total de agua, cambios de temperatura diarios que pueden ir de -1 °C en horas de la noche hasta 30 °C al medio día, altas radiaciones principalmente UV y vientos fuertes. Por la condición poiquilohídrica de estas especies alcanzan potenciales hídricos muy bajos (Montenegro et al. 2005).
En el presente trabajo se estudia la variación de azúcares totales y azúcares reductores en relación con el contenido hídrico de P. schreberi durante época seca en el Páramo de Chingaza y bajo condiciones de déficit hídrico simuladas en laboratorio.
MATERIALES Y MÉTODOS
La fase de campo se desarrolló en los meses de enero yfebrero de 2007 en el Páramo de Chingaza, sector de las lagunas de Buitrago, 4°45'19,73" N 73°49'52,22" O, a 3592 msnm. Se realizaron tres muestreos en campo durante la época seca (Tabla 1).
MATERIAL VEGETAL
Para las mediciones en páramo se seleccionaron cinco poblaciones de P. schreberi dentro de la asociación frailejonal-pajonal, bajo las mismas condiciones microclimáticas. Se tomaron muestras de ápices cada dos horas iniciando a las 5:00 a. m. Se muestreó durante 36 horas en la temporada de inicio, 24 horas en la temporada de mediados y 26 horas para la temporada final de la época seca. El material vegetal utilizado para determinar contenido hídrico se almacenó en tubos de ensayo con cierre hermético para evitar pérdida o ganancia de agua y se procesaron en laboratorio. Los ápices para análisis bioquímicos se almacenaron en envases herméticos, se congelaron inmediatamente y permanecieron a -70 °C hasta su utilización. Para las mediciones bajo condiciones de laboratorio se colectaron muestras en cinco poblaciones de P. schreberi en el mismo sector donde se hizo el muestreo de campo y se transportaron al laboratorio en Bogotá, donde se colocaron bajo condiciones controladas en cuarto de cultivo: fotoperíodo 12 horas luz/12 horas oscuridad, temperatura de 18 °C, irradiación de 27,75 µmol m-2 s-1, humedad relativa de 90 % y tuvieron agua permanentemente durante dos meses para mantener las plantas en condiciones óptimas.
EXPOSICIÓN A DÉFICIT HÍDRICO EN CONDICIONES CONTROLADAS
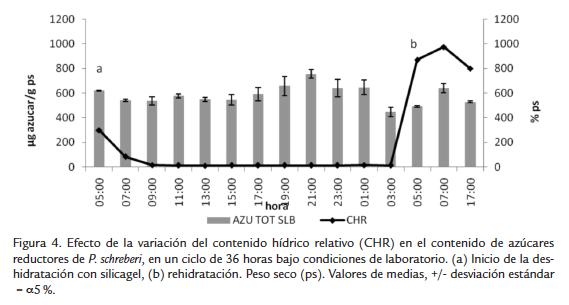
Bajo las condiciones del cuarto de cultivo a los musgos se les retiró el exceso de agua con papel absorbente y se colocaron sobre camas de silicagel en bandejas transparentes con tapa y cierre hermético para simular condiciones de déficit hídrico, se dejaron deshidratar por 24 horas y se rehidrataron al finalizar este período. Se tomaron muestras para contenido hídrico y pruebas bioquímicas cada dos horas, iniciando a las 5:00 a. m. con el musgo hidratado y durante el tiempo de deshidratación. Posteriormente la rehidratación se hizo con agua a las 5:00 a. m. del día siguiente, y se tomaron medidas en el momento de la rehidratación y adicionales dos y 12 horas después de la rehidratación.
CONTENIDO HÍDRICO RELATIVO (CHR)
Para el contenido hídrico relativo (Hernández et al. 1999), se determinó el peso fresco (pf), el peso en turgencia (pt) y el peso seco (ps) de cada muestra, y se expresó como porcentaje según la siguiente fórmula:
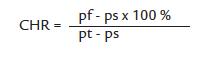
EXTRACCIÓN DE AZÚCARES
Para la extracción de los azúcares el material vegetal fue liofilizado, luego se pesaron 0,02 g por cada muestra y se maceraron en nitrógeno líquido. Se adicionó como solución de extracción 2 ml de buffer acetato de sodio 50 mM pH 5,0 y se agitó durante 30 minutos a 4 °C. Se centrifugó a 6000 rpm durante 30 min a 4 °C. Se tomó el sobrenadante y se utilizó para la determinación de azúcares totales solubles y azúcares reductores.
DETERMINACIÓN DE AZÚCARES TOTALES SOLUBLES
El contenido de azúcares totales solubles se determinó utilizando el método de Dubois et al., 1956, adecuado por Moreno et al. , 2010, utilizando glucosa como patrón (1.01 mg/mL) y leyendo absorbancia a 490 nm en un espectrofotómetro BIO-RAD Smartspec 3000. La mezcla de reacción contenía extracto de la muestra de análisis, fenol (80 % p/v) y ácido sulfúrico al 99 %. Para las muestras de páramo y laboratorio se utilizó un espectrofotómetro BIO-RAD Smartspec 3000.
DETERMINACIÓN DE AZÚCARES REDUCTORES
Se utilizó el método de Somogyi-Nelson (Somogyi, 1952; Nelson, 1944), adecuado por Moreno et al., 2010. La mezcla de reacción contenía el extracto de la muestra de análisis, los reactivos de Somogyi I, Somogyi II, Nelson y agua dd, se leyó absorbancia a 660 nm, se utilizó un espectrofotómetro BIO-RAD Smartspec 3000. Se utilizó glucosa como patrón (1,0 mg/mL). Para las muestras de páramo y laboratorio se utilizó un espectrofotómetro BIO-RAD Smartspec 3000.
ANÁLISIS ESTADÍSTICO
Los datos se analizaron bajo un diseño experimental completamente al azar, con cinco réplicas (cada una de las poblaciones) tanto para las muestras colectadas en campo como para las trabajadas bajo condiciones controladas en cuarto de cultivo. Se realizó un análisis de varianza para comparar las tres temporadas en páramo (inicio, mediados y final de la época seca), análisis de regresión lineal y regresión polinomial para azúcares totales y azúcares reductores en función del CHR para determinar la relación y el modelo. El nivel de significancia fue del 95 % y se utilizó el programa estadístico "Statistix 9".
RESULTADOS
VARIACIÓN EN EL CONTENIDO DE AZÚCARES TOTALES SOLUBLES
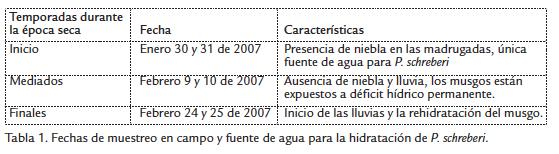
Al inicio de la época seca (Fig. 1A) cuando la planta se encontraba hidratada (horas de la madrugada), el contenido de azúcares totales solubles fue en promedio de 700 µg de azúcar g ps-1, aumentando hasta 1100 µg de azúcar g ps-1 en promedio, cuando el musgo tuvo los CHR más bajos. En la segunda temporada (Fig. 1B) cuando el páramo presentó días sin niebla, altas temperaturas durante el día y humedad relativa promedio inferior al 50 %, se encontró que los contenidos de azúcares totales solubles fueron inferiores a la temporada anterior, igualmente se observaron valores promedio de 600 µg de azúcar g ps-1 en las horas del medio día y tarde cuando la radiación y temperatura son altas y la humedad relativa es baja. Hacia finales de la época seca (Fig. 1C) el musgo llevaba varios días en déficit hídrico y los contenidos de azúcar durante el día fueron similares a los encontrados en la temporada anterior, presentándose también un aumento en horas del medio día. Sin embargo, el contenido de azúcares totales aumentó considerablemente hacia la hora 7:00 del segundo día de muestreo, cuando se pre- sentaron lluvias alcanzando valores de 1100 µg de azúcar g ps-1: en esta última temporada se presentó una regresión altamente significativa (Tabla 2) entre el contenido de azúcar y el CHR, mostrando la mista tendencia.
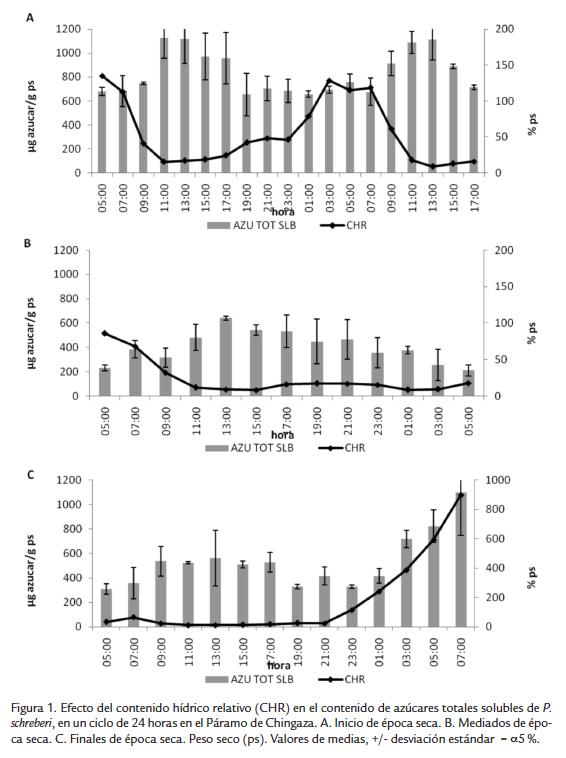
En el laboratorio los musgos permanecieron varias semanas en condiciones ideales de crecimiento presentando contenidos de azúcares totales en promedio de 600 µg de azúcar g p-1 inferiores a los presentados por la planta hidratada en páramo. Sin embargo, con la deshidratación rápida no se presentó una variación significativa en el contenido de azúcares totales solo un pequeño aumento a las 12 horas de estar con CHR bajos llegando a 700 µg de azúcar g ps-1. Tampoco hubo aumento con la rehidratación (Figura 2).
VARIACIÓN EN EL CONTENIDO DE AZÚCARES REDUCTORES
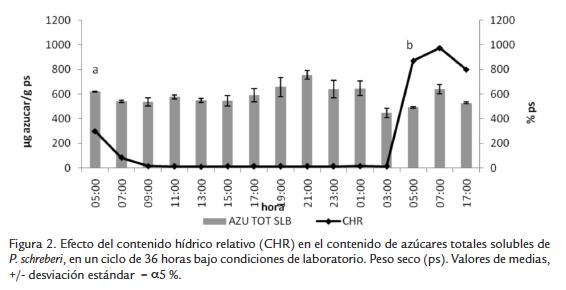
Al inicio y a mediados de la época seca (Figura 3A y 3B, respectivamente) la variación de azúcares reductores no fue significativa a través de todo el día, en promedio el contenido para la primera temporada fue de 300 µg de azúcar g ps-1 y para la segunda de 220 µg de azúcar g ps-1; las regresiones lineales no fueron significativas (Tabla 3). En la tercera temporada durante las horas más secas el promedio de azúcares reductores fue similar al encontrado a mediados de la época seca; sin embargo, aumentó considerablemente cuando el musgo empezó a aumentar su contenido hídrico y en horas de la mañana cuando se activa la fotosíntesis llegando a valores promedio de 450 µg de azúcar g ps-1 (Fig. 3C).
En el experimento bajo condiciones controladas de laboratorio tampoco se presentó una variación significativa en el contenido de azúcares reductores durante el ciclo de deshidratación-rehidratación (Fig. 4), manteniendo un contenido promedio de 300 µg de azúcar g ps-1.
DISCUSIÓN
De acuerdo a lo observado en azúcares totales solubles, P. schreberi presenta un sistema de protección contra estrés hídrico utilizando polisacáridos para realizar el ajuste osmótico y equilibrar la célula a las condiciones secas del medio, posiblemente bajando el potencial hídrico, porque se han registrado en estudios con el musgo Tortula ruralis que el potencial hídrico puede descender a valor inferiores a -70 MPa (Oliver et al., 2005). Es posible que el aumento de azúcares totales observado esté relacionado con el fenómeno de vitrificación del citoplasma el cual depende principalmente del disacárido sacarosa, porque en horas del medio día en las tres temporadas se registraron contenidos hídricos inferiores al 20 %. La vitrificación permite disminuir la velocidad de las reacciones químicas dentro de la célula y así ayuda a preservar macromoléculas y la integridad de la membrana por períodos prolongados de tiempo (Robinson et al., 2000; Oliver et al., 2005; Proctor et al., 2007), aunque faltan estudios para entender este fenómeno en briófitos.
La función de osmoprotectores se ha reportado para varios azúcares solubles entre ellos la sacarosa por su capacidad de formar puentes de hidrógeno con y entre macromoléculas estabilizando su estructura y la funcionalidad de las enzimas (Alpert, 2006; Oliver, 2009). Así, se puede asociar el incremento de azúcares totales solubles en P. schreberi, en el momento de la deshidratación, con una posible función de protección de las membranas de los cloroplastos y las proteínas constituyentes de los fotosistemas. Se ha observado en musgos tolerantes a la deshidratación que los altos niveles de sacarosa también son usados como una fuente de energía almacenada que puede ser utilizada para ensamblar proteínas y otras tareas, mientras se restauran los procesos fotosintéticos (Robinson et al., 2000; Brinda et al., 2011,).
Esta capacidad de aumentar el contenido de azúcares totales solubles en P. schreberi se presenta cuando la deshidratación es lenta porque en las pruebas de laboratorio donde se realizó con sílicagel (rápida) el aumento de los azúcares no fue tan importante como en el páramo. En varias investigaciones con musgos estresados se ha observado el efecto de la velocidad de deshidratación, encontrándose que algunos de los sistemas de defensa (ajuste osmótico, sistema antioxidante, etc.) actúan en mayor magnitud cuando los musgos disminuyen el CHR lentamente (Dhindsa, 1991). Esto también supone que estos azúcares no son una adaptación constitutiva para sobrevivir al estrés hídrico sino que se activan como consecuencia de la deshidratación. Por otra parte, se apreció una mayor concentración de azúcares totales en los musgos expuestos a estrés en páramo durante la primera temporada que en aquellos sometidos a estrés en laboratorio, como una adaptación de P. schreberi a aprovechar al máximo las rehidrataciones que se presentan en horas de la madrugada y poder realizar fotosíntesis eficientemente con las primeras horas de luz para acumular azúcares para protección y fuente de energía, que serán utilizadas en momentos de mayor déficit hídrico como lo fue la segunda temporada de la época seca.
Por lo general, se reconoce el papel esencial de los disacáridos (y otros azúcares) en la tolerancia a la deshidratación de los musgos, incluso en el musgo tolerante a la deshidratación Tortula ruralis alcanzan a ser el 10 % del peso seco (Proctor et al., 2007). Aumentos en el contenido de azúcares solubles durante el estrés hídrico también han sido reportados para el musgo Atrichum androgynum (Mayaba et al., 2001), así como para el musgo Physcomitrella patens donde se reportó un aumento en azúcares solubles de bajo peso molecular siendo el más importante la teanderosa (Nagao et al., 2006).
Los contenidos de azúcares reductores no variaron durante los ciclos de deshidratación-rehidratación, por lo que se considera que no participan en la prevención del daño por estrés hídrico, además en varios estudios se ha encontrado que los azúcares reductores desnaturalizan las proteínas bajo déficit hídrico (Proctor y Tuba, 2002; Alpert 2006). En varias investigaciones con musgos tolerantes a la deshidratación, entre ellos del género Tortula, se ha encontrado que los azúcares reductores permanecen estables o disminuyen cuando se presenta la deshidratación y que los contenidos de glucosa y fructosa son menos de un décimo del contenido de sacarosa (Smirnoff, 1992). Estas disminuciones en los contenidos de glucosa y fructosa se han observado en musgos tolerantes al congelamiento de la Antártida como son Schistidium antarctici, Ceratodon purpureus, Bryum pseudotriquetrum y la hepática Cephaloziella varians (Brinda et al., 2011).
AGRADECIMIENTOS
A la entidad financiadora del trabajo: Dirección de Investigación Sede Bogotá, Universidad Nacional de Colombia. Al Sistema de Parques Naturales Nacionales, Parque Nacional Natural Chingaza por permitir el acceso para realizar la investigación.
BIBLIOGRAFÍA
ALPERT P. Constraints of tolerance: why are desiccation-tolerant organisms so small or rare? J Evolution Biol. 2006;209:1575-1584. [ Links ]
ANICÍC M, TASIC M, FRONTASYEVA MV, TOMASÉVIC M, RAJSÍC S, STRELKOVA P, POPOVIC A, STEINNES E. Active biomonitoring with wet and dry moss: a case study in an urban area. Environ Che Lett. 2009;7(1):55-60. [ Links ]
BRINDA J, FERNANDO C, TUBA Z, SLACK N, STARK L. Ecology of bryophytes in Mojave desert biological soil crusts: effects of elevated CO2 on sex expression, stress tolerance, and productivity in the moss Syntrichia caninervis Mitt. Bryophyte Ecology and Climate Change. Cambridge University Press; 2011. p. 169-191. [ Links ]
DHINDSA R. Drought stress, enzymes of glutathione metabolism, oxidation injury and protein synthesis in Tortula ruralis. Physiology. 1991;95(2):648-651. [ Links ]
DUBOIS M, GILLES K, HAMILTON J, RENERS P, SMITH F. Colorimetric method for determination of sugars and related substances. Anal Chem. 1956;28(3):350-356. [ Links ]
HERNANDEZ C, GONZALEZ J, LOZADA A. Water relations of some mosses growing in pine forests of Tenerife. Lindbergia. 1999;24(1):15-22. [ Links ]
MAYABA N, BECKETT R, CSINTALANJ Z, TUBA Z. ABA Increases the desiccation tolerance of photosynthesis in the afromontane understorey moss Atrichum androgynum. Ann Bot. 2001;88(6):1093-1100. [ Links ]
MORENO L, CRESPO S, PÉREZ W, MELGAREJO LM. Pruebas bioquímicas como herramientas para estudios en fisiología. Capítulo 10, p. 187-248. En: Melgarejo LM, Editor. Experimentos en fisiología vegetal. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá, Colombia; 2010. p. 187-205. [ Links ]
MONTENEGRO LC, CHAPARRO M, BARÓN A. Regulación hídrica en cinco musgos del páramo de Chingaza. En: Estrategias adaptativas de plantas de páramo y del bosque altoandino en la cordillera Oriental de Colombia. Bonilla MA, editor. Universidad Nacional de Colombia; 2005. p. 3-24. [ Links ]
NAGAO M, OKU K, MINAMI A, MIZUNO K, SAKURAI M, ARAKAWA K, et al. Accumulation of theanderose in association with development of freezing tolerance in the moss physcomitrella patens. Phytochemistry. 2006;67(7):702-709. [ Links ]
NELSON N. A photometric adaptation of Somogyi method for the determination of glucose. J Biol Chem. 1944;153:257-262. [ Links ]
OLIVER M. Biochemical and molecular mechanisms of desiccation tolerance in bryophytes. In: Bryophyte Biology. Goffinet B, Shaw J, editors. Second Edition; 2009. p. 269-298. [ Links ]
OLIVER M, VELTEN J, MISHLER B. Desiccation tolerance in bryophytes: a reflection of the primitive strategy for plant survival in dehydrating habitats? Integra. Comp Biology. 2005;45(5):788-799. [ Links ]
OLIVER A, HINCHA D, CROWE J. Looking beyond sugars: the role of amphiphilic solutes in preventing adventitious reactions in anhydrobiotes at low water contents. Comp Biochem Physiol. 2002;131(3):515-525. [ Links ]
PROCTOR M. The bryophyte paradox: tolerance of desiccation, evasion of drought. Plant Ecol. 2000;151(1):41-49. [ Links ]
PROCTOR M, TUBA Z. Poikilohydry and homoihydry: antithesis or spectrum of possibilities? New Phytol. 2002;156(3):327-349. [ Links ]
PROCTOR M, LIGRONE R, DUCKETT J. Desiccation tolerance in the moss Polytrichum formosum: physiological and fine-structural changes during desiccation and recovery. Ann Bot. 2007;99(6):75-93. [ Links ]
PROCTOR M, PENCE VC. Vegetative tissues: Bryophytes, vascular resurrection plants, and vegetative propogules. In: Desiccation and survival in plants: Drying without dying. Black M, Pritchard HW; 2002. p. 207-237. [ Links ]
REIGOSA M, PEDROL N. La ecofisiología vegetal. En: La ecofisiología vegetal, una ciencia de síntesis. Editorial Thomson; 2004. p. 1-58. [ Links ]
ROBINSON SA, WASLEY J, POPP M, LOVELOCK CE. Desiccation tolerance of three moss species from continental Antarctica. Aust J Plant Physiol. 2000;27:379-388. [ Links ]
ROMERO C, ESPINOSA A, CUTANDA M, CORTINA C, HERNÁNDEZ P, CULIÁÑEZ A. La osmorregulación: mecanismos y significado. En: La ecofisiología vegetal, una ciencia de síntesis. Editorial Thomson; 2004. p. 603-620. [ Links ]
SMIRNOFF N. The carbohydrates of bryophytes in relation to desiccation tolerance. J Bryol. 1992;17(2):185-191. [ Links ]
SOMOGYI M. Notes of sugar determination. J Biol Chem. 1952;195:19-23. [ Links ]