Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. vol.17 no.3 Bogotá set./dez. 2012
ESTUDIO DEL CONTENIDO DE FENOLES Y ACTIVIDAD ANTIOXIDANTE DE GUAYABA EN DIFERENTES ESTADOS DE MADUREZ
Study of Phenolic Compounds and Antioxidant Activity of Guava in Different Stage of Ripening
JULIO ANDRÉS OLAYA ZEA1, Maestría en Química (c); LUZ PATRICIA RESTREPO SÁNCHEZ2, M.Sc.
1Universidad Nacional de Colombia. jaolayaz@unal.edu.co
2Profesora asociada, Universidad Nacional de Colombia. lprestrepos@unal.edu.co. Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Ciudad Universitaria, Bogotá, Colombia.
Correspondencia: lprestrepos@unal.edu.co
Presentado el 10 de febrero de 2011, aceptado el 21 de octubre de 2011, correcciones el 2 de mayo de 2012.
RESUMEN
Este trabajo estudió el contenido de compuestos fenólicos, actividad antioxidante y el contenido de vitamina C, en diferentes estados de madurez del fruto de tres variedades de guayaba de Colombia. Se trabajó con dos de alta producción silvopastoril, la regional roja (RR) y la regional blanca (RB) y una de carácter promisorio como es la variedad guavatá victoria (GV), todas provenientes de la región de la hoya del río Suárez (Santander, Colombia). Se obtuvieron extractos etanólicos y se evaluaron el contenido de fenoles libres, capacidades antioxidantes por ABTS•+ y DPPH•, FRAP, decoloración del ß- caroteno y el contenido de vitamina C por HPLC. La guayaba RB en estado maduro fue la variedad que mostró mayor valor de contenido de fenoles libres y mejores capacidades antioxidantes y la RR fue la que presentó mayor valor de contenido de vitamina C.
Palabras clave: antioxidantes, CLAE, fenoles, guayaba, maduración, vitamina C.
ABSTRACT
This work studied the phenolic content, antioxidant activity and the content of vitamin C in different stages of maturity of the fruits of three varieties of guava in Colombia. We worked with two wild varieties, the regional red (RR) and white regional (RB) and a promising character as is the variety guavatá victory (GV), all from the Suárez River region (Santander, Colombia). Ethanol extracts were obtained and evaluated free phenol content, antioxidant capacity by ABTS•+ and DPPH•, FRAP, bleaching of ß-carotene and vitamin C by HPLC. The RB when ripe showed higher value of free phenolic content and antioxidant capacities and best RR was the one with higher value of vitamin C.
Keywords: Antioxidants, guava, HPLC, phenols, ripening, vitamin C.
INTRODUCCIÓN
Este trabajo se enfoca en tres importantes variedades de guayabas colombianas: la regional roja (RR), la regional blanca (RB) y la guavatá victoria (GV), que actualmente son utilizadas principalmente en la elaboración de productos alimenticios de arraigo popular en la gastronmía nacional (bocadillos y dulces). Sin embargo, a pesar de ser Colombia un importante país productor de guayaba, el hecho de ser una fruta altamente perecedera y de poseer muchos problemas fitosanitarios, muestra bajas exportaciones en comparación con otros países latinoamericanos como Brasil o México. Se evalúa el contenido de fenoles, la vitamina C y la capacidad antioxidante que presentan estas variedades en sus diferentes estados de madurez, con el objetivo de aprovechar propiedades funcionales tales como las antioxidantes, que permitan utilizarla en alimentos de consumo masivo en el país y fuera de él y que contribuyan en la disminución de enfermedades relacionadas directamente con el daño celular causado por la exposición a altos niveles de radicales libres (Ames et al., 1993).
MATERIALES Y MÉTODOS
Las guayabas estudiadas fueron suministradas por la cooperativa Éxito (de cultivos tecnificados) ubicada en el municipio de Vélez, departamento de Santander, Colombia. Se emplearon reactivos T.J.Baker y beta caroteno (Sigma), y se utilizó agua T.J.Baker calidadHPLC.
DISEÑO EXPERIMENTAL
Se aplicó un diseño de parcelas divididas de tres variedades de guayaba la RR, RB y GV en cuatro estados de madurez (inmadura, pintona, madura, sobre madura).
Las variables respuesta, fueron el índice de madurez (relación entre los grados brix y la acidez titulable), expresada como % de ácido cítrico, contenido total de fenoles y actividad antioxidante. La acidez titulable se evalúo de acuerdo con la norma técnica colombiana, NTC 4623 y el contenido de sólidos solubles se midió con un refractómetro Atago 8682, expresando el resultado como sólidos solubles.
METODOLOGÍA PARA EL ESTUDIO DE COMPUESTOS FENÓLICOS
La extracción de compuestos fenólicos se realizó con base en las condiciones previamente optimizadas (Restrepo et al., 2009) con algunas modificaciones. Se utilizó una masa de fruta de 1,5 +/- 0.20 g y la proporción masa de fruta - etanol de 1:10 con un tiempo de 30 minutos y una temperatura de 50 °C. Se realizó una segunda extracción bajo las mismas condiciones, y el extracto total obtenido se centrifugó durante 15 minutos a 3500 gravedades a 4 °C. El sobrenadante obtenido de cada lote de muestra se llevó a un volumen final de 25 mL y se utilizó para las determinaciones del contenido de fenoles libres y las diferentes técnicas de medida de actividad antioxidante.
ANÁLISIS ESTADÍSTICO
Se realizó análisis de varianza (ANOVA) y las diferencias significativas entre las variables (estado de madurez, variedad de guayaba, contenido de fenoles y capacidades antioxidantes) fueron separadas por medio del contraste múltiple de rangos, se consideró p < 0,05 como estadísticamente significativo. Se utilizó el paquete estadístico STATGRAPHICS Plus Versión 5.1.
CONTENIDO DE FENOLES LIBRES
El contenido de fenoles libres (Zhou et al., 2006), se cuantificó por el método de Folin Ciocalteu con algunas modificaciones. Se preparó una curva de calibración utilizando ácido gálico como patrón de cuantificación en un rango de concentración de 0,0 a 6,0 mg/L. Se tomaron 100 µL de una mezcla formada por solución stock 1,0 mM de ácido gálico y agua destilada teniendo en cuenta que en el volumen final de la mezcla (1,6 mL), se obtuvieron concentraciones dentro del rango deseado de 0 a 6 mg/L. Posteriormente se adicionaron 750 µL de reactivo de Folin Ciocalteu 10 % v/v y 750 µL de Na2CO3 al 6 % en masa. Transcurridas dos horas a temperatura ambiente (18 °C) y en condiciones de oscuridad, se hicieron lecturas directas de absorbancia a 765 nm de la mezcla anterior, con un espectrofotómetro Genesys 10 UV (Madison WI 53711, USA). A partir del extracto que se obtuvo de la guayaba, se realizó una dilución al 40 % v/v en agua y se tomaron los mismos volúmenes y condiciones descritas con anterioridad. La muestra control o blanco se utilizó bajo las mismas condiciones pero con 100 µL de agua destilada. Los resultados se expresaron como mg equivalentes de ácido gálico por cada 100 g de fruta entera en base húmeda.
ENSAYO DE ACTIVIDAD ANTIRRADICALARIA POR BLOQUEO DE RADICALES LIBRES (ABTS•+)
Se realizó el ensayo ABTS•+ (Re et al., 1999), para lo cual se preparó una mezcla 1:1 v/v compuesta por ABTS 7,0 mM y persulfato de potasio 0,45 mM, la cual se dejó reposar en oscuridad durante mínimo 16 horas a temperatura ambiente. Posteriormente, se tomó un pequeño volumen de la solución anterior (ABTS•+) y se diluyó con etanol hasta alcanzar una absorbancia inicial de 0,7 ± 0,20 a 734 nm. Se preparó una curva de calibración utilizando Trolox como patrón de cuantificación en un rango de concentración de de 0 a 20 µM. Se tomaron 950 µL del reactivo catión radical ABTS•+ y se adicionaron 50 µl de soluciones patrón de Trolox teniendo en cuenta que con el volumen final de la mezcla (1,0 mL), se obtuvieran concentraciones dentro del rango deseado. La mezcla se dejó incubando 30 minutos a una temperatura de 30 °C.
Para los extractos etanólicos obtenidos a partir de las guayabas, se realizaron diluciones al 40 % v/v en etanol y se tomaron las mismos volúmenes y condiciones descritas anteriormente, pero con tiempo de incubación de 60 minutos. Se hicieron lecturas directas de absorbancia a las mezclas a 734 nm con un espectrofotómetro Genesys 10 UV (Madison WI 53711, USA). La muestra control se utilizó bajo las mismas condiciones pero con 50 µL de etanol. Los resultados se expresaron como µmol equivalentes de Trolox/g fracción comestible en base húmeda.
ENSAYO DE ACTIVIDAD ANTIRRADICALARIA POR BLOQUEO DE RADICALES LIBRES (DPPH•)
Para el ensayo DPPH, (Williams et al., 1994), se preparó una solución stock de DPPH 1mM en etanol. Posteriormente, se tomó un pequeño volumen de solución anterior y se diluyó con etanol hasta alcanzar una absorbancia de 1,00 ± 0,20 a 517 nm. Se preparó una curva de calibración utilizando Trolox como patrón de cuantificación en un rango de concentración de de 0 a 25 µM. Se tomaron 950 µL del reactivo radical DPPH• y se adicionaron 50 µl de soluciones patrón Trolox teniendo en cuenta que con el volumen final de la mezcla (1,0 mL), se obtuvieran concentraciones dentro del rango deseado. La mezcla se dejó incubando 30 minutos a temperatura ambiente. Para los extractos etanólicos obtenidos a partir de las guayabas se realizaron diluciones al 40 % v/v en etanol pero con tiempos de incubación de 90 minutos. Se hicieron lecturas directas de absorbancia a las mezclas a 517 nm con un espectrofotómetro Genesys 10 UV (Madison WI 53711, USA). La muestra control se utilizó bajo las mismas condiciones pero con 50 µL de etanol. Los resultados se expresaron como µmol equivalentes de Trolox/g fracción comestible en base húmeda.
ENSAYO DE CAPACIDAD REDUCTORA
La evaluación de la actividad reductora (FRAP, del inglés Ferric-Reducing Antioxidant Power) se llevó a cabo según el método de Benzie y Strain (1996). Para el ensayo FRAP se preparó un buffer acetato de sodio 300 mM pH 3.6, TPTZ en concentración 10 mM disuelto en HCL 40 mM y FeCl3·6H2O 20 mM. El complejo férrico fue preparado mezclando las siguientes cantidades: 25 ml de buffer de acetato de sodio, 2,5 ml de solución de TPTZ y 2,5 ml de solución FeCl3·6H2O en un volumen final de 100 mL. Se preparó una curva de calibración utilizando Trolox como patrón de cuantificación en un rango de concentración de de 0 a 35 µM. Se tomaron 950 µL del reactivo de FRAP y se adicionaron 50 µl de soluciones patrón Trolox teniendo en cuenta que con el volumen final de la mezcla (1,0 mL), se obtengan concentraciones dentro del rango deseado. La mezcla se dejó incubando 10 minutos a 37 °C. Para los extractos etanólicos obtenidos a partir de las guayabas se realizaron diluciones al 40 % v/v en etanol pero con un tiempo de incubación de 30 minutos. Los resultados se expresaron en µmol Trolox/g de fruta en base húmeda. Se hicieron lecturas directas de absorbancia a las mezclas a 593 nm con un espectrofotómetro Genesys 10 UV (Madison WI 53711, USA). La muestra blanco se utilizó bajo las mismas condiciones pero con 50 µL de agua. Los resultados se expresan como µmol equivalentes de Trolox/g fracción comestible en base húmeda Ensayo de decoloración del ß-caroteno
Para este método (Velioglu et al., 1998), se prepararon dos emulsiones: la emulsión blanco o referencia que está formada por 0,20 mL de CHCl3, 0,6 mL tween 20, 0,04 mL de ácido linoleico en un volumen final de 100 mL con agua desionizada. La otra emulsión llamada solución coloreada se preparó añadiendo los mismos componentes pero se adicionaron 0,20 mL de ß-caroteno (1 mg/mL en cloroformo). Las dos se mantuvieron cinco minutos en ultrasonido. Se prepararon tres soluciones a partir de las emulsiones previamente descritas. La solución blanco se preparó mezclando 3,5 mL de emulsión blanco con 0,5 mL de mezcla metanol, la solución control se preparó mezclando 3,5 mL de emulsión coloreada con 0,5 mL de metanol y la solución con muestra se preparó mezclando 3,5 mL de emulsión coloreada con 0,5 mL de muestra antioxidante o patrón de referencia, ácido gálico, en este trabajo fue de concentración 65,5 µM. Las anteriores soluciones se incuban a 50 °C durante dos horas.
DETERMINACIÓN DE VITAMINA C TOTAL
Para la determinación de vitamina C total (ácido ascórbico y dehidroascórbico) en las tres variedades de guayabas en los cuatro estados de maduración se utilizó cromatografía liquida de alta eficiencia (HPLC) según metodología de Gökmen (2000).
EXTRACCIÓN DE LA VITAMINA C TOTAL DE LA FRUTA FRESCA
Para la extracción de la vitamina C de las frutas de guayaba se pesaron 2,0 ± 0,10 g del puré que fueron extraídos con 10,0 mL de agua desionizada mediante agitación durante cinco minutos.
Los extractos se centrifugaron a 3500 gravedades a 4 °C por 15 min. El sobrenadante se coló a través de un filtro Millipore® de 0,45 µm, se tomó 1,0 mL del extracto y se llevó a un volumen final de 10,0 mL de fase móvil para su inyección al equipo de HPLC. Se transfirió 1,0 mL de cada patrón a frascos ámbar (para evitar la oxidación por la luz) y se le adicionó 1,0 mg de ditiotreitol utilizado como agente reductor del ácido deshidrascórbico. La mezcla se dejó reaccionar durante dos horas en la oscuridad, se coló a través de un filtro Millipore® 0,45 µm para su inyección al equipo de HPLC. La curva de calibración obtenida con soluciones de ácido ascórbico entre 0 a 20 mM, se utilizó para la cuantificación de la vitamina C total. Para las muestras de guayaba se transfirió 1 mL del extracto obtenido de la fruta fresca y se colocó en un frasco ámbar y se le adicionó 1 mg de ditiotreitol. La mezcla se dejó reaccionar durante dos horas en la oscuridad, se filtró a través de microporo de 0,45 mm y se inyectó al equipo de análisis.
CONDICIONES CROMATOGRÁFICAS
La fase móvil que se utilizó fue una solución de fosfato monobásico de potasio (KH2 PO4) 0,2 M ajustado a pH 2,4 con H3PO4 filtrada por un filtro de 0,45 mm y desgasificada en ultrasonido por diez minutos. El flujo utilizado fue de 1,0 mL/min y la columna empleada fue RP-18 Licrhosorb (150 mm x 4.0 mm d.i - 5 µm tamaño de partícula) manejada a temperatura ambiente. El detector UV-Vis se utilizó a una longitud de onda de 254 nm para el ácido ascórbico. El contenido de ácido ascórbico total (AAT) se expresa como mg ácido ascórbico /100 g de fruta.
EXTRACCIÓN Y ANÁLISIS PRELIMINAR DE FENOLES DE LA VARIEDAD CON MAYOR CONTENIDO DE FENOLES Y CAPACIDAD ANTIOXIDANTE
En la figura 1 se presenta un diagrama general de la metodología aplicada para la extracción y el análisis preliminar de fenoles obtenidos de la guayaba. Se escogió la variedad y el estado de madurez que presentó mayor contenido de fenoles libres, mayores capacidades antioxidantes y alto contenido de vitamina C. Además, se verificaron las correlaciones existentes entre estas variables como criterio para continuar con el análisis preliminar de fenoles.
Se realizó una extracción de los fenoles preparando una columna con Amberlita® XAD 2. La guayaba entera se maceró y se mezcló con agua en proporción 2:1 m/m (agua: fruta) por 10 min. Posteriormente, se centrifugó a 3500 gravedades otros 10 min a 4 °C recolectando el sobrenadante. El paso anterior se hizo por duplicado. El sobrenadante se eluyó a través de la columna en proporción en masa Amberlita y sobrenadante 1:1 y luego se lavó con agua desionizada hasta que el eluído se mostró completamente incoloro, en este paso son eluidos los compuestos altamente polares como ácidos orgánicos y azúcares. A continuación se eluyeron los fenoles con metanol y el extracto obtenido se concentró a sequedad en un rotavapor a 40 °C a presión reducida (Simunic et al., 2005) y se llevó a un volumen final con 10,0 mL de metanol. El extracto metanólico obtenido se monitoreó por espectroscopia UV a una longitud de onda de 280 nm, y se consideró el fin de la extracción cuando la absorbancia correspondiera al 10 % de la absorbancia inicial.
HIDRÓLISIS ÁCIDA DE FRACCIONES OBTENIDAS
El proceso de hidrólisis se realizó con el objeto de liberar los posibles carbohidratos ligados y obtener la correspondiente agliconas flavonoides presentes en el extracto metanólico, producto de la separación con Amberlita® XAD-2. Se tomaron 10 mL de extracto metanólico o acuosos obtenido de la extracción de la columna Amberlita y se mezclaron con HCl 1,5 M en reflujo durante dos horas. Se dejaron enfriar, luego se llevaron al rotavapor a 50 °C y con vacío para retirarle el metanol aún presente. Después se le adicionaron 15 mL de acetato de etilo y se llevaron a la fase acuosa (la más densa) a pH 7,0 con NaOH 1,0 M para posibilitar la liofilización. La fase orgánica (la menos densa) se llevó a sequedad con un rotavapor a 40 °C a presión reducida, y se llevó a un volumen final de 10 mL con metanol.
DETERMINACIÓN DEL CONTENIDO DE FENOLES Y CAPACIDAD ANTIOXIDANTE DE FRACCIONES PRODUCTO DE LA EXTRACCIÓN POR AMBERLITA® XAD 2 Y DE LA HIDRÓLISIS ÁCIDA
Para el estudio del contenido de fenoles y capacidad antioxidante de las diferentes fracciones, producto de de la separación por Amberlita® XAD 2 y las obtenidas por hidrólisis ácida, se utilizaron los ensayos de determinación de contenido de fenoles libres, bloqueo de radicales libres ABTS•+ y DPPH• y capacidad reductora FRAP (descritos anteriormente).
RESULTADOS Y DISCUSIÓN
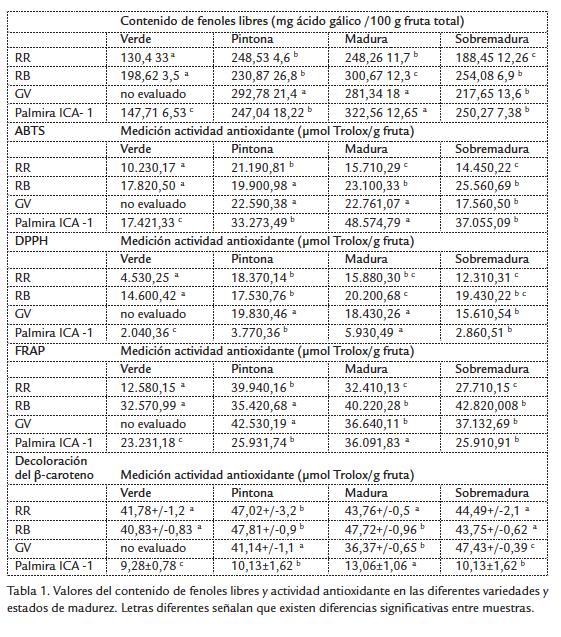
Todos los resultados que se muestran en la Tabla 1 son el promedio de mínimo tres determinaciones y su correspondiente desviación estándar.
CONTENIDO DE FENOLES LIBRES
Se observó que para las variedades RR y RB el contenido de fenoles presenta la tendencia de aumentar hasta el estado maduro. Respecto a la variedad GV, lo observado es que existe un máximo de contenido de fenoles en el estado pintón a diferencia de las anteriores variedades.
Lo observado para las variedades RR y RB, podría explicarse con base en la teoría que los compuestos monofenólicos (como los ácidos fenólicos y los fenilpropanoides) son intermediarios y derivados de las rutas metabólicas fenilpropanoide y shikimato. La conversión de L-fenilalanina a ácido transcinámico es el paso inicial de la ruta biosintética de fenilpropanoides, reacción que es catalizada por la fenilalaninaamonialiasa (FAL), una enzima reguladora de la síntesis de fenoles (Salisbury et al., 1996). Esta enzima permanece activa durante las últimas etapas del crecimiento del fruto e inicios de la maduración favoreciendo la biosíntesis de estos compuestos fenólicos (Arellano Gómez et al., 2005). Este comportamiento coincidió con estudios en otras frutas tropicales como el zapote mamey (Alia Tejecal et al., 2008), el zapote negro (Arellano Gómez et al., 2005), banano (Ibrahim et al., 1994) y mango (Abu-Goukh et al., 1993).
Al llegar al estado sobremaduro o fase de senescencia se notó una disminución en el contenido de fenoles, que podría ser explicado por el alto metabolismo oxidativo que en esta fase favorece la aparición de especies reactivas de oxigeno singlete. Los fenoles al igual que el ácido ascórbico, actúan como antioxidantes primarios produciéndose su disminución. Este comportamiento coincidió con estudios en otras frutas tropicales como el zapote mamey, el zapote negro, banano y mango. La variedad que presentó mayor contenido de fenoles libres fue la variedad RB (en estado maduro) con un valor de 305,2 ± 10,2 mg ácido gálico/100 g de fruta. De manera general se pudo observar que los investigadores que utilizaron etanol o mezclas etanol-agua como solventes de extracción, reportaron menores valores respecto a los que trabajan con metanol y acetona, considerados por muchos investigadores buenos solventes para la extracción de antioxidantes polares (Lu et al., 1999), pero no permitidos como aditivos en alimentos por su toxicidad. Sin embargo, en este trabajo se utilizó etanol como solvente de extracción y los valores resultaron altos posiblemente por el uso de la fruta entera para los análisis respectivos.
MEDICIÓN DE ACTIVIDAD ANTIRADICALARIA POR ABTS•+
La tendencia que se observa es que a medida que la fruta madura, se presenta una mayor capacidad de bloqueo de radicales libres ABTS•+, hecho que podría estar relacionado con aumento en el contenido de fenoles libres que actúan como captadores de radicales libres. Si se comparan los valores obtenidos con otros autores (Restrepo et al., 2009; Rojas Barquera et al., 2009) se observan diferencias notables. Posiblemente los lavados efectuados con acetona por estos autores mejoraron la extracción de fenoles de polaridad intermedia que con etanol son más difícil de extraer, hecho que influyó notablemente en los valores reportados.
La variedad que presentó mayor capacidad de bloquear los radicales libres ABTS•+ fue la variedad GV (en estado maduro) con un valor de 30,25 µmolTrolox/ g de fruta, seguido de la variedad RB (en estado maduro) con un valor 28,06 µmolTrolox/ g de fruta. Según el contraste múltiple de rango sí existen diferencias estadísticamente significativas (DES) para la capacidad antioxidante.
La variedad que presentó mayor actividad por este método fue la variedad RB (en estado maduro) con un valor de 24,54 ±0.83 µmolTrolox/ g de fruta, seguido de la variedad GV (en estado maduro) con un valor 24,50 µmolTrolox/ g de fruta. Según el contraste múltiple de rango no hay diferencias estadísticamente significativas entre las dos variedades. La tendencia que se observó fue que a medida que la fruta se maduró se presentó una mayor capacidad de bloqueo, hecho que podría estar relacionado con el aumento en el contenido de fenoles libres que actúan como captadores de radicales libres.
MEDICIÓN DE ACTIVIDAD ANTIRADICALARIA POR DPPH
Se observa que hubo una disminución de la capacidad de bloquear radicales libres DPPH en el estado sobremaduro, esto va ligado al comportamiento característico de los fenoles ya explicado anteriormente. Cabe recordar que los tiempos de incubación en este trabajo fueron de 90 minutos, lo anterior confirma cómo con solventes fuertemente aceptores de hidrógenos, como el etanol, trabajan muy lentamente con el DPPH•, además, por impedimento estérico moléculas de gran tamaño, se pueden obtener menores valores de capacidad antioxidante.
MEDICIÓN DE CAPACIDAD REDUCTORA POR ENSAYO FRAP
La variedad que presentó mayor capacidad reductora FRAP fue la variedad RB (en estado maduro) con un valor de 48,85±0,34 µmolTrolox/ g de fruta, seguido de la variedad GV (en estado maduro) con un valor 48,71±0,71 µmol Trolox/g de fruta. Según el contraste múltiple de rango, no hay diferencias estadísticamente significativas entre las dos variedades. La tendencia que se observa es que a medida que la fruta madura se presenta una mayor capacidad para reducir el complejo férrico (presencia de sustancias con potencial redox menor a 0,70 V), hecho que podría estar relacionado con el aumento en el contenido de fenoles que actúan como oxidantes. En el estado sobremaduro se notó una disminución capacidad reductora FRAP a causa de la menor disponibilidad de fenoles que funcionan como especies reductoras.
DECOLORACIÓN DEL ß-CAROTENO
La variedad que presentó mayor inhibición de la peroxidación lipídica fue la RB (en estado pintón) con un valor de 47,81 ± 0,26 µmol ácido gálico/ g fruta, seguido de la RB (en estado maduro) con un valor 47,72 ±0,24 µmol ácido gálico/ g fruta y la GV (en estado sobremaduro) con 47,43 ±1,25 µmol ácido gálico/ g fruta. Según el contraste múltiple de rango no hay diferencias estadísticamente significativas (DES) entre estas tres variedades. No existe una tendencia definida respecto a su variación respecto al estado de madurez. A pesar de que en variedades tales como la RR y RB, los mayores valores obtenidos son en el estado pintón; en el estado sobremaduro no se presentan diferencias significativas respecto a los otros estados de madurez (como se observa claramente en otros ensayos de capacidad antioxidante).
Como referencia se pueden citar a Kuskoski et al., 2005, quienes obtuvieron valores de 52,8 ± 4,7 µmol ácido gálico/ g de fruta para la pulpa y 29,7 ± 2,1 µmol ácido gálico/ g de fruta para la cascara de la guayaba roja, y valores de 14.6 ± 1.2 µmol ácido gálico/ g de fruta para la pulpa y 23,2 ±1,6 µmol ácido gálico/ g de fruta para la cascara de la guayaba blanca relativo al patrón de 50 µM de ácido gálico.
Para la variedad GV, se observó un comportamiento diferente que para las otras porque se obtuvo mayor capacidad de inhibición de la peroxidación lipídica para el estado sobremaduro.
VITAMINA C TOTAL
La variedad que presentó mayor contenido de vitamina C total fue la variedad RR (en estado maduro) con un valor de 277,4 mg ácido ascórbico/100 g de fruta, seguido de la variedad RR (en estado pintón) con un valor 272,4 mg ácido ascórbico/ g de fruta. Según el contraste múltiple de rango sí hay diferencias estadísticamente significativas entre las dos variedades. Se presentó un comportamiento característico para la RB, no se observa diferencia estadísticamente significativa entre el estado maduro y sobremaduro.
Podría explicarse este comportamiento por la mayor acidez que esta variedad presenta, lo cual facilitó la disponibilidad de otros ácidos orgánicos susceptibles a ser utilizados como fuente de energía para los procesos oxidativas propios de la senescencia, permitiendo una mayor disponibilidad de ácido ascórbico.
Se observó un mayor contenido de vitamina C total para la RR respecto a los valores reportados en la literatura, lo cual se podría justificar debido a que este trabajo utilizó la fruta entera (cáscara, casco, pulpa y semillas), y en otros trabajos se acostumbra a analizar únicamente la pulpa (Lim et al., 2007; Vasco et al., 2008).
Diversos autores como Bashir (2003) y Abu-Goukh (1993) reportaron valores mayores de vitamina C y fenoles en la cáscara de la guayaba respecto a la pulpa. Esto podría estar justificado en la utilización por parte de las plantas de este tipo de compuestos en la protección contra enfermedades, insectos y en la captación que estas hacen hasta del 90 % de las radiaciones UV, para impedir efectos nocivos de las radiaciones en los tejidos internos de la planta (Palazón et al., 2009).
CORRELACIONES
Para observar la relación existente entre el contenido de fenoles, capacidad antioxidante y contenido de vitamina C se evaluó calculando los coeficientes de correlación descritos en la Tabla 2.
Se observó una alta correlación entre el contenido de fenoles y los ensayos de capacidad antioxidante de DPPH, FRAP y ABTS, pero una baja correlación con el ensayo de ß- caroteno y el contenido de vitamina C.
También se determinó una baja relación entre el contenido de vitamina C y los ensayos de capacidad antioxidante de DPPH y FRAP y poca relación entre el contenido de vitamina C con el ensayo de ß-caroteno y el de ABTS.
Estos resultados están acordes a lo reportado por otros autores (Mahattanatawee et al., 2006) quienes mencionan una alta correlación entre el ensayo de DPPH y el contenido de fenoles, sin embargo, también se encontró una baja correlación entre la técnica de DPPH y el contenido de ácido ascórbico.
Por otro lado, Vasco et al., 2008, obtuvieron alta correlación entre el contenido de fenoles y la capacidad antioxidante medida como DPPH, FRAP y ABTS. Thaipong (2006) y Du et al., (2009) encontraron alta correlación entre los ensayos.
ABTS, DPPH, FRAP con el contenido de fenoles y vitamina C, y entre el contenido de fenoles y la vitamina C. Respecto a la baja correlación observada en este trabajo entre el contenido de fenoles, la vitamina C y la capacidad antioxidante medido por el ensayo de ß-caroteno. Hassimotto et al., 2005, reportaron el mismo comportamiento.
El ensayo de ß-caroteno es más selectivo con especies de carácter lipofílico, y los solventes de extracción utilizados (metanol y etanol) no corresponden a este carácter, lo que puede ser la causa de la baja correlación obtenida con el contenido de fenoles. Se podría concluir de manera parcial que las variedades de guayaba estudiadas presentaron altos contenido de fenoles libres (especialmente la RB), altos contenidos de vitamina C (especialmente la RR), altas actividades antioxidantes (especialmente con el ensayo FRAP) y baja correlación con el ensayo de decoloración por ß-caroteno. Además, se encontraron altas correlaciones entre el contenido de fenoles libres y las actividades antioxidantes medidas con los ensayos de DPPH Y FRAP. Esto permitiría deducir que los fenoles son los principales causantes de esa actividad antioxidante. El hecho de que las variedades de estudio presentaran un bajo nivel de correlación entre el contenido de fenoles con el contenido de vitamina C, podría indicar que la presencia de esta vitamina no interfirió de manera importante en la determinación del contenido de fenoles libres.
Respecto a la baja correlación obtenida entre el contenido de compuestos fenólicos y el ensayo de decoloración por ß-caroteno, se podría indicar que los fenoles presentes en las guayabas de estudio prefieren utilizar como mecanismo de capacidad antioxidante la transferencia de electrones al mecanismo de transferencia de hidrógenos usualmente característico del ensayo de decoloración del ß-caroteno (Apak et al., 2007).
CONTENIDO DE FENOLES Y CAPACIDAD ANTIOXIDANTE, DE FRACCIONES PRODUCTO DE LA EXTRACCIÓN POR AMBERLITA® XAD-2 Y DE LA HIDRÓLISIS ÁCIDA
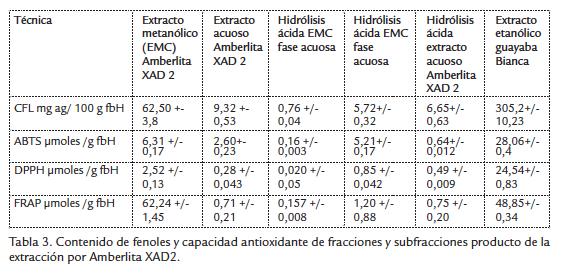
Se determinó el contenido de fenoles libres y la capacidad antioxidante (únicamente por las técnicas DPPH y FRAP que fueron las que mejor correlación tuvieron con el contenido de fenoles) obteniéndose los resultados observados en la Tabla 3.
Respecto al estudio de las fracciones obtenidas por separación de la Amberlita® XAD-2 y los correspondientes productos de la hidrólisis ácida, se observó que todas estas fracciones presentan menores valores de contenido de fenoles libres y de actividad antioxidante, en comparación a los valores obtenidos con el extracto etanólico crudo (excepto para el ensayo de FRAP, donde se nota que la capacidad reductora es mayor para esta fracción por cantidad de fenoles disponibles. Sin embargo, se puede notar que el extracto metanólico presenta valores más altos que el extracto acuoso y las correspondientes fases acuosa y orgánica producto de la hidrólisis ácida.
CONCLUSIONES
De las variedades y estados de madurez de guayabas analizadas, el extracto etanólico obtenido a partir de la RB (en estado maduro) fue la que presentó mayor contenido de fenoles libres, presentando diferencias estadísticamente significativas respecto a las otras variedades y estados de madurez estudiados.
La mayor capacidad antioxidante por las técnicas de DPPH•) y FRAP se presentó en el extracto etanólico de la guayaba blanca (en estado maduro), con el ensayo de ABTS•+) se presentó mayor valor para la variedad GV (en estado maduro), obteniéndose resultados muy similares con la RB madura, pero con diferencias estadísticamente significativas. Se halló alta correlación entre el contenido de fenoles libres y los ensayos de actividad antioxidante ABTS, DPPH y FRAP, de los extractos etanólicos obtenidos de las guayabas en los diferentes estados de madurez. Por otro lado, se halló baja correlación entre el contenido de fenoles y el contenido de vitamina C total y de la antioxidante por el ensayo de decoloración del ß-caroteno. Lo anterior permite sugerir que la capacidad antioxidante de la guayaba va ligada al alto contenido de fenoles que esta presenta y por lo tanto a una alta capacidad captadora de radicales libres.
La extracción con Amberlita® XAD-2, permitió determinar que el extracto metanólico presentó un mayor contenido de fenoles libres y capacidad antioxidante que las fracciones obtenidas de la hidrólisis acida. Sin embargo, esta fracción metanólica no presenta mayores valores respecto al extracto etanólico inicial.
La variedad RR madura fue la que presentó un mayor contenido de vitamina C total con un valor de 277,4±3,32 mg /100 g. Se confirmó a la guayaba como una fruta de gran valor nutricional, de acuerdo a los altos resultados obtenidos para el contenido de fenoles, capacidad antioxidante y vitamina C total.
AGRADECIMIENTOS
A Asohofrucol (Asociación Colombiana de Frutas y Hortalizas), al Ministerio de Agricultura y Desarrollo Rural de Colombia, a la DIB (División de Investigación de la sede Bogotá, Universidad Nacional de Colombia) por el apoyo económico necesario para sacar adelante este trabajo.
BIBLIOGRAFÍA
ABU-GOUKH A, ABU-SARRA A. Compositional changes during mango fruit Ripening. J Agr Sc. 1993;1(1):33-51. [ Links ]
ALIA I, SAUCEDO C, MARTÍNEZ MA, COLINAS MA. Temperaturas de almacenamiento en frutos de mamey Pouteria sapota j. Revista Chapingo, Serie Horticultura. 2008;6(1):73-78. [ Links ]
AMES B, SHIGENAGA M, HAGEN T. Oxidants, antioxidants, and the degenerative diseases of aging. Proc Natl Acad Sci. USA. 1993;90(17):7915-7922. [ Links ]
APAK R, GÜÇLÜ K, DEMIRATA B, ÖZYÜREK M, ÇELIK S, BEKTASOGLU B. Comparative evaluation of various total antioxidant capacity assays applied to phenolic compounds with the CUPRAC assay. Molecules. 2007;12(7):1496-1547. [ Links ]
ARELLANO L, SAUCEDO C, AREVALO L. Biochemical and physiological changes during ripening of black sapote fruit (Diospyros digyna Jacq.). Agrociencia. 2005;39(2):173-181. [ Links ]
BASHIR HA, ABU-BARK A, ABU-GOUKH A. Compositional changes during guava fruit ripening. Food Chem. 2003;80(4):557-563. [ Links ]
BENZIE F, STRAIN J. The ferric reducing ability of plasma as a measure of "antioxidant power:" The FRAP assay. Anal Biochem. 1996;239(1):70-76. [ Links ]
DU G, MINGJUN L, FENGWANG M, DONG L. Antioxidant capacity and the relationship with polyphenol and Vitamin C in Actinidia fruits. Food Chem. 2009;113(2):557-562. [ Links ]
GÖKMEN V, KAHRAMAN N, DEMIR N, ACAR J. Enzymatically validated liquid chromatographic method for the determination of ascorbic and dehyroascorbic acids in fruit and vegetables. J Chromogr A. 2000;881:309-316. [ Links ]
HASSIMOTO N, GENOVESE M, ILAJOLO F. Antioxidant activity of dietary fruits, vegetables, and comercial frozen fruit pulps. J Agric Food Chem. 2005;53(8):2928-2935. [ Links ]
IBRAHIM K, ABU-GOUKH A, YUSUF K. Use of ethylene, acetylene and ether on banana fruit ripening. J Agr Sc. 1994;2(1):73-92. [ Links ]
KUSKOSKI M, ASUERO A, TRONCOSO A , MANCINI-FILHO J, FETT R. Aplicación de diversos métodos químicos para determinar actividad antioxidante en pulpa de frutos. Ciênc Tecnol Aliment. Campinas. 2005;25(4):726-732. [ Links ]
LU T, FOO L. Rosmarinic acid derivatives from Salvia officinalis. Phytochemistry. 1999;51(1):91-94. [ Links ]
MAHATTANATAWEE K, MANTHEY J, LUZIO G, TALCOTT S, GOODNER K, BALDWIN E. Total antioxidant activity and fiber content of select Florida-grown tropical fruits. J Agric Food Chem. 2006;54(19):7355-7363. [ Links ]
RE R, PELLEGRINI N, PROTEGGENTE A, PANNALA A, YANG M, RICE-EVANS C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biol Med. 1999;26:1231. [ Links ]
RESTREPO D, NARVAEZ C, RESTREPO L. Extracción de compuestos con actividad de frutos de guayaba cultivada en Vélez, Santander, Colombia. Quím Nova. 2009;32(6):1517-1522. [ Links ]
ROJAS D, NARVÁEZ C. Determinación de vitamina C, compuestos fenólicos totales y actividad antioxidante de frutas de guayaba (Psidium guajava L.) cultivadas en Colombia. Quím Nova. 2009;32(9):2336-2340. [ Links ]
SALISBURY F, ROSS G. Fisiología vegetal. Grupo Editorial Iberoamericana. México. 1996. p. 759. [ Links ]
SIMUNIC V, KOVAC S, GAÃO-SOKAC D, PFANNHAUSER S, MURKOVIC M. Determination of anthocyanins in four croatian cultivars of sour cherries (Prunus cerasus). Eur Food Res Technol. 2005;220(6-5):575-578. [ Links ]
THAIPONG K, BOONPRAKOB U, CROSBY K, CISNEROS-ZEVALLOS L, HAWKINS D. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts. Food Compos Anal. 2006;19:669-675. [ Links ]
VASCO C, RUALES J, KAMAL-ELDIN A. Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Food Chem. 2008;111(4):816-823. [ Links ]
VELIOGLU Y, MAZZA G, GAO L, OOMAH B. D. Antioxidant and total phenolics in selected fruits, vegetables, and grain products. J Agric Food Chem. 1998;46(10):4113-4117. [ Links ]
ZHOU K, YU L. Total phenolic contents and antioxidant properties of commonly consumed vegetables grown in Colorado. Lebensm Wiss Technol. 2006;39(10):1155-1162. [ Links ]