Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.18 no.2 Bogotá May/Aug. 2013
GRUPOS TRÓFICOS DE MACROINVERTEBRADOS ACUÁTICOS EN UN HUMEDAL URBANO ANDINO DE COLOMBIA
Macroinvertebrate Trophic Groups in an Andean Wetland of Colombia
JOHN JADER RIVERA USME1, M.Sc.; GABRIEL PINILLA AGUDELO2, Ph. D; DIANA LUCÍA CAMACHO PINZÓN3, Lic. Biol.
1 Secretaría de Educación Municipio de Armenia, Armenia, Colombia. Calle 50 #22-01. jaderrivera@yahoo.com.ar; jjriverau@unal.edu.co. 2 Departamento de Biología, Universidad Nacional de Colombia, Bogotá, Colombia. gapinillaa@unal.edu.co. 3 Secretaría de Educación Departamento del Quindío, Armenia, Colombia. dianacamachop@hotmail.com. Autor para correspondencia: Gabriel Pinilla Agudelo, gapinillaa@unal.edu.co.
Presentado el 19 de febrero de 2013, aceptado el 14 de abril de 2013, correcciones el 23 de mayo de 2013.
RESUMEN
En el humedal Jaboque (Bogotá, Colombia) se analizaron las condiciones físicas y químicas del agua y se estudió la comunidad de macroinvertebrados acuáticos por grupos dietarios entre abril de 2009 y enero de 2010. Las aguas del humedal presentaron un carácter ligeramente ácido con valores altos de nitratos, nitrógeno amoniacal y fósforo, por lo que este ecosistema se clasifica como eutrófico a hipereutrófico. La comunidad de macroinvertebrados acuáticos registró seis grupos alimenticios, los cuales estuvieron formados por 27 familias, 26 géneros confirmados y nueve géneros aún por confirmar, con un total de 6403 individuos recolectados en 28 muestras de macrófitas. La mayor abundancia correspondió a detritívoros (43,5 %), colectores-raspadores (31,5 %) y colectores-fragmentadores (14,1 %), los cuales fueron más abundantes en los meses de menor precipitación. Los contenidos estomacales de algunos de los organismos evidenciaron que la mayoría de estos individuos consumieron más de un tipo de alimento, además de altas cantidades de materia orgánica. El análisis de correspondencia linealizado (ACL) mostró una organización espacial (estaciones) y temporal (épocas climáticas) en la que los gremios tróficos se agrupan de acuerdo a sus requerimientos de nicho, fluctuaciones ambientales o factores de intervención humana. Las variaciones en los grupos dietarios reflejaron cambios en la comunidad de macroinvertebrados desde una perspectiva funcional e indicaron que el humedal es un sistema muy alterado por las actividades urbanas.
Palabras clave: grupostróficos alimenticios, humedal urbano, Jaboque, macroinvertebrados acuáticos.
ABSTRACT
In the wetland Jaboque (Bogotá, Colombia) the physical and chemical properties of the water and the food dietary guilds of the aquatic macroinvertebrate community were analyzed from April 2009 to January 2010. The wetland waters had a slightly acid character with high values of nitrate, ammonia and orthophosphate, so this ecosystem is classified as eutrophic to hypereutrophic. In the aquatic macroinvertebrate community six food groups were recorded; they were conformed by 27 families, 26 confirmed genera and nine to be confirmed, with a total of 6,403 individuals collected in 28 samples of macrophytes. The highest abundances corresponded to detritivores (43.5 %), collector-scrapers (31.5 %), and collector-shredders (14.1 %), which were more abundant in the months of low rainfall. Stomach contents of some of the organisms showed that most of these individuals consumed more than one food type and high amounts of organic matter. Detrended correspondence analysis (DCA) showed a spatial (stations) and temporal (climatic seasons) organization, in which trophic guilds are grouped according to their niche requirements, environmental fluctuations or anthropogenic factors. Variations in dietary groups reflected changes in the macroinvertebrate community from a functional perspective and indicated that the wetland is very disturbed by urban activities.
Keywords: aquatic macroinvertebrates, food functional groups, Jaboque, urban wetland.
INTRODUCCIÓN
Los humedales de la zona andina constituyen un hábitat importante para una gran variedad de organismos (Pulido y Melgarejo, 2006) como son plantas, aves, mamíferos y macroinvertebrados acuáticos (MIA), entre otros. La mayoría de estudios sobre los MIA se refieren a su empleo como una herramienta para establecer la calidad del agua, dejando a un lado el papel trófico y otros aspectos ecológicos y funcionales de estas especies (Greathouse y Pringle, 2006). Tales aspectos son importantes para entender cómo se ensamblan estas comunidades dentro de las dinámicas del ecosistema y cómo actúan como indicadores de su estado de conservación (Caicedo y Palacio, 1998).
La producción secundaria (biomasa de consumidores) se encuentra directamente relacionada con el recurso basal alimenticio (Benke y Wallace, 1997). De esta manera la energía en el ecosistema fluye a través de las cadenas alimenticias, en las que los organismos se agrupan por gremios dietarios. Estudiar estos grupos dietarios permite tener una visión más amplia de la ecología del sistema, porque su presencia y abundancia refleja sus capacidades para explotar una gran variedad de recursos orgánicos (Cummins y Klug, 1979; Merritt y Cummins, 1996). Los grupos tróficos dejan ver atributos significativos, relacionados con los ensambles de la comunidad desde una perspectiva funcional.
Según Root (1967), un grupo dietario es un conjunto de especies que explotan la misma clase de recursos ambientales de forma similar, sin tener en cuenta su clasificación taxonómica. Entre sus integrantes se sobreponen ampliamente los requerimientos de sus nichos, por lo que las relaciones ecológicas entre los miembros del grupo están modeladas por la competencia. Los cambios en las condiciones físicas, químicas y biológicas pueden resultar en modificaciones en la composición de especies, en la estructura trófica, en el número de carnívoros y omnívoros y en la aparición de formas especializadas o generalistas en sus comportamientos alimenticios (Kashian y Burton, 2000). Por otra parte, estudiar los grupos funcionales de MIA permite conocerlos procesos de degradación provocados porlas actividades humanas, ya que éstas pueden ocasionar cambios drásticos en ciertos grupos tróficos
Los estudios sobre grupos funcionales de MIA en el trópico son escasos. Tomanova et al. (2006) describieron un listado completo de taxones y sus respectivos grupos funcionales en cuatro ríos de Bolivia. En Colombia, Liévano y Ospina (2007) elaboraron una guía ilustrada de los MIA del río Bahamón (municipios de Anolaima, Cachipay y Zipacón) y en ella plantean sus hábitos alimenticos y sus mecanismos de alimentación. En las ciénagas de Zapatosa, La Pachita y Mata de Palma, Martínez (2009), estudió los macroinvertebrados asociados a macrófitas acuáticas y los agrupó en gremios tróficos. En varias quebradas de la región cafetera, Chará et al. (2010), determinaron la estructura trófica del ensamblaje de insectos acuáticos. Estos autores evidencian la falta de información en el trópico sobre la ecología trófica de estos invertebrados y señalan que para el 50 % de los taxones colectados se registra por primera vez su dieta, mientras que del 20 % no se dispone de información, ni en el trópico ni en la zona templada. Rodríguez-Barrios et al. (2011) estudiaron los grupos funcionales alimentarios en el río Gaira en el departamento del Magdalena, donde hallaron cinco grupos, con predominio de colectores-filtradores. A pesar de estas investigaciones, los estudios sobre los grupos funcionales de MIA en sistemas acuáticos colombianos son insuficientes, en especial en ambientes lénticos como los humedales de la zona andina colombiana. Por lo tanto, en el presente artículo se presenta un estudio de los grupos tróficos de MIA del humedal Jaboque durante los periodos de altas y bajas lluvias. Además, se registran los contenidos estomacales de algunos taxones como hirudíneos e isópodos y se comparan con los datos de la literatura internacional.
MATERIALES Y MÉTODOS
Área de estudio
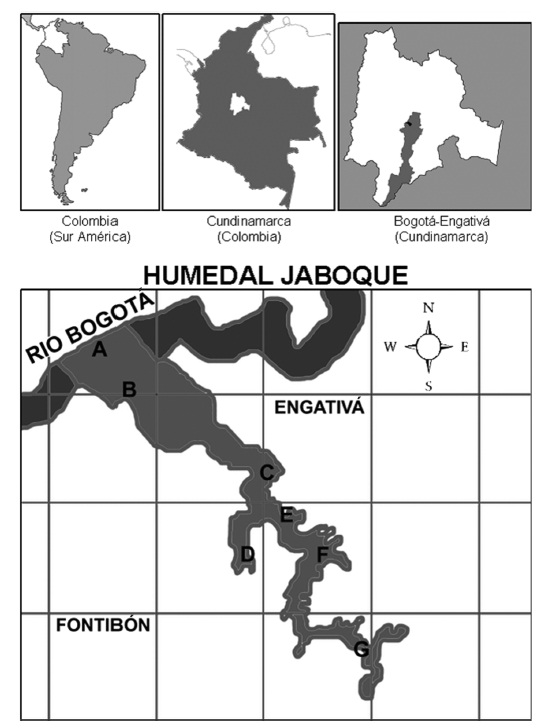
El humedal Jaboque, con una extensión de 151,9 Ha, se ubica en las localidades de Engativá y Suba cerca a la cuenca del río Juan Amarillo, a 2546 msnm (Fig. 1). Es un área inundable de la cuenca del río Bogotá, conformado por zonas permanentemente anegadas con espejos de agua y con vegetación flotante representada principalmente por Eichhornia crassipes, Lemna minuta, Spirodela intermedia, Limnobium laevigatum, Juncus effusus, Typha latifolia, Polygonum punctatum y Myriophyllum aquaticum (Hernández y Rangel, 2009). También presenta zonas de pastizales emergentes que se inundan en épocas lluviosas. La precipitación media anual es de 792,8 mm (IDEAM, 2010). El régimen de distribución de lluvias es bimodal-tetraestacional, con dos periodos de lluvias bajas (diciembre-febrero y junio-agosto) y dos de lluvias altas (septiembre-noviembre y marzo-mayo) (Fig. 2). La humedad relativa promedio es del 80 % con una temperatura media anual de 13,4 °C (IDEAM, 2010). En las últimas cuatro décadas el humedal Jaboque se ha visto fuertemente alterado debido a que funciona como un canal a través del cual pasan las aguas lluvias y las aguas residuales (Rangel y Orjuela, 2003). Esto ha generado un alto deterioro debido a que las aguas servidas, que trascurren por el río Juan Amarillo canalizado, sobrepasan su nivel en ciertos periodos lluviosos e inundan el humedal.


Se seleccionaron siete estaciones de muestreo (Fig. 1), las cuales se encuentran en tres sectores con distinto grado de deterioro. En el sector conservado, más alejado de la zona urbana, se ubicaron las estaciones A (4°43'35,33"N,74°08'45,11"O) y B (4°43'21,55"N, 74°08'33,58"O). En el segundo sector de transición, con áreas semiurbanas, se establecieron las estaciones C (4°42'58,95"N, 74°07'53,81"O) y E (4°42'42,48"N, 74°07'47,83"O). Las estaciones restantes D (4°42'38,57"N, 74°08'02,57"O); F (4°42'35,92"N, 74°07'38,41"O); y G (4°42'11,05"N, 74°07'30,48"O) corresponden al área más deteriorada del humedal, debido a la urbanización y adecuación en su perímetro de canales de recolección de aguas. La estación G presentó durante el periodo de muestreo un pequeño espejo de agua de aproximadamente 100 m2.
Valoración de las variables físicas y químicas
Los muestreos se realizaron en abril y octubre del 2009 (épocas de mayor precipitación) y en agosto de 2009 y enero del 2010 (épocas de menor pluviosidad). La pluviosidad durante estos meses siguió aproximadamente el comportamiento multianual (Fig. 2). En cada una de las siete estaciones se midieron in situ temperatura ambiente y del agua (termómetro ambiental), conductividad eléctrica (µScm-1), pH (unidades de pH) y oxígeno disuelto (mg L-1O2) con una sonda multiparamétrica HandylabMulti 12/Ph02 (Schott AG, Hattenbergstrasse, Alemania). En el Laboratorio de Ecología del Departamento de Biología de la Universidad Nacional de Colombia se midieron nitratos (mg L-1NO3-, método de reducción de cadmio), nitritos (mg L-1NO2-, método de diazotización) y fósforo reactivo soluble (mg L-1PO4=, método del ácido ascórbico) mediante un espectrofotómetro Hach DR-2000 (Hach Company, Loveland, Estados Unidos).
Los sólidos suspendidos totales (SST mg L-1) se determinaron por gravimetría. Los análisis de amonio (mg L-1 N-NH4+) y amoniaco (mg L-1 N-NH3+) y la demanda biológica de oxígeno (DBO5) se realizaron de acuerdo con las metodologías de APHA et al. (1992).
Evaluación de los macroinvertebrados y de las plantas acuáticas
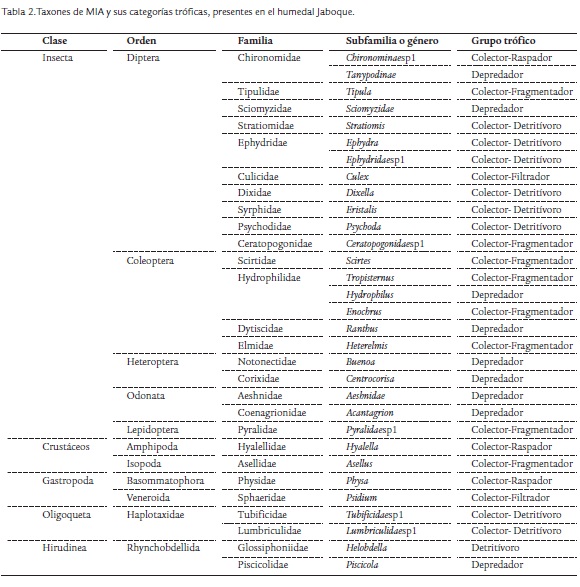
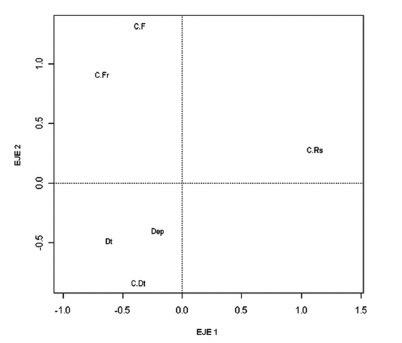
Los MIA se recolectaron en macrófitas acuáticas por mediode una red de mano con ojo de malla de 0,5 mm con un área total de 0,126 m2. Esta red se ubicó bajo la superficie a recolectar, se extrajeron las plantas acuáticas y se colocaron en bolsas plásticas. Luego se removieron los organismos con pinzas entomológicas. Los MIA se fijaron con alcohol al 70 % y se determinaron en el Laboratorio de Palinología del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia (ICN-UNAL), para lo cual se utilizaron claves taxonómicas de Pennak (1978), Roldán (1988), Hansen (1991), Epler (1996), Merritt y Cummins (1996) y Fernández y Domínguez (2001). Estos organismos se asignaron a grupos alimenticios de acuerdo con su especialización trófica. Se emplearon las siguientes categorías propuestas por Cummins y Klug (1979), Merritt y Cummins (1996), Liévano y Ospina (2007) y Tomanova et al. (2006): trituradores, desmenuzadores o colectores-fragmentadores (C.Fr) que se alimentan de materia orgánica particulada gruesa (MOPG), detritívoros (Dt) que consumen MOPG y microflora del sustrato (y ocasionalmente de macrófitas), colectores-raspadores o raspadores (C.Rs) que son herbívoros y se alimentan de perifiton, colectores-detritívoros (C.Dt) (también llamados colectores-recolectores) que consumen materia orgánica particulada fina (MOPF), filtradores o colectores-filtradores (C.F) que es un grupo especial de recolectores que filtran en la columna de agua, y depredadores (Dep) que se alimentan de otros organismos vivos.
Para algunos grupos abundantes (hirudíneos, odonatos, dípteros, coleópteros, anfípodos) se analizaron sus contenidos estomacales. En el caso de los artrópodos esto se hizo a través de la disección ventral del tórax para aislar el estomodeo y el mesodeo (Peckarsky, 1996). La técnica se realizó teniendo en cuenta las recomendaciones de Elosegi y Sabater (2009), quienes sugieren tomar el contenido próximo a la boca, ya que este material está menos digerido. El contenido de cada espécimen se montó con 200 µl de glicerina y se empleó el método de squash (presión y rotación entre portaobjetos y cubre objetos para garantizar la dispersión del contenido estomacal). Las láminas se observaron bajo aumento de 40X en un microscopio marca Zeizz-Axiostar plus (Carl Zeiss, Oberkochen, Alemania) provisto de una cámara Canon Power Shot A70 (Canon Corp., Tokio, Japón). Se seleccionaron campos de manera aleatoria y en ellos se registró cada tipo alimenticio representativo e identificable. Los elementos ingeridos se catalogaron en detritos (material no identificable), material vegetal (porciones pequeñas de hojas), algas filamentosas, diatomeas, hongos (conidios, hifas) y material mineral. En el caso de las especies carnívoras se procuró llegar a la máxima resolución taxonómica de las presas consumidas. Para estimar la proporción de cada tipo alimenticio se empleó el programa CPCE 3.4 (Kohler y Gill, 2006), con el cual se midieron las coberturas. Las macrófitas acuáticas se secaron a 60 °C durante 48 h. El peso seco (PS) se obtuvo con una balanza con precisión de 0,01 g en el Laboratorio de Palinología (ICN-UNAL).
Análisis ecológicos y estadísticos
Se estimó la riqueza específica de MIA a nivel espacial y temporal y se calcularon los índices de dominancia de Simpson y de diversidad de Menhinick con el programa Past (versión1.57, Hammeret al., 2001). Con los datos de abundancia de MIA por grupos tróficos se realizó un ANOVA de una vía (previa revisión de las condiciones de normalidad y homocedasticidad) para establecer las diferencias espaciales (estaciones) y temporales (meses). El mismo análisis se hizo para los valores de los índices ecológicos transformados a logaritmo natural (ln) debido a que no cumplieron los supuestos de normalidad y homocedasticidad. Para estos análisis se empleo el programa Statgraphics Centurión XV (StatPoint Technolgies, 2006). También se realizó un análisis de correspondencia linealizado (ACL) con las abundancias de grupos alimentarios con el fin de explorar las relaciones entre estos grupos y sus fluctuaciones espacio-temporales. Para el ACL se empleó el programa R (R Development Core Team, 2010). La biomasa en PS de las macrófitas se relacionó con la abundancia de MIA por medio de una regresión lineal mediante el programa Statgraphics Centurión XV.
RESULTADOS
Aspectos físicos y químicos
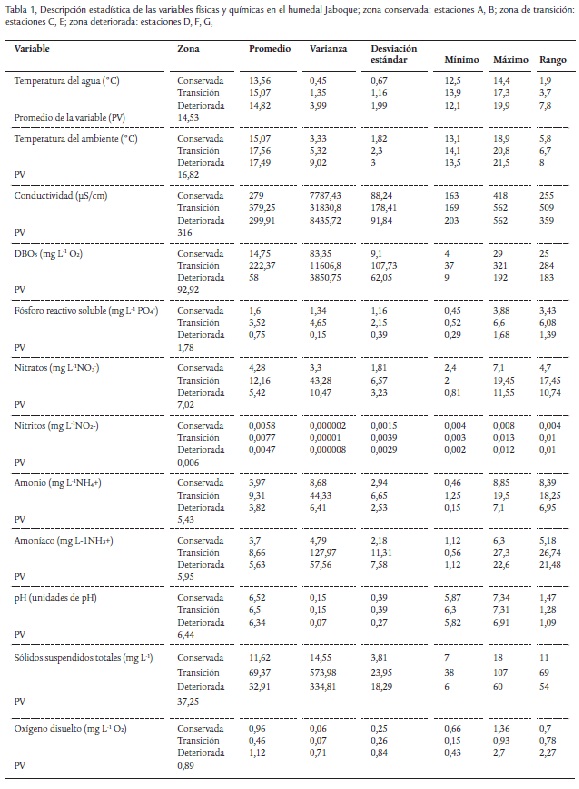
Los parámetros estadísticos descriptivos de las variables físicas y químicas se muestran en la Tabla 1. Las temperaturas del aire y del agua registraron fluctuaciones similares. Durante el periodo de estudio predominaron las bajas concentraciones de oxígeno. El máximo valor se registró en abril (2,7 mg L-1 O2) y el mínimo (0,15 mg L-1 O2) en enero. En general, los menores registros ocurrieron en las épocas de menos lluvias, principalmente en los sectores de transición y alteración (estaciones C y D, con concentraciones inferiores a 1 mg L-1 O2). Estas condiciones anóxicas fueron simultáneas con un incremento en la DBO5, que llegó a un máximo de 321 mg L-1 O2 en agosto (época seca). El nitrógeno en forma de amoniaco fue alto durante la época menos lluviosa (9,15 mg L-1 NH3+ promedio en enero) en los puntos de transición (estación C) y de mayor impacto (estación D). Este mismo comportamiento se observó para el amonio, que tuvo sus máximos valores en enero en la zona de transición (estación C, 19,5 mg L-1 NH4+). Los nitratos también fueron elevados en esta estación (promedio 13,41 mg L-1 NO3-) y en la estación E (10,92 mg L-1 NO3-), en especial en enero. El fósforo reactivo soluble registró concentraciones elevadas, principalmente en agosto (2,52 mg L-1 PO4=) y enero (2,18 mg L-1 PO4=) en los sectores de transición y de mayor impacto (estaciones C y E, zona B). Los nutrientes fueron muy elevados en el sector más urbanizado y en la zona de transición.
Comunidad de macroinvertebrados acuáticos
En 28 muestras de macrófitas se recolectaron 6403 individuos de MIA distribuidos en cinco clases, diez órdenes, 27 familias y 26 géneros confirmados y nueve aún por confirmar. La densidad promedio de MIA en las macrófitas fue de 908 ind/m2. La mayor densidad promedio de individuos se observó durante la época de baja pluviosidad (enero) y la menor en octubre (mayor precipitación). Las familias con mayor abundancia fueron Glossiphoniidae (44 %), Hyalellydae (24 %), Asellidae (8 %) y Chironomidae (4 %).
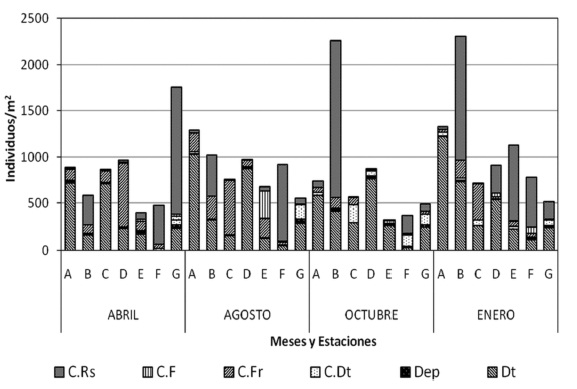
Se registraron seis grupos dietarios, predominando por su elevada abundancia los detritívoros (Dt), representados por la familia Glossiphoniidae (Helobdella sp.) (Tabla 2). La mayor abundancia de este gremio se registró en enero (3347 ind/m2) y agosto (2282 ind/m2), meses de menores precipitaciones. Este grupo registró diferencias significativas por estaciones (p = 0,0001), pero no entre meses (p = 0,46). En sus contenidos estomacales se observó un 42,3 % de materia orgánica (MO) y menos del 2 % de materia inorgánica (MI) y de restos vegetales.
El grupo de los depredadores (Dep) estuvo conformado por nueve taxones (Tabla 2). La mayor riqueza se presentó en abril (ocho taxones) y la menor en octubre (tres taxones). Al igual que los Dt, los depredadores tuvieron una mayor abundancia en enero y agosto (Fig. 3). No se registraron diferencias significativas por mes (p = 0,68) ni por estaciones (p = 0,14). En los contenidos estomacales de los miembros de la familia Aeshnidae se registraron cápsulas cefálicas de Chironomidae, segmentos de mandíbulas y fragmentos de patas de invertebrados (indeterminados), que representaron un 18 % de su dieta, lo que conf irma sus fuertes hábitos depredadores (Merritt y Cummins, 1996). También se registraron restos vegetales y MO (menos del 2 %). La familia Piscicolidae (hirudíneos) se catalogó igualmente dentro de este grupo de Dep debido a que en sus contenidos estomacales se hallaron segmentos de oligoquetos (15 %), en los cuales se pudieron observar quetas bífidas, al parecer de tubifícidos. También se registró en su contenido una espora del hongo Tetraploa aristata y MO en menor proporción (3 %). Dentro del grupo de depredadores también se recolectaron con baja abundancia las familias de chinches acuáticas Notonectidae y Corixidae, descritas en la literatura como depredadoras de insectos (Merritt y Cummins, 1996).

El grupo colector-raspador (C.Rs) representó el 34,6 % de la abundancia. Se hallaron tres taxones de este grupo (Tabla 2). Su mayor abundancia se registró en enero (Fig. 3) y la menor en agosto. No se hallaron diferencias significativas por mes (p = 0,51) pero si por estaciones (p = 0,002). La familia Hyalellidae predominó en el sector de transición (estación B) y en el sector de mayor impacto (estación F) durante todos los meses de muestreo. Los contenidos estomacales de los individuos de esta familia alcanzaron el 22 % de MO y tuvieron poca cantidad de MI. La familia Physidae (3 %) registró su mayor abundancia en enero en el sector de mayor impacto (estaciones D y F) y la menor en agosto.
Los colectores-fragmentadores (C.Fr) llegaron al 14,1 % de la abundancia y estuvieron representados por ocho taxones (Tabla 2). En abril se observó la mayor riqueza, en agosto se registró la mayor abundancia y en octubre se obtuvo la menor cantidad de individuos de este grupo. Se registraron diferencias significativas por estaciones (p = 0,02) pero no por meses (p = 0,07). La mayor abundancia de C.Fr fue aportada por la familia Asellidae, principalmente en la estación C, (sector de transición) y en la estación D (Fig. 3), área afectada por la urbanización y adecuación en su perímetro de canales de recolección de aguas. Bennett y Humphries (1978) indican que su predominancia es propia de ambientes con alto grado de contaminación, lo cual se comprobó en el humedal de Techo (PUJ y EAAB, 2009). Los contenidos estomacales de los miembros de esta familia correspondieron en un 38 % a MO, menos del 1 % a MI y un 4 % a material vegetal (restos de hojas). El género Tipula se registró en la mayor parte de las estaciones pero con especial predominancia en el sector de transición y de mayor impacto (estación E en abril y D de enero). El contenido estomacal de estos organismos estuvo compuesto en un 35,7 % por MO, en un 4,3 % por material vegetal y en menor proporción por MI. Chessman (1986) halló valores entre el 5 y el 57 % de detritos finos en los contenidos estomacales de diferentes especies de Tipulidae, de dimensiones entre cuatro y 22 mm, tamaños similares a los tipúlidos de Jaboque. Los coleópteros de la familia Scirtidae (Scirtes sp.), integrantes de este grupo C.Fr, fueron abundantes en agosto en el sector conservado (estación B). Su contenido estomacal registró un 34,4 % de MO. Autores como Merritt y Cummins (1996) los catalogan como colectores-fragmentadores y herbívoros, pero en Jaboque solo presentaron un 2,1 % de material vegetal en sus contenidos estomacales. La familia Ceratopogonidae tuvo su máxima abundancia en abril (estación A). En sus estómagos se halló un 35 % de MO, valor más alto que el registrado en otros estudios (19,5 %, Motta y Uieda, 2004). También se encontró un 3,6 % de material vegetal y se observaron diatomeas (Pinnularia sp. y Gomphonema parvulum) y esporas del hongo Glomus sp., comunes en la base del tallo y en las hojas de las plantas acuáticas.
El grupo dietario colector detritívoro (C.Dt) estuvo representado por ocho taxones (Tabla 2) y alcanzó un 4,3 % de la abundancia (1098 ind/m2). Su mayor cantidad se encontró en octubre y agosto, principalmente por parte de la familia Tubificidae (oligoquetos). No se evidenciaron diferencias significativas entre meses (p = 0,051) ni entre estaciones (p = 0,052), pero se observó que en el sector de transición (estación C) se presentó la mayor abundancia. En menor proporción se registraron dípteros del género Eristalis (familia Syrphidae).
El grupo colector-filtrador (C.F), formado por el género Culex y por un gastrópodo de la familia Sphaeriidae, tuvo una baja abundancia y no mostró diferencias significativas entre estaciones (p = 0,78) ni entre meses (p = 0,80). Estos organismos fueron más abundantes en agosto en el sector de transición (estación E) y en enero en el sector de mayor impacto (estaciones D y F). Es muy común encontrar en la literatura trabajos que indican que es un grupo asociado con la categoría de detritos finos o MOPF (Cummins y Klug, 1979).
La biomasa de macrófitas acuáticas fluctuó entre 501,6 y1138 g/m2 (PS) con un promedio por estación de 785,1 g/m2. Los valores máximos promedios se registraron en octubre (849,9 g/m2) y abril (830,4 g/m2) y los menores en enero (713,1 g/m2) y agosto (747,1 g/m2). La biomasa de macrófitas de Jaboque se puede considerar alta de acuerdo a la clasificación de Poi de Neiff y Neiff (2006), quienes plantean que valores superiores a 451 g/m2 corresponden a sistemas con biomasas elevadas.
Análisis ecológicos y estadísticos
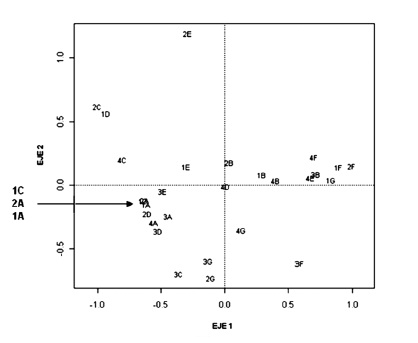
En la figura 4 se observa el ACL para los grupos tróficos dietarios y en la figura 5 se grafican los puntos de muestreo correspondientes al mismo análisis. En el cuadrante superior derecho se encuentra el grupo de los colectores-raspadores (Hyalellidae en su gran mayoría) y en la misma ubicación se halla el 75 % de la estación F y el 100 % de la B. Los representantes de este género usualmente están asociados a la vegetación acuática y se alimentan de MO en descomposición, condiciones halladas en estas estaciones. En el cuadrante superior izquierdo se localizan los grupos de colectores-filtradores y colectores-fragmentadores, que corresponde en la figura 5 a la ubicación de las estaciones D (25 %), C (50 %) y E (50 %) (sectores semiurbanizados y urbanizados). En esta última estación se obtuvieron las máximas abundancias de Sphaeriidae (C.F). Los individuos de Asellidae (C.Fr) predominaron en las estaciones D y C. En el cuadrante inferior izquierdo se agruparon los gremios de detritívoros, colectores- detritívoros y depredadores, que aparecen principalmente en la estación A (100 %). En esta estación del sector conservado se hallaron las máximas abundancias de detritívoros. Dentro del mismo cuadrante se encuentran la estación C (50 %), muy cerca al grupo de los colectores-detritívoros, y la estación G (50 %), donde abundaron los depredadores. Se puede observar en el ACL una organización de las abundancias de los grupos tróficos en la que cada grupo de MIA parece preferir las condiciones de determinadas estaciones o épocas climáticas. Al parecer, algunos grupos aprovechan mejor los recursos disponibles allí donde sus abundancias son mayores.

La regresión lineal simple entre la biomasa de macrófitas y la abundancia de macroinvertebrados tuvo un valor predictivo relativamente bajo (r2 = 0,12 explicación del 12,3 %) pero significativo (p = 0,006 para un nivel de significancia del 0.05 %). La ecuación del modelo ajustado fue y = 442.58 + 0.2723 x abundancia
Índices ecológicos
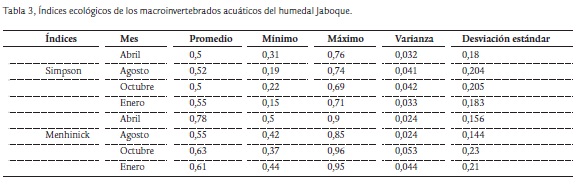
La riqueza fluctuó entre seis y 16 taxones, con diferencias significativas entre los meses (p = 0,001) y entre las estaciones (p = 0,00001). Los máximos valores se registraron en los meses de mayores lluvias (estación G de abril, 16 taxones), lo cual puede deberse a la presencia de un pequeño espejo de agua en este sitio, favorable para la comunidad de MIA. El sector más conservado (estaciones A y B) mostró altos valores de riqueza, ya que se encuentran a mayor distancia de los barrios aledaños. El sector de transición (estación C) tuvo la menor riqueza (seis taxones). La diversidad de Menhinick registró un promedio de 0,7 bits (Tabla 3) y no tuvo diferencias entre meses (p = 0,11) pero si entre estaciones (p = 0,04). El mayor promedio por mes ocurrió en abril (0.78) y el menor en enero (0.61).
La dominancia de Simpson no mostró diferencias significativas entre meses (p = 0.88) aunque sí entre las estaciones (p = 0.02). Los valores más altos del índice de dominancia se registraron en las estaciones B y E en abril y agosto. Este incremento se debió al aumento de individuos pertenecientes a las familias Hyalellidae y Glossiphoniidae (Dt) y de la familia de C.Fr Asellidae, las cuales tienen un amplio espectro de distribución.
DISCUSIÓN
Ambiente fisicoquímico
La temperatura del agua fue moderada, el pH fue neutro a ligeramente ácido, la conductividad fue alta, y los nutrientes y los sólidos suspendidos fueron elevados. De acuerdo a estas características físicas y químicas, el humedal Jaboque puede catalogarse como un sistema de aguas cálidas tropicales y de condiciones eutróficas a hipereutróficas (Salas y Martino,2001). La temperatura no sufre fuertes variaciones como las que ocurren en las regiones templadas. La conductividad indica que las aguas de este humedal tienden a ser mineralizadas, con valores óptimos que estimulan la productividad primaria. Asimismo el pH del agua lo clasifica como un sistema de neutro a ligeramente ácido con fluctuaciones que no perjudican la vida acuática. Las condiciones de anoxia concuerdan con lo propuesto por Lewis (2000), quien señala que los sistemas lénticos tropicales tienden a presentar un alto déficit de oxígeno y aún más cuando el sistema está alterado. La DBO5 y los nutrientes son excesivos. Tres formas de nitrógeno (amonio, amoníaco y nitratos), así como el fósforo soluble, presentaron valores altos con cierta tendencia a un aumento en los periodos de bajas lluvias. El incremento en estas épocas más secas puede estar relacionado con los bajos niveles de oxígeno disuelto y con el aumento en la DBO5, inducidos por las altas descargas de materia orgánica y por el aumento en la temperatura. Este conjunto de factores pudo generar condiciones reductoras que permitieron eventualmente una mayor liberación de las formas reducidas de nitrógeno y fósforo.
Los valores registrados de las variables físicas y químicas permiten clasificar a Jaboque como un sistema de eutrófico a hipereutrófico (Henao, 1987; Salas y Martino, 2001; Roldán y Ramírez, 2008). Es normal que los humedales no perturbados tengan concentraciones importantes de nutrientes y MO. Sin embargo, los datos físicos y químicos medidos en Jaboque son muy elevados, por lo que se puede plantear que este es un sistema alterado, con un detrimento ambiental y ecológico de sus aguas ocasionado por el fuerte impacto urbano. Este impacto se debe a la alta densidad poblacional en algunos sectores del humedal. Es así como las localidades de Engativa y Suba en las que se encuentra Jaboque tienen cerca de 800 mil y un millón de habitantes, respectivamente. De estos, alrededor de 15 mil tienen asiento en inmediaciones del humedal (SDA, 2009; SDP, 2009). Pese a que gran parte del humedal presenta condiciones de detrimento, un pequeño sector (estaciones A y B) muestra características un poco más favorables o menos adversas.
Grupos tróficos de macroinvertebrados acuáticos
La mayor representación de MIA detritívoros en Jaboque durante todos los muestreos quizá se debe a la gran disponibilidad de detritos orgánicos, lo cual fue corroborado en sus contenidos estomacales. Sobre la familia Glossiphoniidae, perteneciente a este grupo, hay controversias con respecto a su categoría trófica. Autores como Baer (1971) y Sawyer (1974) afirman que algunos de estos organismos son depredadores de caracoles, oligoquetos, larvas de insectos, crustáceos y hyalellas, o que pueden ser ectoparásitos (hematófagos) de aves acuáticas, reptiles y anfibios. También se plantea que emplean la ventosa para succionar pequeñas partes de estos animales o que se alimentan de fluidos corporales (Sawyer, 1986). Otros autores como Pennak (1978) y Sket y Trontelj (2008) señalan que raramente estos organismos son detritívoros. Se puede afirmar, al menos para el presente estudio en Jaboque, que estos individuos se pueden catalogar dentro del grupo de los Dt. Es posible que esta familia también se pueda considerar como detritívora-carroñera, pero se requerirán bioensayos de laboratorio para comprobar esta hipótesis. Son escasos los estudios de contenidos estomacales en este grupo de organismos y en este tipo de sistemas lénticos (humedales), en los que las dinámicas y los flujos energéticos son diferentes en comparación con otros sistemas acuáticos, por lo que es aún prematuro establecer una clasificación trófica definitiva para las sanguijuelas de esta familia.
Las fluctuaciones temporales en la abundancia de los depredadores parecen obedecer al aumento de la riqueza general de MIA durante los meses de baja precipitación, lo cual pudo significar un incremento de la disponibilidad de presas para este grupo en esos periodos. Los registros de restos de Tubificidae en los contenidos estomacales de los hirudíneos de la familia Piscicolidae permiten inferir que estos organismos son depredadores. Esto difiere del planteamiento de Sket y Trontelj (2008), quienes consideran que esta familia parasita peces. Es posible que en presencia de peces los Piscicolidae succionen su sangre, pero ante la ausencia o escasa presencia de tales vertebrados en el humedal Jaboque, estas sanguijuelas parecen recurrir a otras fuentes alimenticias. Por su parte, los odonatos son depredadores reconocidos. Corbet (1999) afirma que algunas especies de este orden pueden sincronizar sus periodos de emergencia con la disponibilidad de sustratos, evitando la competencia intraespecífica, lo cual explicaría sus fluctuaciones en Jaboque.
Aunque los C.Rs no fueron dominantes, aumentaron en enero. Esto podría deberse a que en los periodos de baja precipitación hay altas radiación solar y temperatura, y con ello un incremento en la cantidad de algas perifíticas y en la fotosíntesis. Esta mayor producción primaria también podría verse favorecida por el aumento del nitrógeno disuelto en dicho mes. De esta forma las algas perifíticas representarían una oferta alimenticia más elevada para este grupo de organismos. No obstante, la presencia de gran cantidad de MO y no tan alta de algas en los contenidos estomacales de algunos taxones de C.Rs parece concordar con los hallazgos de Chessman (1986), quien encontró en ríos australianos que la familia Hyalellidae tuvo porcentajes de detritos finos entre el 17 y el 56 %, y en menor proporción de microalgas, similar a lo hallado en Jaboque para esta familia. Otro factor que influye sobre el género Hyalella es la conductividad alta, tal como ha sido reportado por Moya et al., (2009), quienes afirman que estos organismos prefieren aguas con elevada mineralización. De igual manera, la familia Physidae probablemente se vio favorecida por un incremento en los nutrientes en las épocas de menor precipitación, lo que pudo haber aumentado la producción primaria y haber beneficiado los hábitos raspadores de estos caracoles (Alonso y Camargo, 2005). Algunos investigadores plantean que los raspadores están influenciados por la producción primaria del perifiton y que la distribución estacional de las algas de esta comunidad se relaciona con las abundancias de los C.Rs. La baja abundancia de raspadores en Jaboque podría deberse a la predominancia E. crassipes, planta que no permite un elevado crecimiento del perifiton debido a la interferencia de la luz que producen sus hojas (Planas y Neiff, 1998).
La mayor abundancia del grupo C.Fr se registró en el sector de transición (estación C), cuyas aguas son de mala calidad. Su alta representación en este sitio indica que estos organismos son tolerantes a tales condiciones, por lo cual pueden establecerse y proliferar allí. De esta manera la gran cantidad de MO, reflejada a través de los altos valores de DBO5 y de sólidos suspendidos, así como las elevadas cantidades de nitratos y fósforo y los bajos valores de oxígeno disuelto en este lugar, parecen controlar la abundancia de los C.Fr. En otros trabajos se ha visto que estos organismos explotan mejor los recursos durante los periodos de baja precipitación, dado que durante estas épocas se dan simultáneamente condiciones de estabilidad hidrológica y altas temperaturas (Miserendino y Pizzolón, 2000). El porcentaje registrado para este grupo fue similar al del humedal Techo (21 %, PUJ y EAAB, 2009), de características físicas y químicas semejantes a las de Jaboque. Como se señaló anteriormente, la menor abundancia de este grupo se presentó en octubre (322 ind/m2), pero en general sus densidades fueron comparativamente bajas. Al respecto es importante tener en cuenta lo señalado por Dudgeon (1984), quien observó que la eutrofización cultural reduce, e incluso puede llegar a eliminar, las poblaciones de desmenuzadores. La elevada presión urbana que presenta el humedal Jaboque desde hace varios años ha ocasionado altas concentraciones de MO y nutrientes, lo que podría ayudar a explicar la reducida presencia de este grupo.
El incremento del impacto humano promueve la abundancia de colectores-detritívoros y desfavorece a los depredadores (Kerans y Karr, 1994), y este parece ser el caso del sector de transición (estación C). En términos sanitarios, algunos autores afirman que el aumento considerable de los C.Dt indica un deterioro en la calidad del agua (Plafkin et al., 1989; Rosenberg y Resh, 1993). El porcentaje de C.Dt en Jaboque no fue muy alto pero su presencia evidencia que la vía detrítica es de suma importancia en este tipo de ecosistemas. El gran porcentaje de MO registrada en sus contenidos estomacales se debe consecuentemente a que los detritos son omnipresentes, encontrándose disponibles en gran abundancia en los ecosistemas acuáticos del neotrópico (Allan, 1982; Tomanova et al., 2006), y aun más en los sistemas lénticos. Los filtradores fueron poco abundantes, lo cual puede deberse a que están mejor representados en sistemas lóticos (Restrepo y Rincón, 2009), ya que la corriente transporta las partículas y favorece su habito alimenticio. En el humedal Techo no se registró la presencia de filtradores (PUJ y EAAB, 2009).
La expresión de varios grupos tróficos y sus múltiples interacciones dentro de los MIA del Jaboque constituye una manera de diversificar el ingreso de energía a esta comunidad de invertebrados, pues no sólo se utilizan las vías de pastoreo (consumo de fitoplancton, perifiton o macrófitas por parte de los filtradores, raspadores y fragmentadores), sino también las vías detríticas. Estas últimas parecen ser más importantes, ya que los detritívoros constituyen el grupo trófico más abundante en Jaboque (y posiblemente en otros humedales similares). En suma, la variada representación de distintos grupos tróficos de MIA permite suponer que el ingreso de energía a este nivel de los consumidores del humedal es diverso.
Los valores de diversidad registrados en Jaboque corresponden a los de un sistema acuático con un grado bastante alto de perturbación ambiental (Washington, 1984), que se reflejó en los cambios en estos índices de la comunidad de MIA durante las épocas de muestreo y entre las estaciones. La diversidad aumentó y la dominancia disminuyó al presentarse un mayor número de especies exclusivas, principalmente en el sector conservado. Por tanto, los taxones más abundantes contribuyeron al aumento en los valores de dominancia. A su vez, estos organismos son indicadores de abundante MO y altos niveles de saprobiedad, lo cual corroboró la alta contaminación orgánica de las estaciones más intervenidas en el humedal.
En el ACL se observa cómo se distribuyen los grupos tróficos de acuerdo a las preferencias y adaptaciones a las condiciones espacio-temporales. La conjugación de las fluctuaciones de las variables físicas y químicas con las interacciones biológicas (depredación, competencia) y la disponibilidad de alimento (nutrientes), estructuran los grupos tróficos de MIA en este humedal. Esta organización espacio-temporal detectada con el ACL sugiere que en las estaciones más conservadas (A y B) tienden a predominar los detritívoros y los depredadores, y que hay cierta mayor representatividad de estos grupos, junto con los colectores de MOPF (C.Dt), en el segundo periodo lluvioso del año (octubre).
El porcentaje de explicación de la relación entre la biomasa de plantas acuáticas y la abundancia de MIA fue menor que el obtenido por Poi de Neiff y Neiff (2006) en lagos del plano de inundación del río Paraná (69 %). Gaston et al. (1995) también encontraron una correlación positiva entre biomasa de macrófitas y densidad de MIA en estuarios del golfo de México. Independientemente del ajuste estadístico de la correlación, es importante tener presente que las plantas acuáticas son albergue, refugio y sitios de reproducción y alimentación de los invertebrados acuáticos. Por lo tanto, es importante conocer la relación macrófitas-invertebrados, ya que los MIA juegan un papel muy significativo en las redes tróficas, en el aporte de biomasa y en la producción secundaria de estos ecosistemas (Millán et al., 1997).
Finalmente, es importante señalar que la categorización de algunos taxones en determinados grupos tróficos se logró mediante el análisis de sus contenidos estomacales. Esto fue posible con los hirudíneos (Glossiphoniidae) y los isópodos (Asellidae), entre otros taxones, lo que permitió confirmar, complementar y, en ciertos casos, proponer modificaciones a los hábitos alimenticios reportado en la literatura. De esta manera, el presente trabajo aporta datos nuevos sobre los hábitos tróficos de los MIA de los sistemas acuáticos neo-tropicales de montaña, una región del mundo cuya limnología es poco conocida. Además, el estudio de los grupos tróficos permitió tener una visión más amplia del estado ecológico del humedal, ya que estos gremios reflejan los atributos relacionados con los ensamblajes de la comunidad desde una perspectiva funcional.
AGRADECIMIENTOS
Los autores agradecen al Posgrado en Biología del Departamento de Biología de la Universidad Nacional de Colombia, al Grupo de Biodiversidad y Conservación del Instituto de Ciencias Naturales y al Grupo de Biodiversidad, Biotecnología y Conservación de Ecosistemas del Departamento de Biología por todo su apoyo durante la elaboración del proyecto. Asimismo al ICN-UNAL y al Laboratorio de Ecología del Departamento de Biología por el préstamo de sus instalaciones. También a Leider Palacio, Diana Marcela Mejía, Yenny Suarez y Alexis Jaramillo, profesor del ICN-UNAL, por la colaboración en la identificación de material estomacal. A Mónica Bayona y Lorena García por la ayuda en la determinación de algunos especímenes.
BIBLIOGRAFÍA
Allan JD. Feeding habits and prey consumption of three predaceous stoneflies (Plecoptera) in a mountain stream. Ecology 1982;63:26-34. [ Links ]
Alonso A, Camargo A. Estado actual y perspectivas en el empleo de la comunidad de macroinvertebrados bentónicos como indicadores del estado ecológico de los ecosistemas fluviales españoles. Rev Ecosistemas [serial online 2005. En:Abcitado 16 feb. 2013; 14(3):87-99. Disponible en: URL: http://www.revistaecosistemas.net/index.php/ecosistemas/article/view/432. [ Links ]
American Public Health Association (APHA), American Water Works Association (AWWA), Water Pollution Control Federation (WPF). Métodos normalizados para el análisis de agua potables y residuales. Traducción del Standard Methods. Barcelona: Editorial Díaz de Santos S.A.; 1992. [ Links ]
Baer JG. El parasitismo animal. Madrid: Editorial Guadarrama S.A.; 1971. [ Links ]
Benke AC, Wallace JB.Trophic basis of production among riverine caddis flies: implications for food web analysis. Ecology 1997;78:1132-1145. [ Links ]
Bennett D, Humphries D. Introducción a la ecología de campo.Madrid: Ediciones Blume. 1978. [ Links ]
Caicedo O, Palacio J. Los macroinvertebrados bénticos y la contaminación orgánica en la quebrada La Mosca (Guarne, Antioquia). Actu Biol. 1998;20(69):61-73. [ Links ]
Chará AMS, Chará JD, Zúñiga MC, Pedraza GX, Giraldo LP.Clasificación trófica de insectos acuáticos en ocho quebradas protegidas de la ecorregión cafetera colombiana. Univ Sci. 2010;15(1):27-36. [ Links ]
Chessman BC. Dietary studies of aquatic insects from two Victorian Rivers. Aust J Mar Freshw Res 1986;37:129-46. [ Links ]
Corbet PS. Dragon flies. Behavior and ecology of Odonata. Nueva York: Harley Books; 1999. [ Links ]
Cummins KW, Klug MJ. Feeding ecology of stream invertebrates. Annu Rev Ecol Syst. 1979;10:147-172. [ Links ]
Dudgeon D. Longitudinal and temporal changes in functional organization of macroinvertebrate communities in the Lam Tsuen River, Hong Kong. Hydrobiología 1984;111(3):207-217. [ Links ]
Elosegi A, Sabater S, editores. Conceptos y técnicas en ecología fluvial. Bilbao: Fundación BBVA; 2009. [ Links ]
Epler JH. Identification manual for the water beetles of Florida (Coleoptera: Dryopidae, Dytiscidae, Elmidae, Gyrinidae, Haliplidae, Hydraenidae, Hydrophilidae, Noteridae, Psephenidae, Ptilodactylidae, Scirtidae). Tallahassee: Florida Department of Environmental Protection; 1996. [ Links ]
Fernández H, Domínguez E. Guía para la determinación de los artrópodos bentónicos sudamericanos. Tucumán: Universidad Nacional de Tucumán, Facultad de Ciencias Naturales - Instituto M. Lillo; 2001. [ Links ]
Gaston GR, Brown SS, Rakocinski CF, Heard RW, Summers JK. Trophic structure of macrobenthic communities in northern Gulf of Mexico estuaries.Gulf Res Rep. 1995;9:111-116. [ Links ]
Greathouse EA, Pringle CM. Does the river continuum concept apply on a tropical island? Longitudinal variation in a Puerto Rican stream. Can J Fish Aquat Sci 2006;63:134-152. [ Links ]
Hammer Ø, Harper DAT, Ryan PD. 2001. PAST: Paleontological statistics software package for education and data analysis. Palaeontol Electronica [serial online 2001 Jan- Jun citado 16 feb. 2013; 4(1): [9 pantallas. Disponible en: URL: http://palaeo-electronica.org/2001_1/past/past.pdf. [ Links ]
Hansen M. The hydrophiloid beetles: phylogeny, classification and a revision of the genera (Coleoptera, Hydrophiloidea). Biol Skr Dan Vid Sel 1991;40:1-367. [ Links ]
Henao De UA. El disco de secchi y el estado trófico. Rev Ainsa. 1987;12:67-79. [ Links ]
Hernández-RJ, Rangel-CH JO. La vegetación del humedal Jaboque (Bogotá, D. C.). Caldasia 2009;31(2):355-379. [ Links ]
IDEAM. Instituto de Hidrología, Meteorología y Estudios Ambientales. Valores totales mensuales de precipitación. Datos de la estación 212057 El Dorado instalada en febrero de 1972. Sistema de Información Nacional Ambiental. 2010. [ Links ]
Kashian DR, Burton TM. A Comparison of macroinvertebrates of two Great Lakes coastal wetlands: Testing potential metrics for an Index of Ecological Integrity. J Great Lakes Res. 2000;26(4):460-481. [ Links ]
Kerans BL, Karr JR. A benthic index of biotic integrity (B-IBI) for rivers of Tennessee Valley. Ecol Appl. 1994;4:768-785. [ Links ]
Kohler KE, Gill SM. Coral Point Count (CPCe) with Excel extensions. A Visual Basic program for the determination of coral and substrate coverage using random point count methodology. Comput Geosci 2006;32(9):1259-1269. [ Links ]
Lewis WJr. Basis for the protection and management of tropical lakes. Lakes Reservoirs: Res Manage. 2000;5:35-48. [ Links ]
Liévano A, Ospina R. Guía ilustrada de los macroinvertebrados acuáticos del río Bahamon. Bogotá: Universidad del Bosque - Instituto Alexander von Humboldt; 2007. [ Links ]
Martínez MA. Macroinvertebrados acuáticos como indicadores de calidad del agua en tres ciénagas del departamento de Cesar, Colombia. [tesis de maestría Bogotá: Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia; 2009. [ Links ] Merritt RW, Cummins KW. An introduction to the aquatic insects of North America.3 ed. Dubuque: Kendall/Hunt; 1996. [ Links ]
Millán A, Moreno JL, Velasco J. Coleópteros y heterópteros acuáticos del complejo lagunar del río Arquillo (Albacete). Al-Basit. 1997;40:29-69. [ Links ]
Miserendino Ml, Pizzolón LA. Macroinvertebrates of a fluvial system in Patagonia: altitudinal zonation and functional structure. Arch Hydrobiol. 2000;150:55-83. [ Links ]
Motta RL, Uieda VS. Diet and trophic groups of an aquatic insect community in a tropical stream. Braz J Biol 2004; 64(4):809-817. [ Links ]
Moya C, Valdovinos C, Moraga A, Romero F, Debels P, Oyanedel A. Patrones de distribución espacial de ensambles de macroinvertebrados bentónicos de un sistema fluvial Andino Patagónico. Rev Chilena de Historia Natura.l 2009;82:425-442. [ Links ]
Peckarsky BL. Predator-prey interactions. En: Hauer FR, Lamberti GA, editores. Methods in Stream Ecology. San Diego: Academic Press; 1996. p. 431-451. [ Links ]
Pennak RW. Fresh-Water Invertebrates of the United States 2 ed. New York: Jhon Wiley; 1978. [ Links ]
Plafkin JL, Barbour MT, Porter KD, Gross SK, Hughes RM. Rapid bioassessment protocols for use in streams and rivers: Benthic macroinvertebrates and fish. Washington: U.S. Environmental Protection Agency, Office of Water Regulations and Standards; 1989. [ Links ]
Planas D, Neiff JJ. Is perifiton important in the E. crassipes meadows? Verh Int Verein Limnol. 1998;26:1865-1870. [ Links ]
Poi De Neiff A, Neiff JJ.Riqueza de especies y similaridad de los invertebrados que viven en plantas flotantes de la planicie de inundación del río Paraná (Argentina). Interciencia 2006;31(3):220-225. [ Links ]
Pontificia Universidad Javeriana (PUJ), Empresa de Acueducto y Alcantarillado De Bogotá (EAAB). Plan de manejo ambiental del humedal de Techo. Bogotá: Pontificia Universidad Javeriana, Instituto de Estudios Ambientales para el Desarrollo IDEADE- Empresa de Acueducto y Alcantarillado de Bogotá, Secretaria Distrital de Ambiente; 2009. [ Links ]
Pulido BHW, Melgarejo LM. Evaluación preliminar del potencial de indicadores de salud y calidad relacionados con el ciclo del carbono de suelos del humedal de Jaboque (Cundinamarca, Colombia). Acta Biol Col. 2006;11(1):149. [ Links ]
R Development Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing [programa de ordenador R version 2.11.1 Copyright (C); 2010. [ Links ]
Rangel J, Orjuela M. Humedales de la localidad de Engativá. El humedal Jaboque. Bogotá: Edit. Códice Ltda; 2003. [ Links ]
Restrepo M, Rincón CM. Aproximación a la caracterización ecológica de la quebrada Fucha en la Reserva Forestal de los Cerros Orientales en la Localidad de San Cristóbal. (Bogotá, Colombia) Biografía: Escritos sobre la Biología y su Enseñanza [serial online 2009 citado 1 octubre 2010; 2 (2): [18 pantallas. Disponible en: URL: http://www.pedagogica.edu.co/revistas/ojs/index.php/bio-grafia/issue/view/27/showToc [ Links ]
Rodríguez-Barrios J, Ospina-Tórres R, Turizo-Correa R. Grupos funcionales alimentarios de macroinvertebrados acuáticos en el río Gaira, Colombia. Rev Biol Trop. 2011; 59(4):1537-1552. [ Links ]
Roldán G. Guía para el estudio de de los macroinvertebrados acuáticos en el departamento de Antioquia. Bogotá: Colciencias - Fondo FEN Colombia; 1988. [ Links ]
Roldán RGA, Ramírez RJJ. Fundamentos de Limnología Neo-tropical. Medellín: Academia Col de Cien Exact Fis y Nat - Univ Catolica de Oriente - Univ de Antioquia; 2008. [ Links ]
Root RB. The niche exploitation pattern of the blue-grey gnatcatcher. Ecol Monogr. 1967;37:317-350. [ Links ]
Rosenberg DM, Resh VH. Freshwater Biomonitoring and Benthic Macroinvertebrates. New York: Chapman Hall Publ; 1993. [ Links ]
Salas HJ, Martino P. Metodologías simplificadas para la evaluación de eutroficación en lagos cálidos tropicales. Lima: Centro Panamericano de Ingeniería Sanitaria y Ciencias del Ambiente, Programa Regional CEPIS/HPE/OPS OPS/CEPIS/PUB/01; 2001. [ Links ]
Sawyer RT. Leech Biology and Behaviour. Oxford: Clarendon Press; 1986. [ Links ]
Sawyer RT. Leeches (Annelida: Hirudinea). En: Hart CW, Samuel L, Fuller H, editors. Pollution ecology of freshwater invertebrates. San Diego: Academic Press; 1974. p. 81-136. [ Links ]
Secretaría Distrital de Ambiente (SDA). Plan Ambiental Localidad de Engativá. Bogotá: Alcaldía Mayor de Bogotá, Secretaría Distrital de Ambiente; 2009. [ Links ]
Secretaría Distrital de Planeación (SDP). Conociendo la Localidad de Suba. Bogotá: Alcaldía Mayor de Bogotá, Secretaría Distrital de Planeación; 2009. [ Links ]
Sket B, Trontelj P. Global diversity of leeches (Hirudinea) in freshwater. Hydrobiologia 2008;595:129-137. [ Links ]
Statpoint Technologies INC. Statgraphics Centurion XV. [programa de ordenador. Version Centurion XV E.U.A: Stat Point, Inc.; 2006. [ Links ]
Tomanova S, Goitia E, Helesic J. Trophic levels and functional feeding groups of macroinvertebrates in neotropical streams. Hydrobiologia 2006; 556:251-264. [ Links ]
Washington HG. Diversity, biotic and similarity indices. A review with special relevance to aquatic ecosystems. Water Res 1984;18:653-694. [ Links ]