Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Acta Biológica Colombiana
versión impresa ISSN 0120-548X
Acta biol.Colomb. vol.19 no.1 Bogotá ene./mar. 2014
https://doi.org/10.15446/abc.v19n1.38384
http://dx.doi.org/10.15446/abc.v19n1.38384
EFECTO DE LA INVASIÓN DE ACACIA NEGRA (GLEDITSIA TRIACANTHOS L. (FABACEAE)) SOBRE LA TEMPERATURA, LUZ Y METABOLISMO DE UN ARROYO PAMPEANO
Honey Locust (Gleditsia triacanthos L. (Fabaceae)) Invasion Effect on Temperature, Light and Metabolism of a Pampean Stream
ADONIS GIORGI1, 2, Ph. D.; CAROLINA VILCHES1, 2, Ph. D.; MARÍA CAROLINA RODRÍGUEZ CASTRO1, 2, Bióloga; EDUARDO ZUNINO1, Biólogo; JUAN DEBANDI2, Biólogo; SEBASTIÁN KRAVETZ2, Biólogo; ANA TORREMORELL1, 2, Ph. D.
1 CONICET, Consejo Nacional de Investigaciones Científicas y Técnicas. Argentina. G. Adonis (adonis@coopenetlujan.com.ar), C. Vilches (carolina_vilches@hotmail.com)
2 Universidad Nacional de Luján, Departamento de Ciencias Básicas, Programa de Ecología de Protistas-Instituto de Ecología y Desarrollo Sustentable-Luján, Argentina. M.C. Rodriguez Castro (carolina.rodriguez.castro@gmail.com); E. Zunino (eduardozunino@yahoo.com.ar); J. Debandi (debandij12@hotmail.com); S.Kravetz (sebastiankravetz@yahoo.com.ar); A. Torremorell (anatorremorell@gmail.com). Autor de correspondencia: Adonis Giorgi. Av. Constitución y Ruta Nac. n.° 5. Luján, Argentina. Tel. 02 32 342 39 79 Ext. 403 1914. adonis@coopenetlujan.com.ar
Presentado el 11 de junio de 2013, aceptado el 17 de septiembre de 2013, fecha de reenvío el 22 de noviembre de 2013.
Citation / Citar este artículo como: GIORGI A, VILCHES C, RODRÍGUEZ CASTRO MC, ZUNINO E, DEBANDI J, KRAVETZ S, TORREMORELL A. Efecto de la invasión de acacia negra (Gleditsia triacanthos L. (Fabaceae)) sobre la temperatura, luz y metabolismo de un arroyo pampeano. Acta biol. Colomb. 19(1):99-106.
RESUMEN
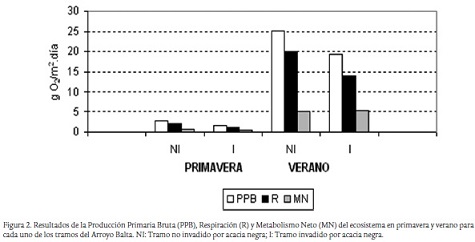
El asentamiento de especies invasoras en una región generalmente produce cambios en los ecosistemas en los que se introducen. En este caso se analiza el efecto producido por una invasión de Gleditsia triacanthos, la acacia negra, sobre un arroyo pampeano. Esta especie modifica el clima térmico y lumínico del tramo. La amplitud térmica se reduce significativamente en el tramo invadido aunque la temperatura promedio en ambos tramos es similar. La irradiación se reduce entre un 85 y un 95 % bajo el dosel arbóreo. Estas modificaciones disminuyen la producción primaria bruta de 2,7 a 1,7 g O2/m2 en primavera y de 25 a 20 g O2/m2 en verano. La respiración se reduce a la mitad en los tramos invadidos, tanto en primavera como en verano, siendo el metabolismo neto similar en ambos tramos y estaciones del año. Por otro lado, el tramo invadido por acacia tiene muy escasas macrófitas. Se postula que la invasión de acacias además de disminuir la biodiversidad por reducción de las macrófitas y de los organismos asociados a ella reduce la producción primaria provocando cambios en la red trófica.
Palabras clave: arroyos, invasoras leñosas, metabolismo.
ABSTRACT
The establishment of invader species in a region generally modifies the ecosystems where they are introduced. In this study we analyze the effect produced by a Gleditsia triacanthos (honey locust) invasion on a pampean stream. This organism modifies the temperature and the light reaching the stream. Thermal range shows significant differences between reaches but mean temperatures are similar in both reaches. Radiation diminished between 85 and 95 % down the trees. These modifications reduce the primary gross production of 2.7 to 1.7 g O2. m-2 at spring and of 25 to 20 g O2. m-2 at summer. Respiration in spring and summer is halved at invaded reaches, but net ecosystem metabolism is similar in both reach and seasons. Moreover, the reach invaded by honey locust show scarce macrophytes. We argue that the honey locust reduces the diversity by reduction of macrophytes and their associated organisms but also reduce the primary production causing changes in the food web.
Keywords: metabolism, streams, woody invaders.
La vegetación leñosa de ambientes ribereños ejerce un rol importante como amortiguador del ingreso de nitrógeno desde campos cultivados, a la vez que aporta materia orgánica indispensable para el funcionamiento de todo el ecosistema fluvial (Sabater et al., 2003). Sin embargo, en la pampa argentina la vegetación ribereña dominante es de tipo herbácea y en forma natural solo existen algunos árboles aislados como el sauce criollo (Salix humboldtiana) o el tala (Celtis tala) (Feijoó y Lombardo, 2007).
A medida que ha ido incrementándose la ocupación urbana del territorio, una serie de especies invasoras, varias de ellas leñosas como la mora (Morus alba), el paraíso (Melia azedarach) y el acacio negro (Gleditsia triacanthos), han ido invadiendo diferentes áreas de la pampa y las riberas de los ambientes fluviales. Según Ghersa et al., (2002) la mayor invasora es la acacia negra. Esta especie es una leñosa de la familia de las leguminosas (Fabaceae), originaria de los Estados Unidos que se ha naturalizado en todos los continentes. En la Argentina fue introducida a mediados del siglo XIX presumiblemente para utilizarla como cerco vivo (Hudson, 1918), ha invadido bosques montanos y del espinal (Ghersa et al., 2002) y en los últimos años se ha extendido en gran parte de las márgenes de arroyos y ríos pampeanos (Leggieri, 2010; Gantes et al., 2011). Esta invasión es favorecida por el ganado que se alimenta de los frutos de la acacia y dispersa la semilla (Blair, 1990). Su dispersión se incrementó en las márgenes de cuerpos de agua sobre todo en los últimos años ya que el ganado ha sido llevado a zonas marginales por el incremento de áreas sembradas. Si bien se ha planteado el efecto negativo de su presencia sobre la producción de los ecosistemas fluviales (Leggieri, 2010), no se ha estimado cuál es su efecto real en los arroyos pampeanos analizando las modificaciones que puedan generar las leñosas sobre la temperatura y la intensidad de luz solar incidente sobre los cursos de agua y cómo dichas modificaciones afectarían la estructura y el funcionamiento de los mismos.
El objetivo de este trabajo fue analizar las diferencias en factores físicos (temperatura y luz) y su posible efecto tanto en el desarrollo de comunidades (macrófitas y epipelon) como en la producción y respiración de un arroyo en tramos invadidos y no invadidos por acacia negra. Nuestra hipótesis es que la colonización de acacias promueve la reducción de la temperatura del agua y de la intensidad de luz incidente sobre los arroyos, así como también reduce su variación diaria, modificando de ese modo el desarrollo de macrófitas y la respuesta funcional del sistema.
Por ello propusimos como predicción que al analizar el metabolismo en un río que presente ambas situaciones encontraríamos una producción primaria bruta menor en la zona invadida por acacia.
Área de estudio
La pampa es una amplia región de Sudamérica que se desarrolla desde el sur de Brasil hasta el sur de la provincia de Buenos Aires en Argentina, incorporando otras provincias como Santa Fe, sur de Córdoba y La Pampa. Las pendientes regionales son bajas (menores al 1 %) y presenta suelos muy fértiles con gran contenido de materia orgánica y arcillas que dificultan el drenaje. El clima es templado cálido con una temperatura media de 17 °C y variaciones entre 0 y 40 °C. Las precipitaciones anuales oscilan entre 600 y 1200 mm (Cabrera y Willink, 1980).
El fondo de los arroyos está compuesto por tosca con predominio de carbonato de calcio sobre el que se depositan sedimentos finos y restos de vegetales en descomposición. En ese tipo de sustrato, se establecen plantas acuáticas que alcanzan un gran desarrollo y sobre las que suelen crecer profusas comunidades de algas epífitas. El desarrollo de plantas acuáticas tanto sumergidas, como flotantes y emergentes es favorecido por la irradiancia que llega sin interrupciones al cuerpo de agua y por la baja velocidad del agua (entre 20 y 40 cm/s) que favorecen su establecimiento y desarrollo (Giorgi et al., 2005). Además, al no poseer rocas ni guijarros la diversidad de hábitats y refugios está conformada por lo que generan las propias plantas acuáticas donde suele encontrarse la mayor cantidad de macroinvertebrados, muchos de los cuales se alimentan de las algas epífitas (Giorgi y Tiraboschi, 1998).
Para el estudio se seleccionaron dos tramos homogéneos de al menos 500 m de longitud en el arroyo Balta, afluente del río Luján ubicado en la Provincia de Buenos Aires (S 34 º 40' 49,9" W 59° 20' 12"). Un tramo con el área ribereña conservada con pastizal (tramo no invadido) y el otro con una alta densidad de acacia (tramo invadido). Se realizaron muestreos en primavera (noviembre 2012) y verano (febrero 2013), época de mayor desarrollo del follaje por parte de la planta invasora. Las márgenes del tramo no invadido se caracterizan por la dominancia de gramíneas de distinto porte como: Stipa hialina, Sonchus oleraceus y Amaranthus quitensis. Además, en este tramo la hidrófita dominante en las márgenes es el junco (Schoenoplectus californicus). Las márgenes del tramo invadido corresponden a un sotobosque denso de acacia negra con árboles jóvenes de entre 1 a 10 años de edad, aunque se han observado varios renovales. Las acacias cohabitan con algunos pocos árboles nativos como el tala (Celtis tala) en mal estado fisiológico, presumiblemente debido a la competencia ejercida por la acacia.
Parámetros
La variación de temperatura se registró en intervalos de media hora durante 30 días en primavera y verano (n = 1440) mediante registradores de temperatura con memoria (ibuttons- MCI electronics) sumergidos en cada tramo.
Para obtener el porcentaje de reducción de luz debido a la sombra de las acacias en el tramo invadido, en cada uno de los tramos se realizaron varias mediciones con un sensor esférico quantum sumergible sensor LI-193 instalado en LI- 250 Quantum Meter (LICOR Inc.). Finalmente, se corrigió la radiación incidente en el tramo invadido debida al porcentaje de reducción calculado. La cobertura de acacias sobre el arroyo se estimó tomando fotografías cada 10 m a lo largo del tramo, y calculando el porcentaje de área cubierta mediante el programa Adobe PhotoShop (CS6 13.0.1.1). (Davies- Colley y Payne, (1998)
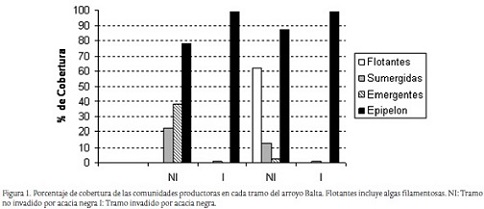
La cobertura de macrófitas se estimó mediante un mapeo en un tramo medio de 100 m de longitud en cada uno de los sitios seleccionados. El mapeo se realizó estimando los porcentajes de cobertura de macrófitas cada 5 m diferenciando flotantes, sumergidas y emergentes. Se consideró que el porcentaje de superficie no cubierto por macrófitas correspondía a epipelon ya que dada la escasa profundidad, las algas pueden desarrollarse sin inconvenientes sobre el fondo.
Para realizar una caracterización de la riqueza de invertebrados presentes en cada sitio se tomó una muestra de las macrófitas del lugar y se colocaron nueve trampas por tramo, distanciadas 20 m aproximadamente y construidas por bolsas (20 x 15 cm) con un centímetro de poro con hojas secas. Estas trampas fueron retiradas luego de permanecer 30 días apoyadas en el lecho de cada tramo. De ambas muestras se extrajeron los invertebrados presentes mediante cuidadoso lavado del material utilizando tamices de 1000 y 500 micrones. Luego de la separación se realizó la identificación siguiendo las claves de invertebrados de Lopretto y Tell (1995). Tanto en primavera como en verano se realizaron mediciones de metabolismo abierto al final de los tramos (Odum, 1956; Uehlinger y Naegeli, 1998; Reichert et al., 2009). Para ello se registró el oxígeno disuelto en intervalos de cinco a 15 minutos con una sonda multiparamétrica HQ40 (HACH company) durante 36 horas. La sonda se ubicó en la parte central del cauce donde corría el agua en forma permanente en condiciones de caudal basal.
Se calculó el metabolismo neto del ecosistema expresado en gO2 m-2 min-1 con la ecuación:
Metabolismo Neto = (Kt (ODs - OD) + dOD/dt).z
Donde Kt es el coeficiente de reaereación (min-1) corregido por la temperatura según Kt = K20 °C x 1,024(T-20 °C) (Acuña et al., 2009); ODs es la concentración de saturación del oxígeno disuelto bajo una temperatura y presión determinadas; OD es la concentración de oxígeno disuelto aguas abajo del tramo en g/ m3; y z es la profundidad media (m). El coeficiente de reaireación (Kt) se estimó basado en la declinación de la curva de oxígeno disuelto durante la noche (Hornberger y Kelly, 1975) y las regresiones lineales para obtenerlo mostraron un R2 ≥ 0,75. Calculamos el metabolismo neto diario (MND) como la suma del metabolismo neto durante 24 horas. La respiración diaria del ecosistema (RDE) como la suma del metabolismo neto durante la noche más la suma de la tasa respiratoria durante las horas de luz. Esta tasa se calculó interpolando el metabolismo calculado a la caída del sol con el de la salida del sol. La Producción Bruta Diaria se calculó sumando el metabolismo neto diario y la respiración diaria del ecosistema (Odum, 1956).
Análisis estadísticos
Las medidas de la irradiación y temperatura de cada tramo fueron comparadas mediante ANOVA de una vía. Los valores de cobertura y metabolismo corresponden a los totales registrados en cada tramo y estación del año. La información referida a los grupos de invertebrados hallados es cualitativa y no indica valores de abundancia o dominancia.
El promedio de temperaturas considerando los meses de noviembre y febrero fue similar en ambos tramos ya que no se registraron diferencias significativas. La amplitud térmica diaria fue significativamente mayor en los tramos no invadidos respecto de los invadidos. La irradiación fue sustancialmente menor en el tramo invadido, reduciéndose un 85 % en primavera y 95 % en verano (Tabla 1). La cobertura generada por el dosel arbóreo se estimó en 80,8 % en primavera y 85,8 % en verano donde hubo mayor desarrollo de follaje. La cobertura de macrófitos fue marcadamente menor en el tramo con mayor densidad de acacia (Fig.1).
La riqueza de invertebrados fue mayor en el tramo no invadido que en el tramo invadido. La mayoría de los invertebrados asociados a la vegetación se repitió en las trampas exceptuando algunos como los cangrejos de río (Aegla sp.) y los oligoquetos que solo aparecieron en las trampas apoyadas sobre el fondo del arroyo (Tabla 2).
Se encontraron mayores valores de producción primaria y respiración en el tramo no invadido tanto en primavera como en verano aunque los valores de metabolismo neto fueron semejantes porque la diferencia entre producción primaria y respiración fue similar. Por otro lado, se incrementó en un orden de magnitud la producción y respiración y metabolismo en verano con respecto a la primavera (Fig. 2).
La invasión de leñosas puede producir efectos diversos sobre la estructura y el funcionamiento de las comunidades acuáticas (Serra et al., 2012). En este estudio se registraron cambios sobre las comunidades de macrófitas que prácticamente desaparecieron en la zona invadida por acacia. Esto incluye la desaparición de algas filamentosas que en verano incrementan su representación en el tramo no invadido pero no sobreviven en donde existe invasión. Evidentemente la reducción de luz en el tramo invadido que alcanza el 95 % de la luz incidente inhibe el desarrollo de las comunidades de macrófitas (Vilches, 2005) aunque permite, pese a la escasa luz incidente, el desarrollo de algas epipélicas (diatomeas y cianofíceas principalmente). Estos resultados coinciden con otros registrados previamente donde se observó una disminución de las comunidades de macrófitas sumergidas en tramos de un arroyo pampeano con especies forestales en sus riberas (Feijoó et al., 2012). Este nuevo tipo de sistema creado por la invasión (escasa luz incidente, bajo desarrollo de macrófitas, perifiton/epipelon constituido por diatomeas) es el descrito por varios autores del hemisferio norte (Vanotte et al., 1980; Richardson y Danehy, 2007) como típico arroyo de cabecera, muy diferentes a los arroyos pampeanos (Feijoó y Lombardo, 2007). La producción primaria del tramo invadido si bien es menor, no se reduce en la proporción que cabría haber esperado por la disminución de luz por el aporte de algas epipélicas. Richardson y Danehy (2007) proponen que el desarrollo de las algas y por lo tanto la producción primaria del sistema depende más fuertemente de la disponibilidad de nutrientes que de la disponibilidad de luz. Los arroyos pampeanos se caracterizan por poseer altas concentraciones de nutrientes por lo que quizás en nuestro caso el efecto de la reducción de energía lumínica sobre la producción primaria se ve amortiguado por la fácil disponibilidad de nutrientes para las algas.
Si bien la producción es menor, al disminuir la cantidad de plantas acuáticas hasta casi su desaparición también disminuye la respiración (Vilches, 2005) en un 50 %, quedando un metabolismo neto similar en ambos tramos. Por otro lado se registró una modificación de la amplitud térmica diaria en el tramo invadido que podrían reducir las tasas respiratorias y de descomposición.
En nuestra región recientemente se ha comenzado a estudiar el efecto de la invasión de G. triacanthos sobre el ecosistema acuático. Gantes et al., (2011) encuentran que la descomposición de hojas de esta acacia es más lenta en las zonas no invadidas y se lo atribuyen a la posibilidad de acción de los invertebrados en cada sitio ya que no hallan diferencias entre los hongos acuáticos estudiados en los tramos invadidos y no invadidos. Por otro lado, también se ha estudiado el efecto de leñosas invasoras en diferentes ambientes (Molinero y Pozo, 2003; Ashton et al., 2005; Serra et al., 2012). Estos autores han encontrado que se modifica el aporte de materia orgánica sobre el ecosistema, modificando la acción de los macroinvertebrados. Complementariamente, los resultados de este estudio demuestran que en arroyos pampeanos el efecto sobre la producción se debería principalmente a la reducción de macrófitas y sus algas asociadas por déficit lumínico. Esto promovería la reducción de la riqueza de macroinvertebrados probablemente por reducción de la complejidad o heterogeneidad del ambiente (Ferreiro et al., 2011). Es interesante destacar que aunque se incremente la cantidad de material orgánico disponible para los invertebrados a partir de la hojarasca, estos muestran una baja riqueza.
En una proyección a futuro de los ecosistemas pampeanos invadidos por G. triacanthos se espera que la invasión reduzca la producción del ecosistema fluvial de modo tal que las redes tróficas se modifiquen, basándose más en energía obtenida a partir de los detritos que a partir de la producción. Suponemos que esto puede implicar una modificación de los grupos dominantes así como una reducción de la biodiversidad que ha sido relevada como alta en los ecosistemas fluviales pampeanos en los últimos años (Rodrigues-Capítulo et al., 2010). Por ello, sería recomendable discutir e implementar acciones de manejo y control de esta especie invasora para conservar no solo la amplia biodiversidad sino también el adecuado funcionamiento del ecosistema.
AGRADECIMIENTOS
Este proyecto ha sido subsidiado por un PIP (CONICET) y PICT (MINCyT) pertenecientes al trienio 2012-2014 y la Universidad Nacional de Luján. Agradecemos especialmente a la propietaria y el personal de Hostería La Soleada por su colaboración durante la toma de muestras y al grupo GER Solar por facilitarnos los datos de radiación en continuo. Se agradece las críticas realizadas por dos revisores y el trabajo editorial que han mejorado sustancialmente el manuscrito.
BIBLIOGRAFÍA
Acuña V, Guasch H, Giorgi A, Izaguirre O. Flujo de energía en el ecosistema fluvial. Análisis del metabolismo. En: Elosegi A, Sabater S, editores. Conceptos y técnicas en ecología fluvial. Barcelona: Fundación BBVA; 2009. p. 367-386. [ Links ]
Ashton I, Hyatt L, Howe K, Gurevitch J, Lerdau M. Invasive species accelerate decomposition and litter nitrogen loss in a mixed deciduous forest. Ecol appl. 2005;15(4):1263-1272. [ Links ]
Blair, RM. Honey locust (Gleditsia triacanthos L.). En: Burns, RM, Honkala, BH, editors. Silvics of North America, Hardwoods. Agriculture Handbook 654 (2), Washington, D.C.: USDA, Forest Service; 1990. p. 358-364. [ Links ]
Cabrera A, Willink A. Biogeografía de America Latina. Washington D.C.: Organization of American States; 1980. p. 17-25. [ Links ]
Davies-Colley RJ, Payne GW. Measuring stream shade. JN Am Benthol Soc. 1998;17(2):250-260. [ Links ]
Feijoó C, Lombardo R. Baseline water quality and macrophyte assemblages in Pampean streams: A regional approach. Water Res. 2007;41(7):1399-1410. DOI: 10.1016/j.watres.2006.08.026. [ Links ]
Feijoó C, Gantes P, Giorgi A, Rosso J, Zunino E. Valoración de la calidad de ribera en un arroyo pampeano y su relación con las comunidades de macrófitas y peces. Biol Acuat. 2012;27:113-128. [ Links ]
Ferreiro N, Feijoó C, Giorgi A, Leggieri L. Effect of macrophyte heterogeneity and food availability on structural parameters of the macroinvertebrate community in a Pampean stream. Hydrobiologia. 2011;664(1):199-211. DOI: 10.1007/s10750-010-0599-7. [ Links ]
Gantes P, Marano A, Rigacci L. Changes in the decomposition process associated with the invasion of Gleditsia triacanthos (honey locust) in pampean streams (Buenos Aires, Argentina). J Freshw Ecol. 2011;26 (4):481-494. DOI: 10.1080/02705060.2011.578397. [ Links ]
Ghersa C, De La Fuente E, Suárez S, León R. Woody species invasion in the Rolling Pampa grasslands, Argentina. Agric Ecosyst Environ. 2002;88(3):271-278. DOI: 10. 1016/S0167-8809(01)00209-2. [ Links ]
Giorgi A, Feijoó C, Tell G. Primary producers in a Pampean stream: temporal variation and structuring role. Biodivers Conserv. 2005;14:1699-1718. DOI 10.1007/s10531- 004-0694-z. [ Links ]
Giorgi A, Tiraboschi B. Evaluación experimental del efecto de dos grupos de macroinvertebrados (anfípodos y gasterópodos) sobre algas epífitas. Ecología Austral. 1998; 9(1):35-44. [ Links ]
Hornberger G, Kelly M. Atmospheric reaeration in a river using productivity analysis. J Environ Engineering. 1975; 101(5):729-739. [ Links ]
Hudson W. Far away and long ago: A childhood in Argentina. London: England; 1918. p 63-76. [ Links ]
Leggieri L. Invasión de Gleditsia triacanthos en los corredores de los sistemas fluviales de la Pampa Ondulada y su efecto sobre la distribución de Myocastor coypus. Ecología Austral. 2010;20:201-208. [ Links ]
Lopreto E, Tell, G. Ecosistemas de aguas continentales Metodologías para su estudio. Tomo III. Ediciones Sur. 1995. [ Links ]
Molinero J, Pozo J. Balances de hojarasca en dos arroyos forestados: impacto de las plantaciones de eucalipto en el funcionamiento ecológico de un sistema lótico. Limnetica. 2003;22(3-4):63-70. [ Links ] Odum H. Primary production in flowing waters. Limnol Oceanogr. 1956;1:102-117. [ Links ]
Reichert P, Uehlinger U, Acuña V. Estimating stream metabolism from oxygen concentrations: the effect of spatial heterogeneity. J Geophys Res. 2009;114:G03016. DOI:10. 1029/2008JG000917. [ Links ]
Richardson J, Danehy R. A synthesis of the ecology of headwater streams and their riparian zones in temperate forest. For Sci. 2007;53(2):131-147. [ Links ]
Rodrigues-Capítulo A, Gómez N, Giorgi A, Feijoó C. Global changes in pampean lowland streams (Argentina): Implication for diversity and functioning. Hydrobiologia. 2010;657(1):53-70. DOI: 10.1007/s10750-010-0319-3. [ Links ]
Sabater S, Butturini A, Clement Jch, Burt T, Dowrick D, Hefting M, et al. Nitrogen Removal by Riparian Buffers along a European Climatic Gradient: Patterns and Factors of Variation. Ecosystems. 2003;6(1):20-30. DOI: 10.1007/ s10021-002-0183-8. [ Links ]
Serra M, Albariño R, Díaz Villanueva V. Invasive Salix fragilis alters benthic invertebrate communities and litter decomposition in northern Patagonian streams. Hydrobiologia. 2012;701(1): 173-178. DOI: 10.1007/s 10750-012-1270-2. [ Links ]
Uehlinger U, Naegeli M. Ecosystem metabolism, disturbance, and stability in a prealpine gravel bed river. J North Am Benthol Soc. 1998;17(2):165-178. [ Links ]
Vannote R, Minshall G, Cummins K, Sedell J, Cushing C. The river continuum concept. Can J Fish Aquat Sci. 1980; 37(1):130-137. DOI: 10.1139/f80-017 [ Links ]
Vilches C. Comparación del metabolismo en productores del arroyo Las Flores (tesis de licenciatura). Luján: Universidad Nacional de Luján; 2005. p. 42-47. [ Links ]