Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.19 no.3 Bogotá Sept./Dec. 2014
https://doi.org/10.15446/abc.v19n3.42890
Artículo de investigación
http://dx.doi.org/10.15446/abc.v19n3.42890
VARIACIÓN DEMOGRÁFICA TEMPORAL DE LA TORTUGA DE RÍO CHOCOANA, Rhinoclemmys nasuta (GEOEMYDIDAE), EN ISLA PALMA, BAHÍA MÁLAGA, PACÍFICO DEL VALLE DEL CAUCA
Temporal Variation in Demography of the Chocoan River Turtle, Rhinoclemmys nasuta (Geoemydidae), on Isla Palma, Malaga Bay, Pacific Coast of Valle del Cauca
MARIO FERNANDO GARCÉS RESTREPO1; M. Sc.; ALAN GIRALDO1, Ph. D.; JOHN L. CARR1,2, Ph. D.
1 Grupo de Investigación en Ecología Animal, Universidad del Valle. Calle 13 n.°. 100-00. Cali, Colombia. mariofgarces@gmail.com; alan.giraldo@gmail.com
2 Department of Biology and Museum of Natural History, University of Louisiana at Monroe, Monroe, Louisiana, 71209-0520, USA. carr@ulm.edu
Autor de correspondencia: Mario Fernando Garcés Restrepo, mariofgarces@gmail.com
Recibido 1 de abril 2014, aceptado con modificaciones 27 de junio 2014, fecha de reenvío 24 de julio 2014.
Citation / Citar este artículo como: GARCÉS RESTREPO MF, GIRALDO A, CARR JL. Variación demográfica temporal de la tortuga de río chocoana, Rhinoclemmys nasuta (Geoemydidae), en Isla Palma, Bahía Málaga, Pacífico del Valle del Cauca. Acta biol. Colomb. 2014;19(3):489-497.
RESUMEN
Pocos estudios demográficos de larga duración han sido realizados en tortugas dulceacuícolas de Suramérica, pese a la necesidad de este tipo de investigación para esclarecer las variaciones naturales y fortalecer procesos de conservación en este grupo particular. En esta investigación se estudió la variación en la demografía de una población de la tortuga de río chocoana (Rhinoclemmys nasuta), a partir de información registrada en una localidad insular del Pacífico colombiano entre 2005 y 2012. En esta localidad se capturaron manualmente tortugas en cinco riachuelos con un área total de 0,4 ha. Se calculó el tamaño poblacional con el método Jolly-Seber en cuatro periodos (2005-06, 2007, 2011 y 2012), y se comparó la estructura poblacional. Se estimó la probabilidad de supervivencia y la probabilidad de captura para machos, hembras y juveniles utilizando el modelo Cormack-Jolly-Seber, y la tasa de crecimiento poblacional con el modelo POPAN. Se evidenciaron aumentos y disminuciones en el tamaño de la población. Se evidenció un aumento significativo del porcentaje de juveniles que hacen parte de la población durante el periodo de estudio. En todos los periodos las hembras dominaron la estructura de sexos de la población. Las variaciones temporales en el tamaño poblacional pueden deberse a cambios naturales en el hábitat o a efectos denso-dependientes. Sin embargo, también pueden corresponder a fluctuaciones normales en los parámetros poblacionales, por lo tanto monitoreos continuos donde se puedan correlacionar factores ambientales y físicos del hábitat podrían permitirnos elucidar a que se deben estas variaciones.
Palabras clave: estructura poblacional, probabilidad de supervivencia, tamaño poblacional, tasa de crecimiento poblacional.
ABSTRACT
Few long-term demographic studies have been conducted in freshwater turtles of South America despite the need for this type of inquiry to investigate natural variation and strengthen conservation efforts for these species. In this study, we examined variation in demography of the Chocoan River Turtle (Rhinoclemmys nasuta) based on a population from an island locality in the Colombian Pacific region between 2005 and 2012. At this locality we captured turtles by hand in five streams with a total area of 0.4 ha. We calculated population size with the Jolly-Seber method and compared the population structure of four time periods (2005-06, 2007, 2011 and 2012). We calculated the probability of survival and capture probability for males, females and juveniles using the Cormack -Jolly-Seber model and we estimated the rate of population growth with the POPAN model. We found increases and decreases in population size, and a significant increase in the percentage of juveniles in 2011 and 2012. In all periods, females dominated the sex structure of the population. Temporal variation in population size may be due to natural changes in habitat or density-dependent effects. However, it may correspond with normal fluctuations in population parameters, therefore continuous monitoring that can be correlated with environmental and physical factors of the habitat could elucidate the causes of the variation.
Keywords: growth rate, population size, population structure, survivorship.
INTRODUCCIÓN
En las últimas décadas se ha evidenciado una gran disminución a nivel mundial de las poblaciones naturales de tortugas continentales (Gibbons et al., 2000; Van Dijk, 2012), incluso las perspectivas más conservadoras estiman que el 45 % de especies de tortugas continentales están amenazadas de extinción, lo cual significa que este es uno de los grupos de vertebrados en mayor peligro, excediendo los niveles de amenaza de otros ordenes como Psittaciformes, Primates o Anura, considerados como ejemplos de grupos sensibles a la extinción (Rhodin et al., 2011; Páez et al., 2012). Múltiples son las causas que afectan la viabilidad de las especies de tortugas, pero se destacan la pérdida y degradación de sus hábitats, la introducción de especies invasoras, la polución ambiental, las enfermedades, el daño y fragmentación del material genético y la sobreexplotación (Mittermeier et al., 1992; Aresco y Dobie, 2000; Gibbons et al., 2000, Hernández-Guzmán et al., 2014); las cuales son agravadas por factores intrínsecos de su biología como la lenta recuperación de las poblaciones y su madurez sexual tardía (Heppell, 1998; Litzgus y Mousseau, 2004; Daigle y Jutras, 2005).
Estos mismos rasgos provocan que tan solo investigaciones demográficas a largo plazo puedan generar información relevante para la conservación de las tortugas (Gibbons, 1987; Cooley et al., 2003; Converse et al., 2005; Daigle y Jutras, 2005). Estos estudios deberían incluir al menos información acerca de cambios en las proporciones sexuales y la supervivencia (Tucker et al., 2001; Henry, 2003; Converse et al., 2005; Litzgus, 2006), con el fin de predecir tendencias poblacionales. Estudios a largo plazo han sido relativamente comunes en el hemisferio norte, incluyendo datos de hasta tres décadas sobre especies amenazadas (Nichols, 1939; Schwartz y Schwartz, 1974; Stickel, 1978; Williams y Parker, 1987; Doroff y Keith, 1990; Converse et al., 2005). Para Suramérica el panorama es diferente, ya que son escasos este tipo de investigaciones. Tan solo en la última década algunos estudios en Argentina y Brasil aportan datos demográficos para algunas especies en periodos no mayores a tres años (Lescano et al., 2008; Fachín-Terán et al., 2003; Neto et al., 2011), destacándose solo el trabajo de Martins y Souza (2009) ya que es el único que incluye datos de más de una década. Para Colombia estudios de este tipo son casi inexistentes o apenas comienzan a ser publicados.
La tortuga de río chocoana, Rhinoclemmys nasuta, especie endémica del Chocó biogeográfico, está considerada como casi amenazada (NT) a nivel mundial y de datos deficientes (DD) a nivel nacional (Castaño-Mora, 2002; Rueda-Almonacid et al., 2007; Carr y Giraldo, 2009; Carr et al., 2012; Van Dijk et al., 2012). A inicios del siglo XXI solo existía un par de trabajos que hacían referencia a su biología básica y distribución (Medem, 1962; Carr y Almendáriz, 1990). Sin embargo, a partir del 2005 se inició una línea de investigación acerca de la biología y ecología de la especie, enfocada en una población localizada en Isla Palma, Bahía Málaga, al norte del Pacífico del Valle del Cauca (Loaiza, 2006; Pérez, 2007; Garcés-Restrepo, 2008; Carr y Giraldo, 2009; Giraldo et al., 2012; Garcés-Restrepo et al., 2013). A través de modelos de población cerrada, se ha registrado una población grande y al parecer estable. Sin embargo debido al corto plazo de los estudios o a los análisis poblacionales cerrados, no se conocen parámetros poblacionales importantes como probabilidad de supervivencia y captura, así como su cambio en el tiempo.
Utilizando como base la información registrada de R. nasuta durante los esfuerzos de muestreos que se han realizado entre 2005 y 2012 en Isla Palma, en esta investigación se evaluó la variación temporal de los parámetros poblacionales de tamaño, proporción sexual, pirámide de edades, probabilidad de supervivencia, probabilidad de captura y tasa de crecimiento con el propósito de describir las tendencias de esta población insular en el tiempo.
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
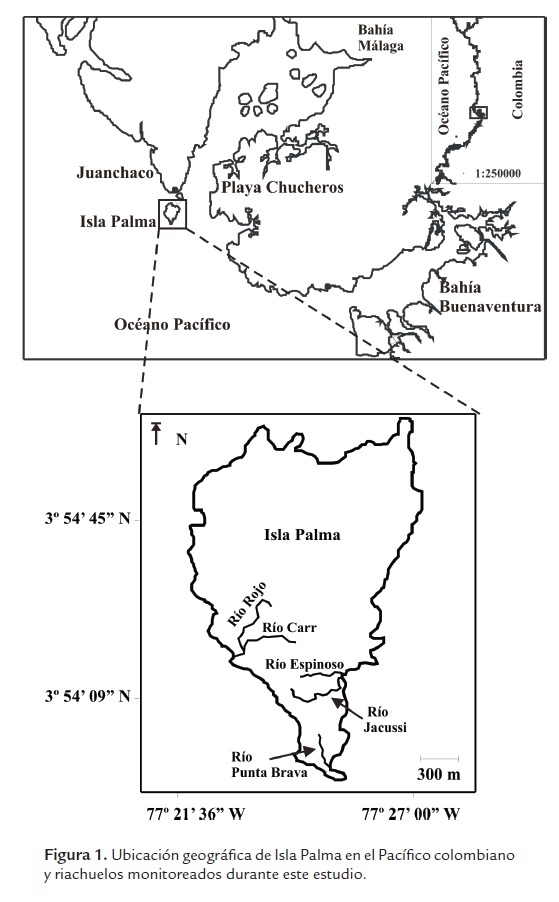
La localidad de Isla Palma se encuentra ubicada al norte del Golfo de Tortugas (3.90019° N, 77.35597° W), pertenece al Chocó Biogeográfico, específicamente a la subregión Costa Pacífica (Fig. 1). La vegetación típica es clasificada como bosque tropical húmedo bajo (Rangel-Ch. y Arellano-P., 2004), específicamente la vegetación en esta localidad se caracteriza porque las raíces no son profundas, con un sotobosque denso y complejo, presentando adicionalmente gran cantidad de bejucos, epífitas, gramíneas y ciperáceas de hojas grandes (Giraldo et al., 2012). La precipitación está entre los 7200 y 8500 mm anuales, una humedad relativa promedio del 90 %, y un rango de temperatura entre 23 y 26#° C (Rangel-Ch. y Arellano-P., 2004; Garcés-Restrepo et al., 2013). Está localidad tiene un área de 138 ha y una elevación que varía entre 0 y 15 m, rodeada por acantilados rocosos uniformemente distribuidos y playas expuestas solamente en marea baja (Cantera et al., 1998; Giraldo et al., 2012). Debido a la alta precipitación y al tipo de relieve, se desarrollan numerosos riachuelos de segundo y tercer orden (Giraldo et al., 2012). Esta localidad es utilizada como faro por la Dirección General Marítima de Colombia (DIMAR), por lo cual es prohibida la caza y no existe pobladores permanentes (Garcés-Restrepo, 2008; Garcés-Restrepo et al., 2013). Actualmente, se encuentra dentro del Parque Nacional Natural Uramba Bahía Málaga (MAVDT, 2010).
MÉTODOS DE CAMPO
Los muestreos se llevaron a cabo entre abril de 2005 y octubre de 2012, en cinco quebradas de primero y segundo orden (anchos menores a 4 m y profundidades menores a 1,5 m) con longitudes variables entre los 100 y 300 m, siendo el área total para todas las quebradas de 0,40 ha.
Los muestreos se realizaron entre las 19:00 y las 23:00 horas, los individuos fueron ubicados de forma visual y colectados manualmente; los recorridos se realizaron usualmente por tres personas a una velocidad promedio de 0,2 km/h. Cada espécimen fue marcado utilizando el método de Cagle (1939), considerando las modificaciones de Giraldo et al.,(2012). Para cada individuo se tomó la longitud media del caparazón (LSMS) con un calibrador tipo vernier, como indicador de la categoría de edad a la que corresponde. El sexo se determinó por la presencia de características secundarias como la longitud pre-cloacal y la presencia o ausencia de la concavidad plastral; o por características primarias como la eversión de penes o la presencia de huevos (detectados a través de palpación inguinal); todos aquellos individuos menores a 140 mm se consideraron como juveniles (Medem, 1962; Carr y Giraldo, 2009; Giraldo et al., 2012). Los individuos se procesaron en el mismo sitio de captura y fueron liberados inmediatamente. Durante el periodo de estudio se realizaron un total de 20 eventos de muestreos, los cuales se dividieron en manera equitativa para los periodos 2005-06, 2007, 2011 y 2012, los muestreos en estos periodos tuvieron una separación de cinco meses como tiempo máximo.
ANÁLISIS DE DATOS
Con base en los datos de las capturas en cada evento, se construyó una historia individual de captura-recaptura. Se estimó el tamaño poblacional para los cuatro periodos usando el método de captura-recaptura Jolly-Seber (Caughley, 1980). Se calculó la probabilidad de supervivencia (φ) y la probabilidad de recaptura (p) para machos, hembras y juveniles en tres intervalos de tiempo (2005-06 a 2007, 2007 a 2011, 2011 a 2012) utilizando el método de Cormack- Jolly-Seber (CJS) (White y Burnham, 1999). La tasa de crecimiento poblacional (λ), se calculó para los mismos intervalos utilizando el modelo Pradel (Pradel, 1996). Estos cálculos no son válidos para el primer y último periodo de tiempo, por lo tanto los valores de tasa de crecimiento de la población solo corresponden al periodo entre el 2007 y el 2011 (Link y Nichols, 1994; Converse et al., 2005).
Se utilizaron todos los modelos posibles que incluyen la variabilidad del tiempo y grupo poblacional, sobre la probabilidad de captura y de supervivencia; estos modelos incluyen todas las posibles variaciones para cada grupo. La elección del mejor modelo se realizó teniendo en cuenta el menor valor del criterio de información de Akaike (AICc) (Lebreton et al., 1992). Todos estos estimativos fueron calculados con el software MARK 6.2 (White y Burnham, 1999).
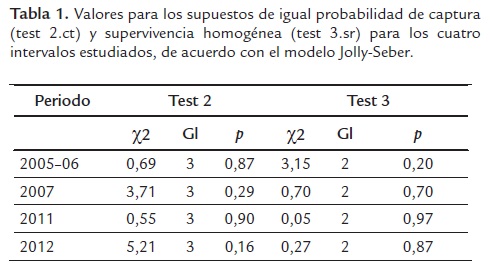
Todos los modelos empleados asumen igual probabilidad de captura entre individuos marcados y no marcados, homogeneidad de supervivencia, marcación correcta de los individuos y liberación inmediata después del muestreo (Amstrup et al., 2005). Los dos últimos supuestos no fueron violados en virtud del tipo de muestreo realizado. Los supuestos de igual probabilidad de captura y homogeneidad de supervivencia fueron evaluados con una prueba de bondad de ajuste, usando el software U-CARE versión 2.3; test 2 (ct) para el supuesto de igual probabilidad de captura en individuos marcados y no marcados y test 3 (sr) para el supuesto de homogeneidad de supervivencia (Choquet et al., 2002).
Para evaluar si existían diferencias a nivel de proporciones sexuales entre los periodos de tiempo se realizaron análisis de tablas de contingencia. Se utilizó una distribución etaria dividiendo la población en adultos y juveniles y se evaluó la diferencia entre periodos utilizando este mismo procedimiento de análisis (Zar, 1998; Lescano et al., 2008; Garcés-Restrepo et al., 2013). El procedimiento estadístico se realizó con el software PAST 2.16 (Hammer et al., 2001).
RESULTADOS
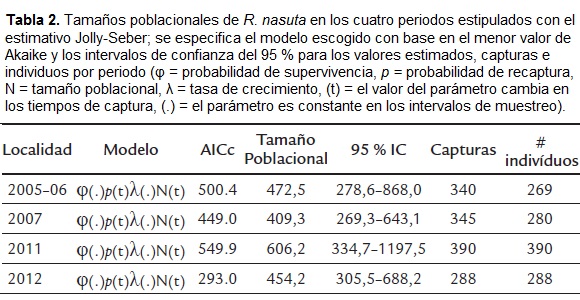
En los 20 eventos de muestreo realizados entre el 2005 y el 2012, se realizaron 1363 capturas correspondientes a 815 individuos. De estos especímenes 495 fueron capturados en una ocasión, 191 en dos, 76 en tres, 27 en cuatro, 14 en cinco, 7 en seis, 3 en siete, 1 en ocho y 1 en nueve ocasiones. El número de capturas por periodo varió entre 288 y 340, mientras que el número de individuos marcados osciló entre 251 y 314. La prueba de igual probabilidad de captura (test 2, ct) indicó que tanto los individuos marcados como los no marcados tuvieron la misma probabilidad de supervivencia en los cuatro intervalos, de igual manera el supuesto de supervivencia homogénea (test 3, sr) se cumplió para todos los periodos de tiempo considerados (Tabla 1). Se estimó el tamaño de la población para el periodo 2005-06 de 472 individuos, para 2007 de 409 individuos, para el 2011 de 606 individuos y para el 2012 de 454 individuos (Tabla 2).
Las pruebas de igual probabilidad de captura (test 2.ct) para machos, hembras y juveniles del modelo CJS indicaron que en las tres categorías los individuos marcados como los no marcados presentaron la misma probabilidad de captura (Tabla 3). Igualmente, se cumplió el supuesto de supervivencia homogénea (test 3.sr) para las tres categorías (Tabla 3).
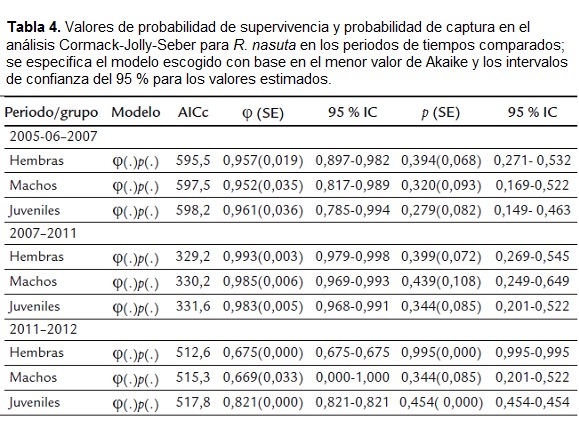
En todos los periodos los valores de probabilidad de supervivencia (φ) fueron mayores en juveniles, seguidos por hembras, en tanto que los machos presentaron la menor probabilidad de supervivencia (Tabla 4). En términos generales, la probabilidad de supervivencia fue similar entre el periodo 2005-06 a 2007 y 2007 a 2011, pero presentó una disminución para todas las categorías etarias entre 2011 y 2012 (Tabla 4). La probabilidad de captura varió entre las categorías y entre los periodos de estudio, sin embargo se detectó un incremento drástico para hembras y juveniles en el último periodo (Tabla 4).
El mejor modelo para estimar la tasa de crecimiento de la población en el periodo 2007 a 2011 presentó una probabilidad de captura no variable en el tiempo, y una tasa de supervivencia, tamaño poblacional y tasa de crecimiento poblacional variable (φ(t)p(.)λ(t) N(t)). La tasa de crecimiento fue estimada en 1,003 (IC 95 % = 1,000-1,005), por lo que se considera que la población tuvo un pequeño crecimiento durante el periodo 2007 a 2011.
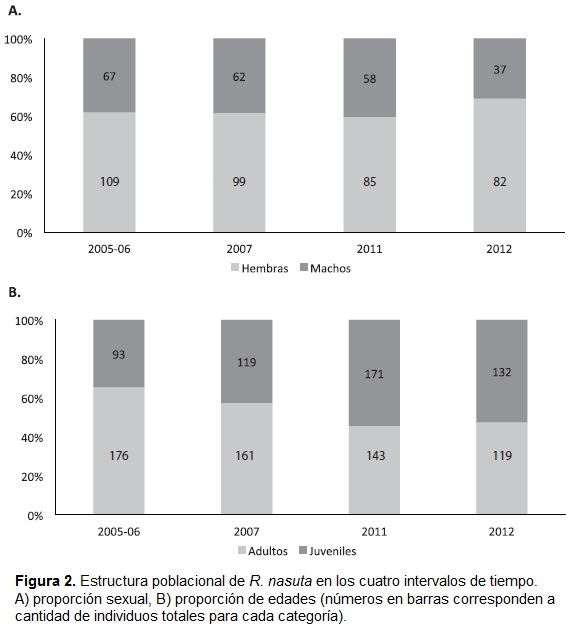
En todos los periodos de tiempo la proporción sexual estuvo dominada por hembras (2005-06 = 38:62, 2007 = 38:62, 2011 = 41:59, 2012 = 31:69) (Fig. 2a). Además, no se encontraron diferencias significativas en la proporción sexual entre periodos (χ2 = 2,57, Gl = 3, p = 0,43). En la proporción etaria (% adulto: % juvenil) se encontraron diferencias significativas entre periodos (χ2 = 16,19, Gl = 3, p<0,01), estando la población dominada por adultos en los periodos 2005-06 y 2007, y por juveniles en los periodos 2011 y 2012 (Fig. 2b).
DISCUSIÓN
Existen varios estimativos del tamaño poblacional para R. nasuta. Giraldo et al., (2012) reportaron un tamaño poblacional de 990 (IC 95 % = 941-1044) con base en el estimador Schumacher para poblaciones cerradas, con nueve eventos de captura en un intervalo de tres años. Por su parte, Garcés-Restrepo et al., (2013) calculan un tamaño poblacional para la localidad de 624 individuos (IC 95 % = 578-670) utilizando también el estimador Schumacher, pero en un periodo de dos meses con tan solo tres campañas de muestreo. Los estimativos poblacionales aquí presentados se encuentran en los rangos inferiores de esos estudios; sin embargo, una comparación directa no es posible ya que se consideran métodos, escalas temporales e intensidades diferentes. Las estimaciones con base en modelos de población cerrada que utilizan muchos muestreos y que poseen un alto número de capturas, tienden a sobreestimar el tamaño poblacional (Chao, 1989).
La dinámica poblacional de R. nasuta en Isla Palma considerando los periodos de estudio sugieren una disminución entre el año 2006 y el 2007, seguido de un aumento entre el 2007 y el 2011 finalizando con una disminución entre el 2011 y 2012. La disminución en la probabilidad de supervivencia detectada para todas las categorías establecidas en esta población durante el último periodo de tiempo de la investigación, hipotéticamente se pueden considerar como un elemento que podría generar tendencias a la reducción en el tamaño poblacional de R. nasuta en Isla Palma.
Como se menciona en la introducción varios factores podrían generar la disminución en el tamaño de una población de tortugas (Mittermeier et al., 1992; Aresco y Dobie, 2000; Gibbons et al., 2000). Sin embargo, estos factores son de baja ocurrencia en Isla Palma, debido a las características de aislamiento y control de ingreso por estar bajo administración conjunta de la Dirección Marítima - DIMAR y Parques Nacionales Naturales de Colombia - UAESPNN. Por lo tanto, la disminución y cambios en la probabilidad de supervivencia de R. nasuta en Isla Palma durante el periodo de estudio podría ser el resultado de cambios naturales en las características del hábitat provocados por fuertes tormentas que afectaron la zona entre 2010-2012, estás generaron la caída de grandes árboles, cambiando la dinámica y estructura de los cursos de agua presentes en la isla. Cambios de este tipo han sido relacionados con la variación en parámetros poblacionales en algunas poblaciones de tortugas (Schwartz y Schwartz, 1974; Williams y Parker, 1987; Converse et al., 2005), teniendo incluso un mayor efecto en una especie como R. nasuta la cual presenta preferencias por hábitats con condiciones particulares como aguas someras, de sustratos rocosos, alta complejidad del hábitat y sitios con poca cobertura vegetal (Garcés-Restrepo, 2013). Sin embargo, este patrón de aumentos seguido de disminuciones recuerda a patrones de poblaciones saturadas que se regulan por procesos denso-dependientes (Sale y Tolimeiri, 2000), lo cual explicaría las modulaciones en esta población.
Otro elemento a considerar es el hecho de que una disminución en la probabilidad de supervivencia podría estar asociada con un incremento en las tasas de emigración, condición que podría estar provocando cambios significativos en la estructura de la población (Joyal et al., 2001). Sin embargo, R. nasuta en esta localidad exhibe una alta fidelidad de sitio (Carr y Giraldo, 2009; Giraldo et al., 2012), incluso durante el periodo de estudio todas las recapturas se hicieron en los riachuelos en donde los individuos fueron marcados inicialmente, por lo que sumado a la condición de insularidad del área de estudio, se podría considerar que no hay procesos significativos de emigración asociados a esta población. En este contexto, la reducción en el estimado de la probabilidad de supervivencia probablemente no estará relacionada con un incremento en la tasa de emigración y estaría siendo representativa de la dinámica de esta población durante el periodo de estudio. Considerando la alta mortalidad de los juveniles y la gran longevidad, la mayoría de las poblaciones naturales de tortugas están dominadas por individuos adultos (Bury, 1979; Gibbs y Amato, 2000; Converse et al., 2005; Neto et al., 2011). Sin embargo, la población de Isla Palma estuvo dominada por juveniles. Aunque este fenómeno es normal en poblaciones con presión de extracción de consumo, donde se eligen animales grandes y las poblaciones comienzan a ser representadas por juveniles (Ramo, 1982; Fachín-Terán y Vogt, 2004; Martins y Souza, 2009), en Isla Palma no hay procesos extractivos significativos. Por lo tanto, la dominancia de juveniles en esta población está relacionado con una reducción en la presencia de depredadores naturales y una menor incidencia en la tasa de infestación de ectoparásitos (Giraldo et al., 2012; Garcés-Restrepo, 2013; Garcés-Restrepo et al., 2013), condiciones que en su conjunto reducirían sustancialmente la probabilidad de mortalidad natural asociada a los individuos juveniles de una población de tortugas.
La proporción de sexos en una población puede ser modulada por una tasa diferencial de mortalidad, edad de maduración, movilidad o utilización de micro hábitats particulares por parte de cada uno de los sexos (Converse et al., 2005). Además, algunas especies de tortugas el sexo está controlado por las temperaturas ambientales de incubación de los neonatos (Schwanz et al., 2010). Ya que la proporción de hembra a macho es estable en el tiempo y ha sido registrado para esta especie en otras localidades (Giraldo et al., 2012; Garcés-Restrepo, 2013; Garcés-Restrepo et al., 2013), es posible que esta proporción obedezca a factores no cambiantes como la temperatura de determinación sexual; sin embargo, no ha sido demostrado que la temperatura genere una determinación sexual en esta especie (Giraldo et al., 2012).
Es importante destacar que el presente estudio se constituye en uno de los trabajos demográficos sobre tortugas más largos en Sudamérica, presentando datos poblacionales en un periodo de alrededor de ocho años. Sin embargo, es necesario continuar con el esfuerzo permanente de monitoreo, sobre todo cuando existen evidencias de una posible disminución poblacional, que parece estar asociada con cambios en la estructura del hábitat. Aunque plantear experimentos de campo que permitan evaluar la respuesta de esta población a cambios drásticos en la estructura del hábitat sería una aproximación ideal para establecer el grado de respuesta de las poblaciones naturales de R. nasuta a alteraciones ambientales drásticas que podrían asociarse al cambio climático o alteraciones humanas, su implementación desde un punto de vista operativo sería complejo. Por lo tanto se recomienda utilizar modelos de viabilidad poblacional para evaluar, bajo escenarios definidos, la respuesta de la población y proyectar los parámetros poblacionales de esta especie en el tiempo.
CONCLUSIONES
Existen variaciones temporales en el tamaño poblacional de R. nasuta en la zona de estudio, debido a cambios naturales en el hábitat o a efectos denso-dependientes. Sin embargo, estos cambios tan solo son fluctuaciones normales en los parámetros poblacionales, por lo tanto, monitoreos continuos donde se puedan correlacionar factores ambientales y físicos del hábitat podrían permitirnos elucidar a que se deben estas variaciones. Se recomienda continuar con monitoreo de la población de R. nasuta en Isla Palma considerando que es una especie endémica del Chocó Biogeográfico, y que exhibe una población grande en una localidad insular que hace parte del sistema nacional de áreas protegidas.
AGRADECIMIENTOS
A todas las personas que contribuyeron en las campañas de muestreo en especial a Bellineth Valencia. La Dirección General Marítima (DIMAR) y la Territorial Pacífico de la Unidad Administradora Especial del Sistema de Parques Nacionales Naturales permitieron el ingreso a Isla Palma. Este trabajo fue financiado parcialmente por El Grupo de Investigación en Ecología Animal y la Universidad del Valle a través de la convocatoria interna para proyectos de investigación 2012 (CI7883), y la Universidad de Louisiana en Monroe. MFGR fue financiado parcialmente por el programa de Asistencia de Docencia de la Universidad del Valle y el programa de Jóvenes Investigadores e Innovadores "Virginia Vallejo de Pineda" del Departamento Administrativo en Ciencia, Tecnología e Innovación-COLCIENCIAS. Gracias a los doctores German Forero y Edgardo Londoño; y a dos revisores anónimos por sus comentarios y contribuciones.
REFERENCIAS
Aresco M, Dobie J. Variation in shell arching and sexual size dimorphism of river cooters, Pseudemys concinna, from two river systems in Alabama. J Herpetol. 2000;34(2):313-317. [ Links ]
Amstrup SC, McDonald TL, Manly BFJ, editors. Handbook of capture-recapture analysis. Princeton, New Jersey: Princeton University Press; 2005. 313 p. [ Links ]
Bury RB. Population ecology of freshwater turtles. In: Harless M, Morlock H, editors. Turtles: Perspectives and Research. New York: John Wiley and Sons; 1979. p. 571-602. [ Links ]
Cagle FR. A system of marking turtles for future identification. Copeia. 1939(3);170-173. [ Links ]
Cantera-K JR, Neira-O R, Ricaurte C. Bioerosión en la Costa Pacífica Colombiana: Un estudio de la biodiversidad, la ecología y el impacto humano de los animales destructores de los acantilados rocosos. Bogotá, Colombia: Fondo FEN Colombia; 1998. 150 p. [ Links ]
Carr JL, Almendáriz A. Conocimiento sobre la distribución geográfica de los quelonios del Ecuador occidental. Politécnica. 1990;14(3):75-103. [ Links ]
Carr JL, Giraldo A. Rhinoclemmys nasuta (Boulenger 1902), Large-Nosed Wood Turtle, Chocoan River Turtle. Chelon Res Monogr. 2009;5:034.1-034.6. [ Links ]
Carr JL, Garcés-Restrepo MF, Giraldo A. Rhinoclemmys nasuta. In: Páez VP, Morales-Betancourt MA, Lasso CA, Castaño-Mora OV, Bock BC, editors. V. Biología y conservación de las tortugas continentales de Colombia. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Bogotá, Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH); 2012. p. 315-322. [ Links ]
Castaño-Mora OV, editor. Libro rojo de reptiles de Colombia. Instituto de Ciencias Naturales-Ministerio del Medio Ambiente-Conservación Internacional. Bogotá, Colombia; 2002. 160 p. [ Links ]
Caughley G. Analysis of vertebrate populations. New York: John Wiley and Sons; 1980. 234 p. [ Links ]
Chao A. Estimating population size for sparse data in capture-recapture experiments. Biometrics. 1989;45(2):427-438. [ Links ]
Choquet R, Reboulet AM, Pradel R, Gimenez O, Lebreton JD. U-Care 2.2: User's Manual. Montpellier, France: CEFE; 2002. Available at: http://www.cefe.cnrs.fr/biostatistiques-et-biologie-des-populations/logiciels [ Links ]
Converse SJ, Iverson JB, Savidge JA. Demographics of an ornate box turtle population experiencing minimal human-induced disturbances. Ecol Appl. 2005;15(6):2171-2179. [ Links ]
Cooley CR, Floyd AO, Dolinger A, Tucker PB. Demography and diet of the painted turtle (Chrysemys picta) at high-elevation sites in southwestern Colorado. Southwest Nat. 2003;48(1):47-53. [ Links ]
Daigle C, Jutras J. Quantitative evidence of decline in a southern Quebec Wood Turtle (Glyptemys insculpta) population. J Herpetol. 2005;39(1):130-132. [ Links ]
Doroff AM, Keith LB. Demography and ecology of an ornate box turtle (Terrapene ornata) population in south-central Wisconsin. Copeia. 1990(2);387-399. [ Links ]
Fachín-Terán A, Vogt RC. 2004. Estrutura populacional, tamanho e razão sexual de Podocnemis uniflis (Testudines, Podocnemididae) no rio Guaporé (RO), norte do Brasil. Phyllomedusa. 2004;3(1):29-42. [ Links ]
Fachín-Terán A, Vogt RC, Thorbjarnarson JB. 2003. Estrutura populacional, razão sexual e abundância de Podocnemis sextuberculata (Testudines, Podocnemididae) na Reserva de Desenvolvimento Sustentável Mamirauá, Amazonas, Brasil. Phyllomedusa. 2003;2(1):43-63. [ Links ]
Garcés-Restrepo MF. Estructura poblacional, variación morfométrica y dimorfismo sexual de Rhinoclemmys nasuta (Testudinata: Emydidae) en dos localidades del Pacífico vallecaucano (trabajo de grado). Cali: Departamento de Biología, Facultad de Ciencias, Universidad del Valle; 2008. 33 p. [ Links ]
Garcés-Restrepo MF. Ecología poblacional de la tortuga de río chocoana (Rhinoclemmys nasuta, Boulenger 1902) en tres localidades de la costa pacífica del Valle del Cauca (tesis de maestría). Cali: Departamento de Biología, Facultad de Ciencias, Universidad del Valle; 2013. 89 p. [ Links ]
Garcés-Restrepo MF, Giraldo A, Carr JL. Population ecology and morphometric variation of the Chocoan river turtle (Rhinoclemmys nasuta) from two localities on the Colombian Pacific coast. Bol Cient Mus Hist Nat. 2013;17(2):160-171. [ Links ]
Gibbons JW. Why do turtles live so long? BioScience. 1987;37(4):262-269. [ Links ]
Gibbons JW, Scott DE, Ryan TJ, Buhlmann KA, Tuberville TD, Metts BS, et al. The global decline of reptiles, déjà vu amphibians. BioScience. 2000;50(8):653-666. [ Links ]
Gibbs JP, Amato GD. Genetics and demography in turtle conservation. In: Klemens MW, editor. Turtle Conservation. Washington, DC: Smithsonian Institution Press; 2000. p. 207-217. [ Links ]
Giraldo A, Garcés-Restrepo MF, Carr JL, Loaiza J. Tamaño y estructura poblacional de la tortuga sabaletera (Rhinoclemmys nasuta, Testudines: Geoemydidae) en un ambiente insular del Pacífico colombiano. Caldasia. 2012;34(1):109-125. [ Links ]
Hammer O, Harper D, Ryan P. PAST: paleontological statistics software for education and data analysis, Versión 2.16. Paleontol Electrón. 2001;4(1):9. [ Links ]
Henry PFP. The eastern box turtle at the Patuxent Wildlife Research Center 1940s to the present: another view. Exp Gerontol. 2003;38(7):773-776. [ Links ]
Heppell S. Application of life-history theory and population model analysis to turtle conservation. Copeia. 1998;1998(2):367-375. [ Links ]
Hernández-Guzmán J, Indy JR, Yasui GS, Arias-Rodriguez L. Los cromosomas de las tortugas tropicales: Kinosternon leucostomum, Trachemys scripta y Staurotypus triporcatus (Testudines: Kinosternidae/Emydidae). Rev Biol Trop. 2014;62(2):671-688. [ Links ]
Joyal LA, McCollough M, Hunter ML. Landscape ecology approaches to wetland species conservation: a case study of two turtle species in southern Maine. Biol Conserv. 2001;15(6):1755-1762. [ Links ]
Lebreton JD, Burnham KP, Clobert J, Anderson DR. Modeling survival and testing biological hypotheses using marked animals: a unified approach with case studies. Ecol Monogr. 1992;62:67-118. [ Links ]
Lescano JN, Bonino MF, Leynaud, GC. Density, population structure and activity pattern of Hydromedusa tectifera (Testudines-Chelidae) in a mountain stream of Córdoba province, Argentina. Amphibia-Reptilia. 2008;29(4):505-512. [ Links ]
Link WA, Nichols JD. On the importance of sampling variance to investigations of temporal variation in animal population size. Oikos. 1994;69(3):539-544. [ Links ]
Litzgus JD. Sex differences in longevity in the spotted turtle (Clemmys guttata). Copeia. 2006;2006(2):281-288. [ Links ]
Litzgus JD, Mousseau TA. Demography of a southern population of the spotted turtle (Clemmys guttata). Southeastern Nat. 2004;3(3):391-400. [ Links ]
Loaiza J. Aspectos ecológicos de la tortuga blanca (Rhinoclemmys nasuta Boulenger, 1902) en Isla Palma, Bahía Málaga-Pacifico colombiano (trabajo de grado). Cali: Departamento de Biología, Facultad de Ciencias, Universidad del Valle; 2006. 57 p. [ Links ]
Martins FI, Souza FL. Demographic parameters of the Neotropical freshwater turtle Hydromedusa maximiliani (Chelidae). Herpetologica. 2009;65(1):82-91. [ Links ]
MAVDT. Resolución Número 1501 "Por medio de la cual se declara, reserva, delimita y alindera el Parque Nacional Natural Uramba Bahía Málaga". Ministerio de Ambiente, Vivienda y Desarrollo Territorial. Bogotá, Colombia. 2010. [ Links ]
Medem F. La distribución geográfica y ecología de los Crocodylia y Testudinata en el Departamento del Chocó. Rev Acad Colomb Cienc. 1962;11:279-303. [ Links ]
Mittermeier RA, Carr JL, Swingland IR, Werner TB, Mast RB. Conservation of amphibians and reptiles. In: Adler K, editor. Herpetology: current research on the biology of amphibians and reptiles. Ithaca, NY, USA: Society for the Study of Amphibians and Reptiles; 1992. p. 59-80. [ Links ]
Neto HJF, Ayub M, De Freitas G, Oliveira T, Berger G, Colli GR. Demography of Acanthochelys spixii (Testudines, Chelidae) in the Brazilian Cerrado. Chelon Conserv Biol. 2011;10(1):82-90. [ Links ]
Nichols JT. Data on size, growth and age in the box turtle, Terrapene carolina. Copeia. 1939;1939(1):14-20. [ Links ]
Páez VP, Morales-Betancourt MA, Lasso CA, Castaño-Mora OV, Bock BC, editors. V Biología y conservación de las tortugas continentales de Colombia. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH). Bogotá, Colombia; 2012. 528 p. [ Links ]
Pérez JV. Tasa de crecimiento y rango habitacional de Rhinoclemmys nasuta en Isla Palma-Pacifico colombiano (trabajo de grado). Cali: Departamento de Biología, Facultad de Ciencias, Universidad del Valle; 2007. 39 p. [ Links ]
Pradel R. Utilization of capture-mark-recapture for the study of recruitment and population growth rate. Biometrics. 1996;52(2):703-709. [ Links ]
Ramo C. Biología del galápago (Podocnemis vogli Muller, 1935) en el hato "El Frío" Llanos de Apure (Venezuela). Doñana, Acta Vertebrata. 1982;9:1-161. [ Links ]
Rangel-Ch JO, Arellano-P H. Clima del Chocó biogeográfico de Colombia. In: Rangel-Ch J, editor. Colombia Diversidad Biótica IV El Chocó Biogeográfico/Costa Pacífica. Bogotá, Colombia: Instituto de Ciencias Naturales; 2004. p. 39-82. [ Links ]
Rhodin AGJ, Walde AD, Horne BD, Van Dijk PP, Blanck T, Hudson R, editors. Turtles in trouble: the world's 25+ most endangered tortoises and freshwater turtles—2011. Lunenburg, MA, USA: Turtle Conservation Coalition IUCN/SSC Tortoise and Freshwater Turtle Specialist Group, Turtle Conservation Fund, Turtle Survival Alliance, Turtle Conservancy, Chelonian Research Foundation, Conservation International, Wildlife Conservation Society, and San Diego Zoo Global; 2011. 54 p. [ Links ]
Rueda-Almonacid JV, Carr JL, Mittermeier RA, Rodríguez-Mahecha JV, Mast RB, Vogt RC, et al. Las tortugas y los cocodrilianos de los países andinos del trópico. Bogotá, Colombia: Conservación Internacional; 2007. 538 p. [ Links ]
Sale PF, Tolimeiri N. Density dependence at some time and place? Oecologia. 2000;124(2):166-171. [ Links ]
Schwanz LE, Spencer RJ, Bowden RM, Janzen FJ. Climate and predation dominate juvenile and adult recruitment in a turtle with temperature-dependent sex determination. Ecology. 2010;91(10):3016-3026. [ Links ]
Schwartz CW, Schwartz ER. The three-toed box turtle in central Missouri: its population, home range, and movements. Pub Miss Dept Conser Terr. 1974;5:1-28. [ Links ]
Stickel LE. Changes in a box turtle population during three decades. Copeia. 1978;1978(2):221-225. [ Links ]
Tucker AD, Gibbons JW, Greene JL. Estimates of adult survival and migration for diamondback terrapins: conservation insight from local extirpation within a metapopulation. Can J Zool. 2001;79(12):2199-2209. [ Links ]
Van Dijk PP, Iverson JB, Shaffer HB, Bour R, Rhodin AGJ. Turtles of the world, 2012 update: annotated checklist of taxonomy, synonymy, distribution, and conservation status. In: Rhodin AGJ, Pritchard PCH, van Dijk PP, Saumure RA, Buhlmann KA, Iverson JB, Mittermeier RA, editors. Conservation biology of freshwater turtles and tortoises: a compilation project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelon Res Monogr. 2012;5:000.243-000.328. [ Links ]
White GC, Burnham. Program MARK: Survival estimation from populations of marked animals. Bird Study. 1999;46(S1):S120-S139. [ Links ]
Williams EC Jr, Parker WS. A long-term study of box turtle (Terrapene carolina) population at Allee Memorial Woods, Indiana, with emphasis on survivorship. Herpetologica. 1987;43(3):328-335. [ Links ]
Zar JH. Biostatistical Analysis. 4 ed. Upper Saddle River, New Jersey: Prentice Hall; 1998. 718 p. [ Links ]