Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.20 no.1 Bogotá Jan./Apr. 2015
https://doi.org/10.15446/abc.v20n1.40976
Artículo de investigación
MODELO EXPERIMENTAL DE HIPOPERFUSIÓN CEREBRAL PRODUCE DÉFICIT DE LA MEMORIA Y APRENDIZAJE Y MODIFICACIONES EN LA EXPRESIÓN DE GENES
Experimental Model of Cerebral Hypoperfusion Produced Memory-learning Deficits, and Modifications in Gene Expression
Rilda LEÓN1, Giselle PENTÓN2, William ALMAGUER1, Javier MARÍN3, Alieski CRUZ2, Lourdes LORIGADOS1, Lisette BLANCO1, Bárbara ESTUPIÑÁN1, Daymara MERCERON4, Laura MACÍAS5, Jorge BERGADO1, Nancy PAVÓN1.
1 Centro Internacional de Restauración Neurológica (CIREN). Ave. 25 e/ 158 y 160, Playa, Código Postal: 11300, La Habana, Cuba.
2 Centro de Ingeniería Genética y Biotecnología (CIGB). La Habana, Cuba.
3 Instituto de Farmacia y Alimentos (IFAL). La Habana, Cuba.
4 Centro de Neurociencias de Cuba. La Habana, Cuba.
5 Hospital Pediátrico Docente "Juan Manuel Márquez", La Habana. Cuba.
For correspondence. nancy.pavon@infomed.sld.cu
Received 25th November 2013, Returned for revision 25th January 2014, accepted 28th April 2014.
Citation / Citar este artículo como: León R, Pentón G, Almaguer W, Marín J, Cruz A, Lorigados L, Blanco L, Estupiñán B, Merceron D, Macías L, Bergado J, Pavón N. Modelo experimental de hipoperfusión cerebral produce déficit de la memoria y aprendizaje y modificaciones en la expresión de genes. Acta biol. Colomb. 2015;20(1):15-25. doi: http://dx.doi.org/10.15446/abc.v20n1.40976.
RESUMEN
A escala mundial, la isquemia cerebral constituye una de las principales causas de muerte, por lo que los modelos animales de isquemia cerebral son extensamente usados tanto en el estudio de la pato-fisiología del fenómeno isquémico; como en la evaluación de agentes terapéuticos con posible efecto protector o regenerador. Los objetivos de este estudio fueron examinar la presencia de daño neuronal en diferentes áreas cerebrales como consecuencia del evento isquémico; así como evaluar consecuencias de este proceder sobre los procesos de memoria-aprendizaje. Los grupos de estudios incluyeron un grupo experimental de animales isquémicos, 30 ratas a las que se les ocluyó ambas arterias carótidas comunes, y un grupo control. Fue evaluada la expresión de genes isquémicos e inflamatorios por técnicas de qPCR 24 horas post lesión, la morfología del tejido cerebral en áreas de corteza, estriado e hipocampo, siete días post lesión y los procesos de memoria y aprendizaje, 12 días post lesión. Los estudios morfológicos evidenciaron que el proceder induce la muerte de poblaciones celulares en corteza, estriado e hipocampo; la isquemia modificó la expresión los genes gfap, ho-1, il-6, il-17 e ifn-γ, lo cual puede ser utilizado como un marcador de proceso isquémico temprano. Adicionalmente, el daño isquémico causó un deterioro en la memoria espacial. Esta caracterización nos permite contar con un modelo experimental donde desarrollar futuros estudios sobre la patofisiología de los eventos isquémicos y la evaluación de estrategias terapéuticas.
Palabras clave: genes, hipoxia-isquemia cerebral, interleucinas, memoria, modelos experimentales.
ABSTRACT
Cerebral ischemia is a major cause of death, for this reason animal models of cerebral ischemia are widely used to study both the pathophysiology of ischemic phenomenon and the evaluation of possible therapeutic agents with protective or regenerative properties. The objectives of this study were to examine the presence of neuronal damage in different brain areas following the ischemic event, and assess consequences of such activities on the processes of memory and learning. The study group included an experimental group ischemic animals (30 rats with permanent bilateral occlusion of the carotids), and a control group. Was evaluated gene expression and inflammatory ischemic by qPCR techniques 24h post injury, brain tissue morphology in areas of cortex, striatum and hippocampus seven days post injury and processes of memory and learning, 12 days post injury. The morphological studies showed that the procedure induces death of cell populations in cortex, striatum and hippocampus, ischemia modified gfap gene expression and ho, il-6, il-17 and ifn-γ, which can be used as a marker of early ischemic process. Additionally, the ischemic injury caused spatial memory decline. This characterization gives us an experimental model to develop future studies on the pathophysiology of ischemic events and assessing therapeutic strategies.
Keywords: brain hypoxia-ischemia, experimental animal models, gene expression, interleukin, memory.
INTRODUCCIÓN
A escala mundial, la isquemia cerebral constituye una de las principales causas de muerte. Sin embargo, no es necesariamente mortal, a excepción de los casos más severos. Con frecuencia los pacientes sobreviven después de un accidente vascular encefálico, pero muchos de ellos con secuelas importantes, lo cual hace que ésta sea la enfermedad neurológica más comúnmente causante de discapacidad y de hospitalización (Howells y Donnan, 2010). El evento isquémico se produce debido a la oclusión de una arteria, lo que provoca una disminución del flujo sanguíneo cerebral en la zona irrigada por la arteria ocluida. Poco después de la isquemia, señales moleculares tales como antígenos derivados del cerebro, citoquinas y quimoquinas son liberadas, activando los astrocitos y la microglía (An et al., 2013). Igualmente, se liberan patrones moleculares asociados a peligro (DAMP, danger-associated molecular patterns), los cuales incrementan la inflamación en la zona dañada, estimulando directamente la producción de mediadores inflamatorios derivados de la glía (Savage et al., 2012).
Los modelos animales de isquemia cerebral son extensamente usados tanto en el estudio de la patofisiología del fenómeno isquémico, como en la evaluación de agentes terapéuticos. Existen dos tipos básicos de modelos animales de isquemia cerebral: los que reproducen la isquemia global y los que simulan la isquemia focal. El modelo de oclusión permanente de las arterias carótidas comunes (OPACC) en ratas, reproduce el evento isquémico en etapas tempranas cuando la hipoperfusión cerebral resulta crónica (Farkas et al., 2007). La OPACC induce alteraciones morfológicas tanto en la sustancia gris como en la sustancia blanca. Se ha constatado una pérdida neuronal asociada a la corteza, el estriado y al hipocampo dos semanas posteriores a la oclusión. La disminución en las concentraciones de oxígeno tisular que acompañan a la isquemia cerebral estimula la expresión de genes involucrados en mecanismos excitotóxicos, inflamatorios, apoptóticos y neuroprotectores, por lo que puede resultar tanto en muerte como en recuperación celular. Aumentos en la expresión de genes pueden ser detectados a pocos minutos del comienzo del evento isquémico (Nagel et al., 2012). La variación en la expresión de los genes juega un papel principal en los procesos de recuperación después del evento isquémico. La isquemia induce la expresión de genes involucrados en la muerte celular apoptótica, lo cual puede aumentar el daño al tejido cerebral (Davila et al., 2012). La variación en el nivel de expresión de estos genes durante la fase temprana del evento isquémico, o isquemia aguda, puede ser utilizada como marcador de hipoperfusión cerebral y neuroinflamación. Por otro lado, la formación hipocampal, que incluye a las áreas CA3 y CA1, participa en la formación de la memoria. Esta área cerebral se ha visto particularmente afectada en el modelo de OPACC en ratas. Se ha sugerido que la hipoperfusión cerebral crónica ocasiona daños cognitivos y que la severidad de la alteración conductual está relacionada con la magnitud de la reducción del flujo sanguíneo.
El propósito de este estudio estuvo dirigido a examinar la presencia de daño neuronal en diferentes áreas cerebrales como consecuencia del evento isquémico inducido por la oclusión de las arterias carótidas comunes; así como evaluar consecuencias de este proceder sobre los procesos de memoria-aprendizaje. Está caracterización permitirá contar con un modelo experimental donde desarrollar futuros estudios sobre la patofisiología de los eventos isquémicos y la evaluación de estrategias terapéuticas.
MATERIALES Y MÉTODOS
Animales de experimentación
Se utilizaron ratas machos adultas Wistar, con pesos entre 280 g y 300 g al inicio del experimento, provenientes del Centro Nacional de Producción de Animales de Laboratorio (CENPALAB), Ciudad de La Habana, Cuba. Los animales fueron mantenidos en cajas plásticas traslúcidas a una temperatura media de 23 #ºC (22 ± 2 #ºC), con suministro de alimentos y agua ad libitum y períodos de luz y oscuridad de 12 horas. Las ratas fueron mantenidas en grupos de cinco por caja. En este estudio se respetaron todas las normas establecidas en el código para la ética de la experimentación animal, siguiendo las recomendaciones del "Guide to the care and use of experimental animals. National Institute of Health-NIH Publication. No. 85-23" (Canadian Council, 1993). Se contó con la autorización del Comité de Ética Médica del Centro Internacional de Restauración Neurológica.
Criterios de exclusión
Fueron excluidos del experimento aquellos animales, pertenecientes a cualquiera de los grupos experimentales, que mostraron en cualquier momento: infecciones severas, lesiones en los ojos que les dificulten la visión o atrofia marcada de alguna extremidad aislada.
Inducción de la hipoperfusión cerebral
Las ratas fueron anestesiadas con una mezcla que contenía: Ketamina, Diazepán y Atropina (100 mg/kg de peso corporal, intraperitoneal) por vía intraperitoneal. Se practicó una incisión en el cuello y se separaron las arterias carótidas comunes de los tejidos adyacentes y del nervio vago. A continuación se ligaron con hilo de sutura de seda de 3,0 de forma permanente. Los animales controles falsos lesionados (n=19) se sometieron al mismo procedimiento quirúrgico, excepto que no se les realizó la oclusión permanente de las arterias carótidas (OPACC).
Estudio de expresión de genes
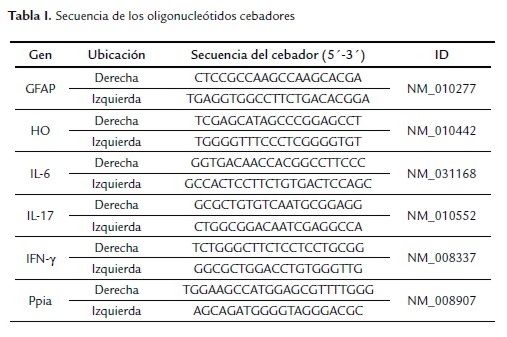
Para estudios de expresión de genes los animales fueron eutanizados 24 horas posteriores a la oclusión de las carótidas. Las áreas cerebrales, fueron disecadas (OPACC n=3, SHAM n=3) y almacenadas a -20 °C hasta su posterior homogenización. La extracción de ARN total a partir del homogenizado de tejido se llevó a cabo con TRIZOL (Invitrogen, San Diego, CA, USA). Se sintetizó el ADN complementario a partir de 1 µg de ARN total (High Capacity cDNA Archive Kit), siguiendo las instrucciones del fabricante. En el qPCR se realizaron tres réplicas por gen. Todos los pasos técnicos fueron ejecutados acorde a las guías de Información Mínima para Publicaciones de Experimentos de qPCR (Bustin et al., 2009). Los oligonucleótidos específicos de cada gen fueron diseñados por un tamizaje en silico, utilizando el algoritmo de alineamiento BLAST (Tabla 1), y fueron usados a una concentración de 300 mM (Metabion, Martinsried, Germany). Fast SYBR Green PCR Master Mix fue usado como sistema de detección en el Light Cycler 480 Fast Real-Time PCR (Roche Applied Science, Mannheim, Germany) (Lech et al., 2010). El control de la reacción consistió en agua bidestilada, la cual resultó negativa para los genes de interés y para el gen de expresión constitutiva. Los datos fueron calculados como unidades de expresión normalizada de la media (MNE) con el software Q-Gene (Muller et al., 2002; Simon, 2003). El gen de referencia usado para la cuantificación relativa fue el peptidil-prolil cis-trans isomerasa A (PPIA, también conocida como ciclofilina A) (Lofqvist et al., 2009). Los resultados se muestran como porciento del grupo control.
Evaluación del daño celular
Animales con lesión inducida por OPACC (n=10) y falsos lesionados (n=4) fueron sacrificados siete días después de inducida la hipoperfusión cerebral. Las ratas fueron anestesiadas con una mezcla que contenía Ketamina, Diazepán y Atropina (100 mg/kg de peso corporal, ip). Los cerebros fueron perfundidos con 250 mL de una solución de cloruro de sodio al 0,9 % y 250 mL de formol al 10 % (en agua destilada). Los cerebros fueron seccionados y colocados en un procesador automático de tejidos (HISTOQUINET). El tejido se deshidrató en soluciones de alcoholes de gradación ascendente, la desalcoholización se realizó con xilol y luego el tejido fue infiltrado en parafina. Se obtuvieron secciones coronales de 6 micras que se tiñeron con hematoxilina-eosina.
Evaluación en el laberinto acuático de Morris
Fue evaluado el desempeño de los animales pertenecientes a ambos grupos experimentales: Grupo con lesión OPACC (n=15) y control falso lesionado (n=10); en el Laberinto Acuático de Morris (LAM), 12 días posteriores a la lesión. Para el análisis fueron tenidas en cuenta el tiempo que demoran los animales en localizar una plataforma transparente de 11 cm de diámetro dentro del tanque (latencia de escape); la distancia recorrida y el tiempo de permanencia en los bordes del tanque (tigmotaxia). La plataforma fue ubicada 1 cm por encima de la superficie del agua (plataforma visible) o sumergida 1 cm por debajo (plataforma oculta), en una piscina circular de 1,5 m de diámetro y una altura de líquido de 40 cm. El tiempo máximo de búsqueda que se permitió fue de 60 s. Una vez que el animal encontró la plataforma se le permitió permanecer en ella durante 30 s antes del siguiente intento. Los datos fueron adquiridos y procesados con el programa SMART versión 2.0 (Copyright Panlab, 2001).
Los primeros tres días los sujetos experimentales fueron sometidos a ocho ensayos con la plataforma sumergida (no visible) ubicada en la región suroeste del tanque. El cuarto día se realizaron cuatro ensayos bajo idénticas condiciones que los días anteriores y un quinto en el que se retiró la plataforma y se contó el número de veces, que el animal pasaba por la zona donde se encontraba la plataforma (cruces). El quinto y último día de evaluación se realizaron ocho intentos, al igual que en los tres primeros días, pero con la plataforma visible.
Análisis estadístico
Toda la información fue recogida y procesada mediante el software profesional Statistica para Windows. Versión 6,0 Copyright Statsoft, Inc. 1996. Se verificó la distribución normal mediante las pruebas de Kolmogorov-Smirnov y la homogeneidad de varianza por la prueba de Levene, en los casos en que esta se cumplía se utilizó la prueba t de Student para las comparaciones entre grupos. Los datos obtenidos de la evaluación conductual fueron comparados mediante un análisis de varianza de clasificación doble con mediciones repetidas (ANOVA). En estos casos, los factores tenidos en cuenta fueron: grupo y bloques. En todos los casos se consideraron significativas diferencias en las que el valor de p fue menor o igual a 0,05. Los resultados se presentaron en forma de gráficas confeccionadas mediante el programa Prism versión 3.0 de Graph Pad Software Inc.
RESULTADOS
De un total de 30 animales trabajados sobrevivieron 26, lo que representa un 86,66 % de supervivencia.
Evaluación del daño celular
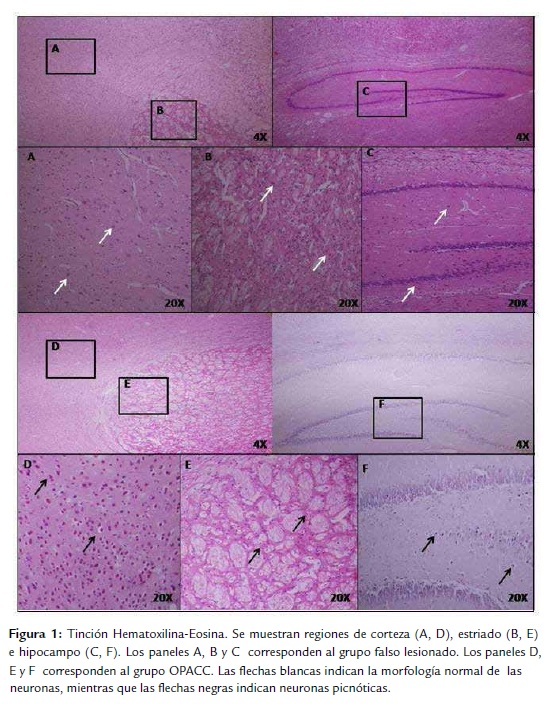
En todas las regiones cerebrales analizadas (corteza, cuerpo estriado e hipocampo) de los animales con OPACC, se pudo observar (Fig. 1) la presencia de núcleos picnóticos, fundamentalmente en cuerpo estriado y corteza.
Expresión de genes
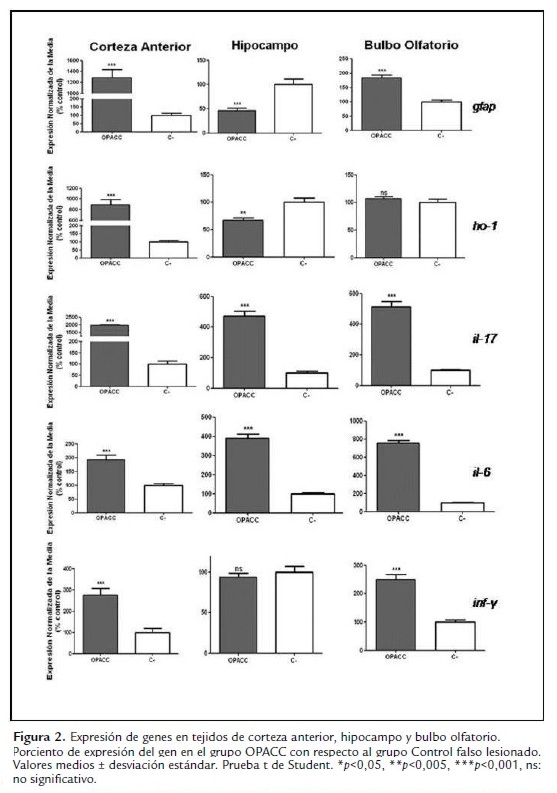
La expresión de cinco genes diferentes fue evaluada pasadas 24 horas de la oclusión permanente de las arterias carótidas. Las figura 2 muestra como se comporta la expresión de estos genes en diferentes áreas del cerebro: corteza anterior, hipocampo, y bulbo olfatorio. Los valores son relativos al gen de expresión interna peptidilprolil isomerasa A (ppia).
Se encontró un incremento significativo en los niveles de expresión de gfap en corteza anterior (t=10,17 df=8) y bulbo olfatorio (t=7,211 df=12); mientras que en el hipocampo estos valores se encontraron significativamente disminuidos (t=4,467 df=11).
La determinación de la expresión del gen ho-1 fue utilizada en nuestro trabajo como un marcador de la presencia de un proceso isquémico agudo. El gen ho-1 (Fig. 3) no mostró diferencias significativas, entre el grupo falso lesionado y el grupo con OPACC, en el bulbo olfatorio (t=0,9288 df=12). Sin embargo, en el área de corteza se observó un incremento significativo en su expresión (t=9,267 df=10) y el hipocampo una disminución de esta (t=4,038 df=12).
El gen correspondiente a IL-17 (Fig. 2) mostró aumentos significativos en su expresión en todas las áreas estudiadas de los animales sometidos a daño isquémico (corteza: t=61,98 df=10; hipocampo: t=9,488 df=9; bulbo olfatorio: t=11,14 df=10). Igual comportamiento fue observado para el gen correspondiente a IL-6 (corteza: t=4,866 df=10; hipocampo: t=12,15 df=10; bulbo olfatorio: t=19,07 df=10)
El último gen en analizar fue el ifn-g (Fig. 2), el cual mostró un incremento significativo en las áreas de corteza (t=4,818 df=10) y bulbo olfatorio (t=7,581 df=10); sin diferencias entre los dos grupos en el área de hipocampo (t=0,6736 df=10).
Estudio conductual
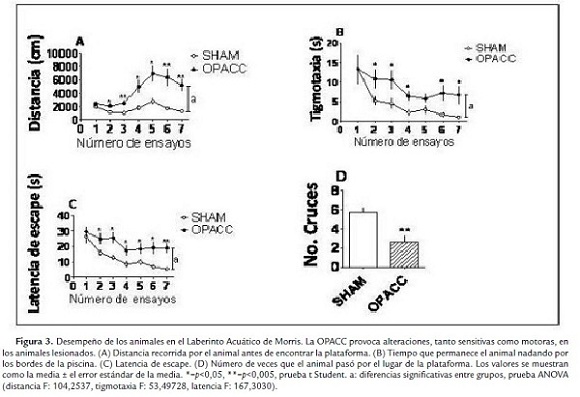
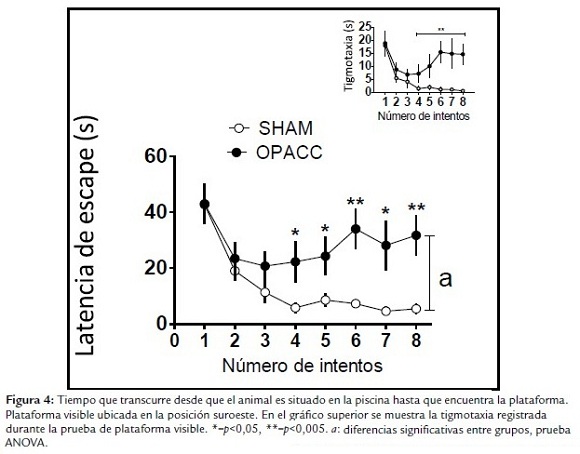
Doce días posteriores a la lesión, la capacidad de memoria y aprendizaje de los animales fue evaluada. Los primeros cuatro días del esquema conductual (plataforma oculta) evaluaron la memoria a largo plazo (Fig. 3), mientras que en el quinto día (plataforma visible) fue evaluado el déficit sensorio-motor y motivacional provocado por la lesión (Fig. 4).
La figura 3a muestra la distancia recorrida por los animales antes de encontrar la plataforma. Es notable como existe una diferencia significativa entre el grupo lesionado con OPACC y el grupo falso lesionado. Es decir, a medida que los animales repiten los intentos, los que pertenecen al grupo falso lesionado establecen estrategias de búsqueda de la plataforma más cortas, con lo que disminuyen la distancia recorrida con respecto a aquellos animales que pertenecen al grupo con OPACC.
En la figura 3b se muestra como se comporta la tigmotaxia en los dos grupos. Se puede observar que los animales con OPACC demoran significativamente más tiempo nadando por el borde de la piscina que los animales controles falso lesionado. En la figura 3c se muestra que los animales con OPACC se demoran significativamente más tiempo en encontrar la plataforma una vez que han sido puestos en la piscina.
Por último, se observa una disminución significativa en el número de cruces por la zona de la plataforma de los animales lesionados con respecto a los controles falsos lesionados.
La figura 4 muestra como, a partir del cuarto intento, la diferencia entre los animales falsos lesionados y los animales con OPACC empieza a ser significativa. De manera que, aún con plataforma visible, los animales con OPACC demoran más tiempo en encontrarla que los animales falsos lesionados. Siendo la diferencia doblemente significativa en el sexto y octavo ensayo.
DISCUSIÓN
En sentido general los animales sometidos a hipoperfusión cerebral mostraron signos de daño tisular en áreas de corteza cerebral anterior, hipocampo y estriado. La isquemia mantenida modificó la expresión de los genes gfap, ho-1, il-6, il-17 e ifn-γ, lo cual puede ser utilizado como un marcador de proceso isquémico temprano. Adicionalmente, el daño isquémico causó un deterioro en la memoria espacial de los animales estudiados.
Evaluación del daño celular
Los signos más evidentes de neurodegeneración son la pérdida de neuronas y de contactos sinápticos. La muerte neuronal que induce la hipoperfusión cerebral puede ser visualizada con tinciones tradicionales como hematoxilinaeosina, cresil de violeta o tuolidina azul (Farkas et al., 2007).
Los resultados muestran que, pasada una semana de la oclusión de las arterias carótidas comunes, hay daños notables en las tres áreas cerebrales estudiadas. Esto puede ser la expresión morfológica de que está ocurriendo un proceso necrótico en el tejido, debido a la falta de ATP. Estos resultados concuerdan con varios trabajos publicados (Liu et al., 2007; Kim et al., 2008; Vicente et al., 2009), que muestran que una hora después de la oclusión de ambas carótidas hay una evidente degeneración neuronal en las áreas de hipocampo y corteza; y pasadas seis horas, se puede observar como en corteza, estriado e hipocampo se desarrolla una necrosis vacuolar (Fu et al., 2006). El hipocampo es, por muchas razones, la región cerebral más utilizada para el estudio de la neurodegeneración inducida por la hipoperfusión cerebral, está altamente involucrado en el aprendizaje espacial y en la memoria (Bergado et al., 2011). Por esta razón, el daño neuronal en esta región y la dificultad en el aprendizaje espacial observada en esta lesión, podrían estar relacionado. Finalmente, el hipocampo, particularmente la región CA1, es una de las áreas cerebrales más sensibles a la isquemia (Farkas et al., 2007).
La isquemia cerebral modifica la expresión de genes
En el Sistema Nervioso Central (SNC), la reducción del flujo sanguíneo conlleva a que se produzcan cambios bioquímicos inmediatos. Los genes que aumentan, o disminuyen, su expresión durante la hipoperfusión cerebral, no solo están relacionados con la isquemia per se, sino también con la inflamación que desencadena la muerte necrótica, característica de la fase aguda de la isquemia cerebral. La GFAP es un importante biomarcador para la isquemia y las lesiones traumáticas cerebrales. Es producida casi exclusivamente por los astrocitos, de manera que es utilizado como marcador específico del cerebro (Schiff et al., 2012). El análisis de la variación en la expresión de gfap en la isquemia aguda (Fig. 2) mostró que, pasadas 24 horas de la lesión, los niveles de gfap en los animales con OPACC aumentaron significativamente en corteza y bulbo olfatorio y disminuyeron en el hipocampo.
Las hemo-oxigenasas (HO) son las enzimas responsables de degradar el grupo hemo, dando como productos los pigmentos biliares y el monóxido de carbono. El monóxido de carbono, entre otras funciones, tiene la capacidad de relajar el músculo liso y bloquear la agregación plaquetaria (Fu et al., 2006). Por estas razones, se ha sugerido que las HO, específicamente HO-1, juegan un papel importante en la protección contra la isquemia cerebral (Bidmon et al., 2001; Choi et al., 2002). Un estudio publicado por Fu et al., (2006) muestra que, en las primeras etapas de isquemia cerebral, se puede detectar expresión del ARN mensajero de ho-1 en corteza e hipocampo. Según este estudio, el transcripto puede ser detectado una hora después de la oclusión, aumenta su expresión rápidamente con un pico a las 12 horas y después disminuye gradualmente hasta el día siete después de la lesión. Al analizar la variación en la expresión del gen ho-1 (Fig. 2), los resultados de este trabajo muestran que, pasadas 24 horas del evento isquémico solo en la corteza se observa un aumento estadísticamente significativo en el grupo con OPACC. El hecho de que se sugiera que un aumento en la expresión de ho-1 puede proteger las neuronas del daño isquémico (Nimura et al., 1996), nos apunta a que las regiones de hipocampo y bulbo olfatorio son las más dañadas por la lesión.
La isquemia cerebral está asociada con un mecanismo inmune que intensifica la reacción inflamatoria y participa en la progresión del daño cerebral. Las células inflamatorias y las citoquinas desempeñan un papel clave en los procesos de daño neuronal (Li et al., 2005). Crecientes evidencias indican que las citoquinas están involucradas en el inicio y desarrollo de la isquemia cerebral (Li et al., 2001; Offner et al., 2009; Wang et al., 2009). La interleuquina-6 es una citoquina con varios efectos perjudiciales que pueden contribuir a una lesión inflamatoria temprana en el cerebro (Jordán et al., 2008). En este trabajo se muestra que en las áreas estudiadas hay un aumento significativo de la expresión de il-6 (Fig. 2) en los animales lesionados con respecto a los animales falsos lesionados. En un estudio realizado por Wang et al., (1995) demuestran que en corteza cerebral de ratas isquémicas hay un aumento significativo de la expresión del ARN mensajero de IL-6 a partir de las tres horas post isquemia, lo cual se mantiene 24 horas después de la lesión (Wang et al., 1995). Hasta donde se conoce, no hay trabajos publicados que estudien los niveles de expresión de il-6 en bulbo olfatorio. En el caso de hipocampo es diferente, ya que esta área es una de las más afectadas, y por tanto, más estudiada en el modelo de hipoperfusión cerebral (Farkas et al., 2007; Vicente et al., 2009; Yasuda et al., 2011). Un estudio publicado por Yasuda et al., (2011) muestra que, a las 24 horas de la hipoperfusión cerebral, los niveles de ARN mensajero de IL-6 en el hipocampo eran significativamente mayor en el grupo lesionado que en el grupo con falsa lesión. Diferentes estudios sugieren que IL-6 tiene efectos perjudiciales en la isquemia cerebral (Jordán et al., 2008).
La interleuquina-17 es conocida como una citoquina pro-inflamatoria, debido a que estimula la liberación de muchos mediadores de la inflamación como la IL-6 e IL-8 (Wang et al., 2009). Sin embargo, poco se conoce acerca de los cambios en la expresión de il-17 en el curso de la isquemia cerebral, especialmente en humanos (Li et al., 2005). Algunos estudios indican que IL-17 aumenta en los hemisferios isquémicos, después de la oclusión permanente de la arteria cerebral media en ratas (Li et al., 2001; Guozhong et al., 2002; Li et al., 2005). Eso sugiere que la IL17 puede jugar un papel importante en el daño cerebral isquémico. Los resultados muestran que, la expresión de il-17 (Fig. 2) se incrementó en los animales con OPACC. La mayor parte de los trabajos que estudian la expresión de la IL-17 en el tejido cerebral isquémico plantean que, los niveles de ARN mensajero de IL-17 pueden ser detectados desde una hora hasta seis días post-lesión (Li et al., 2001; Li et al., 2005; Wang et al., 2009). Según lo propuesto en la literatura, IL-17 juega un papel importante en la etapa tardía del daño cerebral, y se ha sugerido que tiene un patrón de expresión tardío en la isquemia cerebral (Li et al., 2001). Hasta donde conocemos, no hay ningún reporte del estudio de la expresión de il-17 en diferentes áreas del cerebro.
La presencia del interferón gamma en el parénquima cerebral normal, está asociado a la inducción y el empeoramiento de la patología (Lambertsen et al., 2004). Los resultados de este trabajo muestran que, solamente en la corteza cerebral y el bulbo olfatorio, hubo variación significativa en la expresión genética del IFN-g (Fig. 2). Lambertsen et al., (2004) plantean que los efectos proinflamatorios del IFN-g pueden estar debido al efecto secundario de esta citoquina sobre las células micro- y astrogliales y la infiltración leucocitaria, más que a efectos directos del IFN-g actuando sobre las neuronas dañadas.
Proceso de aprendizaje y memoria
La evaluación de la eficacia terapéutica sobre el déficit cognitivo en modelos experimentales resulta crítica para las investigaciones clínicas. El aprendizaje y la memoria espacial se relacionan con la capacidad de adquirir y retener asociaciones características del ambiente, lo que permite al organismo desenvolverse en el espacio (Vicens et al., 2003). En la memoria espacial intervienen múltiples mecanismos especializados en codificar, almacenar y recuperar información acerca de rutas, configuraciones y localizaciones espaciales (Kessels et al., 2001).
Los animales pueden usar, básicamente, tres tipos diferentes de estrategias para escapar a la plataforma durante los ensayos de nado (Brandeis et al., 1989). Pueden utilizar una secuencia de movimientos aprendidos para alcanzar la plataforma (estrategia de praxia); pueden acercarse a la plataforma siguiendo señales proximales (estrategia de taxia); o pueden desplazarse hacia la plataforma siguiendo información sobre la ubicación de esta dentro de la configuración espacial de señales distales (mapeo o estrategia espacial). Adicionalmente un sujeto experimental puede utilizar más de una estrategia de búsqueda para localizar la plataforma.
Todos los animales en los primeros segundos de la prueba nadan pegados a las paredes lo cual es una conducta instintiva que se conoce como tigmotaxia, pero que los animales sanos jóvenes abandonan rápidamente para establecer una estrategia de búsqueda más eficiente, esto es considerado por varios autores como un aprendizaje instrumental (Morris et al, 1986). El presente estudio demuestra que el daño cerebral producido por la oclusión de ambas carótidas causa una afectación importante de la memoria espacial, lo cual puede ser estudiado de manera sensible a través de la prueba en el Laberinto Acuático de Morris. Estos resultados pueden deberse, al menos en parte, a la incapacidad de las ratas lesionadas para iniciar nuevas estrategias de búsqueda, lo cual ha sido reportado después de lesiones corticales (Shear et al., 2010). Un apoyo a esta hipótesis, pudiera ser el patrón de natación tigmotáxico observado en el grupo de ratas lesionadas durante los ensayos en el Laberinto Acuático de Morris. Su desempeño durante el aprendizaje espacial sugiere incapacidad por parte de estos animales para elaborar una estrategia que facilite la búsqueda de la plataforma. Estos resultados coinciden con lo reportado por otros autores (Jia et al., 2012). Se ha reportado déficit específicos en animales con lesión en hipocampo, estriado, ganglios basales, cerebelo y varias regiones de neocorteza (D'Hooge y De-Deyn, 2001). Está bien establecido que la integridad de la formación hipocampal es esencial para el aprendizaje espacial (Almaguer-Melian et al., 2006). El hipocampo y la corteza prefrontal están estrechamente relacionadas con las funciones cognitivas, especialmente el aprendizaje y la memoria. Por otro lado, varios autores han reportado semejanza entre los déficits cognitivos y motores presentes en ratas con lesión estriatal y los que acompañan a pacientes portadores de enfermedad de Huntington (Haelewyn et al., 2007; Scearce-Levie, 2011). Las ratas con lesión en el estriado se mueven significativamente más por las paredes del tanque (tigmotaxia) y mucho más lento que las controles con falsa lesión. Está reportado que en general, las ratas con lesiones en la región medial del cuerpo estriado muestran un comportamiento perseverante (Winter et al., 2004; Bouët et al., 2007). Se conoce que dos días después de la oclusión de las arterias carótidas el flujo sanguíneo disminuye en un 42,4% en la corteza prefrontal y un 78,4 % en la región de CA1 del hipocampo (Otori et al., 2003).
Usualmente la evaluación de los animales con plataforma visible es utilizado para evaluar déficits sensorio-motores y motivacionales (Almaguer-Melian et al., 2006), lo cual significa que latencias de escape elevadas pueden ser atribuidas a un daño sensorio-motor (visual) o indiferencia sensorial. Sin embargo, en este caso nosotros somos del criterio que el comportamiento de nuestro grupo lesionado está más relacionado con la perseverancia de automatismos en su desempeño, donde se acentúa un patrón de conducta tigmotáxico, del cual los animales no pueden escapar; que con un déficit sensorial visual, si bien este último no es totalmente descartado. Está hipótesis se ve reforzada porque a pesar de que la plataforma estaba visible, el patrón de nado predominantemente por las paredes fue significativamente mayor en este grupo que en los controles falsos lesionados.
CONCLUSIONES
En el presente trabajo fue posible demostrar la presencia de daño irreversible (núcleos picnóticos) en corteza, cuerpo estriado e hipocampo. Estos hallazgos, conjuntamente con la disminución en la densidad neuronal observada en estas áreas, en nuestro criterio, están estrechamente relacionados con el déficit funcional observado.
En este estudio se confirma que la oclusión de ambas arterias carótidas comunes produce una reducción del flujo sanguíneo cerebral capaz de inducir una isquemia cerebral, la cual produce la muerte de poblaciones celulares en diferentes regiones cerebrales, especialmente en la región de corteza, hipocampo y cuerpo estriado. La isquemia cerebral producida, además, modifica la expresión de lo genes gfap y ho, lo cual puede ser utilizado como un marcador de proceso isquémico temprano. Por otro lado, aumenta la expresión del ARN mensajero de los genes il-6, il-17 e ifn-g, lo que sugiere la presencia de un proceso inflamatorio que puede contribuir con el daño isquémico. Finalmente, el daño isquémico presente en áreas de estriado e hipocampo, inducido por la lesión, causa un deterioro en la memoria espacial.
REFERENCIAS
Almaguer-Melian W, Rosillo JC, Frey JU, Bergado JA. Subcortical deafferentation impairs behavioral reinforcement of long-term potentiation in the dentate gyrus of freely moving rats. Neuroscience. 2006;138(4):1083-1088. Doi: 10.1016/j.neuroscience.2005.12.003. [ Links ]
An C, Shi Y, Li P, Hu X, Gan Y, Stetler RA, Leak RK, Gao Y, Sun BL, Zheng P, Chen J. Molecular dialogs between the ischemic brain and the peripheral immune system: Dualistic roles in injury and repair. Progress in Neurobiology. 2013 [Epub ahead of print]. doi:10.1016/j.pneurobio.2013.12.002. [ Links ]
Bergado JA, Almaguer W, Rojas Y, Capdevila V, Frey JU. Spatial and emotional memory in aged rats: a behavioral-statistical analysis. Neuroscience. 2011;172:256-269. Doi: 10.1016/j.neuroscience.2010.10.064. [ Links ]
Bidmon HJ, Emde B, Oermann E, Kubitz R, Witte OW, Zilles K. Heme oxygenase-1 (HSP-32) and heme oxygenase-2 induction in neurons and glial cells of cerebral regions and its relation to iron accumulation after focal cortical photothrombosis. Exp Neurol. 2001;168(1):1-22. Doi: 10.1006/exnr.2000.7456. [ Links ]
Bouët V, Freret T, Toutain J, DIvoux D, Boulouard M, Schumann-Bard P. Sensorimotor and cognitive deficits after transient middle cerebral artery occlusion in the mouse. Exp Neurol. 2007;203(2):555-567. Doi: 10.1016/j.expneurol.2006.09.006. [ Links ]
Brandeis R, Brandys Y, Yehuda S. The use of the Morris Water Maze in the study of memory and learning. Int J Neurosci. 1989;48:29–69. Doi: 10.3109/00207458909002151. [ Links ]
Bustin SA, Benes V, Garson JA, Hellemans J, Huggett J, Kubista M, et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clin Chem. 2009;55:611-622. Doi: 10.3109/00207458909002151. [ Links ]
Canadian Council on animal care. Guide to the care and use of experimental animals. Ontario, Canadá; 1993. pp. 82-94 [ Links ]
Choi BM, Kim HJ, Oh GS, Pae HO, OH H, Jeong S, et al. 1,2,3,4,6-penta-O-galloyl-beta-D-glucose protects rat neuronal cells (Neuro 2A) from hydrogen peroxide-mediated cell death via the induction of heme oxygenase-1. Neurosci Lett. 2002;328(2):82-94. Doi: 10.1016/S0304-3940(02)00513-X. [ Links ]
D'hooge R, De-deyn PP. Applications of the Morris water maze in the study of learning and memory. Brain Res Rev. 2001;36:60–90. Doi: 10.1016/S0165-0173(01)00067-4. [ Links ]
Davila D, Connolly NM, Bonner H, Weisová P, Dussmann H, Concannon CG, et al. Two-step activation of FOXO3 by AMPK generates a coherent feed-forward loop determining excitotoxic cell fate. Cell Death Differ. 2012;19(10):1677-1688. Doi: 10.1038/cdd.2012.49. [ Links ]
Farkas E, Luiten P, Bari F. Permanent, bilateral common carotid artery occlusion in the rat: A model for chronic cerebral hypoperfusion-related neurodegenerative disease. Brain Res Rev. 2007;54:162-180. Doi: 10.1016/j.brainresrev.2007.01.003. [ Links ]
Fu R, Zhao ZQ, Zhao HY, Zhao JS, Zhu XL. Expression of heme oxigenase-1 protein and messenger RNA in permanent cerebral ischemia in rats. Neurol Res. 2006;28:38-45. Doi: http://dx.doi.org/10.1179/016164106X91852. [ Links ]
Guo-Zhong L, Hu-Iun L, Di Z. IL-17 expression after cerebral ischemia of the rat. J Apoplexy Nervous Dis. 2002;19:270-272. [ Links ]
Haelewyn B, Freret T, Pacar Y E, Schumann-Bard P, Boulouard M, Bernaudin M, et al. Long-term evaluation of sensorimotor and mnesic behaviour following striatal NMDA-induced unilateral excitotoxic lesion in the mouse. Behav Brain Res. 2007;178(2):235-243. Doi: 10.1016/j.bbr.2006.12.023. [ Links ]
Howells DW, Donnan GA. Where Will the Next Generation of Stroke Treatments Come From?. Plos Medicine. 2010;7(3). Doi: 10.1371/journal.pmed.1000224. [ Links ]
Jia H, Zhang XM, Zhang BA, Liu Y, Min-L J. Dendritic morphology of neurons in medial prefrontal cortex and hippocampus in 2VO rats. Neurol Sci. 2012;33(5):1063-1070. Doi: 10.1007/s10072-011-0898-4. [ Links ]
Jordán J, Segura T, Brea D, Galindo MF, Castillo J. Inflammation as Therapeutic Objective in Stroke. Current Pharmaceutical Desing. 2008;14:3549-3564. Doi: 10.2174/138161208786848766. [ Links ]
Kessels RPC, De Haan EHF, Kappele LJ, Postma A. Varieties of human spatial memory: a meta-analysis on the effects of hipocampal lesions. Brain Res Rev. 2001;35:295-303. Doi: 10.2174/138161208786848766. [ Links ]
Kim JS, Yum J, Bin Y, Lee KS, Kim YI. Ramipril protects from free radical induced white matter damage in chronic hypoperfusion in the rat. J Clin. Neurosci. 2008;15:174-178. Doi: 10.1016/j.jocn.2006.12.003. [ Links ]
Lambertsen KL, Gregersen R, Meldgaard M, Clausen BH, Heibøl EK, Ladeby R, et al. A Role for Interferon-Gamma in Focal Cerebral Ischemia in Mice. J Neuropathol Exp Neurol. 2004;63(9):942-955. [ Links ]
Lech M, Avila-Ferrufino A, Skuginna V, Susanti HE, Anders HJ. Quantitative expression of RIG-like helicase, NOD-like receptor and inflammasome-related mRNAs in humans and mice. Int Immunol. 2010;22:717-728. Doi: 10.1093/intimm/dxq058. [ Links ]
Li GZ, Zhong D, Yang LM, Sun B, Zhong ZH, Yin YH, et al. Expression of IL-17 in Ischemic Brain Tissue. Scand J Immunol. 2005;62:481-486. Doi: 10.1111/j.1365-3083.2005.01683.x. [ Links ]
Li H, Kostulas N, Huang Y, Xiao B, Van der Meide P, Kostulas V, et al. IL-17 and IFN-g mRNA expression is increased in the brain and systemically after permanent middle cerebral artery occlusion in the rat. J Neuroimmunol. 2001;116:5-14. Doi: 10.1016/S0165-5728(01)00264-8. [ Links ]
Lofqvist C, Willett KL, Aspegren O, Smith AC, Aderman CM, Connor KM, et al. Quantification and localization of the IGF/insulin system expression in retinal blood vessels and neurons during oxygen-induced retinopathy in mice. Invest Ophthalmol Vis Sci. 2009;50:1831-1837. Doi: 10.1016/S0165-5728(01)00264-8. [ Links ]
Morris RGM, Anderson E, Lynch GS, Baudry M. Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D-aspartate receptor antagonist, AP5. Nature. 1986;319:774-776. Doi:10.1038/319774a0. [ Links ]
Muller P, Janovjak H, Miserez A, Dobbie Z. Processing of Gene Expression Data Generated by Quantitative Real-Time RT-PCR. BioTechniques. 2002;32(6):1372-4, 1376, 1378-9. [ Links ]
Nagel S, Papadakis M, Pfleger K, Grond-Ginsbach C, Buchan AM, Wagner S. Microarray analysis of the global gene expression profile following hypothermia and transient focal cerebral ischemia. Neuroscience. 2012;208:109-122. Doi: 10.1016/j.neuroscience.2012.01.048. [ Links ]
Nimura T, Weinstein PR, Massa SM, Panter S, Sharp FR. Heme oxygenase-1 (HO-1) protein induction in rat brain following focal ischemia. Brain Res Mol Brain Res. 1996;37(1-2):201-208. Doi: 10.1016/0169-328X(95)00315-J. [ Links ]
Offner H, Vandenbark AA, Hurn PD. Effect of experimental stroke on peripheral immunity: CNS ischemia induces profound immunosupression. Neuroscience. 2009;158(3):1098-1111. Doi: 10.1016/0169-328X(95)00315-J. [ Links ]
Otori T, Katsumata T, Muramatsu H, Kashiwagi F, Katayama Y, Terashi A. Long-term measurement of cerebral blood flow and metabolism in a rat chronic hypoperfusion model. Clin Exp Pharmacol Physiol. 2003;30(4):266-272. Doi: 10.1046/j.1440-1681.2003.03825.x. [ Links ]
Savage CD, Lopez-Castejon G, Denes A, Brough D. NLRP3-Inflammasome Activating DAMPs Stimulate an Inflammatory Response in Glia in the Absence of Priming Which Contributes to Brain Inflammation after Injury. Front Immunol. 2012;18(3):288. Doi: 10.3389/fimmu.2012.00288. [ Links ]
Scearce-Levie K. Monitoring spatial learning and memory in Alzheimer's disease mouse models using the Morris Water Maze. Methods Mol Biol. 2011;670:191-205. Doi: 10.1007/978-1-60761-744-0_14. [ Links ]
Schiff L, Hadker N, Weiser S, Rausch C. A Literature Review of the Feasibility of Glial Fibrillary Acidic Protein as a Biomarker for Stroke and Traumatic Brain Injury. Mol Diagn Ther. 2012;16(2):79-92. [ Links ]
Shear DA, May-Lu XC, Bombard MC, Pedersen R, Chen Z, Davis A, et al. Tortella. Longitudinal Characterization of Motor and Cognitive Deficits in a Model of Penetrating Ballistic-Like Brain Injury. J Neurotrauma. 2010;27:1911-1923. Doi: 10.1089/neu.2010.1399. [ Links ]
Simon P. Q-Gene: processing quantitative real-time RT–PCR data. Bioinformatics. 2003;19(11):1439-1440. Doi: 10.1093/bioinformatics/btg157. [ Links ]
Vicens P, Redolat R, Carrasco MC. Aprendizaje espacial y laberinto de agua: metodología y aplicaciones. Psicothema. 2003;15(4):539-544. [ Links ]
Vicente E, Degerone D, Bohn L, Scornavaca F, Pimentel A, Leite MC. Astroglial and cognitive effects of chronic cerebral hypoperfusion in the rat. Brain Res. 2009:204-212. Doi: 10.1016/j.brainres.2008.11.032. [ Links ]
Wang X, Yue TL, Young PR, Barone FC, Feuerstein GZ. Expression of Interleukin-6, c-fos, and zif268 mRNAs in Rat Ischemic Cortex. J Cereb Blood Flow Metab. 1995;15:166-171. Doi:10.1038/jcbfm.1995.18. [ Links ]
Wang D, Zhao Y, Wang G, Sun B, Kong K, Zhao K, et al. IL-17 potentiates neuronal injury induced by oxygen-glucose deprivation and affects neuronal IL-17 receptor expression. J Neuroimmunology. 2009;212:17-25. Doi: 10.1016/j.jneuroim.2009.04.007. [ Links ]
Winter B, Bert B, Fink H, Dirnagl U, Endres M. Dysexecutive syndrome after mild cerebral ischemia? Mice learn normally but have deficits in strategy switching. Stroke. 2004;35(1):191-195. Doi: 10.1161/01.STR.0000107188.29688.2C. [ Links ]
Yasuda Y, Shimoda T, Uno K, Tateishi N, Furuya S, Tsuchihashi Y, et al. Temporal and sequential changes of glial cells and cytokine expression during neuronal degeneration after transient global ischemia in rats. J Neuroinflammation. 2011;8:70. Doi: 10.1186/1742-2094-8-70. [ Links ]