Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.20 no.2 Bogotá May/Aug. 2015
https://doi.org/10.15446/abc.v20n2.44200
Doi: http://dx.doi.org/10.15446/abc.v20n2.44200
Artículo de investigación
ESTABLECIMIENTO DEL SISTEMA DE REGENERACIÓN POR EMBRIOGÉNESIS SOMÁTICA DE Azadirachta indica A. Juss.
Establishment of Regeneration System for Somatic Embryogenesis of Azadirachta Indica A. Juss.
Maria D. ARTIGAS R1, Rafael FERNANDEZ DA SILVA2.
1Department of Biological Production Science, United Graduate School of Agricultural Science, Tokyo University of Agriculture and Technology (TUAT). Tokyo, Japón.
2Centro de Biotecnología Aplicada (CBA), Departamento de Biología, Facultad Experimental de Ciencias y Tecnología, Universidad de Carabobo. Valencia, Venezuela.
For correspondence. artigasdaniela@gmail.com
Received: 3 July 2014; Returned for revision: 28 August 2014; Accepted: 10 September 2014.
Associate Editor: Xavier Marquínez Casas.
Citation / Citar este artículo como: Artigas R. MD, Fernández da Silva R. Establecimiento del sistema de regeneración por embriogénesis somática de Azadirachta indica A. Juss. Acta biol. Colomb. 2015;20(2):73-83. doi: http://dx.doi.org/10.15446/abc.v20n2.44200
RESUMEN
Azadirachta indica, es una planta con múltiples aplicaciones tanto forestal como farmacológica. Por ende, el establecimiento del sistema de cultivo in vitro por embriogénesis somática ofrece diversas y variadas ventajas, tales como obtener plantas altamente productivas en metabolitos. En este estudio, se utilizaron secciones foliares y cotiledonares, inducidas en medios MS (1962) suplementados con: BAP sólo y combinado con ANA / 2,4-D, TDZ sólo y con ABA. La regeneración fue con MS sólo o con K + AIA y BAP + AIA. Como resultado se estableció un sistema eficiente con secciones de cotiledones, observándose organogénesis a bajas concentraciones de BAP, mientras a altos niveles de BAP (2,5 mg.L-1), así como con TDZ + ABA (0,02 + 1 mg.L-1) respectivamente favorecieron la embriogénesis somática primaria y secundaria en un 96 % y 71 % respectivamente. La regeneración fue 71 % con MS, mientras que el enraizamiento fue de 86,67 % con MS½, obteniéndose plantas completas a corto plazo.
Palabras clave: 6-Bencil-aminopurina (BAP), ácido 2,4-diclorofenoxiacético (2,4-D), embriogénesis somática, Neem, regeneración.
ABSTRACT
Azadirachta indica, is a plant with multiple forest and pharmacological application. Therefore, the establishment of in vitro culture system for somatic embryogenesis offers several distinct advantages such as obtaining highly productive plant metabolites. In this study, were used sections cotyledon and leaf, induced on MS medium (1962) supplemented with: BAP alone and combined with NAA / 2,4-D, TDZ alone and ABA. Regeneration was with MS alone or with K + BAP + IAA and IAA. As a result was established an efficient system with cotyledon sections, being observed organogenesis at low concentrations of BAP, while high levels of BAP (2.5 mg.L-1) with 96 % and TDZ + ABA (0.02 + 1 mg.L-1) with 71 %, favoring the primary and secondary somatic embryogenesis. Regeneration was 71 % with MS; rooting was 86.67 % with MS½, presenting whole plants obtained short term.
Keywords: 6-Benzyl-aminopurine (BAP), 2,4-dichlorophenoxyacetic acid (2,4-D), Neem, regeneration, somatic embryogenesis.
INTRODUCCIÓN
El Neem (Azadirachta indica A. Juss) es un árbol que pertenece a la familia Meliaceae Juss.; tiene su origen en la India y actualmente se distribuye en diferentes regiones de Asia y Oceanía (principalmente Australia), e introducido en América, particularmente en el Caribe (Luz, 2001). Está caracterizado por ser siempre verde, de crecimiento rápido, de copa densa y ovalada, que suele estar entre los 10 y 15 m de altura, tallo leñoso, moderadamente delgado, con corteza fuerte. Las raíces son del tipo penetrantes y extensas. Las hojas son compuestas y pinnadas, mientras que las inflorescencias son panículas ramificadas y axilares, de flores pequeñas con colores amarillo-crema; los frutos son drupas de color verde a amarrillo (Parrotta y Chaturvedi, 1994; Luz, 2001). Esta planta es reconocida por sus múltiples propósitos, tales como el reverdecimiento urbano o reforestación de áreas devastadas, en la agricultura por su aplicación en extractos fungicidas e insecticidas, en la producción de leña, así como, en la medicina debido a que sus extractos tienen actividad bactericida, antiviral y fungicida; esto se corrobora ya que se ha empleado como una medicina tradicional (Allan et al., 1999).
Por otra parte, esta especie también presenta una gran producción de metabolitos secundarios del tipo defensivos, ya que existen muchos patógenos que son afectados por estos compuestos activos (Badu et al., 2006). Sin embargo, no son del tipo tóxico, el principio activo más importante contra insectos es el triterpenoide "azadiractina" el cual no puede ser sintetizado químicamente, y se encuentra principalmente en las semillas en un intervalo de concentraciones de 50 a 4000 mg.L-1 (Isman et al., 1990). Por lo antes descrito, el Neem es una fuente importante de productos naturales, usados como farmacéuticos, agroquímicos, ingredientes saborizantes, fragancias y cosméticos (Tripathi y Tripathi, 2003; Morgan, 2009).
En Venezuela es utilizado como planta ornamental en áreas verdes y plazas, como repelente de plagas y como alimento para el ganado. En el área medicinal se emplea como un antibiótico natural por su actividad antimicrobiana, antifúngica y antiviral (Atawodi y Atawodi, 2009). Asimismo, se ha demostrado que se puede controlar el desarrollo de nemátodos gastrointestinales en bovinos utilizando extractos de semilla o foliares (Pietrosemoli et al., 1999; Salazar y Pariacote, 2004). Desde el punto de vista agrícola se ha empleado para reducir los daños por alimentación causados a los cultivos de arroz en Guayana por el insecto Oebacillus poecillus, retrasar exitosamente el trazador del tomate Liriomyza sativae (Sutherland et al., 2002), cohibir significativamente el desarrollo larval de especies del género Spodoptera (Meisner et al., 1981; Tafur et al., 2007), además de inhibir pronunciadamente el crecimiento micelial y el número de esclerocios de Thielaviopsis basicola (Alcalá et al., 2005). También se ha demostrado que el extracto de semillas inhibe la actividad de la levadura Candida krusei y las bacterias E. coli, Pseudomonas aeruginosa, y Staphylococcus aureus (Gualteri et al., 2004).
Convencionalmente, el Neem es propagado por semillas, inmediatamente luego de ser cosechadas ya que son recalcitrantes y no soportan bajas temperaturas; además, las semillas presentan como principal desventaja la heterogeneidad genética producto de la polinización cruzada (Parrotta y Chaturvedi, 1994; Kundu, 1999). Los métodos de propagación in vitro permitirían minimizar estas desventajas pudiéndose regenerar plantas libres de patógenos y cuyas características no varíen con la fertilización, obteniendo líneas celulares clonales; asimismo, en este sentido, existen reportes de regeneración in vitro de Neem para proliferación de plantas a partir de plántulas derivadas de semillas germinadas (Murthy y Saxena, 1998), de semillas (Wewetzer, 1998), anteras (Gautham et al., 1993), brotes axilares (Sharry et al., 2006), endospermo (Thomas y Chaturvedi, 2008) y embriones cigóticos, siendo estos últimos los de mayor potencial regenerativo (Chaturvedi et al., 2004; Rout, 2005). Asimismo, se ha logrado mantener la integridad genética y viabilidad celular regenerando plantas completas a través de la criopreservación de embriones somáticos de Melia azedarach (Scocchi et al., 2007).
Finalmente en este orden de ideas, el establecimiento de un sistema eficiente de regeneración por cultivo de tejidos en el mundo y en particular en Venezuela, sería un paso importante para futuras investigaciones, en la obtención de nuevos cultivares, así como la optimización de los sistemas de producción de metabolitos secundarios de los mismos, minimizando la cantidad de material vegetal que es utilizada por métodos convencionales hasta ahora (Akula et al., 2003).
MATERIALES Y MÉTODOS
Se utilizaron como explantes secciones foliares sin nervaduras y cotiledones de plantas de A. indica (Neem) de 1 a 2 m de altura, ubicadas en el Campus de la Universidad de Carabobo. La desinfección se realizó primero con un lavado con jabón líquido comercial (Dodecilbencensulfonato de sodio, Brisol, Colgate-Palmolive C.A.) y agua destilada estéril, luego con alcohol isopropílico (70 % v/v por 30 s), seguido de Cloro comercial (3,5% de hipoclorito de sodio) diluido 1/10, más Tween® 20 (1 gota.10mL-1), después se realizaron cuatro lavados con agua destilada estéril. Para las secciones foliares, el último lavado fue con cisteína-L 1 % p/v (Sigma-Aldrich). Posteriormente, se sembraron in vitro, en diferentes medios de cultivo, 20 réplicas por tratamiento (tres secciones de folíolos y cuatro secciones de cotiledones de 4 mm2) por placa de Petri (100 mm x 15 mm) con 30 mL de medio de cultivo).
El medio de cultivo básico fueron las sales de Murashige y Skoog (1962) (MS), suplementado con tiamina-HCl 1 mg.L-1 (Sigma-Aldrich), mio-inositol 10 mg.L-1 (Sigma-Aldrich) y glicina 2 mg.L-1 (Sigma-Aldrich), según Zhuang y Jia (1983), como fuente de carbono se empleó sacarosa al 2 % p/v (Wako) en la inducción y 3 % en la regeneración, el agente solidificante fue Agar Powder 1,1 % p/v (Wako) y como anti-oxidante cisteína-L a 100 mg.L-1 (Sigma-Aldrich). Todos los medios se ajustaron a 5,8 de pH y se esterilizaron a 121 °C, 15 Lb pulgada-2 por 15 min (Autoclave Yamato SM510).
En la primera etapa se indujo la formación de callos sembrando los explantes al envés utilizando medios con diferentes reguladores de crecimiento. Para secciones foliares se usó: Bencil-aminopurina "BAP" (0,10; 0,20; 0,50; 1,0; 5,0 y 10 mg.L-1), 2,4-diclorofenoxi-acético "2,4-D" (0,05 y 0,10 mg.L-1), así como las combinaciones de estas con 6-furfuril amino purina "Cinetina o K" (0,10mg.L-1). Para segmentos cotiledonares, fueron BAP (1,0; 2,0 y 2,50 mg.L-1) o Tidiazuron "TDZ" (0,02 y 0,10 mg.L-1) sólo, y las combinaciones de BAP (1,0 mg.L-1) con Ácido naftalenacético "ANA" (0,50 mg.L-1), TDZ (0,02 y 0,10 mg.L-1) con Ácido abscísico "ABA" (0,10 y 0,50 mg.L-1) (Sigma-Aldrich). Los cultivos se mantuvieron a una temperatura entre 24 y 28 °C, 40 % a 60 % de humedad y en oscuridad continúa por un mes.
Para la regeneración de los callos embriogénicos, se utilizaron envases de vidrio cilíndricos de 40 mm x 50 mm x 80 mm, con 20 mL de medio. Los medios fueron los siguientes: MS sólo (R0), BAP 1,0 mg.L-1 + Ácido indolacético "AIA" 0,50 mg.L-1 (R1) y Cinetina 2,0 mg.L-1 + AIA 0,50 mg.L-1 (R2). Luego se enraizó con el medio MS básico diluido a la mitad (MS½). Los callos fueron incubados bajo un fotoperíodo de 16 h luz y 8 h de oscuridad a una temperatura de 28 a 30 ºC. Para la aclimatación se probaron dos sistemas en vermiculita con ANA (0,05 mg.L-1), la primera con agua estéril y la segunda con la solución nutritiva WMP, constituida por: KNO3 (50 mg.L-1) + Ca(NO3)2 (25 mg.L-1) + KH2PO4 (200 mg.L-1) + NaH2PO4 (50 mg.L-1) + MgSO4 (10 mg.L-1) (McCown y Lloyd, 1981).
Durante el proceso embriogénico se calculó la frecuencia de inducción empleando las fórmulas planteadas por Zaidi et al., (2006) para callos totales (Ct: número de callos / número de Explates x 100), callos embriogénicos (CE: número de callos embriogénicos/ número de explantes x 100) y embriones somáticos secundarios (Ess: número de embriones somáticos secundarios / número de Embriones x 100). También, se midió la frecuencia de embriones somáticos primarios regenerados (Egr: número de Embriones somáticos primarios regenerados/ número de explantes x 100) y de brotes (Br: número de brotes / explantes x 100). Finalmente, se utilizó un Análisis de Varianza y la prueba a posteriori de Duncan en la evaluación de la diferencia del efecto de los distintos medios (p = 0,05) mediante el programa Statistica 6.0 de StatSoft C.A.
RESULTADOS
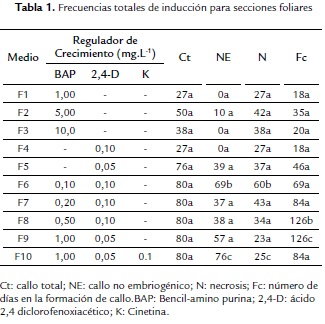
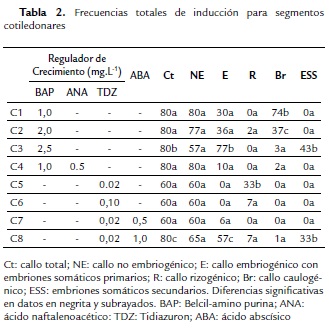
En este trabajo se evaluaron en la etapa de inducción, diez medios para secciones foliares (Tabla 1) y ocho para secciones cotiledonares (Tabla 2). Se observó la inducción de sólo callo no embriogénico (NE) en foliolos (Tabla 1), mientras que en cotiledones se formó este tipo de callo, así como el rizogénico (R), caulogénico o con brotes (Br) y el embriogénico (E) (Tabla 2), respuesta fundamentalmente influenciada por la presencia de BAP sola o combinada con otras citocininas o con auxinas.
En folíolos, se indujo callo en todos los medios, encontrándose una mayor frecuencia callogénica total y por tiempo prolongado en medios con la combinación de citocininas y auxinas (F6-F10), encontrándose sólo diferencias significativas en F8 y F9. Mientras que empleando medios con un solo regulador de crecimiento (F1-F4) la frecuencia de callogénesis total fue menor y a un corto plazo (15 a 30 días), necrosándose rápidamente, excepto a la menor concentración de 2,4-D (F5), que se encontró una frecuencia callogénica total de 76 callos a los 41 a 51 días. Por otra parte, la formación de callo no embriogénico fue variable, siendo mayor (76 %) en F10, un medio suplementado adicionalmente con cinetina.
Al realizar los análisis estadísticos, se evidenciaron diferencias significativas en cuanto a la formación de callos NE de apariencia granular o de tipo gelatinosa, con necrosis (N), con respecto a la composición de reguladores de crecimiento vegetal de los medios, particularmente con las combinaciones de BAP con 2,4-D (F6 y F10), mientras que en medios suplementados con BAP solo (F1-F3) o con 2,4-D solo (F4-F5), no se evidenció una diferencia significativa en el número de callos observado, aunado al hecho que fueron los medios donde menor frecuencia de inducción de callo se obtuvo, evidenciando que en secciones foliares con BAP o 2,4-D solo a las concentraciones ensayadas no son adecuadas para el establecimiento de un sistema de regeneración in vitro.
Por otro lado, al estudiar la relación del tiempo (días) de crecimiento de los callos y en cada medio de cultivo, se observó una tendencia significativa con F8 y F9, lo cual permite conjeturar que las bajas frecuencias inductivas pueden estar influenciadas por factores tales como la manipulación o edad de las plantas.
A diferencia de los folíolos en los segmentos cotiledonares las frecuencias de inducción obtenidas fueron considerables, como se muestra en la Tabla 2, evidenciándose tanto organogénesis como embriogénesis somática indirecta. Se desarrolló callo total (60–80 %) en todos los medios probados, encontrándose una frecuencia de callo no embriogénico entre 57 % y 80 %, mientras que fue baja o nula la de callo rizogénico y caulogénico a excepción de C5 (33 %) para el primero y C1 (74 %) y C2 (37 %) para el segundo, todos con bajos niveles de citocininas. Por otra parte, el desarrollo de callo embriogénico con embriones somáticos primarios se encontró en medios con BAP sola o combinada con ANA y en medios con TDZ con ABA, siendo mayor la frecuencia con 2,5 mg.L-1 de BAP (C3) y con TDZ 0,02 mg.L-1 y 1,0 mg.L-1 ABA (C8) con un 77 % y 57 % respectivamente, siendo a su vez en estos únicos medios donde se evidenció la diferenciación de embriones somáticos secundarios (ESS = C3: 43 % y C8: 33 %), y con ello una mayor frecuencia de embriones somáticos germinados (Egr) en plántulas completas. También se reveló que existen diferencias significativas entre los medios tanto para la embriogénesis somática primaria como secundaria, con respecto al medio C3 y C8, pero no entre ellos dos, por lo cual cualquiera de ellos sería efectivo en la inducción de los procesos ya mencionados.
Con respecto al proceso regenerativo en segmentos cotiledonares, se observaron cambios en dichos explantes luego de 15 días de iniciado el cultivo, se desarrolló un callo en la superficie de las zonas de corte de la cara abaxial de los segmentos del cotiledón. El callo formado fue de dos tipos: uno no embriogénico (NE), similar al de secciones foliares y otro embriogénico (E) (Fig. 1A). Este último anatómicamente se caracterizó por presentar células pequeñas de forma isodiamétrica de paredes gruesas, distribuidas uniformemente en una masa pro embriogénica, las cuales se diferenciaron en embriones somáticos, gracias a la exposición de los explantes a medios enriquecidos con citocininas, como se puede observar en la Fig. 1B. Los embriones somáticos primarios poseían una superficie lisa y brillante, de color amarillo y verde a los 15 y 30 días respectivamente, aislados o conformando agregados, donde se detalló la aglomeración de embriones somáticos de diferentes estadios (globular, corazón y torpedo), o en etapa de germinación, notándose el inicio del desarrollo del vástago. Posteriormente en algunos casos, este primer embrión se tornó de una coloración verde a marrón indicando su maduración (Fig. 1C).
Para la germinación de los embriones somáticos y posterior diferenciación de plantas completas, la frecuencia regenerativa de estas varió de acuerdo a la composición del medio de cultivo. De la germinación de los embriones somáticos o del desarrollo de los brotes (Fig. 1C y 1D), se derivan las plantas regeneradas (Fig. 1F), ya sea por embriogénesis somática o por organogénesis, no obstante, estudios anatómicos indicaron la diferenciación de plantas a través del primer proceso indicado, las cuales son producto del sub-cultivo en medios de regeneración (Fig. 1F), hasta que alcanzan la elongación adecuada, sin llegar a formar raíces, ya que, esto representaría una fase adicional de enraizamiento (Fig. 1G), seguida de la aclimatación (Fig. 1H). Estas fases son generalmente esenciales en sistemas de cultivo in vitro de especies forestales.
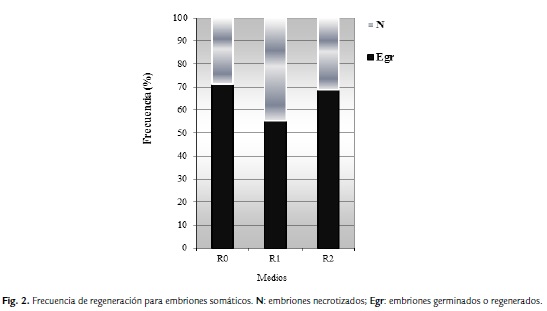
Los resultados en la Figura 2, indican que los medios R0 y R2 fueron los adecuados para diferenciación de plantas, ya que se obtuvo 71 % y 69 % de regenerantes respectivamente, a diferencia de R1 que obtuvo un 55 %, debido a la alta necrosis de los embriones somáticos. Por lo general, los callos de capacidad regenerativa tales como los embriogénicos, presentan gran producción de compuestos polifenólicos, así como gases (etileno), lo cual inicialmente favorece la diferenciación de los embriones somáticos, sin embargo, al acumularse en el medio de cultivo se hace tóxico a las células, cambiando el color de los callos, disminuyendo su tasa de crecimiento y determinando al final la necrosis de los mismos. Es por ello que en las fases de la regeneración y de enraizamiento, se repicaron a medio fresco los embriones, permitiendo el intercambio gaseoso.
En la Figura 3 se presenta gráficamente un resumen de los pasos y tiempos del sistema de regeneración por embriogénesis somática, establecido en este trabajo, la cual se estimó en un total de 16 semanas. Los embriones somáticos inducidos en cinco semanas (Fig. 3A), germinando a las seis semanas con un fotoperíodo 16 h luz / 8 h oscuridad (Fig. 3B), diferenciándose en una planta con hojas de un color verde intenso a las diez semanas (Fig. 3C) y con raíces a las 16 semanas, lista para el proceso de aclimatación (Fig. 3D). En medio de enraizamiento con MS½, el 86,67 % de las plantas regeneradas de embriones, desarrollaron una a tres raíces largas con abundantes pelos radicales, en un período de 15 a 20 días en cultivo.
Posteriormente las vitro plantas se aclimataron con una mezcla de vermiculita y fueron regadas con dos soluciones prueba: una de aclimatación y otra con agua común esterilizada, ambas con ANA 0,05 mg.L-1, encontrándose una planta aclimatada con agua estéril obtenida de la red pública + ANA, a los 30 días.
DISCUSIÓN
Los resultados encontrados en este trabajo indican una respuesta diferencial en cuanto a la formación de callo y la diferenciación de embriones somáticos, en función del tipo de explante y de los reguladores de crecimiento (concentración y combinación), tal como lo señalan Capote y Estrada (2001), Ranjan (2005) en Azadiractha indica y Vila et al., (2009) en Melia azedarach.
En el sistema de regeneración en especies de la familia Meliaceae, por organogénesis vía indirecta se han utilizado explantes de origen foliar, obteniéndose múltiples brotes y por ende plantas completas, empleando medios con solo citocininas: BAP a 1 mg.L-1 en Melia azedarach (Vila et al., 2003; Vila et al., 2004), 0,1 mg.L-1 de TDZ en Toona ciliata (Daquinta et al., 2005), así como en la familia Actinidiaceae con Actinidia deliciosa al emplear 0,5 mg.L-1 de TDZ (Popielarska et al., 2006). Mientras que por embriogénesis somática se ha utilizado con hojas, solo citocininas, diferenciándose embriones somáticos primarios y secundarios empleando 1 mg.L-1 BAP, o combinándose con auxinas u otras citocininas en Azadirachta indica (Chaturvedi et al., 2004; Kota et al., 2006) y Azadirachta excelsa (Te-Chato et al., 2000; Morimoto et al., 2006). Por otra parte, Shekhawat et al. (2009), en Azadirachta indica señalan que el desarrollo del callo embriogénico en hojas puede ser difícil cuando hay combinaciones de auxinas como 2,4-D o AIA con citocininas como el BAP, demostrando que al tener concentraciones altas de ambos reguladores de crecimiento, la frecuencia de formación de este tipo de callo se ve mermada, tal como se observó en nuestros resultados. Otros autores indican que el empleo de bajas concentraciones de auxinas como reguladores de crecimiento promueve procesos de formación de callos regenerativos de tipo organogénicos, con desarrollo de raíces y que altas concentraciones de estos reguladores, promueven la formación de callo no regenerativo, tal como se indicó en Azadirachta indica (Wen Su et al., 1997; Kota et al., 2006; Das, 2011) y Melia azedarach (Sharry y Texeira, 2006). Sin embargo, combinando 4 mg.L-1 de AIB (ácido indol-3-butírico) y 1 mg.L-1 de BAP se favorece tanto la organogénesis como la embriogénesis somática en tejido foliar de Azadiractha excelsa, incrementándose la regeneración de solo brotes al aumentar a 2 mg.L-1 de BAP (Giagnacovo et al., 2001).
Los callos producidos no llegaron a diferenciarse en brotes o embriones somáticos, únicamente raíces (denotado por el tejido vascular, conformado por vasos xilemáticos de engrosamientos reticulares y con abundantes pelos radiculares), lo cual puede atribuirse esencialmente al balance auxina/citocinina exógeno en el medio o endógeno del explante. En este sentido, Kota et al., (2006) indican que las auxinas como el ácido naftalen-acético (ANA) desempeñan un rol importante en la formación de callos en alta frecuencia, pudiendo observarse el fenómeno de diferenciación en brotes o raíces, dependiendo de la concentración de la auxina en el medio y su combinación con una citocinina como la cinetina. Sin embargo, muchos investigadores que han trabajado en forestales de la familia Meliaceae señalan el efecto inductivo embriogénico de BAP solo o combinado con otras auxinas o citocininas (Te-chato y Rungnoi, 2000).
El nivel de necrosis presenciado, probablemente fue causado por una elevada fenolización de los explantes, esto puede estar influenciado por la exposición de las plantas donantes, a factores ambientales o contaminantes (abióticos o bióticos). Esta respuesta in vitro se dio en Neem, a pesar que esta planta es reconocida por su vigoroso crecimiento bajo condiciones adversas del suelo y clima (Luz, 2001). La inexistente respuesta de embriogénesis en secciones de folíolos, se puede deber a la alta diferenciación celular alcanzada y a la recalcitrancia que generalmente poseen los tejidos vegetales de las especies forestales a la regeneración. Adicionalmente, la presencia del raquis y la nervadura central en el folíolo, al presentar tejido vascular favorece la organogénesis en algunas especies forestales (Vila et al., 2004), debido al transporte de hormonas endógenas a través de estos tejidos conductores (Pastelín et al., 2008).
Por otra parte, fundamentado a este hecho, los investigadores que han trabajado con especies de este grupo de plantas, plantean en la mayoría de los casos que la embriogénesis somática en las mismas se logra a partir de determinadas células pro-embriogénicas, sin la presencia de una auxina en el medio de cultivo, tal como el 2.4-D, a diferencia de Deb (2001) en Melia azederach, que logra la diferenciación de embriones somáticos (95 %) y conversión de plantas completas (90,5 %) a partir de secciones cotiledonares en medios con solo auxinas (3 mg.L-1 de 2,4-D más 3 mg.L-1 de ANA). Por lo tanto, en general en Neem se logra el desarrollo de embriones somáticos primarios con solo citocinina como BAP a 1 mg.L-1 (Chaturvedi et al., 2004), a diferencia de Su et al., (1997) que induce embriones somáticos en cotiledones utilizando 0,5 mg.L-1 de ANA y 1 mg.L-1 de BAP, sin embargo, en nuestros resultados a bajas concentraciones de BAP, se potenció la organogénesis indirecta en detrimento de la embriogénesis somática, siendo necesario emplear mayores concentraciones de citocinina. También el desarrollo de embriones somáticos primarios se puede lograr combinando otra citocinina: TDZ con ABA, obteniendo así resultados similares a los reportados por Singh y Chaturvedi (2009), donde obtienen una frecuencia máxima de embriones somáticos primarios del 76 %.
En este sentido en Neem, Chaturvedi et al., (2004) reportaron que al emplear en el medio con 0,22 mg.L-1 de BAP + 0,08 mg.L-1 de AIA, 14 embriones secundarios por embrión primario, los cuales se formaron de callos de color marrón en dos semanas. Dichos resultados difieren de los nuestros, ya que en este trabajo se observó dicha vía regenerativa con una mayor concentración de BAP solo o con la combinación de otra citocinina (TDZ) con ABA, concordando ésta última con los resultados descritos por Singh y Chaturvedi (2009). En este sentido, se favorece la diferenciación de embriones somáticos en medios enriquecidos con citocininas como BAP o TDZ, ya sea de una masa pro embriogénica de A. indica (Shrikhande et al., 1993; Chaturvedi et al., 2003; Thomas y Chaturdevi, 2008) o directamente del explante en Melia azedarach (Vila et al., 2003) y Melia volkensii (Mulanda et al., 2014).
En este orden de ideas, Skoog y Miller (1957) plantean que el mecanismo desencadenante de los procesos morfogénicos esta mediado por la dinámica interacción de reguladores de crecimiento, en particular entre auxinas y citocininas en la expresión de la embriogénesis somática, tal como lo indica Jiménez (2005), variando el grado de competencia embriogénica en función del nivel endógeno de las mismas en relación al tejido y genotipo de la especie vegetal en estudio. Así Visser et al., (1992) señalan en secciones de hipocótilo de Pelargonium, que la acción exógena de citocininas como el TDZ potencia la síntesis y subsecuente acción del mejor balance de auxinas/citocininas a nivel endógeno, que favorezca de manera óptima la inducción de la embriogénesis somática. Asimismo, en el cultivo líquido de callo de Coffea arabica sometidos a pulsos (24–48 horas) de BAP, se induce significativamente la diferenciación de embriones somáticos, debido a las propiedades de este regulador de crecimiento a minimizar la liberación de especies reactivas de oxigeno (ROS) que son altamente toxicas al proceso morfogénico como lo es la embriogénesis somática, ya que éstas están relacionadas a la activación de mecanismos apostóticos celulares, esto también ha sido reportado en caña de azúcar por Medeiros De Araújo Silva et al., (2014).
Entre las diversas familias vegetales leñosas, la Meliaceae, presenta recalcitrancia al proceso regenerativo in vitro, específicamente en el desarrollo de callos embriogénicos, ya que normalmente, por la naturaleza de los tejidos y la condición genética de los mismos, se produce en mayor frecuencia la formación de callos organogénicos (raíces y hojas), a través de los cuales se dificulta la regeneración de plantas completas, sin embargo, se ha encontrado que en tejidos como el cotiledón, con abundante sustancias de reserva, se puede obtener callo regenerativo de tipo embriogénico y a partir de éste inducir la formación de embriones somáticos, a través de los cuales es posible la regeneración de plantas completas, lo que concuerda con el proceso establecido en este trabajo (Chaturvedi et al., 2003; Gairi y Rashid, 2004; Gairi y Rashid, 2005; Thomas y Chaturvedi, 2008; Srivastava et al., 2009). Por otra parte, Goralski et al., (2005) y Ranjan (2005) mencionan en A. indica, que una de las vías seguidas por este tipo de explante es la embriogénesis somática indirecta, evidenciando la formación de embriones sobre el callo regenerativo de tipo embriogénico, como se encontró en esta investigación, no obstante en otras meliáceas como Melia azedarach (Vila et al., 2003) y Melia volkensii (Mulanda et al., 2014), la diferenciación de los embriones somáticos se presenta directamente del tejido embriogénico cigótico inmaduro y cotiledonar respectivamente.
La diferenciación de embriones somáticos tanto primarios como secundarios se evidenció de forma continua y asincrónica, ya que se observaron embriones en diversas etapas de desarrollo, coincidiendo esto con lo descrito por Shrikhande et al., (1993) y Murthy and Saxena (1998) en A. indica, Vila et al., (2009) en Cedrela fissilis y Yang et al., (2012) en Sorbus pohuashanensis. A diferencia de los embriones somáticos primarios, los secundarios se originan directamente de las células epidérmicas y sub-epidérmicas de la zona hipocotilar de los embriones somáticos primarios, tal como se describió en C. arabica, por parte de Fernández et al., (2005), así como en un bajo porcentaje se diferencian del polo radicular, tal como se señaló en Melia azedarach (Scocchi et al., 2007). Pero en este trabajo se logró inclusive observar la ciclación ininterrumpida de la embriogénesis somática debido a su exposición consecutiva a reguladores de crecimiento, esto fue evidenciado a través de la formación de embriones somáticos primarios hasta terciarios, aspecto también indicado por Raemakers et al., (1995). Los embriones siguieron desarrollándose de manera repetitiva apareciendo hasta las 8 semanas, verificando el hecho que al aumentar el período de incubación se incrementa la respuesta embriogénica.
También, se ha reportado que A. indica es una de las especies que puede poseer una concentración relativamente elevada de auxinas. Cuando el nivel de auxinas en el medio de cultivo baja más de cierto umbral, las células embriogénicas empiezan un proceso de histodiferenciación, impidiendo la adquisición de simetría bilateral y el desarrollo del meristemo apical, tal como lo indica Parrott (2002).
Durante la regeneración de callos embriogénicos, Shrikhande et al., (1993) concluyeron que la alta concentración de carbono afecta el desarrollo de este proceso, por lo que redujeron la concentración de caseína hidrolizada a 200 mg.L-1, pero hubo persistencia del desarrollo de callos anormales logrando que el 60 % a 70 % de los embriones se agrandaran y germinaran. En los medios de regeneración ensayados en esta investigación, se utilizó como fuente de carbono sacarosa al 3 %, lo cual permitió la germinación y regeneración de los embriones somáticos obtenidos directamente, con poca o nula callogénesis. La omisión total de reguladores de crecimiento en los medios de cultivo, permite que los embriones transferidos se desarrollen en plantas completas con la raíz y vástago bien diferenciados, tal como lo describieron en Melia volkensii, (Indieka et al., 2007) y Cedrela fissilis (Vila et al., 2009).
A diferencia del enraizamiento hallado en este trabajo, Chaturdevi et al., (2004) en A. indica, enraizaron con MS ½ y ¼ + AIB, con una supervivencia de 87,5 % de vitro plantas en un período de 30 días y Vila et al., (2003; 2005) en Melia azederach enraizaron con MS + 3 mg.L-1 de IBA por 3 o 4 días seguido de 26 a 27 días en MS sin reguladores de crecimiento. Otros autores han propuesto usar AIB hasta 10 mg.L-1, para el enraizamiento obteniendo plantas vivas a los 90 días, sin embargo, hay que considerar el tipo de explante que se está enraizando, ya que existen variaciones que afectan dicho proceso, exigiendo el uso de esta alta concentración de auxina, tal como lo realizaron De Oliveira et al., (2005), donde al no utilizar AIB (control), se obtuvo como resultado una baja supervivencia de plantas in vivo. En otras Meliáceas como Cedrela odorata L., se probaron dos medios: MS y WMP, obteniendo que el mejor medio para el desarrollo de brotes fue WPM diluido a ½ suplementado con sacarosa a 30 g.L-1 favoreciendo el enraizamiento espontáneo de los explantes (Pérez, 2001; Peña-Ramírez et al., 2011). Con respecto al buen desarrollo de las plántulas de Neem, se concuerda con Souza y Pereira (2007), que logran el mejor crecimiento vegetal con vermiculita, ya que la textura ligera y porosa del suelo sustituto previene el daño de la raíz, permite el mejor crecimiento de la misma y el desarrollo óptimo de la planta.
CONCLUSIÓN
En este estudio se estableció un eficiente protocolo de regeneración in vitro por embriogénesis somática para el Neem, resaltándose particularmente la embriogénesis secundaria, con la cual podría obtenerse líneas celulares elites, potencialmente eficientes en la producción de metabolitos secundarios como la azadiractina, ya sea a través de biorreactores o por ingeniería genética.
AGRADECIMIENTOS
Al Consejo de Desarrollo Científico y Humanístico (CDCH) de la Universidad de Carabobo (UC) por el financiamiento (CDCH-VAC-259-09) de este trabajo, así como a todo el personal del Centro de Biotecnología Aplicada (CBA) de la UC.
REFERENCIAS
Akula C, Akula A, Drew R. Somatic embryogenesis in clonal Neem, Azadirachta indica A. Juss. and analysis for in vitro azaridachtine production. In vitro Cell Dev Biol Plant. 2003; 39(3):304-310. Doi: http://dx.doi.org/10.1079/IVP2003415. [ Links ]
Alcalá M, Vargas N, Pire A. Efecto de extractos vegetales y fungicidas sintéticos sobre el crecimiento micelial in vitro de Sclerotium rolfsii y Thielaviopsis basicola. Rev Fac Agron. 2005;22:315-323. [ Links ]
Allan E, Stuchbury T, Mordue A. Azadirachta indica A. Juss (Neem tree), In vitro culture, micropropagation and production of azaradichtin and other secondary metabolites. In: Bajaj YPS (ed). Biotechnol Agric For. 1999;43:11-49. [ Links ]
Badu V, Narasimham S, Nair G. Bioproduction of azadirachtin-A, nimbin and salannin in callus and cell suspension cultures of Neem (Azadiractha indica A. Juss). Curr Sci. 2006;91(1):22-24. [ Links ]
Capote A, Estrada J. Propagación in vitro del nim (Azadirachta indica A. Juss.) mediante brotes axilares. Cienc For. 2001;26 (90):103. [ Links ]
Chaturvedi R, Razdan M, Bhojwani S. An efficient protocol for the production of triploid plants from endosperm callus of Neem, Azadirachta indica A. Juss. J Plant Physiol. 2003;160(5):557-564. Doi: http://dx.doi.org/10.1078/0176-1617-00884. [ Links ]
Chaturvedi R, Razdan M, Bhojwani S. In vitro morphogenesis in zygotic embryo cultures of Neem (Azadirachta indica A. Juss.). Plant Cell Rep. 2004;22(11):801-809. Doi: http://dx.doi.org/10.1007/s00299-004-0768-0. [ Links ]
Daquinta M, Lezcano Y, Cid M, Pina D, Rodriguez R. Morfogénesis in vitro de Toona ciliata a partir de raquis de hojas jóvenes con tidiazuron. Rev Colomb Biotecnol. 2005;7(2):5-9. [ Links ]
Das P. In Vitro Somatic Embryogenesis in some oil yielding tropical tree species. Amer J Plant Sci J. 2011;2(2):217-222. Doi: http://dx.doi.org/10.4236/ajps.2011.22023. [ Links ]
Deb C. Somatic Embryogenesis and Plantlet Regeneration of Melia azedarach L (Ghora Neem) from Cotyledonary Segments. J Plant Biochem Biotechnol. 2001;10(1):63-65. Doi: http://dx.doi.org/10.1007/BF03263110. [ Links ]
De Oliveira M, Freire A, Pereira I. Portes T. Estudo da influência de fitorreguladores no enraizamento de estacas de Nim (Azadiractha indica). Rev Eletr FMB. 2005;1(1):65-71. [ Links ]
Fernandez-Da Silva R, Hermoso L, Menéndez A. Primary and secondary somatic embryogenesis in leaf sections and cell suspension of Coffea arabica CV catimor. Interciencia. 2005;30(11):694-698. [ Links ]
Gairi A, Rashid A. Direct differentiation of somatic embryos on different regions of intact seedlings of Azadirachta in response to thidiazuron. J Plant Physiol. 2004;161(9):1073-1077. Doi: http://dx.doi.org/10.1016/j.jplph.2004.05.001. [ Links ]
Gairi A, Rashid A. Direct differentiation of somatic embryos on cotyledons of Azadirachta indica. Biol Plantarum. 2005;49(2):169-173. Doi: http://dx.doi.org/10.1007/s10535-005-0173-8. [ Links ]
Gautam V, Nanda K, Gupta S. Development of shoots and roots in anther-derived callus of Azadirachta indica A. Juss. A medicinal tree. Plant Cell Tissue Organ Cult. 1993;34(1):13-18. Doi: http://dx.doi.org/10.1007/BF00048458. [ Links ]
Giagnacovo G, Pasqua G, Monacelli B, Van der Esch S, Maccioni O, Vitali F. Organogenesis and embryogenesis from callus cultures of Azadirachta excelsa. Plant Biosyst. 2001;135(1):13-18. Doi: http://dx.doi.org/10.1080/11263500112331350590. [ Links ]
Goralski G, Popielarzka M, Slesak H, Siwinska D, Batycka M. Organogenesis in endosperm of Actinidia deliciosa cv. Hayward cultured in vitro. Acta Biol Crac Ser Bot. 2005;47(2):121-128. [ Links ]
Gualteri M, Villalta C, Guillén A, Lapenna E, Andara E. Determinación de la actividad antimicrobiana de los extractos de la Azadirachta indica A. Juss (Neem). Rev. INHRR. 2004;35(1):1-7. [ Links ]
Indieka S, Odee D, Muluvi G, Rao K, Machuka J. Regeneration of Melia volkensii Gürke (Meliaceae) through direct somatic embryogenesis. New For. 2007;34(1):73-81. Doi: http://dx.doi.org/10.1007/s11056-007-9038-7. [ Links ]
Isman B, Koul O, Luczinski A, Kaminski J. Insecticidal and antifeedant bioactivities of Neem oils and their relationship to azadirachtin content. J Agric Food Chem. 1990;38(6):1406-1411. Doi: http://dx.doi.org/10.1021/jf00096a024. [ Links ]
Jiménez V. Involvement of plant hormones and plant growth regulators on in vitro somatic embryogenesis. Plant Growth Regulation. 2005;47:91-110. Doi: http://dx.doi.org/10.1590/S0103-31312001000200008. [ Links ]
Kota S, Rao R, Chary P. In vitro response of select regions of Azadirachta indica A. Juss (Meliaceae) as elucidated by biochemical and molecular variations. Curr Sci. 2006;91(6):770-776. [ Links ]
Kundu S. The mating system and genetic significance of polycarpy in the Neem tree (Azadirachta indica). Theor Appl Genet. 1999;99(7-8):1216-1220. Doi: http://dx.doi.org/10.1007/s001220051327. [ Links ]
Luz. Neem, un árbol milagroso. Universidad del Zulia, Facultad de Agronomía, Maracaibo-Venezuela; 2001. 49 p. [ Links ]
McCown B, Lloyd G. Woody plant médium (WPM) a revised mineral formulation for micro-culture of woody plant species. Hort Sci. 1981;16:453. [ Links ]
Medeiros De Araújo Silva, Marina, et al. Antioxidant enzymes activity in embryogenic and non-embryogenic tissues in sugarcane. Acta biol. Colomb. 2014;19(2):203-210. Doi: http://dx.doi.org/10.15446/abc.v19n2.39200. [ Links ]
Meisner J, Ascher K, Aly R, Warthen J. Response of Spodoptera littoralis (Boisd.) and Earias insulana (Boisd.) larvae to azadirachtin and salannin. Phytoparasitica. 1981;9(1):27-32. Doi: http://dx.doi.org/10.1007/BF03158326. [ Links ]
Morgan E. Azadirachtin, a scientific gold mine. Bioorg Med Chem. 2009;17(2):4096-4105. Doi: http://dx.doi.org/10.1016/j.bmc.2008.11.081. [ Links ]
Morimoto M, Nakamura K, Sano H. Regeneration and genetic engineering of a tropical tree, Azadirachta excelsa. Plant Biotechnol. 2006;23(1):123-127. Doi: http://dx.doi.org/10.5511/plantbiotechnology.23.123. [ Links ]
Mulanda E, Adero M, Wepukhulu D, Amugune N, Akunda E, Kinyamario J. Thidiazuron-induced somatic embryogenesis and shoot regeneration in cotyledon explants of Melia volkensii Gurke. Propagation of Ornamental Plants. 2014;14(1):40-46. [ Links ]
Murashige T, Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant. 1962; 15: 473-497. Doi: http://dx.doi.org/10.1111/j.1399-3054.1962.tb08052.x. [ Links ]
Murthy B, Saxena P. Somatic embryogenesis and plant regeneration of Neem (Azadirachta indica A. Juss). Plant Cell Rep. 1998;17(6-7):469-475. Doi: http://dx.doi.org/10.1007/s002990050427. [ Links ]
Parrott W. La embriogénesis somática en las angiospermas. VI Int. Symposium on Plant Biotechnol. Instituto de Biotecnología de Las Plantas, Villa Clara, Cuba. 2002; 154 p. [ Links ]
Papanastasiou I, Soukouli E, Moschopoulou E, Kahia E, Kintzios S. Effect of liquid pulses with 6-benzyladenine on the induction of somatic embryogenesis from coffee (Coffea arabica L.) callus cultures. Plant Cell Tiss Organ Cult. 2008;92:215-225. Doi: http://dx.doi.org/10.1007/s11240-007-9326-0. [ Links ]
Parrotta J, Chaturvedi A. Azadirachta indica A. Juss. Margosa, Neem. Meliaceae Familia de la caoba. For Serv Southern For Exp Stn. 1994; 8 p. [ Links ]
Pastelín M, López M, Martínez Y, González T, Rodríguez D, Castañeda O. Germinación in vitro del Neem (Azadirachta Indica A. Juss) y regeneración de múltiples brotes. XXI Reunión Científica-Tecnológica Forestal y Agropecuaria Veracruz y I del Trópico Mexicano. 2008;228-296. [ Links ]
Peña-Ramírez Y, García-Sheseña I, Hernández-Espinoza A, Dominguez-Hernandez A, Barredo-Pool F, González-Rodríguez J, et al. Induction of somatic embryogenesis and plant regeneration in the tropical timber tree Spanish red cedar [Cedrela odorata L. (Meliaceae)]. Plant Cell Tiss and Organ Cult. 2011;105(2):203-209. Doi: http://dx.doi.org/10.1007/s11240-010-9853-y. [ Links ]
Pérez J. Método de micropropagación aplicable a genotipos selectos de Cedrela odorata. Tesis Mag. Sc. CATIE, Turrialba, Costa Rica. 2001. p. 62. [ Links ]
Pietrosemoli S, Olavez R, Montilla T, Campos Z. Empleo de hojas de Neem (Azadirachta indica A. Juss.) en control de nemátodos gastrointestinales de bovinos a pastoreo. Rev Fac Agron. 1999;1(1):220-225. [ Links ]
Popielarska M, Slesak H, Góralski G. Histological and SEM studies on organogenesis in endosperm-derived callus of Kiwifruit (Actinia deliciosa cv. Hayward). Acta Biol Crac Ser Bot. 2006:48(2):97-104. [ Links ]
Raemakers C, Jacobsen E, Visser E. Secondary somatic embryogenesis and applications in plant breeding. Euphytica. 1995;81(1):93-107. Doi: http://dx.doi.org/10.1007/BF00022463. [ Links ]
Ranjan G. In vitro somatic embryogenesis in callus cultures of Azadirachta indica A. Juss.-a multipurpose tree. For Res. 2005;10(2):263-267. Doi: http://dx.doi.org/10.10.1007/s10310-004-0130-y. [ Links ]
Salazar E, Pariacote F. Goat Parasites control using watery extract of Neem seeds (Azadirachta indica A. Juss.). Arch Latinoam Prod Anim. 2004;12(1):82-85. [ Links ]
Scocchi A,Vila S, Mroginski L, Engelmann F. Cryopreservation of somatic embryos of Paradise tree (Melia azedarach L.). Cryo Letters. 2007;28(4):281-290. [ Links ]
Sharry S, Texeira J. Effective organogenesis, somatic embryogenesis and salt tolerance induction in vitro in the Persian lilac tree (Melia azedarach L.). In Floriculture, Ornamental and Plant Biotechnol. Volumen II. Global Books. 2006. p. 317-324. [ Links ]
Sharry S, Cabrera J, Herrera L, Rangel R, Lede S, Abedini W. An alternative pathway for plant in vitro regeneration of chinaberry -tree Melia azedarach L. derived from the induction of somatic embryogenesis. J Biotechnol Spec Issue. 2006;9(3):188-194. Doi: http://dx.doi.org/10.2225/vol9-issue3-fulltext-13. [ Links ]
Shekhawat G, Mathur S, Batra A. Role of phytohormones and nitrogen in somatic embryogenesis induction in cell culture derived from leaflets of Azadirachta indica. Biol Plantarum. 2009;53(4):707-710. Doi: http://dx.doi.org/10.1007/s10535-009-0127-7. [ Links ]
Shrikhande M, Thengane S, Mascarenhas A. Somatic embryogenesis and plant regeneration in Azadiractha indica A. Juss. In vitro Cell Dev Biol Plant. 1993;2 (1):38-42. Doi: http://dx.doi.org/10.1007/BF02632237. [ Links ]
Singh M, Chaturvedi R. An efficient protocol for cyclic somatic embryogenesis in Neem (Azadirachta indica A. Juss.). Proc Int Conf Ener Environ. 2009;3(19-21):656-658. Doi: http://waset.org/Publication/12584. [ Links ]
Skoog F, Miller C. Chemical regulation of growth and organ formation in plant tissues cultured in vitro. Symp Soc Exp Biol. 1957;11:118-140. [ Links ]
Souza A, Pereira A. Enraizamento de plantas cultivadas in vitro. Rev Bras Pl Med Botucatu. 2007;9(4):103-117. [ Links ]
Srivastava P, Singh M, Mathur P, Chaturvedi R. In vitro organogenesis and plant regeneration from unpollinated ovary cultures of Azadirachta indica. Biol Plantarum. 2009;53(2):360-364. Doi: http://dx.doi.org/10.1007/s10535-009-0067-2. [ Links ]
Su W, Hwang W, Kim S, Sagawa Y. Induction of somatic embryogenesis in Azadirachta indica. Plant Cell, Tissue Organ Culture. 1997;50(1):91-95. [ Links ]
Sunday E, Atawodi S, Atawodi J. Azadirachta indica (Neem): a plant of multiple biological and pharmacological activities. Phytochem Rev. 2009;8:601-620. Doi: http://dx.doi.org/10.1007/s11101-009-9144-6. [ Links ]
Sutherland J, Baharally V, Dyndial P. Use of the botanical insecticide, Neem to control the small rice stinkbug (Oebalus poecillus) (Dallas, 1851) (Hemiptera: Pentatomidae) in Guyana. Entomotropica. 2002;17(1):97-101. [ Links ]
Tafur J, Orozco F, Vergara R, Hoyos R. Efecto antialimentario de los extractos de suspensiones celulares de Azadirachta indica sobre Spodoptera frugiperda J. E. Smith en condiciones de laboratorio. Rev Fac Nal Agr. 2007;60(1):3703-3715. [ Links ]
Te-Chato S, Rungnoi O. Induction of somatic embryogenesis from leaves of Sadao Chang (Azadirachta excelsa (Jack) Jacobs). Sci Hort. 2000;86(4):311-321. Doi: http://dx.doi.org/10.1016/S0304-4238(00)00153-9. [ Links ]
Thomas T, Chaturvedi R. Endosperm culture: a novel method for triploid plant production. Plant Cell Tissue and Organ Cult. 2008;93(1):1-14. Doi: http://dx.doi.org/10.1007/s11240-008-9336-6. [ Links ]
Tripathi L, Tripathi J. Role of biotechnology in medicinal plants. Trop J Pharm Res. 2003; 2(2):243-253. Doi: http://dx.doi.org/10.4314/tjpr.v2i2.14607. [ Links ]
Vila S, Rey H, Mroginski L. Factors Affecting Somatic Embryogenesis Induction and Conversion in ''Paradise Tree'' (Melia azedarach L.). J Plant Growth Regul. 2007;26(1):268-277. Doi: http://dx.doi.org/10.1023/A:1027364427795. [ Links ]
Vila S, Rey H, Mroginski L. In Vitro plant regeneration of Melia azederach L.: shoot organogenesis from leaf explants. Biol Plantarum. 2003;47(1):13-19. [ Links ]
Vila S, Rey H, Mroginski L. Influence of genotype and explant source on direct organogenesis by in vitro culture of leaves of Melia azedarach L. Biocell. 2004;28(1):1-9. [ Links ]
Vila S, Rey H, Mroginski L. Plant regeneration, origin, and development of shoot buds from root segments of Melia azedarach L (Meliaceae) seedlings. In Vitro Cell Dev Biol Plant. 2005;41(6):746-751. Doi: http://dx.doi.org/10.1079/IVP2005692. [ Links ]
Vila S, Rey H, Mroginski L. Somatic embryogenesis and plant regeneration from inmature zygotic embryos of Melia azedarach (Meliaceae). In Vitro Cell Dev Biol Plant. 2003;39(3):283-287. Doi: http://dx.doi.org/10.1079/IVP2002377. [ Links ]
Vila S, Rey H, Mroginski L. Somatic embryogenesis and plant regeneration in Cedrela fissilis. Biol Plantarum. 2009;53(2):383-386. Doi: http://dx.doi.org/10.1007/s10535-009-0072-5. [ Links ]
Visser C, Qureshi J, Gill R, Saxena P. Morphoregulatory Role of Thidiazuron. Substitution of Auxin and Cytokinin Requirement for the Induction of Somatic Embryogenesis in Geranium Hypocotyl Cultures. Plant Physiol. 1992;99:1704-1707. Doi: http://dx.doi.org/10.1104/pp.99.4.1704. [ Links ]
Wen Su W, Hwang W, Young S, Sagawwa Y. Induction of somatic embryogenesis in Azadirachta indica. Plant Cell Tissue Organ Cult. 1997;50(1):91-95. Doi: http://dx.doi.org/10.1023/A:1005891113815. [ Links ]
Wewetzer A. Callus cultures of Azadirachta indica and their potential for the production of Azaridachtin. Phytoparasitica. 1998;26(1):7-52. Doi: http://dx.doi.org/10.1007/BF02981265. [ Links ]
Yang L, Wang J, Bian L, Li Y, Shen H. Cyclic secondary somatic embryogenesis and efficient plant regeneration in mountain ash (Sorbus pohuashanensis). Plant Cell Tissue Organ Cult. 2012;111(1):1-10. Doi: http://dx.doi.org/10.1007/s11240-012-0181-2. [ Links ]
Zaidi M, Narayan M, Sardana R, Taga I, Postel S, Johns R, Nulty M, Mao J, Loit E, Altosar I. Optimizing tissue culture media for efficient transformation of different indica rice genotypes. Agron Res. 2006;4(2):563-575. [ Links ]
Zhuang J, Jia X. Increasing differentiation frequencies in Wheat pollen callus. In: Cell and Tissue Culture Techniques for cereal crop improvement. Resp Inst Genet Acad Sinica Sci Press. 1983;453-459. [ Links ]