Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.20 no.2 Bogotá May/Aug. 2015
https://doi.org/10.15446/abc.v20n2.42307
Doi: http://dx.doi.org/10.15446/abc.v20n2.42307
Artículo de investigación
EVOLUCIÓN DE LA INTEGRIDAD ESTRUCTURAL DE ECOSISTEMAS LÓTICOS DEL PIEDEMONTE LLANERO FRENTE A LA INTERVENCIÓN ANTRÓPICA
Evolution of the Structural Integrity of Lotic Ecosystems in "Piedemonte Llanero" in Response to Antropogenic Action
Guillermo BRICEÑO VANEGAS1
1Programa de Ingeniería Ambiental y Sanitaria. Facultad de Ingeniería. Universidad de La Salle. Carrera 2° n° 10-70. Bogotá. Colombia.
For correspondence. gbricenov@unisalle.edu.co
Received: 26 February 2014; Returned for revision: 11 June 2014; Accepted: 23 October 2014.
Associate Editor: John Charles Donato.
Citation / Citar este artículo como: Briceño Vanegas G. Evolución de la integridad estructural de ecosistemas lóticos del piedemonte llanero frente a la intervención antrópica. Acta biol. Colomb. 2015;20(2):133-144. doi: http://dx.doi.org/10.15446/abc.v20n2.42307
RESUMEN
Entre los años 1993 y 2007 se determinó la evolución de la integridad ecológica de dos corrientes del piedemonte llanero del Meta, los caños Mateguadua y Caibe en proximidades a los municipios de Restrepo y Cumaral. Los parámetros analizados fueron la evolución del paisaje, el comportamiento de las variables fisicoquímicas, la calidad y oferta de hábitats acuáticos y la organización estructural de las comunidades ícticas. El paisaje experimentó un deterioro severo durante el periodo analizado de muestreo por causa de la deforestación del bosque de galería en ambas corrientes. El lavado y la erosión de los suelos aportaron una carga considerable de sólidos a las corrientes, produjeron sedimentación en el lecho de ambos caños, alteraron los patrones de profundidad y redujeron drásticamente la heterogeneidad espacial de los hábitats acuáticos. La estructura de la comunidad íctica experimentó alteraciones en respuesta al deterioro ambiental, como por ejemplo el progresivo reemplazamiento de especies insectívoras por especies algívoras y fitófagas y la dominancia de poblaciones de Hemigrammus barrigonae, especie que prosperó gracias al avance paulatino de colonias de microalgas y macrófitas en al agua por causa de la fragmentación del bosque de galería.
Palabras clave: bosque de galería, deforestación, fragmentación, caños.
ABSTRACT
From 1993 to 2007, was analyzed the evolution of the ecological integrity of two streams in the "piedmont" of Meta, the "caños" Mateguadua and Caibe near to Cumaral and Restrepo districts. The parameters analyzed were landscape evolution, physicochemical variables trends, quality and supply of aquatic habitats and the structural organization of fish communities. Landscape quality declined during the sampling period due to deforestation of gallery forests in both streams. Soil erosion process threw considerable amount of solids particles to streams, causing siltation in the bed of both streams. In fact, this condition affected depth patterns and spatial heterogeneity of aquatic habitats. Fish community structure showed changes in response to environmental degradation, such as the progressive replacement of insectivorous species by phytophagous and algivorous species and the dominance of populations of Hemigrammus barrigonae, a species that prospered on gradual progress of colonies of microalgae and macrophytes in the water due to the riparian forest fragmentation.
Keywords: deforestation, fragmentation, gallery forest, landscape, stream.
INTRODUCCIÓN
El piedemonte llanero colombiano es una franja geográfica que abarca una amplia gama de biomas a lo largo del borde este de la Cordillera Oriental, desde el alto Putumayo en el sur hasta la frontera con Venezuela en el norte. Su importancia estratégica radica en que comprende una zona de transición ecológica entre bosques montanos y sabanas de altillanura, abastecida por redes hídricas de drenaje de la vertiente oriental de la cordillera que generan suelos sedimentarios de una fertilidad superior a la de aquellos que se encuentran Orinoquía adentro (IGAC, 2003).
Por causa de su potencial productivo para el interés humano, los suelos, las formaciones vegetales naturales del piedemonte y, por ende, el recurso hídrico, han sufrido desde hace varias décadas un impacto ambiental considerable, causado en primera instancia por el avance de frentes de colonización y de ocupación de la tierra y, posteriormente, por la ampliación de terrenos adaptados para la agricultura y la ganadería extensivas (Van Ausdal, 2009).
La convergencia de todos estos factores históricos y geográficos produce un patrón complejo de causas que redundan en un uso desordenado del suelo y un desconocimiento de las potencialidades que ofrecen los ecosistemas del piedemonte llanero para ser aprovechados dentro de un criterio de sostenibilidad. Se hace preciso entonces realizar estudios científicos que permitan identificar y diagnosticar los principales problemas ambientales regionales en procura de proponer planes de uso y manejo adecuado de la inmensa riqueza de recursos naturales presentes en esta franja geográfica.
Dos de las herramientas de mayor sensibilidad, utilizadas para identificar cambios en la calidad ambiental y evaluar la integridad ecológica de los ecosistemas acuáticos regionales, son el estudio de la evolución del paisaje (Briceño et al., 1996; Flecker, 1997; Fraser et al., 1999; Bojsen y Barriga, 2002) y el análisis estructural de las comunidades ícticas (Angermeier y Karr, 1983; Allan y Flecker, 1993; Winemiller et al., 1996; Briceño et al., 1998; Winemiller et al., 2008).
El presente trabajo tuvo como principal propósito establecer en un periodo de 14 años la evolución de la integridad ecológica de dos corrientes típicas del piedemonte llanero del Meta, expuestas a un alto ritmo de transformación ecosistémica circundante ocasionada por diversas causas de origen antrópico.
MATERIALES Y MÉTODOS
Área de estudio
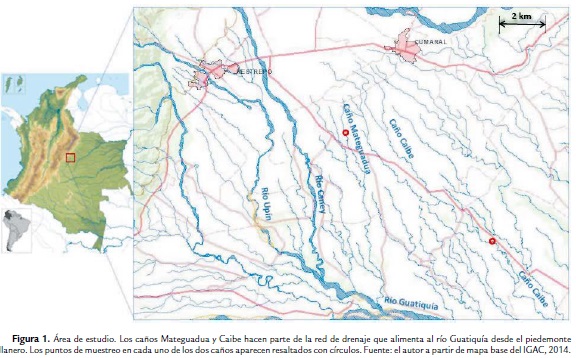
El área de estudio se ubica en el piedemonte llanero del Meta entre los municipios de Restrepo y Cumaral al este de Villavicencio. Su régimen climático obedece a un patrón bimodal con dos periodos de lluvias que alcanzan su pico máximo en abril y septiembre y una temperatura promedio anual de 26 °C. Entre estos dos municipios se advierte una red de drenaje de tipo paralelo (Twidale, 2004) compuesta por un sinnúmero de pequeñas corrientes o caños que drenan desde la vertiente de la Cordillera Oriental hacia el sureste en dirección del río Guatiquia, una de las corrientes componentes del sistema hídrico de la cuenca del río Meta (Fig. 1). Este trabajo se enfocó en la determinación del grado de intervención de dos de estas corrientes y de sus respectivas áreas de influencia: los caños Mateguadua y Caibe, que se trabajaron en los tramos referenciados por las coordenadas 4°14´36.25" N; 73°30´49.81" O y 4°11´25.14" N; 73°27´00.86" O, respectivamente y cuyas características ecológicas ya fueron registradas y analizadas en 1993 (Briceño et al., 1996).
Los caños Mateguadua y Caibe son corrientes que reúnen características geomórficas y ecológicas típicas del piedemonte que bañan áreas geográficas, otrora exuberantes de cobertura vegetal natural en su microcuenca y que se encuentran sometidas a presiones ambientales crecientes por causa de actividades humanas, tanto de subsistencia como de alta productividad económica.
Ambos caños nacen en la altillanura entre Restrepo y Cumaral y drenan en dirección sureste para desembocar en el río Guatiquía, entrelazándose a su paso con afluentes que producen un patrón hidrográfico reticulado, sometido a un régimen hidrológico bimodal, con cambios abruptos en la descarga por causa de la alta precipitación orogénica.
Estos ecosistemas lóticos presentan algunas diferencias fisiográficas entre sí. El caño Mateguadua es una pequeña corriente de agua cuyos bordes no siempre son definidos ya que fluye por pequeñas disecciones sobre terreno llano de poca pendiente, con abundante cobertura de gramíneas en sus márgenes, formando los llamados gramalotes, que pueden ser cubiertos eventualmente por el agua. A diferencia de este, el caño Caibe tiene mayor tamaño y por ende una mayor descarga. Además su curso es persistente, pues en algunos tramos de su recorrido está definido por márgenes de talud, con barrancos de algunos metros de altura que contienen los aluviones e impiden su desborde en época de máximas precipitaciones.
Las condiciones fisicoquímicas de estas corrientes varían de acuerdo al ritmo de disturbios locales repentinos como avenidas y retracciones de los cursos acuáticos. Además el régimen hidrológico regional produce en estos ecosistemas una estructura ecológica espacio-temporal predecible ante la repetición cíclica del ritmo anual de disturbios. (Briceño et al., 1996).
En estos ecosistemas lóticos, las comunidades acuáticas muestran una alta complejidad estructural como consecuencia de la elevada heterogeneidad del hábitat. Los ambientes de supervivencia para comunidades acuáticas producen una gama diversa de condiciones adaptativas que incrementan la biodiversidad de especies de peces. La regulación de parámetros ecológicos de la comunidad, tales como composición, abundancia, riqueza, ritmos de reproducción e ítems alimentarios, obedece a sutiles interrelaciones entre la producción y el consumo al interior de estos ecosistemas; y este equilibrio tan delicado se ve amenazado por factores de disturbio externo, normalmente asociados a presiones inusuales que las actividades humanas ejercen sobre los cursos acuáticos (Briceño et al., 1998).
En el área de influencia, la ocupación del suelo está dada por fincas con diferente propósito en la utilización de recursos naturales y materias primas. Predominan las fincas de pastizales para levante de ganado, haciendas agrícolas y casas de recreo que han modificado en mayor o menor grado los bosques marginales a los caños mencionados. La infraestructura vial se ha modernizado y las transformaciones del paisaje son evidentes. Existe un alto grado de intervención en las áreas naturales por un incremento de la actividad humana en la región, ya que actualmente esta zona del piedemonte constituye un corredor de tránsito obligado entre la zona andina y los departamentos del Casanare y Arauca.
Metodología
Se realizó un estudio de la integridad ecológica de los caños Mateguadua y Caibe con base en la evolución fisiográfica del paisaje, el monitoreo de las variables fisicoquímicas, la evaluación espacio temporal de los hábitats acuáticos y el análisis estructural de las comunidades ícticas. Se llevaron a cabo levantamientos de campo en los años 1993 y 2007 respectivamente, se examinaron parámetros fisicoquímicos e hidrobiológicos en los meses de febrero, abril, junio, septiembre y octubre, para abarcar los periodos correspondientes a las épocas secas y de lluvias para cada uno de los años de muestreo.
La evolución de la integridad del paisaje se analizó por medio de la detección de cambios en la estructura espacial con base en estudios de fotografía aérea del IGAC (vuelos C-2627 faja 7/1997 y C-2615 faja 2/1997) y levantamientos fisiográficos en cuatro tramos de 50 metros de cauce para cada caño con inclusión de las márgenes. En cada tramo, se trazaron 25 transectos paralelos transversales al cauce distanciados 2 metros entre sí. En cada transecto se hicieron perfiles batimétricos de la porción acuática, y topográficos en la porción terrestre con registros cada 50 cm según una modificación de la metodología propuesta por Kilpatrick y Barnes (1964). Los datos levantados en campo se graficaron en representaciones tridimensionales a escala utilizando el programa Surfer 8.0.
En cuanto a las variables fisicoquímicas, se hicieron muestreos in situ de temperatura, oxígeno disuelto, pH y conductividad eléctrica con un equipo multiparámetro YSI y se analizaron las concentraciones de CO2. NO2, NO3, NH4 y PO4 con un equipo AQUAMERCK portátil. Se calcularon los niveles de sólidos totales y disueltos en laboratorio por medio de marchas analíticas.
Adicionalmente se midió la oferta de hábitats en función del ciclo hidrológico utilizando el método de Gorman y Karr (1978) y el índice de ocupación espacio temporal de los mismos por parte de las especies ícticas con la fórmula de Morisita para determinar si hubo cambios interanuales en su calidad estructural.
En lo que respecta a la estructura de las comunidades ícticas, las muestras de peces se obtuvieron por un método de captura con atarraya de 0,5 cm de ojo de malla con un esfuerzo de captura de 30 lances por transecto de 100 metros y con muestreo dirigido a los diferentes tipo de hábitat identificados (Briceño et al., 1996). Los ejemplares colectados fueron determinados hasta el nivel de especie utilizando las claves taxonómicas de Eigenmann (1911, 1922), Schultz (1944), Sterba (1959), Gery (1964), Lowe-McConell (1987) y Mago-Leccia (1994). A partir de las capturas se midieron parámetros de la comunidad íctica como composición, abundancia relativa y riqueza y se hicieron estudios de ítems alimentarios de las especies más representativas en los muestreos, según los protocolos propuestos por Prejs y Colomine (1981) para contenidos estomacales.
El nivel de modificación causado por la intervención antrópica en cada tramo estudiado en los caños fue deducido a partir del registro de cambios en el paisaje, la modificación de la estructura de la comunidad íctica y la condición de integridad ecológica de los caños por medio de la comparación de los datos interanuales en el periodo de 14 años. Los datos se procesaron por medio de los programas BioDiversity Pro2.0, Past 2.17 y Surfer 8.0 y las pruebas estadísticas consistieron en análisis de similaridad de Bray-Curtis con ligamiento simple para muestras de ítems alimentarios en peces y el índice de Morisita para calcular el solapamiento de las especies de peces respecto al uso de hábitats con base en ocupación espacial (presencia ausencia en cada hábitat) y permanencia temporal (frecuencia de aparición diurna/nocturna).
RESULTADOS
Modificaciones del paisaje
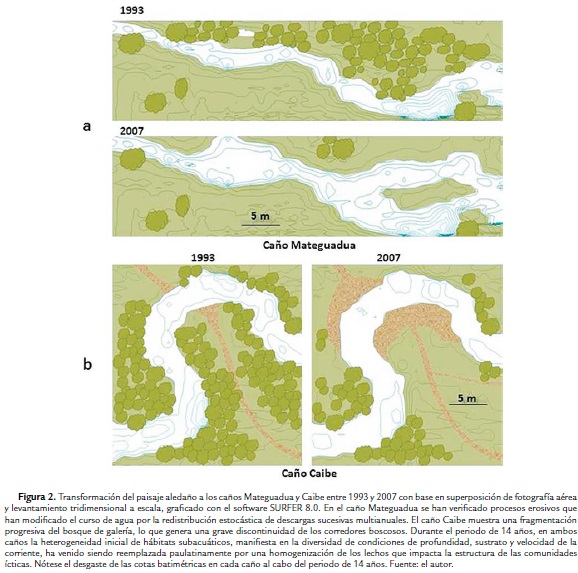
Uno de los cambios más dramáticos que se observa en la región del piedemonte llanero en general, es la progresiva fragmentación de bosques de galería que funcionan como corredores ecológicos de interconexión para los elementos faunísticos y surten de recursos energéticos las corrientes que bajan de la cordillera. En los caños Mateguadua y Caibe, este fenómeno se ha verificado de manera diferente.
En la década de los 90, el caño Mateguadua ya mostraba una alta intervención humana, sobre todo en lo concerniente al despeje de bosque ripario con fines de abrir espacio a actividades ganaderas y pecuarias. Durante el intervalo de 14 años tomado en el estudio, la pérdida paulatina de la poca vegetación arbórea remanente expuso el lecho del caño a una dinámica aluvial que diversificó y modificó el curso en diferentes tramos de varios metros de longitud (Fig. 2a). La acumulación y redistribución de material acarreado y depositado por las sucesivas descargas no pudo contenerse dentro de márgenes definidas, pues el agua aumentó en extensión y desbordó las márgenes cada vez más llanas, al tiempo que perdía profundidad. Como resultado de esta dinámica aluvial, manifiesta en tramos de decenas de metros, se amplió la superficie de agua expuesta a la incidencia directa de la radiación solar, lo que afectó colateralmente la estructura de la comunidad íctica como se discutirá posteriormente.
El caño Caibe experimentó cambios evidentes en el grado de transformación del paisaje, pero ciertamente de manera diferente a lo registrado para el caño Mateguadua, ya que por su mayor profundidad promedio y la presencia de taludes laterales de contención, el curso acuático no experimentó modificaciones hasta el momento. El principal problema de degradación ecológica de esta corriente radica en la deforestación marginal. Desde el muestreo de 1993 ya se notaba la apertura de brechas en el bosque de galería para permitir el acceso de ganado para abrevar en el caño. Catorce años después, estas brechas se ampliaron y esto causó la fragmentación total del bosque en tramos completos de varios metros a lo largo de su curso (Fig. 2b). Este deterioro desencadenó una serie de efectos adversos sobre la dinámica aluvial y la disposición espacial de hábitats en la corriente, lo que se pudo comprobar en la medición de todos los parámetros examinados en la estructura del hábitat y de las comunidades ícticas.
Variables fisicoquímicas
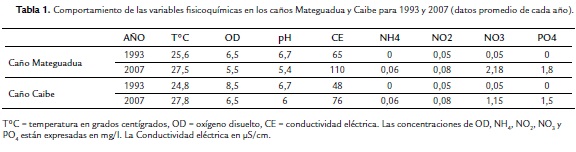
El comportamiento de las variables fisicoquímicas durante el periodo de muestreo permite corroborar que, en efecto, después de 14 años ha habido una fuerte modificación del ambiente físico en ambos caños representada en incremento notable de las fluctuaciones en la descarga media mensual y de sólidos totales en el agua, sobre todo para los meses de septiembre y octubre de cada uno de los años de muestreo. Sin embargo este fenómeno se presentó con más severidad en el caño Mateguadua que en el caño Caibe, lo que conllevó a alterar el trazado geográfico de su curso ante la imposibilidad de contener espacialmente eventos de descargas abruptas con su respectiva depositación progresiva.
Las condiciones químicas en general, si bien mostraron cambios evidentes con tendencias que se discutirán posteriormente, se mantienen dentro del rango de permisividad para la biota (Rodríguez-Olarte y Taphorn, 1995; Bistoni et al., 1999) (Tabla 1). Variables como el oxígeno disuelto, la temperatura y el pH, no mostraron condiciones restrictivas para la existencia de comunidades ícticas.
Las cargas de nutrientes fueron ligeramente más elevadas en el muestreo del 2007 en lo que respecta al nitrógeno y al fósforo. Aunque las variaciones no llegan a tener un efecto directo sobre las especies ícticas, sí lo hacen en cuanto a la consolidación de productores autóctonos oportunistas tales como comunidades de macrófitas y algas microscópicas, que suelen aprovechar el incremento de la radiación solar sobre el curso acuático ante el progresivo despeje de bosque de galería. Esta proliferación afecta indirectamente a las comunidades ícticas ya que modifica la proporción de ítems alimentarios contenidos en la oferta trófica.
Comunidades ícticas
La riqueza presente en ambas corrientes, medida para el periodo de muestreo, fue de 63 especies. Las 17 más representativas que tuvieron una presencia mensual constante fueron Astyanax bimaculatus, Bryconops caudomaculatus, Characidium fasciatum, Creagrutus hildebrandi, Hemigrammus barrigonae, Hoplias malabaricus, Xenagoniates bondi, Chaetostoma brevis, Hemicetopsis minutus, Heptapterus stwarti, Eigenmannia virescens, Aequidens mariae, Apistograma ortmanni, Hypostomus plecostomus, Ancistrus trirradiatus, Curimata elegans y Cochliodon plecostomoides.
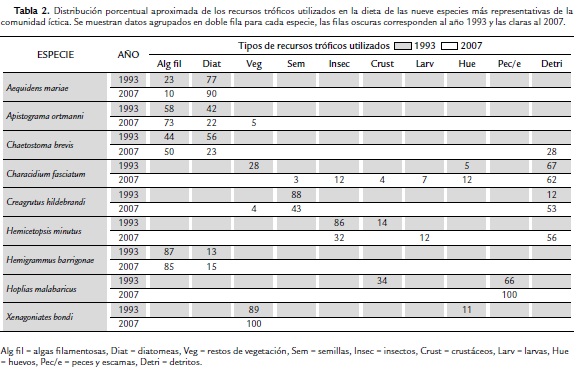
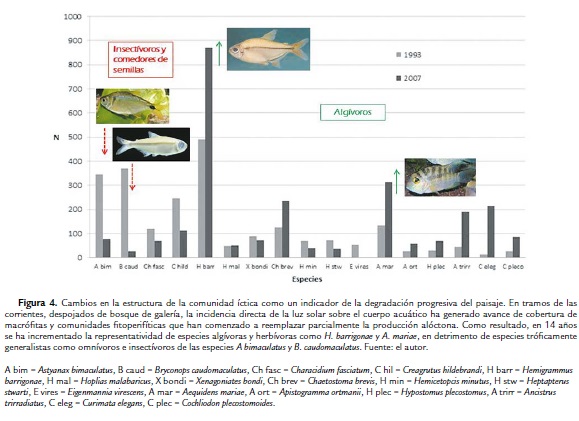
Para el año 1993 las especies más abundantes en los dos caños fueron H. barrigonae, A. bimaculatus y B. caudomaculatus. Para el 2007, con excepción de H. barrigonae que casi duplicó su presencia en ambas corrientes, la dominancia específica se modificó. Las especies más representativas fueron A. mariae, Ch. brevis, C. elegans y A. trirradiatus. Como se verá más adelante, este patrón de reemplazamiento parece estar relacionado con la redistribución de la oferta de hábitats y de recursos alimenticios en las dos corrientes entre 1993 y 2007.
En este periodo de tiempo no hubo modificación de hábitos alimenticios de las especies más representativas y la especialización en el uso de recursos tróficos se mantuvo. Es normal que en diferentes épocas del año se presenten cambios predecibles en la intensidad del uso de recursos tróficos por parte de algunas especies generalistas cuyo alimento favorito puede escasear, ya que la oferta mensual está sujeta a la dinámica hidrológica y al intercambio energético entre el curso acuático y los ecosistemas terrestres adyacentes (Briceño, 1994; Briceño et al., 1998). Sin embargo, a pesar de estas variaciones mensuales predecibles, no se verificaron cambios drásticos en la vocación específica de cada especie en cuanto al uso del recurso trófico entre años (Tabla 2).
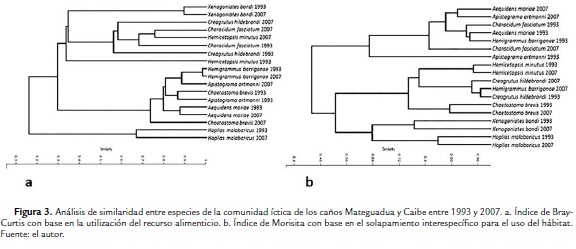
En la figura 3 se puede apreciar la reconfiguración de la estructura de la comunidad íctica después de 14 años, en función de los hábitos alimenticios y de la utilización de los hábitats. De acuerdo al uso del recurso trófico (Fig 3a) se pueden apreciar dos grandes grupos de especies: el primero conformado por especies comedoras de material alóctono como semillas, insectos, frutos y hojas y el segundo compuesto por comedores de material autóctono como microalgas filamentosas, diatomeas y macrófitas acuáticas. Los dos grupos están totalmente separados de la especie H. malabaricus, que es el principal depredador en estos ambientes acuáticos. Especies como B. caudomaculatus y C. hildebrandi mantuvieron su vocación de comedoras de insectos, pero no aparecen en la gráfica por la reducción drástica de su abundancia relativa en el 2007. En cuanto al uso y discriminación del espacio, la mayoría de especies de la comunidad mantuvieron una explotación espaciotemporal que no mostró variaciones notables entre años, más allá de los mínimos ajustes adaptativos por tener que compartir los mismos hábitats con distinto grado de solapamiento. En la figura 3b, parte superior, se puede observar que las especies usualmente presentes en hábitats de macrófitas y vegetación marginal como A. ortmanni, A. mariae y Ch. fasciatum, aparecen agrupadas aparte de las que frecuentan los regadales y el canal principal. En este último grupo se resalta la permanencia constante de H. malabaricus como principal depredador en el hábitat de pozos.
Como se puede apreciar con claridad en la figura 4, a pesar de que un buen número de especies encabezadas por H. malabaricus, mostraron abundancias constantes durante 14 años, se presentó un caso que llama poderosamente la atención: H. barrigonae, una especie de carácido, de no más de unos 6 cm, que come preferencialmente microalgas y eventualmente detritos, proliferó de manera general en 14 años e incrementó su dominancia sobre el resto de especies en ambos caños pero sobre todo en el Mateguadua. Este hecho, aparentemente aislado, representa ni más ni menos, uno de los indicadores más potentes que pone en evidencia la magnitud de los procesos degradativos que está experimentando el paisaje.
La abrumadora dominancia numérica de H. barrigonae, puede explicarse por el hecho de que la frecuencia y distribución espacial de algunos tipos de hábitats se reconfiguraron en 14 años; se redujo en general la profundidad y por ende la oferta de pozos en favor de la ampliación del canal principal y de la proliferación de regadales, propicios para el florecimiento de macrófitas acuáticas y de comunidades fitoperifíticas. En estas condiciones, las poblaciones de H barrigonae prosperaron gracias a la colonización de nuevos espacios donde, además, por la eliminación del bosque ripario, puede disponer de colonias algales cada vez más prolíficas por la incidencia directa de la luz solar.
DISCUSIÓN
En un periodo de 14 años los dos caños evidenciaron una pérdida de integridad ecológica por procesos degradativos, tanto en el paisaje de los ecosistemas terrestres contiguos, como en los hábitats asociados a los cursos acuáticos. Los indicadores de esta pérdida en la calidad ecológica pueden resumirse en cuatro aspectos principales: 1) fragmentación de los bosques de galería y denudación de los suelos próximos a la interfase acuática, 2) alteraciones del ambiente fisicoquímico provocadas por aumento en el acarreo de sedimentos debido a actividades humanas en la cuenca, 3) redistribución de la oferta de hábitats en los caños y disminución de la heterogeneidad espacial subacuática, 4) reconfiguración de la estructura de las comunidades ícticas en lo que respecta a dominancia específica y a la utilización del espacio acuático.
En primer término, la fragmentación del bosque de galería se ha debido al ensanchamiento de brechas para abrir caminos y playones de abrevaderos para ganado. Con los años, estas brechas se han ampliado en detrimento de la cobertura vegetal arbórea hasta convertir grandes extensiones de bosques de galería en potreros para ganadería y cultivos agrícolas. Este fenómeno se verificó sobre todo en el caño Caibe, que 14 años atrás contaba con grandes manchas de bosque, a diferencia del Mateguadua que por entonces ya mostraba riberas desarboladas aunque conservaba manchas de bosque relictual, aisladas por potreros con gran distancia entre ellas.
Como resultado, la definición de la línea de ribera del Mateguadua es difusa, presentándose modificaciones en el trazado del curso de agua, lo que impide amortiguar las descargas repentinas causadas por efecto de precipitaciones súbitas al igual que se ha reportado para corrientes de otras latitudes (Friedman et al., 1996). El desborde de estos aluviones altera localmente el paisaje, por cuanto al llegar las épocas secas los sedimentos depositados en las márgenes influyen sobre la profundidad y velocidad de la corriente, redireccionando el flujo. Adicionalmente, la granulometría del sustrato se reduce pues el canto rodado que fungía como lecho va siendo cubierto por sedimento de grano fino acarreado por los torrentes en épocas sucesivas de lluvias (Lisenby et al., 2014). Esto hace que se produzcan fluctuaciones bruscas entre valores extremos de velocidad de corriente en periodos muy cortos de tiempo (Briceño et al., 1996).
En el caño Caibe la situación es un poco diferente, pues esta corriente esta encausada entre márgenes de taludes que regulan su descarga y este tipo de morfología hace que su posible desborde sea un evento realmente raro (Wohl y Merritt, 2008). Sin embargo, la deforestación ha ocasionado el lavado de suelos y el arrastre resultante de sedimentos a la corriente principal ha reducido drásticamente la heterogeneidad del hábitat.
Un segundo indicador lo constituye el comportamiento de las variables fisicoquímicas (Tabla 1). Aunque variables como el oxígeno disuelto y el pH se mantienen en rangos permisivos para la biota, los valores promedio mensuales se redujeron. En el caso del oxígeno por la descarga de materia orgánica al agua como producto de los escombros de tala y del arribazón de material vegetal desprendido del bosque, que al descomponerse incrementa la DBO, y en el caso del pH por el aporte al agua de taninos ácidos derivados del material orgánico alóctono procedente del suelo colindante.
La temperatura del agua mostró un incremento entre los años muestreados, pero este ascenso fue mucho más significativo en el Caibe por el aumento de la radiación solar que en algunos tramos incide directamente sobre el curso acuático ante la tala del bosque marginal que anteriormente proveía sombra sobre el canal principal.
Los niveles de nitrógeno y fósforo fueron mucho más altos en el 2007 que en 1993. Esto demostró el efecto acumulativo de las sucesivas entradas de estos elementos provenientes de los abonos naturales y fertilizantes químicos utilizados en actividades de agricultura y ganadería y por los aportes orgánicos de las excretas y los desechos. El acarreo de sedimentos en el agua se incrementó en ambos caños. Tanto la profundidad como la heterogeneidad espacial se redujeron por las capas de sedimentos depositados año tras año en el lecho.
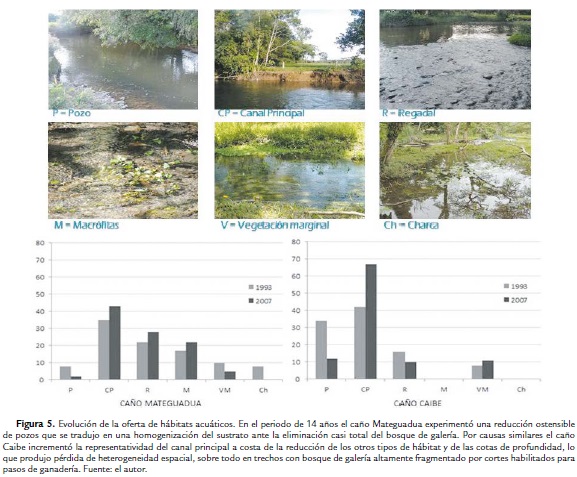
En tercer lugar, la modificación de ambientes subacuáticos y la redistribución resultante de los hábitats disponibles fueron la muestra más elocuente del proceso degradativo que se presenta en estos ecosistemas lóticos del piedemonte llanero del Meta. En el caño Mateguadua en 1993, la diversidad de hábitats acuáticos era alta, encontrándose por entonces hábitats de corriente principal, pozos, regadales, macrófitas, gramalotes y charcas (Fig. 5). En los muestreos realizados durante el año 2007 se encontró que, si bien se mantienen descriptivamente la mayoría de hábitats, su oferta para el asentamiento de las comunidades ícticas y su arreglo espacio-temporal se han modificado ostensiblemente, sobre todo en lo que respecta a la disponibilidad de pozos profundos con poca corriente, ideales para la reproducción y alimentación de algunas especies de carácidos.
El cambio en la oferta de hábitats se ha experimentado en una forma aún más dramática en el caño Caibe, en donde, a lo largo de 14 años se ha producido una fuerte intervención antrópica que ha comenzado a producir homogenización de las condiciones espacio-temporales de los hábitats acuáticos, por razones ya discutidas. El ritmo sostenido de estas intervenciones ha modificado el patrón de hábitats en parches que se verificaba en esta corriente en 1993 (Briceño et al., 1996), lo cual pone en riesgo la estabilidad estructural de las comunidades ícticas. Por ejemplo, la profundidad promedio de los pozos se ha reducido y la variabilidad en los tipos de sustrato también.
Bien es sabido que una reducción en la heterogeneidad espacial de microhábitats es un serio disturbio que redunda en primera instancia en una reacomodación de la estructura de comunidades y posteriormente en la disminución de la riqueza íctica (Angermeier y Schlosser, 1989). La β-diversidad es el garante estructural de la diversidad de especies. Por lógica conclusión, de prevalecer las tendencias en la homogenización espacial no se mantendrá la estructura ecológica, pues la desactivación de hábitats es uno de los síntomas de pérdida de la integridad de los ecosistemas, que suele preceder a la pérdida de especies a escala regional (Angermeier y Karr, 1983; Bojsen y Barriga, 2002).
Finalmente se pone de presente la importancia de utilizar la estructura de las comunidades ícticas como una herramienta de alta sensibilidad para "leer" los ritmos de cambio ambiental y las modificaciones en la integridad ecológica del paisaje, por sutiles que sean. Trabajos recientes han mostrado que la presencia de vegetación marginal en los cuerpos acuáticos está asociada a un incremento de la riqueza y la abundancia de especies ícticas (Abes y Agostinho, 2001).
El caso del incremento poblacional y dispersión espacial de H. barrigonae, una especie comedora de microalgas, a expensas de la reducción poblacional de otras que se alimentan principalmente de insectos como A. bimaculatus, B. caudomaculatus y C. hildebrandi, parece significar el cambio de mecanismo de entradas de energía, pues la producción alóctona que antes era el principal sustento de la comunidad comienza a ser menos evidente frente a la producción autóctona. Esta reacomodación solo tiene sentido como respuesta a la deforestación, pues ante la eliminación de árboles cuyas ramas y follaje antes dejaban caer sus aportes tróficos al agua, la supresión de este recurso limita a las especies ícticas insectívoras. Esta tendencia ha sido confirmada en otros trabajos en la Amazonía ecuatoriana y en pequeñas corrientes del piedemonte del Casanare (Bojsen y Barriga, 2002; Zamudio et al., 2008). Por otra parte, como ya se acotó con anterioridad, la reducción de la profundidad promedio de los caños y la entrada de luz plena sobre el agua, son dos factores que favorecen el asentamiento de comunidades de macrófitas y microalgas perifíticas en donde medran las poblaciones de H. barrigonae, y otras especies de hábitos similares como A. mariae, A. ortmanni, Ch brevis, todas ellas controladas solo por los mecanismos de depredación de H. malabaricus como coinciden otros autores (Winemiller y Jepsen, 1998; Fraser et al., 1999).
En síntesis, para evaluar el impacto generado por actividades antrópicas sobre los ecosistemas lóticos y sus bosques de galería, se hace necesario revisar a diferentes escalas la jerarquía espacial del patrón de hábitats, pues este no depende solo de factores geomorfológicos del paisaje, sino también de aspectos geográficos particulares y de modificaciones puntuales en tramos de centenas e incluso decenas de metros. Algunos autores, por ejemplo, sostienen que la riqueza y diversidad de la comunidad íctica en los ríos no está relacionada directamente con la cobertura de bosques riparios sino con la anchura del canal, la profundidad y el caudal (Angermeier y Karr, 1983; Bojsen y Barriga, 2002; Hoeinghaus et al., 2004) mientras que otros investigadores afirman que la heterogeneidad espacial y la cobertura de bosques de galería, en corrientes como las del piedemonte llanero colombiano, produce un incremento de la riqueza y diversidad ícticas ya que obedece a un ordenamiento discontinuo de hábitats en mosaico y no a un continuo longitudinal como acontece con otros ríos que descienden desde un gradiente altitudinal. (Briceño et al., 1996; Flecker, 1997; Winemiller y Jepsen, 1998).
El otro aspecto que es crucial interpretar para comprender la respuesta de estos ecosistemas frente a alteraciones por actividades humanas es la resiliencia, es decir, la capacidad del sistema para recuperarse de un impacto en particular o de un régimen de disturbios en general. Aunque puede parecer lógico suponer que la riqueza y la diversidad de especies disminuyen con proporcionalidad inversa a medida que aumenta la dimensión y frecuencia de los disturbios, algunos autores han encontrado que la comunidad íctica no alcanza sus máximos valores de riqueza y diversidad en ambientes carentes de disturbios sino en ambientes con un régimen intermedio de los mismos (Wright y Flecker, 2004; Allan et al., 2006). Al parecer, las biocenosis requieren de ciertos factores ambientales que tensionen las relaciones inter específicas para mejorar su desempeño adaptativo como comunidad y por consiguiente las tendencias extremas, ya sea de máximo nivel de disturbios o de ausencia de los mismos, conllevan a la disminución de la riqueza y la diversidad. La información recogida y presentada en este artículo no permite establecer conclusiones claras a este respecto.
Los tipos de impacto antrópico en las áreas de piedemonte y su efecto sobre la biodiversidad han sido investigados en corrientes de Venezuela (Winemiller et al, 1996; Hoeinghaus et al., 2004; Allan et al., 2006, Allan et al. 2012), Colombia (Briceño et al., 1998; Ricaurte et al., 2012), Panamá (Angermeier y Karr, 1983), Argentina (Bistoni et al. 1999), Trinidad (Fraser et al. 1999), Brasil (Abes y Agostinho, 2001), Ecuador (Bogsen y Barriga, 2002), Estados Unidos (Freeman y Marcinek, 2006; Utz et al., 2010) y en una amplia gama de corrientes tropicales (Wohl 2006; Xin et al., en prensa, 2014). Las causas de estos impactos son muy variadas: urbanización de las cuencas, deforestación, desbalance por mal manejo del recurso hídrico, sedimentación, contaminación del agua por actividades domésticas y agropecuarias y fragmentación de los bosques (Winemiller et al., 1996; Allan et al., 2006; Freeman y Macinek, 2006; Utz et al., 2010). La ocurrencia de estos impactos sobre los caños del piedemonte llanero obedece a un patrón causal complejo. No existe un consenso general entre investigadores en cuanto a la interpretación de los efectos que estos impactos tienen sobre los diferentes compartimientos de los ecosistemas. Aunque algunos autores han propuesto estrategias de conservación en corrientes acuáticas similares a los estudiados en este artículo (Allan y Flecker, 1993; Barletta et al., 2010), los trabajos desarrollados hasta ahora en esta franja geográfica resultan insuficientes para determinar una estrategia que permita ejecutar planes de recuperación de los ecosistemas acuáticos y restauración de los bosques. Se hace necesario acopiar mucha más información encaminada a enriquecer bases de datos y usar técnicas de SIG para mejorar la cobertura y calidad del conocimiento ecológico sobre la región.
CONCLUSIONES
Los caños Mateguadua y Caibe, dos de las corrientes representativas del piedemonte llanero del Meta, están experimentando cambios estructurales y funcionales acelerados como respuesta a la intervención humana en la región. La principal causa de estos cambios es el desmonte del bosque de galería y la denudación consecuente de los suelos ribereños. La estabilidad estructural del hábitat y de las comunidades ícticas se ha puesto en riesgo por el ritmo de degradación ambiental de las subcuencas.
La heterogeneidad ambiental propia de los caños llaneros, ha comenzado a verse mermada en las corrientes Mateguadua y Caibe ante la progresiva uniformidad que provoca la sedimentación. La reducción de la heterogeneidad espacial puede tomarse como pérdida paulatina de integridad ecológica en el paisaje. El deterioro ambiental del bosque de galería asociado a las corrientes altera la oferta de hábitat y la reacomodación de la comunidad íctica resultante puede llegar a suponer serios desequilibrios en las cadenas tróficas y en el balance de materiales, pues las especies terminan forzando una adaptación antinatural al filo de arriesgar su persistencia en el ecosistema.
Como se desconoce el grado de resiliencia que estos ecosistemas tienen frente a disturbios de esta magnitud, no se sabe si estos puedan retornar a condiciones de equilibrio con el manejo adecuado de cuencas, pero valdría la pena establecer programas locales de restauración del bosque nativo por medio de estrategias como conservación del bosque de galería remanente y revegetalización estratégica.
AGRADECIMIENTOS
El autor desea expresar sus agradecimientos a la Universidad de La Salle por el apoyo logístico en el préstamo de los laboratorios de Ingeniería Ambiental para el análisis de las muestras tomadas en el año 2007, así como también al Museo de La Salle por el acceso a la división de colecciones ícticas en donde se identificó y catalogó el material biológico. Al profesor Germán Galvis Vergara de la Universidad Nacional de Colombia por el acompañamiento en los muestreos de campo desarrollados durante el año 1993 y a la bióloga Carolina Gallego Herrera por la cesión de parte del material fotográfico y la revisión y corrección del primer manuscrito del presente artículo.
REFERENCIAS
Abes S, Agostinho A. Spatial patterns in fish distributions and structure of the ichthyocenosis in the Água Nanci stream, upper Paraná River Basin, Brazil. Hydrobiologia. 2001;445(1-3):217-227. Doi: 10.1023/A:1017538720502. [ Links ]
Allan JD, Brenner AJ, Erazo J, Fernandez L., Flecker AS, Karwan DL, et al. Land use in watersheds of the Venezuelan Andes: a comparative analysis. Conserv Biol. 2012;16(2):527-538. Doi: 10.1046/j.1523-1739.2002.02301.x. [ Links ]
Allan JD, Flecker AS, Segnini S, Taphorn DC, Sokol E, Kling GW. Limnology of Andean piedmont rivers of Venezuela. J N Am Benthol Soc. 2006;25(1):66-81. Doi: http://dx.doi.org/10.1899/08873593(2006)25[66:LOAPRO]2.0.CO;2. [ Links ]
Allan JD, Flecker AS. Biodiversity conservation in running waters. BioScience. 1993;43(1):32-43. Doi: 10.2307/1312104. [ Links ]
Angermeier P, Karr JR. Fish communities along environmental gradients in a system of tropical streams. En: Zaret T, editors. Evolutionary ecology of neotropical freshwater fishes Environ Biol Fish. 1983;9:117-135. Doi: 10.1007/978-94-015-7682-6_3. [ Links ]
Angermeier P, Schlosser IJ. Species-area relationship for stream fishes. Ecology 1989;70(5):1450-1462. Doi: http://dx.doi.org/10.2307/1938204. [ Links ]
Barletta M, Jaureguizar AJ, Baigun C, Fontoura NF, Agostinho AA, Almeida-Val VMF, et al. Fish and aquatic habitat conservation in South America: a continental overview with emphasis on neotropical systems. J Fish Biol. 2010;76:2118-2176. Doi: 10.1111/j.10958649.2010.02684.x. [ Links ]
Bistoni MA, Hued A, VIdela M, Sagretti L. Efectos de la calidad del agua sobre las comunidades ícticas de la región central de Argentina. Revista Chilena de Historia Natural, 1999;72:325-335. [ Links ]
Bojsen B, Barriga R. Effects of deforestation on fish community structure in Ecuadorian Amazon Streams. Freshw Biol. 2002;47(11):2246-2260. Doi: 10.1046/j.1365-2427.2002.00956.x. [ Links ]
Briceño G. Distribución espacial de la comunidad íctica como respuesta a la oferta alimenticia en un caño del piedemonte llanero. Diógenes. 1994;1(2):151-166. [ Links ]
Briceño G, Galvis G, Guillot G. Dinámica ecológica de las comunidades ícticas de tres sistemas lóticos del piedemonte llanero. Diógenes. 1998;5(1):17-41. [ Links ]
Briceño G, Galvis G, Guillot G. Descripción espacio-temporal de la oferta de coriotopos y caracterización fisicoquímica de tres sistemas lóticos del piedemonte llanero. Diógenes. 1996;3(1):41-62. [ Links ]
Eigenmann C H. The freshwater fishes of British Guyana. 1911. Limnaeus press. Amsterdam; Reprint 1977. 578 p. [ Links ]
Eigenmann C H. 1922. The fishes of western South America. Limnaeus press. Amsterdam; Reprint 1976. 348 p. [ Links ]
Flecker A. Habitat modification by tropical fishes: environmental heterogeneity and the variability of interaction strength. J N Am Benthol Soc. 1997;16(1):286- 295. URL: http://www.jstor.org/stable/1468258. [ Links ]
Fraser D, Gilliam J, MacGowan M, Arcaro M, Guillozet H. Habitat quality in a hostile river corridor. Ecology. 1999;80(2):597-607. Doi: http://dx.doi.org/10.1890/0012-9658%281999%29080%5b0597:HQIAHR%5d2.0.CO;2. [ Links ]
Freeman M, Marcinek P. Fish assemblage responses to water withdrawals and water supply reservoirs in piedmont streams. Environ Manage. 2006;38(3):435-450. Doi: 10.1007/s00267-005-0169-3. [ Links ]
Friedman J M, Osterkamp W R, Lewis W M. The role of vegetation and bed-level fluctuations in the process of channel narrowing. Geomorphology, 1996;14(4):341-351. Doi:10.1016/0169-555X(95)00047-9. [ Links ]
Gery J. Characoids of the world. Neptuno, N. J: TFH Public. 1964. 672 p. [ Links ]
Gorman OT, Karr JR. Habitat structure and stream fish communities. Ecology. 1978:59(3):507-515. URL: http://www.jstor.org/stable/1936581. [ Links ]
Hoeinghaus D, Winemiller K, Taphorn D. Compositional change in fish assemblages along the Andean piedmont - Llanos floodplain gradient of the río Portuguesa, Venezuela. Neotrop. Ichthyol. 2004;2(2):85-92. Doi: http://dx.doi.org/10.1590/S1679-62252004000200005. [ Links ]
Kilpatrick F A, Barnes, H H. Channel geometry of Piedmont streams as related to frequency of floods. US Government Printing Office. 1964. 15 p. [ Links ]
Lisenby P E, Slattery M C, Wasklewicz T A. Morphological organization of a steep, tropical headwater stream: The aspect of channel bifurcation. Geomorphology, 2014;214:245-260. Doi:10.1016/j.geomorph.2014.02.009. [ Links ]
Lowe-McConell R H. Ecological studies in tropical fish communities. Londres. Cambridge University press. 1987. 382 p. [ Links ]
Mago-Leccia F. Electric Fishes of the continental waters of America. Fudeci. Caracas; 1994. 207 p. [ Links ]
Mapa de suelos de Colombia. Escala 1:500000. Memoria explicativa. Instituto Geográfico Agustín Codazzi. IGAC. 2003. [ Links ]
Prejs A, Colomine G. Métodos para el estudio de los alimentos y las relaciones tróficas de los peces. U. Central de Venezuela/U. de Varsovia. Caracas; 1981. 129p. [ Links ]
Ricaurte LF, Jokela J, Siqueira A, Núñez-Avellaneda M, Marin C, Velázquez-Valencia A, et al. Wetland habitat diversity in the Amazonian Piedmont of Colombia. Wetlands. 2012;32(6):1189-1202. Doi: 10.1007/s13157-0120348-y. [ Links ]
Rodríguez-Olarte D, Taphorn D. Los peces como indicadores biológicos: aplicación del índice de integridad biótica en ambientes acuáticos de los llanos occidentales de Venezuela. Biollania 1995;(11):27-41. [ Links ]
Schultz LP. The catfishes of Venezuela with descriptions of thirty eight new-forms. Smithsonian Institution, Washington D.C; 1944. p. 173-338. [ Links ]
Sterba G. Freshwater fishes of the world. Ucrania-Verlag. Leipzig-Jena; 1959. 867 p. [ Links ]
Twidale CR. River patterns and their meaning. Earth Sci Rev. 2004;67:159-218. Doi:10.1016/j.earscirev.2004.03.001. [ Links ]
Utz RM, Hilderbrand RH, Raesly RL. Regional differences in patterns of fish species loss with changing land use. Biol Conserv. 2010;143(3):688-699. Doi:10.1016/j.biocon.2009.12.006. [ Links ]
Van Ausdal S. Pasture, profit, and power: An environmental history of cattle ranching in Colombia, 1850-1950. Geoforum. 2009;40:707-719. Doi:10.1016/j.geoforum.2008.09.012. [ Links ]
Winemiller K, Agostinho A, Pellegrini E. Fish Ecology in Tropical Streams. In: Dudgeon D, editors. Tropical stream ecology. San Diego, CA. Elsevier Inc. 2008. p 107-146. [ Links ]
Winemiller KO, Jepsen DB. Effects of seasonality and fish movement on tropical river food webs. J Fish Biol. 1998;53(Supplement A):267-296. Doi: 10.1111/j.10958649.1998.tb01032.x. [ Links ]
Winemiller KO, Marrero C, Taphorn D. Perturbaciones causadas por el hombre a las poblaciones de peces de los llanos y del piedemonte Andino de Venezuela. Biollania Guanare. 1996;12:13-48. [ Links ]
Wohl E, Merritt DM. Reach-scale channel geometry of mountain streams. Geomorphology. 2008;93(3):168-185. Doi:10.1016/j.geomorph.2007.02.014. [ Links ]
Wohl E. Human impacts to mountain streams. Geomorphology. 2006;79:217-248. Doi:10.1016/j.geomorph.2006.06.020. [ Links ]
Wright JP, Flecker AS. Deforesting the riverscape: the effects of wood on fish diversity in a Venezuelan piedmont stream. Biol Conserv. 2004;120:439-447. Doi:10.1016/j.biocon.2004.02.022. [ Links ]
Xin G, Yuan Z, Sen D, Rui Z, Wei M. Response of fish communities to environmental changes in an agriculturally dominated watershed (Liao River Basin) in northeastern China. Ecological Engineering. In press. 2014. Doi:10.1016/j.ecoleng.2014.04.019. [ Links ]
Zamudio J, Urbano-Bonilla A, Maldonado-Ocampo JA, Bogota-Gregory JA, Cortes-Millan GA. Hábitos alimentarios de diez especies de peces del piedemonte del departamento del Casanare, Colombia. Rev Asoc Colomb Ictiol. 2008;10: 43-55. [ Links ]