Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.20 no.2 Bogotá May/Aug. 2015
https://doi.org/10.15446/abc.v20n2.4525
Doi: http://dx.doi.org/10.15446/abc.v20n2.4525
Artículo de investigación
ELECTROBIORREMEDIACIÓN DE UN SUELO CON UNA CONTAMINACIÓN ANTIGUA DE HIDROCARBURO
Electrobiorremediation of a Soil with an Old Hydrocarbon Contamination
Maite Soledad BAZTAN1, Oscar Héctor PUCCI1, Graciela Natalia PUCCI1.
1Centro de Estudios e Investigación en Microbiología Aplicada (CEIMA). Universidad Nacional de la Patagonia San Juan Bosco (UNPSJB). Ciudad Universitaria ruta pcial N1, km 4. Comodoro Rivadavia, Argentina.
For correspondence. granapu@unpata.edu.ar
Received: 28 August 2014; Returned for revision: 8 November 2014; Accepted: 12 December 2014.
Associate Editor: Susana Raquel Feldman.
Citation / Citar este artículo como: Baztan MS, Pucci OH, Pucci GN. Electrobiorremediación de un suelo con una contaminación antigua de hidrocarburo. Acta biol. Colomb. 2015;20(2):145-152. doi: http://dx.doi.org/10.15446/abc.v20n2.45257
RESUMEN
La electrobiorremediación es la técnica híbrida que suma los efectos de la electrorremediación a la degradación bacteriana de diferentes contaminantes. El objetivo de este estudio fue utilizar esta técnica para aumentar la biodisponibilidad de los hidrocarburos presentes en un suelo con contaminación antigua y su eliminación. El experimento duró 63 días y se realizó en una cuba de vidrio con tres compartimentos comunicados por puentes salinos de buffer fosfato que permitieron establecer la diferencia de voltaje y mantener el pH del suelo en valores óptimos para la vida bacteriana. Se determinaron: pH, humedad, hidrocarburos totales del petróleo (TPH) y bacterias. Los resultados mostraron una disminución de los hidrocarburos siendo la región del cátodo la que mejor eliminó los hidrocarburos, con solo el 9,4 % y 5,46 % de los hidrocarburos alcanos y poliaromáticos; en la celda control estos valores fueron del 15,28 y 14,4 % respectivamente, mientras que el centro fue el lugar que menor degradación presentó quedando el 19,49 % y el 17,88 % de los hidrocarburos alcanos y PAH. Concluimos que los resultados de laboratorio indican la posibilidad de incrementar la biodegradación en suelos con tratamientos biológicos previos.
Palabras claves: contaminación con hidrocarburos, electrobiorremediación.
ABSTRACT
Electrobioremediation (EKB) is a hybrid technique that combines bioremediation with electrokinetics. EKB uses bioremediation to degrade hydrocarbon contaminants and EK to mobilize them. The aim of this study was to use a technique for increasing the bioavailability of the hydrocarbons in soil pollution. The 63-day experiment was conducted in a three compartment glass vial connected by three salt bridges of phosphate buffer that established a voltage difference and maintained soil pH optimum for bacterial life value. pH, moisture, total petroleum hydrocarbons (TPH) and bacteria were determined. The results showed a decrease in hydrocarbon, the best results were close to the cathode, where only 9.4 % and 5.46 % of alkanes and polyaromatic hydrocarbons were left. In the control cell these values were 15.28 and 14.4 % respectively, while the center generated less degradation with 19.49 % and 17.88% of alkanes and PAH hydrocarbons left. We conclude that the results from the laboratory study indicated that this technique gives the possibility of increasing biodegradation in soils with previous biological treatments.
Keywords: electrobioremediation (EKB), oil contaminated soil.
INTRODUCCIÓN
El desarrollo tecnológico de la vida actual hace que la necesidad de utilizar hidrocarburos crezca día a día. Como toda industria, la industria extractiva de hidrocarburo genera residuos y contaminaciones accidentales, también los cambios en las legislaciones ambientales, hacen que se deban tratar sitios con contaminaciones antiguas. La ciudad de Comodoro Rivadavia y sus alrededores, se encuentran dentro de una de las cuencas petroleras más extensas e importantes de Argentina, la Cuenca del Golfo San Jorge. Esto llevó a que el desarrollo económico y social de la ciudad se fundara principalmente, en la actividad hidrocarburífera (Rojo y Rotondo, 2007). El progreso y la necesidad de generar nuevos ingresos en muy poco tiempo, produjo un deterioro ambiental difícil de contrarrestar, dejando pasivos ambientales, en toda la región de la Cuenca.
La biodegradación se utiliza en la región con buenos resultados tanto en la utilización de landfarming como de biopilas con los agregados de nutrientes que deben adicionarse para suplir las bajas concentraciones de los suelos de la cuenca petrolera (Pucci et al., 2011). En las contaminaciones antiguas un problema que se presenta es la baja disponibilidad de los hidrocarburos por las uniones que éstos tienen con las partículas de suelo. En los últimos años se ha desarrollado la electrobiorremediación, una técnica híbrida que combina la biorremediación con la electrocinética que aumenta la biodisponibilidad de los compuestos facilitando de este modo la biorremediación (Wick et al., 2007, Niqui-Arroyo y Ortega-Calvo, 2010).
El objetivo del trabajo fue aplicar la electrobiorremediación a un suelo con contaminación antigua de hidrocarburos para disminuir los valores de hidrocarburos.
MATERIALES Y MÉTODOS
Se trabajó con una muestra de suelo contaminado con residuos de la actividad petrolera, proveniente de un landfarming. La misma se obtuvo a partir de la toma de 20 submuestras del sitio a una profundidad comprendida entre los 10 y 30 cm, que se mezclaron, tamizaron y redujeron por cuarteos sucesivos. La muestra se obtuvo a la profundidad indicada debido a que en esta se encuentra la mayor actividad microbiológica (Atlas y Bartha, 2002). La muestra de suelo contenía un pH 7,46, humedad de 12 %, residuo orgánico 18,34 %, densidad aparente 1,29, porosidad 45 %, capacidad de retención del agua 64 %, cloruros 348,7 ppm, bicarbonatos 60,98 ppm, sulfatos 107,28 ppm, calcio 40,08 ppm, magnesio 24,31 ppm, hierro 2,16 ppm, amonio 1 ppm, fosfato 6,92 ppm, nitratos 17,04 ppm, nitritos 0,21 ppm y hidrocarburos totales del petróleo TPH(total petroleum hydrocarbons) 24600 ppm compuesto por 49, 39, y 12 % de hidrocarburos alifáticos, aromáticos y polares respectivamente.
Experiencia de electrobiorremediación
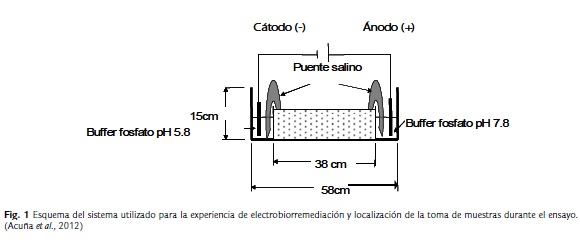
Para los ensayos se utilizaron tres cubas de vidrio de 58 cm de largo, 15 cm de alto y 15 cm de ancho. El interior de estas estaba dividido en tres compartimientos de vidrio, dos de ellos de 10 cm de largo, 15 cm de alto y 15 cm de ancho, ubicados uno a cada extremo de las cubas en donde se colocaron las soluciones buffer. El tercer compartimiento fue el central, de 38 cm de largo, 15 cm de alto y 15 cm de ancho, donde se colocó el suelo (Fig. 1). La experiencia de electrobiorremediación consistió en la colocación de buffer fosfato de potasio 1 M en los compartimientos de los extremos. El buffer a pH 5,8 se colocó en el compartimiento correspondiente al cátodo y el de pH 7,8 en el correspondiente al ánodo. En estas soluciones fueron sumergidos los electrodos de platino y el paso de corriente a través del suelo se logró por la unión de las soluciones buffer con el suelo, utilizando puentes salinos de buffer fosfato. Para los ensayos se utilizaron 4 kg de suelo fertilizado con nutrientes para corregir su relación C:N:P 100:1:0,1 (Acuña et al, 2007). La humedad del suelo utilizado fue de 12 a 15 % (Acuña et al, 2009) y el voltaje aplicado fue de 0,5V.cm-1. Como control, se utilizaron dos sistemas sin aplicación de corriente con los mismos agregados de nutrientes y humedad. Al inicio y al final de la experiencia se realizó un análisis físico, químico, bacteriológico y aislamiento e identificación de cepas bacterianas. Todos los sistemas fueron incubados a 24°C durante 63 días.
Enumeración de microorganismos
El número de microorganismos fue determinado por la técnica de conteo en placa. Se utilizó una suspensión de 10 g de suelo en 90 mL de solución fisiológica estéril que se agitó 30 minutos a 150 r.p.m. para bacterias degradadoras de hidrocarburos (BDH) se utilizó un medio mineral: 100 mL de solución I, 25 mL de solución II , 14 g agar agar y se completa a 1L con agua destilada (solución I: cloruro de calcio 0,235 g, nitrato de potasio 0,427 g, sulfato de amonio 5 g, cloruro de magnesio hexahidratado 1 g, bicarbonato de potasio 1,2 g. Solución II: fosfato ácido di sódico dihidratado 0,5 g, fosfato monopotásico 0,5 g. Solución III: EDTA-Na 800 g, cloruro ferroso 300 g, cloruro de calcio hexahidratado 4 g, cloruro de manganeso tetrahidratado 10 g, sulfato cúprico 1g, permanganato de potasio dihidratado 3 g, cloruro de zinc 2 g, cloruro de litio 0,5 g) al cual se le agregó 30 μL de una mezcla de petróleo y gasoil 1:1 por diseminación en superficie que se denominó MBM-PGO (Pucci y Pucci, 2003). Todos los reactivos son calidad microbiológica.
Análisis de hidrocarburos
Determinación de hidrocarburos por Cromatografía Gaseosa (GC). Para determinar la composición de los hidrocarburos presentes en la muestra se mezclaron 2 g de la muestra, 1 g SO4Na2 (99,99 pureza) y 10 ml de Hexano (calidad pesticida), la cual se filtró para separar la fase sólida y líquida. Seis mililitros del filtrado se evaporo cuidadosamente hasta sequedad, se enfrió y retomo con 50 μL de Hexano. Para la cuantificación se utilizó un cromatógrafo de gases Varian 3800 GC, con detector FID y una columna capilar VF-5ms (30 m, 0,25 mm, 0,2523 μm). La temperatura del inyector fue de 200°C y la del detector FID 300°C, se inyecto 1 μL. Los parámetros de corrida de la columna fueron las siguientes: 45 a 100 °C con un aumento de 5 °C/min y una segunda rampa de 100 a 275 °C a 8 °C/min. La temperatura final de 275ºC se mantuvo por 5 minutos.
Aislamiento e identificación de cepas bacterianas
A partir de las placas de MBM-PGO utilizadas para conteo de bacterias, se aislaron e identificaron 90 cepas por metil ésteres de ácidos grasos (FAMEs) según el método Sherlock MIDI versión 6.0. La extracción de ácidos grasos de membrana se realizó sobre 40 mg de masa celular comenzando con una saponificación, 2mL, con alcohol metílico, hidróxido de sodio y agua (150 mL: 45 g: 150 mL). Posteriormente se realizó una metilación, 1mL, con ácido clorhídrico 6 N y alcohol metílico (325 mL: 275 mL), seguido de una extracción con n-hexano y metilterbutil éter (1:1) 1,25mL. Finalmente se realizó un lavado con hidróxido de sodio y agua, 3mL (10,8 g en 900 mL) de acuerdo a lo propuesto por el sistema de identificación (MIDI Newark, Del., USA).
Los ácidos grasos obtenidos se determinaron como metil ésteres por cromatografía gaseosa. Para tal fin se utilizó una columna capilar Ultra 2 de 25 m de longitud y 0,2 mm de diámetro. El análisis se llevó a cabo con un cromatógrafo HP 6890 series II GC (inyección splitless, presión inicial 10 psi, programa de temperatura: 170-288 °C a 28 °C.min-1, 288-310 °C a 60 °C.min-1, 1,5 min de permanencia a 310 °C, detector por ionización de llama). La integración de los pico se efectuó mediante el programa HP 10.01 ChemStation.
Los ácidos grasos fueron identificados utilizando el sistema Sherlock (versión 6.0) con el estándar Agilent "Calibration standards kit for the microbial identification system". La composición en ácidos grasos fue calculada como porcentaje del área de pico (MIDI).
Análisis de resultados
Los valores de hidrocarburos y recuentos bacterianos se analizaron por análisis de la varianza (ANOVA) mediante el programa BIOM (Applied Biostastics INc 3 Heritage Setauket NY 117II USA). Para el estudio de la comunidad bacteriana se realizó un análisis de componentes principales utilizando el programa PAST (Hammer y Harper, 2005).
RESULTADOS
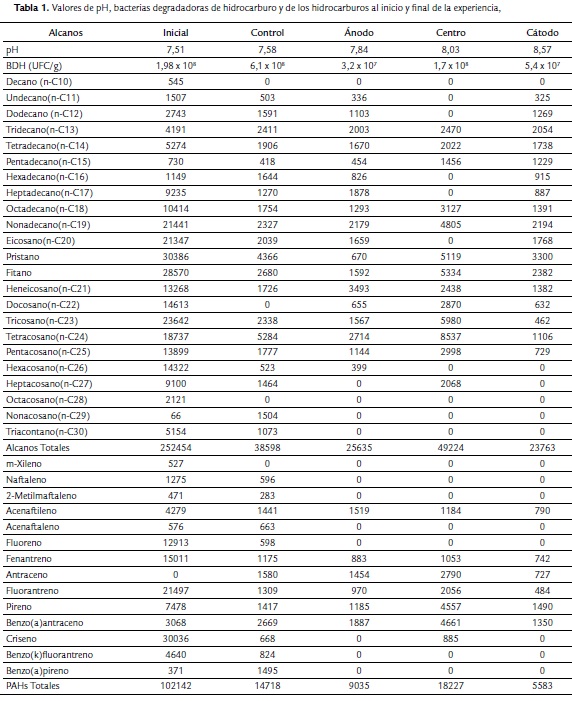
Los hidrocarburos disminuyeron con la aplicación de la electrobiorremediación (Tabla 1). Por la utilización de los puentes de sales de fosfato, el pH se mantuvo en valores que permiten la vida bacteriana (Tabla 1) obteniéndose recuentos de bacterias degradadoras en valores adecuados para esta función y normales para los suelos patagónicos.
La humedad del suelo permaneció en valores adecuados para el procesos de electrobiorremediación (10 % a 20 %) proporcionando a los microorganismos el desarrollo de su metabolismo por períodos de tiempo más prolongados (Acuña et al., 2011). Por otro lado se trabajo con esos valores debido a que se ha demostrado que con porcentajes de humedad de 10 % a 20 % se produce una mayor mineralización de hidrocarburos (Acuña et al., 2012). En un proceso de electrobiorremediación en suelos insaturados los valores de humedad deben estar entre 12 y 15 % ya que a menores valores aumenta el voltaje que se debe aplicar a los electrodos para mantener un valor constante en el suelo, lo que conlleva a un mayor gasto de energía y menor rendimiento del sistema (Acuña et al., 2009; Acuña et al., 2010). La humedad también se incorporó en pequeñas cantidades por los puentes salinos que se deshidrataban con el paso del tiempo, perdiendo aniones y agua.
En este sistema, la aplicación de la diferencia de potencial elevó los porcentajes de degradación de los diferentes compuestos de mayor concentración, como el pristano y el fitano, que fueron del 97 % y 94 % respectivamente en el sector del ánodo, 83 % y 81 % para el centro y 90 % y 91 % para la región del cátodo (Tabla 1). Además se observó que fueron biodegradados los mismos hidrocarburos alifáticos iniciales que en el sistema control, con excepción del compuesto docosano, que si bien fue degradado en los sectores de la cuba, no fue degradado en su totalidad como en el sistema de control (Tabla 1).
Del sistema de electrobiorremediación, el sector del centro fue el que presento una menor degradación de compuestos alcanos, pero hay que destacar que en este sector se lograron degradar completamente compuestos que en los otros sectores no, como por ejemplo el undecano, dodecano, hexadecano, heptadecano y el eicosano, compuesto que se encontraba en una elevada concentración (Tabla 1).
En el caso de los hidrocarburos aromáticos policíclicos, se observó un porcentaje de biodegradación de aproximadamente 85 % para el sistema utilizado como control mientras que en el que se desarrolló la experiencia de electrobiorremediación los porcentajes fueron 91 %, 82 % y 94 % para la región del ánodo, del centro y del cátodo, respectivamente. Además es notorio como en este sistema se han logrado degradar completamente mucho más compuestos que en el sistema control, como por ejemplo los compuestos fluoreno o benzo (k) fluorantreno. (Pucci et al., 2012). El benzo (k) fluorantreno o el benzo(a) pireno se eliminaron, estos están indicados por la legislación provincial como los más peligrosos (Decreto Provincial de Chubut Argentina1456/11).
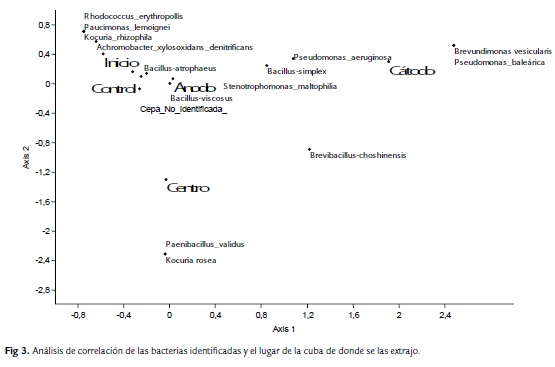
La identificación de las bacterias por Sherlock MIDI analizados por análisis de componentes principales (Fig. 2) mostró que el inicio, control y centro se encuentran más cerca, posee identificaciones bacterianas en común. Los microorganismos identificados ya han sido estudiados por su capacidad de degradar hidrocarburos. Los microorganismos encontrados con mayor frecuencia fueron Achromobacter xylosoxidansdenitrificans, Bacillus-simplex y Stenotrophomonasmaltophilia, microorganismos frecuentes de suelos patagónicos (Acuña et al., 2012).
DISCUSIÓN
La baja concentración de nutrientes biodisponibles (nitrato, nitrito, amonio y fosfato) es característica de los suelos de la meseta patagónica central (Acuña et al., 2008). Estas concentraciones no son indicadas como óptimas por la EPA. Sin embargo la degradación de hidrocarburos es factible por la presencia de bacterias capaces de fijar nitrógeno y degradar hidrocarburos (Acuña et al., 2012).
Con la aplicación de un campo eléctrico y el pasaje de corriente de baja intensidad los aniones migran por la diferencia de voltaje a diferentes velocidades (Xu et al., 2010). En base a este principio se introdujeron al sistema fosfatos provenientes de los puentes salinos, lo cual aumento la concentración inicial de 6,4 ppm a 42 ppm en al ánodo, 19 ppm en el centro de la cuba y 39 ppm en cátodo al final de la experiencia mientras en el sistema control el fosfato se utilizó para la degradación y al final de la experiencia no se encontró. Tiehm et al. (2010) encontraron el nitrato en mayor cantidad en la zona donde estaba la decontaminación de tolueno. En forma análoga, en nuestra experiencia los mayores valores de nitratos se encontraron en la zona del cátodo en donde también se llevó a cabo la mayor degradación, (Tabla 1). Esto coincide con los resultados de Schmidt et al., (2007) que mostraron que el nitrato migra en dirección al cátodo se acumula y por ende favorece la degradación. El valor en el cátodo fue de 4,8 ppm y en resto de la cuba se encontró en 3,5 ppm. Los valores de nitrato bajaron por su utilización en el metabolismo bacteriano.
Los valores de voltaje y de pH se mantuvieron en un rango que no produjo un impacto en el desarrollo bacteriano (Tabla 1) ya que son compatibles con la viabilidad de los microorganismos (Dibble y Bartha, 1979) por eso los recuentos bacterianos se mantuvieron durante el tiempo que duró el experimento, (Tabla 1). Estos valores son similares a los que se encuentran en suelos patagónicos (Peressutti et al., 2003; Pucci et al 2011; Acuña et al., 2012). No se observó una movilización masiva de microorganismos manteniéndose el número equitativamente similar (Tabla 1). Los microorganismos identificados ya han sido estudiados por su capacidad de degradar hidrocarburos. Rhodococcus presenta una gran diversidad metabólica, capaz de transformar, biodegradar y utilizar como única fuente de carbono compuestos hidrófobos (Flavio et al., 1999); posee una gran variedad de vías metabólicas para la degradación y modificación de compuestos aromáticos, siendo la especie R. erythropolis, estudiada por su capacidad de biodegradar gasoil (Huang et al., 2008), hidrocarburos n-alcanos (Carvalho et al., 2009) y poliaromáticos (Pizzul et al., 2006). Pseudomonas aeruginosa, es degradadora de gran cantidad de sustratos como el n-hexadecano, hidrocarburos aromáticos y poliaromáticos, así como del pireno en estudios in Vitro (Fan et al., 2003; Braker et al., 2009). Achromobacter xylosoxidans denitrificans posee la capacidad de utilizar los hidrocarburos como única fuente de carbono y energía (Sette et al., 2007) y que se involucra en la degradación de hidrocarburos poliaromáticos, como el fenantreno (Wang et al., 2006).
El contenido de hidrocarburos totales fue de 2,46 %, constituidos por un 49 % de hidrocarburos alifáticos, un 39 % de hidrocarburos aromáticos y un 12 % de hidrocarburos polares. En los hidrocarburos alifáticos, se observó que en el sistema control hubo un porcentaje de degradación del 84 %, donde compuestos como el docosano y el octacosano lograron ser degradados completamente, y otros compuestos, como el pristano y fitano, tuvieron elevados porcentajes de degradación (Tabla 1). Si bien en esta experiencia se utilizó el método de soxhlet para determinar los hidrocarburos totales adsorbidos por las arcillas, el valor que se obtiene con este método drástico, no es el porcentaje de hidrocarburos que está disponible para las bacterias (Reid et al., 2000). Por esto se utilizó una técnica más simple que es la extracción solo con hexano y agitación (Tao et al., 2006), que extrae los hidrocarburos que se encontrarían biodisponibles para los microorganismos. Los compuestos alifáticos como los PAHs, pueden ser metabolizados por los microorganismos presentes en sistemas de biodegradación (Ghazali et al., 2004; Jacques et al., 2008), aunque los PAHs son el grupo que presenta la menor velocidad de biodegradación (Straube et al., 2003)
En los valores obtenidos para los hidrocarburos alifáticos se observa que la aplicación de una diferencia de voltaje eleva los porcentajes de degradación de los diferentes compuestos comparados con los obtenidos en el sistema control, donde solo se lleva a cabo el proceso de biorremediación. Sin embargo hay que destacar que este tipo de hidrocarburos no son un problema en los sistemas de biodegradación por técnicas convencionales en los suelos patagónicos (Peressutti et al., 2003, Riis et al., 2003). En la cuba de electrobiorremediación, los porcentajes de degradación fueron de 89 %, 80 % y 90 % para el sector del ánodo, centro y cátodo respectivamente, logrando la degradación completa de compuestos como los alcanos de entre 27 y 30 carbonos. Las bacterias identificadas poseen relación con la degradación de hidrocarburos, y las Pseudomonas aeruginosa, Pseudomonas sp., se encuentran entre las bacterias que pueden utilizar hidrocarburos alcanos de C12-C23 (Naik y Sakthivel, 2006), el Rhodococcus erythropolis, los de C12-C36 (van Beilen et al., 2002).
Los PAHs suelen representar un problema en los sistemas de biorremediación, debido a su baja biodisponibilidad para las bacterias. Los valores obtenidos en esta experiencia indican que la aplicación de un campo eléctrico acelera la biodegradación de los PAH, y esto puede estar asociado a la presencia de un flujo electroosmótico provocado por la aplicación de corriente capaz de remover los compuestos desde el interior de los poros de las partículas del suelo, aumentando así su biodisponibilidad para la biodegradación por microorganismos del suelo (Johnsen et al., 2005).
Las diferencias del concentración de los PAHs en las tres zonas de las cubas se debe a la acción conjunta de la electroósmosis, la modificación de las cargas superficiales de las partículas del suelo y de la presencia de las diferentes especies y géneros bacterianos en cada una de las zonas del potencial Z y gradiente eléctrico (Acuña et al., 2009). Las diferencias observadas en los porcentajes de biodegradación de PAHs totales en el cátodo, centro y ánodo, pueden haberse debido a que el flujo electroosmótico generado en el suelo no haya sido uniforme. Esto puede surgir como resultado de que algunas secciones pueden presentar una presión en los poros variables, probablemente como resultado de la naturaleza compleja de los factores que controlan el flujo electroosmótico como ser el potencial zeta y el gradiente eléctrico (Acuña et al., 2010).
En el sistema control, los PAH biodegradados en mayor medida fueron el xileno, el cual fue el único degradado completamente, el fluoreno con un porcentaje de degradación del 95 %, el fenantreno con un 92 %, el fluorantreno con un 93 %, y el criseno con un porcentaje de degradación del 97 %.
En el sistema de electrobioremediación estudiado fueron biodegradados los mismos PAH que en el sistema control, pero el porcentaje de degradación de cada uno fue superior. El sistema logro biodegradar completamente el fluoreno en los tres sectores de estudio. Por otro lado, la aplicación de corriente provocó una degradación completa de compuestos como el benzo(a) pireno, el acenaftaleno, el naftaleno y el 2-metilmaftaleno.
El del antraceno resulta sin embargo particular ya que no se detectó en la muestra inicial y si en todas las demás. Esto posiblemente pueda deberse a su adhesión a las partículas del suelo, que se modificó por el pasaje de corriente directa en el sistema de electrobiorremediación. En el caso del sistema control, la presencia del antraceno nos hace suponer que las bacterias, al ser estimuladas con la incorporación del medio mineral al inicio de la experiencia, aumentaron su población, y produjeron biosurfactantes que disminuyeron la tensión superficial del antraceno con las partículas del suelo.
CONCLUSIONES
La utilización de una diferencia de potencia de 0,5V cm-1 mantuvo la cantidad de microorganismos degradadores de hidrocarburos en los tres puntos de la cuba y aumentó de manera significativa los valores de biodegradación de hidrocarburos en el suelo, logrando la degradación completa de varios compuestos.
AGRADECIMIENTOS
Este trabajo fue financiado por el centro de investigación CEIMA, agradecemos al personal no docente por la preparación de los medios de cultivo y limpieza del material, a Mirta Leiva y Miriam Robledo.
REFERENCIAS
Acuña AJ, Pérez Krenek J. F., Pucci O. H., Pucci G. N. Biodegradación de Hidrocarburos. Influencia de la Fertilización en el Proceso de Biorremediación. Ingen Sanit Amb. 2007;84(20):82-86. [ Links ]
Acuña AJ, Pucci OH, Pucci GN. Caracterización de un proceso de biorremediación de hidrocarburos en deficiencia de nitrógeno en un suelo de la Patagonia Argentina. Ecosistema. 2008;17(2):85-93. [ Links ]
Acuña AJ, Tonín NL, Wick L, Pucci GN, Pucci OH. Electrobiorremediación. Una tecnología en desarrollo para la recuperación de suelos contaminados con hidrocarburos. Ingen Sanit Amb. 2009;105(2):80-85. Doi: 10.1007/s00244-013-9920-6. [ Links ]
Acuña A.J., Tonín N.L., Wick L, Pucci G.N., Pucci O.H. Electrobioremediation of an unsaturated soil contaminated with hydrocarbon after landfarming treatment. Port Elect Acta. 2010;28(4):253-263. Doi: 10.4152/pea.201004253. [ Links ]
Acuña AJ, Pucci OH, Pucci GN. Electrobioremediation of Hydrocarbon Contaminated Soil from Patagonia Argentina. In: Jorge Salgado Gmez, editor. InTech New Tech Oil Gas Ind. 2012. p 29-48. Doi: 10.5772/50872. [ Links ]
Atlas R, Bartha R. Ecol Microbial Microbiol Amb. 4 ed. Editorial Pearson Educación SA. EEUU; 2002:329-380. [ Links ]
Braker G, Fesefelt A, Witzel KP. Development of PCR primer system amplification of nitrite reductase genes (nirK and nirS) to detect denitrifying bacteria in environmental samples. Appl Environ Microbiol. 2009;75(5):5186-5194. [ Links ]
Carvalho C, Wick L, Heipieper H. Cell wall adaptations of planktonic and biofilm Rhodococcuserythropolis cells to growth on C5 to C16 n-alkane hydrocarbons. Appl Microbiol Biotechnol. 2009;82(2):311-320. Doi: 10.1007/s00253-008-1809-3. [ Links ]
Dibble J, Bartha B. Effect of environmental parameters on the biodegradation of oil sludge. Appl Environ Microbiol. 1979;37(4):729-739. [ Links ]
Fan C, Qing X, Kwang J. Aerobic denitrification of Pseudomona aeruginosa monitored by online NAD(P)H Fluorescence. Appl Environ Microbiol. 2003;69(11):6715-6722. Doi: 10.1128/AEM.69.11.6715-6722.2003 [ Links ]
Flavio B, Leonardo F, Zachia M. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Microbiol. 1999;30(3):231-236. Doi: http://dx.doi.org/10.1590/S0001-37141999000300008. [ Links ]
Hammer & Harper DAT [Internet]. 2005. Paleantological Statistics version 1.34. Available from: http://folk.uio.no/ohammer/past. [ Links ]
Ghazali F, Rahman R, Salleh A, Basri M. Biodegradation of Hydrocarbons in Soil by Microbial Consortium. Internat Biodet Biodeg. 2004;54(1):61-67. Doi:10.1016/j.ibiod.2004.02.002. [ Links ]
Huang L, Ma T, Li D, Liang F, Liu R, Li G. Optimization of nutrient component for diesel oil degradation by Rhodococcus erythropolis. Mar Pollut Bull. 2008;56(10):1714-1718. Doi: 10.1016/j.marpolbul.2008.07.007. [ Links ]
Jacques R, Okeke B, Bento F, Teixeira A, Peralba M, Camargo F. Microbial Consortium Bioaugmentation of a Polycyclic Aromatic Hydrocarbons Contaminated Soil. Biorese Technol. 2008;99(7):2637-2643. Doi: 10.1016/j.biortech.2007.04.047. [ Links ]
Johnsen AR, Wick LY, Harms H. Principles of microbial PAH-degradation in soil. Environ Pollut. 2005;133(1):71-84. Doi: 10.1016/j.envpol.2011.02.053. [ Links ]
Naik PR, Sakthivel N. Functional characterization of a novel hydrocarbonoclastic Pseudomonas sp. strain PUP6 with plant-growth-promoting traits and antifungal potential. Res Microbiol. 2006;157(3):538-546. Doi: 10.1016/j.jhazmat.2007.01.009. [ Links ]
Niqui-Arroyo J, Bueno-Montes M, Posada-Baquero R, Ortega-Calvo J. Electrokinetic enhancement of phenanathrene biodegradation in creosote-polluted clay soil. Environ Pol. 2006;142(2):326-332. Doi: 10.1016/j.envpol.2005.10.007. [ Links ]
Peressutti SR, Alvarez HM, Pucci OH. Dynamics of Hydrocarbon-degrading Bacteriocenosis of an Experimental Oil Pollution in Patagonian Soil. Int Biodeterior Biodegradation. 2003;52(1):21-30. Doi: 10.1002/abio.370200207. [ Links ]
Pizzul L, Castillo M, Stenström J. Characterization of selected actinomycetes degrading polyaromatic hydrocarbons in liquid culture and spiked soil. World J Microbiol Biotechnol. 2006;22(7):745-752. Doi: 10.1007/s11274-005-9100-6. [ Links ]
Pucci GN, Acuña AJ, Pucci OH. Biodegradación de hidrocarburos en la meseta patagónica, un resumen de la optimización de los parámetros a tener en cuenta. Ingen Sanit Amb. 2011;115(3):36-41. [ Links ]
Reid B.J., Stokes J.D., Jones K.C., Semple K.T. Nonexhaustive Cyclodextrin-Based Extraction Technique for the Evaluation of PAH Bioavailability. Environ Sci Technol. 2000;34(15):3174-3179. Doi: 10.1021/es990946c. [ Links ]
Riis V, Kleinsteuber S, Babel W, Can J. Influence of high salinities on the degradation of diesel fuel by bacterial consortia. Microbiol. 2003;49(11):713-721. Doi: 10.1128/mBio.01703-14. [ Links ]
Rojo S, Rotondo S. [Internet]. Perfil de especialización del empleo en el Golfo San Jorge: un diagnóstico desde la perspectiva del desarrollo local. Available from: http://www.trabajo.gov.ar/left/estadisticas/descargas/oede/Golfo_de_san_jorge.pdf. 20-08-2014. [ Links ]
Schmidt C.A.B., Barbosa M.C, Almeida M.S.S. Laboratory feasibility study on electrokinetic injection of nutrients on an organic, tropical, clayey soil. J Hazard Mater.2007;143(3):655-661. Doi: 10.1016/S0304-3894(01)00237-0. [ Links ]
Sette L, Simioni K, Vasconcellos S, Dussan L, Neto E, Oliveira V. Analysis of the composition of bacterial communities in oil reservoirs from a southern offshore Brazilian basin. Antonie Van Leeuwenhoek. 2007;91(3):253-266. Doi: 10-10007/s10482-006-9105-8. [ Links ]
Straube W, Nestler CC, Hansen LD, Ringleberg D, Pritchard PH, Jones-Meehan J. Remediation of Polyaromatyc Hydrocarbons (PAHs) through Landfarming with Biostimulation and Bioaugmentation. Acta Biotechnol. 2003;23(2-3):179-196. Doi: 10.1002/abio.200390025. [ Links ]
Tao S, Xu F, Liu W., Cui Y, Coveney RM Jr. A Chemical Extraction Method for Mimicking Bioavailability of Polycyclic Aromatic Hydrocarbons to Wheat Grown in Soils Containing Various Amounts of Organic Matter. Environ Sci Technol. 2006;40(7):2219-2224. Doi: 10.1021/es051967b. [ Links ]
Tiehm A, Augenstein T, Ilieva D, Schell H, Weidlich C, Mangold KM. Bioelectroremediation: electrokinetic transport of nitrate in a flow-through system for enhanced toluene biodegradation. Jour Appl Electroch. 2010;40(6):1263-1268. Doi: 10.1007/s10800-010-0101-2. [ Links ]
van Beilen JB, Smits THM, Whyte LG, Schorcht S, Röthlisberger M, Plaggemeier T, et al. Alkane hydroxylase homologues in Gram-positive strains. Appl Environ Microbiol. 2002;4(11):676-682. Doi: 10.1046/j.1462-2920.2002.00355.x. [ Links ]
Wang Z, Fingas M, Yang C, Christensen J. Crude oil and refined product fingerprinting: Principles. Environ Forens. 1 ed. Academic Press, Incorporated; 2006. p. 339-357. [ Links ]
Wick L, Shi L, Harms H. Electrobioremedation of hydrophobic organic soil-contaminants: A review off fundamental interactions. Electrochim Acta. 2007;52(10):3441-3448. Doi: 10.1016/j.electacta.2006.03.117. [ Links ]
Xu W, Wang C, Liu H, Zhang Z, Sun H. A laboratory feasibility study on a new electrokinetic nutrient injection pattern and bioremediation of phenanthrene in a clayey soil. J Hazard Mater. 2010;184(1-3):798-804. Doi: 10.1016/j.jhazmat.2010.08.111. [ Links ]