Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.20 no.2 Bogotá May/Aug. 2015
https://doi.org/10.15446/abc.v20n2.42302
Doi: 10.15446/abc.v20n2.42302
Artículo de investigación
FORMACIÓN DE EMBRIONES SOMÁTICOS A PARTIR DE SEMILLAS INMADURAS EN Sorghum bicolor VARIEDAD CIAP 132-R
Formation of Somatic Embryos from Immature Seeds of Sorghum bicolor Sorghum Variety CIAP 132-R
Mayelín RODRÍGUEZ URQUIZA1, Rafael GÓMEZ KOSKY1, Silvio de Jesús MARTÍNEZ2, Mileydi PONS CORONA1, Martha PÉREZ PERALTA1, Mariana LA ¨O¨ CÁRDENAS1, Carlos ROMERO QUINTANA1.
1Subdirección de investigaciones y Postgrado, Instituto de Biotecnología de las Plantas. Carretera a Camajuaní Km 5.5. Santa Clara, Villa Clara. Cuba.
2Filial Universitaria Municipal Joaquín Paneca, Camajuaní, Villa Clara. Cuba.
For correspondence. mayelin@ibp.co.cu
Received: 26 February 2014; Returned for revision: 2 April 2014; Accepted: 1 August 2014.
Associate Editor: Xavier Marquínez Casas.
Citation / Citar este artículo como: Rodríguez Urquiza M, Gómez Kosky R, Martínez SJ, Pons Corona M, Pérez M, La ¨O¨ Cárdenas M, Romero Quintana C. Formación de embriones somáticos a partir de semillas inmaduras en Sorghum bicolor variedad CIAP 132-R. Acta biol. Colomb. 2015;20(2):237-245. doi: http://dx.doi.org/10.15446/abc.v20n2.42302
RESUMEN
Existen varios protocolos de regeneración de plantas vía embriogénesis somática de Sorghum bicolor (L.) Moench, sin embargo los porcentajes de formación de callos con estructuras embriogénicas y regeneración de plantas son bajos. Es por ello que esta investigación tuvo como objetivo generar embriones somáticos en sorgo rojo variedad CIAP 132-R. Se ensayaron diferentes concentraciones de 2,4-D para la formación de callos, así como tres concentraciones de ácido ascórbico para eliminar la exudación de compuestos fenólicos por el explante. También para la formación de los embriones somáticos a partir de los callos se evaluaron diferentes concentraciones de 2,4-D y 6-BAP. El mayor porcentaje de formación de callos (57,5 %) se alcanzó con 18,1 µM de 2,4-D. Con la adición al medio de cultivo de 50,0 mg.l-1 de ácido ascórbico fue posible eliminar los compuestos fenólicos en el explante y en el medio de cultivo, además permitió incrementar el porcentaje de formación de callos con estructuras embriogénicas hasta un 95 %. El número mayor de embriones somáticos por callo se alcanzó en el medio de cultivo con concentraciones de 4,52 µM de 2,4- D, combinada con 2,22 µM de 6-BAP. Por primera vez, se logró la formación eficiente de embriones somáticos a partir de los callos obtenidos de semillas inmaduras germinadas como explante inicial en la variedad CIAP 132-R.
Palabras clave: 2,4-Diclorofenoxiacético, 6-Bencilaminopurina, callos, embriogénesis somática, sorgo.
ABSTRACT
Several protocols of plant regeneration via somatic embryogenesis from Sorghum bicolor (L.) Moench have been development, however the percentage of calluses with embryogenic structures and plant regeneration are low. Therefore this study aimed to generate somatic embryos in red sorghum variety CIAP 132-R. Different concentrations of 2,4-D for callus formation, and three concentrations of ascorbic acid to remove phenolics exudation were assayed by explant. For the formation of embryos different concentrations of 2,4-D and 6-BAP were evaluated. The highest percentage of callus formation (57.5 %) was achieved with 18.1 µM 2,4-D. With the addition to the culture medium of 50.0 mg.l-1 of ascorbic acid was possible to eliminate the phenolic compounds in the explant and in the culture medium; also it allows increasing the percentage of calluses with embryogenic structures up to 95 %. The highest number of somatic embryos per callus was achieved with a reduction in the culture medium of 2,4-D to 4.52 µM in combination with 2.22 µM 6-BAP. For the first time, the efficiency of somatic embryo formation was obtained from the freshly germinated sprouts of immature seeds as initial explant CIAP 132-R.
Keywords: 2,4-Diclorofenoxiacetic, 6-Benzylaminopurine, callus, somatic embryogenesis, sorghum.
INTRODUCCIÓN
El sorgo [Sorghum bicolor (L.) Moench] es un cereal de gran importancia en las zonas semiáridas tropical y subtropical de África, India y China, donde persisten la sequía y altas temperaturas, y abundan los suelos pobres en nutrientes (O´Kennedy et al., 2006). Es una planta de metabolismo C-4 con alta eficiencia fotosintética, lo que le permite adaptarse bien a un entorno agroecológico cálido y seco en el que es difícil cultivar otros cereales (Liu et al., 2009). Se utiliza en la alimentación animal y humana, producción de fibra y es un excelente recurso para la producción de etanol, por su alto contenido de azúcares (Henry, 2010). Su cultivo se ha generalizado, ocupando el quinto lugar entre todos los cereales y la sexta especie más sembrada (Zhao et al., 2010). La necesidad mundial de aumentar de manera sostenible la producción de cereales como alternativa para contribuir a la seguridad alimentaria y cubrir las necesidades crecientes de los pueblos, ha propiciado que los productores busquen mayores rendimientos en las áreas improductivas, con el uso de especies que se adapten a esas condiciones (Díaz, 2008).
La variedad de sorgo de grano rojo CIAP 132-R ha sido evaluada en condiciones de campo y se encuentra en fase de generalización. Sin embargo, su producción está limitada por el ataque de aves, enfermedades y plagas postcosecha (Pérez et al., 2010) y por el alto contenido de taninos que afecta la calidad y cantidad de proteína en el grano, así como la composición de aminoácidos (Jaramillo et al., 1993).
Estas características que limitan los diferentes fines de uso de este cultivo necesitan de un programa de mejoramiento genético, donde los métodos tradicionales se encuentran limitados por los largos períodos de selección, la complejidad del carácter a mejorar y la influencia del medio ambiente. El uso de la biotecnología y específicamente la transformación genética, facilita el mejoramiento de la calidad de la proteína del grano (Zhao et al., 2000). El sorgo ha sido caracterizado dentro de las monocotiledóneas como una de las especies más recalcitrante en cultivo in vitro y para la transformación genética (Maheswari et al., 2006).
Los primeros trabajos para la regeneración de plantas vía embriogénesis somática indirecta fueron realizados por Thomas et al. (1977) y Gamborg et al. (1977). Para la formación de callos en sorgo se han empleado varios tipos de explantes: inflorescencias inmaduras (Jogeswar et al., 2007), yemas apicales (Maheswari et al., 2006), embriones cigóticos inmaduros (Gupta et al., 2006), y embriones cigóticos maduros (Zhao et al., 2008; Zhao et al., 2010); no obstante, con ninguno de estos explantes se ha logrado un alto porcentaje de formación de callos con estructuras embriogénicas y regeneración de plantas.
A pesar de existir referencias en la literatura científica sobre la formación de embriones somáticos en este cultivo, se ha demostrado que es genotipo dependiente, presenta alta fenolización en la formación de callos y los porcentajes de regeneración de plantas son bajos. En este sentido, lograr la formación de embriones somáticos en la variedad garantizaría disponer de material vegetal para trabajos de mejoramiento genético.
El presente trabajo tuvo como objetivo formar embriones somáticos a partir de callos de semillas inmaduras de sorgo rojo variedad CIAP 132-R. Este constituye primera referencia de la obtención de embriones somáticos de esta variedad de sorgo rojo empleando como explantes inicial semillas inmaduras.
MATERIALES Y METODOS
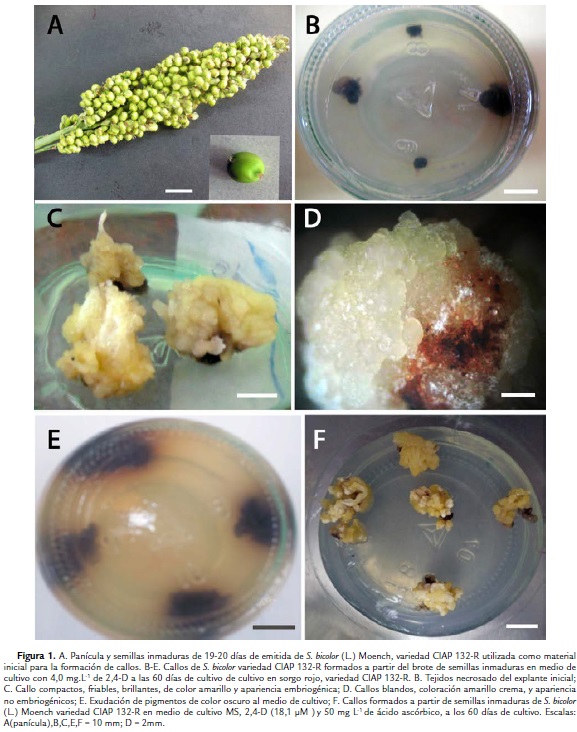
Se empleó como material inicial semillas inmaduras de sorgo (sorgo rojo) variedad CIAP 132-R, del banco de plantas donantes de la Fase de Aclimatización del Instituto de Biotecnología de las Plantas de la Universidad Central "Marta Abreu" de Las Villas, en la ciudad de Santa Clara, Cuba. Estas plantas donantes crecieron en condiciones semicontroladas y sus panículas fueron cubiertas con bolsas de papel encerado a partir de su emisión (Fig. 1A).
Los medios de cultivo utilizados se especifican en cada experimento. El pH de los diferentes medios de cultivo fue ajustado a 5,7 con NaOH (0,1N) y HCl (0,1N) antes de la esterilización en autoclave a una temperatura de 121oC y 1,2 Kg.cm-2 de presión, durante 20 minutos. Como agente gelificante se utilizó 8,0 g.l-1 de Agar Microbiológico extraduro (BIOCEN). Para los experimentos se utilizaron frascos de vidrio de 250 ml de capacidad total y se añadieron 30 ml de medio de cultivo por frasco de cultivo.
La manipulación de los explantes se llevó acabo en cabina de flujo laminar horizontal. El instrumental (pinzas y bisturíes) fue desinfectado con una solución de NaClO 1,0 % (v/v) durante 15 minutos.
Las semillas inmaduras fueron lavadas con agua potable y detergente comercial, posteriormente se lavaron nuevamente y se colocaron en frascos de vidrio estériles de 250 ml. 50 semillas por frasco se desinfectaron en 200 ml de etanol 70 % (v/v) por un minuto, se desechó este desinfectante y se añadió una solución de NaClO al 3 % con dos gotas de Tween-80 por cada 1000 ml por 20 minutos en un agitador orbital (RETOMED) a 180 rpm. Transcurrido este tiempo se enjuagaron tres veces con agua desionizada estéril en cabina de flujo laminar y se sumergieron en una solución estéril de ácido cítrico (50 mg.l-1), hasta ser transferidas a los frascos de cultivo con medio de cultivo para la formación de callo.
El material vegetal en todos los experimentos, se colocó en una cámara de cultivo a una temperatura de 27 ± 2 ºC y oscuridad constante.
El diseño experimental empleado fue completamente aleatorizado. El procesamiento estadístico de los datos experimentales se realizó con la ayuda del paquete computacional SPSS versión 18,0 para Windows (Microsoft®). Para la comparación entre los medias se aplicó el test de Kruskal-Wallis (alternativa no paramétrica al Análisis de Varianzas), y para la comparación entre parejas de grupos se utilizó el test de Mann-Whitney con un nivel de significación para p ≤ 0,05.
Efecto de 2,4-D (ácido 2,4-Diclorofenoxiacético) en la formación de callo
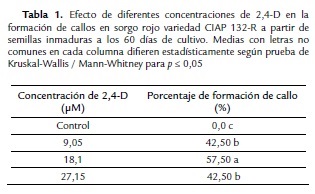
El experimento se realizó con el objetivo de evaluar el efecto diferentes concentraciones de 2,4-D (9,05; 18,1 y 27,14 µM) en la formación de callos de Sorghum bicolor variedad CIAP 132-R. Las semillas inmaduras se colocaron en un medio de cultivo Murashige y Skoog (1962; MS, marca Duchefa, 4,32 g l-1), vitaminas MS, suplementado con 100 mg l-1 de mio-inositol, 50 mg.l-1 de L-prolina, 3 % de sacarosa. Se utilizó 8 g l-1 de Agar extraduro (BIOCEN) como agente gelificante de los diferentes medios de cultivo empleados para los experimentos.
Cada tratamiento tuvo 20 réplicas (frascos de cultivo) con cuatro explantes, para un total de 80. A los 60 días se cuantificó el número de explantes que formaron callo, expresado en porcentaje de callos por frasco de cultivo; así como el número de fenolizados. Se realizaron observaciones visuales cada siete días para detectar la presencia de compuestos fenólicos en el medio de cultivo y el explante.
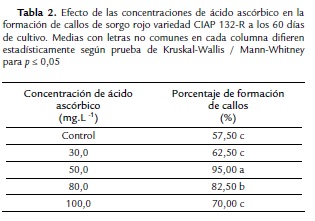
Efecto del ácido ascórbico sobre la oxidación fenólica durante la formación de callo
El experimento se realizó con el objetivo de evaluar el efecto diferentes concentraciones de 2,4-D (9,05; 18,1 y 27,14 µM) en la formación de callos de Sorghum bicolor variedad CIAP 132-R. Las semillas inmaduras se colocaron en un medio de cultivo Murashige y Skoog (1962) (Duchefa) MS (4,32 g L-1), vitaminas MS, suplementado con 100 mg.l-1 de mio-inositol, 50 mg.l-1 de L-prolina, 3 % de sacarosa y 8 g.l-1 de Agar extraduro (BIOCEN).
Cada tratamiento estuvo compuesto por 20 réplicas (frascos de cultivo) con cuatro explantes cada uno. A los 60 días se cuantificó el número de ellos que formaron callo, expresado en porcentaje de callos por frasco de cultivo; así como el número de estos fenolizados. Se realizaron observaciones visuales cada siete días para detectar la presencia de compuestos fenólicos en el medio de cultivo y el explante.
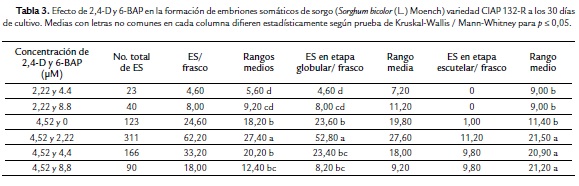
Efecto de 2,4-D y 6-BAP (6-bencilaminopurina) en la formación de embriones somáticos
El experimento se desarrolló con el objetivo de formar embriones somáticos. Se utilizaron callos con cuatro subcultivos de multiplicación. Los callos fueron fragmentados y se colocaron en un medio de cultivo con sales MS, vitaminas MS modificadas con una concentración de tiamina de 0,4 mg.l-1, suplementado con 100 mg.l-1 de mioinositol, 20 mg.l-1 de ácido ascórbico. Se ensayó el efecto de diferentes concentraciones de 2,4-D (1,11; 2,22; 4,52 µM) y 6-BAP (2,22; 4,44 y 8,88 µM) en la formación y diferenciación de los embriones somáticos. Como control se utilizó un tratamiento sin regulador de crecimiento.
Se emplearon 20 réplicas (frascos de vidrio) por tratamiento igual que el anterior experimento. En cada frasco de vidrio se colocaron cuatro callos, para un total de 80 por tratamiento. Se efectuaron observaciones periódicas para detectar el momento de aparición de estructuras embriogénicas. Después de 30 días de cultivo se determinó la presencia o no de estructuras embriogénicas en todos los tratamientos y se evaluó el número total de embriones somáticos por tratamiento, el número de embriones somáticos por callo según la etapa de histodiferenciación. Todas las observaciones y conteos se realizaron con un microscopio estereoscópico (OLYMPUS Modelo BHA, Japón).
RESULTADOS
Formación de callos en sorgo
Efecto de 2,4-D
A partir del tercer día de cultivo, las semillas inmaduras comenzaron a germinar y al mismo tiempo se observó la exudación de compuestos fenólicos alrededor del explante y en el medio de cultivo en todos los tratamientos. Estos influyeron de forma negativa en la germinación de las semillas de la variedad de sorgo rojo CIAP 132-R (Fig. 1B).
En todas las concentraciones evaluadas de 2,4-D se logró la formación de callos a partir de los brotes originados de las semillas inmaduras germinadas in vitro. Se observó el engrosamiento de la hoja cotiledonal a los 15 días de cultivo y a partir de ellas la formación del callo. A los 60 días se formaron dos tipos de callos, unos compactos, friables, brillantes, de color amarillo y apariencia embriogénica (Fig. 1C) y otros blandos de coloración amarillo crema, no embriogénicos (Fig. 1D).
La mayor frecuencia de explantes que formaron callo (50 %) se presentó con la concentración de 18,1 µM de 2,4-D, con diferencias significativas respecto al resto de los tratamientos (Tabla I). Durante la formación de callos se observó la formación de compuestos fenólicos en la totalidad de los explantes. También se produjo la exudación de pigmentos de color purpura al medio de cultivo (Fig. 1E).
Efecto del ácido ascórbico
La adición de ácido ascórbico redujo la exudación y oxidación de los compuestos fenólicos en el explante y en el medio de cultivo durante la formación de callo, permitiendo su crecimiento. La mejor concentración fue 50 mg.l-1 (Tabla. II); concentraciones mayores (80 mg.l-1, 100 mg.l-1) tuvieron un efecto inhibitorio.
La eliminación de los compuestos fenólicos exudados por los explantes al medio de cultivo, debió aumentar la disponibilidad de los componentes del medio de cultivo para el material vegetal, lo cual pudo influir en este incremento del porcentaje de formación de callos. Además no se observó la presencia de pigmentos de color pardo oscuro en el explante y ni en el medio de cultivo (Fig. 1F).
La concentraciones de 80 mg.l-1 y 100 mg.l-1 de ácido ascórbico tuvieron un efecto inhibitorio en la formación de callos respecto a la concentración de 50 mg.l-1. Esto pudiera indicar que estas concentraciones tuvieron niveles de toxicidad explante inicial utlizado para la formación del callo.
Esto resultados indicaron que es necesaria la adición al medio de cultivo de 50 mg.l-1 ácido ascórbico para disminuir la exudación de compuestos fenólicos por los explantes al medio de cultivo y lograr incrementar el porcentaje de formación de callos.
Influencia de 2,4-D y 6-BAP en la formación de embriones somáticos
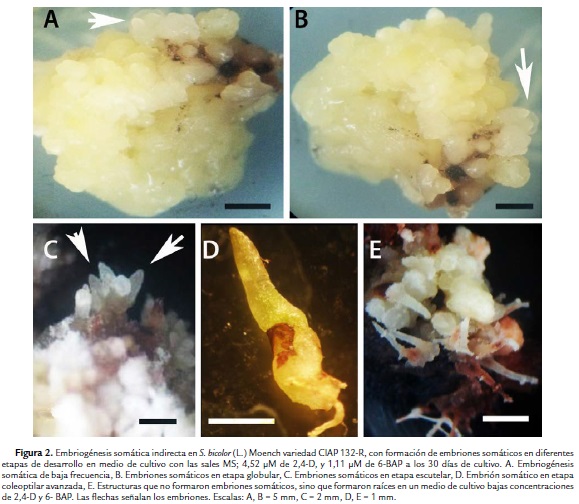
A los 30 días de cultivo en varios de los tratamientos se observó la formación de embriones en diferentes etapas de histodiferenciación (Tabla 3). Se obtuvo una embriogénesis somática de baja frecuencia (ESBF) (Fig. 2A). Esta se caracterizó por embriones somáticos en diferentes etapas: globular de forma redondeada, color blanco, traslúcidos (Fig. 2B), escutelar (Fig. 2C) y coleoptilar (Fig. 2D). Estos se presentaron de forma aislada o en grupos en la superficie de los callos.
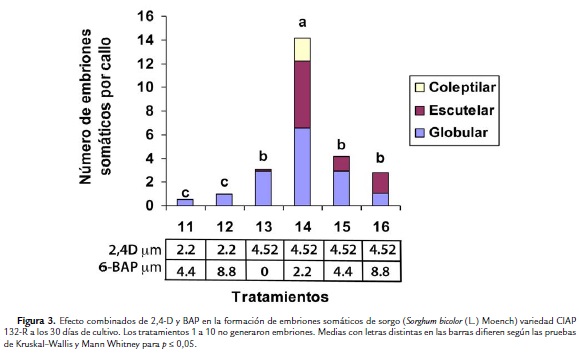
El mayor promedio de embriones somáticos por callos (14) en esta variedad se logró en el tratamiento 14, en el cual se le adicionó al medio de cultivo 4,52 µM de 2,4-D, combinada con 2,22 µM de 6-BAP (Fig. 3). Este tratamiento fue significativamente superior al resto de los tratamientos no solo en cuanto número total embriones somáticos por callo, sino que fue el único tratamiento donde se formaron embriones somáticos en la tres etapas de histodiferenciación (globular, escutelar y coleoptilar). La mayoría de los embriones en el tratamiento antes mencionado se encontraban en etapa globular y escutelar. En los tratamientos del 1 al 10 en los cuales se corresponden a las combinaciones de 2,4-D y 6-BAP de las concentraciones más bajas, no se formaron embriones somáticos. En los tratamientos en que se adicionó 1.11 µM de 2,4-D combinado con las concentraciones más bajas de 6-BAP (2,22 y 4,44 µM) se formaron raíces adventicias (Fig. 4E).
DISCUSIÓN
En la formación de callos con estructuras embriogénicas se emplean diferentes reguladores de crecimiento, sin embargo el 2,4-D es la auxina más empleada con este propósito en los cereales (Vikrant y Rashid, 2003). En sorgo, diferentes protocolos refieren el empleo esta auxina para formar callos con estructuras embriogénicas. Por ejemplo, Zhao et al., (2010) lograron los mayores porcentajes de formación de callos con estructuras embriogénicas en las variedades de sorgo Yuantian No1 (57 %) y M81E (74 %) cultivando embriones cigóticos maduros en las sales MS con 18,1 µM de 2,4-D. Por su parte Pola et al. (2008) lograron entre 40 a 84 % de formación de callos con estructuras embriogénicas en seis variedades de sorgo con 9,05 µM de 2,4-D combinado con 2,32 µM de kinetina. En el presente trabajo se le añadió al medio de cultivo de formación de callos diferentes concentraciones de 2,4-D. La adición exógena de este regulador de crecimiento estimuló la formación de callos para esta variedad y este tipo de explante. Los mayores porcentajes de formación de callos con estructuras con estructuras embriogénicas se logró con 18,1 µM de 2,4-D en el medio de cultivo de este regulador de crecimiento.
Es conocido que la toxicidad in vitro de los exudados fenólicos está en relación con el incremento en la producción de estos compuestos ya que estos son oxidados para formar quinonas, debido a la actividad de enzimas oxidativas y posteriormente polimerizados (Tabiyeh et al., 2006).
Los resultados en el incrementó el porcentaje de formación de callo con la concentración adecuada de esté antioxidante (50 mg.l-1) para la variedad estudiada y el tipo de explante utilizado, pudiera estar dado por la eliminación de las sustancias oxidantes y una mayor disponibilidad de los nutrientes presentes en el medio de cultivo. Además, este agente reductor está implicado en los procesos de división y el alargamiento celular (de Pinto et al., 1999). Se conoce el efecto de las hormonas endógenas presentes en los tejidos vegetales en los procesos de división y alargamiento celular. Según Vasar (2004) los agentes antioxidantes tienen efectos beneficiosos en la protección antioxidante de las hormonas endógenas presentes en los explantes, responsables de los procesos celulares antes mencionados.
Al respecto autores como Zhu et al. (1998) y Raghuwanshi y Birch (2010) refieren que el principal problema descrito en los diferentes protocolos de cultivo in vitro en sorgo es la excesiva producción de compuestos fenólicos, que afectan la formación de callos y regeneración de plantas.
La adición de antioxidantes al medio de cultivo ha sido eficaz en la prevención de la oxidación, con un aumento en la eficiencia de regeneración de brotes (Farooq et al., 2002). Por su parte Baskaran y Jayabalan (2005) evitaron la aparición de la oxidación fenólica con la incorporación al medio de cultivo de ácido ascórbico (30 mg.l-1) y agua de coco (5 %); así lograron una alta frecuencia de regeneración en los genotipos de sorgo K8 y K5. Otros autores como Zhao et al., (2010), eliminaron la oxidación fenólica durante la formación de callos en las variedades de sorgo Yuantian No1 y M81E con concentraciones de 10 mg.l-1de este antioxidante.
En este trabajo, se observó la secreción de compuestos fenólicos al medio de cultivo, alrededor del explante, lo que incrementó la mortalidad de las semillas inmaduras empleadas como explante inicial e influyó de forma negativa en la formación de callo al impedir la germinación de estas. Por ello para eliminar el efecto negativo de los compuesto fenólicos se le adicionó ácido ascórbico al medio de cultivo. Con el ácido ascórbico 50 mg.l-1 se logró una reducción significativa de la oxidación fenólica y se incrementó el porcentaje de formación de callo hasta un 95 %.
Existen en la literatura científica referencia de varios protocolos de regeneración de plantas vía embriogénesis somática en sorgo (Zhao et al., 2010). Sin embargo, es limitada la información que en ellos aparecen acerca del proceso de formación de embriones somáticos y la descripción de las diferentes etapas de histodiferenciación. En la regeneración de plantas por esta vía se emplean diferentes reguladores de crecimiento (auxinas y citoquininas), pero el tipo y concentración que se han utilizado en los diferentes protocolos de regeneración de plantas son variados. La combinación de bajas concentraciones de 2,4-D y 6-BAP estimularon la formación de embriones somáticos en sorgo variedad CIAP 132-R. La reducción de las concentraciones de 2,4-D en el medio de cultivo es utilizado para la obtención de embriones somáticos en la mayoría de los cultivos de especies monocotiledóneas, fundamentalmente en las Poaceas. En este estudio la reducción de la concentración de 2,4-D de 18,1 a 4,52 µM y la adición de 6-BAP (2,22 µM) al medio de cultivo, estimuló la formación de embriones somáticos. En este caso el balance auxina / citoquininas en los tratamientos del uno al diez, no fue suficiente para la formación de embriones somáticos por lo que se produjo la formación de raíces.
En condiciones experimentales las células embriogénicas se desarrollan y expresan su potencial embriogénico. La fase de formación y diferenciación de los embriones es crucial, aquí se determinan y especifican los patrones de polaridad del eje apical-basal para el desarrollo de los ápices caulinar y radicular del embrión somático (Souter y Lindsey, 2000).
Como ha sido descrito por varios autores, las citoquininas adicionadas al medio de cultivo pueden influir en la formación y diferenciación de los embriones somáticos. Sobre esto, George (1996) señaló que las citoquininas promueven el desarrollo de los embriones somáticos preformados. Estos reguladores del crecimiento actúan como un estímulo y son requeridos para mantener la división celular y además están involucradas en promover la transición de las células indiferenciadas hacia la diferenciación (del Pozo et al., 2005).
El 2,4-D en concentraciones bajas ha sido el regulador del crecimiento más estudiado para la formación de callos con estructuras embriogénicas en los cereales (Manjula et al., 2000 y Bi et al., 2007). Pola et al. (2008) obtuvieron una alta frecuencia de callos con estructuras embriogénicas (84 %) cuando emplearon 9,05 µM de 2,4-D. Sin embargo, al combinar esta auxina con otra citoquinina como la kinetina (2,32 µM) lograron el mayor porcentajes de formación de callos con estructuras embriogénicas (100 %).
En sorgo Da Costa et al. (2002) y Muñoz (2003) adicionaron 6-BAP en los medios de cultivo para la formación embriones somáticos, logrando con 4.44 µM el mayor número de embriones somáticos por callo. Otros autores como Gupta et al. (2006), Maheswari et al. (2006), Pola y Mani (2006) también observaron el efecto estimulante de la combinación de auxina y citoquinina en la formación de callos con estructuras embriogénicas.
Los resultados del presente ensayo evidenciaron que la combinación del 2,4-D y de 6-BAP en el medio de cultivo en bajas concentraciones favoreció el proceso de formación y diferenciación de embriones somáticos a partir de callos con estructuras embriogénicas en sorgo variedad CIAP 132-R.
CONCLUSIONES
Se logró la formación de callos a partir de hojas cotiledonales de semillas inmaduras de sorgo rojo, variedad CIAP 132-R. La alta eficiencia en la formación de callos con estructuras embriogénicas fue estimulada por la concentración de 2,4-D, el efecto antioxidante del ácido ascórbico y el tipo de explante utilizado como material inicial. La adición de reguladores de crecimiento al medio de cultivo favoreció la formación de embriones somáticos. La bajas concentraciones en el balance auxina / citoquinina exógena, incrementó la formación de embriones somáticos.
AGRADECIMIENTOS
Al Instituto de Biotecnología de las Plantas de la Universidad Central ¨Martha Abreu¨ de las Villas de la Ciudad de Santa Clara, Villa Clara, Cuba, por permitir llevar a cabo esta investigación.
REFERENCIAS
Baskaran P, Jayabalan N. A simple approach to improve plant regeneration from callus culture of Sorghum bicolor for crop improvement. Journal Agricul Biotech. 2005;1(1):179-192. [ Links ]
Bi R, Kou MM, Chen LG, Mao SR, Wang HG. Plant regeneration through callus initiation from mature embryo of Triticum. Plant Breed. 2007;126(1):9-12. Doi: 10.1111/j.1439-0523.2007.01327.x. [ Links ]
Da Costa E, Volkmer de Castillo C, Netto F, Viana A. In vitro culture of Cedrela fissilis Vellozo (Meliaceae). Plant Cell Tis Organ Cult. 2002;70:259-268. [ Links ]
De Pinto M, Francis D, De Gara L. The redox state of the ascorbate-dehydroascorbate pair as a specific sensor of cell division in tobacco BY-2 cells. Protoplasma. 1999;209(1-2):90-97. [ Links ]
Del Pozo JC, López-Matas MA, Ramírez-Parra E, Gutiérrez C. Hormonal control of the plant cell cycle. Physiologia Plantarum. 2005;123(2):173-183. Doi: 0.1111/j.1399-3054.2004.00420.x. [ Links ]
Díaz MF. Estudios desarrollados con sorgo en el Instituto de Ciencia Animal (ICA) 2006-2008. La Habana, Cuba; 2008. p 14. [ Links ]
Gamborg OL, Shyluk JP, Brar DS, Constable F. Morphogenesis and plant regeneration from callus of immature embryos of sorghum. Plant Sci Lett.1977;10:67-74. [ Links ]
George E. Plant propagation by tissue culture. Part 2. In: Practice. 2nd ed. Exegetics Limited. England; 1996. 1361 p. [ Links ]
Gupta S, Khanna VK, Ramesh War S, Garg GK. Strategies for overcoming genotypic limitations of in vitro regeneration and determination of genetic components of variability of plant regeneration traits in Sorghum bicolor (L) Moench. Plant Cell Tiss Organ Cult. 2006;86(3):379-388. Doi: 10.1007/s11240-006-9140-0. [ Links ]
Henry RJ. Evaluation of plant biomass resources available for replacement of fossil oil. Plant Biotechnol J. 2010;8(3):288-293. Doi: 10.1111/j.1467-7652.2009.00482.x. [ Links ]
Jaramillo M, Peña M, Ángulo I, León A. Valor nutricional de cultivares de sorgo granífero (Sorghum bicolor (L) Moench) altos en taninos producidos en Venezuela. Zoot Trop Fonoiap. 1993;12(1):23-53. [ Links ]
Jogeswar G, Ranadheer D, Anjaiah V, KaviKishor P. High frequency somatic embryogenesis and regeneration in different genotypes of Sorghum bicolor (L.) Moench from immature inflorescence explants. In Vitro Cell Dev Biol. 2007;43(2):159-166. Doi: 10.1007/s11627-007-9033-x. [ Links ]
Liu G, Zhou Q, Song S, Jing H, Gu W, Li X. et al. Research advances into germplasm resources and molecular biology of the energy crop sweet sorghum. China Bull Bot. 2009;44(3):253-261. [ Links ]
Maheswari M, Jyothi Lakshmi N, Yadav S, Varalaxmi Vijaya L, Vanaja M, et al. Efficient plant regeneration from shoot of sorghum. Biol Plant. 2006;50(4):741-744. Doi: 10.1007/s10535-006-0120-3. [ Links ]
Manjula S, Maralappanavar M, Kuruvinashetti M, Harti C. Regeneration establishment and evaluation of somaclones in Sorghum bicolor (L.) Moench. Euphytica. 2000;115(3):173-180. Doi: 10.1023/A:1004010315991. [ Links ]
Muñoz S. Embriogénesis somática en Cedro (Cedrela odorata L.) a partir de Cotiledones. Trabajo de diploma en opción al título de licenciado en Biología, Universidad Nacional Agraria La Molina, Perú; 2003. [ Links ]
Murashige T, Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol Plant. 1962;15(3):473-497. Doi: 10.1111/j.1399-3054.1962.tb08052.x. [ Links ]
O' Kennedy M, Grootboom A, Shewry P. Harnessing sorghum and millet biotechnology for food and health. J Cereal Sci. 2006;44(3):224-235. Doi: 10.1016/j.jcs.2006.08.001. [ Links ]
Pérez A, Saucedo O, Iglesias J, Wencomo H, Reyes F, Oquendo G, et al. Caracterización y potencialidades del grano de sorgo (Sorghum bicolor L. Moench). Pastos y Forrajes. 2010;33(1):1-18. [ Links ]
Pola S, Saradamani N, Ramana T. Enhanced shoot regeneration in tissue culture studies of Sorghum bicolor. Journal Agric Techn. 2008;3(2):275-286. [ Links ]
Pola S, Mani S. Somatic embryogenesis and plantlet regeneration in Sorghum bicolor (L.) Moench, from leaf segments. J Cell Molec Biol. 2006;5:99-107. [ Links ]
Raghavan V. Role of 2,4-dichlorophenoxyacetic acid (2,4-D) in somatic embryogenesis on cultured zygotic embryos of Arabidopsis: cell expansion, cell cycling, and morphogenesis during continuous exposure of embryos to 2,4-D. Amer J Bot. 2004;91(11):1743-1756. Doi: 10.3732/ajb.91.11.1743. [ Links ]
Raghuwanshi A, Birch R. Genetic transformation of sweet sorghum. Plant Cell Rep. 2010;29(9):997-1005. Doi: 10.1007/s00299-010-0885-x. [ Links ]
Souter M y Lindsey K. Polarity and signaling in plant embryogenesis. J Exp Bot. 2000;51:971-983. Doi: 10.1093/jexbot/51.347.971. [ Links ]
Tabiyeh D, Bernard F, Shacker H. Investigation of glutathione, salicylic acid and GA 3 effects on browing in Pistacia vera shoot tips culture. Acta Hortic. 2006;726:201-204. [ Links ]
Thomas E, King P, Portykus I. Shoot and embryo-like structure formation from cultured tissues of Sorghum bicolor. Naturwissenschaften. 1977;64(11):587. Doi: 10.1007/BF00450647. [ Links ]
Vasar V. Aplication of antioxidants in rooting of Prunus Avium (L). Microshoots. Acta Universitatis Latvieensis, Biology. 2004;676:251-256. [ Links ]
Vikrant L, Rashid A. Somatic embryogenesis or shoot formation following high 2,4-D pulse-treatment of mature embryos of Paspalum scrobiculatum. Biol Plant. 2003;46:297-300. Doi: 10.1023/A:1022875332607. [ Links ]
von Arnold S, Sabala I, Bozhkov P, Dyachok J Filonova L. Developmental pathways of somatic embryogenesis. Plant Cell Tiss Org Cult. 2002;69(3):233-249. Doi: 10.1023/A:1015673200621. [ Links ]
Zhao Z, Cai T, Tagliani L, Miller M, Wang N, Pang, H, et al. Agrobacterium-mediated sorghum transformation. Plant Mol Biol. 2000;44(6):789. Doi: 10.1023/A:1026507517182. [ Links ]
Zhao L, Liu S, Song S. Efficient induction of callus and plant regeneration from seeds and mature embryos of sweet sorghum. Chin Bull Bot. 2008;25:465-468. [ Links ]
Zhao L, Liu S; Song S. Optimization of callus induction and plant regeneration from germinating seeds of sweet sorghum (Sorghum bicolor (L.) Moench). African J Biotech. 2010:9(16):2367-2374. [ Links ]
Zhu H, Muthukrishnan S, Krishnaveni S, Wilde G, Jeoung J, Liang G. Biolistic transformation of sorghum using a rice chitinase gene. Journ Gen Breed. 1998;52:243-252. [ Links ]