Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Acta Biológica Colombiana
versión impresa ISSN 0120-548X
Acta biol.Colomb. vol.20 no.3 Bogotá set./dic. 2015
https://doi.org/10.15446/abc.v20n3.47354
Doi: http://dx.doi.org/10.15446/abc.v20n3.47354.
Artículo de investigación/Original research paper
POTENCIAL DE REGENERACIÓN DE Psychotria ipecacuanha (Rubiaceae) A PARTIR DE CAPAS DELGADAS DE CÉLULAS
Regeneration Potential of Psychotria ipecacuanha (Rubiaceae)from Thin Cell Layers
Catalina BOTERO GIRALDO1, Aura Inés URREA TRUJILLO1, Esther Julia NARANJO GÓMEZ1
1 Grupo de Biotecnología, Universidad de Antioquia. Medellín, Colombia.
For correspondence. catabuffy@gmail.com.
Received: 21st November 2014, Returned for revision: 8th February 2015, Accepted: 21st April 2015.
Associate Editor: Xavier Marquínez Casas.
Citation / Citar este artículo como: Botero Giraldo C, Urrea Trujillo AI, Naranjo Gómez EJ. Potencial de regeneración de Psychotria ipecacuanha (Rubiaceae) a partir de capas delgadas de células. Acta biol. Colomb. 2015;20(3):181-192. doi: http://dx.doi.org/10.15446/abc.v20n3.47354.
RESUMEN
Conociendo las propiedades medicinales de la especie vegetal Psychotria ipecacuanha (Brot.) Stokes, su crítico estado de conservación, así como las dificultades que presenta para la propagación efectiva, el presente estudio tuvo como objetivo evaluar su potencial de propagación por los sistemas de regeneración in vitro, organogénesis y embriogénesis somática. Para este propósito, capas delgadas de células (CDCs) de tallos y de hojas, así como segmentos foliares fueron sometidos a diferentes tratamientos con reguladores de crecimiento y condiciones de luz. Además se estableció el efecto de diferentes longitudes de onda vía diodos emisores de luz (LEDs), sobre la regeneración en estos explantes y nudos provenientes de plantas in vitro. Los resultados obtenidos mostraron que los segmentos de hoja y las CDCs de tallo sembrados en el medio de cultivo MS suplementado con las combinaciones de los reguladores de crecimiento IBA + BAP e IBA + TDZ formaron embriones somáticos y brotes. Los cortes histológicos realizados corroboraron estos dos tipos de origen. Se encontró que bajo la condición lumínica 16/8, se alcanzaron los mejores resultados de inducción de brotes y embriones. En cuanto al efecto de las diferentes longitudes de onda de luz, se encontró que las correspondientes al rojo, verde y blanca, favorecieron el crecimiento y desarrollo de brotes y la inducción de embriones somáticos. El desarrollo de los brotes a partir de los nudos no presentó diferencias estadísticas entre los tratamientos con LEDs, por lo que se recomienda el uso de la luz blanca continua y con fotoperiodo durante el proceso de multiplicación y desarrollo de éstos.
Palabras clave: análisis histológico, diodos emisores de luz, embriogénesis somática, organogénesis, reguladores de crecimiento.
ABSTRACT
Knowing the medicinal properties of the plant specie Psychotria ipecacuanha (Brot.) Stokes, its critical condition and the difficulties for its effective propagation, the present study aimed to assess the potential of propagation of P. ipecacuanha by in vitro systems of regeneration, organogenesis and somatic embryogenesis. For this purpose, thin cell layers (TCL) of stems and leaves, as well as leaf segments were subjected to different treatments of plant growth regulators and light conditions. Furthermore, the effect of different wavelengths via light emitting diodes (LED's), was established for the regeneration in these explants and nodal explants from in vitro plants. The results showed that leaf segments and stem TCL, cultured in MS medium supplemented with the combinations of growth regulators IBA + BAP and IBA + TDZ, formed somatic embryos and shoots. The histological sections supported the two types of source. It was found that the best results in shoot induction and embryos were achieved under the light condition 16/8-h light/ dark. Regarding the effect of different wavelengths, it was found that those corresponding to red, green, and white supported the growth and shoot development as well as somatic embryos induction. The shoots development from the nodal explants did not show statistical differences between LEDs treatments, so the use of a continuous white light and photoperiod is recommended during their multiplication and development.
Keywords: histology, light-emitting diodes, organogenesis, plant growth regulators, somatic embryogenesis.
INTRODUCCIÓN
Psychotria ipecacuanha (Brot.) Stokes (Rubiaceae) es una especie de gran importancia medicinal a nivel mundial, sus poblaciones naturales se distribuyen en países como Nicaragua, Costa Rica, Panamá, Brasil y Colombia (Garcia et al., 2005; Ferreira et al., 2012). Esta especie se encuentra en peligro crítico de extinción según los reportes de literatura, aunque no ha sido categorizada por la Unión Internacional para la Conservación de la Naturaleza (UICN) (Garcia et al., 2005; Martins et al., 2009). En Colombia las poblaciones remanentes de esta especie no superan los 20 individuos, excepto un sitio en el Chocó (Titumate), donde se reporta un poco más de 50 individuos (Cardona, com. pers.). Desde principios del siglo XX, la planta se encuentra amenazada por la explotación exagerada a la que fue sometida desde el pasado por su potencial en la medicina tradicional, ya que fue y aún es usada como emético, expectorante, amebicida y diaforético (Souza et al., 2008; Ferreira et al., 2012). Se conoce su uso en el tratamiento de la disentería amebiana causada por Entamoeba histolytica durante casi 50 años. Estas propiedades farmacológicas se deben principalmente a la producción de los alcaloides emetina, cefalina, psicotrina, éter metílico de psicotrina y emetamina (Trease y Evans, 1988). La emetina, es el componente bioactivo que se encuentra en mayor proporción (60-70 %), es extraído de la corteza del rizoma y de las raíces. Actúa inhibiendo la síntesis y actividades de proteínas, del DNA y RNA ribosomales y mitocondriales, ensayos realizados en células de mamífero, levaduras y vegetales (Akinboye y Bakare, 2011). Recientemente se reportó que este alcaloide tiene una actividad antiviral significativa contra el virus del dengue (DENV) (Low et al., 2009).
La propagación convencional de esta especie se realiza principalmente vía asexual, la propagación por semillas presenta dificultades debido a que pierden fácilmente la viabilidad después de su recolección, su germinación es pobre, el crecimiento es lento y un alto número de plántulas mueren prematuramente en condiciones naturales. Los métodos convencionales aplicados en la domesticación de P. ipecacuanha no han sido del todo exitosos (Hidalgo y Palma, 1993; Palma, 1996). Lo anterior sumado a la explotación exagerada de sus poblaciones naturales, hacen necesario plantear alternativas eficientes para la propagación, reforestación, conservación y uso sostenible de esta especie medicinal.
Dentro de las técnicas biotecnológicas, el cultivo in vitro ofrece la posibilidad de obtener un alto número de plantas con las mismas características genéticas de la planta madre, aún para aquellas especies difíciles de propagar por métodos convencionales. Además de estas ventajas se tiene el costo económico, ya que la propagación se puede lograr en menor tiempo, en un espacio reducido y con la posibilidad de conservarla por cortos o largos periodos de tiempo.
La regeneración de plantas in vitro se puede alcanzar vía organogénesis o embriogénesis somática, ambas formas de regeneración pueden lograrse involucrando diferentes explantes, los más utilizados son ápices, nudos, segmentos de hojas, partes florales entre otros. Las capas delgadas de células (CDCs) han sido utilizadas con éxito para la regeneración de Beta vulgaris (remolacha), Brassica napus (canola), Panax ginseng (ginseng), Phaseolus vulgaris (fríjol), Oryza sativa (arroz), Sorghum bicolor (sorgo), Zea mays (maíz), Musa spp. (banano), Citrus spp. (naranja, limón, mandarina), Cocos nucifera (coco), Lycopersicon esculentum (tomate), Manihot esculenta (yuca), Pinus radiata (pino), Pseudotsuga menziesii y Sequoiadendron spp. (coníferas), Rosa spp., entre otras (Nhut et al., 2003a; Nhut et al., 2003b). Entre las ventajas comparativas descritas para este explante se tienen que las células son más sensibles de responder por estar expuestas directamente a los componentes del medio de cultivo, lo que facilita la difusión de nutrientes (Teixeira da Silva et al., 2006; Kumar y Singh, 2009) y de sustancias promotoras del crecimiento, y se elimina el posible efecto negativo de capas de mayor grosor, mayor tamaño del explante. Según Fehér et al. (2003) una mayor superficie de contacto con el medio de cultivo, puede considerarse estresante y así alterar el metabolismo celular.
En P. ipecacuanha se han empleado técnicas de cultivo de tejidos principalmente para la propagación usando ápices, segmentos nodales y de raíz (Ideda et al., 1988; Jha y Jha, 1989; Yoshimatsu y Shimomura, 1991; Yoshimatsu y Shimomura, 1994). Rout et al. (2000) lograron inducir embriones somáticos indirectos y el desarrollo de vitroplantas a partir de éstos. En este mismo sentido Lara et al. (2003b), reportan la obtención de embriones somáticos y brotes adventicios directos a partir de porciones de hojas. Batistini et al. (2002), reportaron un trabajo preliminar sobre diferentes técnicas de cultivo para la micropropagación de esta especie, incluyendo un sistema de inmersión temporal, y sistemas en medio semisólido y líquido, obteniendo un número bajo de brotes por explante. Naranjo et al. (2014), describen el efecto de la procedencia sobre la respuesta in vitro al proceso embriogénico.
Para la especie relacionada Psychotria acuminata, Lara et al. (2003a), realizaron la propagación clonal de individuos de cuatro poblaciones de Costa Rica, encontrando muy baja eficiencia en el protocolo de desinfección para diferentes explantes evaluados, cuando el material provenía directamente del campo. Estos autores, describen además, diferencias en los coeficientes de multiplicación para las diferentes poblaciones.
Actualmente en Colombia no se han realizado estudios sobre Psychotria ipecacuanha en relación a aspectos ecológicos, manejo del cultivo, contenido de metabolitos secundarios, variabilidad genética y apenas se inicia con la propagación in vitro, siendo éste un trabajo pionero en cuanto al uso de capas delgadas de células y el segundo de cultivo in vitro.
Con el propósito de establecer un protocolo de regeneración in vitro, en este trabajo se evaluó la respuesta organogénica y/o embriogénica de capas delgadas de células (CDCs) de tallos y hojas y segmentos de hoja de P. ipecacuanha, así como el efecto de diferentes longitudes de onda usando diodos emisores de luz.
MATERIALES Y MÉTODOS Material vegetal
El material vegetal consistió en plantas in vitro obtenidas de individuos de diferentes poblaciones de P. ipecacuanha del Urabá antioqueño, de acuerdo al Contrato No. 50 de Acceso a Recursos Genéticos sin interés Comercial otorgado por el Ministerio de Ambiente y Desarrollo Sostenible.
Propagación in vitro
Ápices y nudos provenientes de plantas mantenidas en casa malla, fueron desinfectados siguiendo la metodología descrita por Naranjo et al. (2014) y sembrados en el medio de cultivo basal estandarizado previamente para el establecimiento y multiplicación del material stock, compuesto por las sales MS (Murashige y Skoog, 1962) a la mitad de su concentración, suplementado con sacarosa (20 gL-1) y gelrite (Gellan Gum Powder, Phyto Technology Laboratories®) 2,8 gL1, ajustando el pH a 5,8 antes de esterilizar en autoclave a 121 °C y 120 lb de presión por 15 min. El material fue mantenido en condiciones estándar de crecimiento de las plantas in vitro, en un cuarto de crecimiento a 23 ± 1 °C y luz constante de 20 (jmolrrrV. Se realizaron subcultivos cada cuatro semanas.
Organogénesis y embriogénesis somática
Para estos ensayos se utilizaron como explantes CDCs de tallos y hoja, y segmentos de hoja de las plantas propagadas in vitro con cinco subcultivos. Para obtener las CDCs se realizaron cortes transversales a los tallos (entrenudos sin incluir el meristemo lateral) y segmentos de hojas jóvenes de tamaños entre 0,5-1,0 mm y entre 0,20,5 mm respectivamente. Los segmentos de hoja, de ca. 0.5 cm2 fueron sembrados con el haz en contacto con el medio de cultivo.
Para establecer el tratamiento más adecuado para inducir procesos de regeneración vía organogénica y/o embriogénica, se evaluó el efecto de las combinaciones de los reguladores de crecimiento IBA + BAP e IBA + TDZ; teniendo en cuenta ensayos preliminares y de acuerdo a lo descrito en la literatura para esta especie y otras relacionadas. Los reguladores fueron adicionados al medio de cultivo compuesto por las sales basales MS suplementado con sacarosa (30 gL-1), mio-inositol (100 mgL-1), glutamina (400 mgL-1), asparagina (100 mgL-1), arginina (100 mgL-1), tiamina (4 mgL-1) y gelrite (2,8 gL-1) (Tabla 1).
En este ensayo los cultivos se mantuvieron en cámara climatizada (DIES Climática 480+, Modelo CLL80 PLUS) a 25 ± 2 °C, humedad relativa de 60 % y a una intensidad lumínica entre 20-30 (jmolnvV. Se evaluaron además dos condiciones lumínicas, oscuridad y fotoperiodo 16 horas luz/8 oscuridad. El tamaño de muestra utilizado fue 16 CDCs de tallo, 16 CDCs de hoja y 16 segmentos de hoja por tratamiento, distribuidos en cajas de petri (100 x 15 mm de diámetro) con 4 explantes por caja. El ensayo se realizó por triplicado.
Sesenta (60) días después de la siembra, se registraron como variables respuesta, la supervivencia (%), el promedio de explantes que respondieron a la formación de brotes y/o embriones y el promedio de embriones y/o brotes por explante. Luego de 4 meses de permanecer bajo las condiciones anteriores, los explantes fueron transferidos al medio de regeneración (MR) seleccionado luego de ensayos preliminares, con el propósito de continuar con el proceso de desarrollo hasta plantas completas. El medio de regeneración utilizado consistió del medio de cultivo descrito en este ensayo suplementado con BAP 0,5 mgL-1.
Análisis histológico
Para corroborar el origen embriogénico u organogénico de los brotes obtenidos, se realizaron cortes histológicos de algunos explantes que presentaron respuesta a la formación de brotes y embriones.
Los explantes seleccionados de los diferentes tratamientos fueron fijados en formol-alcohol-ácido acético (FAA) durante 24 horas. Posteriormente, se cortaron en fragmentos de 1 cm de longitud para ser procesados en una serie de deshidratación de alcoholes y xilol (Ruzin, 1999). Los fragmentos fueron embebidos en parafina (PARAPLAST) durante 12 h a 55 °C. Se obtuvieron secciones longitudinales y transversales con un micrótomo rotatorio (LEICA Model RM2125), en espesores de 3-5 jm.
Para las descripciones histológicas generales las secciones obtenidas se colorearon con safranina y azul de alcian (Johansen, 1940). Para descripciones adicionales, algunas secciones fueron coloreadas con el reactivo de PAS (reacción de Schiff del ácido periódico) para polisacáridos insolubles, contrastado con Amido black, para proteínas (Yeung y Saxena, 2005).
Las muestras se examinaron con un microscopio fotónico (Olympus CH30 Co, Ltda) y las fotografías se tomaron con una cámara digital incorporada a un microscopio Nikon Eclipse 80i.
Efecto de diferentes longitudes de onda sobre el crecimiento y desarrollo de brotes y/o inducción de embriones somáticos
Para evaluar la respuesta de segmentos nodales, CDCs de tallo y segmentos de hoja a las longitudes de onda correspondientes al azul (450-495 nm), rojo (620-750 nm), verde (495-570 nm) en un equipo de celdas de luz (Dimaq, Colombia), y blanca (420-450 nm) como control correspondiente a la emitida por la cámara climatizada. Los explantes fueron sembrados en el medio de cultivo basal suplementado con las combinaciones de reguladores que tuvieron mayor efecto a la formación de embriones y/o brotes. El medio de cultivo basal y las condiciones de crecimiento se mantuvieron como el ensayo anterior.
Para las CDCs y segmentos de hoja, el tamaño de muestra incluyó tres cajas de Petri (60 x 15 mm de diámetro) por tratamiento y por LED, cada uno con cuatro CDCs de tallo y cuatro segmentos de hoja. El experimento se realizó por triplicado. Las variables respuesta fueron las mismas registradas en el ensayo anterior y a los 60 días.
En cuanto a los segmentos nodales de plantas in vitro, éstos tuvieron un tamaño promedio de 2 cm de longitud. El tratamiento control fue luz blanca continua y además se incluyó un control de luz blanca con fotoperiodo. El medio de cultivo utilizado en este caso fue el medio de multiplicación descrito inicialmente. Los cultivos fueron mantenidos bajo las mismas condiciones ambientales descritas en el ensayo anterior. El tamaño de muestra fue de cinco frascos de vidrio (6,5 cm x 8,0 cm) por condición lumínica, cada uno con tres nudos. Se registró la supervivencia (%), la altura (cm), número de hojas y número de nudos por explante, cada dos (2) meses después de la siembra, siendo transferidos a medio fresco de la misma composición cada 30 días.
Análisis de los datos
Para los análisis estadísticos se evaluaron primero los supuestos de normalidad y homogeneidad de varianza, y para los que no cumplieron con el supuesto se realizaron análisis estadísticos no paramétricos. Los datos tabulados se presentaron como medias ± SD. La significancia estadística de las diferencias entre grupos se evaluó mediante ANOVA unifactorial usando el paquete estadístico R versión 3.0.3 Copyright (C) (2014). Se valoraron las diferencias entre los tratamientos utilizando la prueba de Tukey HSD con un 95 % de confianza. Las pruebas se consideraron significativas para un error a = 0,05.
RESULTADOS
Respuesta organogénica y embriogénica
La respuesta a la regeneración vía organogénica y embriogénica se alcanzó en los segmentos de hoja y en las CDCs de tallo, mientras que las CDCs de hoja mostraron baja supervivencia y respuesta nula. En general el número de explantes con respuesta a los diferentes tratamientos fue muy bajo (1 ó 2), manteniéndose este comportamiento en todas las repeticiones, por lo que los promedios obtenidos por tratamiento no se ajustaron a una distribución normal aún con diferentes pruebas estadísticas.
Cuando se evaluó el efecto de la condición lumínica, se encontró que en oscuridad, los explantes respondieron formando callo no embriogénico en un alto porcentaje (65,3 %). El callo bajo estas condiciones es friable y fibroso, de apariencia hidratada y con raíces, comparado al obtenido bajo condiciones de fotoperiodo (23,8 %), típicamente granular y nodular.
Organogénesis
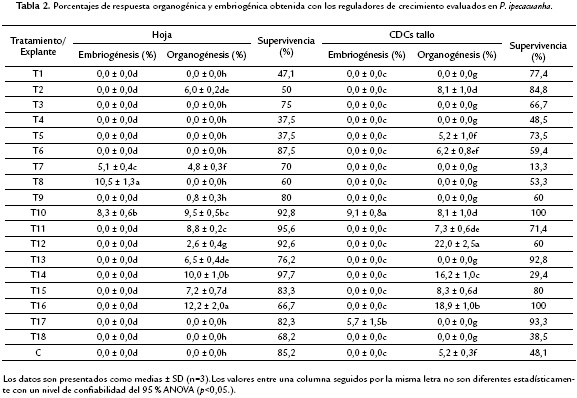
Para este sistema de regeneración los tiempos de respuesta fueron variables, estuvieron en un rango entre dos y cinco meses después de la siembra. Con la combinación de reguladores IBA + BAP (IBA 2 + BAP 1, IBA 1 + BAP 2, IBA 0,5 + BAP 1, IBA 10 + BAP 5, IBA 5 + BAP 1 mgL-1), se logró organogénesis tanto a partir de CDCs de tallo como segmentos de hoja. Los porcentajes de respuesta oscilaron entre 5 % y 8,0 % de explantes formando brotes.
Con la combinación de reguladores de crecimiento IBA + TDZ (IBA 1 + TDZ 0,3, IBA 2 + TDZ 0,3, IBA 3 + TDZ 0,3, IBA 1 + TDZ 0,5, IBA 2 + TDZ 0,5, IBA 3 + TDZ 0,5, IBA 1 + TDZ 1 mgL-1), también respondieron ambos explantes, los porcentajes de respuesta organogénica fluctuaron entre 2,6 % y 22 %. La menor frecuencia se obtuvo con segmentos de hoja (2,6 %) en la combinación IBA (3,0 mgL-1) más TDZ (0,3 mgL-1), mientras que la mayor frecuencia (22 %) se alcanzó a partir de CDCs de tallo con la misma combinación. Es de resaltar el promedio de brotes totales por explante obtenido con esta combinación de reguladores, 0,71 y 0,24, para CDCs de tallo y segmentos de hoja, respectivamente, fue mayor al alcanzado con la combinación IBA + BAP, 0,12 y 0,09 para CDCs de tallo y hoja, respectivamente (Tabla 2).
En los segmentos de hoja que presentaron respuesta organogénica, ésta siempre se obtuvo en la vena media, en el extremo proximal al peciolo. Además se encontró que el grosor de la vena media, tuvo un efecto promotor sobre la respuesta.
Embriogénesis somática
Para este sistema de regeneración el tiempo de respuesta se presentó entre cinco a siete meses. Los porcentajes de respuesta embriogénica fluctuaron entre 5 % y 10 %. Con segmentos de hoja se alcanzó la frecuencia más baja de respuesta (5 %) en el tratamiento IBA (10 mgL-1) + BAP (5 mgL-1), y la más alta (10%) en el tratamiento IBA (4 mgL-1) + BAP (2 mgL-1). El número de embriones somáticos promedio obtenidos fue de 0,46 para segmentos de hoja y 0,59 para CDCs de tallo (Tabla 2).
Análisis histológico
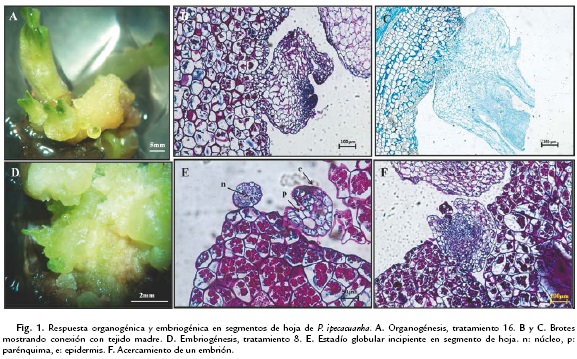
Con los cortes histológicos se logró evidenciar la principal característica que diferencia un proceso embriogénico de uno organogénico, la conexión con el tejido materno en el caso de la organogénesis (Fig. 1B-1C) y la completa independencia del tejido que le dio origen en la embriogénesis (Kumar y Singh, 2009) (Fig. 1E-1F).
En los embriones se visualizó una capa de células bien definida formando la epidermis, seguida de células parenquimáticas rodeando la zona procambial y los haces vasculares. En el callo embriogénico se observó un estadío globular incipiente, delimitado por una capa bien definida de células epidérmicas con núcleo conspicuo (Fig. 1E).
En la zona de formación de los meristemos fue evidente una tinción más fuerte, normalmente en esas zonas las células son pequeñas, con núcleos grandes y citoplasma denso (Fig. 1F).
Efecto de diferentes longitudes de onda sobre el crecimiento y desarrollo de brotes y/o inducción de embriones somáticos
Cabe subrayar que este es el primer trabajo donde se evalúan los diodos emisores de luz sobre la inducción y desarrollo de brotes y embriones en P. ipecacuanha.
La respuesta predominante en todos los LEDs evaluados fue la organogénesis y solo en algunos explantes se formaron estructuras parecidas a embriones tanto en segmentos de hoja como en CDCs de tallo. El tiempo de respuesta varió entre 60 y 120 días, además de no evidenciarse un patrón entre los tratamientos, tipo de explante y condición lumínica. Se encontraron, sin embargo respuestas diferenciales de la supervivencia de los explantes, formación de raíces, de callo nodular y de callo embriogénico en cada uno de los LEDs evaluados.
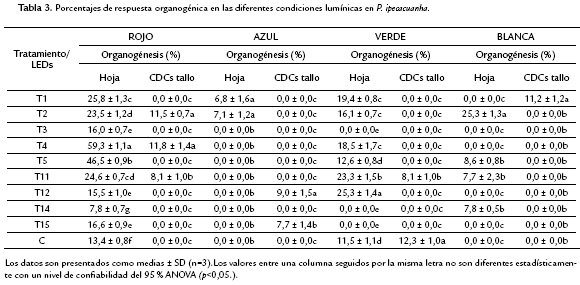
Bajo estas condiciones de LEDs, se encontró que las CDCs de tallo como tipo de explante presentaron un porcentaje de supervivencia menor, en comparación con los segmentos de hoja. Bajo el LED verde, las CDCs de tallo tuvieron el porcentaje más bajo de supervivencia (24,71 %), sugiriendo que esta longitud de onda afecta negativamente la respuesta de este explante. En los segmentos de hoja se registraron los porcentajes más altos de supervivencia, sin embargo, bajo el LED azul se alcanzó solo un 53,66 %. Igual que en el ensayo de regeneración, la frecuencia de respuesta organogénica fue muy baja.
En el LED rojo, con los segmentos de hoja se alcanzó la frecuencia más baja de respuesta (8,3 %) en el tratamiento 14 y la más alta (60 %) en el tratamiento 4. Con las CDCs de tallo también se alcanzó el porcentaje más bajo de respuesta (8,3 %) en el tratamiento 11 (Tabla 3). El número de brotes promedio obtenidos fue de 2,0 para segmentos de hoja y 0,69 para CDCs de tallo. Bajo la longitud de onda del verde, con los segmentos de hoja se alcanzó la frecuencia más alta de respuesta (25 %) en los tratamientos 11 y 12. Con CDCs de tallo se dio el porcentaje más bajo de respuesta (8,3 %) en el tratamiento 11. El número de brotes promedio obtenidos fue de 0,62 para segmentos de hoja y 0,09 para CDCs de tallo.
En general bajo la longitud de onda del rojo y del verde, los explantes alcanzaron casi el doble de su tamaño original, presentaron abundantes raíces y un alto porcentaje de callo con estructuras parecidas a embriones.
En el LED azul, con segmentos de hoja se alcanzó la frecuencia más baja de respuesta (6,7 %) en el tratamiento 1 y la más alta (8,3 %) en el tratamiento 2. Con las CDCs de tallo también se alcanzó el porcentaje más alto de respuesta (8,3 %) en los tratamientos 12 y 15. El número de brotes promedio obtenidos fue de 0,07 para segmentos de hoja y 0,25 para CDCs de tallo.
Bajo la longitud de onda del azul el porcentaje de mortalidad de los segmentos de hoja fue notablemente mayor que en las demás condiciones. Aunque se registró la formación de brotes, en general, esta longitud de onda no favoreció la regeneración de plantas ni desarrollo de estructuras con potencial embriogénico u organogénico.
Por último, bajo la luz blanca, con segmentos de hoja se alcanzó la frecuencia más baja de respuesta (8,3 %) en los tratamientos 5, 11 y 14, y la más alta (25 %) en el tratamiento 2. El número de brotes promedio obtenidos fue de 0,92 para segmentos de hoja y 0,11 para CDCs de tallo.
La respuesta de los explantes bajo esta condición se caracterizó por la formación de callo nodular y granular en alto porcentaje, y varias estructuras parecidas a embriones tanto a partir de CDCs de tallo como de segmentos de hoja.
Los resultados obtenidos bajo las diferentes longitudes de onda mostraron que en las combinaciones de reguladores evaluadas predominó la respuesta organogénica, aunque fue dependiente de la condición lumínica y el tipo de explante. Los segmentos de hoja presentaron mayor porcentaje de respuesta en comparación con las CDCs de tallo. Además se encontraron tratamientos con potencial embriogénico bajo los LEDs rojo, verde y blanco.
Ensayo con segmentos nodales
En este experimento, no se encontraron diferencias significativas (Kruskal-Wallis, p > 0,05), para la altura de la planta (cm), número de hojas y número de nudos registrados a los dos y cuatro meses bajo los diferentes LEDs evaluados.
Bajo condiciones de luz continua, los brotes desarrollados a partir de nudos y a los dos meses después de sembrados, alcanzaron la máxima altura (2,5 cm), el mayor número de hojas (8) y el mayor número de nudos (3). A los cuatro meses de sembradas, las plantas obtenidas presentaron un aumento en la altura respecto al valor registrado a los dos meses (5,5 cm) bajo condiciones de luz continua, sin embargo para el número máximo de hojas (10), las condiciones de luz favorables además de la luz continua fueron el LED rojo y luz blanca con fotoperiodo. El número máximo de nudos (5) se obtuvo en los LEDs verde y rojo.
Con relación a la supervivencia de los nudos, se encontró que a los dos meses bajo todas las condiciones lumínicas evaluadas el porcentaje fue superior al 95 %. Mientras que a los cuatro meses, aún con transferencias a medio fresco cada 30 días, los porcentajes disminuyeron en su mayoría, para el LED verde fue del 55,6 % siendo el menor, seguido del LED rojo 64,7 %, LED azul 71,4 %, luz blanca con fotoperiodo 83,3 %, mientras que en luz blanca continua se mantuvo el 100% de supervivencia de los nudos.
Estos resultados sugieren que las diferentes longitudes de onda empleando LEDs no afectan a corto plazo el desarrollo de P. ipecacuanha, sin embargo después de este tiempo, sólo la luz blanca continua promueve de forma mantenida la supervivencia de las plantas. En general, se observó mayor vigor de las plantas bajo la luz continua y en condiciones de fotoperiodo, y por tanto seleccionadas como las adecuadas para el crecimiento in vitro de P. ipecacuanha.
DISCUSIÓN
La respuesta de sólo un ó dos explantes a un mismo tratamiento de reguladores puede explicarse principalmente por la procedencia (coordenadas geográficas) del material vegetal ya que las plantas in vitro fuente de explantes no estaban identificadas de acuerdo a las poblaciones muestreadas en el Urabá antioqueño (Naranjo et al., 2014). Lara et al. (2003a) describen para la especie relacionada Psychotria acuminata, que las diferencias en el potencial de multiplicación dependieron de la localidad de la cual provenían. También se le puede atribuir a la sensibilidad diferencial según la ubicación en el tejido y estado fisiológico del tejido mismo, tanto para CDCs de tallo como en los segmentos de hoja.
Las CDCs involucran un tipo de célula o capa de tejido y en respuesta a condiciones estrictamente controladas de crecimiento (por ejemplo, luz, temperatura, pH, reguladores de crecimiento y aditivos del medio de cultivo), podría conducir a la inducción in vitro de programas morfogenéticos específicos. La capacidad de una CDCs para entrar a un programa depende de un número de factores, que incluyen percepción correcta de la señal y transducción, la capacidad de la maquinaria genética de responder y reaccionar a estas señales, además del estado fisiológico y origen (tejido y órgano) de las CDCs (Roca y Mroginski, 1991; Teixeira da Silva y Dobránszki, 2013). Lo anterior puede explicar los resultados obtenidos con las CDCs de hoja, ya que este tejido está completamente diferenciado y por tanto la sensibilidad a los reguladores de crecimiento y a otros factores no necesariamente es la misma que la sensibilidad de las CDCs de tallos, los cuales contienen tejidos conductores que le dan mayor competencia.
Contrario a lo obtenido en este trabajo, respuestas exitosas a partir de CDCs de hoja han sido reportadas para otras especies, por ejemplo en manzana (Malus x domestica Borkh) se alcanzó la regeneración de brotes adventicios a partir de CDCs transversales de hoja (Dobránszki y Teixeira da Silva, 2011), en violeta africana (Saintpaulia ionantha) se logró organogénesis directa a partir de este tipo de explante (Ohki, 1994) y en Iris (Iris pallida), se obtuvieron embriones somáticos (Tran Thanh y Bui, 2000).
La respuesta organogénica obtenida siempre en la vena media, puede explicarse debido a que en esta zona de la hoja están presentes los tejidos conductores, el xilema y floema, por donde constantemente se están transportando gran cantidad de nutrientes y agua, además proteínas, reguladores de crecimiento, que podrían estar dando más sensibilidad al tejido frente a reguladores de crecimiento exógenos, promoviendo la regeneración de diferentes órganos (Karam y Al-Majathoup, 2000; Sreedhar et al., 2008).
Se conocen muchos trabajos sobre regeneración vía organogénesis y embriogénesis somática, directa e indirecta en una gran diversidad de plantas, empleando segmentos de hoja y CDCs de tallo (Zhou et al., 2010; Dam et al., 2010; Pacheco et al., 2012; Swarna y Ravindhran, 2013; Yin et al., 2013). Sin embargo, en P. ipecacuanha este es el primer trabajo que evalúa CDCs como explante potencial para su regeneración.
Nuestros resultados a partir de segmentos de hojas en la combinación de los reguladores de crecimiento kinetina (2,5 mgL-1) y 2,4-D (1,0 mgL-1) no indujo respuestas de regeneración, contrario a lo reportado por Rout et al. (2000) en esta misma especie. Nuestros resultados tampoco corroboran los reportes de Lara et al. (2003b), en Psychotria acuminata, quienes obtuvieron embriogénesis directa a partir de hojas con la combinación de reguladores BAP y ANA.
La combinación de reguladores IBA y TDZ ha sido reportada en la regeneración de brotes a partir de hojas cotiledonares en cártamo (Carthamus tinctorius L.) (Ba§alma et al., 2008), Jatropha curcas (Deore y Johnson, 2008) y en Fragaria spp. (Landi y Mezzetti, 2006). Malik y Saxena (1992) sugieren un papel crucial del TDZ en la interacción con otros reguladores de crecimiento endógenos en la reprogramación organogénica y embriogénica de un órgano o tejido, posiblemente liberando, sintetizando, protegiendo o incluso inhibiendo la acción de las auxinas in situ en combinación con otros cambios metabólicos subcelulares. El empleo de la combinación IBA y TDZ podría ser el mejor tratamiento para eliminar la secreción de sustancias fenólicas (debido a la oxidación de fenoles) atribuida a las oxidasas de la auxina.
En este trabajo además de la combinación de reguladores IBA + TDZ, con la combinación de IBA + BAP se promovió respuesta organogénica y embriogénica, a partir de CDCs de tallo y segmentos de hoja. Para otras plantas la acción de ambos reguladores también ha logrado resultados similares (Cob et al., 2010; Kaur et al., 2013; Shukla et al., 2013).
Respecto al efecto del BAP en la respuesta organogénica; Salazar y colaboradores (2005), encontraron que este regulador induce cambios en las células del parénquima distribuidas hacia los alrededores de los haces vasculares, lo cual podría ser la señal que direcciona el destino de las células hacia la formación finalmente de brotes. .
Con la condición lumínica 16 horas luz/8 oscuridad, se alcanzaron los mejores resultados de inducción de brotes y embriones, resultados similares a los descritos por De la Peña et al. (2008), quienes obtuvieron embriogénesis somática en Coffea canephora luego de 21 días, bajo luz continua y condiciones de fotoperiodo, mientras que en completa oscuridad los embriones se formaron luego de cinco semanas. Esto es contrario a la mayoría de reportes en embriogénesis somática que recomiendan mantener los cultivos en condiciones de oscuridad (Teixeira da Silva, 2004; Vengadesan y Pijut, 2009; Gerdakaneh y Zohori, 2013).
En el análisis histológico, la tinción más fuerte en la zona de formación de meristemos es debido a que son células mitóticamente activas con una mayor cantidad tanto de ácidos nucleicos como de proteínas (Lara et al., 2003b). Vasil et al. (1985), sugirieron que la formación de áreas meristemáticas a partir de células diferenciadas, como el parénquima, ocurre en algunos casos debido a la proximidad de estas últimas con tejidos meristemáticos existentes como el procambium, donde hay una mayor concentración de reguladores de crecimiento.
A pesar que la luz es uno de los factores más importantes en el crecimiento de las plantas, la tasa fotosintética y la producción en biomasa, ha sido poco estudiada en términos de calidad y cantidad requerida por las diferentes especies vegetales durante el cultivo de tejidos, considerando que las plantas exhiben un alto grado de plasticidad fisiológica, morfológica y anatómica a diferentes espectros de luz (Avercheva et al., 2009; Brazaityté et al., 2010). Teniendo en cuenta los resultados obtenidos en este trabajo, la luz blanca constante y/o con fotoperiodo 16 luz/8 oscuridad favorecen el crecimiento y desarrollo de brotes a partir de nudos. No obstante, para CDCs de tallo y segmentos de hoja, los LEDs rojo, verde y luz blanca resultaron más efectivos en la respuesta de organogénesis.
En este trabajo se reporta para P. ipecacuanha que la luz roja promueve la elongación de yemas e incremento en altura de brotes, longitud de entrenudos y frecuencia de enraizamiento, además de la inducción de embriogénesis somática, mientras que la luz azul inhibe la embriogénesis, aumenta la síntesis de clorofila y desarrollo estomático, produce brotes cortos con buen desarrollo de hojas (Aksenova et al., 1994; Hoshino y Cuello, 2006; Poudel et al., 2008).
En este trabajo en el LED rojo se alcanzó el rango de porcentajes más altos en cuanto a la formación de brotes y estructuras parecidas a embriones, obteniendo en los segmentos de hoja porcentajes mayores (8,3 - 60 %) que en CDCs de tallo (8,3 - 12,5 %). Además bajo esta condición se encontró alta formación de raíces, similar a lo reportado por Poudel et al. (2008).
Marks y Simpson (1999) reportan en Vitis, que la elongación excesiva bajo el LED rojo, está mediada por fitocromos que afectan el metabolismo de las auxinas, de tal manera que la auxina se conservaría en cultivos iluminados con luz roja, pero sería degradada en cultivos bajo luz azul. Además se ha encontrado que la calidad de la luz regula el metabolismo de los carbohidratos en las plantas superiores, y el contenido de éstos es mayor bajo la luz roja, por lo que se esperaría que las plantas crecieran más bajo este tipo de luz, tal como lo describen Samuoliené et al. (2009).
Li et al. (2010), afirman que las diferencias encontradas en cuanto a la elongación del tallo bajo la luz azul y roja, se da por las interacciones sinergísticas de los receptores de ambas longitudes de onda sobre la promoción o inhibición de la elongación del tallo. Sin embargo, así como en la mayoría de procesos durante el cultivo in vitro, el efecto de la calidad de la luz sobre el crecimiento es genotipo dependiente (Kaldenhoff et al., 1994; Kintzios y Taravira, 1997; Latkowska et al., 2000).
Aunque en los trabajos que describen el uso de LEDs se reportan diferencias en la respuesta bajo la luz roja y azul, en el ensayo de segmentos nodales aquí realizado no se encontraron diferencias significativas en la altura (cm) entre estas dos condiciones lumínicas para los tiempos evaluados.
En el LED azul se obtuvieron los porcentajes más bajos de respuesta organogénica en segmentos de hoja (6,7 - 8,3 %) y CDCs de tallo (8,3 %). Además se dio una completa inhibición de la formación de raíces en segmentos de hoja, igual que se ha reportado para especies como el crisantemo (Teixeira da Silva, 2003), en la cual inhibió la longitud de la planta y la formación de raíces.
Respecto a los tipos de respuesta promovidos por la luz blanca, se ha encontrado que aumenta la inducción de embriogénesis somática (Verhagen y Wann, 1989) y de raíces (Daud et al., 2013). En este trabajo se alcanzaron porcentajes de respuesta a la formación de brotes y embriones, que oscilaron entre 8,3 y 25 % en segmentos de hoja y de 11,1 % en CDCs de tallo, también se presentó abundante formación de raíces.
CONCLUSIONES
En el presente trabajo se demostró que las CDCs de tallo, al igual que los segmentos de hoja presentan potencial de respuesta organogénica y embriogénica en P. ipecacuanha, contrario a las CDCs de hoja. En los segmentos de hoja, el estado fisiológico, la ubicación del explante en la hoja misma e hipotéticamente la procedencia del material vegetal tiene un efecto sobre la respuesta. Las combinaciones de los reguladores de crecimiento IBA + BAP e IBA + TDZ promueven la regeneración vía organogénesis y embriogénesis en segmentos de hoja y CDCs de tallo, mantenidos bajo luz blanca, y fotoperiodo (16 horas luz/8 oscuridad). Los LEDs rojo y verde también favorecen este tipo de respuestas. Los segmentos nodales alcanzan una mayor supervivencia y características morfológicas del desarrollo deseables si son mantenidos bajo luz blanca continua o con fotoperiodo.
Para inducir procesos de organogénesis y embriogénesis somática en P. ipecacuanha, las CDCs de tallo y segmentos de hoja son los explantes adecuados. Además, la condición lumínica 16/8 favoreció la respuesta de regeneración cuando se emplearon las combinaciones de los reguladores de crecimiento IBA + BAP e IBA + TDZ. Los LEDs rojo, verde y luz blanca promovieron la respuesta organogénica en segmentos de hoja principalmente y la formación de estructuras parecidas a embriones. Mientras que los segmentos nodales que permanecieron bajo la luz blanca continua y con fotoperiodo, presentaron mayor supervivencia y características morfológicas deseables.
AGRADECIMIENTOS
A Colciencias y al CODI por el apoyo financiero para el desarrollo del proyecto, a la Universidad de Antioquia y al Grupo de Biotecnología. A Edgar Javier Rincón por la colaboración en el procesamiento histológico de las muestras.
REFERENCIAS
Akinboye ES, Bakare O. Biological Activities of Emetine. Open Nat Prod J. 2011;4:8-15. Doi: 10.2174/1874848101104010008. [ Links ]
Aksenova NP, Konstaninova TN, Sergeeva LI, Macháková I, Golyanovskaya SA. Morphogenesis of potato plants in vitro. Effect of light quality and hormones. J Plant Growth Regul. 1994;13(3):143-146. Doi: 10.1007/BF00196378. [ Links ]
Avercheva OV, Berkovich YA, Erokhin AN, Zhigalova TV, Pogosyan SI, Smolyanina SO. Growth and photosynthesis of Chinese cabbage plants grown under light-emitting diode-based light source. Russ J Plant Physiol. 2009;56(1):14-21. Doi: 10.1134/S1021443709010038. [ Links ]
Basalma D, Uranbey S, Mirici S, Kolsarici O. TDZ x IBA induced shoot regeneration from cotyledonary leaves and in vitro multiplication in safflower (Carthamus tinctorius L.). Afr J Biotechnol. 2008;7(8):960-966. [ Links ]
Batistini AP, Moro JR, França SC, Pereira AMS. Avaliação de diferentes sistemas de cultivo "in vitro" para micropropagaçao de Psychotria ipecacuana (Brot.) Stokes. Rev Bras Pl Med. 2002;5(1):27-35. Doi: 10.1590/S1516-05722012000200024. [ Links ]
Brazaitytė A, Duchovskis P, Urbonavičiūtė A, Samuolienė G, Jankauskienė J, Sakalauskaité J, Sabajevienė G, Sirtautas R, Novičkovas A. The effect of light-emitting diodes lighting on the growth of tomato transplants. Zemdirbyste. 2010;97(2):89-98. [ Links ]
Cob J, Sabja A, Ríos D, Lara A, Donoso P, Arias L, Escobar B. Potencial de la organogénesis como estrategia para la masificación in vitro de Persea lingue en la zona centro-sur de Chile. Bosque. 2010;31(3):202-208. Doi: http://dx.doi.org/10.4067/S0717-92002010000300004. [ Links ]
Dam A, Paul S, Bandyopadhyay TK. Direct somatic embryogenesis and plant regeneration from leaf explants of Limonium sinensis (Girard) Kuntze. Sci Hort. 2010;126(2):253-260. Doi: 10.1016/j.scienta.2010.06.016. [ Links ]
Daud N, Faizal A, Geelen D. Adventitious rooting of Jatropha curcas L. is stimulated by phloroglucinol and by red LED light. In Vitro Cell Dev Biol - Plant. 2013;49(2):183-190. Doi: 10.1007/s11627-012-9486-4. [ Links ]
De la Peña C, Galaz Ávalos RM, Loyola Vargas VM. Possible role of light and polyamines in the onset of somatic embryogenesis of Coffea canephora. Mol Biotechnol. 2008;39(3):215-224. Doi: 10.1007/s12033-008-9037-8. [ Links ]
Deore CA, Johnson ST. High frequency plant regeneration from leaf disc cultures of Jatropha curcas L.: an important biodiesel plant. Plant Biotechnol Rep. 2008;2(1):7-11. Doi: 10.1007/s11816-008-0042-y. [ Links ]
Dobránszki J, Teixeira da Silva J. Adventitious shoot regeneration from leaf thin cell layers in apple. Sci Hort. 2011;127(3):460-463. Doi:10.1016/j.scienta.2010.11.003. [ Links ]
Fehér A, Pasternak T, Dudits D. Transition of somatic plant cells to an embryogenic state. Plant Cell Tissue Organ Cult. 2003;74(3):201-228. Doi: 10.1023/A:1024033216561. [ Links ]
Ferreira QS, Paloma M, Lima dos Santos L, Trindade MF. Use and importance of quina (Cinchona spp.) and ipeca (Carapichea ipecacuanha (Brot.) L. Anderson): Plants for medicinal use from the 16th century to the present. J Herb Med. 2012;2(4):103-112. Doi: 10.1016/j.hermed.2012.07.003. [ Links ]
Garcia RMA, de Oliveira LO, Moreira MA, Barros WS. Variation in emetine and cephaeline contents in roots of wild Ipecac (Psychotria ipecacuanha). Biochem Syst Ecol.2005;33(3):233-243. Doi: 10.1016/j.bse.2004.08.005. [ Links ]
Gerdakaneh M, Zohori M. The Effect of picloram on somatic embryogenesis of different explants of strawberry (Fragariaananassa Duch.). Br Biotechnol J. 2013;3(2):133-142. Doi: 10.9734/BBJ/2013/2370. [ Links ]
Hidalgo DN, Palma TZ. Micropropagación in vitro de la raicilla (Psychotria ipecacuanha). Informe final. Vicerrectoría de investigación y Extensión. Instituto Tecnológico de Costa Rica; 1993. p. 58. [ Links ]
Hoshino T, Cuello J. Somatic embryogenesis. In: Mujib A, Samaj J, editors. Environmental design considerations for somatic embryogenesis. Berlin, Heidelberg: Springer; 2006. p. 25-34. [ Links ]
Ideda K, Teshima D, Aoyama T, Satake M, Shimomura K. Clonal propagation of Cephaelis ipecacuanha. Plant Cell Rep. 1988;7(4):288-291. Doi: 10.1007/BF00272545. [ Links ]
Jha S, Jha T. Micropropagation of Cephaelis ipecacuanha Rich. Plant Cell Rep. 1989;8(8):437-439. Doi: 10.1007/ BF00269043. [ Links ]
Johansen DA. Plant Microtechnique. New York, EEUU: McGraw-Hill; 1940. p. 523. [ Links ]
Kaldenhoff R, Henningsen U, Richter G. Gene activation in suspension-cultured cells of Arabidopsis thaliana during blue-light-dependent plantlet regeneration. Planta. 1994;195(2): 182-187. Doi: 10.1007/BF00199677. [ Links ]
Karam NS, Al-Majathoup M. Direct shoot regeneration and microtuberization in wild Cyclamen persicum Mill. using seedling tissue. Sci Hort. 2000;86(3):235-236. Doi: 10.1016/S0304-4238(00)00146-1. [ Links ]
Kaur M, Singh A, Singh J, Singh A, Singh S. Effect of media composition and explant type on the regeneration of eggplant (Solanum melongena L.). Afr J Biotechnol. 2013;12(8):860-866. Doi: 10.5897/AJB12.554. [ Links ]
Kintzios SE, Taravira N. Effect of genotype and light intensity on somatic embryogenesis and plant regeneration in melon (Cucumismelo L.). Plant Breed. 1997;116:359-362. Doi: 10.1111/j.1439-0523.1997.tb01012.x. [ Links ]
Kumar S, Singh MP. Plant tissue culture. Nueva Delhi, India: APH Publishing Corporation; 2009. p. 286. [ Links ]
Landi L, Mezzetti B. TDZ, auxin and genotype effects on leaf organogenesis in Fragaria. Plant Cell Rep. 2006;25(4):281-288. Doi: 10.1007/s00299-005-0066-5. [ Links ]
Lara A, Valverde R, Gómez L, Hidalgo N. Micropropagación de la planta medicinal Psychotria acuminata. Agronomía Costarricense. 2003a;27(2):7-20. [ Links ]
Lara A, Valverde R, Gómez L. Histología de embriones somáticos y brotes adventicios inducidos en hojas de Psychotria acuminata. Agronomía Costarricense. 2003b;27(1):37-48. [ Links ]
Latkowska MJ, Kvaalen H, Appelgren M. Genotype dependent blue and red light inhibition of the proliferation of the embryogenic tissue of Norway spruce. In Vitro Cell Dev Biol-Plant. 2000;36(1):57-60. Doi: 10.1007/s1 1627000-0013-7. [ Links ]
Li H, Xu Z, Tang C. Effect of light-emitting diodes on growth and morphogenesis of upland cotton (Gossypium hirsutum L.) plantlets in vitro. Plant Cell Tissue Organ Cult. 2010;103(2):155-163. Doi: 10.1007/s11240-010-9763-z. [ Links ]
Low YJS, Chen KC, Wu KX, Mah-Lee NM, Chu HJJ. Antiviral activity of emetine dihydrochloride against dengue virus infection. J Antivir Antiretrovir. 2009;1(2):62-71. Doi: 10.4172/jaa.1000009. [ Links ]
Malik KA, Saxena PK. Regeneration in Phaseolus vulgaris L: High frequency induction of direct shoot formation in intact seedlings by N6-benzylaminopurine and thidiazuron. Planta. 1992;186(3):384-389. Doi: 10.1007/BF00195319. [ Links ]
Marks TR, Simpson SE. Effect of irradiance on shoot development in vitro. Plant Growth Regul. 1999;28(2):133-142. Doi: 10.1023/A:1006276724956. [ Links ]
Martins ER, Oliveira LO, Maia JTLS, Vieira IJC. Estudo ecogeográfico da poaia [Psychotria ipecacuanha (Brot.) Stokes]. Rev Bras Pl Med. 2009;11(1):24-32. Doi: 10.1590/S1516-05722009000100005. [ Links ]
Murashige T, Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant. 1962;15(3):473-497. Doi: 10.1111/j.1399-3054.1962. tb08052.x. [ Links ]
Naranjo EJ, Urrea AI, Atehortúa L. Avances en la propagación vía embriogénesis somática de Psychotria ipecacuanha (Brot.) Stokes, planta medicinal en peligro crítico. Rev Colomb Biotecnol. 2014;16(1):86-92. Doi: http://dx.doi.org/10.15446/rev.colomb.biote.v16n1.44228. [ Links ]
Nhut DT, Takamura T, Watanabe H, Okamoto K, Tanaka M. Responses of strawberry plantlets cultured in vitro under super bright red and blue light emitting diodes (LED's). Plant Cell Tissue Organ Cult. 2003a;73(1):43-52. Doi: 10.1023/A:1022638508007. [ Links ]
Nhut DT, Teixeira da Silva JA, Aswath CR. The importance of the explant on regeneration in thin cell layer technology. In Vitro Cell Dev Biol-Plant. 2003b;39(3):266-276. Doi: 10.1079/IVP2002408. [ Links ]
Ohki S. Scanning electron microscopy ofshoot differentiation in vitro from leaf explants of the African violet. Plant Cell Tissue Organ Cult. 1994;36:157-162. Doi: 10.1007/ BF00037714. [ Links ]
Pacheco G, Garcia R, Lugato D, Vianna M, Mansur E. Plant regeneration, callus induction and establishment of cell suspension cultures of Passiflora alata Curtis. Sci Hort.2012;144:42-47. Doi: 10.1016/j.scienta.2012.06.022. [ Links ]
Palma T. Biotecnología en la domesticación de plantas medicinales. Costa Rica: X Congreso Nacional Agronómico; 1996. p. 31-33. [ Links ]
Poudel PR, Kataoka I, Mochioka R. Effect of red- and blue light-emitting diodes on growth and morphogenesis of grapes. Plant Cell Tissue Organ Cult. 2008;92(2):147-153. Doi: 10.1007/s11240-007-9317-1. [ Links ]
Roca WM, Mroginski LA. Cultivo de tejidos en la agricultura: fundamentos y aplicaciones. Cali, Colombia: CIAT; 1991. p. 969. [ Links ]
Rout GR, Samantaray S, Das P. In vitro somatic embryogenesis from callus cultures of Cephaelis ipecacuanha A. Richard. Sci Hort. 2000;86(1):71-79. Doi: 10.1016/S0304-4238(00)00130-8. [ Links ]
Ruzin SE. Plant microtechnique and microscopy. New York, EEUU: Oxford University; 1999. p. 322. [ Links ]
Salazar R, Vargas TE, De García E, Oropeza M. Micropropagación y organogénesis de Aster ericoides cultivar. INCI. 2005;30(5):295-299. [ Links ]
Samuolienė G, Urbonavičiūtė A, Brazaitytė A, Jankauskienė J, Duchovskis P, Bliznikas Z, Žukauskas A. The benefits of red LED's: improved nutritional quality due to accelerated senescence in lettuce. Sodinink Darzinink. 2009;28(2):111-120. [ Links ]
Shukla P, Makwana V, Bhatt D, Robin P. Efficient method for direct and indirect organogenesis in biofuel crop Jatropha curcas. Int J Pharm Bio Sci. 2013;4(1):673 - 682. [ Links ]
Souza MM, Martins ER, Santana TN, de Oliveira LO. Reproductive studies in Ipecac (Psychotria ipecacuanha (Brot.) Stockes; Rubiaceae): Pollen development and morphology. Braz Arch Biol Techn. 2008;51(5):981-989. Doi: 10.1590/S1516-89132008000500015. [ Links ]
Sreedhar RV, Venkatachalam L, Thimmaraju R, Bhagyalakshmi N, Narayan MS, Ravishankar GA. Direct organogenesis from leaf explants of Stevia rebaudiana and cultivation in bioreactor. Biol Plantarum. 2008;52(2):355-360. Doi: 10.1007/s10535-008-0073-9. [ Links ]
Swarna J, Ravindhran R. In vitro organogenesis from leaf and transverse thin cell layer derived callus cultures of Talinum triangulare (Jacq.) Willd. Plant Growth Regul. 2013;70(1):79-87. Doi: 10.1007/s10725-012-9780-5. [ Links ]
Teixeira da Silva JA. Thin cell layer technology for induced response and control of rhizogenesis in chrysanthemum. Plant Growth Regul. 2003;39(1):67-76. Doi: 10.1023/A:1021854320969. [ Links ]
Teixeira da Silva JA. Evaluation of carbon sources as positive selection agents for chrysanthemum (Dendranthema X grandiflorum (Ramat.) Kitamura) transformation. N Z J Crop Hortic Sci. 2004;32:55-67. Doi: 10.1080/01140671.2004.9514280. [ Links ]
Teixeira da Silva JA, Singh N, Tanaka M. Priming biotic factors for optimal protocorm-like body and callus induction in hybrid Cymbidium (Orchidaceae), and assessment of cytogenetic stability in regenerated plantlets. Plant Cell Tissue Organ Cult. 2006;84(2):135-144. Doi: 10.1007/ s11240-005-9003-0. [ Links ]
Teixeira da Silva J, Dobránszki J. Plant Thin Cell Layers: A 40-Year Celebration. J Plant Growth Regul. 2013;32(4):922-943. Doi: 10.1007/s00344-013-9336-6. [ Links ]
Tran Thanh VK, Bui VL. Curent status of thin cell layer method for the induction of organogenesis or somatic embryogenesis. In: Mohan SJ, Gupta PK, Newton RJ, editores. Somatic Embryogenesis in Woody Plants. Dordrecht, The Netherlands: Kluwer Academic Publishers; 2000. p. 51-92. [ Links ]
Trease GE, Evans W. Tratado de farmacognosia. 12° Ed. México DF: Nueva Editorial Interamericana; 1988. p. 611-615. [ Links ]
Vasil V, Lu C Y, Vasil I. K. Histology of somatic embryogenesis in cultured immature embryos of maize (Zea mays L.). Protoplasma. 1985(1-2);127:1-8. Doi: 10.1007/BF01273696. [ Links ]
Vengadesan G, Pijut P. Somatic embryogenesis and plant regeneration of northern red oak (Quercus rubra L.). Plant Cell Tissue Organ Cult. 2009;97(2):141-149. Doi: 10.1007/s11240-009-9508-z. [ Links ]
Verhagen SA, Wann SR. Norway spruce somatic embryogenesis: High-frequency initiation from light-cultured mature embryos. Plant Cell Tissue Organ Cult. 1989;16(2):103-111. Doi: 10.1007/BF00036518. [ Links ]
Yeung EC, Saxena PK. Histological Techniques. In: Mohan JS, Gupta PK, editores. Protocol for Somatic Embryogenesis in Woody Plants. Dordrecht, The Netherlands: Springer; 2005. p. 517-538. [ Links ]
Yin ZF, Zhao B, Bi WL, Chen L, Wang WC. Direct shoot regeneration from basal leaf segments of Lilium and assessment of genetic stability in regenerants by ISSR and AFLP markers. In Vitro Cell Dev Biol-Plant. 2013;49(3):333-342. Doi: 10.1007/s11627-013-9501-4. [ Links ]
Yoshimatsu K, Shimomura K. Efficient shoot formation on internodal segments and alkaloid formation in the regenerates of Cephaelis ipecacuanha A. Richard. Plant Cell Rep. 1991;9(10):567-570. Doi: 10.1007/BF00232333. [ Links ]
Yoshimatsu K, Shimomura K. Plant regeneration on cultured root segments of Cephaelis ipecacuanha A. Richard. Plant Cell Rep. 1994;14(2-3):98-101. Doi: 10.1007/BF00233769. [ Links ]
Zhou H, Li M, Zhao X, Fan X, Guo A. Plant regeneration from in vitro leaves of the peach rootstock 'Nemaguard' (Prunus persica x P. davidiana). Plant Cell Tissue Organ Cult. 2010;101(1):79-87. Doi: 10.1007/s11240-010-9666-z. [ Links ]