Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Biológica Colombiana
versão impressa ISSN 0120-548X
Acta biol.Colomb. vol.20 no.3 Bogotá set./dez. 2015
https://doi.org/10.15446/abc.v20n3.45601
Doi: http://dx.doi.org/10.15446/abc.v20n3.45601.
Artículo de investigación/Original research paper
ATIVIDADE ANTIMICROBIANA E EFEITO COMBINADO SOBRE DROGAS ANTIFÚNGICAS E ANTIBACTERIANAS DO FRUTO DE Morinda citrifolia L.
Antimicrobial Activity and Combined Effects on Antifungal and Antibacterial Drugs the Fruit of Morinda citrifolia L.
Actividad antimicrobiana y efecto combinado sobre medicamentos antifúngicos y antibacterianos del fruto de Morinda citrifolia L.
Saulo R. TINTINO1, Abel A. de C. NETO2, Irwin R. A. MENEZES3, Cícera Datiane de M. OLIVEIRA3, Henrique D. M. COUTINHO1
1 Laboratório de Microbiologia e Biologia Molecular, Universidade Regional do Cariri. Rua Cel. Antonio Luis, 1161, Pimenta, CEP 63105- 000. Crato, CE, Brasil.
2 Laboratorio de Microbiologia, Faculdade Leão Sampaio. Av. Leão Sampaio, Km 3, CEP 63000-000,Juazeiro do Norte, CE, Brasil.
3 Laboratório de Farmacologia e Química Medicinal, Universidade Regional do Cariri. Rua Cel. Antonio Luis, 1161, Pimenta, CEP 63105- 000. Crato, CE, Brasil.
For correspondence. saulorelison@gmail.com.
Received: 23rd September 2014, Returned for revision: 5th February 2015, Accepted: 6th April 2015.
Associated Editor: Francisco José Martínez Pérez.
Citation/Citar este artículo como: Tintino SR, Neto AAC, Menezes IRA, Oliveira CD de M, Coutinho HDM. Atividade antimicrobiana e efeito combinado sobre drogas antifúngicas e antibacterianas do fruto de Morinda citrifolia L. Acta biol. Colomb. 2015;20(3):193-200. doi: http://dx.doi.org/10.15446/abc.v20n3.45601.
RESUMO
O aparecimento de micro-organismos resistentes e a toxicidade associada aos fármacos antimicrobianos aumentam a necessidade de pesquisas por novos princípios ativos. Morinda citrifolia L., uma planta frutífera utilizada popularmente como antibacteriano e com diversos outros usos farmacológicos. Possui diversos metabólitos primários e secundários, principalmente flavonóides, triterpenóides e alcalóides. O presente trabalho visou testar o potencial antimicrobiano e modulador dos extratos do seu fruto. Os extratos do fruto foram testados quanto ao seu efeito antimicrobiano e em combinação com antibacterianos e antifúngicos contra microrganismos patógenos pelo método de microdiluição em caldo. Observou-se que as associações entre antibióticos e extratos mostraram resultados com relevância clínica diante dos testes com bactérias Pseudomonas aeruginosa e Escherichia coli.
Palavras-chave: efeito modulador, extratos, metabolitos secundários, multirresistente.
ABSTRACT
The rising of the drug resistant microrganisms and the toxicity related with the antimicrobial drugs enhances the necessity about the search of new bioactive compounds. Morinda citrifolia L. is a fruit tree traditionally used as antibacterial and with several other pharmacological properties. This plant presents several phytocompounds as flavonoids, alkaloids and triterpenes. The objective of this work was assay the antimicrobial and modulatory potential of the fruit extract. The extract was assayed alone and associated with antibiotics and antifungals against pathogenic microrganisms using the microdilution assay. The results demonstrated that the association between extract and antimicrobial drugs resulted in a potentiation of the drug activity clinically relevant against Pseudomonas aeruginosa and Escherichia coli.
Keywords: extracts, modulatory effect, secondary metabolites, multidrug-resistant.
RESUMEN
La aparición de microorganismos resistentes y la toxicidad asociada a los antimicrobianos aumenta la necesidad de investigar nuevos principios activos. Morinda citrifolia L., es una planta fructífera utilizada popularmente como antibacteriano y con otros diversos usos farmacológicos. Posee diversos metabolitos primarios y secundarios, principalmente flavonoides, triterpenoides y alcaloides. Este estudio tuvo como objetivo ensayar la potencial actividad antimicrobiana y moduladora de los extractos obtenidos de su fruta. Los extractos de las frutas fueron testados tanto para determinar el efecto antimicrobiano como también utilizándolo en combinación con agentes antibacterianos y antifúngicos contra microorganismos patógenos, por el método de microdilución en caldo. Se observó que la asociación entre antibióticos y extractos dió resultados clínicamente significativos en pruebas con bacterias Pseudomonas aeruginosa y Escherichia coli.
Palabras clave: efecto modulador, extractos, metabolitos secundarios, multirresistente.
INTRODUÇÃO
Segundo a Organização Mundial da Saúde (OMS) aproximadamente 25 % das mortes no mundo inteiro são decorrentes de doenças causadas por micro-organismos. Dentro esse total de mortes, cerca de 45 % acontece nos países subdesenvolvidos, onde o surgimento de micro-organismos resistentes a diversas drogas, tem se destacado como um dos principais fatores de mortalidade (Schenkel et al., 2001).
O uso incorreto dos medicamentos antibacterianos e antifúngicos é descrito como um dos principais responsáveis pela seleção micro-organismos resistentes a medicamentos como antibióticos, germicidas e desinfetantes. Isso ocorre principalmente pelo fato de que as bactérias apresentam a capacidade genética para adquirir e transmitir resistência contra esses agentes antibacterianos atualmente disponíveis, assim como os fungos apresentam mutações próprias, que proporcionam o surgimento de cepas resistentes (Hamdan e Hahn, 2006).
Há vários relatos, sobre isolados bacterianos e fúngicos, que são conhecidos por serem sensíveis às drogas rotineiramente utilizadas, mas que se tornaram multirresistente aos outros medicamentos disponíveis no mercado (Nascimento et al., 2000; Sakagami e Kajimura, 2002; Hamdan e Hahn, 2006).
Nesse contexto, os produtos naturais como os de origem vegetal, tem se destacado tanto por apresentarem atividade antibacteriana, como também pela sua capacidade de potencializar a atividade antibiótica (Gibbons, 2004; Tintino et al., 2013). A utilização de extratos, oriundos de produtos naturais, com a finalidade de serem agentes antimicrobianos pode ser uma via importante, já que se tem em vista que os mesmos são dotados de uma reduzida possibilidade de ocasionar resistência microbiana, porque os mesmo são misturas complexas, o que torna a adaptação dos micro-organismos difícil (Daferera etal., 2003).
A Morinda citrifolia L. é uma pequena arvore da família das Rubiáceas, de origem do sudeste asiático, ela foi difundida pela Ásia e Ilhas do Oceano Pacífico, (Santos-Júnior et al., 2011). Possui o nome popular de Noni (na língua havaiana) no Taiti, aal (na língua Hindi). Seu fruto também pode ser conhecido como, Ba Ji Tian, Nonu, Indian Mulberry, Canary Wood e Cheese fruit (Silva et al., 2012).
A espécie da Morinda citrifolia L. é uma das mais notáveis por possuir um vasto uso (Brito, 2008). Praticamente toda a parte da planta é utilizada, e a cada parte é atribuída uma capacidade medicinal diferente. Ao fruto são atribuídas as aplicações: antibacteriano, analgésico, anticongestivo, antioxidante, expectorante, anti-inflamatório, adstringente, emoliente, emenagogo, laxativo, analgésico, hipotensor, purificador do sangue, imunoestimulante e tônico (Elkins, 1997). Ainda é atribuída a capacidade anticancerígena (Rodríguez e Pinedo, 2004).
O fruto de Morinda citrifolia L., conhecida popularmente como Noni, tem sido objeto de estudos relativos às suas propriedades nutracêuticas (Chan-Blanco et al., 2006). Diversos componentes fitoquímicos já foram identificados na planta do Noni, a maior parte dos micronutrientes identificados são componentes fenólicos, ácidos orgânicos e alcalóides. Entre os componentes fenólicos, os mais importantes são as antraquinonas (Wang e Su, 2001). Os compostos fenólicos identificados representam o maior grupo de micronutrientes funcionais no suco de Noni (Wange Su, 2001).
Já existem estudos que mostram a atividade antibacteriana do extrato do fruto Morinda citrifolia L. contra Pseudomonas aeruginosa e Escherichia coli. É também conhecido que estas bactérias são responsáveis processos infecciosos, que levam a um grande número de mortalidade (Santos, 2004). Considerando este fato, o objetivo deste trabalho foi avaliar atividade antibacteriana, antifúngica e modificadora da atividade de antibióticos aminoglicosídeos e antifúngicos, pelo do extrato etanólico do fruto da Morinda citrifolia L. contra cepas resistentes oriundas de isolados clínicos.
MATERIAL E MÉTODOS
Coleta e preparo do material vegetal
Para identificação e registro, as folhas e frutos de Morinda citrifolia L. foram coletadas no município do Crato, no estado de Ceará, em março de 2012. As amostras foram coletadas sobre a permissão Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis, durante a estação chuvosa. Uma amostra foi depositada no Herbário do departamento de Biologia da Universidade Federal de Sergipe sob número 13503.
Para os experimentos, foi preparado o extrato etanólico do fruto, onde 300 g do fruto seco e triturado de M. citrifolia L. foi submerso em etanol 99 % por 72h. Após isso, o extrato foi filtrado e concentrado em rotaevaporador (modelo Q-344B-Quimis, Brasil) e banho-maria (modelo Q-214M2-Quimis, Brasil) (Matos, 1997). Após a obtenção do extrato, o mesmo foi liofilizado em Liofilizador (modelo L101 - LIOTOP, Brasil). Após este processo, foi obtido um valor de 13,4 g do extrato do fruto. A solução utilizada nos testes foi preparada inicialmente em uma concentração de 10mg/mL, dissolvida em DMSO (Dimetilsulfóxido, Sigma-Aldrich®) e posteriormente diluída com água destilada para uma concentração de 1024 ^g/mL, reduzindo assim a concentração de DMSO para menos de 10 % para evitar o efeito tóxico do DMSO (Matias et al., 2010a).
Micro-organismos utilizados
Os microrganismos utilizados nos testes foram obtidos através do Instituto Nacional de Controle de Qualidade em Saúde (INCQS) da Fundação Oswaldo Cruz, Ministério da Saúde. Foram utilizadas linhagens padrão de bactérias Escherichia coli ATCC 11105; Pseudomonas aeruginosa ATCC 15442 e cepas do fungo Candida krusei ATCC 2538.
Concentração inibitória mínima
Foi adotado o procedimento de microdiluição em caldo (NCCLS, 2003), onde foram preparadas soluções em tubos eppendorf contendo cada um deles 1 mL de solução com 900 μL de BHI 10 % e 100 μL da suspensão bacteriana ou fúngica com 106 UFC segundo a escala de McFarland. A placa foi preenchida no sentido numérico adicionando-se 100 μL desta solução em cada poço em um total de 96 poços, e em seguida procedeu-se a microdiluição seriada com a solução de 100 μL do produto natural (extrato), variando nas concentrações de 512 a 8 μg/mL. As placas foram levadas à incubadora por 24 horas a 37 °C. A revelação da CIM bacteriana foi feita utilizando-se a resazurina, enquanto para os fungos foi observada a turbidez provocada pelo crescimento. A CIM foi definida como a menor concentração na qual nenhum crescimento foi observado.
Aumento da ação das drogas
Para verificar se o extrato modificaria a ação dos antibióticos frente às cepas testadas, utilizou-se o método proposto por Coutinho et al. (2008), onde a solução do extrato foi testada em concentração sub-inibitória (CIM/8) de 128 μg/ mL. Foram preparados tubos eppendorf® contendo cada um deles 1,5 mL de solução, com 1.162 μL de BHI 10 %, 150 μL da suspensão bacteriana ou fúngica e 188 μL do produto natural (extrato). Para o controle foram preparados tubos eppendorf® com 1,5 mL de solução contendo 1.350 μL de BHI (10 %) e 150 μL de suspensão de microrganismos. A placa foi preenchida no sentido alfabético adicionandose 100 μL desta solução em cada poço. Em seguida, 100 μL da droga (antibiótico ou antifúngico) foi misturada ao primeiro poço, procedendo a microdiluição em série, numa proporção de 1:1 até a penúltima cavidade. Todos os procedimentos foram realizados em triplicata.
Os antibióticos Amicacina e Gentamicina (ambos da classe dos aminoglicosídios, inibidores de síntese protéica), Imipenem (da classe dos carpenêmicos, inibidor da síntese da parede celular) e Oxacilina (beta-lactâmico, inibidor da síntese da parede celular) foram avaliados em concentrações que variaram de 5000 - 2,44 μg/mL. Além dos antibacterianos utilizados, também usou-se os antifúngicos cujo mecanismo de ação afeta tanto a síntese de lipídios quanto a formação da parede celular fúngica: Benzoilmetronidazol, Mebendazol, Anfotericina B e a Nistatina em concentrações que variavam entre 1024 - 0,5 μg/mL. Todos os antibióticos e antifúngicos testados foram obtidos junto a Sigma Co. (S. Louis, USA).
Análise estatística
Os dados são expressos como médias geométricas. A significância estatística foi avaliada com um teste ANOVA de duas vias seguida pelo teste de Bonferroni post hoc (onde p < 0,05 e p <0,0001 são considerado significativo e p > 0,05 não significativo).
RESULTADOS
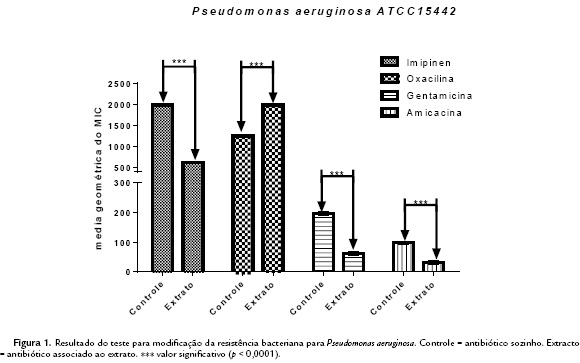
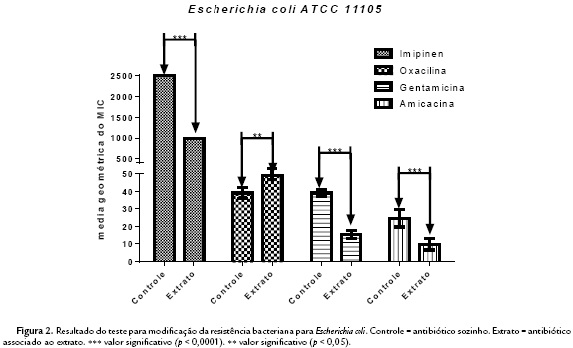
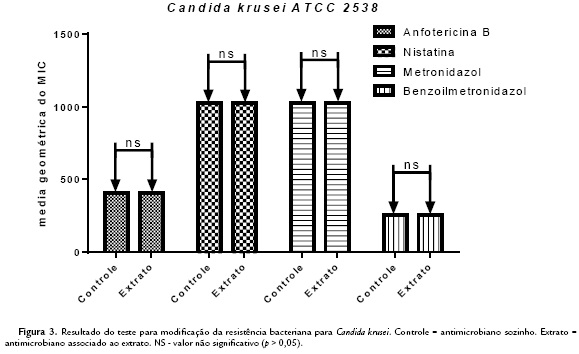
Ao observar a concentração inibitória mínima (CIM) contra bactérias (Escherichia coli e Pseudomonas aeruginosa) e o fungo (Candida kruzei), obteve-se resultados de > 1024 g/mL, mostrando não serem clinicamente relevantes (Holetz et al., 2002). Entretanto, na modulação foram observados resultados sinérgicos pela modificação da atividade antibiótica, com redução da CIM do antibiótico na presença do extrato, comparado ao controle com apenas o antibiótico, perante as cepas das bactérias Pseudomonas aeruginosa e Escherichia coli. Todas apresentaram um valor de significância com p < 0,0001 ou p < 0,05, com todas as drogas testadas, exceto com a Oxacilinan que, contra ambas as cepas, foi observado resultado de antagonismo com significância de p < 0,0001 ou 0,05 contra as duas linhagens (Fig.1 e Fig.2). Contra o fungo Candida kruzei não foram obtidos valores de sinergismo relevantes, em associação aos antifúngicos utilizados (Fig. 3).
DISCUSSÃO
Como já foi apresentado anteriormente a atividade antimicrobiana do fruto da Morinda Citrifolia L. não demonstrou resultados clinicamente relevantes perante os micro-organismos testados. Há relatos da atividade desta espécie, contra bactérias como foi o estudo realizado por Atkinson (1956). Este demonstrou que o extrato etanólico do fruto da Morinda citrifolia L, inibiu o crescimento de certas bactérias in vitro, tais como Staphylococcus aureus, Pseudomonas aeruginosa, Bacillus subtilis, Escherichia coli, Helicobacter pylori, Salmonella e Shigella, entretanto este estudo foi realizado através do método de difusão em disco e em altas concentrações.
Em experimentos mais recentes pelo método de microdiluição em caldo foi observada a inibição pelo extrato etanólico do fruto de Morinda citrifolia L., contra Escherichia coli, Shigella flexneri, Proteus mirabilis, Pseudomonas diminuta, Enterobacter cloacae, S. aureus ATCC 6538, onde foi demonstrada a atividade contra todas as cepas, nas concentrações entre 100 mg/mL a 50 mg/mL, concentrações estas, mais altas do que as analisadas no presente estudo (Natheer et al., 2012).
Há também o relato da atividade antibacteriana do extrato hidroetanólico do fruto de Morinda citrifolia L., com relevância clinica, contra Staphylococcus aureus ATCC 25923, com CIM menor que 1000 jg/ml. Um fator que pode ter contribuído para a diferença nos resultados obtidos é fato do extrato desse estudo ser oriundo de plantas de local diferente e consequentemente apresentar diferentes constituintes da amostra desse estudo, além da preparação e composição do extrato ter sido diferente (Matos, 1997; Silva-Silveira et al., 2011).
Em relação à atividade antifúngica, há um estudo realizado por Goun et al. (2003), que mostra a ação do extrato do fruto puro de Morinda citrifolia L. contra Candida albicans, onde houve inibição do crescimento desse fungo em concentrações de 30 mg/mL e 40 mg/mL, pelo método de microdiluição em caldo. Portanto, como pode ser visto, esta são concentrações mais elevadas do que as utilizadas nos ensaios do presente trabalho, justificando-se assim a ausência da atividade antifúngica relevante.
Entretanto, o resultado do presente estudo pode ser considerado relevante, visto que o extrato etanólico do fruto de Morinda citrifolia L. não causou danos celulares, já que não atual como um fungicida eficiente, como também não antagonizou o afeito da droga antifúngica testada, o que nos remete a uma possível baixa toxicidade do produto, tornando sua aplicação ainda mais propícia como melhorador do efeito de antibacterianos.
É conhecida a ação sinérgica de produtos naturais junto a antimicrobianos normalmente utilizados no tratamento terapêutico, determinando uma diminuição na sua CIM (Sousa et al., 2011; Figueredo et al., 2013). Sabe-se que metabólitos secundários como flavonóides e terpenos apresentaram ação antimicrobiana (Perruchon, 2002; Simões et al., 2004). Assim como já é conhecido que flavonoides e alcalóides são potencializadores da ação antibiótica (Teffo et al., 2010; Araruna et al., 2012) e são sintetizados por plantas em resposta a infecções microbianas (Dixon et al., 1983; Ho et al., 2001), sendo capazes de alterar a parede celular ou destruir a membrana plasmática das células bacterianas, facilitando a absorção das drogas (Tsuchiya et al., 1996; Matias et al., 2010b; Figueredo et al., 2013).
Identificou-se no fruto da Morinda citrifolia L., diversos componentes, principalmente aminoácidos, hidratos de carbono redutores, antraquinonas, flavonóides, esteróides, triterpenóides e alcaloides (Wang e Su, 2001). Assim como foi demonstrada a presença de triterpenos e fitoesteroides em Morinda citrifolia L. (Rivera et al., 2011).
Portanto, a modificação do efeito do antibiótico contra as bactérias mostrou-se clinicamente relevante contra E. coli e P. aeroginosa, quando o extrato foi associado ao Imipenen, Gentamicina e Amicacina. Efeitos estes, são provavelmente derivados dos metabólitos secundários contido na planta utilizada neste estudo, e citados anteriormente, atuando como modificadores da atividade antibacteriana. Não há nenhum estudo associando o fruto desta planta a antimicrobianos.
A habilidade que produtos naturais têm de modificar a ação de antimicrobianos pode ser vista a partir de estudos que comprovam que associação de drogas sintéticas e extratos de plantas podem atuar revertendo a resistência microbiana, dificultado a bomba de efluxo ou modificando parede celular bacteriana e a membrana celular (Coutinho et al., 2009; Coutinho et al., 2010).
Na associação com a Oxacilina como apresentado anteriormente, verificou-se o antagonismo. O antagonismo é descrito por Saraiva (2012), como sendo resultado da associação de uma droga a um extrato, onde o extrato dificulta ou inibe a ação do fármaco. E de acordo com Granowitz e Brown (2008), os efeitos antagônicos do uso combinado entre antibióticos podem ser atribuídos a quelação mútua. O que pode justificar o resultado de antagonismo observado.
Como descrito anteriormente na associação com antifúngicos, não foi obtido nenhum resultado significativo da atividade modificadora sobre as drogas testadas. Apesar de alguns trabalhos já comprovarem resultados sinérgicos de produtos naturais com antifúngicos (Santos et al., 2012; Tintino et al., 2014), o efeito sinérgico desse extrato com drogas antifúngicas ainda é pouco comum. Isso pode ser relacionado ao fato que os fungos apresentam vários mecanismos moleculares de resistência muito mais variados e complexos que as bactérias, sendo resistentes a essa associação da droga ao produto natural (White et al., 1998).
CONCLUSÃO
O extrato de Morinda citrifolia L., apesar de não mostrar atividade antimicrobiana clinicamente relevante sobre os micro-organismos, apresentou resultados mais significativos sobre efeito modulador das drogas testadas perante P. aeroginosa ATCC 15442 e E. coli ATCC 11105. Entretanto não apresentou nenhuma ação de potencialização de antifúngicos sobre a cepa fúngica. Portanto, são necessários estudos mais abrangentes sobre os compostos fitoquímicos que estão presentes nesta espécie, bem como novos estudos in vitro e in vivo para evidenciar os mecanismos detalhados pelos quais os metabólitos secundários podem modificar a atividade antibiótica.
AGRADECIMENTOS
A Faculdade Leão Sampaio, ao CNPq e Funcap pelo apoio financeiro e à Universidade Regional do Cariri pela disponibilização de materiais e espaço físico.
REFERÊNCIAS
Araruna MK, Brito AS, Morais-Braga MF, Santos KK, Souza TM, Leite TR, et al. Evaluation of antibiotic and antibiotic modifying activity of pilocarpine and rutin. Indian J Med Res. 2012;135(2):252-254. [ Links ]
Atkinson N. Antibacterial substances from flowering plants. Antibacterial activity of dried Australian plants by rapid direct plate test. Aust J Exp Biol Med Sci. 1956;34(1):17-26. [ Links ]
Brito DRB. Avaliação da atividade anti-helmíntica da Morinda citrifolia (noni), em aves poedeiras naturalmente infectadas (Dissertação de mestrado). Teresina: Mestrado em Saúde Animal, Universidade Federal do Piauí; 2008. 62 p. [ Links ]
Chan-Blanco Y, Vaillantb F, Perezb AM, Reynesc M, Brillouetc JM, Bratc P. The noni fruit (Morinda citrifolia L.): A review of agricultural research, nutritional and therapeutic properties. J Food Compos Anal. 2006;19(6-7):645-654. Doi:10.1016/j.jfca.2005.10.001. [ Links ]
Coutinho HDM, Costa JGM, Lima EO, Falcão-Silva VS, Siqueira-Júnior JP. Effect of Momordica charantia L. in the resistance to aminoglycosides in methicilin-resistant Staphylococcus aureus. Comp Immunol Microbiol Infect Dis. 2010;33:467-471.Doi: 10.1016/j.cimid.2009.08.001. [ Links ]
Coutinho HDM, Costa JGM, Lima EO, Falcão-Silva VS, Siqueira-Júnior JP. Herbal therapy associated with antibiotic therapy: Potentiation of the antibiotic activity against methicillin - resistant Staphylococcus aureus by Turnera ulmifolia L. BMC Complement Altern Med. 2009;9(13):1-9. Doi: 10.1186/1472-6882-9-13. [ Links ]
Coutinho HDM, Costa JGM, Lima EO, Falcão-Silva VS, Siqueira-Júnior JP. Enhancement of the Antibiotic Activity against a Multiresistant Escherichia coli by Mentha arvensis L. and Chlorpromazine. Chemotherapy. 2008;54:328-330. Doi: 10.1159/000151267. [ Links ]
Daferera DJ, Ziogas BN, Polissiou MG. The effectiveness of plant essential oils on the growth ofBotrytiscinerea, Fusarium sp. and Clavibacter michiganesis subsp. Michiganesis. Crop Prot. 2003;22(1):39-44. Doi:10.1016/S0261-2194(02)00095-9. [ Links ]
Dixon RA, Dey PM, Lamb CJ. Phytoalexins: enzymology and molecular biology. Adv Enzymol Relat Areas Mol Biol. 1983;55:1-69. [ Links ]
Elkins R. Noni (Morinda citrifolia) la hierba preciada del pacífico sur. Pleasant Grove, Utah: Woodland Publishing; 1997. p. 31. [ Links ]
Figueredo FG, Ferreira EO, Lucena BFF, Torres CMG, Lucetti DL, Lucetti ECP, et al. Modulation of the antibiotic activity by extracts from Amburana cearensis A. C. Smith and Anadenanthera macrocarpa (Benth.) Brenan. Biomed Res Int. 2013;2013:1-5. Doi: 10.1155/2013/640682. [ Links ]
Gibbons S. Anti-staphylococcal plant natural products. Nat Prod Rep. 2004;21:263-277. Doi: 10.1039/ b212695h. [ Links ]
Goun E, Cunningham G, Chu D, Nguyen C, Miles D. Antibacterial and antifungal activity of Indonesian ethnomedical plants. Fitoterapia, 2003;74(6):592-596. Doi:10.1016/S0367-326X(03)00117-5. [ Links ]
Granowitz EV, Brown RB. Antibiotic adverse reactions and drug interactions. Crit Care Clin. 2008;24(2):421-442. Doi: 10.1016/j.ccc.2007.12.011. [ Links ]
Hamdan JS, Hahn RC. Antifungal drugs for systemic mycosis: an overview of mechanism of action and resistance. Antinfect Agents Med Chem. 2006;5(10):403-412. Doi:10.2174/187152106778520479. [ Links ]
Ho KY, Tsai CC, Huang JS, Chen CP, Lin TC, Lin CC. Antimicrobial activity of tannin components from Vaccinium vitisidaea. J Pharm Pharmacol. 2001;53:187-191. [ Links ]
Holetz FB, Pessini GL, Sanches NR, Cortez DAG, Nakamura CV, Dias FDP. Screening of plants used in the Brazilian folk medicine for the treatment of infectious diseases. Mem Inst Oswaldo Cruz. 2002;97(7):1027-1031. Doi: 10.1590/S0074-02762002000700017. [ Links ]
Matias EEF, Santos KKA, Almeida TS, Costa JGM, Coutinho HDM. Atividade antibacteriana In vitro de Croton campestris A., Ocimum gratissimum L. e Cordia verbenácea DC. Rev Bras Biocienc. 2010a;8(3):294-298. [ Links ]
Matias EEF, Santos KKA, Almeida TS, Costa JGM, Coutinho HDM. Enhancement of antibiotic activity by Cordia verbenacea DC. Latin Am J Pharm. 2010b;29(6):1049-1052. [ Links ]
Matos FJA. Introdução à fitoquímica experimental. Fortaleza: UFC Edições; 1997. p. 15-20. [ Links ]
Matos FJA. Plantas da medicina popular do Nordeste: propriedades atribuídas e confirmadas. Fortaleza: EUFC; 1999. 80 p. [ Links ]
Nascimento GGF, Locatelli J, Freitas PC, Silva GL. Antibacterial activity of plant extracts and phytochemicals on antibiotic-resistant bacteria. Braz J Microbiol. 2000;31(1):247-56. Doi: 10.1590/S1517-83822000000400003. [ Links ]
Natheer SE, Sekar C, Amutharaj P, Rahman MSA, Khan KF. Evaluation of antibacterial activity of Morinda citrifolia, Vitex trifolia and Chromolaena odorata. Afr J Pharm Pharmacol. 2012;6(11):783-788. Doi: 10.5897/AJPP11.435. [ Links ]
NCCLS (Nattinal Committee For Clinical Laboratory Standards). Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that grow aerobically. 6a ed. Wayne, PA: NCCLS Approved Standart M7-A6; 2003. p. 50-62. [ Links ]
Perruchon S. Estudo das propriedades dos flavonóides para cosméticos através do relacionamento função-estrutura. Cosm & Toil. 2002;14(6):74. [ Links ]
Rivera A, Giono S, Gonzalez M, Rodríguez N, Cedillo L. Antibacterial effect of Morinda citrifolia fruit juice against mycoplasmas. Ann Biol Res. 2011;2:491-497. [ Links ]
Rodríguez FJM, Pinedo DM. Mito y realidad de Morinda citrifolia L. (Noni). Rev Cubana Plant Med. 2004;9(3):3-6. [ Links ]
Sakagami Y, Kajimura K. Bactericidal activities ofdisinfectants against vancomycin-resistant enterococci. J Hosp Infec. 2002;50(2):140-4. Doi:10.1053/jhin.2001.1150. [ Links ]
Santos KKD, Matias EF, Tintino SR, Souza CE, Braga MF, Guedes GM, et al. Cytotoxic, trypanocidal, and antifungal activities of Eugenia jambolana L. J Med Food. 2012;15(1):66-70. Doi: 10.1089/jmf.2010.0298. [ Links ]
Santos-Júnior RQ, Soares LC, Mendes LMS, Araújo KS, Filho ALMM, Costa CLS, Santos IMSP. Histomorfologia de órgãos-alvo de ratos diabéticos suplementados com noni (Morinda citrifolia). ConScientiae Saúde. 2011;10(4):657-664. [ Links ]
Santos NQ A resistência bacteriana no contexto da infecção hospitalar. Texto e Contexto Enfermagem. 2004(v):13. [ Links ]
Saraiva RMC. Atividade antibacteriana de plantas medicinais frente à bactérias multirresistentes e a sua interação com drogas antimicrobianas (Dissertação de mestrado). Belém: Mestrado em Ciências Farmacêuticas, Universidade Federal do Pará; 2012. 94 p. [ Links ]
Schenkel EP, Gosmann G, Petrovick PR. Produtos de origem vegetal e o desenvolvimento de medicamentos. In: Simões CMO, Schenkel EP, Gosmann G, Mello JCP, Mentz LA, Petrovick PR, org(s). Farmacognosia: da planta ao medicamento. 3a ed. Porto Alegre/Florianópolis: Editora da Universidade UFRGS/ Editora da UFSC; 2001. p. 301-332. [ Links ]
Silva CLR, Medeiros PVQ, Leite AG, Silva KJP, Mendonça CV, Silva CGG. Caracterização do fruto de Morinda citrifolia L. (Noni). Rev Cubana Plant Med. 2012;17(1):93-100. [ Links ]
Silva-Silveira LM, Olea RSG, Gonçalves LHB, Santos PF. Atividade antibacteriana de amostras de fruto do noni (Morinda citrifolia L.-Rubiaceae) vendidas em feiras livres de São Luís, Maranhão. Rev Saud & Cien. 2011;2(1):31-37. [ Links ]
Simões CMO, Schenkel EP, Gosmann G, Mello JCP, Mentz LA e Petrovick PR. Farmacognosia: da planta ao medicamento. 5a ed. Florianópolis: Editora da UFSC; 2004. p. 615-656. [ Links ]
Sousa EO, Barreto FS, Rodrigues FFG, Costa JGM. Atividade antibacteriana e interferência de Lantana camara Linn e Lantana montevidensis Briq na resistência de aminoglicosídeos. Rev Bras Bioci. 2011;9(1):1-5. [ Links ]
Teffo LS, Aderogba MA, Eloff JN. Antibacterial and antioxidant activities of four kaempferol methyl ethers isolated from Dodonaea viscosa Jacq. var. angustifolia leaf extracts. S Afr J Bot. 2010;76:25-29. Doi:10.1016 j.sajb.2009.06.010. [ Links ]
Tintino SR, Guedes GMM, Cunha FAB, Santos KKA, Ferreira EFM, Morais-Braga MF, et al. In vitro evaluation of antimicrobial activity and modulating the ethanol and hexane extracts of Costus arabicus bulb. Biosci J. 2013;29(3):732-738. [ Links ]
TIntino SR, Souza CES, Guedes GMM, Costa JIV, Duarte FM, Chaves MCO, et al. Modulatory antimicrobial activity of Piper arboreum extracts. Acta Bot Croat. 2014;73(1):303-311. Doi:10.2478/botcro-2013-0026. [ Links ]
Tsuchiya H, Sato M, Miyazaki T, Fujiwara S, Tanigaki S, Ohyama M, Tanaka T, Jinuma M. Comparative study on the antibacterial activity of phytochemical flavanones against methicillin-resistant Staphylococcus aureus. J Ethnopharmacol. 1996;50:27-34. Doi:10.1016/0378-8741(96)85514-0. [ Links ]
Wang MY, SU C. Cancer Preventive Effect of Morindacitrifolia (Noni). Ann N Y Acad Sci, 2001;952:161-168. Doi:10.1111/j.1749-6632.2001.tb02737.x. [ Links ]
White TC, Kieren AM, Bowden RA. Clinical, cellular and molecular factors that contribute to antifungal drug resistence. Clin Microbiol Rev. 1998;11(2):382-402. [ Links ]