Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.21 no.1 Bogotá Jan./Apr. 2016
https://doi.org/10.15446/abc.v21n1.49336
Doi: http://dx.doi.org/10.15446/abc.v21n1.49336.
EXPRESIÓN DE LOS GENES Serrate1 Y Notch1 DURANTE EL DESARROLLO DEL TERCIO MEDIO FACIAL DEL EMBRIÓN DE POLLO
Expression of Serrate1 and Notch1 Genes During Chicken Embryo Midface Development
Daniel Mauricio MEZA LASSO1, Cindy Johana PEÑA BARRERA1, Francy Yomara BAYONA RODRIGUEZ1, Belfran Alcides CARBONELL MEDINA1, Clementina INFANTE CONTRERAS1,2.
1 Grupo de Investigación en Crecimiento y Desarrollo Craneofacial, Facultad de Odontología, Laboratório de Genética, Instituto de Genética, Universidad Nacional de Colombia. Bogotá D.C. Colombia.
2 Programa de Maestria en Odontología- Plan de Estúdios en Investigación, Facultad de Odontología, Universidad Nacional de Colombia. Bogotá D.C. Colombia.
For correspondence. ccontrerasi@unal.edu.co
Received: 25th February 2015, Returned for revision: 20th May 2015, Accepted: 15th July 2015.
Associate Editor: Graciela Bailliet.
Citation / Citar este artículo como: Meza Lasso DM, Pena Barrera CJ, Bayona Rodriguez FY, Carbonell Medina BA, Infante-Contreras C. Expresión de los genes Serrate1 y Notch1 durante el desarrollo del tercio medio facial del embrión de pollo. Acta biol. Colomb. 2016;21(1):175-182. doi: http://dx.doi.org/10.15446/abc.v21n1.49336.
RESUMEN
La via de senalización Notch se caracteriza por mediar la comunicación célula-célula, regulando diferentes procesos celulares como proliferación, apoptosis y definición del destino celular. Esta via ha sido implicada en el desarrollo de estructuras craneofaciales como paladar, diente y bóveda craneal. El objetivo de esta investigación fue identificar los patrones de expresión de los genes componentes de la via Notch, Serrate1 y Notch1, durante el desarrollo del tercio medio facial. Se utilizaron embriones de pollo (Callus gallus) seleccionados de acuerdo a los criterios de Hamilton y Hamburger y sobre los cuales se realizó hibridación in situ con ribosondas marcadas con Digoxigenina (DIG), para luego ser detectadas con anticuerpos Anti-Dig. Los resultados mostraron expresión de los genes evaluados, en las prominencias maxilares (pmx) y frontonasal (pfn) durante el desarrollo del tercio medio facial. Estos resultados sugieren una probable participación de la via Notch a través de estos genes, en los diferentes procesos celulares que determinan la morfogénesis y el desarrollo del tercio medio facial.
Palabras clave: Desarrollo facial, Notch1, prominencia frontonasal, prominencias maxilares, Serrate1, via de senalización Notch.
ABSTRACT
The Notch signaling pathway is characterized by mediate cell-cell communication, regulating different cellular processes as proliferation, apoptosis and cell fate definition. This pathway has been implicated in craniofacial structures development as palate, teeth and cranial vault. The objective of this research was to identify the genes expression patterns of some Notch signaling pathway components, Serrate1 and Notch1, during the midface development. It was used chicken embryos (Callus gallus) selected according to Hamilton and Hamburger criteria. We performed in situ hybridization with Digoxigenin (DIG)-labeled riboprobes and detected with the antibody Anti-Dig. The results showed the expression of the evaluated genes in the maxillary (pmx) and frontonasal (pfn) prominences during the midface development. These results suggest a probable involvement of the Notch pathway through these genes in different cellular processes that determine midface morphogenesis and development.
Keywords: Facial development, frontonasal prominence, maxillary prominences, Notch signaling pathway, Notch1, Serrate1.
INTRODUCCIÓN
La estructura craneofacial es de gran interés dada la complejidad de su morfogénesis y de las malformaciones que en esta región se generan (Chai y Maxson, 2006). La necesidad de entender los mecanismos celulares y moleculares involucrados en el desarrollo normal y patológico de las estructuras craneofaciales, ha llevado al uso de diferentes modelos animales como ratón, pez y pollo (Szabo-Rogers etal., 2010). Los embriones de aves son útiles para estudios embriológicos dado que son amniotos y por eso más relacionados con humanos y ratones, que con peces y anfibios (Buchtová et al., 2010). En todos los amniotos, un conjunto de huesos intramembranosos separados se condensan para formar el maxilar superior (Lee et al., 2004). Adicionalmente, la disposición de las prominencias faciales alrededor de la futura cavidad oral es caracteristica en vertebrados complejos como mamiferos, reptiles y aves (Lee et al., 2004), razón por la cual el embrión de pollo es un modelo adecuado para estudiar la morfogénesis del tercio medio facial y en alguna medida, extrapolar los resultados al humano.
El desarrollo facial en humanos tiene lugar a partir de la cuarta semana de vida intrauterina, correspondiente al estadio HH19 en pollos, cuando la cavidad oral primitiva está limitada por cinco prominencias faciales (Will y Meller, 1981; Jiang et al., 2006; O'Rahilly y Muller, 2007). En la región más rostral al estomodeo o cavidad oral primitiva, se sitúa una prominencia simétrica e impar, la prominencia frontonasal (pfn), la cual está en intima relación con el prosencéfalo. Lateralmente, el estomodeo está limitado por un par de prominencias maxilares (pmx) y, caudalmente por otro par llamadas prominencias mandibulares (pmd) (Jiang et al., 2006). Estas prominencias están constituidas por una cubierta interna de endodermo, una externa de ectodermo y un centro de mesénquima. La mayor parte del mesénquima craneofacial es derivado de las células de la cresta neural craneal (CCNC), con una contribución más pequeña de células del mesodermo paraxial cefálico (Noden y Trainor, 2005; Noden y Schneider, 2006; O'Rahilly y Muller, 2007). Las CCNC darán lugar entonces a las estructuras esqueléticas del viscerocráneo y de la base de cráneo anterior, neuronas de los ganglios craneales, cartilago y tejido conectivo facial, mientras el mesodermo paraxial, contribuirá a la formación del endotelio vascular y la musculatura facial (Creuzet et al.,2005).
A medida que avanza el desarrollo embrionario, las prominencias faciales van diferenciándose morfológicamente y creciendo, hasta que contactan y se fusionan dando como resultado una morfologia facial definida. Al finalizar la sexta semana en humanos y el estadio HH29 en pollos, las pmx y la pfn se han contactado y fusionado para posteriormente dar lugar al desarrollo de la región intermaxilar, cartilago prenasal y hueso nasal en pollos y, a estructuras homólogas en humanos, el paladar primario, huesos nasales y labio superior (Will y Meller, 1981; Jiang et al., 2006).
El desarrollo de las prominencias faciales al igual que el resto de estructuras craneofaciales, es resultado de la interacción epitelio-mesenquimal orquestada por diferentes vias de senalización como FGF, BMP, SHH, WNT y Notch (Wedden, 1987; Valsecchi et al., 1997; Lan et al., 2006; Paiva et al., 2010; Wang et al., 2011).
La via de senalización Notch está implicada en el desarrollo de varias estructuras del sistema cardiaco, auditivo y nervioso, entre otros (MacGrogan et al., 2010). Esta via, a través de un mecanismo de comunicación célula-célula, regula procesos celulares como apoptosis, proliferación, diferenciación y definición de destino celular (Fiuza y Arias, 2007). Este mecanismo de senalización es conservado evolutivamente en vertebrados e invertebrados, funcionando de forma similar en todos los metazoarios (Perdigoto y Bardin, 2013). Ejemplo de esto es que los receptores Notch han sido encontrados en Drosophila (Notch), en Caenorhabditis elegans (lin-12 y glp-1) y en vertebrados (Notch1-4). De la misma forma, los genes que codifican para los ligandos Delta/Serrate se han aislado en Drosophila (Delta y Serrate), C. Elegans (lag2 y apx-1) y en vertebrados (Delta like 1, 3 y 4, Jagged/Serrate 1 y 2) (Mitsiadis et al., 1997; Perdigot y Bardin, 2013).
Estudios que han analizado la secuencia de los ligandos Serrate en pez cebra (Danio rerio), han determinado que su estructura dominante es similar al ligando Serrate de Drosophila y a los Jagged/Serrate de los tetrapodos (Lissemore y Starmer, 1999).
Varios genes componentes de la via Notch han sido implicados en el desarrollo de estructuras craneofaciales. Por ejemplo, Notch1, el gen que codifica para el receptor Notch1, ha sido involucrado en el desarrollo del paladar secundario y de la mandibula (Casey et al., 2006; Loomes et al., 2007). Otro de los genes involucrados en el desarrollo de estructuras craneofaciales es el gen Jagged1 (Serrate1 en polloj. Este gen codifica para un ligando de esta via, regula la diferenciación de las células osteogénicas de las suturas craneales en desarrollo y su mutación se ha visto relacionada con craneosinostosis (Yen et al., 2010). Adicionalmente, en pacientes con sindrome de Alagille se ha identificado una haploinsuficiencia del gen Jagged1 (Krantz et al., 1998). Los pacientes con este sindrome se caracterizan por presentar alteraciones craneofaciales como: frente amplia, barbilla puntiaguda, nariz bulbosa e hipoplasia del tercio medio facial (Kamath et al., 2002). Este fenotipo facial indica que Jagged1 podria tener alguna función durante el desarrollo del tercio medio facial. Experimentos de perdida de función de Jagged1 en CCNC en un modelo de ratón, evidenciaron alteraciones en los niveles de proliferación de las CCNC en el tercio medio facial, en la vasculogénesis y en la producción de matriz extracelular en los procesos palatinos, asociados con un crecimiento anormal de la región facial (Humphreys et al., 2012). Adicionalmente, otras investigaciones han detectado la expresión de Jagged1 en los primordios de las prominencias maxilares y mandibulares del embrión de ratón (Mitsiadis et al., 1997), asi como un papel trascendental en el desarrollo del cartilago facial y los arcos branquiales en el pez cebra (Zecchin et al., 2005; Zuniga et al., 2010).
Mientras algunos de estos estudios evidencian la implicación de Jagged1 y Notch1 durante el desarrollo de algunas estructuras craneofaciales, aún no se cuenta con un mapa de expresión génica que muestre las estructuras y los momentos en los cuales estos dos genes podrían regular varios de los procesos celulares que toman lugar durante el desarrollo del tercio medio facial. A continuación se muestra, a través de hidridación in situ en el modelo de embrión de pollo, los patrones de expresión de los genes Notch1 y Serrate1 durante los estadios de desarrollo HH25, HH27 y HH29, fases tardias de la formación del tercio medio facial caracterizadas por la aproximación y fusión completa de las pmx y pfn (Buchtová et al., 2010).
MATERIALES Y MÉTODOS
Obtención y fijación de embriones de pollo
Huevos de gallina fertilizados de la especie Callus gallus fueron incubados entre 37,5 °C y 38 °C por 5, 5,5 y 6,5 días para obtener embriones en estadios HH25, HH27 y HH29, respectivamente. Estos estadios fueron seleccionados dado que representan los periodos más críticos del desarrollo del tercio medio facial donde toma lugar el contacto entre las pmx y pfn (Will y Meller, 1981). Los embriones fueron clasificados en los estadios mencionados de acuerdo con los criterios definidos en Hamburger y Hamilton (1992).
Los embriones fueron extraidos de los huevos y colocados en PBS/DEPC (solución buffer fosfato/ dietilpirocarbonato) y fijados en paraformaldehido (PFA) al 4 % por 12 horas, previa perfusión con PFA en el sistema circulatorio. Posteriormente, los embriones fueron deshidratados en metanol/PBST (tampon fosfato salino con Twin 20) a concentraciones de 25 %, 50 %, 75 % y 100 % por cinco minutos y almacenados a -20 °C en metanol al 100 %. Los procedimientos para obtención de embriones fueron avalados por el Comité de Ética de la Facultad de Odontología de la Universidad Nacional de Colombia mediante acta 08-13 de 06 de Mayo del 2013.
Construcción de ribosondas
Plásmidos que contenian la secuencia de DNA codificante para los genes Notch1 y Serrate1, obtenidos por cortesía de los profesores, Fernando Giráldez del grupo de Biología del Desarrollo de la Universitat Pompeu Fabra-Parc de Recerca Biomédica de Barcelona, y Domingos Henrique del Instituto de Medicina Molecular de la Universidad de Lisboa, Portugal, fueron utilizados para la construcción de la ribosonda (Myat et al., 1996).
Para la amplificación del DNA se utilizó la cepa de bacterias Escherichia Coli TOP10®. La competencia de estas bacterias se llevó a cabo por el método de cloruro de calcio y su transformación con los plásmidos se dio por choque térmico (Sambrook et al., 1989). Se promovió el crecimiento de las bacterias transformadas en medio LB (Luria Bertani)/ampicilina líquido. Una vez amplificados los plásmidos, se purificaron extrayendo el DNA plasmidico con el Kit QIAprep Miniprep (Qiagen®). Posteriormente, se realizó linearización de los plásmidos que contenian los segmentos de DNA codificante para Notch1 con la enzima de restricción BamH1 (Fermentas®) y por transcripción in vitro se construyó ribosonda antisentido utilizando la enzima T3 RNA polimerasa (Roche®) y ribonucleotidos marcados con digoxigenina-UTP (Uridine TriPhosphate) (Roche®). Para la construcción de la ribosonda antisentido de Serrate1 se utilizó la enzima de restricción EcoRI (Fermentas®) y la transcripción in vitro se realizó con T7 RNA polimerasa (Roche®).
Hibridación in situ en embriones completos
Se realizó hibridación in situ sobre embriones completos por triplicado para cada estadio evaluado. Se utilizaron sondas de RNA antisentido marcadas con Digoxigenina-UTP para los genes Notch1 y Serrate1, previamente utilizadas (Myat et al., 1996). Durante el primer dia los embriones fueron rehidratados en una serie de lavados con concentraciones decrecientes de metanol en PBST (100, 75, 50 y 25 %) y luego tres veces con PBST. Con el fin de facilitar la penetración de la sonda a evaluar, los embriones fueron pretratados con proteinasa K 10 Mg/ml a temperatura ambiente por 25 min. Posteriormente fueron lavados en PBST, posfijados en PFA 4 % fresco, lavados nuevamente en PBST, luego preincubados en solución de hibridación por 10 min a 60 °C e incubados toda la noche con las ribosondas antisentido a 60 °C. En el segundo dia, se realizaron tres lavados poshibridación con solución I (Formamida 50 %, SSC 5X y SDS (Dodecilsulfato sódico) 1 %) y solución II (Formamida 50 % y SSC (saline-sodium citrate 2X) por 30 minutos cada uno, seguido de lavados con TBST. Finalmente, se realizó bloqueo de inespecificidad con solución de bloqueo al 20 % (suero de oveja + Albumina sérica en TBST (Tris Buffered Saline) por tres horas a temperatura ambiente e incubación con anticuerpo Anti-Dig (1:5000 en solución de bloqueo), toda la noche a 4 °C. Con el objetivo de eliminar los excesos de anticuerpo, en el tercer dia, se realizaron 6 lavados con TBST por 30 min y se dejaron los embriones toda la noche con agitación en TBST. Finalmente, al cuarto dia se realizaron tres lavados con NTMT (Alkaline phosphatase buffer) por 15 min cada uno y posteriormente la visualización de los sitios de hibridación fue realizada a través de un sistema de detección NBT (nitro-blue tetrazolium chloride) y BCIP (5-bromo-4-chloro-3'-indolyphosphate p-toluidine salt).
RESULTADOS
Expresión de los genes Notch1 y Serrate1 en el estadio HH25
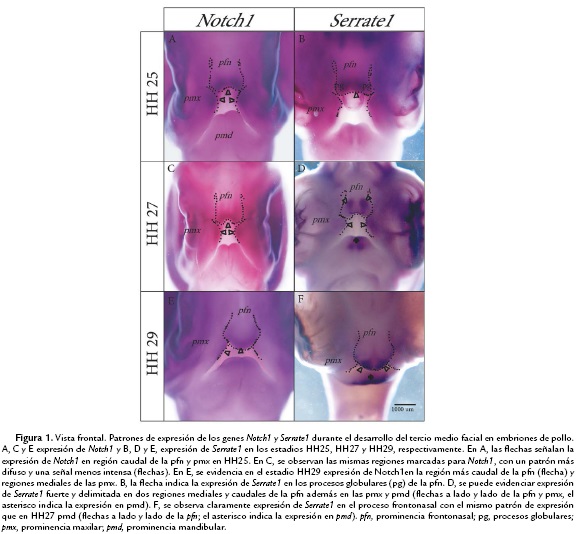
El desarrollo del tercio medio facial toma lugar durante la cuarta semana de vida intrauterina en humanos y en el estadio HH25 en el embrión de pollo cuando las pmx y pfn crecen y definen la morfologia facial. El estadio HH25 se caracteriza porque la pfn ha experimentado un crecimiento caudal que la sitúa un poco superior a las pmx, muy cercana en distancia, pero sin contactar aún con estas. Mediante hibridación in situ se evaluaron los patrones de expresión de los genes Notch1 y Serrate1 en este estadio. En embriones completos se puede observar que el gen Notch1 se expresa tanto en las dos pmx, como en los procesos globulares (pg) de la adyacente pfn (Fig. 1A). Con respecto al gen Serrate1, su expresión se identificó en la región más caudal de la pfn, tal y como se observó con Notch1 en esta misma estructura; no se detectó expresión para Serrate1 en las pmx (Fig. 1B).
Expresión de los genes Notch1 y Serrate1 en el estadio HH27
El desarrollo del tercio medio facial en el estadio HH27 en pollos y correspondiente a la quinta semana de vida intrauterina en humanos, se caracteriza porque la pfn se ha desplazado más caudalmente y está en contacto con las dos pmx a lado y lado, aunque todavía no hay un proceso de fusión. En este estadio se puede observar una menor intensidad del marcaje obtenido para Notch1 tanto en la región más caudal de la pfn como en las pmx que contactan con los proceso globulares (pg) (Fig. 1C). Serrate1 por su parte presenta una expresión circunscrita a la región más caudal y medial de la pfn. Esta expresión se evidencia en dos regiones puntuales del proceso frontonasal y da la impresión de dos grupos de células, que aunque están expresando un mismo gen, se encuentran separadas por una región libre de expresión del gen Serrate1 (Fig. 1D). En este estadio también se observa expresión en la región más caudal de la pmx y de manera muy intensa en la prominencia mandibular (pmd) (Fig. 1D). El patrón de expresión para Serrate1 y Notch1 en la pfn permanece sobrelapado como en el estadio HH25.
Expresión de los genes Notch1 y Serrate1 en el estadio HH29
En este momento del desarrollo, el aspecto más relevante del tercio medio facial hace referencia al proceso de fusión entre la pfn y las pmx a lado y lado del estomodeo. Además, es importante destacar un aumento considerable en el crecimiento caudal del proceso frontonasal. Se puede evidenciar que la intensidad del marcaje para Notch1 en la región más caudal (punta) de la pfn, se observa más leve, al igual que en la región medial de las pmx (Fig. 1E). La expresión de Serrate1 en este estadio del desarrollo sigue siendo bastante intensa y con el mismo patrón observado en el estadio anteriormente evaluado (Fig. 1F). En este estadio del desarrollo facial se observa como la expresión de Serrate1 y Notch1 se localizan en la región más caudal y medial de la pfn, mostrando un patrón de expresión sobrelapado, aunque la expresión de Notch1 es más dispersa y menos intensa. No se detectó expresión de Serrate1 en las pmx, sin embargo, se observó expresión en la región medial de la pmd (Fig. 1F).
DISCUSIÓN
La morfogénesis facial en vertebrados se caracteriza por el desarrollo de cinco prominencias faciales que rodean la cavidad oral primitiva (Jiang et al., 2006). Estas prominencias están constituidas por una región central de mesénquima derivado de las CCNC y mesodermo paraxial, cubiertas por epitelio derivado del endodermo faríngeo en la región más interna y externamente por epitelio derivado del ectodermo oral. La formación de la cara es el resultado de la interacción epitelio-mesenquimal, que regula varios procesos celulares como proliferación y apoptosis. Es así como los altos niveles de proliferación celular generan el crecimiento de las prominencias faciales promoviendo su contacto y fusión (McGonnell et al., 1998).
Uno de los principales objetivos de la biología del desarrollo craneofacial es estudiar los diferentes genes implicados en el desarrollo de la región facial. Por esta razón, en este trabajo se planteó identificar los patrones de expresión de los genes Notch1 y Serrate1 durante el desarrollo del tercio medio facial, en el modelo de embrión de pollo.
Determinar los patrones de expresión génica es prerrequisito para aclarar el papel que pueden tener estos genes en el desarrollo de las pmx y la pfn, teniendo en cuenta que han sido implicados previamente en el desarrollo de estructuras craneofaciales como el paladar y en síndromes con fenotipos que involucran alteraciones en el complejo facial (Oda et al., 1997; Krantz et al., 1998; Piccoli y Spinner, 2001).
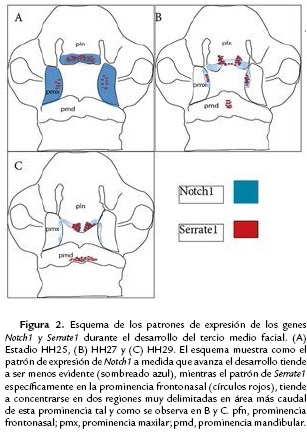
Nuestros resultados muestran como Notch1 y Serrate1 se expresan en las pmx y en la pfn, durante etapas tardías del desarrollo del tercio medio facial, estadios HH25 a HH29, cuando estas se aproximan y fusionan. La expresión de estos genes coincidió en la pfn durante todos los estadios analizados y, en las pmx en el estadio HH27 (Figs. 2A-2C). Esta coincidencia podría sugerir una relación ligando receptor, Notch1-Serrate1. No obstante, deben ser realizados ensayos de función para confirmar esta hipótesis. A pesar de que el marcaje de los dos genes coincide durante los estadios HH27 y HH29, la intensidad de la serial se hace diferente, siendo más concentrada y fuerte para Serrate1 y más dispersa en el caso de Notch1. Estudios previos en un modelo murino han evidenciado patrones de expresión de Notch1 durante el desarrollo de estructuras craneofaciales como el paladar secundario, el cual se desarrolla en estadios más tardios que los analizados en esta investigación, demostrando que la activación del receptor Notch1 estaba mediada, especificamente por Jagged2 (homólogo de Serrate2). Sin embargo, este estudio no analizó la expresión de Jagged1 (Casey et al., 2006).
Por otro lado, otras investigaciones en el modelo de pez cebra (Danio rerio) han encontrado la expresión de Jagged1b (homólogo de Jagged1/Serrate1) durante etapas tempranas del desarrollo facial, en la región dorsal de los arcos branquiales (Zuniga et al., 2010). Adicionalmente, demostraron que la activación de la vía Notch en este momento del desarrollo, estaba mediada por la interacción Jagged1b-Notch2, asegurando la identidad dorsal dentro del proceso mandibular al reprimir la expresión génica ventral (Zuniga et al., 2010). Este estudio y las mutaciones halladas en el Síndrome de Alagille, muestran que tanto en etapas tempranas como tardías del desarrollo facial, Jagged1 parece estar interactuando con Notch2. Dado que hasta la fecha no existían reportes que mostraran una correlación de patrones de expresión durante el desarrollo del tercio medio facial para Serrate1 y Notch1, los hallazgos de nuestro trabajo resultan de gran interés.
Nuestros resultados muestran un patrón de expresión de Serrate1 bastante contundente en la región caudal de la pfn (Fig. 1B, 1D y 1F), la cual es considerada como una de las áreas de mayor proliferación celular y que contribuye al crecimiento de esta prominencia y a su posterior contacto y fusión con las pmx (McGonnell et al., 1998; Szabo-Rogers et al., 2008). Estudios previos en ratones con una mutación condicional de Jagged1 en las CCNC, muestran un fenotipo craneofacial similar al síndrome de Alagille, el cual se caracteriza por una hipoplasia marcada del tercio medio facial. La causa de este fenotipo se debió principalmente a la disminución en la proliferación del mesénquima (Casey et al., 2006). Estos resultados fueron obtenidos de tejidos provenientes de las pmx y los procesos palatinos, sin evaluar lo que ocurre en la prominencia frontonasal; obviando el aporte que realiza al desarrollo del tercio medio facial. Por lo tanto, teniendo en cuenta el patrón de expresión observado para Serrate1 en nuestro estudio y la participación reportada de la vía Notch en la regulación del ciclo celular, surge el planteamiento de una probable participación de Serrate1 en los procesos proliferativos del mesénquima frontonasal (Humphreys et al., 2012).
Por otro lado, además de la probable participación de Serrate1 en eventos de proliferación celular, este ligando también puede estar mediando procesos de diferenciación del mesénquima frontonasal hacia un linaje condroblástico u osteoblástico. Durante el desarrollo del maxilar superior se ha evidenciado que Jagged1 participa en el proceso de osificación intramembranosa regulando la diferenciación de células mesenquimales hacia un linaje osteoblástico y la consecuente mineralización de la matriz (Hill et al., 2014). Otros estudios han mostrado que la via Notch a través de Jagged1 y Notch2 regulan los procesos de osificación intramembranosa y endocondral en células mesenquimales procedentes de calvaria murina (Dishowitz et al., 2012). Por lo tanto, teniendo en cuenta que en los estadios evaluados, además de eventos de proliferación del mesénquima frontonasal también toma lugar el proceso de osificación, cabe sugerir que Serrate1 también podría estar regulando la osificación de las estructuras óseas derivadas del proceso frontonasal.
Finalmente, los patrones de expresión observados en este estudio pueden ser comparados con la expresión de genes componentes de otras vías de seralización que han sido previamente implicadas en el desarrollo del tercio medio facial como WNT y BMP (Gong y Guo, 2003; Brugmann et al., 2007). Los patrones de expresión observados para Notch1 y Serrate1 en el estadio HH25 y HH27 son similares a los observados para Wnt9B, Wnt5A y Wnt5B (Geetha-Loganathan et al., 2009). De estos patrones, cabe resaltar la expresión de Wnt5A quien, al igual que Serrate1 en la pfn, muestran un patrón de expresión en la región caudal y a lo largo del eje medial-lateral durante el estadio HH25. Posteriormente, en el estadio HH27 esta expresión se reduce a dos poblaciones distintivas en la región más caudal y medial del proceso frontonasal (Geetha-Loganathan et al., 2009). Como se expresó anteriormente, se ha demostrado que esta región es considerada la de más altos niveles de proliferación mesenquimal. Por otro lado, Bmp-4 y Bmp-2 también muestran un patrón de expresión similar a los observados para Serrate1 y Notch1 tanto en la pfn como en los procesos maxilares antes y durante el proceso de fusión de las prominencias faciales (Gong y Guo, 2003). Estos datos comparativos generan nuevas inquietudes sobre las probables funciones de la vía Notch durante el desarrollo del tercio medio facial y su potencial interacción con otras vias de senalización. Inquietudes que deben ser resueltas con estudios más profundos de proliferación, muerte y diferenciación celular, asi como estudios de ganancia y pérdida de función génica.
CONCLUSIONES
Los genes analizados en este estudio, se expresan con un patrón característico en las pmx y la pfn durante la aproximación y fusión de las mismas, en el embrión de pollo. Detectar esta expresión sugiere una posible función de la via de senalización celular Notch a través de este ligando y este receptor, posiblemente mediando procesos celulares como proliferación y diferenciación. No obstante, estudios adicionales deben ser llevados a cabo para profundizar sobre estos hallazgos.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Nacional de Colombia, al Programa de Maestria en Odontología, al Centro de Investigación y Extensión de la Facultad de Odontología de la Universidad Nacional de Colombia por la financiación del presente trabajo, al Instituto de Genética de la Universidad Nacional de Colombia por el uso de sus instalaciones, al profesor Humberto Arboleda Granados por ser apoyo fundamental e impulsar el grupo de investigación.
REFERENCIAS
Brugmann SA, Goodnough LH, Gregorieff A, Leucht P, ten Berge D, Fuerer C, et al. Wnt signaling mediates regional specification in the vertebrate face. Development. 2007;134(18):3283-3295. Doi:10.1242/dev.005132. [ Links ]
Buchtová M, Kuo WP, Nimmagadda S, Benson SL, Geetha-Loganathan P, Logan C, et al. Whole genome microarray analysis of chicken embryo facial prominences. Dev Dyn. 2010;239(2):574-591. Doi:10.1002/dvdy.22135. [ Links ]
Casey LM, Lan Y, Cho ES, Maltby KM, Gridley T, Jiang R. Jag2-Notch1 signaling regulates oral epithelial differentiation y palate development. Dev Dyn. 2006;235(7):1830-1844. Doi:10.1002/dvdy.20821. [ Links ]
Creuzet S, Couly G, Le Douarin NM. Patterning the neural crest derivatives during development of the vertebrate head: insights from avian studies. J Anat. 2005;207(5):447-459. Doi:10.1111/j.1469-7580.2005.00485.x. [ Links ]
Chai Y, Maxson RE Jr. Recent advances in craniofacial morphogenesis. Dev Dyn. 2006;235(9):2353-2375. Doi:10.1002/dvdy.20833. [ Links ]
Dishowitz MI, Terkhorn SP, Bostic SA, Hankenson KD. Notch signaling components are upregulated during both endochondral y intramembranous bone regeneration. J Orthop Res. 2012;30(2):296-303. Doi:10.1002/jor.21518. [ Links ]
Fiúza U-M, Arias AM. Cell and molecular biology of Notch. J Endocrinol. 2007;194(3):459-474. Doi:10.1677/JOE-07-0242. [ Links ]
Geetha-Loganathan P, Nimmagadda S, Antoni L, Fu K, Whiting CJ, Francis-West P, et al. Expression of WNT signalling pathway genes during chicken craniofacial development. Dev Dyn. 2009;238(5):1150-1 165. Doi:10.1002/dvdy.21934. [ Links ]
Gong SG, Guo C. Bmp4 gene is expressed at the putative site of fusion in the midfacial region. Differentiation. 2003;71(3):228-236. Doi:10.1046/j.1432-0436.2003.710304.x. [ Links ]
Hamburger V, Hamilton HL. A series of normal stages in the development of the chick embryo. Dev Dyn. 1992;195(4):231-272. Doi:10.1002/aja.1001950404. [ Links ]
Hill CR, Yuasa M, Schoenecker J, Goudy SL. Jagged1 is essential for osteoblast development during maxillary ossification. Bone. 2014;62:10-21. Doi:10.1016/j. bone.2014.01.019. [ Links ]
Humphreys R, Zheng W, Prince LS, Qu X, Brown C, Loomes K, et al. Cranial neural crest ablation of Jagged1 recapitulates the craniofacial phenotype of Alagille syndrome patients. Hum Mol Genet. 2012;21(6):1374-1383. Doi:10.1093/hmg/ddr575. [ Links ]
Jiang R, Bush JO, Lidral AC. Development of the upper lip: morphogenetic and molecular mechanisms. Dev Dyn. 2006;235(5):1152-1166. Doi:10.1002/dvdy.20646. [ Links ]
Kamath BM, Loomes KM, Oakey RJ, Emerick KE, Conversano T, Spinner NB, et al. Facial features in Alagille syndrome: specific or cholestasis facies?. Am J Med Genet. 2002;112(2):163-170. Doi:10.1002/ajmg.10579. [ Links ]
Krantz ID, Colliton RP, Genin A, Ry EB, Li L, Piccoli DA, et al. Spectrum and frequency of jagged1 (JAG1) mutations in Alagille syndrome patients and their families. Am J Hum Genet. 1998;62(6):1361-1369. Doi:10.1086/301875. [ Links ]
Lan Y, Ryan RC, Zhang Z, Bullard SA, Bush JO, Maltby KM, et al. Expression of Wnt9b and activation of canonical Wnt signaling during midfacial morphogenesis in mice. Dev Dyn. 2006;235(5):1448-1454. Doi:10.1002/dvdy.20723. [ Links ]
Lee AS, Zhang M, Evans DJ. Changes in the proportion and number of Pax(7+ve) and MF20(+ve) myoblasts during chick myogenesis in the head and limb. Int J Dev Biol. 2004;48(1):31-38. [ Links ]
Lissemore JL, Starmer WT. Phylogenetic analysis of vertebrate and invertebrate Delta/Serrate/LAG-2 (DSL) proteins. Mol Phylogenet Evol. 1999;11(2):308-319. Doi:10.1006/mpev.1998.0588. [ Links ]
Loomes KM, Stevens SA, O'Brien ML, Gonzalez DM, Ryan MJ, Segalov M, et al. Dll3 and Notch1 genetic interactions model axial segmental and craniofacial malformations of human birth defects. Dev Dyn. 2007;236(10):2943-2951. Doi:10.1002/dvdy.21296. [ Links ]
MacGrogan D, Nus M, de la Pompa JL. Notch signaling in cardiac development and disease. Curr Top Dev Biol. 2010;92:333-365. Doi:10.1016/S0070-2153(10)92011-5. [ Links ]
McGonnell IM, Clarke JD, Tickle C. Fate map of the developing chick face: analysis of expansion of facial primordia and establishment of the primary palate. Dev Dyn. 1998;212(1):102-118. Doi:10.1002/(SICI)1097-0177(199805)212:1<102::AID-AJA10>3.0.CO;2-9. [ Links ]
Mitsiadis TA, Henrique D, Thesleff I, Lendahl U. Mouse Serrate-1 (Jagged-1): expression in the developing tooth is regulated by epithelial-mesenchymal interactions and fibroblast growth factor-4. Development. 1997;124(8):1473-1483. [ Links ]
Myat A, Henrique D, Ish-Horowicz D, Lewis J. A chick homologue of Serrate and its relationship with Notch and Delta homologues during central neurogenesis. Dev Biol. 1996;174(2):233-247. Doi:10.1006/dbio.1996.0069. [ Links ]
Neves J, Parada C, Chamizo M, Giraldez F. Jagged 1 regulates the restriction of Sox2 expression in the developing chicken inner ear: a mechanism for sensory organ specification. Development. 2011;138(4):735-744. Doi:10.1242/dev.060657. [ Links ]
Noden DM, Schneider RA. Neural crest cells and the community of plan for craniofacial development: historical debates and current perspectives. Adv Exp Med Biol. 2006;589:1-23. Doi:10.1007/978-0-387-46954-6_1. [ Links ]
Noden DM, Trainor PA. Relations and interactions between cranial mesoderm and neural crest populations. J Anat. 2005;207(5):575-601. Doi:10.1111/j.1469-7580.2005.00473.x. [ Links ]
O'Rahilly R, Muller F. The development of the neural crest in the human. J Anat. 2007;211(3):335-351. Doi:10.1111/j.1469-7580.2007.00773.x. [ Links ]
Oda T, Elkahloun AG, Meltzer PS, Chyrasekharappa SC. Identification and cloning of the human homolog (JAG1) of the rat Jagged1 gene from the Alagille syndrome critical region at 20p12. Genomics. 1997;43(3):376-379. Doi:10.1006/geno.1997.4820. [ Links ]
Paiva KB, Silva-Valenzuela M, Massironi SM, Ko GM, Siqueira FM, Nunes FD. Differential Shh, Bmp and Wnt gene expressions during craniofacial development in mice. Acta Histochem. 2010;1 12(5):508-517. Doi:10.1016 j.acthis.2009.05.007. [ Links ]
Perdigoto CN, Bardin AJ. Sending the right signal: Notch and stem cells. Biochim Biophys Acta. 2013;1830(2):2307-22. Doi:10.1016/j.bbagen.2012.08.009 [ Links ]
Piccoli DA, Spinner NB. Alagille syndrome and the Jagged1 gene. Semin Liver Dis. 2001;21(4):525-534.Doi:10.1055/s-2001-19036. [ Links ]
Rizzoti K, Lovell-Badge R. SOX3 activity during pharyngeal segmentation is required for craniofacial morphogenesis.2007;134(19):3437-3448. Doi:10.1242/dev.007906. [ Links ]
Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. Vol. 1, 2, 3. NY: Cold Spring Harbor Laboratory Press; 1989. p. 51. [ Links ]
Szabo-Rogers HL, Geetha-Loganathan P, Nimmagadda S, Fu KK, Richman JM. FGF signals from the nasal pit are necessary for normal facial morphogenesis. Dev Biol. 2008;318(2):289-302. Doi:10.1016/j. ydbio.2008.03.027. [ Links ]
Szabo-Rogers HL, Smithers LE, Yakob W, Liu KJ. New directions in craniofacial morphogenesis. Dev Biol. 2010;341(1):84-94. Doi:10.1016/j.ydbio.2009.11.021. [ Links ]
Valsecchi C, Ghezzi C, Ballabio A, Rugarli EI. JAGGED2: a putative Notch ligand expressed in the apical ectodermal ridge and in sites of epithelial-mesenchymal interactions. Mech Dev. 1997;69(1-2):203-207. [ Links ]
Wang Y, Song L, Zhou CJ. The canonical Wnt/beta-catenin signaling pathway regulates Fgf signaling for early facial development. Dev Biol. 2011;349(2):250-260. Doi:10.1016/j.ydbio.2010.11.004. [ Links ]
Wedden SE. Epithelial-mesenchymal interactions in the development of chick facial primordia and the target of retinoid action. Development. 1987;99(3):341-351. [ Links ]
Will LA, Meller SM. Primary palatal development in the chick. J Morphol. 1981;169(2):185-190. Doi:10.1002/jmor.1051690205. [ Links ]
Yen HY, Ting MC, Maxson RE. Jagged1 functions downstream of Twist1 in the specification of the coronal suture and the formation of a boundary between osteogenic and non-osteogenic cells. Dev Biol. 2010;347(2):258-270. Doi:10.1016/j.ydbio.2010.08.010. [ Links ]
Zecchin E, Conigliaro A, Tiso N, Argenton F, Bortolussi M. Expression analysis of jagged genes in zebrafish embryos. Dev Dyn. 2005;233(2):638-645. Doi:10.1002/dvdy.20366. [ Links ]
Zuniga E, Stellabotte F, Crump JG. Jagged-Notch signaling ensures dorsal skeletal identity in the vertebrate face. Development. 2010;137(11):1843-1852. Doi:10.1242/dev.049056. [ Links ]