Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.21 no.2 Bogotá May./Aug. 2016
https://doi.org/10.15446/abc.v21n2.51253
Doi: http://dx.doi.org/10.15446/abc.v21n2.51253
INMOVILIZACIÓN DE LAS MICROALGAS Scenedesmus ovalternus (Scenedesmaceae) Y Chlorella vulgaris (Chlorellaceae) EN ESFERAS DE ALGINATO DE CALCIO
Immobilization of Microalgae Scenedesmus ovalternus (Scenedesmaceae) and Chlorella vulgaris (Chlorellaceae) in Calcium Alginate Beads
Mario Andrés FORERO-CUJIÑO1, Luis Carlos MONTENGRO RUIZ1, Gabriel Antonio PINILLA-AGUDELO1, Luz Marina MELGAREJO-MUÑOZ1.
1 Departamento de Biología, Universidad Nacional de Colombia, Carrera 30 nº. 45-03, edificio 421. Bogotá, Colombia.
For correspondence. maforeroc@unal.edu.co
Received: 21st July 2015, Returned for revision: 14th September 2015, Accepted: 21st October 2015. Associate Editor: Rafael Riosmena Rodríguez.
Citation / Citar este artículo como: Forero-Cujiño MA, Montengro-Ruiz LC, Pinilla-Agudelo GA, Melgarejo-Muñoz LM. Inmovilización de las microalgas Scenedesmus ovalternus (Scenedesmaceae) y Chlorella vulgaris (Chlorellaceae) en esferas de alginato de calcio. Acta biol. Colomb. 2016;21(2):437-442. doi: http://dx.doi.org/10.15446/abc.v21n2.51253
RESUMEN
En este trabajo se describe la técnica de inmovilización de microalgas en esferas de alginato de calcio. Se emplearon las especies Scenedesmus ovalternus y Chlorella vulgaris, se determinó la estabilidad de las esferas, la cinética de crecimiento y la concentración de las microalgas en el interior de las esferas. Chlorella vulgaris alcanzó mayores densidades poblacionales y tasas de crecimiento más altas cuando se inmovilizó en concentraciones del 10 % v/v con el alginato (1,31*106 cél/ml). Para Scenedesmus ovalternus se observó una mayor densidad poblacional y una mayor tasa de crecimiento cuando se inmovilizó en concentraciones del 20 % v/v (7,06*105 cél/ml). Estos resultados son útiles para aplicaciones prácticas de las algas encapsuladas, tales como el biomonitoreo o la biorremediación.
Palabras clave: alginato de calcio, Chlorella vulgaris, microalgas inmovilizadas, técnica de inmovilización, Scenedesmus ovalternus.
ABSTRACT
This paper describes the immobilization technique of microalgae in calcium alginate beads. Scenedesmus ovalternus and Chlorella vulgaris species were used. The stability of beads, the kinetics of growth and the concentrations of microalgae inside the beads were determined. The higher density and the upper growth rate of Chlorella vulgaris occurred when it was immobilized in alginate at a concentration of 10 %v/v (1,31*106 cél/ml). Scenedesmus ovalternus achieved a higher population density and an elevated growth rate when it was immobilized at a concentration of 20 % v/v (7,06*105 cél/ml). These results are useful for subsequent applications of the encapsulated algae, such as biomonitoring and bioremediation.
Keywords: calcium alginate, Chlorella vulgaris, immobilization technique, immobilized microalgae, Scenedesmus ovalternus.
INTRODUCCIÓN
El acelerado aumento de la población humana genera graves procesos de deterioro y contaminación de los sistemas acuáticos, tales como la eutrofización, lo que a su vez favorece los florecimientos algales (Roldán y Ramírez, 2008). La abundancia de ciertas algas puede reflejar el estado trófico de un sistema acuático, ya que son muy sensibles a los contaminantes y reaccionan rápidamente ante diferentes concentraciones de nutrientes (Pinilla, 2000; Roldán y Ramírez, 2008). Los estudios realizados en Colombia sobre el papel bioindicador de las algas son relativamente pocos debido a los dispendiosos procedimientos de colecta e identificación y a los complejos factores que las afectan. Las microalgas inmovilizadas en cápsulas de alginato de calcio permiten el biomonitoreo del estado trófico de una forma más confiable (Twist et al., 1998). La inmovilización de microalgas surgió hace más de 20 años en Canadá (La Noüe y Proulx, 1988), donde se usaron para el tratamiento de aguas residuales. Otros trabajos iniciales fueron los de Van Donk et al. (1992), Van Donk et al. (1993) y Faafeng et al. (1994). Se destaca el estudio de Twist et al. (1998), quienes encapsularon algas en alginato adheridas a láminas de nylon y establecieron la influencia de los nutrientes sobre el crecimiento algal como un mecanismo de monitoreo del estado trófico. El presente trabajo buscó adaptar la técnica de inmovilización con Scenedesmus ovalternus y Chlorella vulgaris en esferas de alginato de calcio y establecer la cinética de crecimiento de estas especies, como base para un nuevo sistema de biomonitoreo del estado trófico.
Se emplearon las cepas nativas LAUN 001 (Scenedesmus ovalternus Chodat) y LAUN 002 (Chlorella vulgaris Beijerinck), del Laboratorio de Cultivo de Microalgas (LCM) del Departamento de Biología de la Universidad Nacional de Colombia, en donde se desarrollaron todos los experimentos en 2011. Los cultivos sólidos de cada especie se disolvieron en Medio Basal de Bold (BBM), de donde se tomaron 5 mL y se llevaron a 200 mL en el mismo medio de cultivo. Esta mezcla se utilizó como inóculo inicial para la producción de biomasa algal a mayor escala. Los cultivos fueron tipo batch en recipientes de vidrio de 375 y 2000 mL, con bombeo de aire atmosférico permanente, temperatura de 23 °C ± 2 ºC, iluminación artificial con intensidad lumínica de 60 μEm-2s-1 y fotoperiodo de 16:8 h luz:oscuridad.
La elaboración de las esferas de alginato con microalgas se basó en los procedimientos descritos por Bashan (1986), González y Bashan (2000) y de-Bashan y Bashan (2010) con los siguientes ajustes: la solución de alginato de sodio fue del 4 % (León, 2004) y se preparó con agua destilada estéril. La mezcla se agitó vigorosamente durante una hora (Bashan, 1986) y los grumos remanentes se disolvieron por calentamiento en microondas por 30 s, tantas veces como fue necesario hasta obtener una solución homogénea. Esta solución se dejó en refrigeración entre 12 y 36 h para eliminar las burbujas. La mezcla de alginato con las algas se realizó con una jeringa estéril de 1 mL; para ello se colocó la alícuota del cultivo algal en un vaso de precipitado (1, 2 o 5 mL para obtener mezclas de algas-alginato al 10, 20 y 50 %, respectivamente), se completó a 10 mL con BBM estéril, se agregaron 10 mL del alginato de sodio al 4 % p/v y se mezcló manualmente. Este procedimiento se realizó en una cámara de flujo laminar. Las concentraciones del 10 % correspondieron a 3,53*105 células/ml de S. ovalternus y 1,31*106 células/ml de C. vulgaris; las del 20 % fueron de 7,06*105 células/ml de S. ovalternus y 2,63*106 células/ml de C. vulgaris; y las del 50 % fueron 1,77*106 células/ml de S. ovalternus y 6,58*106 células/ml de C. vulgaris. De la mezcla alginato-microalgas se tomó un volumen con una jeringa estéril de 1 mL y se formaron gotas (Bashan, 1986; González y Bashan, 2000) que se hicieron caer en una solución al 2 % v/v de CaCl2 (González y Bashan, 2000; de-Bashan et al., 2002a; de-Bashan et al., 2008), cuya temperatura estaba entre 1 y 3 °C (León, 2004). Las esferas formadas se mantuvieron en la solución de CaCl2 durante 60 minutos (Bashan et al., 2002). Luego se colocaron en recipientes de 375 mL, dentro de los cuales se redujo la intensidad de la aireación para evitar la fricción entre las esferas. En cada ensayo se cultivaron 200 esferas distribuídas en seis recipientes de 375 mL (dos réplicas para cada una de las tres densidades mencionadas anteriormente), cada uno con 200 mL de BBM.
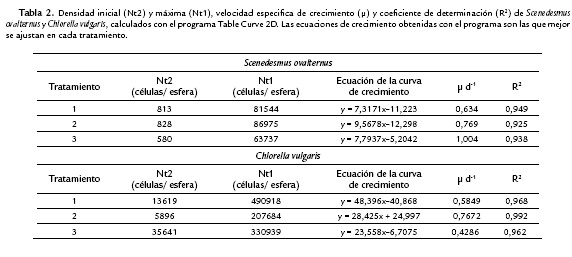
La cinética de crecimiento se basó en el conteo de algas de cada cultivo, cada 24 horas durante todo el período de cultivo (diez y ocho días para S. ovalternus y C. vulgaris, respectivamente). Para ello se tomaron diariamente nueve esferas de cada cultivo y se disolvieron individualmente en bicarbonato de sodio al 4 % p/v a temperatura ambiente (Yabur et al., 2007; de-Bashan et al., 2008). Para facilitar la solubilidad de las esferas, se agitaron vigorosamente en un Shaker rotatorio a 100 rpm (Bashan, 1986; Bashan et al., 2002a) durante 15 minutos. De cada esfera disuelta se colocó 0,1 mL en una cámara de Neubauer para hacer el conteo en un microscopio de luz (de-Bashan et al., 2004). Para S. ovalternus se contaron las células de los cenobios. Se utilizó el programa Table Curve 2D (v5.01), que permite ajustar automáticamente la curva de crecimiento a la ecuación integral más apropiada. Se realizaron análisis de varianza de una vía (ANOVA) con un nivel de significancia del 95 %, para determinar las diferencias entre los tratamientos. Las tasas de crecimiento se determinaron con la ecuación μ= ln Nt(1) - ln Nt(2)/ΔT, en donde Nt(1) y Nt(2) son respectivamente la población promedio máxima (día diez para S. ovalternus y ocho para C. vulgaris, inicio de la fase estacionaria de crecimiento en la que el número de células fue relativamente constante) y mínima (densidad inicial del cultivo) en cada uno de los ensayos. El tiempo de duplicación Td (días) se calculó con la ecuación Td = 0,6931*μ.
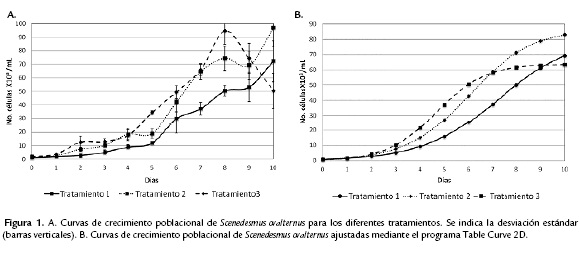
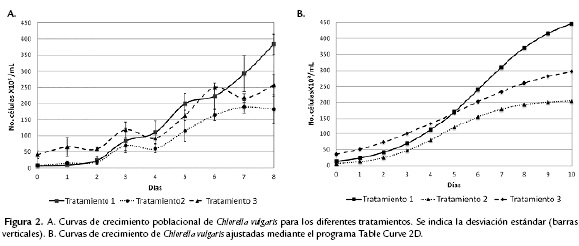
Los resultados mostraron que el crecimiento poblacional de las dos especies inmovilizadas fue diferente para cada concentración ensayada (10, 20 y 50 % v/v). S. ovalternus creció más cuando la concentración inicial fue del 20 % v/v (7,06*105 células/mL) (Figs. 1A- 1B). Para C. vulgaris el crecimiento fue mayor cuando se partió de una concentración celular del 10 % v/v (1,31*106 células/mL) (Figs. 2A- 2B). Las curvas de crecimiento poblacional sin ajustes de cada tratamiento permitieron establecer los parámetros que se observan en la Tabla 1. Según estos resultados, para S. ovalternus el mejor coeficiente de determinación (R2) se logra con la ecuación de crecimiento del tratamiento dos y para C. vulgaris con el tratamiento uno. Las ecuaciones y las curvas de crecimiento ajustadas al modelo logístico con el programa Table Curve 2D (Tabla 2), dejan ver con mayor claridad la dinámica poblacional de las algas. En todos los casos, las curvas sigmoidales de crecimiento tuvieron coeficientes de determinación superiores a 0,9. Bajo estos modelos ajustados S. ovalternus tuvo la tasa de crecimiento más alta con el tratamiento tres, pero con un R2 menor; la mejor curva de crecimiento fue la del tratamiento dos (Fig. 1B). Por su parte, el crecimiento más rápido y el mayor R2 de C. vulgaris se logró con el tratamiento dos, pero la mejor curva de crecimiento se obtuvo en el tratamiento uno (Fig. 2B).
Scenedesmus ovalternus es una especie muy abundante y frecuente en aguas ricas en nutrientes, principalmente nitrógeno (Wehr y Sheath, 2003), de tal forma que aprovecha bien los recursos que le provee el medio BBM. Consecuentemente, sus tasas de crecimiento fueron relativamente altas en todos los tratamientos. Bajo condiciones de laboratorio Twist et al. (1998) encontraron que a mayor cantidad de nutrientes la especie S. subspicatus embebida en alginato de calcio tiene un crecimiento más elevado, lo que corrobora los resultados de la presente investigación. Cabría esperar una mejor curva de crecimiento cuando S. ovalternus se inmoviliza en concentraciones del 50 % v/v (tratamiento tres). Esto no ocurre probablemente porque se presenta una fuerte competencia por los nutrientes, la luz y el espacio, lo que limita el desarrollo de la población. Es probable que S. ovalternus se vea favorecida cuando se inmoviliza en concentraciones intermedias, no solo porque habría una menor competencia intraespecífica, sino por un mejor posicionamiento de las células en la matriz de alginato. En un estudio sobre la ultraestructura de las esferas de alginato (Lebsky et al., 2001), se evidenció que las microalgas se distribuyen uniformemente dentro de la matriz de alginato en las cavidades formadas durante el proceso de solidificación. Por otra parte, el hecho de que S. ovalternus sea un organismo cenobial no parece influir en su reproducción, como ha sido establecido por Reynolds (2006) al comparar las tasas de crecimiento de muchas especies coloniales y unicelulares.
En el caso de C. vulgaris, una baja población inicial parece reducir la competencia por los recursos, lo que favorecería una curva de crecimiento más elevada. C. vulgaris es una especie común y frecuente en aguas con baja concentración de nutrientes (Wehr y Sheath, 2003), en las que generalmente presenta bajas abundancias. Reynolds (2006) indica que la tasa de crecimiento de Chlorella sp. es una de las más altas entre las microalgas planctónicas, pues en condiciones de laboratorio llega a 1,8 d-1. Esta prominente capacidad de reproducción le permite crecer eficientemente ante una elevada cantidad de nutrientes como los que le ofrece el BBM. De otro lado, una menor densidad microalgal inicial permitiría un mejor posicionamiento de las células al interior de las esferas, lo que mejoraría el crecimiento de C. vulgaris, como parece suceder en el tratamiento uno. El tamaño de las esferas es por tanto un factor que podría limitar el crecimiento poblacional de las algas. Se observó que en los últimos días de los cultivos las esferas adquirieron una coloración verde muy intensa debido a la altísima concentración algal. En estas condiciones es posible que las microalgas no tengan el espacio suficiente para expandirse a través de la matriz del polímero. No se sabe si esta alta concentración celular pueda propiciar o acelerar la desintegración de las esferas, pero se evidenció que después de diez días de cultivo éstas empiezan a disolverse.
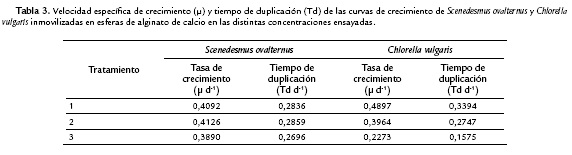
Los parámetros poblacionales calculados manualmente (Tabla 3) muestran que S. ovalternus tuvo un crecimiento más rápido y una tasa de duplicación mayor en el tratamiento dos. C. vulgaris tuvo mejores resultados en el tratamiento uno. Los tiempos de duplicación de las dos especies fueron menores cuando las densidades iniciales fueron altas (tratamiento 3). El análisis de varianza (ANOVA) indicó que los tratamientos presentaron diferencias significativas en cuanto al número de células por esfera, para las dos especies estudiadas (F=230; p=6x10-8 para C. vulgaris y F=246; p=2x10-7 para S. ovalternus).
La adaptación en Colombia de la técnica de inmovilización de microalgas que se describió en este trabajo, constituye una base para realizar estudios más eficientes de biomonitoreo del estado trófico y de otros tipos de contaminación. La utilización de cepas nativas elimina la necesidad de adaptar previamente especies foráneas a las condiciones locales de la comunidad algal. Se evita también el uso de algas potencialmente peligrosas, como por ejemplo cianobacterias tóxicas (Twist et al., 1998). Además, se superan algunas limitaciones de los métodos fisicoquímicos, que solo evalúan las condiciones del momento en que se toman las muestras de agua, y de los métodos biológicos convencionales, que muestran una gran variabilidad que hace muy difícil su interpretación. En suma, esta nueva metodología permitiría la implementación de un método biológico, rápido, repetible y comparable entre los distintos ecosistemas acuáticos, manteniendo las mismas características de la prueba. Se disminuiría así considerablemente la incertidumbre en el establecimiento del estado trófico y del grado de contaminación en general de los ecosistemas acuáticos. Los trabajos de Delgadillo (2013) y Pineda (2014) constituyen los primero acercamientos con esta perspectiva. Además del monitoreo de la contaminación, las algas inmovilizadas pueden tener nuevas aplicaciones biotecnológicas, tales como la biorremediación o la obtención de metabolitos y otros productos.
AGRADECIMIENTOS
Este estudio hizo parte del proyecto de investigación "Biomonitoreo del estado trófico de ecosistemas acuáticos lénticos con microalgas inmovilizadas", cofinanciado por COLCIENCIAS y la Universidad Nacional de Colombia Sede Bogotá, contrato 462-2011. Los autores agradecen a los grupos de investigación "Biodiversidad, biotecnología y conservación de ecosistemas" y "Fisiología del estrés y biodiversidad en plantas y microorganismos" del Departamento de Biología y a los laboratorios de Ecología, de Cultivo de Algas, y de Fisiología y Bioquímica Vegetal del Departamento de Biología de la Universidad Nacional de Colombia, donde se desarrollaron todos los experimentos y mediciones.
REFERENCIAS
Bashan Y. Alginate beads as synthetic inoculant carriers for the slow release of bacteria that affect plant growth. Appl Environ Microb. 1986;51(5):1089-1098. [ Links ]
Bashan Y, Hernández J, Leyva L, Bacilio M. Alginate microbeads as inoculant carriers for plant growth-promoting bacteria. Biol Fert Soils. 2002;35(5):359-368. Doi:10.1007/s00374-002-0481-5. [ Links ]
De-Bashan L, Bashan Y. Immobilized microalgae for removing pollutants: Review of practical aspects. Bioresource Technol. 2010;101(6)1611-1627. Doi: 10.1016/j.biortech.2009.09.043. [ Links ]
De-Bashan L, Bashan Y, Moreno M, Lebsky V, Bustillos J. Increased pigment and lipid content, lipid variety, and cell and population size of the microalgae Chlorella spp. when co-immobilized in alginate beads with the microalgae-growth-promoting bacterium Azospirillum brasilense. Can J Micro. 2002a;48:514-521. Doi:10.1139/W02-051. [ Links ]
De-Bashan L, Hernández J, Morey T, Bashan Y. Microalgae growth-promoting bacteria as ''helpers'' for microalgae: novel approach for removing ammonium and phosphorus from municipal wastewater. Water Res. 2004;38(2):466-74. Doi:10.1007/978-1-4020-5765-6_28. [ Links ]
De-Bashan L, Magallon P, Antoun H, Bashan Y. Role of glutamate dehydrogenase and glutamine synthetase in Chlorella vulgaris during assimilation of ammonium when jointly immobilized with the microalgae-growth-promoting bacterium Azospirillum brasilense. J Phycol. 2008;44(5):1188-1196. Doi:10.1111/j.1529-8817.2008.00572.x. [ Links ]
Delgadillo I. Respuestas biológicas de Scenedesmus ovalternus y Chlorella vulgaris inmovilizadas en alginato de calcio, ante diferentes concentraciones de nutrientes en condiciones de laboratorio (Tesis de Maestría) Bogotá: Departamento de Biología, Universidad Nacional de Colombia; 2013. p. 4-25. [ Links ]
Faafeng B, Van Donk E, Källqvist S. In situ measurement of microalgal growth potential in aquatic ecosystems by immobilized algae. J Appl Phycol. 1994;6(3):301-308. Doi:10.1007/BF02181943. [ Links ]
González L, Bashan Y. Increased growth of the microalga Chlorella vulgaris when coimmobilized and cocultured in alginate beads with the plant-growth-promoting bacterium Azospirillum brasilense. Appl Environ Microbiol. 2000;66(4):1527-1531. [ Links ]
La Noüe J, Proulx D. Biological tertiary treatment of urban wastewaters with chitosan-immobilized Phormidium. Appl Microbiol Biotechnol. 1988;29(2):292-297.Doi:10.1007/BF00939324. [ Links ]
Lebsky V, González-Bashan L, Bashan Y. Ultrastructure of interaction in alginate beads between the microalga Chlorella vulgaris with its natural associative bacterium Phyllobacterium myrsinacearum and with the plant growth- promoting bacterium Azospirillum brasilense. Can J Microbiol. 2001;47(1):1-8. Doi:10.1139/w00-115. [ Links ]
León C. Técnicas para el uso biotecnológico de las microalgas. Manual de laboratorio. Puntarenas (Costa Rica): Universidad Nacional, Escuela de Ciencias Biológicas, Laboratorio Biotecnología de Microalgas (LABMA); 2004. [ Links ]
Pineda A. Efecto del grado de trofía de tres sistemas lénticos sobre el crecimiento poblacional de las especies Scenedesmus ovalternus y Chlorella vulgaris, inmovilizadas en esferas de alginato de calcio. (Tesis de Maestría) Bogotá: Departamento de Biología, Universidad Nacional de Colombia; 2014. p. 14-15. [ Links ]
Pinilla G. Indicadores biológicos en ecosistemas acuáticos continentales de Colombia. Bogotá: Universidad Jorge Tadeo Lozano; 2000. 67 p. [ Links ]
Reynolds C. The ecology of phytoplankton. Cambridge: Cambridge University Press; 2006. 552 p. [ Links ]
Roldán G, Ramírez J. Fundamentos de limnología neotropical. Segunda Edición. Medellín: Universidad de Antioquia; 2008. 440 p. [ Links ]
Twist H, Edwards A, Codd G. A novel in-situ biomonitor using alginate immobilised algae (Scenedesmus subspicatus) for the assessment of eutrophication in flowing surface waters. Water Resour. 1998;31(8):2066-2072. Doi: 10.1016/S0043-1354(97)00035-3. [ Links ]
Van Donk E, Abdel-Hamid Mi, Faafeng Ba, Källqvist T. Effects of Dursban 4E and its carrier on three microalgal species during exponential and P-limited growth. Aquat Toxicol. 1992;23(3-4):181-191. Doi: 10.1016/0166-445X(92)90051-N. [ Links ]
Van Donk E, Faafeng Ba, Hessen Do, Källqvist T. Use of immobilized algae for estimating bioavailable phosphorus released by zooplankton. J Plankton Res. 1993;15(7):761-769. Doi:10.1093/plankt/15.7.761. [ Links ]
Wehr JD, Sheath RG. Freshwater algae of North America. Ecology and classification. San Diego: Academic Press; 2003. 917 p. [ Links ]
Yabur R, Bashan Y, Hernández-Carmona G. Alginate from the macroalgae Sargassum sinicola as a novel source for microbial immobilization material in wastewater treatment and plant growth promotion. J Appl Phycol. 2007;19(1):43-53. Doi:10.1007/s10811-006-9109-8. [ Links ]