Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Biológica Colombiana
Print version ISSN 0120-548X
Acta biol.Colomb. vol.21 no.3 Bogotá Sept./Dec. 2016
https://doi.org/10.15446/abc.v21n3.54845
DOI: http://dx.doi.org/10.15446/abc.v21n3.54845
TOXICIDAD DEL HERBICIDA PROPANIL (PROPANIL TRUST® 500EC) EN EMBRIONES Y RENACUAJOS DE TRES ESPECIES DE ANUROS
Toxicity of the Herbicide Propanil (Propanil Trust® 500EC) to Embryos and Tadpoles of three Anuran Species
Teófila María TRIANA VELÁSQUEZ1; Liliana Marcela HENAO MUÑOZ1; Manuel Hernando BERNAL BAUTISTA1.
1Grupo de Herpetología, Eco-Fisiología y Etología, Departamento de Biología, Universidad del Tolima, Altos de Santa Helena. Ibagué, Colombia.
For correspondence. mhbernal@ut.edu.co
Received: 21st December 2015, Returned for revision: 15th January 2016, Accepted: 30th April 2016.
Associate Editor: Martha Patricia Ramírez Pinilla.
Citation/Citar este artículo como: Triana Velásquez TM, Henao Muñoz LM, Bernal Bautista MH. Toxicidad del herbicida Propanil (Propanil Trust® 500EC) en embriones y renacuajos de tres especies de anuros.Acta biol. Colomb. 2016;21(3):627-634. DOI: http://dx.doi.org/10.15446/abc.v21n3.54845
RESUMEN
El Propanil es un herbicida empleado en el control de arvenses que puede afectar organismos no blanco como los anuros. El objetivo del trabajo fue evaluar los efectos letales (concentración letal media, CL50) y subletales (retrasos en el desarrollo, longitud total y máxima distancia de natación) del Propanil (Propanil Trust® 500EC) sobre embriones y renacuajos de tres especies de anuros bajo condiciones de laboratorio y microcosmos, que incluyen algunos componentes de campo (sedimentos y material vegetal). La especie más sensible fue Rhinella humboldti (embriones: laboratorio CL50= 9,14 mg/L y microcosmos CL50= 83,92 mg/ha; renacuajos: laboratorio CL50= 5,09 mg/L y microcosmos CL50= 44,52 mg/ha), y la más resistente Hypsiboas crepitans (embriones: laboratorio CL50= 19,58 mg/L y microcosmos CL50= 179,53 mg/ha; renacuajos: laboratorio CL50= 16,54 mg/L y microcosmos CL50= 190,72 mg/ha). Engystomops pustulosus mostró una sensibilidad intermedia. En general, en laboratorio los CL50 indicaron una letalidad alta y se encontraron cambios significantes en la longitud total y la máxima distancia de natación de los organismos expuestos al Propanil, contrario a los resultados en microcosmos, aunque el tiempo de desarrollo embrionario no mostró diferencias entre tratamientos. Al comparar los CL50 se encontró que los renacuajos fueron más sensibles al herbicida que los embriones. En conclusión, el Propanil resultó tóxico para los embriones y renacuajos en condiciones de laboratorio pero tuvo un efecto menor en microcosmos. Esto demuestra que los componentes de campo de los microcosmos y la falta de renovación de las soluciones reducen la toxicidad del Propanil en los anuros de estudio.
Palabras clave: agroquímicos, anfibios, CL50, Colombia, efectos subletales.
ABSTRACT
Propanil is an herbicide used to control weeds that can affect non-target organisms such as anurans. The aim of this study was to assess the lethal (median lethal concentration, LC50) and sublethal effects (delays in development, total length and maximum swimming distance) of Propanil (Propanil Trust® 500EC) on embryos and tadpoles of three species of anurans under laboratory and microcosm conditions, which include some field components (sediments and vegetal materials). The most sensitive species was Rhinella humboldti (embryos: laboratory LC50= 9.14 mg/L and microcosm LC50= 83.92 mg/ha; tadpoles: laboratory LC50= 5.09 mg/L and microcosm LC50= 44.52 mg/ha), whereas the most resistant was Hypsiboas crepitans (embryos: laboratory LC50= 19.58 mg/L and microcosm LC50= 179.53 mg/ha; tadpoles: laboratory LC50= 16.54 mg/L and microcosm LC50= 190.72 mg/ha). Engystomops pustulosus showed an intermediate sensitivity. In general, in laboratory the LC50 indicated a high lethality and were found significant changes in the total length and maximum swimming distance of the organisms exposed to Propanil, as opposed to the microcosm results, although the time of embryonic development did not show differences between treatments. Comparing the LC50, it was established that tadpoles were more sensitive to the herbicide than embryos. In conclusion, the Propanil was toxic to embryos and tadpoles in laboratory tests but had a low effect in microcosms. This demonstrates that the field components of the microcosms and the lack of solution renewals notably decrease the toxicity of Propanil on the anurans studied.
Keywords: agrochemicals, amphibians, Colombia, LC50, sublethal effects.
INTRODUCCIÓN
Los ecosistemas acuáticos han presentado cambios desfavorables en todo el mundo a lo largo de los últimos años, en la mayoría de los casos irreversibles (Botelho et al., 2012). Dichos cambios son asociados frecuentemente con actividades antrópicas como la deforestación, la liberación de desechos industriales o domésticos, y el uso de pesticidas en zonas agrícolas, siendo este último una de las principales fuentes que contribuye al deterioro de la calidad del agua (Botelho et al., 2012). Los pesticidas, ya sean herbicidas, insecticidas o fungicidas, se usan con el propósito de proteger los cultivos agrícolas de plagas y enfermedades; sin embargo, estos pueden llegar directamente o por escorrentía a cuerpos de agua donde habitan diferentes especies de anuros generándoles afectaciones (Bridges, 2000). El Propanil (3',4'-dicloro propionanilida) es un herbicida muy utilizado en Colombia para controlar ciperáceas y malezas de hoja ancha en cultivos de arroz (Propanil Trust® 500EC, 2011). Además, es de uso post-emergente, estable a la hidrólisis, no deja acción residual y no presenta acción sistémica (Propanil Trust® 500EC, 2011). De acuerdo con el Ministerio de Protección Social de Colombia este herbicida se encuentra catalogado como ligeramente peligroso para la salud humana (categoría toxicológica III) (Propanil Trust® 500EC, 2011).
El reporte de venta de plaguicidas químicos de uso agrícola en Colombia, del Instituto Colombiano Agropecuario (ICA), menciona 47 presentaciones comerciales de Propanil como ingrediente activo (ICA, 2015), y entre estas se encuentra el Propanil Trust® 500EC, el cual es ampliamente utilizado en el país (ICA, 2015). La hoja de seguridad del producto indica que es nocivo para la salud humana al ser ingerido, causando ardor e irritación en la boca, garganta y esófago, y puede generar daño severo o la muerte al entrar a los pulmones (Propanil Trust® 500EC, 2011). Como efectos ambientales, el herbicida resulta tóxico para organismos acuáticos, aunque no se específica bajo qué condiciones ni a que organismos hace referencia. No obstante, un estudio de toxicidad del Propanil realizado en pulgas de agua (Daphnia magna Straus, 1820) muestra que el herbicida afecta negativamente el crecimiento, la supervivencia y la tasa de alimentación de la especie expuesta durante 21 días a concentraciones subletales de Propanil menores a 0,55 mg/L (Villarroel et al., 2013). Así mismo, se encontró que el agroquímico inhibe el proceso fotosintético del fitoplancton, generando el descenso de los niveles de oxígeno en el cuerpo de agua (Tucker, 1987), lo que afectaría de manera indirecta a todos los organismos acuáticos. En anuros, la toxicidad del Propanil ha sido poco estudiada, Jayawardena et al., (2010) hallaron un CL50 de 2,21 mg/L para la especie Polypedates cruciger Blyth, 1852 expuesta durante 48 horas al herbicida Propanil (3, 4 DPA®), y un 45 % de los metamorfos presentaron malformaciones. Adicionalmente, Moore et al., (1998) reportaron un CL50 de 8,17 mg/L de Propanil (Stam M-4TM) en renacuajos de Xenopus laevis (Daudin, 1802) expuestos durante 48 horas.
La mayoría de los estudios toxicológicos en anuros reportan valores de CL50 en un sólo estadío ontogénico, sin tener en cuenta que la sensibilidad de las especies puede variar a lo largo de su desarrollo (Bridges, 2000; Edginton et al., 2003; Henao et al., 2015). Es por esto que algunos trabajos han evaluado la respuesta de las especies a contaminantes considerando diferentes estadíos, tal y como el estudio de Bridges (2000), quien evaluó la toxicidad del Carbaryl en la especie Rana sphenocephala (Cope, 1886), encontrando que a mayor desarrollo la sensibilidad al pesticida aumentaba. Igualmente, Edginton et al., (2003) encontraron una sensibilidad mayor en los renacuajos (estadío 25) de las especies Rana pipiens (Schreber, 1782), R. clamitans (Latreille, 1801), Bufo americanus (Holbrook, 1836) y X. laevis, en comparación con los embriones (estadíos 8 a 10) al ser expuestos al herbicida Release® (Triclopyr) a diferentes pH. En contraste con estos resultados, Räsänen et al., (2003) reportan una mayor resistencia en larvas de R. arvalis Nilsson, 1842 expuestas a pH ácidos, al ser comparadas con estadíos embrionarios.
Teniendo en cuenta que la sensibilidad de los anuros frente a la exposición de pesticidas puede variar a lo largo del desarrollo, y considerando que no existen reportes de toxicidad del herbicida Propanil en especies colombianas, el presente estudio evalúa la letalidad y efectos subletales (retrasos en el desarrollo, longitud total y máxima distancia de natación) de este herbicida, en su presentación comercial Propanil Trust® 500EC (Nufarm Limited, Colombia), sobre los embriones y renacuajos de tres especies de anuros.
MATERIALES Y MÉTODOS
Especies de estudio
Las especies Engystomops pustulosus (Cope, 1864), Hypsiboas crepitans (Wied-Neuwied, 1824) y Rhinella humboldti (Gallardo, 1965) fueron seleccionadas para este trabajo por presentar un elevado número de huevos por postura (Guayara-Barragán y Bernal, 2012), no encontrarse en alguna categoría de amenaza para su conservación y por hallarse comúnmente asociadas a los cultivos de arroz asperjados con Propanil Trust® 500EC. Las posturas de huevos de las especies se colectaron en las horas de la mañana en dos localidades del departamento del Tolima, Colombia, E. pustulosus e H. crepitans en la vereda Potrerillo, del municipio de Coello (04°15' N, y 74°58' W), y Rhinella humboldti en el corregimiento de Payandé, municipio de San Luis (04°13' N, y 75°05' W). Luego, estas posturas fueron transportadas en contenedores plásticos al Laboratorio de Herpetología de la Universidad del Tolima, donde se mantuvieron en agua declorada, aireación continua y temperatura ambiente, hasta que los organismos alcanzaron los estadíos experimentales, embriones en estadío 10 y renacuajos en estadío 25 (Gosner, 1960).
Pruebas de toxicidad en laboratorio
En peceras de 2 litros de capacidad se depositó un litro de la solución experimental del herbicida Propanil a diferentes concentraciones: 1,8; 3,6; 7,2; 14,4 y 28,8 mg/L. El agua utilizada para preparar las soluciones fue previamente declorada por aireación. Durante 96 horas se expusieron 25 embriones y diez renacuajos, separadamente, por cada una de las concentraciones experimentales y un control negativo (agua declorada), más su respectiva réplica, para un total de 50 embriones y 20 renacuajos por tratamiento.
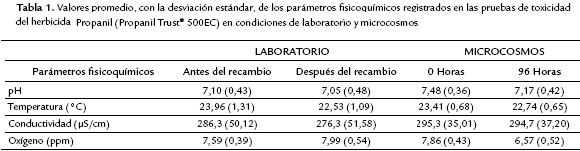
Las soluciones experimentales fueron renovadas cada 24 horas, y previo y posterior al recambio se registraron los parámetros fisicoquímicos de pH, temperatura, conductividad y oxígeno disuelto (Tabla 1). Las peceras fueron ubicadas en un estante metálico iluminado con lámparas de luz blanca (Phillips TLT 20W/54RS) conectadas a un temporizador digital que permitió mantener un fotoperiodo de 12 horas luz-12 horas oscuridad. Los experimentos se realizaron en un área del laboratorio con aire acondicionado, a una temperatura de 24 ± 2 °C.
El efecto letal del herbicida Propanil fue determinado mediante el cálculo de la concentración letal media (CL50) para cada especie, a través del método TSK Trimmed Spearman-Karber (Versión 1.5) (Hamilton et al., 1977), utilizando los datos de mortalidad acumulada a las 96 horas en cada una de las concentraciones experimentales y el control.
Pruebas de toxicidad en microcosmos
Los microcosmos son montajes experimentales diseñados para estudios ecológicos y toxicológicos que incluyen componentes de los sistemas naturales, los cuales pueden ser llevados a cabo en condiciones de laboratorio (Van Leeuwen y Vermeire, 2007; Caquet, 2013). En este estudio, los microcosmos fueron ubicados en un área ventilada e iluminada del laboratorio de Herpetología de la Universidad del Tolima y sometidos a un fotoperiodo ambiental de 12:12 horas luz-oscuridad, aproximadamente, con una temperatura promedio de 25 ± 2 °C. Para el desarrollo de estos experimentos se utilizaron recipientes plásticos circulares de 70 cm de diámetro y 13 cm de profundidad, a los que se les agregó tierra y arena en la misma proporción (total: 1000 g), y fueron cubiertos en el fondo con una tela blanca (muselina), sujetada con tres piedras (100 g cada una, aproximadamente), la cual se usó para facilitar el conteo de los organismos dentro del montaje experimental. Posteriormente, a cada recipiente se le agregó 10 litros de agua declorada, una macrófita y dos hojas secas. Por cada microcosmos se expusieron 50 embriones y 25 renacuajos, independientemente, más su réplica, para un total de 100 embriones y 50 renacuajos por concentración y grupo control. Luego los montajes fueron asperjados una única vez en el centro del recipiente a 50 cm de altura con 150 mL de Propanil a través de una bomba de aspersión manual (Jardinera Lhaura 1,5 L Ref. 10505), a cinco concentraciones del herbicida: 18; 36; 72; 144 y 288 mg/ha. Al igual que en los experimentos en condiciones de laboratorio se contó con un control negativo (agua declorada) y la exposición tuvo una duración de 96 horas, aunque bajo condiciones estáticas, sin recambio de las soluciones.
En los microcosmos se registraron cada 24 horas los parámetros fisicoquímicos de pH, temperatura, conductividad y oxígeno disuelto. En la Tabla 1 se muestran los valores de estos parámetros fisicoquímicos a las 0 y 96 horas. Al concluir la exposición se utilizó la mortalidad acumulada en cada una de las concentraciones para estimar la CL50 mediante el método TSK.
Efectos subletales
Finalizada la exposición se tomaron entre 15 y 20 organismos sobrevivientes del control y concentraciones experimentales inferiores al valor CL50 para determinar la incidencia del Propanil en: 1) el desarrollo embrionario, 2) la longitud total de las larvas (obtenidas de los embriones), 3) la longitud total de los renacuajos, y 4) la máxima distancia de natación de los renacuajos. Para el caso del desarrollo embrionario, se registró el estadío alcanzado por los embriones expuestos durante las 96 horas, los cuales se compararon de manera cualitativa ya que en general fueron similares dentro de cada tratamiento por especie. Para la medición de la longitud total, los organismos sobrevivientes fueron fotografiados sobre un papel milimetrado y mediante el programa ImageJ se midió la distancia desde la punta del hocico hasta el final de la cola. Estos datos se compararon entre los tratamientos, incluido el control, mediante análisis de varianza factoriales (Anova: concentraciones x especies) y posteriores pruebas de Tukey. Adicionalmente, los renacuajos sobrevivientes tanto del control como de la concentración menor del herbicida fueron sometidos a una prueba de natación en el laboratorio, medida a través de la máxima distancia alcanzada. Esta prueba consistió en estimular con un pincel la parte posterior de la cola de un renacuajo para obligarlo a desplazarse a través de una pista de 50 cm de longitud x 1 cm de ancho x 1 cm de alto, que contenía agua (utilizada en el control) a una temperatura de 24 ± 1 °C. Siguiendo lo propuesto por Fitzpatrick et al., (2003) y Walker et al., (2005), por cada renacuajo se realizaron tres registros, de los cuales se escogió la máxima distancia recorrida (en centímetros) para hacer las comparaciones estadísticas a través de Análisis de covarianza factoriales (Ancova: concentraciones x especies), en donde se incluyó la longitud total como co-variable. En todos los análisis realizados el factor especie siempre presentó diferencias significativas (p < 0,05), debido a las características propias de crecimiento y desarrollo de cada especie; sin embargo, estos resultados no se discuten ya que no hacen parte del propósito de este estudio. Todos los análisis estadísticos se llevaron a cabo en el programa InfoStat (Di Rienzo et al., 2015).
El presente trabajo contó con la aprobación del Comité de Bioética de la Universidad del Tolima (Acta número 5 de 2015).
RESULTADOS
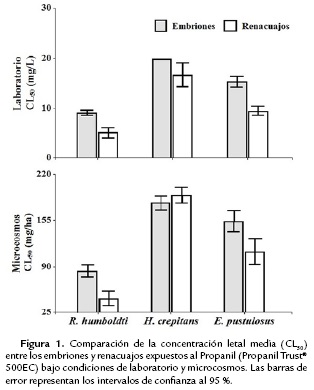
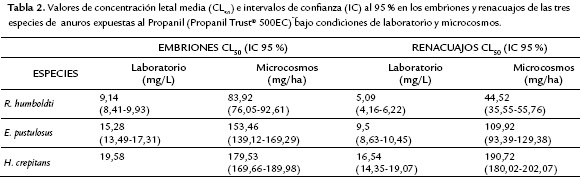
Los valores de CL50 para los dos estadíos experimentales muestran que R. humboldti fue la especie más sensible a la aplicación del herbicida Propanil (embriones: laboratorio CL50 = 9,14 mg/L y microcosmos CL50 = 83,92 mg/ha; renacuajos: laboratorio CL50 = 5,09 mg/L y microcosmos CL50 = 44,52 mg/ha), mientras que H. crepitans fue la más tolerante (embriones: laboratorio CL50 = 19,58 mg/L y microcosmos CL50 = 179,53 mg/ha; renacuajos: laboratorio CL50 = 16,54 mg/L y microcosmos CL50 = 190,72 mg/ha). Por su parte, los embriones y renacuajos de E. pustulosus mostraron una sensibilidad intermedia a la exposición del herbicida (Tabla 2). Al comparar los intervalos de confianza de los CL50 entre los dos estadíos evaluados, se encontró que los embriones resultaron significantemente más tolerantes que los renacuajos en condiciones de laboratorio y microcosmos (Fig. 1).
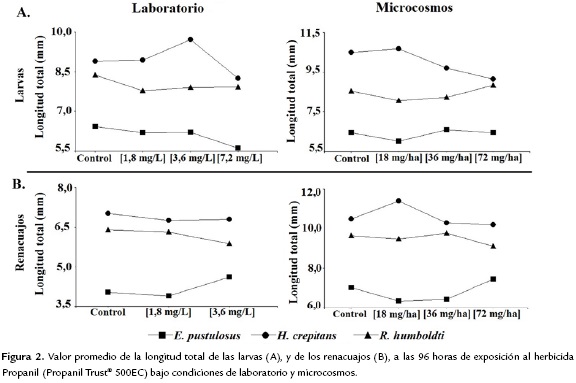
El herbicida Propanil no generó retrasos en el desarrollo de los organismos expuestos desde embriones en ninguna de las especies, ni en laboratorio ni en microcosmos. Sin embargo, las larvas obtenidas de los embriones (estadío 10) expuestos al herbicida mostraron diferencias significativas en su longitud total (laboratorio: Anova, F = 11,93, p < 0,0001; microcosmos: Anova, F = 2,88, p = 0,037) (Fig. 2A). En general, la longitud total fue significativamente menor a la concentración experimental más alta (laboratorio: Tukey, p < 0,05; microcosmos: Tukey, p < 0,05).
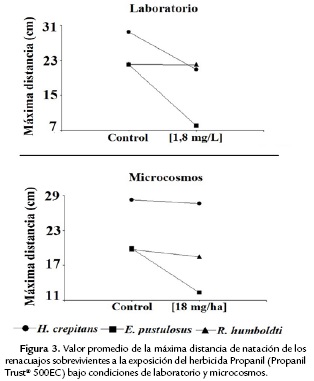
Los renacuajos expuestos al Propanil presentaron diferencias significativas en la longitud total (Anova, F = 7,19, p = 0,001) y la máxima distancia de natación (Ancova, F = 10,89, p = 0,001) sólo bajo las condiciones de laboratorio. En la mayoría de los casos, los individuos del tratamiento control fueron significativamente más grandes (Tukey, p < 0,05) (Fig. 2B) y realizaron los mayores desplazamientos en la pista de agua (Fig. 3).
DISCUSIÓN
Los herbicidas tienen como propósito el control y eliminación de arvenses en los cultivos a través de la interrupción de su vía fotosintética, por lo que no deberían tener algún efecto en individuos sin fotosíntesis (Jayawardena et al., 2010). No obstante, numerosas investigaciones indican que estos agroquímicos pueden provocar consecuencias directas e indirectas en la supervivencia de organismos no blanco asociados a la agricultura, como los anfibios (Bridges, 2000; Greulich y Pflugmacher, 2003; Lajmanovich et al., 2003; Bernal et al., 2009a, b; Jayawardena et al., 2010; Egea et al., 2012; Reylea, 2012; Henao et al., 2015a; Henao et al., 2015b). De acuerdo con nuestros resultados, la exposición al herbicida Propanil en embriones y renacuajos de anuros resultó letal en las pruebas de laboratorio, ya que para todos los casos los valores CL50 fueron inferiores a la concentración usada en campo (8400 mg/L), lo que concuerda con Moore et al., (1998), Jayawardena et al., (2010), y Jayawardena et al., (2011), quienes reportaron que el herbicida Propanil fue tóxico bajo condiciones de laboratorio en renacuajos de X. laevis, P. cruciger y B. melanostictus. Sin embargo, en condiciones de microcosmos los valores de letalidad (Tabla 2) fueron superiores a la concentración de aplicación del herbicida (51,07 mg/ha), a excepción de los renacuajos de la especie R. humboldti, los cuales presentaron un CL50 menor (44,52 mg/ha). La menor toxicidad encontrada en los microcosmos con respecto a las pruebas de laboratorio puede estar relacionada con una fotodegradación del ingrediente activo después de 48 horas de la aplicación (Carvalho et al., 2010), y por la presencia de los sedimentos y material vegetal de los microcosmos (Van Leeuwen y Vermeire, 2007), que podrían disminuir la toxicidad del Propanil a lo largo de las 96 horas de exposición estática, contrario a las pruebas de laboratorio en donde se realizaron recambios diarios de las soluciones.
En este trabajo se encontró que los renacuajos fueron más sensibles al herbicida que los embriones. Este resultado coincide con Henao et al., (2015a), quienes hallaron una mayor tolerancia en los embriones en comparación con los renacuajos de H. crepitans, R. humboldti y E. pustulosus a la mezcla del herbicida glifosato (Roundup® Activo) con el Cosmo-Flux®411F en condiciones de laboratorio. Una mayor resistencia en estadíos embrionarios ha sido reportada por varios autores en diferentes pesticidas (Bridges, 2000; Bridges y Semlitsch, 2000; Greulich y Pflugmacher, 2003; Edginton et al., 2004; Ortiz-Santaliestra et al., 2006; Egea et al., 2012), los cuales atribuyen la menor toxicidad a la matriz gelatinosa de los embriones que los protege durante las primeras horas de experimentación. Caso contrario sucede con los renacuajos, quienes presentan estructuras sensibles a los contaminantes, como las branquias o el sistema nervioso (Ortiz-Santaliestra et al., 2006).
Con respecto a los efectos subletales evaluados, no se encontraron cambios significantes en el tiempo de desarrollo de los embriones expuestos al herbicida Propanil en comparación con el control; sin embargo, Jayawardena et al., (2010) reportaron retrasos en el desarrollo de los renacuajos de P. cruciger sometidos al Propanil (3, 4 DPA®) en condiciones de laboratorio. De otra parte, las alteraciones en la longitud total de las larvas bajo condiciones de laboratorio y microcosmos, así como en los renacuajos sobrevivientes de las pruebas de laboratorio, concuerdan con lo reportado por Jayawardena et al., (2010), quienes encontraron una reducción significativa en el tamaño corporal de renacuajos de P. cruciger expuestos al 3, 4 DPA®. Finalmente, la disminución en la distancia recorrida por los renacuajos bajo condiciones de laboratorio podría relacionarse con la acción del pesticida sobre las funciones del sistema nervioso (Salazar et al., 2008) y consecuentemente sobre su actividad motora. Estos efectos del Propanil sobre la capacidad de desplazamiento son importantes porque pueden afectar aspectos vitales de los renacuajos como la evasión de depredadores y la competencia por recursos (Kats et al., 2002), incidiendo directamente en la supervivencia y el mantenimiento de sus poblaciones. Sin embargo, este resultado no se observó en condiciones de microcosmos, posiblemente debido a la degradación del ingrediente activo del herbicida por la falta de renovación de las soluciones experimentales, lo que pudo disminuir su concentración y acción sobre el desempeño natatorio de los renacuajos.
CONCLUSIONES
La exposición al herbicida Propanil resultó tóxica para los embriones y renacuajos de las especies de estudio en las pruebas de laboratorio, pero tuvo un efecto menor en los microcosmos. Así, estos resultados indican que la toxicidad del Propanil se reduce notablemente en estos anuros cuando los experimentos se realizan bajo un escenario que simula algunas de las condiciones de campo, como la presencia de sedimentos, material vegetal, y donde la aplicación del agroquímico no es continua.
AGRADECIMIENTOS
Los autores agradecen al programa Jóvenes Investigadores e Innovadores de Colciencias por la beca pasantía otorgada a Teófila María Triana y Liliana Marcela Henao durante la cual se realizó la presente investigación. Este trabajo fue financiado por el Fondo de Investigaciones de la Universidad del Tolima a través del proyecto con código 420113.
REFERENCIAS
Bernal MH, Solomon KR, Carrasquilla G. Toxicity of formulated glyphosate (Glyphos) and Cosmo-Flux to larval Colombian frogs 1. Laboratory acute toxicity. J Toxicol Environ Health A. 2009a;72(15-16):961-965. Doi: 10.1080/15287390902929709. [ Links ]
Bernal MH, Solomon KR, Carrasquilla G. Toxicity of formulated glyphosate (Glyphos) and Cosmo-Flux to larval and juvenile Colombian frogs 2. Field and laboratory microcosm acute toxicity. J Toxicol Environ Health A. 2009b;72(15-16):966-973. Doi: 10.1080/15287390902929717. [ Links ]
Botelho RG, Cury JP, Dos Santos JB, Tornisielo VL. Herbicides and the Aquatic Environment. In: Hasaneen MN, editor. Herbicides-Properties, Synthesis and Control of Weeds. Rijeka: INTECH Open Access Publisher. [Internet]. 2012. [Consulted 15 June 2015]. Available from: http://www.intechopen.com/books/herbicides-properties-synthesis-and-control-of-weeds/herbicides-and-the-aquatic-environment. [ Links ]
Bridges CM. Long-term effects of pesticide exposure at various life stages of the southern leopard frog (Rana sphenocephala). Arch Environ Contam Toxicol. 2000;39(1):91-96. Doi: 10.1007/s002440010084. [ Links ]
Bridges CM, Semlitsch RD. Variation in pesticide tolerance of tadpoles among and within species of Ranidae and patterns of amphibian decline. Conserv Biol. 2000;14(5):1490-1499. [ Links ]
Caquet T. Aquatic Mesocosms in Ecotoxicology. In: Férard J, Blaise C, editors. Encyclopedia of Aquatic Ecotoxicology. Dordrecht: Springer Netherlands; 2013. p. 99-108. [ Links ]
Carvalho G, Marques R, Lopes AR, Faria C, Noronha JP, Oehmen A, et al. Biological treatment of Propanil and 3, 4-dichloroaniline: kinetic and microbiological characterization. Water Res. 2010;44(17):4980-4991. Doi: 10.1016/j.watres.2010.08.006. [ Links ]
Di Rienzo JA, Casanoves F, Balzarini MG, Gonzalez L, Tablada M, Robledo CW. InfoStat versión 2015. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. Available from: http://www.infostat.com.ar. [ Links ]
Edginton AN, Stephenson GR, Sheridan PM, Thompson DG, Boermans HJ. Effect of pH and Release® on two life stages of four anuran amphibians. Environ Toxicol Chem. 2003;22(11):2673-2678. [ Links ]
Edginton A, Sheridan P, Stephenson G, Thompson D, Boermans H. Comparative effects of pH and Vision herbicide on two life stages of four anuran amphibian species. Environ Toxicol Chem. 2004;23:815-822. Doi: 10.1897/03-115. [ Links ]
Egea‐Serrano A, Relyea RA, Tejedo M, Torralva M. Understanding of the impact of chemicals on amphibians: A meta‐analytic review. Ecol Evol. 2012;2(7):1382-1397. Doi: 10.1002/ece3.249. [ Links ]
Fitzpatrick BM, Benard MF, Fordyce JA. Morphology and escape performance of tiger salamander larvae (Ambystoma tigrinum mavortium). J Exp Zool Part A Comp Exp Biol. 2003;297A:147-159. Doi: 10.1002/jez.a.10254. [ Links ]
Gosner KL. A simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica. 1960;16:183-190. [ Links ]
Greulich K, Pflugmacher S. Differences in susceptibility of various life stages of amphibians to pesticide exposure. Aquat Toxicol. 2003;65(3):329-336. Doi: 10.1016/S0166-445X(03)00153-X. [ Links ]
Guayara-Barragán MG, Bernal MH. Fecundidad y fertilidad en once especies de anuros colombianos con diferentes modos reproductivos. Caldasia. 2012;34(2):483-496. [ Links ]
Hamilton MA, Russo RC, Thurston RV. Trimmed Spearman-Karber method for estimating median lethal concentrations in toxicity bioassays. Environ Sci Technol. 1977;11(7):714-719. [ Links ]
Henao LM, Montes CM, Bernal MH. Acute toxicity and sublethal effects of the mixture glyphosate (Roundup® Active) and Cosmo-Flux® 411F to anuran embryos and tadpoles of four Colombian species. Rev Biol Trop. 2015a;63(1):223-233. Doi: 10.15517/rbt.v63i1.12893. [ Links ]
Henao LM, Triana TM, Bernal MH. Evaluación de la toxicidad de dos agroquímicos, Roundup® Activo y Cosmo-Flux® 411F, en renacuajos de anuros colombianos. Acta biol Colomb. 2015b;20(2):153-161. Doi: 10.15446/abc.v20n2.43492. [ Links ]
ICA. Registros de venta de plaguicidas químicos de uso agrícola. [Internet]. 2015. [Consulted 15 June 2015]. Available from: http://www.ica.gov.co/getdoc/2dae6093-c021-49d1-8b29-c9dfebce2757/REGISTROS-DE-VENTA-PQA-24-01-09.aspx. [ Links ]
Jayawardena UA, Rajakaruna RS, Navaratne AN, Amerasinghe PH. Toxicity of agrochemicals to common hourglass tree frog (Polypedates cruciger) in acute and chronic exposure. Int J Agric Biol. 2010;12:641-648. [ Links ]
Jayawardena UA, Navaratne AN, Amerasinghe PH, Rajakaruna RS. Acute and chronic toxicity of four commonly used agricultural pesticides on the Asian common toad, Bufo melanostictus Schneider. J Natl Sci Found. 2011;39(3):267-276. [ Links ]
Kats LB, Kiesecker JM, Chivers DP, Blaustein AR. Effects of UV‐B Radiation on Anti‐Predator Behavior in Amphibians: Reply to Cummins. Ethology. 2002;108(7):649-654. Doi: 10.1046/j.1439-0310.2002.00810.x. [ Links ]
Lajmanovich R, Lorenzatti E, Maitre MI, Enrique S, Peltzer P. Comparative acute toxicity of the commercial herbicides glyphosate to neotropical tadpoles Scinax nasicus (Anura: Hylidae). Fresen Environ Bull. 2003;12(4):364-367. [ Links ]
Moore MT, Pierce JR, Milam CD, Farris JL, Winchester EL. Responses of non-target aquatic organisms to aqueous Propanil exposure. Bull Environ Contam Toxicol. 1998;61(2):169-174. [ Links ]
Ortiz‐Santaliestra ME, Marco A, Fernández MJ, Lizana M. Influence of developmental stage on sensitivity to ammonium nitrate of aquatic stages of amphibians. Environ Toxicol Chem. 2006;25(1):105-111. Doi: 10.1897/05-023R.1. [ Links ]
PROPANIL TRUST ® 500 EC. Hoja de Datos de Seguridad de Materiales HDSM. [Internet]. 2015. [Consulted 15 June 2015]. Available from: http://www.nufarm.com/Assets/17185/1/PROPANILTRUST500EC.pdf. [ Links ]
Räsänen KR, Laurila A, Merilä J. Geographic variation in acid stress tolerance of the moor frog, Rana arvalis. II. Adaptive maternal effects. Evolution. 2003;57(2):363-371. Doi: 10.1554/0014-3820(2003)057[0363:GVIAST]2.0.CO;2. [ Links ]
Relyea RA. New effects of Roundup on amphibians: Predators reduce herbicide mortality; herbicides induce antipredator morphology. Ecol Appl. 2012;22(2):634-647. Doi: 10.1890/11-0189.1 [ Links ]
Salazar KD, Ustyugova IV, Brundage KM, Barnett JB, Schafer R. A review of the immunotoxicity of the pesticide 3, 4-dichloropropionanalide. J Toxicol Environ Health B. 2008;11(8):630-645. Doi: 10.1080/10937400701724386. [ Links ]
Tucker CS. Short-term effects of Propanil on oxygen production by plankton communities from catfish ponds. Bull Environ Contam Toxicol. 1987;39:245-250. [ Links ]
Van Leeuwen CJ, Vermeire TG. Risk assessment of chemicals: An introduction. 2 ed. Dordrecht: Springer; 2007. p. 311. [ Links ]
Villarroel MJ, Sancho E, Andreu-Moliner E, Ferrando MD. Caloric content of Daphnia magna as reflect of Propanil stress during a short-term exposure and its relationship to long-term responses. Environ Toxicol Phar. 2013;35:465-472. Doi: 10.1016/j.etap.2013.02.012. [ Links ]
Walker JA, Ghalambor CK, Griset OL, McKenney D, Reznick DN. Do faster starts increase the probability of evading predators?. Funct Ecol. 2005;19:808-815. Doi: 10.1111/j.1365-2435.2005.01033. [ Links ]