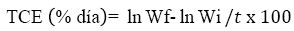INTRODUCCIÓN
La acuicultura es una actividad productiva con un crecimiento considerable en Colombia y el mundo, sin embargo enfrenta limitaciones tecnológicas y de bioseguridad que ponen en peligro su sostenibilidad (FAO, 2014). La incidencia de bacterias patógenas como Streptococcus agalactiae, Francisella sp. (Assis et al., 2016), Streptococcus iniae (Baiano y Barnes, 2009), Aeromonas salmonicida (Dallaire-Dufresne etal., 2014), Aeromonas hydrophila, virus y parásitos causa mortalidades en tilapia cultivada en todo el mundo, generando pérdidas económicas importantes.
Para combatir las infecciones en el cultivo de tilapia el uso indiscriminado de antibióticos de amplio espectro fue común hasta hace pocos años, ya que lograban controlar las enfermedades al interferir en funciones vitales de las bacterias, como síntesis de la pared, replicación de ADN y síntesis de proteínas. Sin embargo, su inclusión habitual en las granjas desencadenó problemas como la aparición de cepas bacterianas multiresistentes, cambios en la microbiota propia del medio, e incluso efectos en la salud de los animales cultivados y de los consumidores finales (Montalban-Arques et al., 2015; Chuah et al., 2016).
Como alternativa, el uso de probióticos se ha integrado en los protocolos de cultivo en diversas granjas piscícolas ya que limita el tratamiento con antibióticos e incrementa la productividad gracias a diversos mecanismos de acción como son el fortalecimiento de sistema inmunológico de los peces, actividad antibacteriana por producción de compuestos inhibitorios, competencia por espacio y nutrientes, entre otros (Villamil y Novoa, 2009). A pesar de los numerosos trabajos publicados recientemente sobre el tema, una gran parte de probióticos comerciales contienen bacterias acido lácticas de origen terrestre, que si bien tienen el estatus GRAS "Generally Recognized as Safe" presentan limitaciones para colonizar y establecerse en la microbiota de los peces y en el sistema de cultivo, así como restricciones en cuanto a su espectro de acción antimicrobiana, pues generalmente solo son efectivas contra bacterias Gram positivas (Hai, 2015). Por este motivo, el presente estudio propone analizar la idoneidad del uso de bacterias aisladas del intestino de tilapias cultivadas y estudiar distintas actividades in vitro e in vivo. Específicamente se analizará el potencial probiótico de los aislados l9, l15, l19 de los géneros Enterococcus, Exigobacterium y Myroides, respectivamente.
MATERIALES Y MÉTODOS
Aislamiento de bacterias asociadas a tilapia
Se usaron juveniles de tilapia (Oreochromis niloticus) sanos, obtenidos del SENA agropecuario de Gaira, Magdalena. Los peces se aclimataron a 26 °C en acuarios de 20 L, con aireación continua, con 12 horas de luz y oscuridad y recambio diario de agua del 75 %.
Después de un día sin alimentación, los peces se sacrificaron siguiendo los principios de bioética de Russel y Burch (1959) y en condiciones de esterilidad se obtuvieron muestras de macerados de intestino. Las muestras se sembraron en distintas diluciones (10-2, 10-3, 10-4, 10-5, 10-6, 10-7) en agar tripticasa soya (TSA, Becton and Dickinson, USA) a temperatura ambiente durante 48 a 72 horas. Se procedió al aislamiento de las colonias y su posterior almacenamiento en el medio correspondiente con 25 % de glicerol para su conservación a -80 °C.
Evaluación de actividad antimicrobiana de los productos extracelulares
Los productos extracelulares (ECPs) se obtuvieron según Cabo et al. (1999), para ello cada bacteria se sembró en 10 mL de caldo tripticasa soya (TSB) durante 24 horas a 30 °C. Después de la incubación el pH se ajustó a 3,5 con HCL 2 N, se calentó a 80 °C por tres minutos y se centrifugó a 500 g por 30 minutos, posteriormente se filtró a 0,45 µm, se ajustó a pH 6,0 y se almacenaron en alícuotas a -80 °C.
En placa estéril de 96 pocillos (Corning, Sigma-Aldrich, USA) se agregaron por triplicado 50 µL de los ECPs obtenidos de los aislados l9, l15, l19 y 50 µL de las bacterias patógenas, a 106 UFC / mL. La placa se incubó 24 horas a 30 °C y se midió la absorbancia cada 12 h a 600 nm y los valores de absorbancia se expresaron como porcentaje de inhibición.
Inhibición del Quorum Sensing
Se llevó a cabo según metodología propuesta previamente (Villamil et al., 2014). Brevemente, se realizó siembra masiva de Chromobacterium violaceum en agar CASO (Sigma-Aldrich, USA) y se impregnaron discos de papel filtro estériles con los ECPs de las bacterias seleccionadas. Se incubó a 30 °C por 24 horas y registraron las medidas de los halos de inhibición de producción de pigmento (violaceína) según la técnica de disco de difusión. El resultado se expresó en milímetros y se consideró como positivo para la disrupción del QS.
Adherencia bacteriana a mucus intestinal
Se emplearon adultos de tilapia (O. niloticus) sanos, mantenidos en las mismas condiciones mencionadas antes. Se llevó a cabo la extracción de mucus intestinal de tres peces adultos según metodología propuesta previamente (Vine et al., 2004), con algunas modificaciones; en condiciones asépticas se obtuvo el mucus intestinal, se resuspendió en solución NSS (NaCl, 17,6 g; Na2SO4, 1,47 g; NaHCO3, 0,08 g; KCl, 0,25 g; KBr, 0.04; MgCl.6H2O, 1,87 g; CaCl2. H2O, 0,41g; SrCl2.6H2O, 0,008 g; H3BO3, 0,008 g en 1000ml de agua destilada), se centrifugó dos veces a 8000 g por 15 minutos para eliminar la materia particulada y el sobrenadante se filtró a 0,22 µm, se ajustó a 0,25 mg / mL de proteína por el método de Bradford.
Se inmovilizaron 300 µL del sobrenadante filtrado de mucus intestinal de tilapia en un portaobjetos y dejó secar 12 horas, posteriormente se fijó la placa con metanol por 20 minutos. Aparte se preparó una suspensión de la bacteria a una concentración de 108 cel / mL y se añadieron 200 µL de la suspensión bacteriana sobre el portaobjetos con el mucus intestinal previamente fijado. Se incubó a 20 °C por dos horas con agitación suave, se lavó, y fijó en metanol por 20 minutos y se tiñó con cristal violeta para recuento al microscopio de las células bacterianas adheridas. Este procedimiento fue realizado por triplicado.
Cinética de crecimiento bacteriano
Se siguió la metodología Zamora et al. (2003), que consistió en cultivar por separado cada aislado bacteriano y el patógeno en medio TSB. Posteriormente, se sembraron por triplicado 100 mL de cada suspensión bacteriana en una microplaca de 96 pocillos, ajustada a una absorbancia aproximada de 0,05 (600 nm) con el fin de realizar un análisis espectrofotométrico (Modulus Microplate Reader, Turner) a 600 nm cada 12 horas durante tres días. A partir de los datos de absorbancia se construyó una curva de crecimiento que estima la concentración de microorganismos. Se estudió la cinética de crecimiento de I9, l15, l19 y E. tarda como control.
Para determinar las características del crecimiento de las bacterias se tuvo en cuenta la velocidad específica de crecimiento (pendiente de la recta que se obtiene de la representación gráfica del logaritmo neperiano de los valores de absorbancia final menos inicial en función del tiempo en fase de crecimiento exponencial).
Identificación bacteriana
Se realizó la caracterización morfológica y bioquímica de cada aislado previamente seleccionado de acuerdo con las características morfológicas y bioquímicas y la identificación molecular mediante la extracción de ADN de las bacterias seleccionadas (QIAamp DNA Mini Kit, Qiagen, USA).
Para la amplificación de los genes se usaron los iniciadores y condiciones de amplificación descritas previamente (Chakravorty et al., 2007). Las secuencias obtenidas se analizaron mediante Blast en la base de datos de GenBank del NCBI (National Library of Medicine, National Center for Biotechnology Information, 1982) y del Ribosomal Database Project (Cole et al., 2014). Para la asignación de género y especie se siguieron las recomendaciones para el empleo de genes 16S en la identificación bacteriana. Como son: mínimo de 500-550 bases secuenciadas con un porcentaje de ambigüedad menor al 1 %, para la identificación especies se usó el criterio de mínimo 99 % ideal 99,5 % de similaridad a la cepa de referencia.
Preparación del alimento para ensayos in vivo
Los aislados seleccionados se incubaron en TSB 24 horas a 30 °C, se tomaron inóculos y se lavaron en tampón PBS estéril, se ajustó a 106 UFC / mL y se verificó por posterior recuento en placa en agar TSA.
Se utilizó alimento comercial para tilapias con 24 % de proteína y se mezcló la dilución de la bacteria correspondiente hasta que quedara húmedo de manera homogénea. Posteriormente se dejó secar y se refrigeró a 4 °C por un periodo máximo de cuatro días. Al alimento para el grupo control se le agregó el buffer PBS estéril en el mismo volumen de los demás tratamientos.
Evaluación del crecimiento de tilapia
Se usaron tilapias (O. niloticus) sanas de 0,2 a 2 g, obtenidas del SENA agropecuario de Gaira, Magdalena. Los peces se aclimataron a 26 °C y se alimentaron con pienso comercial ad libitum; para luego ser distribuidos en acuarios de 20 L, a la misma temperatura con aireación continua y recambio diario del 25 % de agua.
Para evaluar el efecto de los aislados de bacterias nativas (aislados l9, l15, l19), se contó con tres tratamientos correspondientes a cada aislado bacteriano, cada uno con cuatro réplicas independientes (n = 15 peces sanos). Se administró el alimento correspondiente a cada tratamiento (106 UFC / g) y control, tres veces al día en raciones que suman el 5 % de su peso corporal, hasta completar cuatro semanas. Se tomaron longitud total y peso en los días uno y 30 del experimento, para su posterior análisis estadístico. Cada tratamiento y el control se efectuaron por triplicado.
Evaluación del efecto de los aislados seleccionados durante una infección experimental con E. tarda
Después de 15 días de suplementación en el alimento con los aislados nativos l9, l15, l19 usando el mismo protocolo indicado en el punto anterior de la metodología , se efectuó un desafío experimental mediante inyección intraperitoneal con la bacteria patógena E. tarda 100 μL (105 UFC / mL) y se empleó PBS para los controles. Se estimó la sobrevivencia en cada uno de los grupos teniendo en cuenta el n de los peces al iniciar el periodo de infección. E. tarda fue aislada nuevamente de los organismos que murieron para confirmar el agente etiológico de acuerdo con los postulados de Koch (Evans, 1976). Cada tratamiento fue evaluado por triplicado.
Tratamiento de datos
Se realizaron cálculos de incremento en peso mediante la determinación de la tasa de crecimiento específica, TCE según Martin et al. (2013).
Wi: Peso promedio inicial, Wf: Peso promedio final, t: tiempo de tratamiento.
Para los tratamientos mencionados anteriormente, se realizó un análisis exploratorio de los datos, involucrando medidas de tendencia central (Orozco-Medina et al., 2002) y medidas de variabilidad de tipo inferencial (error estándar) (Cumming et al., 2007). Adicionalmente después de comprobar la normalidad (Curtosis) y homogeneidad (Test Bartlet) de los datos, se realizaron análisis de varianza (ANOVA) para la adherencia a mucus intestinal, TCE y la sobrevivencia, tanto en el periodo de tratamiento con alimento suplementado, así como para el ensayo de la infección. Se utilizó el programa Statgraphics Plus 5.0.
Consideraciones éticas
Todos los experimentos con peces se realizaron teniendo en cuenta las normas para la investigación en animales contenidas en la Ley 84 (Congreso Nacional de Colombia, 1989). El manejo y cultivo de los aislados bacterianos se llevó a cabo conforme al manual de Seguridad de Laboratorio de la Universidad. No se requirió un permiso de ICA, ya que tilapia es un recurso de pesca y acuicultura en Colombia y los experimentos planteados fueron realizados en laboratorio a pequeña escala.
RESULTADOS
Evaluación de actividad antimicrobiana e inhibición de QS de los productos extracelulares
Se aislaron un total de 120 morfotipos bacterianos, de los cuales el 30 % aproximadamente tuvieron actividad antibacteriana contra alguna de las bacterias patógenas estudiadas. Se seleccionaron tres morfotipos bacterianos aislados de intestino que presentaron mayor actividad antibacteriana, contra E. tarda y S. agalactiae: l9 inhibió 24,5 y 31 % respectivamente, l15 18 % en ambos casos y el aislado l19 inhibió 21.4 y 22 % respectivamente.
Las pruebas de inhibición de quorum sensing (QS), indicaron que los aislados l9 e l19 tienen capacidad para limitar la producción de violaceína de la bacteria indicadora, C. violaceum y generaron halos de inhibición de producción de pigmentos de 6,5 y 7,5 mm respectivamente.
Adherencia bacteriana a mucus intestinal
Se observó una diferencia significativa (p<0,001) en la capacidad de adherencia al mucus intestinal. Los aislados l15, l19 tienen una capacidad de adherencia superior al aislado I9 y a la bacteria usada como referencia, E. tarda (Fig. 1).
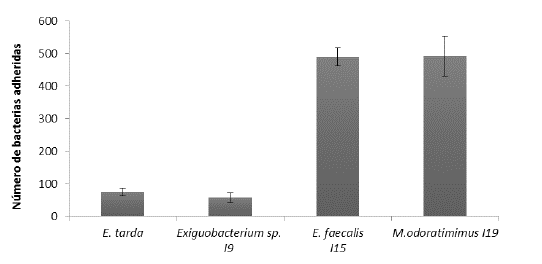
Figura 1 Comparación de la adherencia bacteriana de posibles probióticos y patógeno E. tarda, a mucus intestinal de tilapia nilótica expresada como el número de bacterias adheridas al mucus intestinal por recuento con tinción con cristal violeta, comparación entre los tres aislados con potencial probiótico I9 Exiguobacterium sp., l15 Enterococcus faecalis, l19 Myroides odoratimimus. y E. tarda + E.S. n=3. Existen diferencias significativas entre tratamientos (p < 0,001).
Cinética de crecimiento
Se observó diferencia en la curva de crecimiento de los aislados estudiados; a las 24 horas el aislado I9 presentó el crecimiento más rápido en comparación con los aislados l15, l19 y similar a E. tarda. A partir de las 36 horas el crecimiento de l9 se estabilizó, mientras que el de E. tarda aumentó significativamente, seguido de l15, por su parte el de l19 se mantuvo muy bajo durante todo el tiempo de estudio (Fig. 2). La velocidad específica de crecimiento para E. tarda fue 1,906; para I9 0,84; para l15 1,81 y para l19 0,11.

Figura 2 Cinética de crecimiento bacteriana expresada como la densidad óptica (O.D a 600 nm) de aislados bacterianos con potencial probiótico I9 Exiguobacterium sp., l15 Enterococcus faecalis, l19 Myroides odoratimimus y el patógeno E. tarda a diferentes horas de incubación. Datos presentados como la media + SD. n=3.
Identificación
Se encontró una homología de 100 %, en el caso de los aislados l15, identificado como Enterococcus faecalis, y el aislado l19 identificado como Myroides odoratimimus. El aislado I9, solo pudo ser identificado a nivel de género como Exiguobacterium sp.
Evaluación del crecimiento de tilapia
El tratamiento con los aislados seleccionados causó un incremento en la tasa de crecimiento específico de los peces superior al control sin probióticos. A pesar de no encontrar diferencias estadísticas entre tratamientos, los mejores resultados se observaron con el suplemento en el alimento con el aislado l15 E. faecalis (Fig. 3).
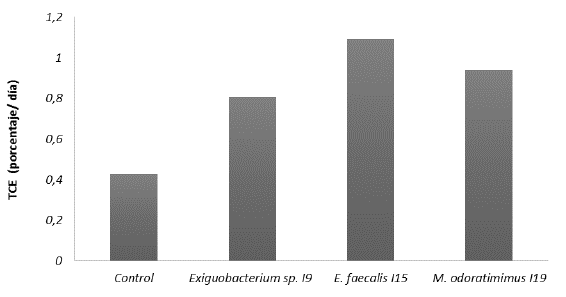
Figura 3 Tasa de Crecimiento Específico de tilapia nilótica, (TCE porcentaje/día) con alimento suplementado con aislados con potencial probiótico I9 Exiguobacterium sp., l15 Enterococcus faecalis, l19 Myroides odoratimimus a 106 UFC / g y control durante cuatro semanas. TCE (% día) - In Wf- ln Wi /t x 100. W : Peso promedio inicial, Wf: Peso promedio final, t: tiempo de tratamiento. n=4. No se encontraron diferencias significativas entre tratamientos (p = 0,12).
Evaluación del efecto de los aislados seleccionados durante una infección experimental con E. tarda
Los peces infectados experimentalmente que no consumieron el alimento suplementado con los aislados seleccionados como potencial probiótico (I9, l15, l19) o tratamiento control tuvieron una supervivencia promedio de 55,7 %; mientras que los tratamientos con suplemento probiótico superaron la supervivencia del 70 % (Fig. 4).

Figura 4 Supervivencia de tilapia nilótica durante una infección experimental con E. tarda, después de 15 días de alimentación con los aislados con potencial probiótico I9 Exiguobacterium sp., l15 Enterococcus faecalis, l19 Myroides odoratimimus a 106 UFC / g y control. Promedio de supervivencia + S.D. n=3. No se encontraron diferencias estadísticamente significativas entre tratamientos (p = 0,142).
DISCUSIÓN
Los aislados bacterianos de tilapia evaluados en este estudio presentaron actividades in vitro y efectos in vivo que permiten su postulación como posibles probióticos para el cultivo de tilapia, con algunas consideraciones que se expondrán.
Exiguobacterium sp. (l9)
En el caso de Exiguobacterium sp. l9, hasta el momento, este es el primer estudio en el que se reporta el género como potencial probiótico para el cultivo de tilapia. Este aislado, presentó la mayor actividad antimicrobiana contra bacterias patógenas para tilapia como E. tarda y S. agalactiae, probablemente relacionado con la producción de compuestos antimicrobianos que ha sido también descrita en otras especies del género como Exiguobacterium mexicanum, en la que se ha encontrado descrito la producción de dos compuestos: 3,6,18-trion, 9,10-dihydro-12'-hydroxyl-2metil-5-(fenil metil) (5'-alfa, 10-alfa)-dihidroergotamina (C3) y dipropil-S-propil ester (C4) con actividad bactericida contra Shigella flexneri, Klebsiella pneumonia y Salmonella enterica (Shanthakumar et al., 2015).
Por otra parte, los resultados indican actividad disruptora del QS por Exiguobacterium sp. l9, tras evidenciarse el halo de inhibición de violaceína de la bacteria biosensora (C. violaceum); el mecanismo específico para interferir en el QS, requiere ser estudiado en el futuro con mayor detalle; se presume pueden ser de carácter enzimático con potencial para degradar la acil homoserin lactona (AHL) (Grandclément et al., 2016). Esta actividad se asocia con el potencial de inhibir la expresión de factores de virulencia que se regulan por QS en bacterias patógenas, sin afectar directamente su división y crecimiento representa una ventaja al no ejercer presión selectiva y eventual resistencia. En acuicultura, otras especias bacterianas han sido efectivas en la disrupción del QS, por ejemplo Bacillus sp. QSI-1, aislado del tracto gastrointestinal de Carassius auratus, con capacidad degradadora de AHL (Chu, et al., 2014)., permitió un incremento en la tasa de supervivencia de pez cebra (Danio rerio) infectado experimentalmente.
Se sabe que a su vez, Exiguobacterium produce una molécula de comunicación tipo acil homoserin lactona AHL, 3-oxo-octanoyl homoserin lactona (3OC8-HSL), que regula la formación de biopelículas y producción de compuestos extracelulares (Biswa y Doble, 2013).
In vivo, la inclusión del aislado I9 en el alimento de la tilapia no generó mortalidad en los peces, al contrario causó un incremento considerable en la tasa de crecimiento específica, posiblemente también relacionado con la producción de proteasas y antioxidantes descrita previamente en el género (Kumar y Suresh, 2014). La actividad celulítica y alginolítica encontrada en especies del mismo género también pudo contribuir a la mejor asimilación de nutrientes presentes en el alimento (Mohapatra et al., 2012). Por otra parte, estudios previos indican que este género bacteriano tiene un efecto positivo en el crecimiento y el desarrollo de los nauplios de Artemia franciscana (Orozco-Medina et al., 2002).
La inclusión de Exiguobacterium sp. l9, en la dieta generó un aumento en la supervivencia durante la infección experimental con E. tarda. Estos resultados sugieren que a pesar de tener un crecimiento menos rápido que el patógeno y mostrar una adherencia al mucus intestinal relativamente bajo, su administración continua durante 15 días ejerce un efecto positivo en parámetros productivos de alta importancia como son supervivencia e incremento en peso de tilapia.
En otros campos se han descrito aplicaciones biotecnológicas de Exiguobacterium ya que posee la capacidad de neutralizar aguas residuales de la industria textil y de remover pesticidas (Lopez et al., 2005), también alta actividad degradadora de poliestileno (Yang et al., 2015) y de generar condroitina / glicosaminoglicanos (Bhotmange y Singhal, 2015).
Enterococcus faecalis (l15)
En cuanto a I15 Enterococcus faecalis, se observó actividad antibacteriana in vitro contra los patógenos estudiados, que puede estar relacionada con la producción de metabolitos secundarios y bacteriocinas capaces de inhibir el crecimiento de patógenos Gram positivos y negativos descritos previamente en este género (Araujo et al., 2015; Schubiger et al., 2015, Ghomarassi et al., 2016). E. faecalis también se aisló del pez Channa striatus presentando actividad contra A. hydrophila, Pseudomonas aeruginosa, Shewanella putrefaciens, al ser administrado en el alimento causó efectos positivos en el incremento de la supervivencia durante una infección experimental con A. hydrophila (Allameh et al., 2014). En el presente estudio se evidenció que su inclusión en la dieta causó un aumento en la tasa de crecimiento específico de los peces y una disminución en la mortalidad de tilapia infectada experimentalmente en comparación con el control. De igual manera, se ha descrito que otras especies del mismo género como Enterococcus faecium, generan incremento en el peso y respuesta inmunológica en tilapia cultivada (Wang et al., 2008), así mismo, nuestros resultados indican que l15 E. faecalis, presenta una alta adherencia al mucus intestinal de tilapia, lo cual puede estar relacionado con la tasa de crecimiento específica superior observada en estudios previos.
Por otra parte, se ha descrito que la administración a través del alimento vivo de E. faecium IMC 511 a larvas de Solea solea, causó una disminución del recuento de vibrios con respecto a las larvas control, así como una reducción en la expresión de la proteína de choque térmico, HSP70 indicadora de estrés y miostatina, relacionada con la limitación del crecimiento de tejido muscular (Avella et al., 2011). Recientemente, (Matsuura et al., 2014), mostraron que E. faecalis inactivada por calor e inoculada por inyección intraperitoneal en la carpa Carassius auratus langsdorfii, tiene un efecto inmunomodulador causando un incremento en los linfocitos CD4-1 y CD8a+.
No obstante, es preciso advertir que algunas especies de Enterococcus han sido identificadas como patógenas para tilapia (Martins et al., 2009), así como portadoras de genes de resistencia a antibióticos (Osman et al., 2016), por esta razón es importante verificar que la especie con potencial uso probiótico no genere ningún efecto adverso para el hospedero. Se aclara que en el presente estudio, no se evidenció mortalidad o signos de enfermedad causada por el aislado evaluado (I15), por lo que se recomienda tener mayor información relacionada con la bioseguridad de la especie.
Myroides odoratimimus (l19)
Respecto a l19 M. odoratimimus, se sabe que esta especie bacteriana ha sido aislada de peces marinos previamente así como de tilapia Oreochromis mossambicus, encontrándose una alta capacidad de adherencia a sustratos (Wu et al., 2010) además, M. odoratus también se aisló de tilapia O. mossambicus y mostró ser una especie que tiende a agregarse y generar crecimiento en biofilms (Jacobs y Chenia, 2009). Los resultados de adherencia a mucus intestinal de tilapia nilótica encontrados en el presente estudio, muestran una alta capacidad de adherencia del aislado l19, significativamente superior a E. tarda.
Otro de los mecanismos, por medio de los cuales esta especie puede ejercer acción probiótica es mediante la actividad antibacteriana a través de la producción de metabolitos (Dharne et al., 2008), así como por la producción de lactonasas que causan una interferencia relevante en el QS (Ma et al., 2013). En el presente estudio se encontró que el aislado l19 tiene actividad antibacteriana contra E. tarda y S. agalactiae y también interfiere en el QS, tal como pudo observarse por el halo de inhibición de producción de violaceina en C. violaceum.
El aislado M. odoratimimus I19 incrementó la TCE en comparación con los peces control y también aumentó la sobrevivencia de los peces tratados, en aproximadamente el 20 % durante la infección experimental con E. tarda, bacteria patógena en la que es conocida la producción de moléculas como N-acyl-homoserin lactona y auto inductor A2 como moléculas mediadoras de QS.
Otra posible manera de incrementar la supervivencia de los peces, es a través de la estimulación del sistema inmune, mecanismo demostrado en Myroides pelagius PTH7, que redujo la expresión de citoquinas pro inflamatorias en ratones (Islam e al., 2014).
Sin embargo, es necesario aclarar, que a pesar de que en el presente estudio el aislado l19 no causó mortalidad ni algún síntoma de enfermedad, Ravindran et al. (2015) señalaron a Myroides odoratimimus (NIOCR-12) como el agente causal de mortalidad en lisa, Mugil cephalus, por lo que se requiere mayor estudio del presente aislado, antes de ser evaluado en el cultivo de tilapia a escala comercial.
CONCLUSIONES
Las bacterias aisladas de tilapia nilótica; Exiguobacterium sp. l9, Enterococcus faecalis l15 y Myroides odoratimimus l19 tienen capacidad para aumentar la tasa de crecimiento específico, al ser administradas en el alimento y aumentar el porcentaje de sobrevivencia en juveniles de O. niloticus, después de una infección experimental con E. tarda. Su uso como probióticos podría estar explicado por varios mecanismos evaluados in vitro, sin embargo, existen riesgos de bioseguridad que demandan futuros estudios para los aislados E. faecalis l15 y M. odoratimimus l19, mientras que el efecto de Exiguobacterium sp. I9 debería ser estudiado a escala piloto antes de su uso como probiótico en cultivos comerciales de tilapia.