INTRODUCCIÓN
Los estudios de la variación del ADN mitocondrial (ADNmt) han mostrado que los nativos americanos pertenecen a uno de los cinco haplogrupos maternos A, B, C, D y X (Schurr et al., 1990; Torroni et al., 1992; Brown et al., 1998). Análisis recientes de mitogenomas han permitido establecer la presencia de linajes más específicos, algunos de distribución Pan-Americana (A2, B2, C1b, C1c, C1d, D1 y D4h3), descritos como linajes fundadores, y otros presentes sólo en algunas zonas del Norte y Sur de América (A2a, A2b, C4c, D2A, D3, D4E1, X2a, X2g, A2ad, A2af1 B2i2, B2J, B2K, B2L, C1b13, D1G, D1J) (Tamm et al., 2007; Perego et al., 2009; De Saint Pierre et al., 2012a; De Saint Pierre et al., 2012b; Gómez-Carballa et al., 2012; Perego et al., 2012; Gómez-Carballa et al., 2015). Así mismo, el análisis de la variación genética de la región control del ADNmt ha permitido identificar sitios polimórficos que comparten los individuos de un mismo haplogrupo fundador, los cuales definen haplotipos (sublinajes) específicos en cada linaje. Los sublinajes pueden ser específicos de grupos poblacionales (Torroni etal., 1993; Malhi etal., 2002) o de familias lingüísticas (Derbeneva et al., 2002), por lo que se utilizan para estudiar con mayor precisión las relaciones genéticas entre las poblaciones.
Por otra parte, el desarrollo de técnicas moleculares en la recuperación de ADN en muestras antiguas como restos óseos, tejidos momificados, dientes y coprolitos humanos, han permitido estudiar de manera directa la genética de las poblaciones antiguas (Páábo, 1985; De La Cruz et al., 2008; Kemp et al., 2010). En Colombia este tipo de análisis en poblaciones precolombinas han ido en aumento, especialmente en los Andes Orientales. Se ha logrando amplificar el ADNmt en diferentes poblaciones, principalmente en comunidades chibchas tales como Muiscas, Guanes y Laches (Uricoechea, 2010; Casas-Vargas et al., 2011; Casas-Vargas et al., 2017); a su vez en grupos precerámicos como Checua (Cundinamarca) (Díaz-Matallana et al., 2016) y del período Herrera o Formativo en Madrid (Cundinamarca) (Silva et al., 2008).
A la llegada de los españoles otra comunidad chibcha importante fueron los Chitareros, por referencias históricas se sabe que se ubicaron hacia el nororiente del país en los departamentos de Norte de Santander, extendiéndose hasta San Cristobal y el Estado de Táchira en Venezuela, hacia el oriente se asentaron en los valles del Chitagá, Silos, Labateca y Toledo. La denominación Chitarero y de otros grupos étnicos, resulta problemática puesto que los españoles generalizaron algunas denominaciones a vastas regiones, cuando en realidad los indígenas se circunscribían a pequeños valles y altiplanos; para nuestro caso los indígenas de la provincia de Pamplona fueron denominados "chitareros" (Aguado [1581]1956; Langebaek, 1992; Rodríguez, 2011) (Fig. 1), porque usaban calabazos atados a la cintura en los cuales almacenaban chicha de maíz y yuca. Se ha descrito que desde 1530 los Chitareros fueron sometidos a un proceso acelerado de conquista y mestizaje por parte de los españoles, cuya consecuencia inmediata fue la rápida extinción de la etnia (Ruge, 2014). Desafortunadamente, no existe un contexto histórico y arqueológico completo que permita inferir acerca del origen y dinámicas poblacionales de este grupo.
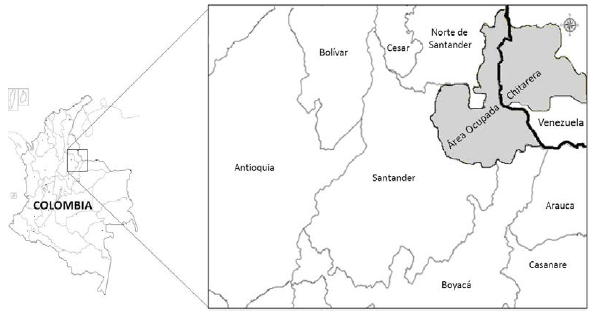
Figura 1 Caracterización geográfica del Área Chitarera. Contorno gris: Territorio ocupado por el grupo étnico Chitarero en Colombia y Venezuela en el tiempo de la conquista española. Tomado de (Ruge, 2014).
El objetivo de esta investigación es caracterizar la composición genética de la comunidad precolombina Chitarera de Norte de Santander, a partir del análisis del ADN mitocondrial en la región hipervariable I (HVRI) y establecer sus posibles relaciones biológicas con otras poblaciones para así contribuir al conocimiento de sus posibles orígenes.
MATERIALES Y MÉTODOS
Población de estudio
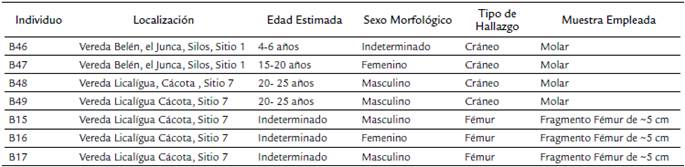
Se analizaron siete individuos que hacen parte de la colección arqueológica del Laboratorio de Antropología Física de la Universidad Nacional de Colombia. Todos los individuos fueron encontrados en abrigos rocosos de los municipios de Silos y Cácota (Norte de Santander, Colombia) en los años 2002 y 2006 en marco del Proyecto Inventario Arqueológico, Paleontológico y de Arte Rupestre de Norte de Santander (Ruge, 2014). Se obtuvieron muestras de dientes y huesos largos para el análisis molecular.
Desde el punto de vista arqueológico los lugares donde fueron encontrados los restos óseos corresponden en su mayoría a abrigos rocosos que fueron utilizados como recintos funerarios, similar a lo encontrado en la Mesa de Los Santos (Santander) y en Silos (Norte de Santander) (Silva, 1947). Las estimaciones de sexo y edad se obtuvieron de los análisis bioarqueológicos previos. No se cuenta con una datación de radiocarbono de las muestras que permita situar cronológicamente a estos individuos, pero a juzgar por el ajuar corresponden al período Reciente (siglos X-XVI d. C.) (Tabla 1).
Precauciones de contaminación para el análisis de ADN antiguo
Para garantizar los resultados y evitar cualquier contaminación exógena, se siguieron algunos de los protocolos propuestos por Cooper y Poinar (2000). Las muestras fueron analizadas en un laboratorio ubicado en el Instituto de Genética de la Universidad Nacional de Colombia que es exclusivo para el análisis de los restos óseos antiguos. Se contó con áreas de trabajo separadas, que garantizaron todas las condiciones de asepsia para el análisis de cada una de las muestras, material desechable (batas, guantes, tapabocas y gorro) y limpieza e irradiación con luz UV de los materiales antes de su uso.
Para detectar la posible contaminación por ADN exógeno moderno, blancos de extracción y amplificación se utilizaron como controles negativos.
Para cada una de las muestras procesadas, se realizaron réplicas de los análisis (de dos a tres aislamientos y amplificaciones por cada muestra). Adicionalmente, se realizó reproducibilidad de los resultados de una muestra escogida al azar en otro laboratorio de ADNa ubicado en la Universidad de la Sabana (Bogotá, Colombia). Por último, todas las personas involucradas en el proceso de las muestras, se tipificaron genéticamente (secuenciación HVR I) y fueron comparados con los resultados obtenidos.
Extracción de ADN
Cada muestra fue sometida a una limpieza antes de su procesamiento como se ha descrito previamente (Casas-Vargas et al., 2011; Casas-Vargas et al., 2017). Brevemente, la descontaminación se realizó removiendo completamente la capa externa del hueso empleando un mototool (para las piezas dentales no fue necesario realizar este primer proceso). Posteriormente las muestras fueron lavadas con hipoclorito al 5 % por diez minutos, seguido de etanol al 70 % por cinco minutos y finalmente exposición a luz ultravioleta por cada uno de los lados durante 15 minutos. Finalmente, se procedió a obtener aproximadamente dos gramos de pulverizado de hueso o diente usando el molino MM400 de Retsch.
Aproximadamente un gramo de pulverizado fue incubado a 56 °C durante 18 horas en una solución de 15 mL que contenía EDTA 0.5M, N-Lauryl-Sarcosyl al 1 %, y proteinasa-K (20 mg/mL). Luego se realizó la extracción del ADN empleando el kit Qiaquick PCR Purification (Qiagen) siguiendo las recomendaciones del fabricante y las modificaciones realizadas por la Comisión Internacional de Personas Desaparecidas (International Commission on Missing Persons [ICMP] (Huffine et al., 2001; Parsons et al., 2007; Huel et al., 2012). Brevemente, el lisado obtenido se centrifuga a 4000 rpm durante cinco min, el sobrenadante se transfiere a filtros Amicon y se centrifuga a 4000 rpm para concentrar la muestra hasta que quede un volumen final de 250 uL. El volumen recuperado se transfiere a tubos de 1,5 mL que contienen 1,250 uL de buffer PB y alícuotas de 720 uL se centrifugan en filtros QIAquick a 14000 rpm por un min. A continuación, se añaden 720uL de buffer PE al filtro y se centrifugan a 14000 rpm por un min. El ADN se eluye mediante la adición de buffer EB, se incuba durante dos min, y se centrifuga a 14000 rpm durante un minuto.
Este proceso se repitió durante dos ocasiones para algunas de las muestras escogidas al azar en momentos separados para confirmar los resultados obtenidos. Los aislados de ADN fueron cuantificados empleando el equipo Qubit® 2.0 Fluorometer de Invitrogen, siguiendo las recomendaciones del fabricante. Para la reacción de PCR fueron empleados de 3 a 7 ng de ADN.
Como control de contaminación, se realizó la extracción de ADN de los investigadores que intervinieron en el proceso, a partir de sangre empleando tarjetas FTA® (Whatman Bioscience, Cambridge, United Kingdom), las cuales están diseñadas para la recolección, almacenamiento y posterior purificación del ADN, mediante el uso de un buffer FTA ®.
Análisis del ADN mitocondrial
Los aislados de ADN fueron amplificados para cuatro fragmentos de PCR de tamaños entre los 160 y 180 pb que amplifican la región hipervariable I del ADN mitocondrial, (Tabla S1). El ADN fue amplificado mediante PCR utilizando master mix HotStarTaq Master Mix (Qiagen®) 2X, 1X de enhancer (Epicentre®),100 ug de BSA (Roche®) y 0,8uM de cada cebador o primer. El programa de PCR utilizado considera: denaturación inicial, 95 °C por 15 min, 50 ciclos de: denaturación, 95 °C por 30 seg; anillamiento, 30 seg a una temperatura de 57- 58 °C dependiendo de los primers empleados; elongación, 72 °C por 30 seg; y elongación final a 72 °C por diez minutos.
La presencia e integridad de los amplificados obtenidos en las PCRs fueron verificadas por electroforesis en gel de agarosa al 1,5 % teñido con Syber® Safe. Se confirmó la concentración y altura de la banda esperada por comparación con el patrón de peso molecular HyperLadderTM II (Bioline). La purificación de cada fragmento amplificado se realizó con el Kit WizardTM PCR Prep System (Promega), siguiendo las recomendaciones del fabricante. Los productos de purificados de PCR fueron enviados a MACROGEN (Seoul, South Korea). Se realizaron secuencias bidireccionales empleando los mismos primers de la amplificación de por lo menos dos-productos de PCR por cada muestra para cada uno de los fragmentos (con el fin de descartar errores). Para las muestras control de los investigadores se emplearon los primers L15,997 y H16,391 que amplifican un fragmento de 433 pb de la HVR I del ADN mitocondrial (Sánchez, 2007).
Análisis de la deleción de 9pb
La confirmación de los resultados de la secuenciación se hizo mediante el análisis de la deleción de 9 pb en COII/ tARNlys, característica del haplogrupo B. El ADN fue amplificado mediante PCR utilizando master mix GoTaq Hot Start® ADN polimerasa (Qiagen®) 2X, 1X de enhancer (Epicentre®), y 100 ug de BSA (Roche®) y 0,5uM de cada cebador o primer (Tabla S1). El programa de PCR utilizado considera: denaturación inicial, 95 °C por 15 min, 50 ciclos de: denaturación, 95 °C por 45 seg; anillamiento, 55 °C por 45 seg; elongación, 72 °C por 45 seg.; y elongación final a 72 °C por tres minutos. La deleción fue evidenciada en gel de poliacrilamida:bisacrilamida en concentración 40:1 teñido con Syber® Safe.
Amplificación del ADN para marcadores autosómicos y amelogenina
La amplificación se realizó empleando el kit comercial multiplex AmpFiSTR® SEfilerTM (Applied Biosystems) el cual cuenta con 11 marcadores STRs autosómicos (D2S1338, D3S1358, D8S1179, D16S539, D18S51, D19S433, D21S11, FGA, SE33, TH01 y vWA) y el marcador sexual Amelogenina. En un volumen final de 25 uL se mezclaron los siguientes componentes: mezcla de reacción para PCR (AmpFiSTR® SEfilerTM MIX: MgCl2, dNTPs, albúmina de suero bovino en buffer con azida de sodio 0.05 %) 10 uL; set de primers (forward y reverse) 5 uL; enzima ADN polimerasa (AmplitaqGoldTM DNA Polimerase 5 U/uL) 0,5 uL; ADN (1,0-2,5 ng/uL) 5 uL y 4,5 uL de agua destilada desionizada. La PCR se llevó a cabo en un termociclador Thermal cycler ®PCRSystem 2720 de Applied-Biosystems®, siguiendo las recomendaciones del fabricante. Se utilizó un Analizador Genético ABI PRISM® 310 (Applied Biosystems) para la tipificación molecular siguiendo las recomendaciones del fabricante. Se empleó el software Genemapper ID v3.2, el cual analiza el estándar de tamaño de control interno GeneScan-500 LIZ® en cada muestra y la escalera alélica para asegurar la precisión en cada inyección del capilar. La asignación alélica de las muestras analizadas se realizó por comparación de los fragmentos obtenidos en pares de bases para cada pico del alelo con los picos de la escalera alélica provista por la casa comercial para el kit SEfi ler ® (Applied Biosystems®, Foster City, CA).
Análisis de datos
Para la asignación de los haplotipos, las secuencias fueron comparadas con la Secuencia de Referencia Revisada de Cambridge (rCRS) (Andrews et al., 1999), en el software Sequencher 5.2.4 (Gene Codes Corporation, Ann Arbor, MI, USA). La asignación del haplogrupo fue acorde a Phylotree build 17 (Van Oven y Kayser, 2009) (Fig. S1).
La frecuencia de los haplogrupos se calculó dividiendo el número de individuos de cada haplogrupo entre el número total de individuos analizados.
Para establecer la posible relación biológica entre los individuos precolombinos encontrados en el área Chitarera con otras comunidades nativas antiguas y contemporáneas se compararon los datos obtenidos con 31 comunidades nativas americanas contemporáneas, y con 34 poblaciones antiguas precolombinas suramericanas (Tabla S2). Se realizó análisis de UPGMA basado en las frecuencias de haplogrupo de las diferentes poblaciones amerindias colombianas empleando el software MVSP® v3.1 (Kovach, 2007).
Las distancias genéticas se estimaron con base en las frecuencias de cada haplogrupo del ADNmt, calculando los datos del índice de fijación (F) con el programa Arlequín® (Excoffier et al. 2005). Se compararon las poblaciones por medio del análisis de escalamiento multidimensional basado en los datos del FST, con el programa MVSP® , versión 3.1 (Kovach, 2007).
RESULTADOS
Marcadores autosómicos y amelogenina
Para las siete muestras de restos óseos analizadas, se realizó la tipificación de 12 marcadores autosómicos con el kit comercial multiplex AmpFiSTR® SefilerTM (Applied Biosystems®). Este análisis se realizó con el fin de garantizar que se trataran de individuos únicos y no se tomaran dos piezas óseas de un mismo individuo. La determinación del sexo con el marcador de la amelogenina fue utilizada para comparar la evidencia genética con los datos arqueológicos según sus características morfológicas, encontrando concordancia en todas ellas. En tres muestras se logró obtener perfiles en 11 STRs (individuos B15, B17 y B49); en la muestra B47 no se obtuvo amplificación debido al estado de degradación del ADN, lo cual es característico de las muestras antiguas (Tabla S3), para el individuo B48 fue posible determinar el sexo femenino (XX), aportando datos genéticos a los análisis antropológicos previos. Finalmente, los perfiles de ADN encontrados en los restos óseos no coincidieron con los de los investigadores que manipularon el material durante la experimentación (Tabla S3).
Análisis de haplogrupos mitocondriales
La metodología de extracción de ADNa implementada en este trabajo presentó una reproducibilidad del 100 % la cual es bastante alta dada la complejidad del procedimiento realizado, es decir, que se logró extraer y cuantificar ADN de las siete muestras analizadas (Tabla S3). Estos resultados mostraron cantidades suficientes de ADN para su amplificación y asegurar la repetibilidad de los mismos.
La asignación del haplogrupo mitocondrial se realizó siguiendo los lineamientos de Phylotree build 17 (Van Oven y Kayser, 2009). Los siete individuos presentaron el mismo haplotipo con la presencia de un solo polimorfismo en la posición 16217C característicos del haplogrupo B2 (Tabla 2).
Tabla 2 Haplotipos mitocondriales región HVRI de las muestras analizadas. investigadores involucrados en la manipulación del material óseo.
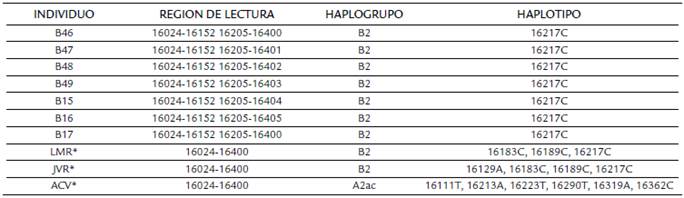
La amplificaron y secuenciación de HVRI de los tres fragmentos correspondientes a las regiones 1 (16,011 - 16,131), 3 (16,210-16,330) y 4 (16,250-16,382), fueron exitosos. Sin embargo, la secuenciación del fragmento 2 (16,127-16,229) provoca un deslizamiento de la polimerasa, lo cual, no hace fácil la interpretación de los polimorfismos en esta región. Por este motivo el polimorfismo en la posición T16,189C, característico del haplogrupo B4 no fue detectado (Tabla 2).
Con el fin de confirmar este haplogrupo se realizó el análisis de la delecion de 9pb, en COII/tARNlys característica del haplogrupo B; todas las muestras presentaron esta deleción.
Teniendo en cuenta que en poblaciones Nativo Americanas el haplogrupo B predominante es el B2, caracterizado por la deleción de nueve pares de bases en la región COII/ tARNlys y presencia del polimorfismo en la posición 16217 (De Saint Pierre et al., 2012a; De Saint Pierre et al., 2012b), designaremos las muestras como haplogrupo B2.
Relación genética de los Chitareros con otros grupos étnicos colombianos: un análisis regional
En Colombia, los estudios de ADNa realizados con restos humanos han involucrado principalmente poblaciones andinas del Altiplano Cundiboyacense (Silva et al., 2008; Casas-Vargas et al., 2017), Santander (Casas-Vargas et al., 2011) y el Valle del Cauca (Barreto et al., 2010). Para Norte de Santander no se tienen registros, siendo una zona culturalmente importante para el país debido a que fue un área de asentamiento de poblaciones prehispánicas de diversa filiación étnico-cultural y lingüística (Rodríguez, 2007).
Al construir un dendograma UPGMA basado en las frecuencias de los haplogrupos de las diferentes poblaciones amerindias antiguas y actuales colombianas, se observó una estrecha relación genética de los individuos del estudio (Chit-COL-ANT), con tres poblaciones antiguas pertenecientes a los tres periodos de ocupación precolombina: Precerámico (Precer- COL-ANT), Formativo (Herr-COL-ANT) y Reciente (Quimb- COL-ANT) (Fig. 2).
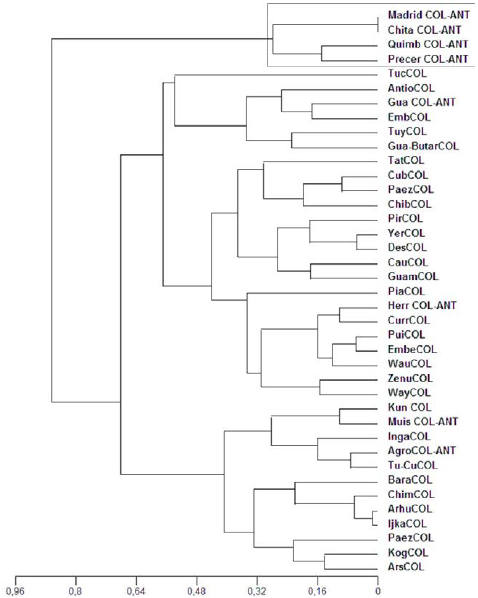
Figura 2 Dendograma NJ construido a partir de las frecuencias de haplogrupos mitocondriales de las muestras del presente proyecto comparado con muestras de otras poblaciones amerindias antiguas y actuales de Colombia. Los nombres claves de las abreviaturas están indicados en paréntesis: ChibCOL (ChibchaCOL), CubCOL (CubeoCOL), Paez COL (PaezCOL), DesCOL (DesanoCOL), CurrCOL (CurripacoCOL), WayCOL (WayuuCOL), WauCOL (WaunanaCOL), IngCOL (InganoCOL), Tu-CuCOL (Tule-CunaCOL), TucCOL (TucanoCOL), EmbCOL (EmberaCOL), AntCOL (AntioquiaCOL), TatCOL (TatuyoCOL), ZenuCOL (ZenuCOL), PiuCOL (PuinaveCOL), CauCOL (CaucaCOL), Guan-ButarCOL (Guane-ButareguaCOL), GuamCOL (GuambianoCOL), ArsCOL (ArsarioCOL), KunCOL (KunaCOL), KogCOL (KoguiCOL), ArhCOL (ArhuacoCOL), IjkaCOL (IjkaCOL), ChimCOL (ChimilaCOL), PiaCOL (PiapocoCOL), PirCOL (PiratapuyoCOL), YerCOL (YeralCOL), TuyCOL (TuyucaCOL), BarCOL (BarasanoCOL).
Chitareros y la dinámica poblacional precolombina en Suramérica
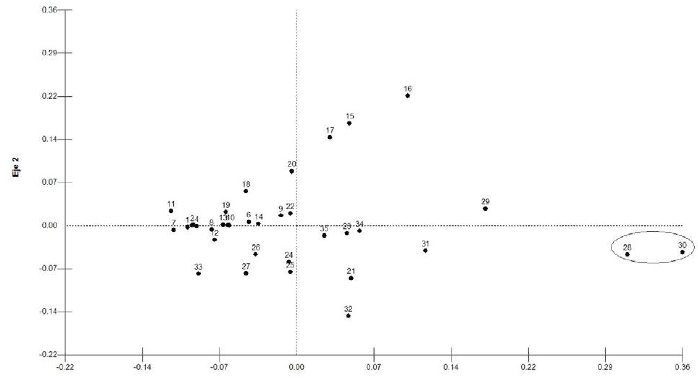
Se construyó una matriz de distancias a partir de datos del FST y se analizaron los componentes principales (PCA) (Fig. 3). Se observa la cercanía de los chitareros (No. 28) con la población antigua de Madrid, Cundinamarca (No. 30) clasificados en el período Formativo o Herrera (Fig. 3).
DISCUSIÓN
Este estudio constituye el primer esfuerzo en la realización de estudios de ADN antiguo en el Nororiente colombiano, suministrando información complementaria a las reseñas históricas y los datos antropológicos recolectados previamente para este grupo étnico. El análisis molecular permitió clasificar a todos los individuos chitareros estudiados como pertenecientes al haplogrupo B2 por la presencia del polimorfismo en la posición T16, 217C respecto a la secuencia de referencia rCRS. Todos presentaron el mismo haplotipo indicando posiblemente que se tratara de un grupo humano estrechamente emparentado, con un alto nivel de endogamia, teniendo en cuenta una probable densidad demográfica baja y por lo tanto una baja diversidad genética, similar a lo encontrado en otras poblaciones precolombinas como en Madrid (Cundinamarca-Colombia) (Periodo Formativo o Herrera) (Silva et al., 2008), lo cual sería un dato valioso y aportaría a la información etno-histórica disponible hasta la fecha. Un factor importante que debemos tener en cuenta es que la muestra no sea realmente representativa de la población conocida como Chitareros asentada en los municipios de Santo Domingo de Cácota y Silos en Norte de Santander durante el periodo Reciente o chibcha; a pesar de ello, estos datos representan los primeros hallazgos moleculares que complementarían los análisis craneométricos y dentales que indican una gran afinidad con el grupo Muisca del Norte (Rodríguez, 2011).
Según la información de los cronistas sobre los grupos chitareros del siglo XVI, ubicados entre los ríos Guaca, Servitá y Suratá (Norte de Santander), los describen como comunidades independientes, con asentamientos dispersos, pequeños, apartados unos de otros, en distintos pisos térmicos, que no superaban la cifra de 30.000 habitantes (Aguado [1581] 1956; Langebaek, 1992; Rodríguez, 2001). Por el contrario, los tamaños poblaciones de las comunidades precolombinas aledañas son superiores a estos valores como es el caso de los muiscas en donde se ha calculado una cifra de 600.000-900.000 habitantes para el siglo XVI, para los guanes 100.000-150.000 habitantes (Rodríguez, 2011), esto afectaría la diversidad genética entre cada uno de los grupos poblacionales.
El patrón de distribución de frecuencias de la población precolombina Chitarera es muy similar al encontrado en otro estudio realizado en restos óseos antiguos del periodo Herrera ó Formativo de la sabana de Bogotá en donde se analizaron seis individuos y todos ellos presentaron el mismo haplogrupo mitocondrial (B) (Silva et al., 2008). Caso contrario sucede cuando se compara con otros grupos cercanos geográfica y culturalmente como los Muiscas y los Guanes (Casas-Vargas et al., 2011; Casas-Vargas et al., 2017), donde se ha reportado una mayor variabilidad genética con altas frecuencias de haplogrupo A, frecuencias intermedias de haplogrupo B, y en menores frecuencias los linajes Cy. Los hallazgos de esta distribución de frecuencias en poblaciones antiguas colombianas ha sido atribuida a un arribo inicial de individuos que traían consigo los haplogrupos B y D, y posteriormente un flujo génico más reciente de pobladores que presentaban una alta frecuencia del haplogrupo A (Jara, 2007).
Moraga et al. (2005) han descrito una frecuencia del haplogrupo B en un 42 % en población antigua (1800-1300 AP) del norte de Chile. En muestras precolombinas de la región de la Pampa Grande (Salta, Argentina), se reportó este haplogrupo en un 42 % de las muestras (Carnese et al., 2010), reflejando un flujo genético entre las tierras altas a los valles de la región del sur del complejo Andino. Altas frecuencias del haplogrupo B han sido detectadas en poblaciones modernas de los Andes Centrales, como los Aymara, Quechua, Tupe, Yungay, Arequipa (Fuselli et al., 2003; Lewis et al., 2007). Este haplogrupo ha sido encontrado también en todos los periodos arqueológicos colombianos (Precerámico, Herrera, Reciente), sugiriendo una continuidad poblacional a lo largo del tiempo (Fernández, 1999; Silva et al., 2008; Casas-Vargas et al., 2011; Casas-Vargas et al., 2017).
El estudio de la variación genética en el ADNmt en poblaciones de nativos americanos, ha dado lugar a una extensa discusión acerca del poblamiento de América (Powell y Neves 1999; Perez et al., 2009; Chatters et al., 2014). Cuando se compara la diversidad y la estructura genética de poblaciones andinas y amazónicas se observa que las primeras tienen una mayor diversidad genética dentro de las poblaciones, pero pequeñas distancias genéticas, en contraste con las amazónicas (Luiselli et al., 2000; Tarazona-Santos et al., 2001; Fuselli et al., 2003; Lewis et al., 2005). Adicionalmente, la distribución de las frecuencias de los haplogrupos del ADNmt (A-D) en poblaciones actuales, ha mostrado que las Andinas tienen un alto porcentaje del haplogrupo B (63 %), mientras que los otros haplogrupos se encuentran en menor proporción, en comparación con las amazónicas, en las cuales el haplogrupo C, tiene la mayor frecuencia (Rodriguez-Delfin et al., 2001).
Los datos de este estudio muestran la importancia del ADNa en los estudios arqueológicos, y constituyen una primera aproximación genética en esta comunidad precolombina del Norte de Santander. Es necesario ampliar el rango de lectura en el ADN mitocondrial, con el fin de dar mayor poder de resolución y lograr retratar sublinajes mas informativos, profundizando de esta manera en el conocimiento de los origenes y dinámicas poblacionales de estas comunidades.
Finalmente, uno de los principales problemas en los análisis de ADNa humano es la abundancia del ADN humano moderno, debido a esto es necesario adoptar ciertos criterios de autenticidad. Sin embargo, muchos de sus criterios no están al alcance de los investigadores. Gilbert et al. (2005) argumentan que los investigadores en este campo deben tomar una aproximación más cognoscitiva y autocrítica, especialmente, en el momento de comprobar en detalle todos los criterios de la lista, los investigadores pueden explicar cómo los datos fueron obtenidos y por qué ellos creen que son auténticos (Gilbert et al., 2005). Por lo anterior, los resultados que se obtuvieron fueron realizados teniendo en cuenta por lo menos siete de los criterios sugeridos por Cooper y Poinar (2000).
Esto conllevó a ser más rigurosos en los análisis con el fin de descartar cualquier tipo de contaminación cruzada entre las muestras o con otro tipo de ADN exógeno. Dado que en muchas ocasiones los haplogrupos de ADN mitocondrial no permiten individualizar, fue necesario emplear marcadores autosómicos de tipo STR's para garantizar que se trataran de individuos únicos y que los perfiles genéticos no correspondieran a algunos de los investigadores que intervinieron en el proceso. Así mismo los resultados fueron evaluados bajo criterios de repetibilidad (cambio de analista) y reproducibilidad (laboratorio alterno de ADNa). En ambas situaciones se presentaron los mismos resultados brindándole un mayor soporte a nuestros resultados.
CONCLUSIONES
Nuestros datos resaltan la importancia de la contribución del ADN antiguo en los estudios arqueológicos. Durante este estudio se implementó una metodología con alta reproducibilidad para la extracción de ADNa, que permitió un análisis del ADN mitocondrial y la confirmación molecular del sexo antropológico. De los cuatro haplogrupos mitocondriales reportados en la literatura se determinó la presencia del linaje B en los siete individuos precolombinos con fi liación cultural Chitarera. Adicionalmente, se encontró una fuerte asociación de este grupo con otras poblaciones antiguas andinas de diferentes periodos antropológicos sugiriendo una afinidad poblacional a lo largo del tiempo.
Para comprender mejor la dinámica poblacional de esta comunidad, se hace necesario ampliar el tamaño de la muestra, explorar un mayor territorio y analizar marcadores genéticos adicionales. Así mismo en este estudio se resalta la importancia de que exista una contextualización arqueológica previa al análisis molecular, ya que sin ella las inferencias genéticas acerca de sus relaciones biológicas y comportamientos culturales (endogamia o rituales funerarios) pueden ser imprecisas e ineficientes.
La información genética obtenida en el presente estudio puede contribuir a los arqueólogos y antropólogos interesados en estudiar esta zona del país y que deseen contextualizar mejor a este grupo étnico, en conjunto con los datos obtenidos se aumentará la consistencia de los resultados y aportarán mucha más información sobre la historia poblacional de este grupo étnico.