INTRODUCCIÓN
Las coberturas forestales de la región neotropical han sufrido modificación y degradación a causa de la expansión agrícola y ganadera, la extracción de madera y el aumento desmedido de las infraestructuras urbanas (Armenteras et al., 2011). Estos procesos se traducen a escala local en el establecimiento de cultivos permanentes, la generación de agroindustria, la ganadería extensiva y la mayor demanda de recursos a causa del crecimiento de la población (Rudel et al., 2009). La calidad del agua y las comunidades biológicas de los ecosistemas acuáticos han sido fuertemente afectadas por cambios en el uso del suelo, principalmente por la deforestación y el desarrollo de actividades agrícolas y ganaderas (Schiller et al., 2007). Los cambios en las características físicas del entorno de los humedales, como son la cobertura vegetal y el tipo de sustrato en la zona litoral, afectan la disponibilidad de luz, la temperatura, la composición química del agua y el contenido de materia orgánica (Lowe, 1996; Jorcin y Nogueira, 2008).
Conservar la vegetación riparia es fundamental para preservar la biodiversidad, ya que ofrece varios tipos de hábitats para la fauna, la flora y los microorganismos (Patten, 1998). La vegetación boscosa de la zona riparia genera sombra, minimiza la entrada directa de la radiación solar y reduce la temperatura del agua (Granados-Sánchez, et al., 2006). Un incremento en la temperatura y una reducción en la concentración de oxígeno disuelto en un ecosistema acuático, conlleva a la proliferación de especies adaptadas a aguas más cálidas, a decrecimientos poblacionales locales, o a que determinados grupos funcionales puedan ser severamente afectados (Roldán y Ramirez, 2008; Armas, 2015). La deforestación en la zona riparia ocasiona modificaciones en los ciclos de nutrientes, especialmente del nitrógeno y el fósforo, y en la disponibilidad de los sustratos orgánicos (Jorcin y Nogueira, 2008), parámetros capaces de regular la estructura y composición del perifiton (Lowe, 1996). Por otro lado, una de las funciones más importantes de la vegetación litoral es la retención de escorrentías, nutrientes y sedimentos (Boothroyd et al., 2004), lo que impide la eutrofización y conserva la diversidad del ecosistema (Hill et al., 2001).
En la región colombiana conocida como llanos orientales, durante las últimas décadas ocurre una progresiva deforestación debido al desarrollo de nuevos sistemas de producción agropecuaria (Romero et al., 2012). Tres grandes amenazas enfrentan los ecosistemas en la Orinoquía, según el Reporte de Salud de la Cuenca del Orinoco estas son: el cambio en el uso del suelo, la pérdida de cobertura natural y la transformación de sus ecosistemas (citado en IAvH, Omacha, WWF, 2016). Amenazas que se han ido expandiendo, primordialmente por actividades de extracción de hidrocarburos y ampliación de la frontera agropecuaria. Entre los años 2001 y 2008 la deforestación para siembra de pastos por la actividad ganadera se incrementó en más de 1,5 millones de hectáreas (Viloria, 2009). En el departamento del Meta dicha deforestación corresponde al 79 % del total del territorio (CORMACARENA, 2008).
A pesar del drástico cambio en las coberturas de esta región, no existen trabajos previos que permitan evaluar los impactos de estos procesos sobre el funcionamiento de los ecosistemas acuáticos. Es documentado en la literatura que el fitoperifiton responde ante variaciones en las características físicas y químicas del medio acuático mediante cambios en la composición y estructura de sus comunidades (Castro-Roa y Pinilla-Agudelo, 2014; Hill et al., 2001). Esta estrecha relación con su entorno, permite usar las algas como indicadores del efecto de los factores tensionantes (Lowe, 1996; Wetzel, 2001). Considerando lo anterior, se plantea la siguiente pregunta: ¿Cómo afecta el tipo de cobertura vegetal de la zona riparia, la estructura del fitoperifiton de humedales de la Orinoquía? La hipótesis de este trabajo fue que el tipo de vegetación circundante en la zona litoral de los humedales tendría un impacto sobre las características físicas y químicas del agua y, por lo tanto, las algas de esta zona podrían reflejar diferencias entre los tipos de coberturas mediante cambios en la composición y la diversidad de sus comunidades.
MATERIALES Y MÉTODOS
Área de estudio
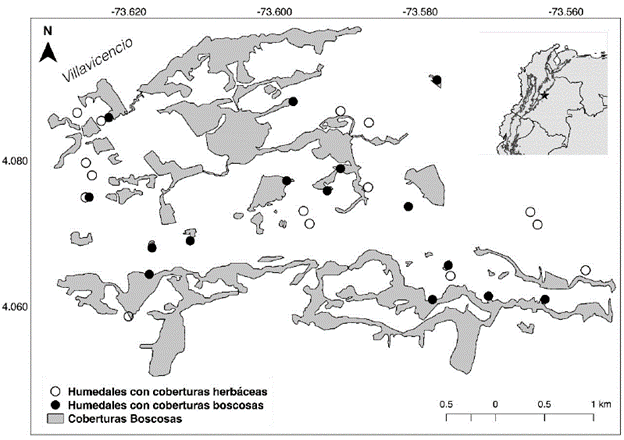
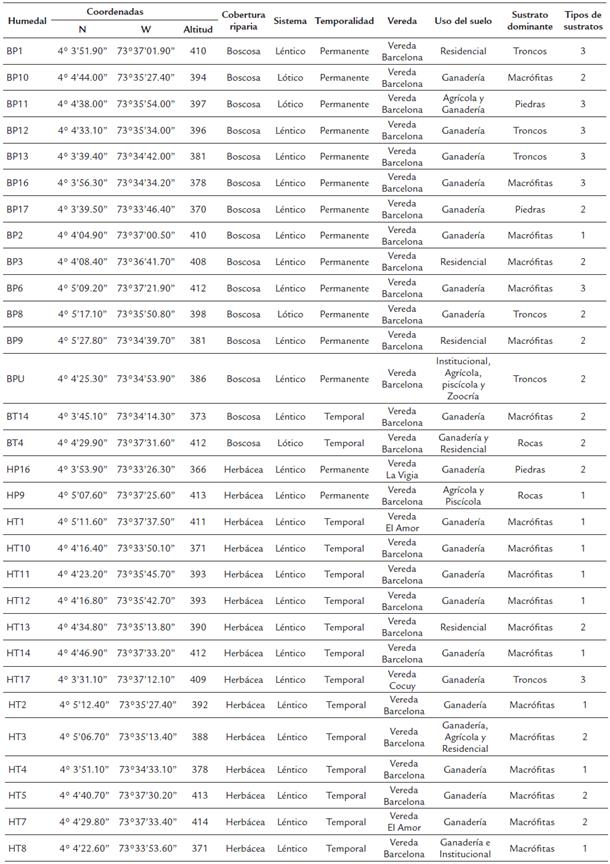
Este estudio se realizó en 30 humedales de la zona periurbana de Villavicencio, Meta, Colombia (Fig. 1). La zona es una planicie, con altitudes que varían entre 120 y 470 m y un clima tropical cálido muy húmedo (Leyva, 2003), con un rango de temperatura de 20 °C a 39 °C, precipitación promedio anual de 4383 mm y humedad relativa que varía entre 60 % y 80 % (Instituto de Hidrología, Meteorología y Estudios Ambientales-IDEAM, 2000). En la zona se encuentran parches de bosque húmedo tropical y vegetación herbácea, como producto de las actividades antrópicas (Armenteras et al., 2011).
Mediante un análisis de imágenes satelitales de Google Earth© con aumento de 600 m de alto ojo, se seleccionaron 15 humedales con vegetación riparia herbácea (H) y 15 con vegetación riparia boscosa (B) (Apéndice 1). Durante el muestreo se validó y cuantificó el porcentaje de la zona litoral del lago que estaba rodeada de bosque. Para esto, se realizaron recorridos a lo largo de la zona litoral de cada humedal y mediante observación visual se estimó la cobertura entre 0 y 100 %. Un análisis de varianza y una prueba de Kruskal-Walis mostraron que el porcentaje de cobertura boscosa litoral entre los dos tipos de lagos preseleccionados fue significativamente distinto (p<0,001) y que la clasificación realizada mediante imágenes satelitales fue correcta. A partir del historial de imágenes de Google Earth© se identificó la permanencia de los humedales en épocas de sequía, clasificándolos como permanentes o temporales (Apéndice 1). En cada uno de los humedales se realizó un único muestreo durante la época de transición de lluvias a sequía, del 28 de noviembre al 8 de diciembre de 2016.
Los humedales con vegetación litoral herbácea presentaron mayor frecuencia de plantas acuáticas. Dentro de las plantas acuáticas observadas, fueron dominantes la Eichhornia sp, la Ceratophyllum spp, la Najas spp y la Azolla spp. En algunos humedales también se observó la presencia de Eleocharis cf. elegans (Kunth) Roem y Schult, Ludwigia inclinata (L.f.) P.H. Raven y Tonina fluviatilis Aubl. El bosque ripario asociado a los humedales se caracterizó por poseer varios estratos, desde matorrales y pasturas hasta palmas de moriche (Mauritia flexuosa; L.f. 1782) y bosque inundable en algunos casos.
Muestreo
Las muestras para el análisis de las comunidades algales se colectaron mediante un muestreo sistemático en 20 puntos en la zona litoral de cada humedal. En cada uno de los humedales se incluyeron todos los tipos de sustratos visibles, procurando una representatividad homogénea de los sustratos presentes. De esta manera, por cada uno de los ecosistemas se colectó una sola muestra integrada. Pese a que el tipo de sustrato puede afectar la distribución de las algas, no fue posible controlar este factor debido a la alta variabilidad que existe entre estos ecosistemas. No obstante, el número de tipo de sustratos presentes en cada humedal fue considerado como una variable explicativa del perifiton en los análisis estadísticos. Para sustratos duros (rocas y troncos) se raspó una cuadricula de 20 x 20 mm con un cepillo de cerdas duras. Para sustratos blandos (hojas y macrófitas, incluida la raíz) se tomó el sustrato y se exprimió sobre el frasco de colecta (Rivera-Rondón et al., 2010). Las muestras se preservaron con 1 ml de solución formol por 100 ml de muestra (American Public Heatlh Association, American WaterWorks Association & Water Pollution Control Federation, 1998).
En campo, se midió la conductividad (conductímetro Hanna HI 98311, USA), la temperatura, el pH (potenciómetro Hanna HI 98127, USA), y el oxígeno disuelto (OD) del agua (oxímetro Hanna HI 9146, USA). Adicionalmente, se tomaron muestras de agua para el posterior análisis de carbono orgánico total (COT), fósforo total (PT), nitrógeno total Kjeldahl (NTK) y turbiedad siguiendo procedimientos estandarizados (American Public Heatlh Association, American WaterWorks Association & Water Pollution Control Federation, 1998).
Análisis de laboratorio
Cada una de las muestras colectadas se dividió en dos porciones, una fue destinada al análisis del fitoperifiton y la otra, al estudio de las diatomeas. Las diatomeas se limpiaron mediante el método de oxidación que consiste en tomar 0,5 ml de la muestra, agregar 0,3 ml de HCl y 5 ml de H2O2 y, llevar a baño maría (70-75 °C) hasta que toda la materia orgánica se digiera. Después, con el fin de abrir las valvas de las diatomeas y hacer transparente el material no digerido, se añadió 1-2 ml de HCL y nuevamente se llevó las muestras al baño maría a 70-75 °C durante 1-2 horas (Battarbee, 1986; Díaz-Quirós y Rivera-Rondón, 2004). Por último, se realizaron los respectivos montajes permanentes en portaobjetos utilizando Naphrax como resina.
Para el análisis del fitoperifiton se utilizó un microscopio óptico Nikon E100; cada muestra se contó hasta alcanzar mínimo 400 células de la especie más abundante. El conteo por célula se realizó tanto para especies unicelulares cómo coloniales, dado que permite obtener una mejor estimación de la abundancia. Este método de conteo causa tan solo un 10 % de error en la estimación de las abundancias relativas (Wetzel y Likens, 1991). Las muestras de diatomeas se procesaron en un microscopio Zeiss Axio Imager A2 con contraste interferencial, contando 500 valvas por muestra. Para la identificación de las diatomeas, se utilizaron las claves taxonómicas generales de Krammer y Lange-Bertalot (2004) y Metzeltin y Lange-Bertalot (2007), entre otras. Para el resto de microalgas se utilizaron las claves taxonómicas especializadas de John et al., (2002) y Bicudo y Menezes (2006), entre otras. Los datos del fitoperifiton y de las diatomeas se transformaron a porcentaje y se analizaron independientemente.
Análisis de datos
Con el objeto de evaluar la representatividad de la diversidad de algas en el muestreo, se elaboraron curvas de acumulación de especies y se calcularon los estimadores de riqueza de Chao1, Chao2, Jackknife 1 yJackknife 2 (Colwell y Coddington, 1994).
La diversidad de las comunidades se analizó mediante el índice de diversidad inverso de Simpson (1/D) (Simpson, 1949). Este índice reduce el efecto del submuestreo de especies y por tanto, permite una mejor comparación entre comunidades con alta dominancia de unas pocas especies. Para evaluar diferencias significativas de este índice entre humedales con diferente cobertura riparia, se utilizó la prueba de Kruskal-Wallis con cada una de las características del hábitat (tipo de cobertura litoral, temporalidad del humedal, tipo de sistema, sustrato dominante y número de sustratos). Asimismo, se elaboraron diagramas de caja con algunas de las variables fisicoquímicas.
Para cuantificar el nivel trófico de los humedales se calculó el índice de Estado Trófico (IEET PT) de Carlson (1997), que se basa en las concentraciones PT. Mediante un análisis de componentes principales (ACP) se identificó patrones en la variabilidad física y química. Para establecer las variables ambientales que explican las especies de fitoperifiton se realizaron análisis de redundancia (ARD): un primer análisis incluyó solo las diatomeas y otro analizó todo el fitoperifiton excluyendo las diatomeas. Se utilizó un test de Monte Carlo con 1000 permutaciones para validar estadísticamente la relación de las variables ambientales con las especies. Con el objeto de establecer que tanta varianza es explicada por estos modelos, se compararon los valores obtenidos con respecto a la variación de las especies obtenida en un análisis de correspondencia sin tendencia (ACD). Finalmente, se realizaron modelos de regresiones lineales entre el índice de Simpson y las características del hábitat. Los análisis se desarrollaron en el Software R usando los paquetes stats (v. (3.4.2) y vegan (2.4-4) en lenguaje de R (R Core Team, 2017).
RESULTADOS
Características físicas y químicas de los humedales analizados
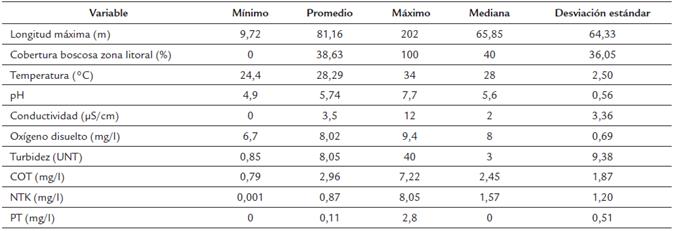
Los humedales fueron principalmente lénticos, de tamaño pequeño (longitud máxima: 9,72-202 m) y distribuidos en áreas intervenidas por ganadería extensiva y cultivos. En menor grado estos humedales están afectado por la presencia de casas, edificaciones y zoocría (Apéndice 1).
Los humedales con cobertura litoral herbácea presentaron una tendencia a valores más altos de temperatura y COT, y registros menores de conductividad y PT (Fig. 2, Tabla 1). No obstante, solo la temperatura presentó diferencias significativas entre los dos grupos de humedales (P= 0,013). Según el índice de estado trófico, la mayor parte de los humedales muestreados presentaron condiciones oligotróficas (IEET PT <35), excepto los humedales BPU (111,2), BP17 (79,7), HT5 (68,4) y HT2 (54,5), los cuales fueron eutróficos (Apéndice 1).
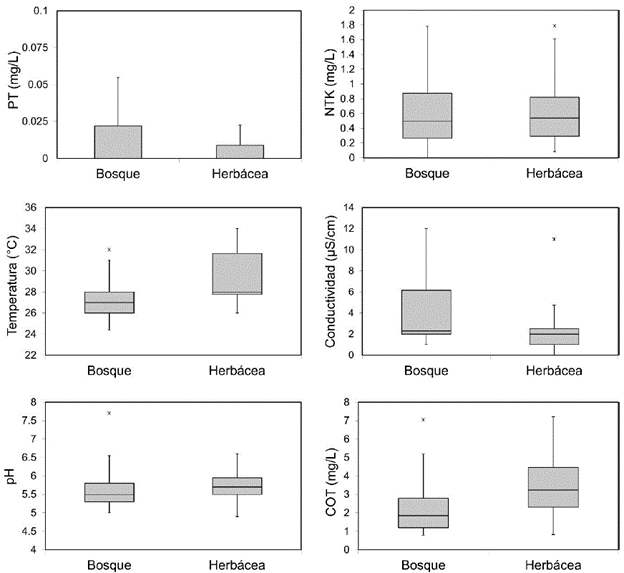
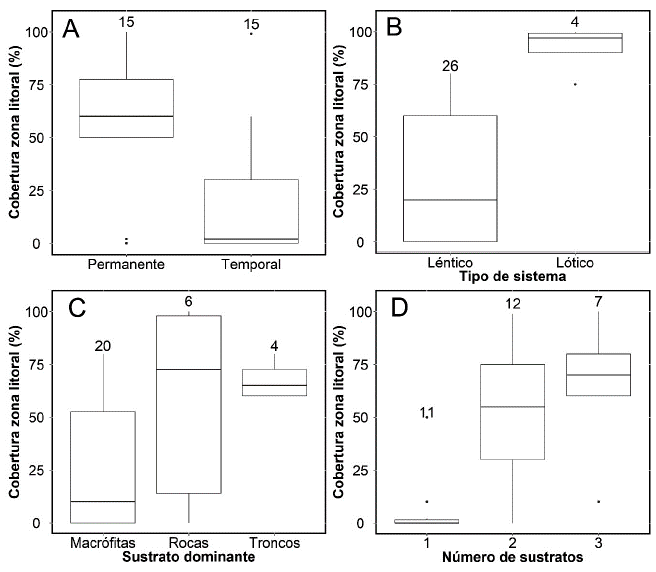
Figura 2 Diagramas de cajas de algunas de las variables físicas y químicas cuantificadas en los humedales, respecto al tipo de cobertura de la zona litoral.
Tabla 1 Resumen de las características del hábitat y las variables físicas y químicas de pequeños humedales de la región de la Orinoquía.
En el ACP realizado con las variables físicas y químicas se observó que los dos primeros ejes del modelo explicaron el 47,9 % de la variación total de los datos. El primer eje se asoció principalmente a la cobertura litoral (porcentaje de cobertura boscosa). La cobertura litoral presentó una relación inversa con el COT, la temperatura y el pH. El segundo eje se correlacionó con el NT y la conductividad. El análisis separó a lo largo del primer eje los dos tipos de humedales muestreados, pero algunos de ellos respondieron al segundo eje. Así, el humedal HP9, afectado por piscicultura, presentó valores altos de NT, mientras que el humedal HT7 (humedal cercano a una quebrada) se asoció a valores altos de conductividad (Fig. 3, Apéndice 1).
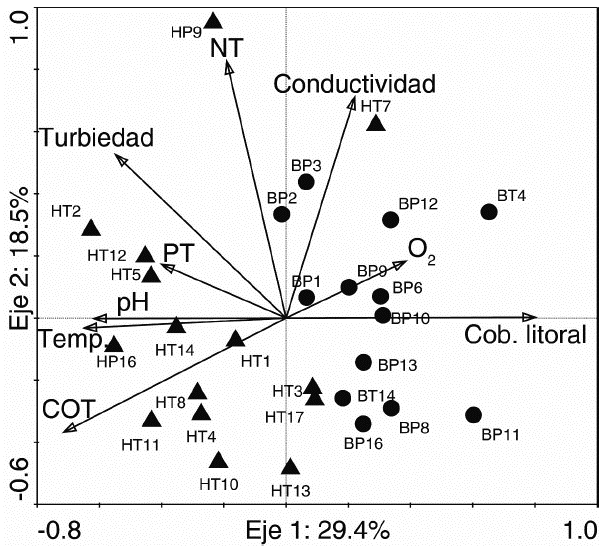
Figura 3 Biplot de los dos primeros ejes de un Análisis de Componentes Principales que describe las relaciones entre las variables físicas y químicas. Humedales con vegetación litoral herbácea se representan con triángulos, y humedales con litoral arbóreo con círculos. En el apéndice 1 se describen las siglas de cada una de las muestras.
La descripción física de los sistemas mostró que el grado de cobertura litoral también se relacionó con la temporalidad de los humedales, el tipo de humedal y el tipo y número de sustratos (Fig. 4). Así, la mayoría de humedales fueron sistemas lénticos y los humedales con mayor cobertura boscosa fueron permanentes. Por otro lado, las macrófitas representaron el sustrato dominante y el número de sustratos aumentó con el porcentaje de cobertura riparia arbórea (Fig. 4).
Descripción de las comunidades algales y su diversidad
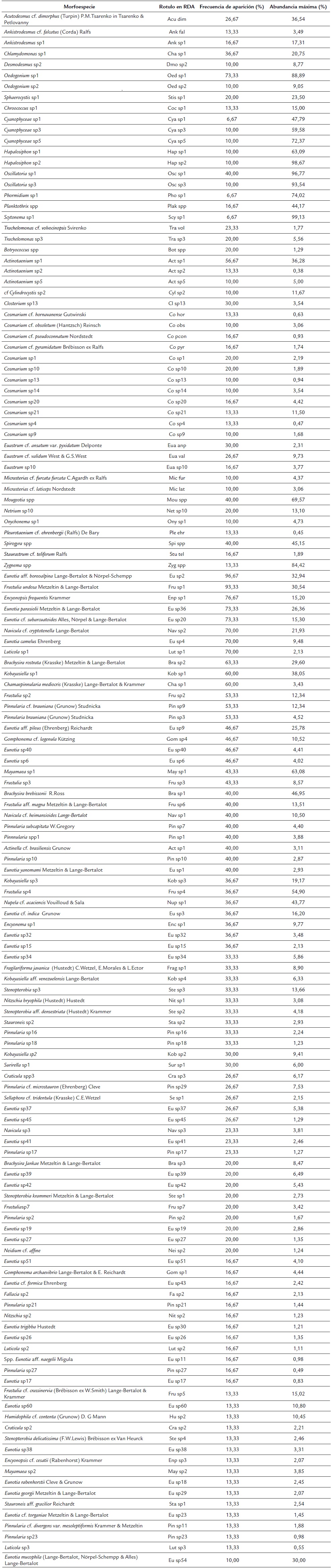
Se encontraron 467 morfotipos de microalgas perifíticas. El 36,2 % perteneció a la clase Zygnematophyceae, el 35,3 % a Bacillariophyceae, el 11,5 % a Chlorophyceae y el 8,5 % a Cyanophyceae. El 8,5 % restante correspondieron a las clases Glaucophyceae, Florideophyceae, Klebsormidiophyceae, Trebouxiophyceae, Dynophyceae, Rhodophyta, Ulvophyceae, Euglenophyceae, Chrysophyceaey Bangiophyceae. Se encontraron 165 morfoespecies de diatomeas, distribuidas en 16 familias y 30 géneros, de los cuales Eunotia representó la mayor riqueza con 53 morfoespecies (32 %), seguido de Pinnularia (16 %). Con respecto a los 81 géneros de otros grupos que no pertenecen a diatomeas, Cosmarium y Euastrum fueron los más representativos con 38 y 24 morfotipos, respetivamente. Las microalgas de la clase Cyanophyceae fueron las más abundantes (50,2 %), especialmente de los géneros Oscillatoria y Hapalosiphon. En cuanto a las diatomeas, los géneros de mayor abundancia fueron Eunotia (38 %) y Frustulia (14 %), con las especies Eunotia aff. boreoalpina Lange-Bertalot y Nõrpel-Schempp y Frustulia undosa Metzeltin y Lange-Bertalot como las más representativas (Apéndice 2).
En general, Cyanophyceae fue el grupo más abundante, tanto en humedales con vegetación riparia herbácea como en humedales asociados a bosques, excepto en los ecosistemas BP16 y HT17, donde dominó la clase Ulvophyceae. En BP2 dominaron las clorofíceas, en BP3 las diatomeas, en BT14 prevaleció una especie de rodófita, y en HT2, HT5, HT3 y HT8 predominaron las desmidias (Zygnematophyceae).
En humedales con litoral herbáceo se encontraron 232 morfotipos de microalgas perifíticas y 147 de diatomeas, mientras que en litorales boscosos se encontraron 190 morfotipos de microalgas y 129 de diatomeas. En humedales con litoral boscoso, Cyanophyceae y Chlorophyceae fueron más abundantes. En cuanto a las diatomeas, Eunotia y Brachysira fueron las más abundantes. Por otro lado, los humedales con litoral herbáceo presentaron más abundancia de desmidias y de los géneros de diatomeas Frustulia y Pinnularia (Apéndice 2).
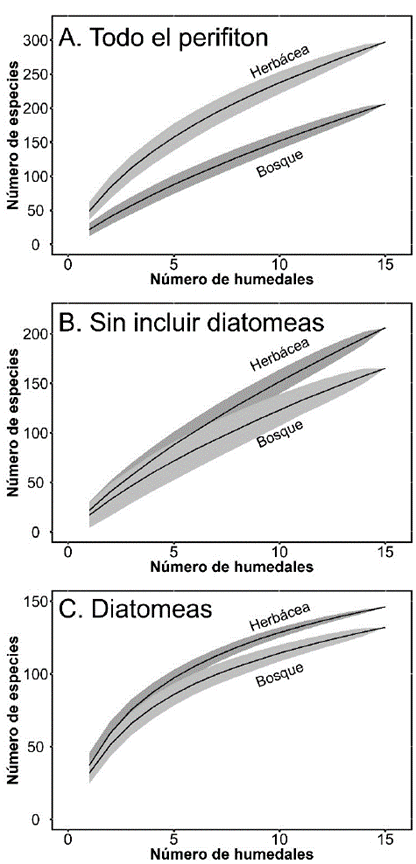
Las curvas de acumulación de especies y los estimadores de riqueza muestras que existe una gran diversidad de algas esperada en estos humedales (Fig. 5). De acuerdo con los estimadores existe un remanente de especies faltantes entre el 16 y 26 % en los humedales con litoral herbáceo; y entre 23 y 31 % en los humedales con cobertura de bosques.
Relaciones entre la estructura de las comunidades algales y el ambiente
En ARD desarrollado con las diatomeas mostró que las variables ambientales incluidas explicaron una baja variación de las especies (Tabla 2, Fig. 6). Las únicas variables significativas en el modelo fueron la cobertura de la zona litoral y el COT, separando los humedales según el tipo de cobertura a lo largo del primer eje.
Tabla 2 Variabilidad de las comunidades de algas descrita mediante un Análisis de Correspondencia sin tendencia (ACD) y relación de las especies con las variables ambientales mediante un Análisis de Redundancia (ARD)
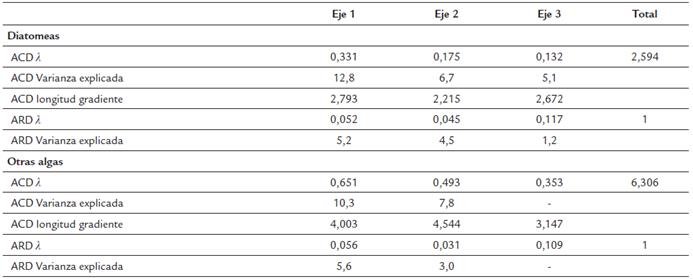
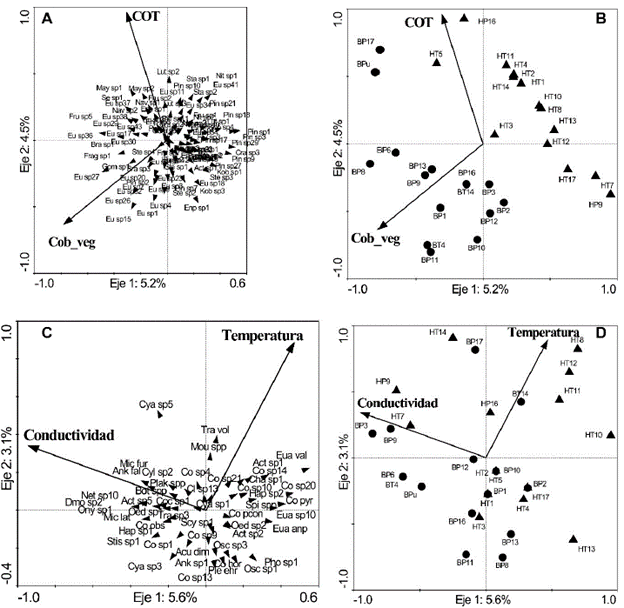
Figura 6 Análisis de redundancia de la relación entre las principales variables ambientales estudiadas con las diatomeas (A y B) y las demás algas (C y D). Humedales con vegetación litoral herbácea se representan con triángulos, y arbórea con círculos. En los apéndices 1 y 2 se describen las siglas de cada una de las muestras y especies. Cob_veg: Cobertura vegetal arbórea, COT: Carbono orgánico total.
Especies de los géneros Luticola, Nitzschia, Neidium, Pinnularia, Navicula y Stauroneis se asociaron a los humedales en pastizales y con valores más altos de COT, mientras que especies de Actinella y Craticula se relacionaron con valores bajos de COT. En los humedales rodeados de bosque, el género Mayamaea se relacionó con alta concentración de COT, mientras que el Fragilariforma se relacionó con bajos valores. Por otro lado, Eunotia y Brachysira presentaron una tendencia a encontrarse en humedales con mayor cobertura boscosa. De acuerdo con esto, la abundancia de Mayamaea presentó una correlación significativa (Spearman) con el OD (r= -0,52, n=30) y el COT (r=0,45, n=30), Eunotia presentó una correlación con el pH (r= -0,38, n=30) y con la cobertura boscosa (r= 0,40, n=30) y Pinnularia con la cobertura boscosa (r= -0,41, n=30).
El ARD desarrollado con las demás especies del perifiton también mostró una baja explicación de la variabilidad de las especies (Tabla 2, Fig. 6). La conductividad y la temperatura fueron las dos variables que significativamente explicaron la distribución de las especies. En el diagrama de ordenación (Fig. 6), se observó que las algas Cyanophyceae sp5 y Mougeotia spp se asocian a altas temperaturas. Las desmidias se distribuyen a lo largo de la gráfica, encontrando Micrasterias furcata C.Agardh ex Ralfs, M. laticeps Nordstedt, Cylindrocystis sp2, Cosmarium sp4, Onychonema sp1 y Netrium sp10, asociadas a altos valores de conductividad. Zygnema spp, Actinotaenium sp2, Euastrum sp10, Pleurotaenium cf. Ehrenbergii (Ralfs) De Bary, Staurastrum cf. Teliferum Ralfs y varios morfotipos de Cosmarium, se asociaron a bajos valores de conductividad. Trachelomonas volvocinopsis Svirenko estuvieron asociada a altas temperaturas, a diferencia de algunas clorofíceas que se asociaron a valores altos de conductividad.
Patrones en la diversidad de las comunidades y su relación con las variables ambientales
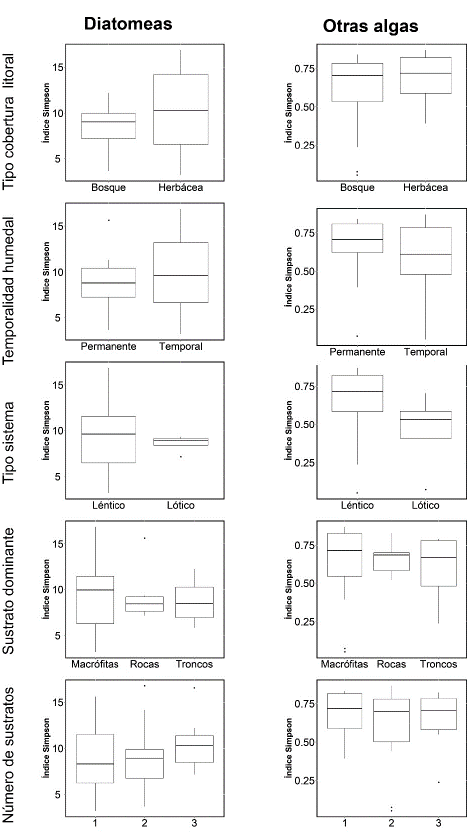
El índice de Simpson calculado para las diatomeas y las demás algas, no mostró diferencias significativas cuando se comparó con el tipo de zona litoral, de temporalidad, de sistema, sustrato dominante y número de sustratos (Fig. 7). Al relacionar el índice con el porcentaje de cobertura de vegetación arbórea, se observó una relación inversa (Fig. 8). Esta relación solo fue significativa con la comunidad de diatomeas cuando se incluyen los lagos con alguna presencia de vegetación arbórea (r2= 0,34 n=20). Al realizar un modelo de regresión lineal múltiple con las variables del hábitat (Tabla 3), se observó que mientras la cobertura arbórea tiene un efecto negativo sobre la diversidad, la temporalidad de los humedales y el número de tipos de sustratos presentes en la zona litoral, tienen un efecto positivo y significativo sobre la diversidad (Tabla 3).
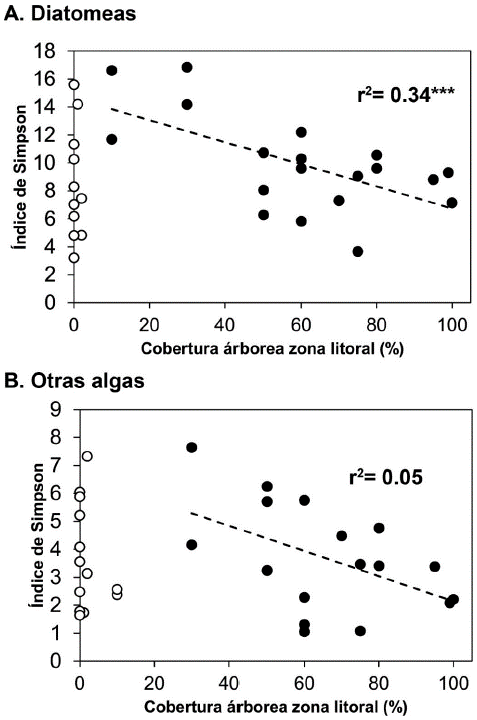
Figura 8 Relación del índice dominancia de Simpson y la cobertura de la zona litoral. Se presenta una regresión con coberturas >10 % para diatomeas (A) y >30 % para las otras algas (B).
Tabla 3 Modelos de regresión lineal entre la dominancia de Simpson y las características del hábitat para diatomeas (n=19) y las demás algas del fitoperifiton (n=17). EE: error estándar, Cob_veg: cobertura boscosa de la zona litoral, Tempor: Temporalidad de los humedales, No.Sustratos: Número de tipos de sustratos.

DISCUSIÓN
Descripción ambiental de los humedales
Los humedales se caracterizaron por presentar condiciones ácidas, baja conductividad y altas temperaturas (Tabla 1), lo que coincide con lo reportado para ecosistemas acuáticos de la región de la Orinoquía por Rivera-Rondón et al., (2010) y Sala et al., (2002) para otros ecosistemas en Colombia. Los humedales estudiados fueron en su mayoría oligotróficos, excepto BPu, BP17 y HT5, los cuales fueron hipereutróficos. BPu está altamente intervenido por las prácticas agropecuarias que se desarrollan en la Universidad de los Llanos. El alto estado trófico del humedal BP17 probablemente se deba a la actividad ganadera adyacente yala conectividad con un arroyo que le proporciona constante arrastre de materiales.
De acuerdo con el ACP, la temperatura de los humedales con litoral boscoso fue menor, debido a la sombra que proporcionan los árboles al espejo de agua. La reducción en la entrada de los rayos solares disminuye la absorción de energía en las capas superiores de la columna de agua y, por lo tanto, en el contenido calorífico (Roldán y Ramírez, 2008). Pese a la tendencia de separación de los humedales en el ACP a partir de la cobertura, la ausencia de diferencias estadísticas en otras variables, sugiere una alta variación en las condiciones locales. Los sistemas son en general pequeños, por lo que variaciones en los usos del suelo y en el tipo de cobertura litoral pueden causar una alta dispersión en las características físicas y químicas del agua.
Ecología de las comunidades algales
Cyanophyceae fue el grupo con mayor abundancia relativa. Este grupo se caracteriza por tolerar altas temperaturas, variaciones en la radiación solar y aumentos en las concentraciones de nutrientes. Además, son capaces de utilizar de forma más eficaz el nitrato y el amonio, cuando la limitación de nutrientes es más severa, lo que las hace menos susceptibles a los cambios ambientales (Vázquez et al., 2011).
Oedogonium (Chlorophyceae) fue el género más frecuente siendo registrado en 22 de 30 humedales. Este género presenta una alta capacidad de tolerar la desecación, la facilidad de adherirse a muchos tipos de sustrato (Lee, 2008) y la producción de estructuras resistentes como las zigosporas, que pueden permanecer latentes mucho tiempo antes de originar nuevos filamentos (Domitrovic et al., 2013). Por otro lado, la mayor riqueza de desmidias se relaciona con la abundancia de macrófitas (Sala et al., 2002), la baja concentración de nutrientes y la prevalencia de pH ácido en casi todos los humedales (Coesel, 1996; Rivera-Rondón et al., 2010).
Otro grupo abundante fueron las diatomeas, debido a sus estrategias de adhesión al sustrato (Round, 1991). La riqueza de los géneros Eunotia y Pinnularia indica bajo contenido de iones, pH ácidos y oligotrofia (Sala et al., 2002). Por el contrario, los ambientes fuertemente contaminados presentaron condiciones ligeramente ácidas y alto contenido de nutrientes, con alta dominancia de Mayamaea y Diadesmis confervacea Kützing. La relación observada entre los géneros Nitzschia, Frustulia y Mayamaea con el COT, coincide con la tolerancia de estos géneros a la contaminación orgánica (Spaulding y Edlund, 2008). Por su parte, Luticola tendió a preferir humedales con cobertura riparia herbácea, sistemas principalmente temporales, en donde su adaptación a condiciones de aerófila puede ser ventajosa (Lowe et al., 2007). Los géneros Eunotia y Brachysira tienen una tendencia a encontrarse en humedales con zona litoral de bosque, donde se mantienen las condiciones de luz, acidez y oligotrofia (Spaulding y Edlund, 2008; Furey, 2010).
Las variables estudiadas explicaron una baja porción de la varianza de las especies, tanto al analizar las comunidades de diatomeas, cómo las demás algas. Esto se explica por el corto gradiente ambiental en la mayor parte de las variables ambientales. No obstante, las diatomeas presentaron una relación significativa con la cobertura vegetal litoral y el COT, mientras que el resto de algas con la conductividad y la temperatura. La cobertura riparia incide directamente en la disponibilidad de luz en la zona litoral de los lagos, por lo que puede afectar distribución de las especies (Mosisch et al., 2001; Hill y Dimick, 2002; Vázquez et al., 2011). En este sentido, las diatomeas presentan conjuntos de especies que pueden responder a distintos niveles de luz en la zona litoral (Fonseca y Rodrigues, 2008; Sánchez et al., 2013).
Por otro lado, debido a que muchas especies de diatomeas son mixótrofas, estas suelen depender del carbono orgánico disponible en el medio acuático y usualmente muestran una relación estadística con esta variable (Antoniades et al., 2005).
La relación de la conductividad eléctrica y la temperatura con las especies del perifiton es explicada por el gradiente de mineralización y de temporalidad de los humedales. Sistemas más asociados a canales o ríos pueden recibir un mayor aporte de iones que repercute en diferentes aportes de micronutrientes y cambios en la turbiedad del agua (Bichoff et al., 2016). Asimismo, diferencias en el flujo de agua y la profundidad del ecosistema afectarán la temperatura, modificando la respuesta de las comunidades algales. La ausencia de relación entre la cobertura de la zona litoral y las demás algas perifíticas puede estar relacionada con la alta dominancia de cianofíceas. Este grupo tiene un conjunto de estrategias que le permite persistir en distintos tipos de ambientes y por lo tanto, su presencia depende principalmente de la historia sucesional del perifiton y no de su relación con las condiciones físicas y químicas del hábitat en un momento dado.
Factores que explican la diversidad del perifiton
La ausencia de relaciones significativas entre las características del hábitat y la diversidad ecológica (Fig. 7) se relacionó con la fuerte influencia en los datos, de humedales con muy bajas coberturas boscosas en la zona riparia. Al eliminar del análisis los lagos que solo tiene pastos en su zona litoral, se observó una relación inversa entre la diversidad de diatomeas y la cobertura arbórea. Asimismo, cuando se excluyen estos lagos se observa una relación significativa con la temporalidad de los sistemas y el número de sustratos (Tabla 3). Los lagos con muy baja cobertura están expuestos a otra serie de factores inadecuadamente cuantificados durante el estudio. La dominancia de pastos puede favorecer un mayor impacto de actividades ganaderas y agrícolas, cuya intensidad variará localmente afectando la respuesta de la diversidad ante las otras variables. Así por ejemplo, en esta región, la zona litoral de los humedales con vegetación riparia herbácea ha sido sometida a una compactación del sustrato por la entrada de ganado al cuerpo de agua, causando una fuerte modificación física que podría afectar el desarrollo de las comunidades perifíticas (Rial, 2006; Fonseca y Rodrigues, 2008).
La relación inversa entre la diversidad de diatomeas y la cobertura arbórea, puede ser explicada por una combinación de factores asociados a la disponibilidad de carbono orgánico. La cobertura arbórea no solo puede homogenizar el tipo de fuentes de carbono, sino que además puede reducir la disponibilidad de luz, afectando la diversidad de diatomeas. Por otro lado, un mayor número de sustratos puede promover un aumento en la diversidad. Así por ejemplo, la presencia de macrófitas que son sustratos claves para el establecimiento de las diatomeas perifíticas (Wetzel, 2001), puede promover el aumento de la diversidad. Finalmente, dentro de estos ambientes que están menos afectados por factores antrópicos, la temporalidad puede favorecer una mayor diversidad algal, al mantener condiciones moderadamente inestables, en donde más especies pueden tener la posibilidad de mantenerse en el tiempo.
Los resultados obtenidos no permiten dar una explicación robusta sobre la falta de relación entre la diversidad de los otros grupos algales y las características físicas y químicas de los humedales. No obstante, la alta dominancia de unas pocas especies de Cyanophyceae podría haber tenido un efecto importante. La alta dominancia ecológica influye en una adecuada caracterización de la diversidad algal, lo que puede afectar la observación de los patrones encontrados.
CONCLUSIONES
El tipo de cobertura de la zona litoral afectó la composición y diversidad de las comunidades de diatomeas, pero no tuvo un efecto significativo sobre las demás comunidades algales. La diversidad de las diatomeas perifíticas también es explicada por el número de sustratos y la temporalidad de los humedales.
Los resultados sugieren que los humedales localizados en zonas de pastizales están expuestos a una mayor cantidad de factores antrópicos, que afectan la observación de relaciones entre el perifiton y las características físicas y químicas del hábitat. No obstante, las relaciones significativas encontradas entre la composición y estructura de las comunidades de diatomeas y la cobertura de la zona litoral, sugiere que esta comunidad podría ser utilizada para monitorear el impacto de las actividades antrópicas sobre los humedales que aún no tienen su zona riparia muy alterada.