INTRODUCCIÓN
La seguridad alimentaria se ha convertido en eje principal para la supervivencia del planeta, dada la aumentada expansión demográfica y la decreciente disponibilidad de recursos alimenticios (FAO, 2017). El pescado juega un papel esencial, dado que puede reducir los índices de malnutrición por su contenido de aminoácidos esenciales, proteína de alta calidad, lípidos con ácidos grasos esenciales (EPA y DHA), vitaminas y minerales (Kris et al., 2002; FAO, 2016). Adicionalmente reduce el riesgo de enfermedades coronarias, diabetes e hipertensión y contribuye al desarrollo y crecimiento fetal (Fuentes et al., 2018).
La mayoría de metales como Mercurio (Hg), Plomo (Pb), Cadmio (Cd) e incluso el Arsénico (As); surgen de procesos de liberación al medio ambiente, producto de fenómenos naturales o actividades antrópicas (Nawab et al., 2018). No obstante, genera gran preocupación el Hg, toda vez que casi todo el que se acumula en el músculo de los peces, se encuentra en su forma más tóxica, el Metilmercurio (CH3Hg), logrando biomagnificarse en concentraciones miles de veces mayores a las encontradas en el agua y biodisponible a cualquier matriz (tejidos musculares y adiposos de los peces) (Nakamura et al., 2014; Salazar et al.,2017). La conversión del Hg a una forma orgánica como el CH3Hg, es el puente de entrada del metal a las cadenas alimentarias acuáticas que culminan en el consumo humano (Hsu et al., 2013).
De acuerdo con el Programa de las Naciones Unidas para el Desarrollo (PNUD), en Colombia, y particularmente en las poblaciones ribereñas y costeras, el 90 % del consumo de proteína de origen animal proviene del pescado, principalmente como resultado de un acceso muy bajo a otro tipo de proteínas. Sin embargo, los niveles de contaminación que se reportan en ríos como el San Jorge, Cauca y Magdalena, han limitado el consumo de esta fuente alimenticia a la población (Fuentes et al., 2018).
Atendiendo a lo anterior y partiendo de los múltiples estudios que confirman la presencia de estos contaminantes en peces de consumo, incluso en zonas no mineras, como la región de La Mojana, ubicada en el Norte de Colombia, se pretende realizar una revisión bibliográfica que permita entender la dinámica entre la afectación ambiental y el riesgo a la salud de los colombianos.
METALES PESADOS
Biocinética en peces
Mercurio y metilmercurio
En ambientes acuáticos, el Hg inorgánico se transforma principalmente a través de microorganismos en un compuesto orgánico lipofílico (CH3Hg), gracias al enlace C-Hg presente en las moléculas de CH3Hg que se forman, esta característica lo hace más propenso a la biomagnificación en las cadenas alimenticias (Hsu et al., 2013); al tiempo que le confiere una alta facilidad para atravesar membranas y distribuirse en diferentes órganos de un ser vivo, entre estos los seres humanos que consumen alimentos contaminados, como el pescado. De Carvalho et al., (2014), señalaron que el Hg orgánico, especialmente el CH3Hg, utiliza las enzimas y proteínas del pez, para mediante sus grupos sulfhidrilo, ingresar y fijarse en el cuerpo de este.
En los peces se atribuye a la dieta o hábito alimenticio de la especie, un factor fundamental para el ingreso de contaminantes, toda vez que se reporta que más del 10 % del Hg orgánico, principalmente CH3Hg, se encuentra en el zooplancton, eslabón primario de la cadena alimenticia (De Carvalho et al., 2014). Marrugo et al., (2008) concluyeron, luego de analizar las concentraciones de Hg y CH3Hg en P. magdalenae (Bocachico), P. surinamensis (Pacora) y H. malabaricus (Moncholo), especies consumidas por habitantes cercanos al municipio de Montecristo (Bolívar, Colombia), que estas guardan relación con el hábito alimenticio, señalando que las mayores concentraciones se encontraron en los peces carnívoros, con una alta proporción de Hg en forma de CH3Hg.
Biocinética en humanos
Mercurio y metilmercurio
Tanto el Hg como el CH3Hg, luego de ser generado por procesos naturales y/o antrópicos (Gusso-Choueri PK et al., 2018), logran ingresar a la cadena trófica, a través de las bacterias, fito y zooplancton, peces con hábitos alimenticios que los posesionan al inicio de la cadena trófica, seguidos por quienes los supera en el nivel trófico o directamente por el ser humano.
Una vez se encuentra disponible, el Hg ingresa al organismo a través del tracto gastrointestinal, el sistema respiratorio y/o por vía cutánea. Rice et al., (2014), reportan que las especies orgánicas del Hg solo pueden ingresar a través de la ingesta de matrices contaminadas y su absorción podría superar el 90 %; posterior a esto, el tóxico comienza un proceso de metabolización intracelular que impide su fácil eliminación. Aunado a lo anterior, las especies orgánicas de Hg pueden atravesar las barreras hematoencefálicas produciendo encefalopatías graves (Aschner y Aschner, 1990). Budtz et al., (2004), indicaron que el CH3Hg se une a la hemoglobina y dada su alta afinidad por la hemoglobina fetal produce una mayor concentración de Hg en la sangre del cordón umbilical que en la sangre materna. Rice et al., (2014), consideran que los procesos de eliminación de CH3Hg a través de la orina son insuficientes; se estima que la vida biológica del CH3Hg es de 39 a 70 días.
Otros metales y Arsénico
Dentro de las fuentes antrópicas del Cd, se incluyen las emisiones industriales, los agroquímicos, los lodos cloacales y aguas residuales suministrados a cultivos destinados al consumo humano (Faroon et al., 2012). La ingesta de pescado contaminado se considera una fuente fundamental en el ingreso y aumento de niveles de Cd en las poblaciones humanas, la mayor parte del metal se encuentra en su forma mayormente absorbible el cloruro de cadmio (CdCl2), reportando eficacia de absorción gastrointestinal entre 3-8 % de la carga ingerida (Faroon et al., 2012).
El Pb es producto de procesos erosivos de la superficie terrestre y la deposición atmosférica. Las fuentes antrópicas son las labores en refinerías de plomo, industrias de fundición, manipulación de plásticos y plantas de fabricación de baterías (Goyer y Clarkson, 2001; Járup, 2003). Cuando se encuentra disponible, el Pb ingresa al organismo a través de la ingesta, la inhalación, la absorción y por deglución; puede ser transportado a través del sistemas circulatorio al resto de los órganos (Goyer y Clarkson, 2001; Castro y Méndez, 2008).
El As, es un constituyente natural de los diferentes compartimientos ambientales (suelo, rocas, agua, aire, alimentos). Químicamente, se puede encontrar en forma orgánica, formada cuando los iones se combinan con carbono e hidrógeno, esta forma se encuentra principalmente en peces y mariscos; el As inorgánico, se encuentra en aguas subterráneas, que muchas veces son consumidas por pobladores de países subdesarrollados (ATSDR, 2007).
RIESGO A LA SALUD HUMANA
Los efectos adversos para la salud son el resultado de la especificación del metal acumulado en el cuerpo, el grado de exposición (cantidad, frecuencia y duración) y la edad del sujeto (Clarkson y Magos, 2006; Kim et al., 2016). Járup, (2003), considera que las mujeres en edad fértil tienden a acumular mayor cantidad de contaminantes, a causa de los cambios hormonales, procesos de gestación, ciclos menstruales y cantidad de grasa corporal.
Mercurio y metilmercurio
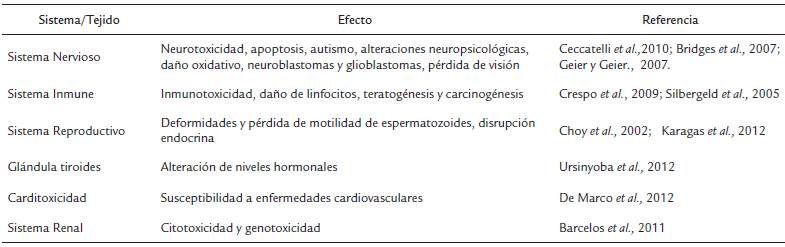
Von Stackelberg et al., (2017), indican que contaminantes como el CH3Hg, podría incidir en la proliferación de células carcinogénicas, enfatizando que estas consecuencias no siempre guardan proporción con la edad del organismo. Karri et al., (2018), afirman que el CH3Hg funciona como un potente agente neurotóxico, que ingresa a través de la dieta y logra ser absorbido por vía tracto gastrointestinal al mismo tiempo que los nutrientes esenciales, transportándose activamente a través de la barrera que separa el fluido sanguíneo del sistema nervioso central (barrera hematoencefálica). Budtz et al., (2004), realizaron seguimiento a niños cuyas madres las sometieron a exposición prenatal durante su vida intrauterina. Luego de más de siete años de estudios, al analizar el coeficiente intelectual de los niños, a través de modelos de ecuaciones estructurales que estimaban la imprecisión analítica total y, las concentraciones de Hg en cabello y sangre (2,2 - 8,8 y 13,5 mg/L), encontraron una correlación inversa. Algunos otros efectos del Hg y CH3Hg sobre los diferentes sistemas de un organismo, se detallan en la Tabla 1.
Tabla 1 Algunos efectos del Hg y CH3Hg sobre los diferentes sistemas y tejidos de un organismo, reportados por diversos autores.
Recientemente la Unión Europea (UE, 2017), realizó una revisión de los niveles máximos permisibles (mg/kg peso fresco) de metales pesados en productos alimenticios; esta regulación es matriz para la normatividad nacional de los diferentes países sometidos al acuerdo o que pretendan emprender comercios transfronterizos. Se estableció que para el Hg, el contenido máximo permisible en carne de pescado debe ser de 0,5 mg/kg peso fresco. Similar limite consideró el Codex Alimentarius (UNEP y WHO, 2008). En cuanto a la ingesta semanal, la Joint FAO/World Health Organization (WHO) Expert Committee on Food, Additives (JECFA) en 2006, estableció como valor sensible para mujeres en edad fértil y niños concentraciones de 1,6 Mg/kg de peso corporal, mientras que para el resto de la población tasas de ingestión semanal de 3,2 Mg/kg de peso corporal.
Van et al., (2013), luego de monitorear el CH3Hg acumulado naturalmente en peces (Esox lucius) de un lago canadiense y que posteriormente fueron trasladados a otro lago, estimaron que la vida media del Hg en el músculo de ese pez es de 3,3 años, corroborando de esta manera, lo paulatino del proceso de eliminación de este tóxico en los peces. La conclusión de este estudio podría sugerir que no es conveniente el consumo de peces grandes y longevos cualquiera que sea su especie, mucho menos si la especie posee hábitos carnívoros, toda vez que la eliminación del metal es mucho más lenta que su acumulación.
Otros metales y Arsénico
El Cd tiene una vida biológica de 17 a 30 años y su absorción aumenta con dietas bajas en hierro, calcio y proteínas (Castro y Méndez, 2008). Un estudio realizado en Pakistán muestra que las altas concentraciones de Cd, afectan la calidad seminal y fertilidad en los hombres (Zafar et al., 2015; Alamdar et al., 2016). El Cd en carne de pescado, solo es permitido para el consumo humano si su contenido máximo no supera los 0,050 mg/kg peso fresco (UE, 2017). La ingesta semanal aceptada por la JECFA, no debe superar los 420 Mg de Cd para una persona con peso promedio de 60 kg (FAO y WHO, 2005).
El Pb en los seres humanos podría acumularse principalmente en las estructuras calcáreas (dientes y huesos), afectando asimismo diferentes sistemas (gastrointestinal, neuro-muscular, renal y sanguíneo) e incluso atravesando la barrera hematoencefálica y la placenta, de manera que su acción en el organismo fácilmente conlleva a la muerte (Alamdar et al., 2017). Para el Pb tanto la Unión Europea como el Codex Alimentarios coinciden en afirmar que 0,30 mg/kg peso fresco en el músculo de los peces de consumo humano, es suficiente para representar algún tipo de riesgo a la salud (FAO y WHO, 2007; UE, 2017). La JECFA establece como valor de ingesta semanal tolerable provisional para el Pb 0,025 mg/kg por peso corporal.
Los contenidos de As en el agua de consumo, alimentos y/o aire, representan la posibilidad de afectaciones a la salud, tales como: formación de verrugas y callos (hiperqueratosis), melanosis manchada, pigmentación de la piel, cáncer de pulmón, enfermedades cardiovasculares e incluso infertilidad (Mohmand et al., 2015). Cuando la exposición es producto de la ingesta de alimentos contaminados (pescado), sus afectaciones se podrían expresar con lesiones en la piel, disfunción del sistema renal, pulmonar, esquelético y reproductivo (Ahmed et al., 2015). De acuerdo con la JECFA la ingesta semanal tolerable provisional para el As inorgánico es de 0,015 mg/kg (FAO y WHO, 2005). No obstante, la European Food Safety Authority (EFSA) afirma que se han reportado efectos negativos en la salud humana, por concentraciones entre 0,002 - 0,007 mg/kg/ día (Oliveira et al., 2017).
Karri et al., (2018) al evaluar la citotoxicidad de cuatro metales pesados: Plomo (Pb), Arsénico (As), Cadmio (Cd) y Metilmercurio (CH3Hg), durante diferentes tiempos de exposición; lograron concluir que la mayor potencia para generar una muerte celular programada, se encontraba en el CH3Hg > As >Cd > Pb, resaltando así, el efecto neurodegenerativo del contaminante.
METALES EN PECES DE COLOMBIA
A nivel mundial la FAO, (2016) reportó un consumo aparente de pescado per cápita de 19,7 kg/año para 2013, con estimaciones que apuntan a un aumento de estas cifras para los próximos años. En este mismo informe la FAO afirma que el pescado proporcionó casi el 20 % de la ingestión per cápita promedio de proteína de origen animal a cerca de 3100 millones de personas. En Colombia, el consumo per cápita es de 4,73 kg/año, muy por debajo del promedio de América Latina (18 kg/año) pero superando por poco la ingesta de los Estadounidenses en 2010 (4,42 kg/año) (MADR y FAO, 2015). De acuerdo con la Encuesta Nacional de Situación Nutricional (ENSIN, 2010), solo el 26,9 % de los colombianos consume pescados o mariscos semanalmente.
Estos datos llevarían a pensar que el riesgo a la salud por consumo de pescado contaminado con metales pesados, de una población como la colombiana es bajo; sin embargo, el consumo de pescado en el país es regionalizado, presentando alto consumo en zonas donde la oferta o poder adquisitivo de otras fuentes proteicas es escaso, por ejemplo en zonas ribereñas y costaneras (MADR y FAO, 2015).
Actualmente, Colombia enfrenta uno de los mayores problemas por contaminación ambiental a nivel mundial, causado en gran parte por el abuso de sustancias químicas en la explotación de minerales, mala disposición de aguas servidas y prácticas industriales y agrícolas inadecuadas realizadas en cuerpos de aguas naturales (Pinedo et al.,2015).
Se estima que en el país, la extracción de oro es la principal contribuyente de la contaminación por Hg en los cuerpos de agua (Marrugo et al., 2015a). Cordy et al., (2011), mostró que en Colombia cerca del 50 % del Hg utilizado en los pequeños molinos de bolas de la minería aurífera, se pierde; al igual que el 46 % en los lavados y el 4 % en la amalgamación. Ellos señalan que el país ha llegado a emitir hasta 150 toneladas anuales de Hg, lo que lo posiciona como el mayor contaminante per cápita de Hg en el mundo, producto solo de la extracción artesanal del oro.
Desde hace algún tiempo, la comunidad científica ha manifestado gran interés en demostrar el aumento de procesos bioacumulativos de sustancias tóxicas en los principales alimentos de la población. Los peces en particular han sido objeto de la mayoría de las investigaciones, para evidenciarlo se recopiló de manera resumida los resultados de los estudios desarrollados en Colombia, durante los últimos diez años y disponibles en las bases de datos estructuradas como SciVerse Scopus, SpringerLink, Web de Knowledge, Taylor & Francis, Pubmed y Google Académico, utilizando palabras claves como Hg, MeHg, Pb, Cd, As, Fish, Colombia. La Tabla 2, presenta las concentraciones medidas en Mg/g de Hg, Pb, Cd y As, en diferentes especies de peces de cuerpos de agua naturales y centros de abastecimientos alimenticios de la población.
Tabla 2 Resumen de Concentraciones promedio de metales pesados (pg/g, peso húmedo) en músculo de peces de Colombia.
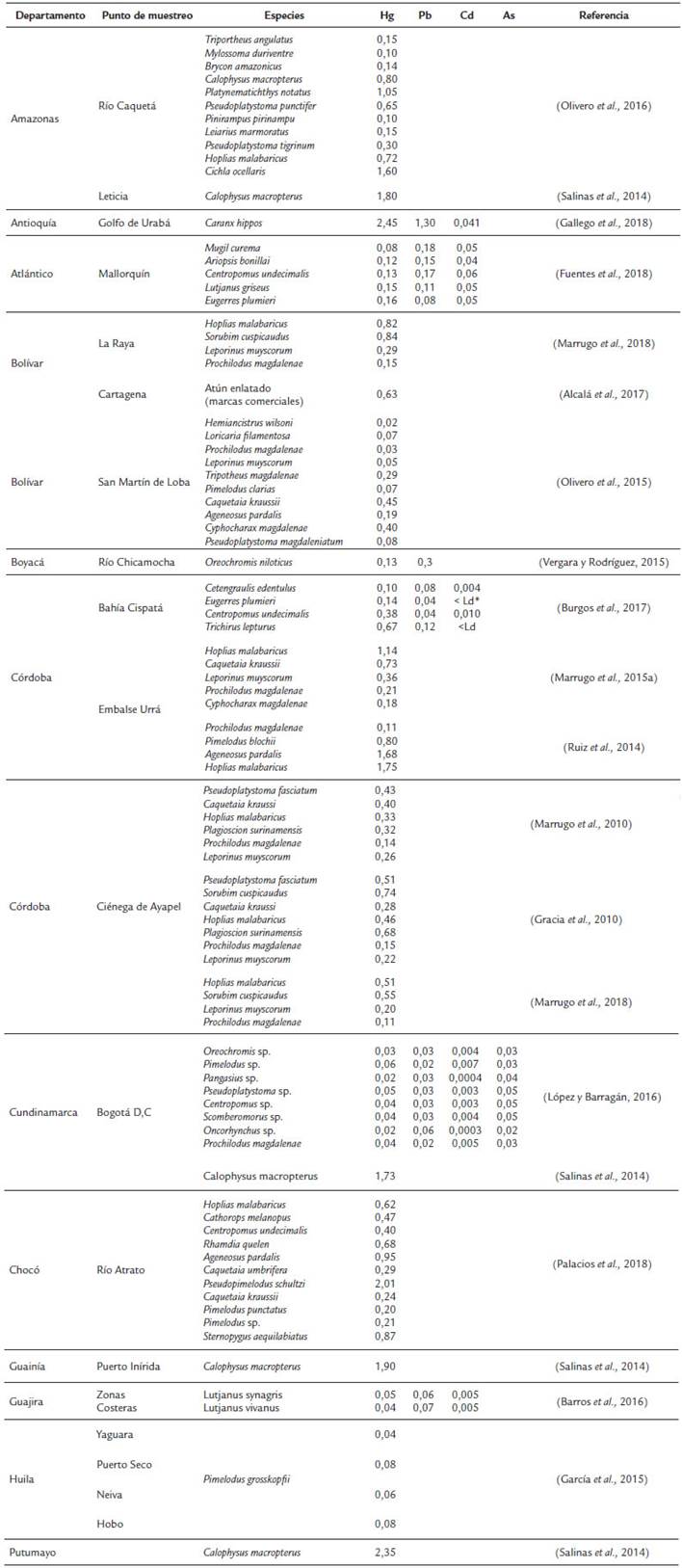
* Ld = Límite de detección (μg/g) Cd: < 0,004.
En Colombia, la legislación que regula los metales pesados tiene su eje central en las afectaciones que estos causan a la salud humana a través de procesos de bioacumulación. A partir de aquí, se establecen normas entre el Ministerio de Ambiente y Salud y Protección Social, como la Ley 1658 de 2013 por la cual se establecen disposiciones para el comercio y uso de Hg, la Resolución 122 de 2012 por medio del cual se reglamentan los límites máximos de metales pesados, excepto el As, en el pescado de consumo humano (Pb: 0,3 mg/kg ; Cd: 0,05 mg/kg; Hg: 0,5 mg/kg) y la Norma Técnica Colombiana (NTC) 1443 que promulga los límites para consumo humano (Pb: 0,4 mg/kg; Cd: 0,1 mg/kg; Hg: 0,5 mg/kg). La técnica más utilizada para la determinación de metales como el Hg en Colombia y el mundo, es la espectroscopia de absorción atómica con la técnica de vapor frío (Marrugo et al., 2018), aunque se reportan la espectrometría de masas con plasma acoplado (González, 2015). Los métodos por los cuales se determinan los metales, también se encuentran regulados en el país, bajo la NTC 1322 (Pb: AOAC 972,23.; Cd: AOAC 945,58 y AOAC 973,34.; Hg: AOAC 977,15.); no obstante, resulta curioso que en ninguno de estos documentos se reporte el límite para el As, ni se establezca límites diferentes para poblaciones con mayor grado de vulnerabilidad (niños, mujeres en edad fértil, embarazadas y consumidores frecuentes).
En consecuencia, las conclusiones de aquellos estudios que han determinado las concentraciones de metales pesados en peces de consumo en Colombia, resaltan frecuentemente la vulnerabilidad de niños y mujeres en edad fértil y, recomienden a grupos sensibles como mujeres embarazadas, evitar el consumo de especies carnívoras como H. malabaricus (Moncholo) y A. pardalis (Doncella) (Ruiz et al., 2014). En un estudio desarrollado en el Río Caquetá, la conclusión para disminuir el riesgo de exposición al Hg de las poblaciones indígenas de la Amazonía, fue reducir la ingesta de peces y restringir la lactancia materna, además de controlar la extracción de oro en estas zonas (Olivero et al., 2016). Alcalá et al., (2017) luego de determinar las concentraciones de Hg en latas de atún de diferentes marcas comercializadas en la ciudad de Cartagena (Colombia), resaltó que el 15,5 % de las muestras excedió el límite de la regulación colombiana para enlatados (1,0 Mg/g) y el 18,3 % cuando se evaluó con el límite FAO y WHO (0,5 Mg/g), con esto concluyó que el consumo de Atún enlatado podría representar un alto riesgo para poblaciones vulnerables. Fuentes et al., (2018) al evaluar el riesgo por consumo de pescado importado en mercados de Barranquilla (Colombia) concluyó luego de determinar la cantidad máxima de Atún enlatado que debería consumir una persona, que no se debería ofrecer en la dieta de niños atún enlatado, las embarazadas no deberían consumir más de una lata por semana y el resto de la población debería consumir máximo tres latas semanales.
Sin embargo, el riesgo no solo ha sido reportado por consumo directo de peces u otros alimentos contaminados, Gallego et al., (2018) concluyeron que la contaminación puede ser el reflejo de la transferencia de altas concentraciones de metales (hasta 77 %) que provienen de material de desecho combinado de especies como Caranx hippos (Jurel), en el ensilado o las harinas a base de materia prima contaminada (pescado) y que terminan alimentando otros peces, otros animales e incluso a los humanos.
De acuerdo con el Registro Minero Nacional (RNM), en Colombia hasta el año 2015 se habían otorgado 1058 títulos solo para explotación de oro, distribuidos entre 21 departamentos, liderados por Antioquía (435), Bolívar (183), Caldas (142), Tolima (59) Santander (50), Nariño (41) y Chocó (40) (UPME, 2015). Ahora bien, si se considerara cada punto de muestreo de los estudios referenciados (28, ver Tabla 2) como una unidad porcentual del total de los estudios citados en Colombia durante los últimos años y se comparara con el reporte que realiza la Unidad de Planeación Minero Energética (UPME, 2015), del histórico de producción aurífera y específicamente los títulos mineros por departamento que se otorgan, se podría afirmar que más del 90 % de los estudios reportados y disponibles, se ejecutaron en zonas No productoras de oro, que se estima es la principal forma de minería donde se utiliza Hg como insumo principal. El valor de referencia utilizado para discernir el grado de afectación de las poblaciones ubicadas, en su mayoría, en zonas no mineras, fue el establecido por la Organización Mundial de la Salud 0,5 Mg/g. El 31,5 % de los resultados publicados registran valores por encima del límite permisible recomendado por la OMS.
A nivel nacional un eje referencial para determinar los efectos colaterales del uso de metales pesados en las actividades mineras e industriales, es la región de la Mojana, con jurisdicción en los departamentos de Córdoba, Sucre, Antioquia y Bolívar; esta zona está sujeta a una fuerte presión antrópica que incluye la descarga en su interior de grandes cantidades de aguas residuales, domésticas y sustancias contaminadas con Hg y CH3Hg, que podrían provenir de procesos de extracción artesanal de oro en las zonas mineras del sur de Bolívar, norte de Antioquia y parte alta del río San Jorge, teniendo en cuenta que esta no es una zona de explotación minera intensiva (Marrugo et al., 2018).
Marrugo et al., (2010), registraron en el 13,5 % de las muestras de músculo de peces con diferentes hábitos alimenticios de la Región de la Mojana, presencia de Hg en concentraciones que excedían el límite máximo permisible para el consumo humano, recomendado por la OMS (0,5 mg/g de peso fresco). Otra señal de alerta para esta población fue emitida por Calao y Marrugo, (2015), quienes evaluaron la genotoxicidad de moradores de una zona de la región de la Mojana, expuestos a residuos de metales pesados, encontrando asociaciones significativas entre la presencia de Hg y daño en el ADN.
CONCLUSIONES
Los resultados presentados en este manuscrito evidencian la urgente necesidad de realizar estudios que evalúen el riesgo a la salud que enfrentan los pobladores de zonas mineras y no mineras de Colombia, teniendo en cuenta que podrían ser herramientas fundamentales para evaluar aspectos de toxicología ambiental y riesgo a la salud humana, al tiempo que permite inferir el efecto que puede llegar a tener una actividad minera en la alimentación adecuada de las poblaciones.
Asimismo, esta revisión permite dilucidar que parte del problema de las regiones mineras y no mineras afectadas, surge de una dicotomía socio-espacial, al colocar en un mismo plano, las grandes poblaciones que dependen del recurso íctico y la población asociada a fuentes de contaminación con metales pesados, como la agricultura y la minería; interviniendo ambas en la inocuidad y seguridad alimentaria en la región, inhibiendo cualquier acción que contribuya al cumplimiento de los Objetivos de Desarrollo Sostenible (1: Fin de la pobreza, 2: Hambre cero y 3: Salud y Bienestar) planteados en la Agenda 2030.
Las concentraciones de los metales pesados analizados en el músculo de los peces de consumo, permite evidenciar el riesgo de la población colombiana, al tiempo que aporta fundamentos científicos y bases para el establecimiento de ejes estratégicos para la puesta en marcha de nuevos proyectos productivos, que ofrezcan el acceso de la población a diversas fuentes de alimentación.















