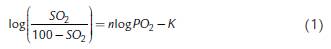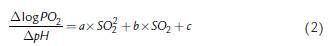INTRODUCCIÓN
La condición para el suficiente aporte de oxígeno a los tejidos es la existencia de la molécula transportadora, hemoglobina, en los eritrocitos. Esta liga el oxígeno en los pulmones reversiblemente y lo entrega a los tejidos. Las propiedades funcionales que son influenciables por diferentes factores (construcción molecular de la Hb, fosfatos, temperatura, ácidos, entre otros) se pueden medir mediante la determinación de la curva de asociación al oxígeno (dependencia de la saturación porcentual de la presión parcial de oxígeno). Los parámetros decisivos son la forma sigmoidal medida como la pendiente n en el diagrama de Hill y la posición de la relación SO2-PO2, medida como presión de oxígeno que logra el 50 % de saturación (P50), el cual se informa normalmente en condiciones estándar, es decir 37 °C, pH 7,4 y presión parcial de CO2 (PCO2) de 40 mmHg. Para el ajuste a estos valores se requieren los correspondientes factores de corrección para el efecto de ácidos y de la temperatura. Ya que el trabajo muscular, hipoxia y diferentes enfermedades modifican estos efectos, es de gran significado medir las modificaciones de la afinidad.
La determinación de la Curva de Disociación de Oxígeno (ODC) bajo condiciones fisiológicas es de crítica importancia en el estudio de las funciones respiratorias (Rossi-Bernardi et al., 1975). Fisiológicamente la hemoglobina no solo es importante en el transporte de O2 y de CO2, sino en el equilibrio ácido-básico de la sangre (Ferry, 1924). Mediante las propiedades de unión de la proteína al oxígeno es posible inferir la oferta de oxígeno en el ambiente que habitan los organismos de acuerdo con el medio que respiran. Hall y McCutcheon, (1938) determinaron que la hemoglobina del pez sapo, el cual vive en aguas abisales, presenta un traslado de la curva de equilibrio hacia la izquierda con relación a la curva desplazada completamente a la derecha del jurel, el cual habita aguas superficiales con mayores niveles de oxígeno disuelto. Cuando el medio ventilatorio es aire, una adaptación semejante se ha comprobado en camélidos suramericanos de gran altura (Chiodi, 1971).
En el establecimiento de la cinética de unión Hb: O2 han contribuido en forma independiente muchos fisiólogos (e.g. Christian Bohr y August Krog). La cuantificación de todos los valores que intervienen en la forma de la ODC (moduladores de la afinidad, presión parcial de oxígeno, saturación arterial) elevó el requerimiento de equipos debido a la obligada medición en forma separada de las variables, volviendo el procedimiento muy dispendioso. De otro lado, las muestras de sangre debían ser primero tratadas para producir soluciones puras de hemoglobina. Los protocolos, los reactivos, así como los equipos utilizados en el establecimiento de la CDO han sido de diferente índole, lo cual puede ser revisado en los estudios de Van Slyke, (1918), Sidwell et al., (1938), Drabkin y Schmidt, (1945), quienes llevaron a cabo las primeras investigaciones en la asociación Hb: O2.
Existen diferentes métodos para medir la curva de disociación, que nuestro grupo de trabajo ha empleado durante años. En las primeras investigaciones la sangre fue equilibrada con diferentes mezclas de gas (CO2 + O2) y el contenido de O2 posteriormente medido. El pH sanguíneo se ha calculado a partir de PCO2 y del correspondiente contenido de gas en la sangre. (Boning et al., 1975; Braumann et al., 1988). Una posibilidad adicional para esta determinación ha sido la mezcla de volúmenes de sangre totalmente saturada e insaturada con contenido de O2 conocido y medición posterior de PO2 y de pH (Meier et al., 1974), mediante lo cual se pueden obtener fácilmente una gran cantidad de puntos. Con modernos analizadores de gases sanguíneos se pueden determinar con mayor facilidad PO2, PCO2 y pH en lugar del contenido de oxígeno y de la saturación. Cuando se equilibra sangre simultáneamente con diferentes valores de PCO2, o se adicionan sales, o bien ácido láctico, se puede establecer el efecto Bohr para HCO3 o para ácidos fijos ((logPO2/(pH). Esto último, es lo que se ha hecho recientemente en pacientes con fibrosis quística (Boning et al., 2014).
También existen micro métodos, en los cuales pequeñas cantidades de sangre se disuelven con soluciones buffer (y con ello de pH conocido) en las cuales se mide fotométricamente la SO2 durante la adición de oxígeno (Asakura, 1979). La desventaja de este método es que el ambiente fisiológico del eritrocito (plasma sanguíneo) no está presente, por lo tanto estos métodos han sido reemplazados. La solución buffer fue modificada y se ha adicionado CO2 al gas de equilibración (Schmidt et al., 1987; Boning et al., 1991). Finalmente es posible medir modificaciones de SO2 y de PO2 in vivo en la sangre durante hipoxia o trabajo muscular, y a partir de ello, construir curvas de disociación (Boning et al., 1975; Braumann et al., 1979).
En este estudio, el método de mezcla ha sido simplificado ya que no requiere de un equipo de tonometría para equilibrar la sangre en valores fijos de PO2. Debido a que esta es una determinación clásica de la fisiología, resulta de gran importancia para estudiantes de las ciencias de la salud y de la vida como la biología y la medicina veterinaria conocer un método sencillo a través del cual sea posible estudiar los aspectos de los cuales depende la asociación Hb: O2. El propósito de este artículo es dar a conocer un método sencillo para establecer CDO mediante equipos que se han vuelto comunes en los laboratorios de fisiología en las universidades.
MATERIALES Y MÉTODOS
Muestra de sangre
El método simplificado fue desarrollado inicialmente en Bogotá para la ejecución en el ámbito de prácticas de laboratorio en las carreras de Medicina, Biología y afines. Una serie de determinaciones fue hecha con sangre venosa de un donante de sexo femenino con las siguientes características: 18 años de edad, un peso corporal de 45,0 kg, una talla de 1,50 m y un IMC de 20,0 kg/m2, siendo una atleta entrenada en pruebas de resistencia. La donante se presentó en las horas de la mañana al laboratorio y después de 10 min de reposo (sentada), la muestra de sangre (20 mL) fue retirada de la vena antecubital en tubos al vacío con EDTA como anticoagulante con aplicación de torniquete. La donante leyó y firmó el consentimiento informado, así como generalidades de los procedimientos, los cuales fueron aprobados por el comité de ética de la Facultad de Ciencias de la Universidad Nacional de Colombia (Acta No 01, del 22.02, de 2011). A continuación, describimos los principios del método a partir de la información recolectada de una única muestra de sangre.
Equilibración de la sangre con CO2 y N2
Para la determinación se requiere de un analizador de gases arteriales ABL720 (Radiometer, Copenhague, Dinamarca) o de aparatos equivalentes que puedan medir las variables de forma separada con capacidad de registrar simultáneamente PO2, PCO2, la correspondiente saturación (SO2) y el pH de la sangre. La muestra puede obtenerse de estudiantes del curso y la determinación puede llevarse a cabo simultáneamente en muestras de sangre provenientes de varios donantes. La sangre fue inicialmente transferida a jeringa de 20 mL y equilibrada con una mezcla de CO2 al 6,0 % y N2 al 94,0 % mediante suave y continua agitación en un tiempo de incubación arbitrario de 15-30 min con el propósito de desplazar el oxígeno de la hemoglobina y obtener así el menor valor de SO2 posible. Luego del paso de equilibración, los valores de SO2, PO2 y PCO2 fueron medidos en un analizador de gases arteriales a 37 °C para comprobar su reducción.
Equilibración de la sangre con O2 y tratamiento matemático
Una vez que el valor de SO2 alcanzó un rango bajo (10 - 20 %), en el paso anterior, la mezcla de gases fue desechada y pequeñas burbujas de oxígeno puro fueron adicionadas. Después de cada adición, el gas fue mezclado con la sangre y luego desechado, se aseguró que la PCO2 permaneciera casi constante. Durante la oxigenación de la sangre la PCO2 se redujo de 48,0 mmHg en el minuto 2 a 45,7 y en el minuto 18 a 4,8 % (ver Tabla 1). Los valores de SO2 y de PO2 fueron registrados cada 2,0 min. En el proceso de oxigenación de la hemoglobina, la jeringa fue girada suavemente para asegurar una mezcla progresiva y para que el resultado después de cada giro condujera a una pequeña elevación en los niveles de SO2 y de PO2, lo cual fue confirmado mediante la medición de los valores. El proceso de giro fue repetido hasta obtenerse una saturación cercana al 100 %. La medición fue realizada igualmente con una mezcla de gases de equilibración de CO2 12 % y N2 88 % para establecer el efecto Bohr. La curva resultante de la relación PO2 y SO2 fue convertida en una relación lineal de acuerdo con Hill mediante la siguiente ecuación:
Tabla 1 Valores en la equilibración de la sangre en el establecimiento de la CDO.
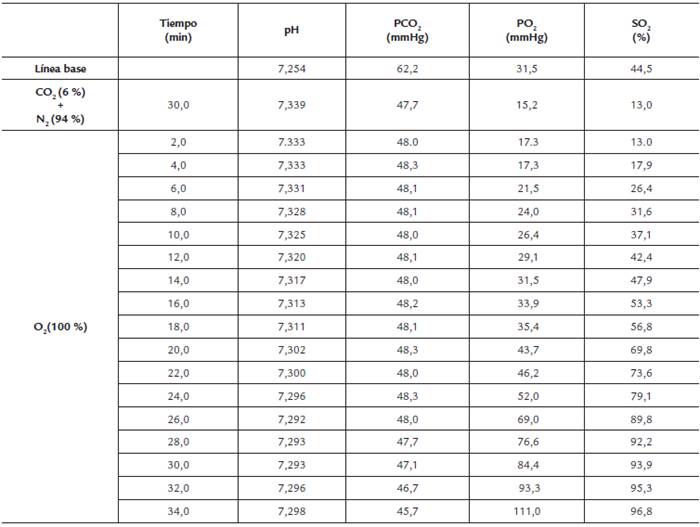
Valores de pH, presión parcial de oxígeno (PO2), de dióxido de carbono (PCO2) y de saturación arterial (SO2) después de 30 minutos de mezcla con CO2 (6,0 %) y N2 (94 %), así como saturación progresiva con O2 puro
Donde n es la pendiente, K el valor de logPO2 cuando SO2 es igual a 50 %, es decir el logaritmo en base 10 de la presión parcial de oxígeno que genera el 50 % de la saturación (P50). Para establecer el diagrama de Hill, una regresión lineal fue calculada de acuerdo con el siguiente procedimiento. Los valores de PO2 para niveles fijos de saturación desde 10 hasta 90 % fueron establecidos por interpolación. Del mismo modo, los valores de pH medidos para cada saturación se interpolaron para los niveles de saturación de 10 a 90 %. A partir de las diferencias entre logPO2 y las diferencias de pH para cada nivel de saturación entre las ODC para 6 y 12 % CO2 fueron calculados los coeficientes de Bohr (Dlog PO2 /DpH). Para esta relación se calculó la siguiente regresión cuadrática:
Donde a, b, y c son los coeficientes que se obtienen para el cálculo de una ecuación cuadrática. Para obtener la curva estándar de asociación y la presión estándar de saturación media (P50), todos los valores de PO2 fueron corregidos para niveles fijos de saturación a un pH de 7,4 mediante los coeficientes de Bohr obtenidos de esta forma. Todos los procedimientos fueron revisados y avalados por el Comité de Ética de la Facultad de Ciencias de la Universidad Nacional de Colombia. Los cálculos y tratamientos matemáticos fueron realizados en hojas de cálculo Excel, los valores presentados en las tablas son únicos y como ya se mencionó anteriormente, provienen de una sola muestra de sangre.
RESULTADOS
La Tabla 1 muestra la secuencia de valores obtenidos en un experimento típico durante la equilibración de la sangre con CO2 y N2, así como durante la reoxigenación. En el 80 % de los ensayos, el tiempo utilizado en la equilibración con CO2 + NO2 fue suficiente para alcanzar en un solo paso un nivel de desaturación suficientemente bajo para iniciar la mezcla con oxígeno puro. Los valores de PCO2 son elevados debido al torniquete utilizado para tomar la muestra de sangre y al tiempo en que esta reposó en la jeringa hasta el inicio del experimento. Para los resultados de la determinación estos valores son irrelevantes. Los niveles de PO2 y SO2 decayeron desde 31,5 mmHg y 44,5 % en la línea base respectivamente hasta 15,2 mmHg y 13,0 % después de 30 min de equilibración con 35 mL de mezcla de gases en los mismos parámetros. La PCO2 descendió desde 62,2 mmHg en la línea de base 47,7 mmHg después del periodo de equilibración. Como consecuencia de este cambio, el pH ascendió de 7,254 a 7,339. La PCO2 presentó una variación leve de 2,3 mmHg (Tabla 1) descendiendo desde 48 a 45,7 mmHg en la fase de reoxigenación de la sangre. La saturación de la hemoglobina incrementó en forma paulatina, lo que generó suficientes parejas de valores PO2:SO2 para establecer el transcurso sigmoidal de la asociación. En el rango fisiológico, la mayor saturación (96,8 %) se obtuvo con PO2 de 111,0 mmHg después de 30 minutos de equilibración.
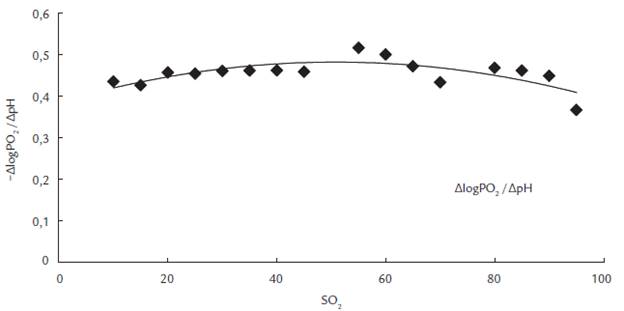
La reoxigenación de la sangre sucedió en ascensos leves, los cuales permitieron construir la curva de disociación estándar con un transcurso sigmoidal típico para la asociación Hb-O2 (Fig. 1). La acidificación de la sangre con CO2 en diferente fracción porcentual produjo curvas estándar con un transcurso tal, que no es posible diferenciar las condiciones de equilibración. De acuerdo con el transcurso de las curvas, la saturación de la sangre se muestra independiente del pH. Sin embargo, el logaritmo en las variables de la curva generó líneas rectas (Diagrama de Hill) con una clara separación para las dos fracciones porcentuales de CO2. Las rectas de Hill presentaron coeficientes de regresión elevados (0,999) con pendientes similares de 2,8 y 2,7 para condiciones de equilibración con CO2 de 6 y 12 % respectivamente (Fig. 2). El coeficiente de Bohr para acidificación con CO2 fue en promedio 0,43 y mostró una tendencia de incremento leve desde valores bajos hasta medios de saturación para decaer en valores elevados de saturación (Fig. 3).
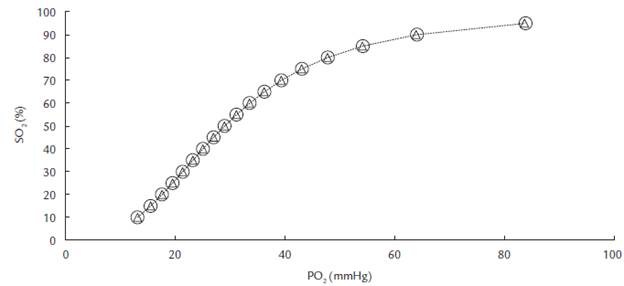
Figura 1 Curva de disociación estándar construida a partir de valores corregidos de PO2 para niveles fijos de saturación a pH 7,4. 2
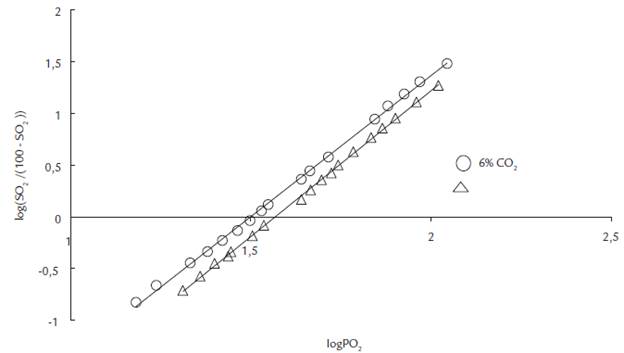
Figura 2 Diagrama de Hill para la mezcla de sangre con CO2 6,0 % + N2 94 % (ecuación de regresión: log(SO2 /(100-SO2)) = 2,81logPO2 - 4,41; r=0,999, círculos) y CO2 12 % + N2 88 % (ecuación de regresión log(SO2 /(100-SO2)) = 2,82SO2 - 4,09; r=0,999, triángulos).
DISCUSIÓN
A través el método propuesto se logró establecer la CDO de forma simplificada y con mínimos requerimientos de infraestructura. Las ventajas de su uso y aplicación son el poco tiempo requerido (64 min) en los pasos de equilibración y reoxigenación, que permite su implementación en prácticas de laboratorio. Este tiempo se puede reducir en cuanto se logre la experiencia necesaria para conocer la duración mínima de equilibración y disminuir igualmente el número de puntos. Adicionalmente no se necesitan gases de composición conocida o sistemas de mezcla, y con mayor experiencia, permite reducir el volumen de sangre necesario. Los valores de la muestra de sangre en la línea de base son característicos para sangre venosa, la cual tiene una baja SO2 y una elevada PCO2 con un pH acorde a los valores (ver Tabla 1).
Después de 30 min de contacto con el gas adicionado, el equilibrio de PCO2 y PO2 no fue completo, pero suficiente para la construcción de la CDO. De igual forma, la PCO2 disminuyó al 76 % con cambio de solo 0,08 unidades de pH, lo cual evidencia el fuerte poder amortiguador de la sangre y la importancia de la homeóstasis acido-básica en la función respiratoria (Boning et al., 2014). Las CDO con CO2 al 6 y al 12 % calculadas a pH 7,4, fueron casi iguales y presentaban la típica forma sigmoidal de la unión Hb: O2. Este transcurso se obtuvo en razón a una reoxigenación secuencial con elevación en pequeños incrementos en la saturación. La P50 estándar calculada de 29,5 mmHg es relativamente alta comparada con el valor generalmente aceptado de 27,0 mmHg (Obdahl et al., 2011). Sin embargo, en hombres se han registrado valores superiores de P50 (Boning et al., 1978; Schmidt et al., 1990; Balabana et al., 2013; Boning et al., 2014). La altura en hombres causa un incremento de la concentración del bifosfoglicerato, no obstante, en las mujeres la causa es aún desconocida.
Cuando la equilibración se hizo con CO2 al 12 %, el tratamiento matemático permitió discriminar en el diagrama de Hill el efecto de las distintas condiciones en la composición de la mezcla de gases en la equilibración. Las pendientes de las rectas o coeficientes de Hill de 2,8 y 2,7 para equilibración con CO2 al 6 y 12 % respectivamente son valores cercanos al rango teórico esperado de 2,8 - 3,4 (Holt y Ackers, 2009). La pendiente de un diagrama de Hill no determina el número de sitios de interacción de una proteína con su sustrato sino el grado de interacción o cooperatividad entre ellos. Si n es igual 1, la unión del ligando no es cooperativa. Un valor de n mayor que 1 indica cooperatividad positiva en la unión del ligando. Para el caso de la hemoglobina, el valor de n implica, que la unión de una molécula del ligando facilita la unión de otras (Lehninger, 2005).
El coeficiente de Bohr no está totalmente en concordancia con los valores ya determinados en la población colombiana habitante de la altura (Schmidt et al., 1990) y en pacientes con fibrosis cística (Boning et al., 2014), una enfermedad pulmonar con origen genético. Esta mutación se ubica en el cromosoma 7 (locus 7q31,2), la cual reduce en pacientes la efectividad de la conductancia transmembranal del regulador CFTR (Cystic Fibrosis Transmembrane Conductance Regulator), el cual es esencial para la secreción de cloro y consecuentemente agua en muchas células. En estas investigaciones, así como en varias anteriores, el valor absoluto AlogPO2 /ApH para acidificación con CO2 sube con saturaciones bajas. Si esta tendencia es diferente en habitantes con adaptación crónica a la hipoxia, es un tema que debe ser investigado en forma específica en mujeres, ya que Schmidt et al., (1990) establecieron en hombres el efecto de la hipoxia y del ejercicio sobre las propiedades de unión de la hemoglobina al oxígeno. Esta coincidencia en el transcurso de la CDO y el establecimiento de propiedades de unión de la hemoglobina al oxígeno (Coeficientes de Bohr y diagrama de Hill) evidencia la validez de nuestro método en lo que se refiere a la manipulación de la muestra de sangre, así como en la aplicación de las ecuaciones.
CONCLUSIONES
Mediante el método propuesto se obtuvo la CDO con un transcurso típico de la unión Hb:O2. El tratamiento matemático realizado permitió establecer los valores teóricos fijos de PO2 que pueden corresponden a condiciones experimentales. El tratamiento experimental y matemático propuesto es de fácil implementación en un laboratorio ya que requiere del uso de un solo aparato y de mezclas de gases de fácil consecución con proveedores comerciales. Este método permite el estudio de un tema clásico y obligado en la fisiología respiratoria, así como de su aplicación en la investigación sobre los efectos sobre la CDO de distintas condiciones como el ejercicio en población humana, la hipoxia ambiental en humanos y animales.