INTRODUCCIÓN
Las infecciones causadas por el virus Dengue (DENV) han ido en aumento durante las últimas cinco décadas, reportándose cifras que oscilan entre los 50-100 millones de casos de dengue en todo el mundo cada año; dicha enfermedad genera no solo un impacto importante en salud pública, sino, además, a nivel económico (Shepard et al., 2016). DENV es un virus con envoltura perteneciente al género Flavivirus (familia Flaviviridae) y su genoma, una cadena sencilla de ARN de polaridad positiva, codifica diez proteínas (tres estructurales y siete no estructurales) las cuales conforman la partícula viral infecciosa (Kunh et al., 2002).
En la actualidad, los virus con genoma ARN representan un reto en la búsqueda de antivirales debido a su alta tasa de mutación y baja estabilidad genética. Así mismo, al igual que los virus con genoma ADN, estos virus requieren de factores celulares para realizar prácticamente todas las etapas del ciclo replicativo, incluyendo: la entrada y desnudamiento, traducción del ARN, procesamiento de la poliproteína, replicación del genoma, ensamblaje y liberación de la progenie viral (Whelan, 2013). Por tal razón, estudios recientes demuestran la importancia de conducir la investigación antiviral a encontrar compuestos dirigidos hacia blancos celulares, ya que estos no seleccionan mutantes resistentes a los fármacos, pueden mostrar actividad antiviral de amplio espectro y tener mecanismos de acción complementarios a los antivirales de acción directa (Plummer et al., 2015).
La Quinasa Dependiente de Ciclina 5 es una serinina/treonina quinasa atípica, ya que no se ha demostrado su participación durante el ciclo celular, ha sido considerada tradicionalmente como una quinasa neuro-especifica (Shah y Lahiri, 2014). No obstante, en células epiteliales y endoteliales se ha reportado que CDK5, entre otras funciones, regula la dinámica del citoesqueleto (Arif, 2012; Hydbring et al., 2016). Componentes del citoesqueleto como filamentos de actina y microtúbulos, son necesarios para que se lleve a cabo la entrada, producción y liberación de muchos tipos virales, entre ellos el DENV (Zamudio-Meza et al., 2009; Wang et al., 2010; Shrivastava et al., 2011; Zhang et al., 2016; Cuartas et al., 2018), lo cual resalta la importancia del este complejo supramolecular para que se lleve a cabo una infección productiva.
Diferentes aproximaciones metodológicas se han empleado a través de los años para bloquear o suprimir el efecto de determinadas proteínas celulares, incluyendo la inhibición química con pequeñas moléculas o el uso de micro ARNs (miARNs) artificiales. Estos últimos representan una poderosa herramienta para regular la expresión génica disminuyendo selectivamente la expresión de genes específicos (Pillai, 2005). Teniendo en cuenta lo anterior, el presente trabajo tiene como objetivo determinar el rol CDK5 durante la infección por DENV-2 empleando un miARN artificial y el inhibidor químico roscovitina, así como evidenciar los efectos de su inhibición sobre la reorganización de los filamentos de actina y microtúbulos en el contexto de la infección.
MATERIALES Y MÉTODOS
Compuestos y reactivos
Las soluciones madre de roscovitina se prepararon en Dimetil sulfóxido (DMSO), a una concentración de 10 μM y se conservaron a -20 °C hasta su uso. La concentración de DMSO en los ensayos biológicos fue de 0,05 % y se utilizaron controles celulares con DMSO a esta concentración. El Medio Esencial Mínimo de Eagle modificado por Dulbecco (DMEM) y el reactivo para la técnica del MTT (bromuro de 3-(4,5-dimetiltiazol-2-yl)-2,5 difeniltetrazolio) fueron obtenidos de Sigma-Aldrich Chemical Co. (Nueva Jersey, USA). El Suero Fetal Bovino (FBS) y el antibiótico penicilina/ estreptomicina/neomicina (PSN) se adquirieron de Invitrogen Life Technologies (Carlsbad, CA, USA). El DMSO se obtuvo de Merck KGaA (Darmstadt, Alemania).
Virus y células
Para todos los ensayos se empleó el virus Dengue tipo 2 (DENV-2) cepa Nueva Guinea, donado por la doctora Eva Harris (Instituto de Ciencias Sostenibles y de la Universidad de California en Berkeley), el cual se amplificó en células C6/36HT de Aedes albopictus y posteriormente se tituló en células Vero (células de riñón de mono verde africano ATCC CCL-81) (Martínez-Gutiérrez et al., 2011).
Las células Vero fueron mantenidas a 37 °C en atmósfera de CO2 al 5 %, en fase logarítmica de crecimiento con DMEM suplementado con 10 % de FBS inactivado, 1 μg/ mL de penicilina/estreptomicina y 2 μg/mL de neomicina. Estas células se emplearon para realizar los ensayos de citotoxicidad, inhibición química y silenciamiento con el miARN artificial. Las células C6/36HT, empleadas para realizar la expansión del virus Dengue, fueron mantenidas a 34 °C en atmósfera de CO2 con DMEM al 10 % de FBS, además de las condiciones anteriormente descritas.
Citotoxicidad del inhibidor químico (roscovitina)
Con el fin de determinar la concentración inhibitoria 50 (IC50) de roscovitina en células Vero, y conocer la concentración óptima para utilizar en los ensayos posteriores, se empleó la técnica del MTT (Betancur et al., 2002), realizando dos diferentes esquemas de tratamiento. Las células fueron cultivadas en platos de 96 pozos e incubadas con roscovitina en un rango de concentración de 12,5-1000 μM durante 24 h o en un rango de concentración de 3,931,25 μM por 6 días a 37 °C (5 % de CO2). Posteriormente se adicionó el reactivo MTT (4 mg/mL) y se realizó la lectura espectrofotométrica a 570 nm. Los valores de IC50 fueron obtenidos por análisis de regresión lineal de curvas de dosis-respuesta a partir de las absorbancias obtenidas utilizando el programa estadístico GraphPad Prisma 5.0 y fue expresada como la media ± el error estándar de la media de dos ensayos independientes por cuadruplicado.
Ensayos actividad antiviral empleando roscovitina
Para evaluar el efecto del compuesto previo a la infección de las células, diluciones seriadas (1:2) del inhibidor se prepararon y agregaron a los platos en un rango de concentración de 7,5-60 μM; células y compuestos se dejaron en incubación durante 24 h a 37 °C (5 % de CO2). Pasado este tiempo, se realizó un lavado de las células con PBS (phosphate buffered saline, pH = 7,4) y se infectaron con una multiplicidad de infección (MOI = 0,01 PFU/célula) del virus DENV-2. Luego de 2 h, las células fueron lavadas nuevamente con PBS y se les agregó CMC (carboximetilcelulosa) al 1,5 %.
Para el ensayo post-infección, las células fueron infectadas con una MOI = 0,01 se incubaron durante 2 h a 37 °C (5 % de CO2). Luego se realizó un lavado con PBS y se agregaron diferentes diluciones de roscovitina (rango de concentración de 3,75-30 μM) previamente preparadas en CMC 1,5 % (Roa-Linares et al., 2016). Tanto para el ensayo de pre-tratamiento y post-infección, los platos se dejaron incubar durante 6 días, se fijaron y se tiñeron con una solución de 3,5 % de formaldehído/cristal violeta al 0,2 % y se realizó el conteo de placas con el fin de determinar la concentración que inhibe en un 50 % el número de placas (EC50).
Los valores de EC50 fueron obtenidos por análisis de regresión lineal de curvas de dosis-respuesta, empleando el programa estadístico GraphPad Prisma 5.0 y fue expresada como la media ± el error estándar de la media de tres ensayos independientes por duplicado.
Purificación de plásmidos
La purificación de los plásmidos que contenían la secuencia interferente (pAAV-U6miRCDK5.2-hrGFP) y control (pAAV-U6miRCDK5.scr-hrGFP), se llevó a cabo mediante el protocolo (Plasmid or Cosmid DNA Purification Using QIAGEN Plasmid Maxi Kits). Una vez purificado el ADN, se cuantificó su concentración, así como la relación proteína/ADN (260/280) empleando un NanoDrop 2000 UV-Vis Spectrophotometer. Para los ensayos de silenciamiento génico solo se emplearon aquellos plásmidos cuya relación 260/280, estuviese entre 1,8 y 2,0.
Eficiencia de transfección de los miARNs y silenciamiento de CDK5 en células Vero
Para la transfección de los plásmidos, células Vero (55 000 células/pozo) fueron sembradas en platos de 24 pozos, con el fin de asegurar un 80 % de confluencia luego de 24 h de incubación a 37 °C (5 % de CO2). Pasado este tiempo, se preparó una mezcla de transfección del ADN plasmídico con lipofectamina 2000 (Invitrogen™) en una relación ADN/ lipofectamina (500 ng/2 uL), la cual se agregó a las células gota a gota. Pasadas 3 h de incubación se retiró la mezcla de las células, luego se lavaron con PBS y se agregó DMEM suplementado al 2 % FBS. Las células fueron monitoreadas al microscopio con el fin de observar la expresión de la fluorescencia del gen reportero GFP (Green Fluorescent Protein) luego de 24 horas y 48 horas post-transfección (hpt).
Con el fin de cuantificar la cantidad de células que expresaban GFP luego de 48 h post-transfección y la eficiencia de silenciamiento de los miARNs, las células se desprendieron de los platos y fueron lavadas con PBS. Posteriormente se fijaron con paraformaldehido (3,8 % peso/vol) durante 15 minutos a 37 °C. Luego fueron permeabilizadas con Triton X-100 (0,2 % vol/vol) y posibles sitios de unión no especifica fueron bloquedos con una solución de albúmina sérica bovina al 5 % preparada en PBS. Finalmente, se adicionó un anticuerpo primario contra CDK5 (C8-rabbit, Santa Cruz Biotechnology; 1:500) y un anticuerpo secundario (Alexa fluor 594, Invitrogen; 1:1000), con el fin de detectar la cantidad de quinasa presente. La eficiencia de transfección fue determinada empleando un citómetro de flujo (FACS Canto II, BD Biosciencies, USA) ajustando los parámetros del laser para determinar el número de células que expresaban GFP en el citoplasma. 10 000 eventos por condición fueron capturados para el análisis. Por otra parte, la efectividad del silenciamiento de CDK5 fue evaluada empleando microscopía avanzada de fluorescencia.
Efecto del silenciamiento e inhibición química sobre la proteína de envoltura viral, filamentos de actina y microtúbulos.
Para este ensayo se evaluó el efecto del inhibidor químico, así como del miRCDK5 durante la infección por DENV, empleando microscopia avanzada de fluorescencia (Cuartas et al., 2018). Células Vero se sembraron sobre láminas cubreobjetos y fueron transfectadas como se describió previamente; pasadas 24h y48 hpt, las células fueron infectadas a una multiplicidad de infección (MOI = 3) de DENV-2 durante 24 h. Para evaluar el efecto de roscovitina (30 μM), las células fueron infectadas y posteriormente tratadas con la molécula por 24 h. Luego, los cristales se lavaron con buffer de citoesqueleto (CBS) y se fijaron con paraformaldehido (3,8 % peso/vol) preparado en CBS por 30 minutos (Cuartas et al., 2018). Posteriormente, las células fueron permeabilizadas con Triton X-100 (0,2 % vol/ vol), posibles sitios de unión no especifica se bloqueron con PBS (5 % FBS) y se incubaron con un anticuerpo primario dirigido hacia la proteína CDK5 (C8-rabbit;1:500) y la proteína de envoltura viral (4G2 anti-E; 1:500). Luego se adicionaron los anticuerpos secundarios (Alexa fuor 488 o Alexa fluor 594;1:1000), así como faloidina conjugada a Alexa 594 (marcaje de actina;1:1000), tubulina conjugada a Cy3 (marcaje de microtúbulos;1:1000) y Hoechst 33258 (marcaje de núcleos; 1:10.000). Los anticuerpos secundarios se utilizaron para el marcaje de las proteínas de envoltura o CDK5, y se emplearon las combinaciones adecuadas para diferenciar los marcajes en cada experimento. Por último, las células se lavaron con PBS y los cristales se observaron en un microscopio de epifluorescencia (Olympus IX83P2ZF). Las imágenes fueron procesadas con el software Image J, con el fin de cuantificar la intensidad media de fluorescencia (IMF) de las proteínas CDK5 y de envoltura viral durante el tratamiento con roscovitina o en condiciones de silenciamiento con miRCDK5.
RESULTADOS
Roscovitina tiene actividad contra DENV-2 en etapas pre y post-infectivas
Inicialmente se determinó la concentración de roscovitina capaz de inhibir el 50 % de la viabilidad celular (IC ), con el fin de establecer la concentración óptima para realizar los experimentos de actividad antiviral, así como los demás ensayos planteados en este trabajo.
El efecto citotóxico del inhibidor químico se evaluó usando la técnica del MTT, luego de la exposición de las células al compuesto durante 24 h y 6 días, siendo la IC50 obtenida de 158,5 μM y 13,77 μM, respectivamente (Figs. 1a y 1b). El análisis estadístico en los dos casos arrojó un coeficiente de regresión lineal (R2 > 0,70) y un valor p < 0,05.
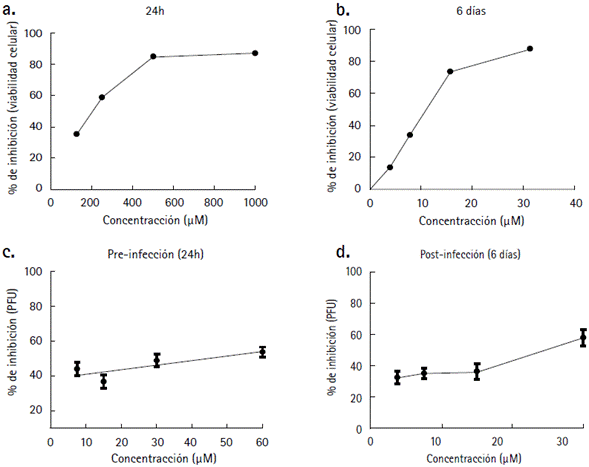
Figura 1 Roscovitina tiene actividad contra DENV en etapas pre y post-infectivas. Células Vero fueron tratadas con diferentes concentraciones del inhibidor para determinar la concentración inhibitoria 50 (IC50) después de 24 h (a) y 6 días (b) de tratamiento. La actividad antiviral de roscotivina contra DENV-2 en etapas pre (c) y post (d) infectivas se calculó a partir de curvas de dosis-respuesta empleando concentraciones no citotóxicas del compuesto. Los resultados son expresados como la media ± el error estándar de la media de dos ensayos realizados por cuadruplicado (a-b) y tres ensayos realizados por duplicado (c- d).
Una vez definida la IC50 se evaluó el efecto de roscovitina durante dos diferentes momentos de la infección por DENV-2, con el propósito de definir en qué etapa del ciclo replicativo viral podría estar participando la quinasa CDK5. Para ambos tratamientos se realizó un ensayo de reducción de unidades formadoras de placa (PFU) y la concentración de roscovitina que redujo el número de placas virales en un 50 % (EC50) se interpoló a partir de curvas de dosis-respuesta. Los resultados revelan que antes de la infección, roscovitina redujo en un 50 % las unidades formadoras de placas a una concentración de 24,45 μM (Fig. 1c). Un resultado similar se observó en el tratamiento después de la infección, ya que roscovitina mostró actividad anti-DENV a una EC50 de 23,89 μM (Fig. 1d).
miRCDK5 y roscovitina alteran la cantidad de proteína de envoltura viral
Una vez definido en qué punto de la infección viral podría estar participando la proteína CDK5, se llevó a cabo la transfección de los plásmidos que contenían las secuencias control (Scr) y la secuencia interferente (miRCDK5), con la finalidad de determinar la cantidad de células que contenían el gen reportero GFP por citometría de flujo. En las figuras 2a y 2b se puede observar que el porcentaje de células que expresan GFP es de un 23 - 24 %, indicando un porcentaje moderado de células transfectadas con los plásmidos. Así mismo, se puede apreciar la cantidad de células transfectadas respecto al total de células sembradas empleando un microscopio invertido.
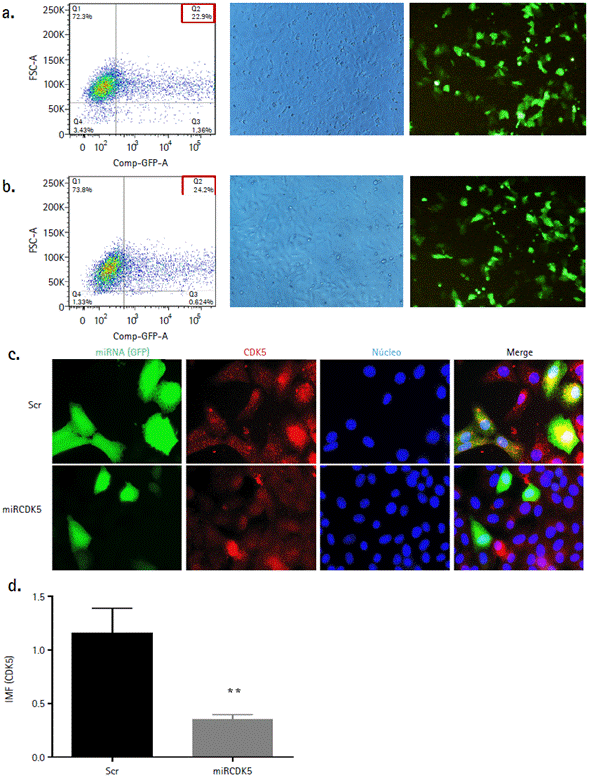
Figura 2 Efecto del silenciamiento con miARNs artificiales sobre la proteína CDK5. La eficiencia de transfección de los plásmidos Scr (a) y miRCDK5 (b) fue determinada por citometría de flujo y microscopía de fluorescencia (objetivo 10X) luego de 48 horas post transfección. El efecto del silenciamiento de los miARNs artificiales sobre la proteína CDK5 se evidenció por microscopia avanzada de fluorescencia (c). La cuantificación de la intensidad media de fluorescencia (d) se realizó empleando el software Image J. Los resultados son expresados como la media ± el error estándar de la media de tres ensayos realizados por duplicado. La comparación entre grupos se realizó usando una prueba t de Student de datos no pareados (**, p < 0,01) IMF: intensidad media de fluorescencia.
Seguidamente se evalúo la capacidad del miRCDK5 de bloquear o suprimir la expresión de su proteína blanco, luego de 48 hpt empleando microscopía avanzada de fluorescencia (Fig, 2c). Las imágenes obtenidas fueron analizadas en el software Image J y la intensidad de fluorescencia de CDK5 fue calculada. Como se puede observar, la intensidad de fluorescencia de la proteína CDK5 se reduce de manera significativa (aproximadamente en un 70 %) cuando las células fueron transfectadas con miRCDK5, respecto al control de silenciamiento (Fig. 2d).
En paralelo, se comparó el efecto del interferente y roscovitina sobre la proteína CDK5 y de envoltura viral (ENV), durante la infección por el virus DENV-2. Luego de 24 horas post-infección (hpi) y 48 hpt con el miARN interferente, no se observó una reducción significativa en la intensidad de fluorescencia de la proteína CDK5 (Fig. 3a y 3b). Dicho resultado es inesperado ya que en células no infectadas, miRCDK5 reduce de manera eficiente la IMF de CDK5. Por su parte, el tratamiento por 24 h de las células infectadas con el inhibidor químico (Fig. 3e y 3f), tampoco reduce la IMF de CDK5. Dicho efecto es esperado ya que roscovitina actua como un inhibidor de la función de CDK5, pero no de su expresión en las células tratadas. Sin embargo, se observó una reducción significativa de la proteína ENV en presencia del interferente (Figs. 3c y 3d) y de roscovitina (Figs. 3e y 3g), lo cual puede estar asociado con una disminución en la replicación del genoma viral y/o traducción proteica.
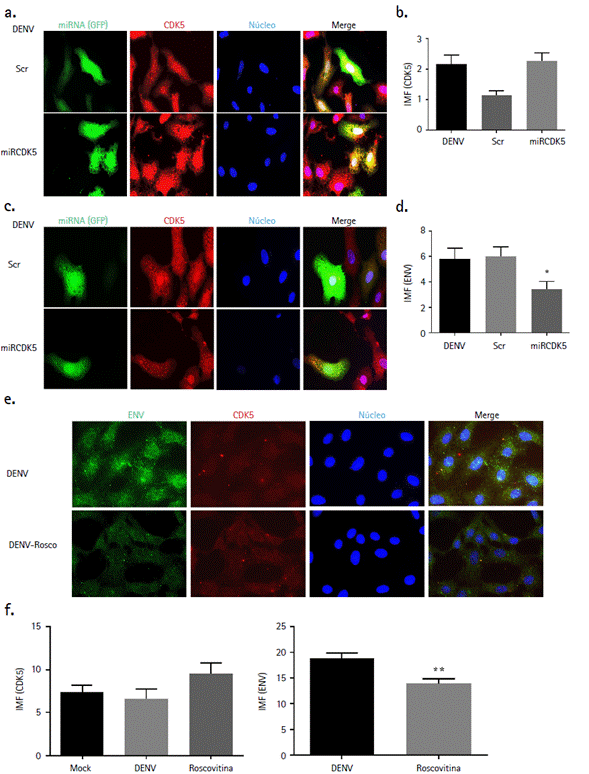
Figura 3 miRCDK5 y roscovitina reducen la cantidad de proteína de envoltura viral pero no de CDK5 durante la infección por DENV-2. Células Vero fueron transfectadas o tratadas con roscovitina, infectadas con DENV-2 y tenidas con anticuerpos específicos para observar su efecto sobre la proteína CDK5 (a) y de envoltura viral (b) empleando microscopía avanzada de fluorescencia. La cuantificación de la intensidad media de fluorescencia (c-d) se realizó empleando el software Image J. Los resultados son expresados como la media ± el error estándar de la media de tres ensayos realizados por duplicado. La comparación entre grupos se realizó usando una prueba t de Student de datos no pareados (*, p < 0,05; **, < 0,01). IMF: intensidad media de fluorescencia; ENV: proteína de envoltura viral. Rosco: roscovitina.
Roscovitina afecta el remodelamiento de los filamentos de actina y la distribución de los microtúbulos durante la infección por DENV
Finalmente, el efecto sobre elementos del citoesqueleto (actina y microtúbulos) fue evaluado en presencia de miRCDK5, así como del inhibidor químico. En las figuras 4b y 5b no se aprecian cambios evidentes sobre los filamentos de actina ni sobre la distribución de los microtúbulos en las células transfectadas con Scr o miRCDK5 y posteriormente infectadas con DENV-2, en comparación con los controles no infectados (Figs. 4a y 5a). Sin embargo, durante el tratamiento con roscovitina se evidencian cambios moderados en la morfología celular, reducción en la cantidad de fibras de estrés y proyecciones de la membrana plasmática (Fig. 4c), así como alteración de la distribución de los microtúbulos (Fig. 5c), particularmente durante la infección por DENV.
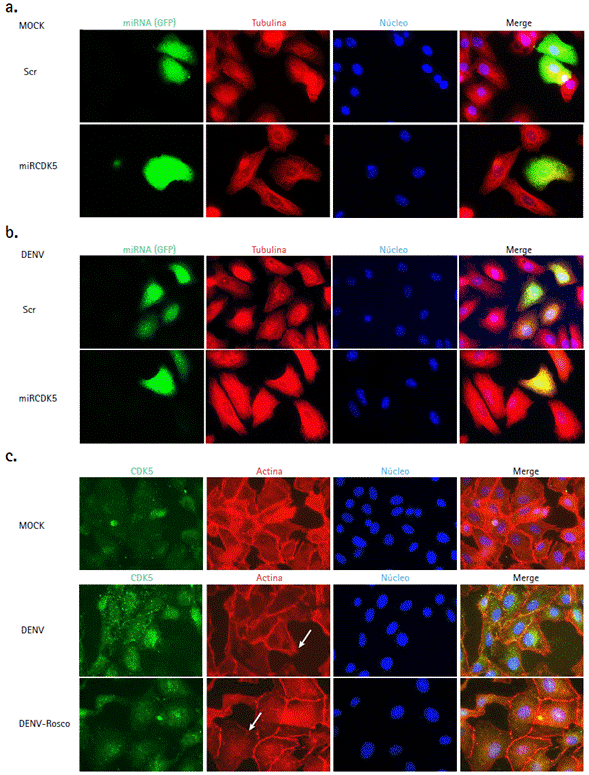
Figura 4 Efecto de miRCDK5 y roscovitina sobre el remodelamiento de actina durante la infección por DENV-2. Células Vero fueron transfectadas (b) o tratadas con roscovitina (c), infectadas con DENV-2 y tenidas para observar su efecto sobre los fi lamentos de actina comparado con el mock (a). Las imágenes son representativas de tres experimentos realizados por duplicado y fueron capturadas con un objetivo de 60X. Las flechas indican reducción de proyecciones derivadas de la membrana plásmatica y fi lamentos de actina durante el tratamiento con roscovitina en comparación con el control de infección no tratado. ENV: proteína de envoltura viral. Rosco: roscovitina.
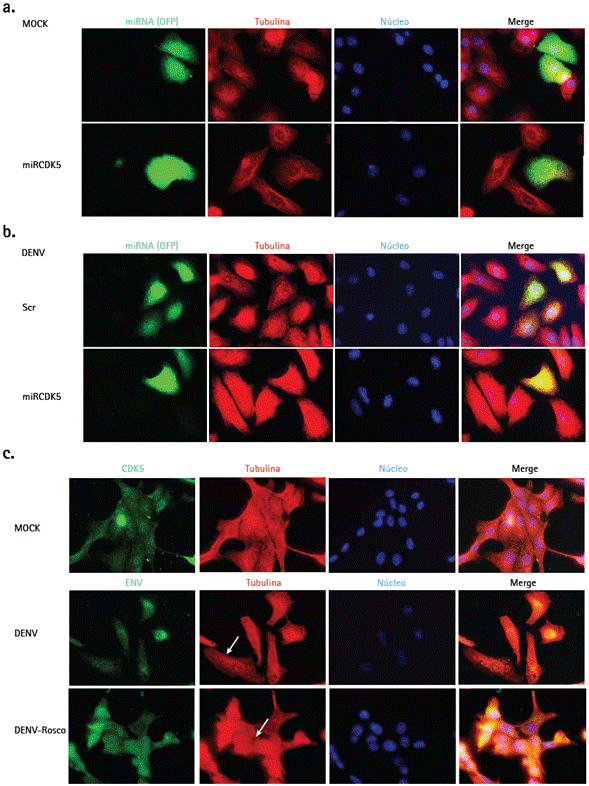
Figura 5 Efecto de miRCDK5 y roscovitina sobre la distribución de los microtúbulos durante la infección por virus DENV-2. Células Vero fueron transfectadas (b) o tratadas con roscovitina (c), infectadas con DENV-2 y tenidas para observar su efecto sobre los microtúbulos comparado con el mock (a). Las imágenes son representativas de tres experimentos realizados por duplicado y fueron capturadas con un objetivo de 60X. Las flechas cambios en la morfología celular y en el patrón de distribución de los microtúbulos durante el tratamiento con roscovitina en comparación con el control de infección no tratado. ENV: proteína de envoltura viral. Rosco: roscovitina.
DISCUSIÓN
En la búsqueda de nuevas alternativas antivirales, los denominados antivirales dirigidos hacia blancos celulares (HTA, por sus siglas en inglés) se han postulado como una estrategia promisoria, principalmente contra virus con genoma de ARN, debido a que la célula hospedera tiene una alta estabilidad genética y baja tasa de mutación, lo cual restringe la selección de mutantes virales resistentes a los fármacos (Martínez et al., 2014; Plummer et al., 2015; Boldescu et al., 2017). Así mismo, este tipo de estudios han permitido ahondar aún más en la estrecha relación del virus con su célula hospedera y por ende comprender mejor la patogénesis viral.
Dentro de la amplia gama de dianas terapéuticas estudiadas hasta el momento, las quinasas dependientes de ciclina (CDKs) se han postulado desde hace más de 15 años como potenciales blancos para la búsqueda de agentes contra virus que no dependen del ciclo celular para su infección productiva, tales como el virus de la inmunodeficiencia humana tipo 1 (HIV-1), citomegalovirus humano (HCMV), virus de la varicela zoster (VZV) y los virus del herpes simple humano tipo 1 y 2 (HSV-1 y HSV-2). Lo anterior se basa en datos que demuestran la potente actividad in vitro de flavopiridol y roscovitina, dos inhibidores de CDKs, contra estos virus (Schang, 2002; 2005; Schang et al., 2006).
Reportes más recientes indican que la activación de CDK5 mediada por p53, durante la infección aguda in vitro por HSV-1 es necesaria para evitar la apoptosis en neuronas y, por tanto, perpetuar la infección (Mostafa et al., 2015). Así mismo, la hiperactivación de CDK5 causada por la proteína Tat de HIV resulta en la fosforilación anormal de la proteína Tau, lo cual está relacionado con la aparición de desórdenes neurocognitivos durante la infección por este virus (Fields et al., 2015).
Por otra parte, la participación de otras quinasas entre las cuales se encuentran la fosfoinositol 3-quinasa (Lee et al., 2005; Chen et al., 2017; Cuartas et al., 2018), proteína quinasa activada por AMP (Jordan y Randall, 2017), Fyn quinasa (de Wispelaere et al., 2013), proteina quinasa activada por mitógenos (Sreekanth et al., 2018), Scr quinasa (Chu y Yang, 2007) y esfingosina quinasa (Al-Shujairi et al., 2019), durante la infección por DENV-2 ha sido previamente documentada; sin embargo, el efecto de la perdida de función de CDK5 en el curso de la infección por DENV-2 no ha sido reportado. En este estudio, se evidencia la potencial participación de la quinasa CDK5 durante la infección por virus dengue, empleando dos diferentes métodos, inhibición química y silenciamiento génico con un micro ARN artificial.
Los resultados revelan que roscovitina, una pequeña molécula que inhibe eficientemente CDK5, reduce de manera estadísticamente significativa la infección por DENV-2 a concentraciones no citotóxicas, cuando el compuesto se adicionó antes y después de la infección (Fig. 1). El ensayo de pre-infección permite hacer una estimación aproximada sobre el rol de CDK5 durante la adherencia y/o entrada de la partícula viral a la célula hospedera; por su parte el ensayo posinfección permite suponer la participación de esta quinasa en varios pasos posteriores a la entrada, que incluyen el tráfico, replicación del genoma, ensamblaje, liberación de nuevas partículas virales y diseminación célula-célula. La eficacia del micro ARN artificial (miRCDK5) sobre su proteína blanco, fue evaluada inicialmente en células no infectadas luego de 48 hpt, evidenciándose un 70 % de silenciamiento de la quinasa (Fig. 2).
Para confirmar el posible rol de CDK5 en la replicación y/o traducción de la poliproteína viral, las células fueron transfectadas con miRCDK5 por 24 h y posteriormente infectadas con DENV-2 o infectadas y luego tratadas con roscovitina por 24 h. Empleando este esquema de tratamiento, se evidenció que tanto el interferente como el inhibidor químico reducen de manera significativa la cantidad de proteína de envoltura viral (Fig. 3d y 3g). No obstante, contrario a lo esperado, el miARN artificial no reduce la cantidad de CDK5 durante la infección viral (Figs. 3b y 3f). Ensayos adicionales, como la detección de CDK5 por citometría de flujo en condiciones de silenciamiento e infección, son necesarios para confirmar los datos obtenidos.
Si bien el rol de CDK5 en células no neuronales no se encuentra ampliamente estudiado, se ha reportado que esta quinasa regula la dinámica del citoesqueleto en este tipo de células (Arif, 2012; Hydbring et al., 2016). Así mismo, el papel de los filamentos de actina y microtúbulos durante la infección por dengue y de otros flavivirus ha sido extensamente documentado (Zamudio-Meza et al., 2009; Wang et al., 2010; Shrivastava et al., 2011; Zhang et al., 2016; Cuartas et al., 2018).
Nuestros resultados demuestran que solo el tratamiento con roscovitina ejerce un efecto apreciable sobre la reorganización de actina y distribución de los microtúbulos (Figs. 4c y 5c), ya que durante el silenciamiento con miRCDK5 estas estructuras celulares conservan un patrón similar a los controles no tratados.
La diferencia en el efecto cuando las células se someten a estas dos diferentes condiciones de tratamiento podría explicarse considerando que el silenciamiento génico puede inhibir de manera regulada y parcial la expresión de una proteína celular. Por su parte, un compuesto químico puede llegar a inducir un efecto más agresivo sobre la función celular, la cual se puede observar de manera evidente a nivel fenotípico (Weiss et al., 2007).
Otro aspecto técnico para tener en cuenta, es que las células previamente transfectadas en tapices celulares resultan ulteriormente un poco refractarias a la infección, razón por la cual en los últimos años se ha implementado la llamada "transfección reversa" (Erfle et al., 2007). Se le llamado así porque la transfección convencional implicaba realizar el procedimiento sobre células adheridas a cristales, a las cuales se les adicionaba el reactivo de la transfección con los plásmidos conteniendo los ADNs de interés. Por el contrario, en la transfección reversa primero se adiciona la mezcla de transfección a las células en suspensión, lográndose un mejor efecto para posteriores tratamientos, que necesitan una membrana plasmática más permisiva, por ejemplo, a la infección viral.
Hacia una perspectiva básica en la biología del virus dengue, restan muchos interrogantes por evaluar experimentalmente que acá se han abierto, porque la participación decisiva de CDK5 en la dinámica de los microtúbulos aún debe ser examinada, en vista que nuestra aproximación metodológica no lo permitió. Serían requeridos ensayos de imagenología de células vivas (Live Cell Imaging) para reconocer la participación de esta quinasa en la dinámica de microtúbulos y en general del citoesqueleto, porque cada vez son más los reportes que hablan de un entrecruzamiento funcional y estructural para los tres elementos (actina, microtúbulos y filamentos intermedios). En otra investigación en la cual hemos contribuído (Piedrahita etal., 2010; López-Tobón etal., 2011), pudimos entrever el grado de complejidad del problema, de tal forma que futuros planteamientos basados en esta experiencia pero ahora aplicados al dengue, podrán ser de gran utilidad en el entendimiento de la biología celular de la infección viral.
Nuestros datos tienen relación con la EMT (Epithelialto-Mesenchymal Transition), porque además constituyen parcialmente la validación biológica, de una predicción computacional ya publicada en un trabajo de nuestro grupo. Resulta curioso que uno de esos blancos hallados por una predicción por biología computacional, para las estructuras del genoma DENV que son parecidas a microARNs, sea el gen para la proteína CDK5 (Ospina et al., 2014) y que además en otro trabajo sobre cáncer de mama (Liang et al., 2013) esta quina resulte esencial en la inducción de la Transición Epitelio-Mesénquima (EMT, por sus siglas en inglés) dada por TGF-β1. Igualmente, nos pone en una ruta optimista el hecho que hemos hallado que la migración celular relacionada con EMT (Alvarez et al., 2018), podrían estar explicando parte de la fisiopatología del dengue de una manera no convencional.
Conjuntamente todos los datos aportados en esta investigación así como las referencias de otros trabajos, apuntan a que la efectividad de la terapia basada en blancos de células del hospedero, además de ser una excelente alternativa de antivirales de amplio espectro, está abriendo posibilidades para fármacos antitumorales como se ha visto en otros estudios (Mulder et al., 2013; Shin et al., 2018).
CONCLUSIONES
Los hallazgos obtenidos en el presente estudio, tales como reducción de la infección en etapas pre y post-infectivas, disminución de la proteína de envoltura viral y cambios en el remodelamiento del citoesqueleto, indican la potencial participación de CDK5 durante la infección por DENV-2. Lo anterior es consistente con la regulación que este virus hace de otras quinasas para llevar a cabo una infección productiva y aporta nueva información sobre la patogénesis de DENV-2 en células epiteliales. Así mismo, estos datos permiten postular a CDK5 como una potencial diana terapéutica para el tratamiento de las infecciones causadas por este virus. Sin embargo, ensayos adicionales se requieren para comprender específicamente en que etapa del ciclo replicativo actuá esta quinasa, así como para confirmar el motivo por el cual no se detecta un efecto significactivo del microARN sobre CDK5 en células infectadas con DENV-2.















