INTRODUCCIÓN
Las hepatitis de origen viral constituyen una causa importante de mortalidad en el mundo, en el 2015 éstas causaron 1,3 millones de muertes, datos que igualan las muertes por infecciones como la tuberculosis o el VIH, pero con el agravante que, en el caso de las hepatitis víricas, éstas reciben menos atención y su tendencia es al aumento (Organización Mundial de la Salud, 2019).
Entre las cinco hepatitis víricas, las causadas por el Virus de la Hepatitis C (VHC) y B, representan el 96 % de las muertes por esta causa, pero la situación más grave se da con el VHC cuyos casos están aumentando con cerca de 71 millones de infectados, mientras que la tendencia del VHB es descendente por el aumento de la cobertura de vacunación (Organización Mundial de la Salud, 2019).
Esta situación resulta más preocupante al considerar informes de la OMS que han indicado que la mayoría de los infectados por el VHC no conocen su estado por problemas de acceso al diagnóstico y baja tamización poblacional, por lo que podrían avanzar a cirrosis, carcinoma hepatocelular y muerte (Organización Mundial de la Salud, 2019). En este contexto, los bancos de sangre constituyen una institución prestadora de servicios de salud de gran importancia para estimar el riesgo poblacional de algunas infecciones, entre las cuales se incluye el VHC, dada la ausencia de programas de vigilancia epidemiológica activa en población general (Bedoya et al., 2012; Organización Panamericana de la Salud, 2013; Sánchez et al., 2013; Gupta et al., 2014; Cardona et al., 2019). Asimismo, resulta de gran importancia disponer de pruebas diagnósticas con excelentes propiedades analíticas como eje de los programas de tamización de población potencialmente expuesta, así como para la orientación de decisiones médicas sobre el tratamiento (Torres et al., 2004).
En este orden de ideas, en la literatura científica mundial se han realizado algunos estudios sobre la evaluación diagnóstica de diferentes pruebas de detección del VHC; así, se dispone de algunas basadas en la determinación simultánea de antígenos y anticuerpos (Tagny et al., 2014), otros que sólo miden antígenos o sólo anticuerpos (Ha et al., 2017), la cuales presentan variaciones en los valores de sensibilidad y especificidad, y en muchos casos no hacen una presentación completa de los parámetros de evaluación diagnóstica, al no estimar los cocientes de probabilidad, el área bajo la curva ROC, entre otros que son determinantes para generar evidencia de alta calidad.
Por lo anterior, el objetivo de esta investigación fue evaluar la validez y desempeño del inmunodiagnóstico del virus de la hepatitis C (VHC), a partir de estudios publicados en la literatura científica mundial, los cuales mejora la validez externa de los resultados, la calidad de las recomendaciones clínicas y epidemiológicas, la precisión de las estimaciones, entre otras ventajas (Zamora et al., 2006; Cardona et al., 2016).
MATERIALES Y MÉTODOS
Tipo de estudio: revisión sistemática de la literatura con metaanálisis.
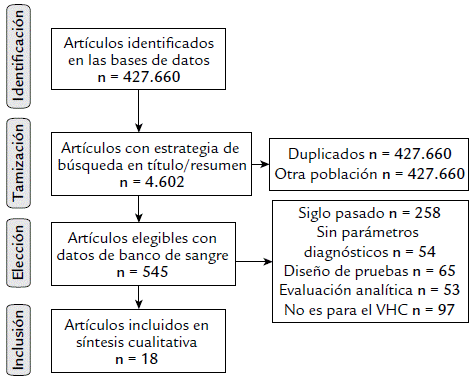
Protocolo de búsqueda y selección de estudio: se realizó según las fases de la guía PRISMA (Preferred reporting ítems for systematic reviews and meta-analyses) (Moher et al., 2009).
Identificación: Se realizó una búsqueda por especificidad (circunscrita a lenguaje controlado en términos de tesauros, particularmente DeCS) de artículos originales publicados en PubMed, Scielo, Science Direct y Google Scholar. Se emplearon ocho términos de búsqueda para los parámetros de evaluación diagnóstica (falsos positivos, falsos negativos, valor predictivo negativo, valor predictivo positivo, verdadero negativo, verdadero positivo, sensibilidad y especificidad), dos sinónimos para banco de sangre (Blood Banks, Blood Banking) y dos para donantes de sangre (Blood Donation, Blood Donor); la combinación de estos términos derivó en un total de 32 estrategias de búsqueda diferentes, las cuales se aplicaron en inglés y español, con restricción a publicaciones sobre el VHC (o hepacivirus). Algunas sintaxis empleadas fueron (Sensitivity[Title/Abstract] AND (Blood donor [Title/Abstract] OR Blood Banks[Title/Abstract])) en PubMed, Title, abstract, keywords: Positive Predictive Value AND Blood Donor en Science Direct y (ab:(Positive Predictive Value AND Blood Donation)) en Scielo.
Tamización: en esta fase se eliminaron los estudios duplicados y se aplicaron los criterios de inclusión de ser artículos con los términos de búsqueda en título y/o resumen, estudios originales, desarrollados en población de donantes de bancos de sangre. La búsqueda se restringió a publicaciones de este siglo y la última actualización del protocolo de búsqueda se realizó el 10 de diciembre de 2018.
Elección: se excluyeron los estudios cuyo objetivo no era la evaluación diagnóstica o no reportaron medidas de validez como la sensibilidad y la especificidad, o parámetros de desempeño diagnóstico como los valores predictivos negativo y positivo; también se excluyeron las investigaciones que no reportaron los resultados de evaluación diagnóstica para pruebas de detección del VHC, los estudios no disponibles en las bases de datos y sin respuesta de autores ante su solicitud, y manuscritos con información incompleta en el número de evaluados, verdaderos positivos o verdaderos negativos.
Inclusión: Los estudios que cumplían las fase anteriores fueron leídos en su totalidad para síntesis cualitativa de las siguientes variables: título, autor principal, año de publicación, lugar de estudio, población, tipo de prueba diagnóstica analizada, verdaderos positivos (donantes con VHC con resultado positivo en la prueba de tamización), verdaderos negativos (donantes sin VHC con resultado negativo en la prueba de tamización), falsos positivos (donantes sin la infección con resultado positivo en la prueba de tamización) y falsos negativos (donantes con la infección con resultado negativo en la prueba de tamización).
Reproducibilidad y evaluación de la calidad: Se garantizó la reproducibilidad de la búsqueda y selección de los estudios aplicando el protocolo por dos revisores, a priori se determinó que las diferencias se resolverían por consenso. Para garantizar la reproducibilidad de la extracción de las variables, ésta fue realizada de manera independiente por dos revisores, aplicando índice kappa para las variables cualitativas y coeficiente de correlación intraclase para las cuantitativas. Para evaluar la calidad metodológica de los estudios incluidos se aplicaron los criterios de la guía QUADAS 2 (Quality Assessment of Diagnostic Accuracy Studies) (Whiting et al., 2017).
Plan de análisis: Los estudios se describieron con frecuencias absolutas y relativas. Para las pruebas de detección de anticuerpos se estimó sensibilidad, especificidad, cocientes de probabilidad (Likelihood Ratio) positiva y negativa, Razón de Odds Diagnóstica y curva ROC con sus intervalos de confianza del 95 %. Los análisis se realizaron con un metaanálisis de efectos aleatorios en MetaDiS (Meta-analysis of studies of evaluations of Diagnostic and Screening tests) con una significación del 0,05. Las medidas combinadas de los estudios se basan en la Prueba Q (χ2) de Der Simonian-Laird, los intervalos de confianza del 95 % se corrigieron con una estimación por sobre-dispersión. El análisis de heterogeneidad se basa en el estadístico Q de Cochrane y el de incertidumbre (sensibilidad) en el porcentaje de peso de cada estudio individual sobre el resultado global.
RESULTADOS
En la aplicación de las estrategias de búsqueda sin ningún filtro en las bases de datos se hallaron más de 400 mil resultados, de los cuales sólo 4602 los incluía en el título o resumen, de éstos 18 cumplieron con el protocolo de esta investigación (Fig. 1). Los estudios incluidos presentaron una excelente calidad metodológica al cumplir más del 70 % de los criterios de calidad de la guía QUADAS-2 y presentar un bajo riesgo de sesgos en la elección de la prueba a evaluar, el estándar de referencia en todos los casos correspondía a los usados en los laboratorios de referencia de los bancos de sangre, y hubo un buen flujo de tiempos en la aplicación de las pruebas incluidas en la evaluación.
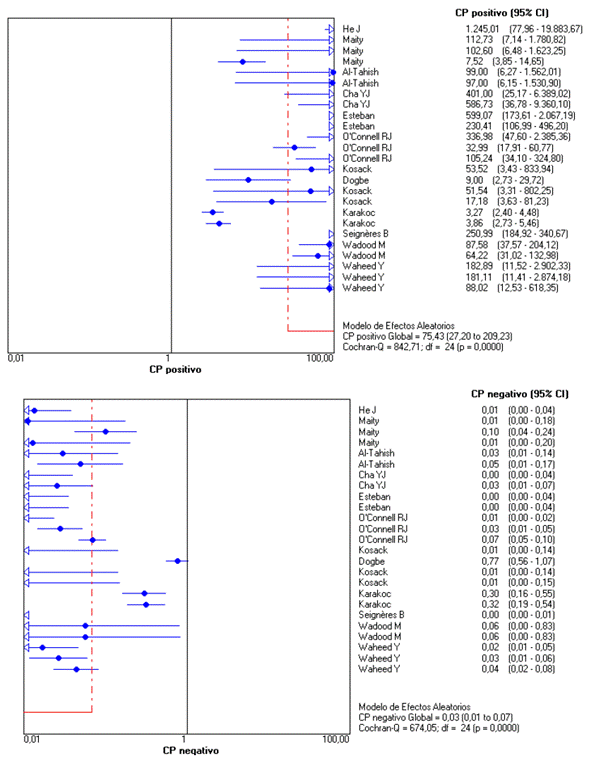
La mayoría de los estudios se realizaron en países europeos o asiáticos, empleando tres tipos de técnicas diferentes (detección de antígenos, anticuerpos o ambos) en 22 383 donantes sin infección y 5516 infectados con el VHC (Tabla 1). Los estudios con detección de anticuerpos se realizaron en 21 483 donantes sanos y 3145 infectados en quienes se halló una sensibilidad de 97,8 % (IC 95 % = 97,3 -98,2), especificidad 99,0 % (IC 95 % = 98,9 - 99,2) (Figura 2), cociente de probabilidad positivo 75,4 (IC 95 % = 27,2 -209,2) y negativo de 0,02 (IC 95 % = 0,01 - 0,07) (Figura 3). Finalmente, la razón de odds diagnóstica fue de 3197 (IC 95 % = 734 - 13 909) y el área bajo la curva de 99,8 % (p < 0,001). Dado que en todos los metaanálisis se halló una alta heterogeneidad, con I2 > 50 %, las medidas combinadas se estimaron con un modelo de efectos aleatorios que incluye la varianza intra e inter-estudios.
Tabla 1 Descripción de las investigaciones según año, país y población evaluada.
| Autor | Año | País | Sanos | Infectados |
|---|---|---|---|---|
| Detección de Antígeno y Anticuerpo | ||||
| Vermeersch et al. | 2010 | Bélgica | 78 | 177 |
| Tagny et al. | 2014 | Francia | 37 | 1.941 |
| Detección de Antígeno | ||||
| Agha S et al. | 2004 | Japón | 53 | 142 |
| Ha et al. | 2017 | Corea | 732 | 111 |
| Detección de Anticuerpo | ||||
| Liu et al. | 2010 | Estados Unidos | 1.065 | 3 |
| He et al. | 2011 | China | 630 | 259 |
| Maity et al. | 2012 | India | 56 | 44 |
| Al-Tahish et al. | 2013 | Egipto | 50 | 50 |
| Cha et al. | 2013 | Corea | 500 | 337 |
| Esteban et al. | 2013 | Multicéntrico (Europa) | 6.850 | 224 |
| O'Connell et al. | 2013 | Estados Unidos | 339 | 335 |
| Kosack et al. | 2014 | Alemania | 26 | 248 |
| Dogbe y Arthur | 2015 | Ghana | 228 | 12 |
| Kosack y Nick | 2016 | Alemania | 78 | 284 |
| Seigneres et al. | 2016 | Multicéntrico (Europa) | 1.0718 | 1.054 |
| Karakoc et al. | 2017 | Turquía | 342 | 79 |
| Wadood y Usman | 2019 | Pakistán | 509 | 8 |
| Waheed et al. | 2019 | Pakistán | 92 | 208 |
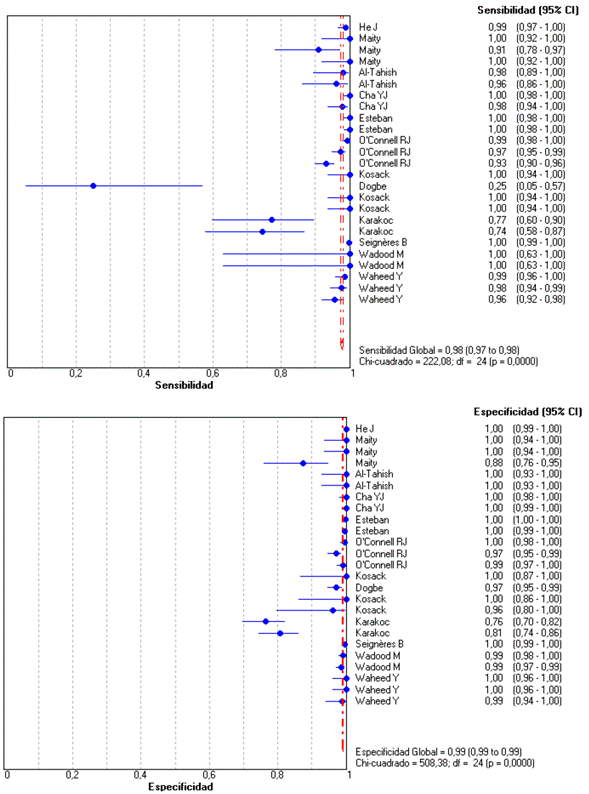
Figura 2 Forest plot para la sensibilidad y especificidad de las pruebas de detección de anticuerpos del VHC.
DISCUSIÓN
En esta investigación se incluyeron 18 estudios con excelente calidad metodológica, en una población de 22 383 donantes sin infección y 5516 infectados con el VHC, en quienes se aplicaron varias tecnologías de determinación de la infección; éstas y otras características cristalizan las ventajas de los metaanálisis como lo son el mejoramiento de las posibilidades de extrapolación de sus resultados, generar evidencia de alta calidad para las decisiones clínicas y epidemiológicas, mejorar las estimaciones, entre otras (Zamora et al., 2006; Cardona et al., 2016).
Se identificaron estudios que evaluaron tres tipos diferentes de inmunodiagnósticos, algunos sólo determinaron anticuerpos o antígenos, y pocos estudios implementaron tecnologías de tercera generación. En este sentido es oportuno indicar que las pruebas más comunes se basan en anticuerpos anti-VHC los cuales dan cuenta de la exposición al virus, lo que resulta clave para los estudios de prevalencia, a pesar de no diferenciar los casos activos de aquellos en quienes de resolvió la infección (Dawson, 2012).
En las pruebas que detectaron anticuerpos se halló una excelente validez diagnóstica, con sensibilidad y especificidad cercanas al 100 %, lo reflejarían una proporción de resultados falsos (negativos o positivos) cercano a cero, cociente de probabilidad positivo de 75, negativo de 0,02 y una razón de odds diagnóstica de 3197 que demuestran la excelente capacidad de la prueba para discriminar sanos de enfermos, o la seguridad de todo tipo de resultados de la prueba (tanto la identificación de verdaderos infectos como verdaderos sanos), y área bajo la curva cercana al 100 % como síntesis de la excelente relación entre sensibilidad y especificidad (Torres et al., 2004; Campo et al., 2014).
En conjunto, estos hallazgos demuestran la validez y seguridad de estas pruebas para los programas de tamización en bancos de sangre, y la importancia de su extrapolación a contextos clínicos donde constituirían un factor clave para orientar un tratamiento correcto de la infección. En adición, se debe tener presente que las tecnologías basadas en detección de antígeno core permiten identificar los casos de infección activa y en algunos casos podrían ser útiles para el seguimiento de la eficacia del tratamiento de los pacientes, aunque ésta generalmente se realiza con medición del ARN viral antes y después del tratamiento (Dawson, 2012).
Lo expuesto toma mayor relevancia al considerar que la mayoría de infectados no conocen su estado y el acceso a prueba de diagnóstico es bajo, lo que explica el aumento del número de infectados, con el subsecuente riesgo de cirrosis o cáncer hepático, pese a la disponibilidad y relativa sencillez del tratamiento de la infección (Organización Mundial de la Salud, 2019). En este orden de ideas, los bancos de sangre son un factor determinante para la vigilancia epidemiológica de esta infección que afecta a cerca de un 3 % de la población mundial, cuya principal vía de trasmisión es sanguínea y que constituye el agente causal de cerca del 80 % de las hepatitis crónicas (Gupta et al., 2014).
También se debe tener presente que el perfil epidemiológico de las hepatitis víricas está cambiando de manera importante en los últimos años, lo que demuestra la relevancia de este tipo de investigación como eje y etapa inicial de cualquier esfuerzo de vigilancia epidemiológica, intervención clínica o evaluación de diferentes acciones en salud; máxime al considerar que la incidencia del VHC se redujo en muchos países a partir de la inclusión de la tamización de donantes de sangre con la medición de anticuerpos y en los años reciente con la determinación de ARN viral (Stramer et al., 2000; Kim, 2002; Bruguera y Forns, 2004).
Entre las principales limitaciones de esta investigación se encuentran la imposibilidad de identificar las fuentes de heterogeneidad entre los estudios, dado que su bajo número impidió la realización de meta-regresiones. Además, el reporte de variables sobre las características de los sujetos estudiados fue deficiente en algunos estudios.
CONCLUSIONES
Con base en una población de elevado tamaño, tanto en el número de donantes sanos como infectados con el VHC, se concluye que las pruebas de tercera generación presentan una excelente validez, desempeño y utilidad diagnóstica para la detección de esta infección en donantes de sangre, lo cual puede extrapolarse a la población general. Esto constituye una evidencia de excelente calidad para respaldar recomendaciones sobre su implementación en programas de tamización, así como en ámbitos clínicos en los cuales el diagnóstico precoz es un factor determinante para el éxito en su tratamiento.