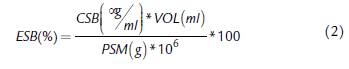INTRODUCCION
El mercado mundial de ingredientes nutracéuticos se valoró en 27 mil millones de dólares en 2016 y se espera que aumente a una tasa compuesta anual del 7,5 % (Mordor Intelligence, 2017). Los hongos comestibles son considerados como alimentos nutracéuticos per se, ya que presentan propiedades tanto nutricionales como medicinales que permiten mejorar las funciones biológicas, y en efecto, la salud del consumidor (Valverde et al., 2013).
Pleurotus ostreatus (Jacq: Fries) Kummer, también conocido como orellana o champiñón ostra, es el segundo hongo comestible más cultivado en el mundo (Suárez y Nieto, 2013). Su producción a nivel mundial durante el año 2013 fue de aproximadamente 6,5 millones de toneladas y se espera que siga en aumento debido a su importancia nutricional, medicinal y gastronómica (Royse y Sánchez, 2017). P. ostreatus sintetiza gran variedad de compuestos bioactivos, principalmente: polisacáridos (alfa y beta-glucanos) (Palacios et al., 2012), proteínas (lectinas y lacasas) (El-fakharany et al., 2010; Gao et al., 2013), glicoproteínas (ubiquitina)(Wang y Ng, 2000), policétidos (lovastatina) (Chen et al., 2012) y polifenoles (primordialmente flavonoides) (Unekwu et al., 2014). Se reporta en la literatura que los extractos de P. ostreatus presentan actividad anticancerígena (Deepalakshmi y Mirunalini, 2016), antihipertensiva (Wang et al., 2002), antiinflamatoria (Gunawardena et al., 2014), antimicrobiana (Ramesh y Pattar, 2010), antioxidante (Khan et al., 2017), anti-tirosinasa (Hapsari et al., 2012), antitumoral (Devi et al., 2015) , cardioprotectora (Yan et al., 2015), hepatoprotectora (Zhang et al., 2016a), hipocolesterolémica, hipoglucémica (Zhang et al., 2016b), inmunomoduladora (Llauradó et al., 2016) y osteoprotectora (Zhang et al., 2017), entre otras. Existen diversos métodos de extracción de compuestos bioactivos, tanto convencionales como no convencionales que, a pesar de diferir en sus metodologías, tienen objetivos en común, tales como, presentar alta eficiencia de extracción, ser factibles tecnológicamente, ser reproducibles y conservar tanto la estabilidad como la bioactividad de los extractos (Smith, 2003; Bernal-Rodríguez, 2012). Sin embargo, todavía no existe un método estandarizado para la extracción de sustancias bioactivas a partir de hongos, ya que las farmacopeas existentes sólo recopilan procedimientos para la obtención de productos naturales de origen vegetal y animal (Farmacopea Francesa, 1847; Farmacopea argentina, 2003; Farmacopea Brasileña, 2010). La industria espera que el método de extracción empleado sea, además de económico, eficiente, para obtener el máximo aprovechamiento de los recursos empleados y mayores utilidades (Martínez-Sánchez y Pérez-Pérez, 2002). La eficiencia, constituye junto con la productividad, el nexo causal para el desarrollo de la empresa (Acevedo y Linares, 2012) y estimula los procesos de I+D+i (Martínez-Rincón, 2016). La optimización de la eficiencia es un reto en el que se puede trabajar de forma conjunta con la academia (Palmer y Chaguturu, 2017).
La maceración es junto con la extracción Soxhlet y la hidrodestilación, uno de los métodos convencionales de extracción de sustancias bioactivas. Consiste en poner en contacto la matriz sólida con el solvente durante un tiempo determinado. La matriz sólida es el material biológico seco en polvo. El solvente, también conocido como menstruo, es un líquido de naturaleza general como el agua, alcoholes alifáticos de hasta tres carbonos (por lo general etanol) o la mixtura de ambos. La mezcla de la matriz sólida con el solvente se denomina tintura. La maceración es un método que pese a ser sencillo, inocuo y de bajo costo, presenta baja eficiencia (Farmacopea Argentina, 2003; Cujic et al., 2016 Azmir et al., 2013; ). La eficiencia del método depende primordialmente de los parámetros de operación (tanto controlables como no controlables), la naturaleza de la matriz sólida, la química de los compuestos bioactivos de interés, los conocimientos científicos y la destreza del experimentador (Azmir et al., 2013); los parámetros de operación son los factores más influyentes (Valverde y Dos Santos, 2000).
Las eficiencias reportadas en la literatura para la extracción de sustancias bioactivas de Pleurotus spp. por maceración dinámica son muy bajas, y oscilan entre 0,4 % y 22 % (Alam et al., 2010; Maity et al., 2011), aún con agitación, parámetro que notoriamente favorece la difusión de sustancias bioactivas en el solvente (Azmir et al., 2013; Duarte-Trujilo y Pineda-Insuasti, 2018). Además, las eficiencias documentadas no hacen alusión al tipo de sustancia bioactiva extraída, ya que son valores generales. La patente estadounidense número US10092609B2, describe el proceso de elaboración de preparados medicinales con paletas mezcladoras, a partir de biomasa fúngica fresca, incluyendo a Pleurotus ostreatus. Proceso mediante el cual se logró una bioactividad mayor que la reportada en la literatura, aunque no se calculó la eficiencia de extracción, ni se detallaron los parámetros de operación (Wieser et al., 2015). Tan sólo un estudio evaluó la influencia de algunos parámetros de operación en el proceso de extracción, pero no obtuvo eficiencias mayores al 3,6 % (Jiao et al., 2017), lo que indica que probablemente la combinación de los parámetros de operación no fue la adecuada.
En un estudio preliminar, se evaluó la influencia del tamaño de partícula, el tiempo de maceración y la frecuencia de agitación, y se encontró que este último es el único factor que influye significativamente sobre la eficiencia de extracción, por lo que se optó por realizar los experimentos consecutivos en condiciones de agitación. La mayor eficiencia se obtuvo operando con frecuencia de agitación de 160 rpm (Duarte-Trujilo y Pineda-Insuasti, 2018). La temperatura es un parámetro que favorece la extracción, sin embargo, se comprobó que el calentamiento afecta la bioactividad de las sustancias, por lo que en este trabajo se prefirió trabajar a temperatura ambiente (Gil-Ramírez et al., 2013; Szwengiel y Stachowiak, 2016). La influencia del resto de parámetros es desconocida.
En este contexto, el objetivo de este trabajo es evaluar la influencia de la concentración de etanol ([etOH]) y la relación sólido/solvente (R/N) en el proceso de extracción de sustancias bioactivas totales y parciales de P. ostreatus (Orellana) por maceración dinámica, manteniendo constantes el resto de parámetros de operación, para demostrar que con lo realizado se puede mejorar ostensiblemente la eficiencia de extracción.
MATERIALES Y MÉTODOS
Material biológico y reactivos
Los cuerpos fructíferos de P. ostreatus, con contenido de humedad del 90 %, se adquirieron de la empresa colombiana CasOrellana, cultivo Mesitas del Colegio (Cundinamarca, Colombia), donde fueron cultivados en bagazo de caña a 23 °C, 990 msnm y 90 % de humedad relativa. Los reactivos de grado analítico se adquirieron de PanReac AppliChem (Barcelona, España), mientras que, el beta-glucano laminarina se adquirió de Sigma-Aldrich (San Luis, MO, EE.UU.).
Preparación del material biológico
Se deshidrataron los hongos frescos en un horno de secado Jelotech OF-11E a 60 °C hasta peso constante (balanza analítica Kern PCB 350-3), según metodología de Ma et al. (2014); posteriormente se molieron en molino eléctrico Victoria VH750-C monofásico a 1650 rpm y se tamizaron con tamices Fisher No. 18 (1 mm) y 35 (0,5 mm) según especificación A.S.T.M.E. El tamaño de partícula (TP) promedio de la matriz sólida (polvo fúngico) fue de 0,6786 mm de ancho por 1,3940 mm de largo, que se determinó con el procesador de imágenes digitales ImageJ.
Diseño experimental
Se realizó un diseño experimental factorial 32, completamente aleatorizado. Se seleccionó como unidad experimental una muestra de 5 g de polvo fúngico y como variable de respuesta la eficiencia de extracción (Ef). Los factores de estudio fueron la concentración de etanol acuoso ([etOH]) y la relación sólido/solvente (R/N). Cada factor contó con tres niveles, los cuales se combinaron formando un total de nueve tratamientos, como relaciona la tabla 1. Los tratamientos se realizaron por triplicado, dando lugar a 27 experimentos. Los parámetros de operación fueron el tipo de solvente (etanol), el tamaño de partícula de la matriz sólida (0,5- 1,0 mm), la frecuencia de agitación (150 rpm) y el tiempo de maceración (90 min) (Albuquerque et al., 2017; Duarte-Trujilo y Pineda-insuasti, 2018). La temperatura (°T) de la tintura se consideró como factor de ruido y se midió en tres momentos: al inicio de la maceración (TM = 0 min), al intermedio (TM = 45 min) y al final (TM = 90 min).
Maceración dinámica
Se pesaron 5 g de polvo fúngico en balanza analítica Kern PCB 350-3 y se depositaron en cada Erlenmeyer junto con la cantidad correspondiente de etanol, conforme al diseño experimental (Tabla 1). Todos los Erlenmeyer se envolvieron en papel aluminio, se rotularon y se dejaron macerando en agitador IKA HS260 (b-s1) a 150 rpm durante 90 minutos. La temperatura (°T) de las tinturas se monitoreó introduciendo el termómetro LCD Digital BOE310 dentro de cada erlenmeyer en el TM indicado. Las tinturas se filtraron en bomba de vacío 5 CFM 1/3hp, con papel Whatman No. 4 previamente secado (horno de secado Jelotech OF-11E) y pesado (balanza analítica Kern PCB 350-3). Los residuos se reservaron para el cálculo de Ef (%) en base seca, y los filtrados (extractos líquidos) para la cuantificación de las sustancias bioactivas, también en base seca.
Tabla 1 Matriz del diseño experimental, para la evaluación de la extracción de sustancias bioactivas de Pleurotus ostreatus por maceración dinámica, empleando etanol acuoso como solvente.
| TRATAMIENTO | [etOH] (%) | R/N |
| T1 | 50 | 1:10 |
| T2 | 50 | 1:20 |
| T3 | 50 | 1:30 |
| T4 | 80 | 1:10 |
| T5 | 80 | 1:20 |
| T6 | 80 | 1:30 |
| T7 | 90 | 1:10 |
| T8 | 90 | 1:20 |
| T9 | 90 | 1:30 |
Donde; [etOH] corresponde a la concentración del etanol acuoso en términos de porcentaje, y R/N representa la relación sólido/solvente.
Cuantificación de eficiencia de extracción total
La ecuación 1 permitió calcular la Ef (%) como el cociente entre el Peso Seco del Extracto (PSE) y el Peso Seco de la Muestra (PSM), multiplicado por 100. PSM corresponde a 5 g de polvo fúngico, mientras que PSE se calcula restando el Peso Seco del Residuo al PSM. PSE se calculó con una resta, con el objetivo de la evitar la evaporación de los filtrados, ya que en forma líquida es más fácil la cuantificación de sustancias bioactivas.
Cuantificación de eficiencia por componentes
Se cuantificaron por espectroscopia en espectrofotómetro UV-VIS RIGOL Ultra-3660 por quintuplicado. Se aplicó el método del ácido sulfúrico y fenol para la estimación de carbohidratos (CH) totales usando glucosa (C6H12O6) como patrón (DuBois et al., 1956); el método del ácido dinitrosalicilico (DNS) para la medición de azúcares reductores empleando glucosa (C6H12O6) como patrón (Miller, 1959; Ávila et al., 2012); el método del Folin-Ciocalteu para la cuantificación de polifenoles usando ácido gálico (C7H6O5) como patrón (Singleton et al., 1999); el método de rojo congo para medición de beta-glucanos empleando laminarina de Laminaria digitata como patrón (Nitschke et al., 2011); y el método de Bradford para la determinación de proteinas empleando Albúmina de Suero Bovino (BSA) como patrón (Bradford, 1976; Tehrani et al., 2012).
La ecuación 2 permitió calcular la eficiencia de extracción por Sustancia Bioactiva (ESB). Consta del producto de la Concentración de Sustancia Bioactiva en el extracto (CSB) y el Volumen de la Tintura (VOL), dividido entre el producto del Peso Seco de la Muestra y el factor de conversión de microgramos a gramos, multiplicado todo por 100.
Análisis estadístico
Los datos fueron tratados en el Software estadístico R® - 3.4.2, con un nivel de confianza del 95 %. Se realizó un Análisis de Varianzas (ANOVA, por sus siglas en inglés), y en los casos en donde se encontró diferencias significativas entre los tratamientos, se realizó la prueba de comparaciones múltiples de Tukey (HSD, por sus siglas en inglés) para identificar cuáles son los tratamientos diferentes entre sí. Previamente, se verificaron los supuestos de la estadística paramétrica más importantes: normalidad y homocedasticidad (homogeneidad de varianzas). La distribución normal se verificó con la prueba de Shapiro-Wilk, mientras que la homocedasticidad de los datos se verificó con la prueba de Levene. Los datos que no presentaron distribución normal se transformaron con la distribución de Johnson, empleando la función "SB" (Chou et al., 1998), y se sometieron de nuevo a verificación de supuestos.
RESULTADOS
Control de temperatura
La Fig. 1 representa las temperaturas (°T) de cada tintura, medidas en diferentes tiempos de maceración (TM). Se observa que, con el transcurso del TM, la °T permaneció inestable en T4; fluctuó con tendencia a aumentar en T2 y T5; aumentó en T1, T7 y T8; y disminuyó paulatinamente en T3, T6 y T9.
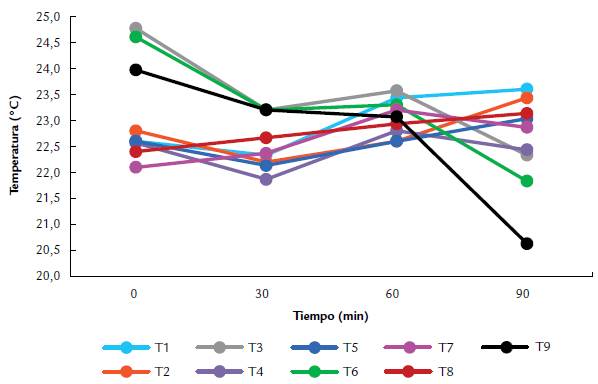
Figura 1 Control de temperatura de la tintura (solvente + polvo fúngico) durante la extracción de sustancias bioactivas de Pleurotus ostreatus por maceración dinámica, empleando etanol acuoso como solvente a diferentes concentraciones (50 %, 80 %, 95 %) y diferentes relaciones sólido/solvente (1:10, 1:20, 1:30). Los tratamientos (T) evaluados fueron: T1(50 %, 1:10); T2 (50 %, 1:20); T3 (50 %, 1:30); T3 (80 %, 1:10); T4 (80 %, 1:20); T5 (80 %, 1:30); T6 (95 %, 1:10); T7 (95 %, 1:20); T7 (95 %, 1:30). Los datos corresponden a la media de la temperatura a partir de tres experimentos independientes por tratamiento. Los datos se tomaron en cuatro momentos: TM= 0 min, TM= 30 min, T= 60 min, T= 90 min.
Eficiencia de extracción de sustancias bioactivas totales
T3 fue el tratamiento que presentó la mayor eficiencia, correspondiente al 40,9 %, seguido de T2 y T1, con eficiencias del 36,6 / y 32,4 /, respectivamente. Los resultados de la prueba de Tukey mostraron que T3 fue el único tratamiento estadísticamente diferente del resto. Por el contrario, T2 y T1 presentaron similitud estadísticamente significativa entre sí (Fig. 2). El ANOVA multifactorial arrojó un valor p de 5,254e11 para [etOH], de 8,485e05 para la R/N y de 0,3022 para la interacción entre ellos. Se dedujo que ambos factores tienen una influencia estadísticamente significativa sobre Ef (%), pero su interacción no. La influencia de [etOH] fue mayor, ya que los tres mejores tratamientos operaron con etanol al 50 %, pero difieren en la R/N.
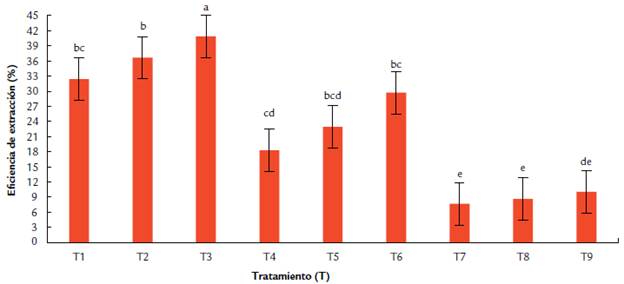
Figura 2 Efecto de los diferentes tratamientos en la eficiencia de extracción de sustancias bioactivas totales de Pleurotus ostreatus por maceración dinámica, empleando etanol acuoso como solvente a diferentes concentraciones (50 %, 80 %, 95 %) y diferentes relaciones sólido/ solvente (1:10, 1:20, 1:30). Los tratamientos (T) evaluados fueron: T1(50 %, 1:10); T2 (50 %, 1:20); T3 (50 %, 1:30); T3 (80 %, 1:10); T4 (80 %, 1:20); T5 (80 %, 1:30); T6 (95 %, 1:10); T7 (95 %, 1:20); T7 (95 %, 1:30). Los datos corresponden a la media de la eficiencia a partir de tres experimentos independientes por tratamiento. Como análisis estadístico se realizó una prueba de comparaciones múltiples de Tukey, con un nivel de confianza del 95%. Las letras sobre las barras representan las diferencias estadísticamente significativas entre tratamientos.
Eficiencia de extracción por componentes
Carbohidratos totales
Los tratamientos que presentaron mayor eficiencia fueron T2, T3 y T6, con eficiencias de 17,9 %, 11,9 % y 12,4 %, respectivamente. Los resultados de la prueba de Tukey revelaron que T2 presenta diferencias estadísticamente significativas con respecto a T3 y T6 (Fig. 3a). El ANOVA multifactorial arrojó un valor p de 1,79e-11 para [etOH], de 1,97e-05 para R/N y de 0,00243 para la interacción entre estos. Se comprobó que tanto los factores como su interacción tienen influencia estadísticamente significativa sobre la ESB (%) de carbohidratos totales.
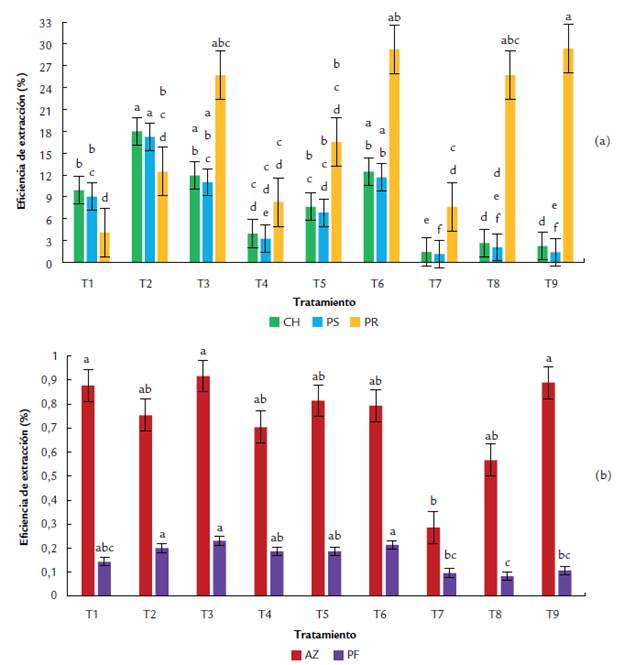
Figura 3 Efecto de los diferentes tratamientos en la eficiencia de extracción selectiva (por componentes) de sustancias bioactivas de Pleurotus ostreatus por maceración dinámica, empleando etanol acuoso como solvente a diferentes concentraciones (50 %, 80 %, 95 %) y diferentes relaciones sólido/solvente (1:10, 1:20, 1:30). Donde; CH = carbohidratos; PS = polisacáridos; PR = proteínas; AZ = azúcares reductores; PF = polifenoles. Los tratamientos (T) evaluados fueron: T1(50 %, 1:10); T2 (50 %, 1:20); T3 (50 %, 1:30); T3 (80 %, 1:10); T4 (80 %, 1:20); T5 (80 %, 1:30); T6 (95 %, 1:10); T7 (95 %, 1:20); T7 (95 %, 1:30). Los datos corresponden a la media de la eficiencia a partir de tres experimentos independientes por tratamiento. Como análisis estadístico se realizó una prueba de comparaciones múltiples de Tukey, con un nivel de confianza del 95%. Las letras sobre las barras representan las diferencias estadísticamente significativas entre tratamientos.
Azúcares reductores
T3, T9 y T1 presentaron las mayores eficiencias (0,92 %, 0,89 % y 0,88 % respectivamente). Los resultados de la prueba de Tukey revelaron que T1, T3 y T9 no presentaron diferencia estadísticamente significativa entre sí (Fig. 3b). El ANOVA multifactorial arrojó un valor p de 0,0339 para [etOH], de 0,0592 para la R/N y de 0,1344 para la interacción entre ellos; por lo que se dedujo que ambos factores tienen influencia estadísticamente significativa sobre la ESB (%) de azúcares reductores, pero su interacción no tiene efecto.
Polisacáridos totales
T2 presentó el valor de eficiencia más alto, correspondiente al 17,23 %, seguido de T3 y T6, con eficiencias del 10,99 % y 11,66 %. Los resultados de la prueba de Tukey revelaron que los tres mejores tratamientos presentaron similitud estadística entre sí (Fig 3a). El ANOVA multifactorial arrojó un valor p de 1,17x1009 para [etOH], de 0,000166 para R/N y de 0,040940 para la interacción entre ellos; lo que demostró que ambos factores, al igual que su interacción, tienen una influencia estadísticamente significativa sobre ESB (%) de polisacáridos totales.
Polifenoles
Los tratamientos que presentaron las eficiencias más altas fueron T3, T6 y T2 (0,23 %, 0,21 % y 0,20 %, respectivamente), los cuales no presentaron diferencias estadísticamente significativas entre sí, según la prueba de Tukey (Fig. 3b). El ANOVA multifactorial arrojó un valor p de 1,27x10e-06 para [etOH], de 0,0351 para R/N y de 0,1107 para la interacción entre ellos, lo que indica que ambos factores tienen influencia significativa sobre la ESB(%) de polifenoles, pero su interacción no.
Proteínas
T9 y T6 tienen la ESB (%) más alta (29,39 % y 29,21 % respectivamente), seguidos de T3 y T8 (25,7 % cada uno). Según la prueba de Tukey, T9 presenta diferencias estadísticamente significativas con el resto de tratamientos, aunque es similar T6, T3 y T8 (Fig. 3a). Por otro lado, T3 y T8 no presentan diferencias estadísticamente significativas entre sí. El ANOVA multifactorial arrojó un valor p de 0,169 para [etOH], de 3,25x10-05 para R/N y de 0,686 para la interacción entre ellos, lo que quiere decir que el único factor que tiene influencia estadísticamente significativa sobre la ESB(%) de proteínas es R/N.
DISCUSIÓN
Control de temperatura
Algunos tratamientos como T3, T6 y T9 disminuyeron su temperatura en el transcurso de la maceración, lo que se debió principalmente a la alta concentración del etanol, una sustancia con alta presión de vapor que absorbe energía del medio para volatilizarse (Griffin, 2009; Thorpe y Thorpe, 2010). Otros tratamientos como T1, T4 y T7 aumentaron su temperatura en el transcurso de la maceración, ya que la baja R/N permitió la concentración de las saponinas fúngicas (Nikiforova et al., 2009), cuya actividad surfactante promovió la formación de puentes de hidrógeno y, por lo tanto, la retención del alcohol en la matriz sólida porosa (hongo molido), evitando su volatilización (Nam y Lee, 1999).
Sin embargo, los cambios de °T no fueron lo suficientemente grandes como para evaluar la influencia de este parámetro en el proceso de extracción.
Gil-Ramírez et al. (2013) evaluaron la influencia de los parámetros de operación en el método de Extracción por Agua Presurizada y obtuvieron la máxima actividad hipocolesterolémica (76 %) a una °T de 25 °C. Cuando aumentaron la °T a 200 °C obtuvieron la mayor eficiencia (55 %), aunque la bioactividad fue casi nula. Lo anterior indica que la bioactividad es una variable influenciable por ciertos parámetros de operación. Se recomienda su evaluación para estudios posteriores.
Eficiencia de extracción de sustancias bioactivas totales
En la literatura no se encontraron estudios donde se haya usado etanol al 50 % en la extracción de sustancias bioactivas totales de Pleurotus spp. por maceración dinámica, que permitiera contrastar las eficiencias de extracción con los tres mejores tratamientos de esta investigación (T3, T2 y T1), que operaron a esa concentración. Sólo la patente KR20160072674A describe el método de extracción de sustancias bioactivas de P. ostreatus por reflujo, empleando diferentes concentraciones de etanol (25, 50, 75, 95 %) sin revelar eficiencias de extracción (Akiko et al., 2002; Kim, 2014). Si bien, un estudio realizado con la levadura Kluyveromyces lactis reveló que el etanol al 40-50 % es un agente eficaz de permeabilización a °T de 5 °C y °T de 30 °C, favoreciendo la difusión de las sustancias bioactivas (Flores et al., 1994). La Farmacopea Brasileña (2010) aconseja extraer las sustancias bioactivas a partir de matrices sólidas vegetales con etanol al 60 %, ya que este es un solvente de naturaleza general y alta polaridad que permite extraer la mayor parte de constituyentes químicos del material biológico (Cujic et al., 2016).
En cuanto a la R/N, no se pudo hacer comparaciones, ya que sólo Alam et al., (2010) y Lin et al., (2014) informaron una R/N de 1:22 para la extracción, por maceración dinámica, de P. ostreatus y P. eryngii, respectivamente. Wang et al. (2002) patentaron un extracto medicinal de P. ostreatus por maceración estática, usando una R/N de 1:4. Tetsuro et al. (2004) patentaron un proceso de extracción de sustancias bioactivas de P. ostreatus por decocción o reflujo, usando una R/N entre 1:3 y 1:10, del mismo modo que Kim (2014), quien a diferencia usó una R/N de 1:40. Cheung y Wu (2013) extrajeron las sustancias bioactivas de Cordyceps sinensis por Extracción Asistida por Ultrasonido (UAE, por sus siglas en inglés) y encontraron que la R/N tiene influencia significativa sobre la Ef (%), ya que el rendimiento del extracto en base seca disminuyó cuando la relación aumentó de 1:30 a 1:70. El mayor rendimiento se obtuvo con la R/N de 1:30, al igual que en esta investigación.
La influencia de [etOH] y R/N en la eficiencia de extracción de sustancias bioactivas totales de Pleurotus spp. por maceración dinámica no había sido estudiada en ninguna investigación anterior. Aunque analizando la literatura se encontró una correlación negativa entre [etOH] y Ef (%), ya que al emplear etanol al 70 % la eficiencia fue del 15,7 %(Hapsari et al., 2012), con etanol al 80 % la eficiencia disminuyó al 13,8 % (Alam et al., 2010) y con etanol absoluto la eficiencia se redujo a tan sólo el 0,23 % (Choi et al., 2013). Se evidenció que al igual que en esta investigación, un aumento en [etOH] se traduce en una disminución en Ef (%).
En el presente trabajo se obtuvo una Ef (%) de aproximadamente el 41 %, lo que representó un gran avance en materia de viabilidad, teniendo en cuenta que las mayores Ef (%) reportadas en la literatura para la extracción de sustancias bioactivas totales de P. ostreatus por maceración dinámica correspondieron al 15,7 % (Hapsari et al., 2012) y 22,2 % (Alam et al., 2010), usando como solvente etanol 70 % a 50 °C y agua a 70 °C, respectivamente. En cuanto a la maceración estática, la mayor Ef (%) reportada es del 10 %, empleando agua a ebullición para la obtención de extractos de P. cornucopiae con actividad antioxidante (Pahila et al., 2017), y del 0,23 % para la obtención de extractos de P. eryngii con actividad anti-dermatitis, empleando etanol absoluto como solvente (Choi et al., 2013). Lo anterior muestra que incorporar agitación durante la maceración incrementa notablemente la Ef (%) (Cujic et al., 2016).
Se logró aumentar la eficiencia en aproximadamente el doble de la reportada en la literatura, lo que aumenta la viabilidad del proceso. El extracto obtenido puede ser utilizado sólo o como ingrediente activo en composiciones farmacéuticas. En caso de utilizarse sólo, puede ser agregado a jugos y bebidas nutritivas (Mahajna et al., 2006).
Eficiencia de extracción por componentes
Carbohidratos totales y azúcares reductores
Los carbohidratos de Pleurotus spp. son en su mayoría bioactivos, de los cuales, los beta-glucanos son los polisacáridos que presentan mayor actividad biológica (Gomes-Corrêa et al., 2016). Los glucósidos cardiacos y los glucósidos esteroides son los únicos azúcares de P. ostreatus que presentan actividad biológica, aunque no existen estudios que evalúen su proceso de extracción (Iwalokun et al., 2007; Unekwu et al., 2014).
La extracción de carbohidratos totales de Pleurotus spp. no ha sido muy abordada porque este grupo de biomoléculas comprende gran variedad de sacáridos, que difieren en cuanto a secuencia, longitud, estructura molecular y grado de polimerización, entre otras propiedades que influyen en su actividad biológica y en su solubilidad en el solvente de extracción (Ramakrishnan y Angayarkanni, 2007; Villares, 2014).
Debido a la diversidad de carbohidratos que puede contener el extracto, una sola concentración de etanol no podría extraer todos los carbohidratos de Pleurotus spp., aunque en general, los azúcares son muy solubles en agua y algo solubles en etanol, mientras que los polisacáridos son por lo general insolubles a una [etOH] mayor al 80 % (Ramakrishnan y Angayarkanni, 2007; Villares, 2014), lo que explica que en este trabajo, el etanol al 50 % promovió la mayor extracción de carbohidratos totales.
Polisacáridos totales
Comúnmente, la extracción de polisacáridos fúngicos implica la maceración del hongo seco y molido en soluciones acuosas, que pueden ser alcalinas, etanólicas o solamente agua a ebullición; aunque algunos polisacáridos hidrofóbicos pueden no ser extraídos (Wang et al., 2012).
La R/N de T2 (1:20), el tratamiento con la eficiencia más alta, estuvo comprendida dentro del intervalo (1:17 a 1:22) descrito en la patente CN107987180A para la extracción de polisacáridos de P. ostreatus con agua caliente y etanol absoluto. Sun et al., (2010), optimizaron la extracción de polisacáridos de P. ostreatus por maceración estática y obtuvieron su mayor pureza con una R/N de 1:22, muy similar a la de T2. No se midió la eficiencia de extracción.
Cheung y Wu (2013) optimizaron la extracción de polisacáridos de Cordyceps sinensis por UAE y alcanzaron la mayor eficiencia con una R/N de 1:30, como T3, el segundo mejor tratamiento. La patente CN104292348B describe la extracción de polisacáridos de P. ostreatus con agua caliente, seguido de etanol absoluto, con una R/N de 1:30 (Li, 2009). La patente CN104292348B describe la extracción de polisacáridos de P. ostreatus con agua caliente y R/N 1:30, y documenta una eficiencia de extracción del 8,3 % (Hu et al., 2014). T2 duplicó la eficiencia reportada por la patente.
La influencia significativa de la R/N coincidió con el estudio de Sun et al., (2010), quienes optimizaron mediante el Método de Superficie de Respuesta (RSM) el proceso de extracción acuosa de polisacáridos de P. ostreatus por maceración estática. Jiao et al. (2017) también optimizaron por RSM el proceso de Extracción Enzimática Asistida (EAE) de polisacáridos de P. djamor, y obtuvieron su mayor eficiencia (3,61 %) operando con una R/N de 1:57. La alta R/N pudo haber causado la baja eficiencia de extracción, ya que es un factor con influencia significativa, como indica el ANOVA multifactorial. Yuan et al. (2017) también hallaron influencia significativa de la R/N en la extracción de polisacáridos de Russula griseocarnosa; la eficiencia aumentó entre la R/N de 1:20 y la R/N de 1:50, y posteriormente disminuyó. El resto de autores no evaluaron la influencia de la R/N, pero usaron las siguientes proporciones de forma predeterminada: 1:10 (Mitra et al., 2013; Chen et al., 2016), 1:15 (Liu et al., 2015), 1:25 (Ma et al., 2014),1:30 (Li y Shah, 2016), 1:50 (Radzki et al., 2016).
La influencia significativa del Factor [etOH] coincidió con el estudio de Liu et al. (2010), que optimizaron el proceso de extracción de polisacáridos de Pleurotus spp. por UAE. Para los autores, el etanol al 90 % permitió la máxima eficiencia de extraccción, correspondiendo al 7,1 % para P. nebrodensis, 7,5 % para P. eryngii y 8,2 % para P. cornucopiae. Sin embargo, las eficiencias fueron muy bajas en contraste con otros estudios, debido a que las [etOH] mayores al 80 % sólo permiten la extracción selectiva de lípidos, azúcares reductores, proteínas y moléculas de bajo peso molecular (Tong et al., 2009; Dalonso et al., 2010; Maity et al., 2011; Mitra et al., 2013; Facchini et al., 2014; Komura et al., 2014; Yan et al., 2015; Radzki et al., 2016; Jiao et al., 2017). El etanol a concentraciones altas es el alcohol más favorable para la precipitación de los polisacáridos fúngicos, por lo que resulta más útil en procesos de separación y purificación que en procesos de extracción (Villares, 2014).
Se logró superar en más del doble las eficiencias reportadas en la literatura. Mientras que en este trabajo se reportó una eficiencia máxima del 17,23 %, otros autores sólo alcanzaron valores entre el 3,6 % y el 7,8 % (Tong et al., 2009; Dalonso et al., 2010; Maity et al., 2011; Mitra et al., 2013; Facchini et al., 2014; Komura et al., 2014; Yan et al., 2015; Radzki et al., 2016; Jiao et al., 2017).
Polifenoles
Cujic et al. (2016) obtuvieron la máxima extracción de polifenoles de Aronia spp. por maceración dinámica operando con una [etOH] de 50 % y una R/N de 1:20, las mismas condiciones que T2, el tratamiento más eficiente. Etanol al 50 % fue referido por algunos autores como un solvente apropiado para la solubilización de polifenoles extraíbles de plantas (Dominguez-Rodriguez et al., 2017; Okiyama et al., 2018).
Un modelo creado mediante RSM para evaluar la extracción de polifenoles de cáscara de granada evidenció que 1:30 fue la mejor R/N, ajustada por una [etOH] del 60 % (Sood y Gupta, 2015), coincidiendo con dos de los tratamientos más eficientes, T3 y T6, que operaron con la misma R/N y concentraciones del 50 % y 80 %, respectivamente. Tratamientos como T6, con etanol 80 % y R/N = 1:30, ya fueron reportados en la literatura como la mejor combinación en la extracción de polifenoles de Thymus serpyllum L. (Jovanovic et al., 2017). De igual modo, ya se reportó el etanol al 80 % como el mejor solvente para la extracción de polifenoles de cáscara de mandarina por UAE (Safdar et al., 2017).
La influencia significativa del factor [etOH] coincidió con el estudio de Finimundy et al., (2018), quienes optimizaron la extracción de polifenoles de P. sajor-caju mediante Extracción Asistida por Calentamiento (HAE, por sus siglas en inglés), obteniendo su mayor eficiencia a una [etOH] del 72 %, cercana T6.
Proteínas
La extracción de proteínas se realizó de acuerdo con Bravo etal. (2011), mezclando los extractos hidro-alcohólicos con buffer fosfato de sodio (FS) pH 7,3 en relación 1:1 y agitando durante 2-3 horas. Luego, se centrifugó en Centrífuga Thermo Scientific SL-40R a 4500 rpm durante 30 min y se mezcló el sobrenadante con acetona fría en relación 1:4. Para concentrar las proteínas, se centrifugó a 4000 x g durante 20 minutos a 4 °C (Tehrani et al., 2012). El proceso de extracción de proteínas fue similar al de Karmali (2007) y Zhang et al. (2017), quienes también emplearon acetona fría y buffer fosfato salino a pH neutro, aunque con diferentes parámetros de operación.
Se encontraron dos patentes (KR100971874B1, CN102382181B), que describen procesos de extracción de proteínas fúngicas. El primero detalla la extracción acuosa a alta temperatura y alta presión con R/N de 1:20. El segundo detalla la extracción acuosa a baja presión y baja temperatura con una R/N de 1:10 a 1:20, seguida de una extracción en etanol (70-80 %) con los mismos parámetros de operación (Young, 2008; Chen et al., 2011). No se pudo hacer comparaciones con este trabajo, ya que los métodos de extracción eran diferentes y la eficiencia del proceso no fue relacionada en la invención.
Tao et al. (2009) emplearon buffer NaCl para la obtención de extractos proteicos de P. tuber-regium, con una ESB(%) de hasta el 42 %, superando en aproximadamente un 10 % la máxima ESB(%) obtenida en T9, el tratamiento con la eficiencia más alta. Por su parte, Xia et al. (2011) extrajeron proteoglicanos de P. ostreatus por maceración estática con agua a 80 °C y luego precipitaron las proteínas con etanol a 4 °C durante 12 h, obteniendo eficiencias de menos del 5 %. Según esto, este trabajo no representó un avance en términos de eficiencia de extracción de proteínas, ya que la eficiencia máxima fue inferior a la reportada en la literatura.
Betaglucanos
La extracción de los beta-glucanos fúngicos está en función de su estructura, de la cual depende su solubilidad en agua caliente o soluciones alcalinas (principalmente NaOH acuoso). El agua caliente extrae los beta-glucanos polares mientras que las soluciones alcalinas extraen los apolares (Zhu et al., 2015). La mayoría de los betaglucanos polares presentan una o más actividades biológicas, mientras que los apolares raramente presentan actividad biológica, pero cuando lo hacen tienen mayor acción estimulante del sistema inmunológico (Bohn y BeMiller, 1995; Zekovic et al., 2005).
El agua de extracción tiene que estar caliente para alterar la estructura de los beta-glucanos y aumentar la solubilidad, lo que explica que en este trabajo la extracción haya sido casi nula, ya que se operó a temperatura ambiente para evitar la degradación de los compuestos fenólicos por las altas temperaturas (Valverde y Dos Santos, 2000; Zhu et al., 2015).
CONCLUSIONES
La maceración dinámica con etanol acuoso es un método de extracción apropiado para la extracción de sustancias bioactivas totales de Pleurotus ostreatus. La concentración de etanol ([etOH]) y la relación sólido/solvente (R/N) son dos parámetros de operación que influyen significativamente en la eficiencia; por su parte, los cambios de temperatura, producto de la agitación de la tintura, no son lo suficientemente grandes como para evaluar su influencia en el proceso. Operar con etanol al 95 % y una R/N de 1:30 permite obtener extractos ricos en proteínas, con una eficiencia del 30 % en base seca mientras que, operar con etanol al 50 % y una R/N de 1:30, permite obtener extractos ricos en polisacáridos, azúcares reductores y polifenoles, alcanzando una eficiencia del 41 % en base seca. La eficiencia obtenida duplica la máxima reportada en la literatura, lo que representa un aporte científico y tecnológico para el proceso de maceración dinámica de matrices sólidas fúngicas con fines industriales, y en particular, para la obtención de novedosos productos nutracéuticos y cosmocéuticos.
Por otro lado, se recomienda evaluar la influencia de los diferentes parámetros de operación en la bioactividad de los extractos, ya que el potencial nutracéutico está en función de la bioactividad.