INTRODUCCIÓN
El tratamiento de leishmaniosis se ha centrado en el uso de antimoniales pentavalentes (Glucantime, Pentostam) como primera elección (OMS, 1998; Henao et al., 2004). Sin embargo, dado a los efectos colaterales, costo, distribución, administración parenteral y seguimiento médico estricto, se han propuestos tratamientos alternativos aún en fase experimental ó fase preclínica (Soto y Soto, 2006; Maldonado y Pérez, 2016). Específicamente, una nueva generación de tratamientos químicos como la Ulamina, se orientan hacia la búsqueda de antimoniales menos citotóxicos, más tolerables para el paciente, con una mejor relación costo-beneficio de adecuada disponibilidad para él en las localidades endémicas (Scorza Dagert et al., 2006). Sin embargo, existen otras alternativas de tratamiento no basadas en antimoniales, como la inmunoterapia usada en pacientes leishmánicos. A pesar de no ser un tratamiento propuesto oficialmente por la Organización Mundial de la Salud, a nivel local (Venezuela), se evidenció cura clínica en pacientes tratados con la vacuna de promastigotes atenuados. Sin embargo, existen diferencias en la efectividad entre los servicios locales de salud determinándose en promedio un 60 % de curación exitosa (Convit et al., 2005). En la última década, se han evaluado otras alternativas anti-Leishmania, que han favorecido la identificación y validación de nuevas dianas quimio terapéuticas, basadas en la disponibilidad reciente de la secuencia genómica de Leishmania. Por ello en la actualidad se están ensayando exhaustivamente inhibidores de la biosíntesis de ergosterol como un blanco de acción (Nieves et al., 2007).
Algunos autores han señalado como una alternativa viable, el uso de fármacos antimicóticos, antifúngicos y antirítmicos cardíacos (amiodarona, aplicación experimental) de venta comercial y empleados convencionalmente para tratar otras patologías en humanos, ya que actúan inhibiendo la síntesis del ergosterol y por ende la membrana celular (López-Carvajal et al., 2016; Pinto y Tempone, 2018). No obstante, con su aplicación se ha evidenciado quimio-resistencia y efectos colaterales en niños y mujeres embarazadas (Serrano et al., 2009). Esto ha motivado a otros grupos de investigación en la búsqueda de tratamientos naturales y alternativos, como el uso de extractos de plantas para tratar la úlcera leishmánica (Ponte-Sucre et al., 2007), así como el uso de la terapia larval (TL), que a priori brinda la posibilidad de tratar a pacientes con úlceras leishmánicas, clasificadas como lesiones crónicas de piel, en donde el proceso normal de cicatrización está alterado, en su fase inflamatoria y de proliferación, más la frecuente existencia de co-infección bacteriana que deriva en la no cicatrización (Jiménez, 2008). Aunque se señalan efectos colaterales durante el uso de la TL en algunos pacientes, por lo que se necesita evaluar periódicamente al paciente tratado sin necesidad de hospitalización, la relación beneficio-costo de la TL es alta, además de sus propiedades de curación de heridas (Sánchez et al., 2004; Sherman, 2009; Sherman, 2013; Patarroyo, 2015; Brambilla, 2018).
Teniendo en cuenta lo propuesto anteriormente, la TL combina variables que se centran en las propuestas más efectivas para los tratamientos de leishmaniosis cutánea, tales como la actividad bactericida de amplio espectro debida a la aplicación de antifúngicos y antimicrobiales, el efecto citotóxico de la excreciones y secreciones sobre amastigotes y promastigotes por actividad anti-Leishmania, la cicatrización efectiva y rápida de las lesiones a largo plazo, con menor número de aplicaciones locales no invasivas de carácter hospitalaria, y la mejor relación costo-beneficio (Pinheiro et al., 2015; Azad et al., 2016; Laverde-Paz et al., 2018). Siguiendo el enfoque de la terapia larval como un tratamiento de la medicina tradicional (Sánchez et al., 2004), existen previas investigaciones sobre el uso efectivo de la TL para el tratamiento curativo de la leishmaniosis usando Lucilia sericata, L. eximia y Sarconesiopsis magellanica (Arrivillaga et al., 2008; Wolff Echeverri et al., 2010; Polat y Kutlubay, 2014; Cruz-Saavedra et al., 2016). Sin embargo, uno de los principales problemas en la cría de moscas para terapia larval de las úlceras leishmániacas, es que las moscas son necrófagas, lo que implica que uno de los principales problemas a nivel hospitalario es el control del olor durante la colonización y producción de las larvas por lo que se han sugerido diferentes métodos y dietas de alimentación para el uso de especies convencionales en TL como Lucia sericata (Sherman y Pechter, 1988), representando beneficios-costos diferenciales a nivel hospitalario.
En el caso de L. eximia, se han encontrado resultados que requieren evaluar la idoneidad para su uso en terapia larval con fines biomédicos derivado a la formación de abscesos miásicos, a pesar de su efectividad durante la aplicación de la TL (Calderón-Arguedas et al., 2014). En este sentido, se plantea el uso de M. domestica, una promisoria especie de mosca en la terapia larval de lesiones crónicas, ya que comparativamente con otras especies de moscas usadas en la TL- Leishmania, es una especie no necrófaga, doméstica, rara vez causa miasis en humanos y las pocas veces en que se han reportado han sido casos accidentales, tiene una ciclo de vida más corto, distribución geográfica cosmopolita, mayor abundancia poblacional, es una especie sinantrópica de fácil colecta, y su alimentación con base en una dieta sintética facilita su mantenimiento bajo condiciones de laboratorio con bajo costo de producción (Li et al., 2008; Martiradonna et al., 2009). Adicionalmente, existen estudios que han evidenciado el uso masivo de Musca domestica para el tratamiento de lesiones crónicas de piel en humanos, sin evidencia de efectos colaterales en su uso directo (Jun-Cheng et al., 2012). Además, se han caracterizado sus extracciones y secreciones larvales, determinándose una potente actividad antitumoral, antiviral y antibacterial de las fracciones proteicas de larvas (Fu et al., 2009), así como sus efectos anti-plasmodial sobre Plasmodium berghei, lo que representa la primera evidencia de acción sobre un parásito metaxénico (Shittu et al., 2013). Por lo tanto, el objetivo de esta investigación fue evaluar a la especie M. domestica como una especie de mosca alternativa para la terapia larval de úlceras causadas por Leishmania en un modelo murino.
MATERIALES Y MÉTODOS
Desinfección de las larvas para TL
El material biológico de M. domestica, proviene de una colonia previamente establecida en el laboratorio de Parasitología de la Universidad de los Andes, Venezuela, según el protocolo de Martiradonna et al. (2009). Desde el material de colonia, se seleccionó un grupo de huevos que fueron desinfectados según el protocolo de Arrivillaga et al. (2008) mediante un tratamiento de desinfección en una solución de hipoclorito de sodio al 5 % (50 000 ppm). Luego, se lavaron con solución fisiológica estéril al 0,9 % (9000 ppm) dentro de una cámara de flujo laminar, se esterilizaron con solución de formalina al 10 % y luego se colocaron en placas en un medio de cultivo agar sangre estéril para su eclosión y verificación de la esterilidad de las larvas (Figueroa et al., 2007).
Modelo animal, Mesocricetus auratus
Los animales de experimentación se obtuvieron del Bioterio experimental de la Universidad Centro Occidental "Lisandro Alvarado" de Venezuela. En los ensayos se utilizaron 15 ejemplares machos de cinco semanas de edad y con un peso promedio de 70 gramos. Se escogió esta especie de roedor por sus características inmunes que la hacen susceptible a la infección por Leishmania, observándose una respuesta infecciosa superior a la de ratones (Rezzano y Scorza, 1985; Salomón et al., 2001). Adicionalmente, se empleó como modelo animal ya que se obtienen lesiones crónicas similares a las observadas en humanos (Henao et al., 2004). Por otro lado, en la mayoría de los estudios farmacológicos para el tratamiento de la leishmaniosis se emplea este modelo animal, lo que permite comparar los resultados (Rezzano y Scorza, 1985).
Los animales experimentales se mantuvieron en el laboratorio experimental del "Insectario Pablo Anduze", del Instituto Experimental "José W. Torrealba" de la ULA-Trujillo, y se manejaron bajo las normativas del Código de Bioética y Bioseguridad del Ministerio de Ciencia y Tecnología de Venezuela (MCT, 2002). Los protocolos de bioética para la terapia larval en un modelo animal fueron aprobados por la comisión de bioética de la Universidad Simón Bolívar (6-6-2008) y por la comisión de ética del Fonacit como parte del Proyecto Misión Ciencia "Producción de conocimiento y nuevas tecnologías nacionales para el tratamiento de quemaduras y lesiones crónicas de piel" N. 2007001522 (17-01-2012).
Aplicación de larvas de mosca
Se seleccionaron las larvas de segundo estadio temprano (L2) para optimizar su manipulación, por su efectividad similar a las larvas de primer estadio convencionalmente usadas en la TL (Polat et al., 2012), y para evaluar el efecto de formación potencial de abscesos miásicos por invasividad, vistos en otras especies de moscas que se han usado recientemente en la terapia larval de Leishmania (Calderón-Arguedas et al., 2014).
Según la metodología de Arrivillaga et al. (2008), se consideró la relación de una larva por 10 mm2 de lesión para calcular el número de L2 adecuado al tamaño de cada lesión leishmánica en el modelo experimental murino, lo que equivale a 10 larvas/cm2 (Figueroa et al., 2007; Calderón-Arguedas et al., 2014). Las larvas se aplicaron directamente sobre la lesión y en el perímetro de la lesión se colocó un apósito de hidrocoloide (DUODERM CGF), con el fin de que las larvas no salieran del área de tratamiento, y así mantener la humedad de la lesión. El vendaje con las larvas se retiró a las 12 horas, ya que se sugiere que este es el tiempo mínimo para ver los efectos de la TL en el modelo de hámster para Leishmania, según Arrivillaga et al. (2008).
Inoculación experimental en hámsteres
Se usó una cepa de referencia mundial, Leishmania amazonensis, FLA/BR/67/PH8 (De Moura et al., 2005), la cual constituye un material biológico certificado para poder comparar resultados y validar técnicas. Esta cepa de referencia tiene características fenotípicas y genotípicas definidas (WHO, 2000) y fue donada en un hámster infectado por el doctorJosé Vicente Scorza de la Universidad de los Andes (ULA), Mérida, Venezuela, mantenida en animales de experimentación (Mesocricetus auratus) y en medio de cultivo agar sangre (NNN) en el laboratorio de Parasitología de la ULA-Mérida. El mantenimiento y pase de los parásitos en los tubos de cultivo a pH 7,4 se realizó cada siete días y se mantuvieron a una temperatura de 27 °C con 100 µl de solución de antibióticos (20 000 µg/ml de penicilina, 20 000 µg/ml de estreptomicina) y un 1 ml de sangre de conejo desfibrinada por 2 ml de agar (Evans, 1994). Posteriormente, se sacrificó el animal donador infectado con la cepa de Leishmania para preparar el inóculo de parásitos desde la impronta del hámster donador. Se tomaron muestras del nódulo con un bisturí y se trituraron en 2 ml de solución salina estéril al 0,9 % con 350 unidades de penicilina cristalina (Pinardi y Barrios, 1993). El tejido fue macerado en un mortero (de Jesus et al., 1999) y luego se filtró mediante una gasa estéril y una inyectadora. Para el contaje se tomó una alícuota de 10 microlitros que se dejó caer en el recuadro del portaobjetos y se distribuyó en forma homogénea en un área de 1 cm3 en una lámina portaobjeto. Posteriormente se fijó con etanol y se coloreó con giemsa al 30 % durante 10 minutos. Bajo el microscopio con objetivo de inmersión se contaron 20 campos escogidos al azar; el promedio de los parásitos contados se multiplicó por el factor de conversión del microscopio y a partir del valor obtenido se prepararon inóculos del orden de 1 X 106 amastigotes por cada 0,1 ml de macerado. Este volumen de macerado se inoculó en el dorso de las patas traseras de cada uno de los 15 animales (Ampuero et al., 2000; Rosa et al., 2000; Bruzual et al., 2008). El tiempo promedio de evolución para la aparición de la lesión fue de 18 días. Dada la agresividad de la cepa, a los dos días de aparición de la lesión se iniciaron los ensayos, lo que correspondió al día uno de evaluación.
Esquema terapéutico sobre hámsteres infectados con Leishmania amazonensis
Primer grupo experimental.
Tres hámsteres (H1, H2, H3) como animales controles positivos fueron infectados con L. amazonensis (cepa de referencia PH8); dichos animales no recibieron ningún tratamiento sobre las lesiones leishmánicas que desarrollaron en ambas patas. El tiempo de evaluación fue de 20 días con monitoreo continúo.
Segundo grupo experimental.
Tres hámsteres (H1, H2, H3) fueron tratados con antimonial Ulamina (línea de pentavalente en fase experimental) luego de la aparición de la lesión de piel por L. amazonensis en ambas patas. El antimonial se aplicó vía intraperitoneal, con dosis calculadas según el peso del animal, con aplicaciones por 20 días consecutivos y a la misma hora, siguiendo el protocolo empleado para el Glucamtime (OMS, 1998). El tiempo de evaluación fue de 20 días con monitoreo continúo.
Tercer grupo experimental.
Tres hámsteres (H1, H2, H3) fueron tratados con la TL local luego de la aparición de las lesiones de piel por L. amazonensis en ambas patas. En este tratamiento se usaron las larvas L2 de forma directa sobre la úlcera, siguiendo el protocolo descrito por (Arrivillaga et al., 2008; Calderón-Arguedas et al., 2014). Se evaluaron los animales a las 12 horas de la aplicación de la TL simple (día uno de aplicación), y consecutivamente se realizó un monitoreo hasta el día 20 para la evaluación de la TL sobre las lesiones. Previo al ensayo experimental con la TL los animales del grupo experimental (H1, H2, H3) se anestesiaron con 1 mL de solución de fenobarbital (100 mg/2 mL) vía intraperitoneal, permaneciendo dormidos por 24 horas e hidratándolos durante este tiempo, con la finalidad de que los hámsters no removieran los vendajes de sus patas.
Cuarto grupo experimental.
Tres hámsteres (H1, H2, H3) fueron tratados con la TL + antimonial Ulamina luego de la aparición de las lesiones de piel por L. amazonensis en ambas patas. El tratamiento se inició con la aplicación de la TL local, y al tercer día se aplicó el antimonial durante 20 días consecutivos. La primera evaluación se realizó a las 12 horas aplicada la TL con monitoreo continúo hasta la última evaluación del día 20.
Quinto grupo experimental.
Tres hámsteres (H1, H2, H3) fueron tratados con antimonial Ulamina + TL luego de la aparición de las lesiones de piel por L. amazonensis. La primera aplicación de la TL se hizo al tercer día de iniciado el tratamiento con Ulamina. La primera evaluación se realizó a las 12 horas de aplicada la TL y la última evaluación se realizó el día 20.
Análisis de los parámetros cualitativos y cuantitativos
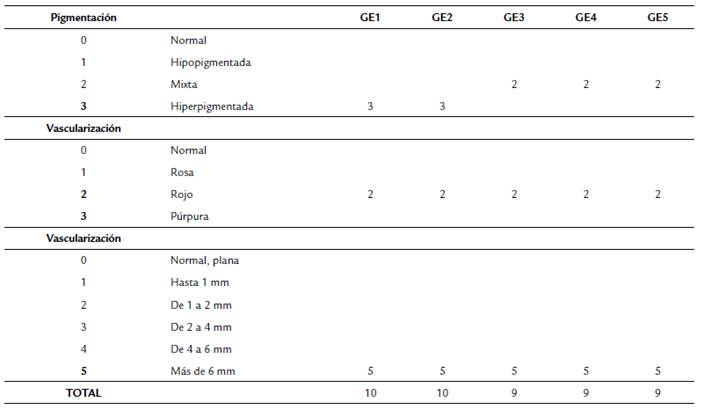
Los parámetros físicos que se utilizaron como criterios de evaluación para la efectividad de la terapia larval y Ulamina (esquema simple y combinado) sobre la cura de las lesiones de leishmaniasis cutánea como variable cualitativa ponderada fue la cicatrización (uno = ausente; dos = parcial; tres = completa). Adicionalmente, como variables cuantitativas se midió el ancho y el largo de la lesión, las cuales son parámetros que determinan la superficie de la úlcera como criterio para evaluar el proceso de cicatrización (ancho x largo en mm), y el parámetro de inflamación (grosor-altura en mm). Los tres parámetros son importantes al evaluar esquemas terapéuticos sobre lesiones crónicas, al igual que los criterios ponderados de pigmentación y de vascularización de las lesiones (Senet, 2008; Prezzavento et al., 2017). Las medidas se tomaron empleando un vernier digital (mm) y los parámetros se evaluaron al inicio y al final de la experimentación por grupo establecido.
Previo al ANOVA se verificaron los supuestos de distribución normal y de homogeneidad de varianzas de los datos de cada una de las variables, mediante las pruebas de bondad de ajuste de Kolmogorov-Smirnov y de Bartlett. Las mediciones obtenidas se analizaron estadísticamente. A fin de comparar los distintos grupos experimentales se consideró el hámster, la pata, el grupo experimental y el tiempo de evaluación utilizando un análisis de varianza (ANOVA) de una vía para muestras independientes, en donde la varianza (análisis estándar con ponderación de medias) fue equivalente a una prueba t para comparaciones dentro de un mismo tratamiento (antes y después por parámetro medido). En caso de determinar diferencias estadísticamente significativas, se aplicó la prueba de Tukey HSD (diferencia absoluta entre los promedios de cualquiera de las muestras para obtener una diferencias significativa en el nivel de significancia p = 0,05).
Para los análisis integrales se realizó un ANOVA de dos vías con anidación de individuos, considerando para los factores significativos (grupo experimental y día (antes y después)) determinándose valores de probabilidad significativos. La organización de los datos se llevó a cabo empleando el programa computacional de Microsoft Office Excel®. Todas las gráficas y análisis estadísticos de varianza se desarrollaron mediante el uso del software R (R Core Team, 2013). Adicionalmente, se analizaron de forma cualitativa-cuantitativa las variables de pigmentación y vascularización utilizando la escala de Vancouver para la evaluación de las lesiones (Prezzavento et al., 2017). También se analizaron el porcentaje de variación de la superficie de la lesión, el porcentaje de incremento-reducción de la superficie y de incremento-reducción de la inflamación de la lesión en los grupos experimentales.
Diagnosis parasitológica de impronta (frotis)
Antes de iniciar los ensayos no se tomaron muestras parasitológicas para no alterar la superficie de la lesión según el protocolo de Arrivillaga et al. (2008). Sin embargo, después de cada tratamiento se colocaron láminas porta objetos sobre las úlceras abiertas y se realizaron frotis por aposición de las improntas y se dejaron secar (Bonfante, 1983). Después de secadas las láminas se agregaron unas gotas de metanol en los frotis para fijar los parásitos y luego unas gotas de Giemsa para colorear las leishmanias. En el caso de las úlceras cicatrizadas, para preparar los frotis se cortó un pedazo de piel regenerada y se colocaron láminas porta objetos sobre la dermis y el tejido inflamado. Toda la búsqueda de las leishmanias se llevó a cabo en un microscopio Leica DM 1000 con objetivo de 100 X en aceite de inmersión.
Diagnosis molecular de Leishmania vía PCR
De las muestras de las improntas se extrajo ADN utilizando el protocolo de Golczer y Arrivillaga (2010). Para la amplificación vía PCR se utilizó un cebador con las secuencias HSP20d 5'- CCAAGCTTAT GTGGAGCCCG AGCAACAA -3' y HSP20r 5'- CGGGATCCTT AGTCGATGGT GACTGAGT -3', para la amplificcaión de un fragmento del gen-específico hsp20 que codifica para la proteína térmica de 20kDa de L. amazonensis (Montalvo et al., 2014). El coctel de PCR con un volumen final de 25 µl contiene 0,5 U de Taq polimerase (Go Taq Promega), 5X flexi buffer, 25 mM MgCl2, 100 nmol dNTPs, 1 pmol/µL primer, y de 3-4 µl ADN de la muestra. La amplificación del ADN de los parásitos se realizó en un termociclador, con desnaturalización a 94 °C x 5 min, seguido por 30 ciclos de 92 °C, 65 °C x 1 min, 72 °C x 1 min y por último 72 °C x 5 min. Finalmente, 5 µl del producto de amplificación de las muestras se analizaron mediante electroforesis en un gel de agarosa 8 % en Buffer TBE (89 mM Tris borato, 2 mM EDTA, pH 8,3) que contiene 0,5 µg/ml de bromuro de etidio. La amplificación del producto (amplicon de 480 pb) se visualizó bajo transiluminador UV con una cámara Sony Ericsson Cyber-Shot con 3,2 megapixeles (Montalvo et al., 2014).
RESULTADOS
Los análisis de correlación no paramétricos de Spearman de las variables como largo y ancho, superficie e inflamación que se evaluaron en los animales infectados antes de conformar los grupos experimentales, evidenciaron una correlación positiva entre ellos (valores entre 0,9575 y 0,9953). Posterior a la aplicación de los esquemas terapéuticos en los grupos experimentales dos, tres, cuatro y cinco, se observó que el proceso de cicatrización estuvo correlacionado negativamente con las variables ancho, largo, superficie, inflamación (valores entre -0,8652, -0,8637, -0,892, -0,8665, respectivamente). Estos resultados mostraron que las variables seleccionadas pueden ser empleadas para monitorear el desarrollo, la efectividad y eficacia de un tratamiento sobre una lesión leishmánica.
Antes de iniciar la experimentación y tratamientos, los análisis de varianza del tamaño de lesión de cada grupo experimental no evidenciaron diferencias estadísticas significativas entre hámster (p = 0,6670), ni entre patas por hámster (p = 0,9567). Además, no se presentaron diferencias estadísticas significativas en cuanto al ancho (p = 0,9603), largo (p = 0,854), superficie (p = 0,8449), inflamación (p = 0,930) ni cicatrización ausente (p = 1,000), lo que indica que existe una homogeneidad entre las medidas del área de las úlceras, ideal para comparaciones directas entre los 15 animales con lesiones por L. amazonensis que conformaron los grupos experimentales. Por otro lado, los análisis de varianza de las variables analizadas con respecto a la lesión, al culminar la experimentación y tratamientos correspondientes, evidenciaron diferencias estadísticamente significativas entre los grupos experimentales (p = 0,002456).
Infección con L. amanzonensis
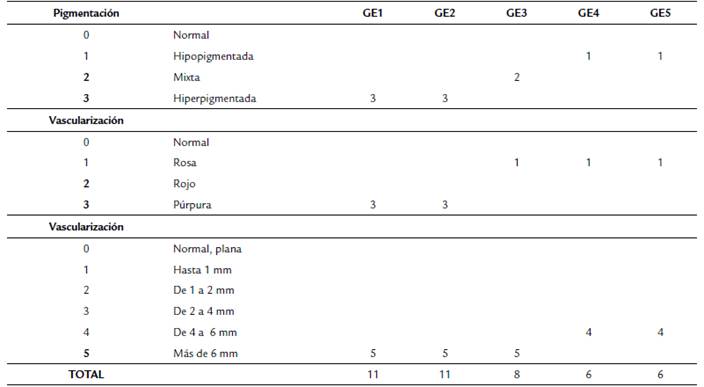
Los tres animales control infectados no tratados, evidenciaron una evolución progresiva y severa en las manifestaciones clínicas de las lesiones ulcerativas de la leishmaniosis de forma localizada sobre las patas inoculadas entre los días dos a siete de la experimentación (22-27 días posterior a la inoculación). Específicamente, se observó un aumento en la profundidad de las lesiones (día 20 de experimentación), con presencia de abundante exudado, edema y una fuerte inflamación acompañada de malos olores, indicativo de coinfección bacteriana y presencia de tejido necrótico en el área de las lesiones. Por lo anterior, en el 100 % de los animales se vio la no curación-cicatrización de heridas de forma espontánea, evidenciándose cualitativamente abundantes parásitos en los frotis, característico de hospedadores no tratados (Fig. 2a). Adicionalmente, durante el periodo de evaluación la inflamación se incrementó en promedio en un 55,90 %, así como la superficie de la lesión en un 71,39 %. Sin embargo, no existen diferencias estadísticamente significativas entre el antes y después para el grupo experimental uno (p < 0,05), observándose hiperpigmentación y la vascularización púrpura en las lesiones al final de la experimentación (Fig. 1a, Tablas 1a y 1b). Además, el grupo experimental uno (controles positivos) no mostró diferencias significativas (p> 0,05) con el grupo dos (Ulamina) y grupo tres (TL simple), pero sí se observaron diferencias estadísticamente significativas (p < 0,05) con los grupos experimentales cuatro (TL+Ulamina) y cinco (Ulamina+TL) (Figs. 3 y 4).
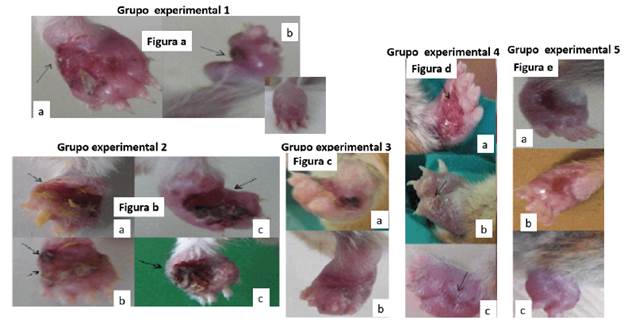
Figura 1 Lesiones de piel por ulceras leishmánicas en animales experimentales: a) Úlcera infectada con L. amanzonensis en el grupo experimental uno (control positivo no tratado); b) Úlcera infectada con L. amanzonensis en el grupo experimental dos (animales tratados con Ulamina-simple; c) Úlcera infectada con L. amanzonensis en el grupo experimental tres (animales tratados con terapia larval-simple); d) Úlcera infectada con L. amanzonensis en el grupo experimental cuatro (animales tratados con terapia larval-Ulamina); e) Úlcera infectada con L. amanzonensis en el grupo experimental cinco (animales tratados con Ulamina- terapia larval); a (antes tratamiento), b y c (después de tratamiento).
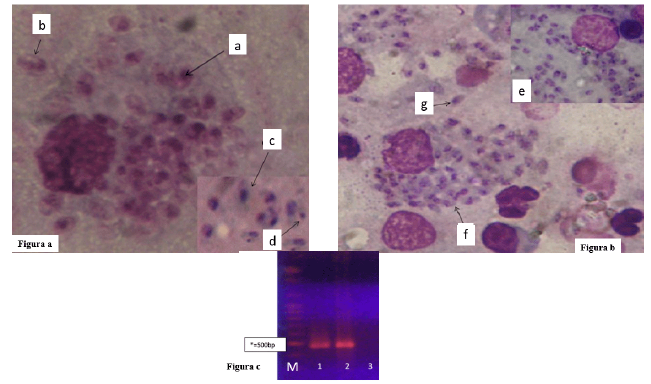
Figura. 2 Leishmania amazonensis en frotis (improntas) y PCR (amplicones de 480 pb) de muestras de animales experimentales. a) Tipo frotis de animales infectados no tratados o infectados tratados con la TL, b) Tipo frotis de animales infectados y tratados con Ulamina de forma simple o combinada con la TL. a. Amastigotes dentro de macrófagos, b. Amastigotes extracelulares, c. Amastigotes libres, d. Kinetoplasto de amastigotes, e. Leishmania fuera de macrófago roto, f. Macrófago con membrana deteriorada, g. Leishmania vacuolada, M (Molecular de 100 bp), c) Resultados de PCR. M. Marcador de 100 bp. 1. Control positivo de ADN de Leishmania amazonensis de animales pertenecientes al grupo experimental uno, 2. Muestra de ADN desde tejido de las improntas de animales tratados con esquema combinados (TL+Ulamina), 3. Control negativo.
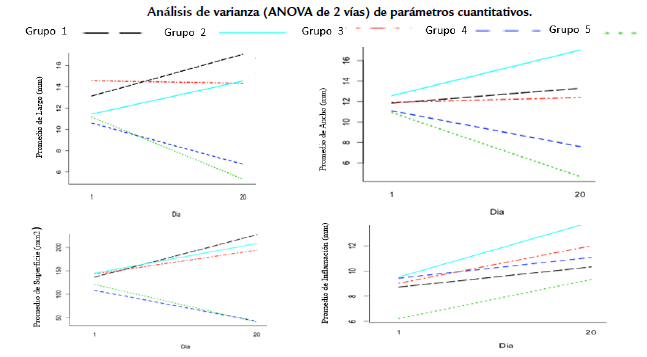
Figura 3 Análisis de varianza (ANOVA- 2 vías) de los parámetros evaluados largo, ancho, superficie e inflación en la úlcera leishmánica en función de la interacción de los factores grupo experimental y día de evaluación.
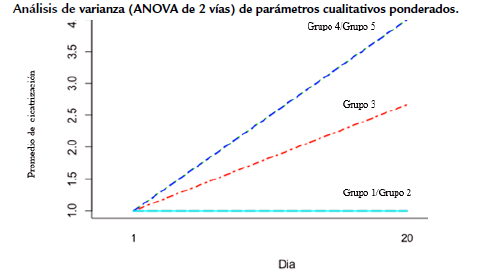
Figura 4 Análisis de varianza (ANOVA- 2 vías) del parámetro evaluado de cicatrización en la úlcera leishmánica en función de la interacción de los factores grupo experimental y día de evaluación.
Tabla 1a Variables de pigmentación según escala Vancouver antes de iniciar la experimentación. Ge= Grupo experimental.
Aplicación Antimonial Ulamina
Durante los 20 días de aplicación de la Ulamina, los animales mostraron una mejoría parcial de los signos leishmánicos, disminuyó el olor, el exudado y el edema, pero con persistencia de la inflamación. Al tercer día después de terminar la aplicación de la Ulamina, se observó la activación de la lesión con desarrollo progresivo de mal olor, exudado y edema. Esto derivó en la dificultad para caminar del 100 % de los animales infectados y tratados con Ulamina, los cuales fueron sacrificados el día cinco después de terminar los tratamientos (45 días después de la inoculación). En general, los resultados obtenidos con Ulamina (grupo experimental dos) fueron similares a los obtenidos para los animales no tratados del grupo experimental uno, ya que no se observó curación-cicatrización de la lesión leishmánica. En promedio hubo un incremento de la superficie (51,18 %) y de la inflamación (12,46 %) en la lesión tratada (Fig. 1b) y se mantuvo la hiperpigmentación y la vascularización púrpura de la lesión (Tabla 1a y 1b).
Los análisis estadísticos no mostraron diferencias significativas entre antes y después de la aplicación de la Ulamina (p > 0,05) dentro del grupo dos experimental de hámsteres, en función de las variables evaluadas (superficie de la lesión (p = 0,105), inflamación (p = 0,7167), cicatrización (p = 1,000). De igual forma, no hubo diferencias estadísticamente significativas (p >0,05) entre los resultados de este grupo (Ulamina) y los obtenidos para los grupos experimentales uno (control) y tres (TL simple), pero sí se observaron diferencias estadísticamente significativas con respecto a los grupos experimentales cuatro y cinco, que corresponden a los tratamientos combinados (p < 0,05). (Figs. 3 y 4).
Aplicación de la TL
En los animales infectados y tratados solo con una aplicación de la TL (durante 12 horas), no se evidenció una evolución progresiva y severa de las manifestaciones clínicas de las lesiones ulcerosas leishmánicas, en contraste con los animales tratados del grupo experimental uno y dos. Se observó una disminución parcial del edema, del exudado, de la profundidad de la herida y del olor (Fig. 1c). Sin embargo, estas diferencias con los grupos experimentales uno y dos no son explicadas sobre la base de los resultados estadísticos (p > 0,05). En los animales H1 y H2 (66,66 %) dentro del grupo experimental tres, se percibió perdida de exudado y edema acompañado de una regeneración epitelial, dando como resultado la aparición de una completa cicatrización (Fig. 1c) a los diez días posteriores a la aplicación de la TL (día uno de experimentación). Sin embargo, en el animal H3 se evidenció una cicatrización parcial, a pesar de existir una mejoría de los signos leishmánicos ulcerativos (Tablas 1a, 1b).
Durante la experimentación con el grupo tres, en promedio se dio un incremento de la superficie de la lesión del 28,80 % y de la inflamación de 37,03 %. Sin embargo, estas diferencias entre antes y después de la experimentación no son explicadas estadísticamente (p> 0,05), con base en las variables de superficie de la lesión (p = 0,403) e inflamación (p = 0,065). En cambio, sí se evidenciaron diferencias estadísticamente significativas entre el antes y después con respecto a la variable cicatrización para el grupo experimental (p = 0,00134). Adicional al proceso de cicatrización con la TL, la pigmentación de la lesión mejoró, así como su vascularización (Tablas 1a y 1b). Por otra parte, a pesar de existir mejorías cualitativas de los signos leishmánicos de la úlcera, los resultados no son comparables con los obtenidos para los grupos experimentales cuatro y cinco (Figs. 3 y 4), existiendo diferencias estadísticamente significativas entre el tratamiento TL simple con respecto al TL combinado con el antimonial (p < 0,05). Finalmente, por consideraciones bioéticas, los animales se sacrificaron ocho días después de haber culminado el periodo de evaluación experimental.
Aplicación la TL + Ulamina
Se observó un efecto potenciador al combinar la TL (12 horas, día uno) con Ulamina (aplicada durante 20 días, días tres al 20 de experimentación), ya que para el día 20 el proceso de cicatrización y granulación en las lesiones leishmánicas se completó de forma irreversible en el 100 % de los animales tratados. Esto derivó de la reducción de la superficie de la lesión entre un 71-83 % con respecto a su tamaño inicial (p = 0,01), con un incremento de la inflamación entre el 5-10 % en relación con el día uno, lo cual no representa una diferencia estadísticamente significativa (p = 0,4851). Se observó una hipopigmentación de la lesión y un mejoramiento significativo en su vascularización (Fig. 1d, Tablas 1a y 1b).
En contraste, se determinaron diferencias estadísticamente significativas entre el grupo cuatro y los grupos experimentales uno, dos y tres (p < 0,05). Sin embargo, no se determinaron diferencias estadísticas significativas (p > 0,05) entre los grupos experimentales cuatro (TL+ Ulamina) y cinco (Ulamina+TL). Adicionalmente, se observó una inflamación persistente similar a la observada en todos los grupos experimentales analizados en el presente trabajo de investigación (p = 0,176) (Fig. 3 y 4). Luego de finalizar los tratamientos, a los diez días se observó en uno de los animales (H2) la aparición de úlceras satélites cercanas a los bordes de las lesiones de piel perfectamente cicatrizada. Las lesiones satelitales fueron tratadas con la TL nuevamente por 12 horas, pero sin aplicar nuevamente Ulamina, observándose la final cicatrización, granulación y reepitalización de las lesiones secundarias en tres días, sin apertura de las lesiones tratadas y con ausencia de la aparición de nuevas lesiones satelitales.
Aplicación de Ulamina + la TL
Durante el ensayo, se observó que luego de combinar los tratamientos (día 20), se logró la cicatrización de las lesiones leishmánicas en el 100 % de los animales (p < 0,05), con un incremento de la inflamación (17,60 - 21,71 %) estadísticamente no significativa (p = 0,207), y una disminución de la superficie de la lesión del 57-61 %, cuya diferencia fue estadísticamente significativa (p = 0,048). Adicionalmente, se observó al culminar la experimentación la hipopigmentación de la lesión y una mejor vascularización (Fig. 1e, Tablas 1a y 1b).
Luego de culminar los experimentos no hubo diferencias estadísticamente significativas (p > 0,05) entre el grupo experimental cuatro (TL+ Ulamina) y el cinco (Ulamina+TL) con relación a las variables superficie (p = 0,918), inflamación (p = 0,195) y cicatrización (p = 1,00). En el grupo experimental cinco no se observaron lesiones satelitales, ni apertura de las úlceras cicatrizadas durante los 20 días de evaluación en ninguno de los animales (Fig. 1e). Adicionalmente, los resultados obtenidos para el grupo experimental cinco mostraron diferencias estadísticamente significativas con respecto a los obtenidos para los grupos experimentales uno, dos y tres (p < 0,05) (Figs. 3 y 4). Finalmente, los análisis del ANOVA de dos vías indicaron diferencias estadísticamente significativas para la interacción de los factores evaluados y los grupos experimentales por día de evaluación para las variables asociadas a la lesión (pata izquierda/pata derecha): largo (p = 0,006317/p = 0,004623), ancho (p = 0,000523/ p = 0,0007058) y superficie (p = 0,021541/p = 0,001 185). Al evaluar la interacción con el factor día, solo se determinaron diferencias estadísticamente significativas en la variable inflamación (p = 0,01180) (Figs. 3 y 4). Adicionalmente, se evidenciaron diferencias estadísticamente significativas en los grupos experimentales solo para tres de los parámetros cuantitativos: largo (p = 0,024721), ancho (p = 0,0005633) y superficie (p = 0,006324), siendo la variable inflamación no significativa entre tratamientos (p = 0,07502).
Diagnosis parasitológica de la infección por Leishmania en los animales experimentales
Los análisis parasitológicos directos (frotis) evidenciaron la presencia de Leishmania en todos los animales experimentales (Fig. 2). Sin embargo, la diferencia parasitológica más contrastante fue que en los frotis obtenidos de los animales de los grupos experimentales uno y tres, se observó la integridad morfológica de la forma intracelular amastigota. Por su parte, en los frotis de los animales tratados con Ulamina en su esquema simple o combinando, correspondientes a los grupos experimentales dos, cuatro y cinco, se observó un gran número de amastigotes vacuolados y deformes, así como un gran número de macrófagos deformes, destruidos y sin membrana celular (Figs. 2a y 2b).
En los frotis que correspondieron a los animales tratados con Ulamina, los parásitos no pudieron ser visualizados de forma apropiada por las características de la tinción, por lo que no se pudo realizar su contabilización de forma correcta al final del periodo de evaluación experimental. Sin embargo, los resultados moleculares de la amplificación gen-específico de L. amazonensis evidenciaron la presencia de una banda de aproximadamente 480 pb en todas las muestras analizadas por grupo experimental, sin visualizarse diferencias en la intensidad ó ancho de la banda (Fig. 2c).
DISCUSIÓN
Los resultados obtenidos en los ensayos experimentales mostraron que el esquema terapéutico de la TL en aplicación simple o combinada con M. domestica es efectivo para la desbridación de las úlceras en piel de la leishmaniosis cutánea, basada en la regeneración de la epidermis y la dermis, y en la reducción de la superficie de la lesión que conlleva al proceso de cicatrización. La aplicación de larvas de M. domestica para la cicatrización epitelial de úlceras leishmánicas en hámsteres es acorde con otras investigaciones sobre terapia larval (Arrivillaga et al., 2008; Polat y Kutlubay, 2014; Cruz-Saavedra et al., 2016; Sanei-Dehkordi et al., 2016), y con la cicatrización observada en pacientes humanos (Wolff Echeverri et al., 2010). Sin embargo, en la presente investigación la TL simple y combinada muestran resultados diferentes; en el caso de la TL simple se obtuvo una efectividad del 66,66 % sobre los animales tratados, en comparación con el 100 % de cicatrización observada en los animales tratados con la TL combinada con Ulamina. Adicionalmente, se observaron diferencias en el porcentaje de reducción de la superficie de la lesión; en el caso de la Tl simple se logró una reducción entre 22 y 36 %, mientras que en la TL combinada osciló entre el 57 y el 83 %.
Los resultados de la TL combinada son similares a los obtenidos por Polat y Kutlubay (2014). En el tratamiento de la TL con Lucia sericata estos autores lograron una cicatrización del 100 % en dos de los pacientes humanos infectados con Leishmania, quienes previamente mostraron resistencia al Glucantime al ser tratados con este tipo de antimonial. En el caso de los resultados de la TL simple, estos fueron diferentes a los señalados por otros autores, siendo estos un 100 % de la cicatrización de la úlcera leishmánica en los animales tratados con una aplicación simple de 12 horas de larvas de Lucilia sericata sobre úlceras producidas por L. amazoneneis (Arrivillaga et al., 2008; Polat et al., 2012). Estos resultados sugieren que la especie de mosca es un factor para considerar en la TL de úlceras leishmánicas.
Por otro lado, en el tratamiento de úlceras de piel con diferente etiología no parasitaria (pie diabética, úlcera sacras, osteomelitis, úlceras isquémicas, neoplásicas, lesión por arma de fuego, quemaduras, etc.) no se plantean diferencias significativas en el proceso de cicatrización de la lesión dependiendo de la especie de mosca usada: Lucilia sericata, L. illustris, L. caesar, L. cuprina, L. eximia, Phormia regina, Calliphora erythrocephala, C. vicina, Chrysomya rufifacies, Cynomyia cadaverina, Wohlfahrtia nuba, Musca domestica y Sarconesiopsis magellanica (Sherman y Pechter, 1988; Parnés y Lagan, 2007; Li et al., 2008; Sherman, 2009; González- de Paz et al., 2010; Wolff Echeverri et al. 2010, Ríos et al., 2013; Sherman et al., 2013; Díaz-Roa et al., 2016).
Los reportes sobre el tratamiento de úlceras leishmánicas no han señalado diferencias estadísticamente significativas en la aplicación de la TL, ni en los parámetros de cicatrización evaluados, luego de lograr la cicatrización de la úlceras aplicando larvas de L. sericata y S. magellanica en un modelo murino (Díaz-Roa et al., 2016). Sin embargo, los resultados de la TL con M. domestica mostrados en el presente estudio, podrían explicarse sobre la base de que esta especie de mosca no pertenece al grupo de las Calliphoridae y no es una especie necrófaga, en contraste con las especies utilizadas en investigaciones anteriores y señaladas en la literatura (Arrivillaga et al., 2008; WolffEcheverri et al., 2010; Polat et al., 2012; Polat y Kutlubay, 2014; Cruz-Saavedra et al., 2016). Por tanto, su efectividad en la cicatrización y reducción del tamaño de la lesión durante el tratamiento de úlceras leishmánicas pareciera ser menor, pero esto debe evaluarse con comparaciones directas con otras especies de moscas no necrófagas.
En las especies de califóridos que han resultado efectivas en la aplicación de la TL simple, se han identificado en las ES (excresiones/secreciones) fracciones con actividad antibacterial-antifungíca (Zapata et al., 2008; Cazander et al., 2013; Pöppel et al., 2014; Góngora et al., 2015; Patarroyo, 2015), proteolítica (Parnés y Lagan, 2007; Pinilla et al., 2013; Bauman et al., 2017) y principalmente anti-Leishmania. En relación con la anti-Leishmania se han señalado diferencias en su efecto sobre Leishmania, al comparar especies de moscas diferentes como L. sericata, S. magellanica y C. vicina (Polat y Kutlubay, 2012; Sanei-Dehkordi et al., 2016; Laverde-Paz et al., 2018). En el caso de M. domestica hasta la fecha se han detectado ES con actividad antibacterial, antimicrobial, antioxidante, mitogénica, con efecto hepático protector o antitumoral. Otras investigaciones indican que existe actividad biológica de péptidos muy complejas como cecropinas, defensinas y atacinas en las larvas de M. domestica (Andersen et al., 2010; Jin et al., 2010; Wang et al., 2012; Zhu et al., 2013; Pinheiro et al., 2015; Chu et al., 2016), pero se desconoce si existen ES con potencial actividad anti-Leishmania. Por otro lado, en las investigaciones de la TL sobre úlceras leishmánicas en modelos murinos, se ha trabajado no solo con diferentes especies de moscas, sino también con varias especies de Leishmania como L. amazonensis, L. panamensis, L. major y L. tropica, observándose la efectividad de cicatrización y anti-Leishmania de L. sericata sobre L. amazonensis, L. panamensis, L. major y L. tropica. Sin embargo, de forma comparativa, L. sericata es menos efectiva que S. magellanica al tratar úlceras infectadas con L. panamensis, mientras que L. sericata es más efectiva en el tratamiento de L. major en comparación con C. vicina (Arrivillaga et al., 2008; Polat y Kutlubay, 2012; Sanei-Dehkordi et al., 2016; Laverde-Paz et al., 2018). Por ello, las diferencias en los resultados de la TL en una sola aplicación (12 horas tiempo óptimo para el modelo murino en contraste con pacientes humanos donde se requieren más de tres aplicaciones de forma convencional para activar el proceso de cicatrización) sobre las úlceras leishmánicas producidas por L. amazonensis aplicando M. domestica (en la presente investigación) o L. sericata (Arrivillaga et al., 2008), podrían explicarse por las posibles diferencias en la ES anti-Leishmania de M. domestica. Podría existir ausencia de este tipo de actividad en las ES de M. domestica, tener menor actividad o tener menor efecto sobre el parasito, ya que en los frotis no se evidenció ningún efecto citotóxico sobre los amastigotes al usar terapia larval en el esquema simple. Lo anterior se evidenció a través de la PCR con la amplificación de ADN de L. amazonensis, al igual que en otros tratamientos de la TL sobre la misma especie de parásito (Arrivillaga et al., 2008) o en tratamientos con antimoniales, en los que después de diez años se ha amplificado el ADN-Leishmania en pacientes tratados (Guevara et al., 1994).
En concordancia con los trabajos de Polat y Kutlubay (2012), quienes no evidenciaron la presencia de L. tropica luego de aplicar la TL con L. sericata, derivado de la actividad anti-Leishmania, así como su acción acelerada de curación de lesiones de piel con reducción de la inflamación crónica (Cazander et al., 2013), en el presente trabajo se avala el uso de M. domestica en terapia larval de lesiones de piel con fines de desbridación y curación. Igualmente, nuestros resultados son congruentes con los hallazgos obtenidos por Li et al. (2008).
Adicionalmente, se evidenció la potenciación del proceso de cicatrización de las lesiones leishmánicas por L. amazonensis al combinar la TL con el antimonial Ulamina, en la que la TL permite la desinfección y desbridación de la úlcera, con una disminución parcial de la inflamación. Esto potencia la acción de la Ulamina, por su efecto citotóxico sobre Leishmania, lo que controla la inflamación persistente, permite el proceso de activación de fibroblastos y de células endoteliales y ayuda a la formación de la matriz celular que favorece la formación de tejido de granulación (Jaklic et al., 2008; Andersen et al., 2010; Ríos et al., 2013).
El proceso de cicatrización fue completado en un máximo de 20 días, en contraste con el tiempo de cicatrización de diez días que se señala para el tratamiento que combina glucantime (en pacientes humanos con dosis completas del antimonial según OMS) con la TL con L. sericata (Polat y Kutlubay, 2014). Estos resultados podrían mostrar un efecto sinérgico entre los dos tratamientos que actúa sobre las Leishmanias, como ha sido señalado al combinar tratamientos antibacterianos y antimoniales pentavalentes (Narváez et al., 1979). También puede darse un efecto aditivo, resultado de sumar la acción de los dos tratamientos sobre el proceso de inflamación y cicatrización, en donde se añade el efecto de limpieza, desbridación y reepitalización de la TL al efecto citotóxico de la Ulamina sobre los amastigote de Leishmania.
CONCLUSIONES
La terapia larval con M. domestica es una alternativa para el tratamiento de úlceras leishmánica por L. amazonensis. La aplicación combinada con antimoniales como la Ulamina se muestra como el esquema más adecuado para lograr la cicatrización y cura clínica de la úlcera. Sin embargo, hay que considerar el grado de inflamación persistente, lo cual se ha señalado en la literatura con respecto a los tratamientos convencionales para Leishmania. Son necesarios futuros estudios para evaluar la actividad anti-Leishmania de M. domestica, así como realizar comparaciones directas de la TL y las ES con las especies de moscas que ya han sido evaluadas sobre cultivos de promastigotes y amastigotes de Leishmania en el modelo murino.