INTRODUCCIÓN
La Familia Sciaenidae está constituía por peces abundantes y diversos en las comunidades ícticas costeras tropicales (Yáñez-Arancibia y Sánchez-Gil, 1988). El Pacífico colombiano presenta 49 especies, las cuales pueden alcanzar un alto valor alimenticio y comercial en los mercados de su costa (Rubio, 1988; 2007). Múltiples especies de esta familia forman parte de la fauna acompañante de la pesca de arrastre de camarón de aguas someras (CAS). Una pequeña parte de esta fauna incidental es utilizada por el pescador, mientras que la parte restante, conformada principalmente por peces pequeños que aún no han alcanzado la talla de primera madurez, es desechada al mar en lo que se denomina descarte (Rueda etal., 2006). Algunos autores han sugerido que hasta el 96 % de la captura total de la pesca de arrastre de camarón somero es fauna acompañante (FAO, 2001; CCI, 2009), y se calcula que en el Pacífico colombiano el 85 % de esta captura incidental está conformada por peces (Rueda et al., 2006).
Stellifer melanocheir (Eigenmann, 1918) se distribuye desde la bahía de Buenaventura (Colombia) hasta el golfo de Guayaquil (Ecuador). La mayor longitud total reportada es de 15 cm y vive en aguas someras, inclusive en pozas intermareales (Chao, 1995). En la actualidad no existen estudios de la biología de esta especie, aunque se han realizado esfuerzos de investigación en otras especies del género, entre los que destacan el estudio de Neuta y Perdomo (2004) en el Golfo de Tortugas, Colombia, en el que evaluaron las interacciones tróficas de otras especies del género: S. ericymba, S. fuerthii, S. mancorensis, S. oscitans y S. zestocarus; los estudios por Ramos-Miranda et al. (2009) sobre crecimiento, mortalidad, madurez y reclutamiento de S. lanceolatus en el golfo de México, y los realizados en el Atlántico brasileño sobre reproducción, crecimiento y ecología trófica de S. brasiliensis y S. rastrifer (Morales-Nin, 1994; Chaves y Vendel, 1997; 1998; Almeida y Branco, 2002; Camargo e Isaac, 2004; 2005; Frehse, 2009).
Se parte de la premisa de que para lograr un ordenamiento pesquero multi específico en una región es necesario conocer aspectos reproductivos, de crecimiento y alimentarios de las especies propensas a ser capturadas, incluyendo las especies incidentales, toda vez que fortalecer la información técnico-científica de las especies que no son parte de la pesca comercial permitiría impulsar su uso como recursos aprovechables para diversificar las capturas y optimizar la utilización de los recursos marítimos del país. Debido a la ausencia de estudios sobre S. melanocheir, el propósito de esta investigación fue proporcionar información acerca de algunos parámetros de crecimiento y de los aspectos reproductivos y alimentarios de S. melanocheir en el Golfo de Tortugas, Pacífico colombiano.
MATERIALES Y MÉTODOS
Se recolectaron mensualmente especímenes de S. melanocheir entre septiembre de 2011 y abril de 2012 en el Golfo de Tortugas, Pacífico colombiano (3°40' N - 77°12' W), excepto en enero debido a la temporada de veda de camarón. Se utilizaron las capturas incidentales de faenas de pesca de camarón y peces asociados al fondo realizadas entre las seis y diez de la mañana, a bordo de embarcaciones artesanales llamadas "Changas", en zonas cercanas a la costa entre 4 y 8 m de profundidad. Las muestras se preservaron en formol al 20 % y posteriormente se identificaron a nivel de especie mediante las claves taxonómicas de Chao (1995; 2001). A cada individuo se le midió la longitud total (Lt, cm), el peso húmedo total (W, g) y el peso eviscerado (We, g). Posteriormente los especímenes se sexaron por observación directa de las gónadas. Las gónadas y el estómago se extrajeron y almacenaron en formol buffer al 10 % para análisis del estadio de desarrollo gonádico (reproducción) y contenido estomacal (hábitos alimentarios).
Relación peso/longitud
La relación peso/longitud (W/Lt) se calculó para cada sexo mediante la ecuación W = αLt b (Pauly, 1983), donde: W es el peso, Lt la longitud total, α la ordenada al origen y b es la pendiente de la curva. Se evaluó el tipo de crecimiento isométrico (b = 3) o alométrico (b # 3) mediante una prueba de hipótesis de valoración con t estimada (Pauly, 1984). Se realizó una prueba de U Mann-Whitney para evaluar diferencias de W y Lt entre sexos y un análisis de covarianza (ANCOVA) para determinar diferencias en la relación W/Lt entre machos y hembras.
Crecimiento
La curva de crecimiento de S. melanocheir se estimó con el método de progresión modal de Von Bertalanffy Lt = L∞ (1-e[-k(t - t0)]) a partir de la distribución de frecuencias de Lt mensuales (intervalos de 0,5 cm). Los parámetros longitud asintótica (L∞) y coeficiente de crecimiento (K) se estimaron con la rutina ELEFAN I incorporada en el programa FISAT II (FAO-ICLARM Fish Stock Assessment Tools). El valor de t0 fue calculado con la ecuación empírica log10(-t0) = -0,3922-0,2752log10L∞-1,038log10K (Pauly, 1983) derivada principalmente para especies tropicales. Con estos valores se calculó el índice de crecimiento ø' = log10K+2log10L∞ (Munro y Pauly, 1983), para posteriores comparaciones entre curvas de crecimiento intra e interespecíicas.
Reproducción
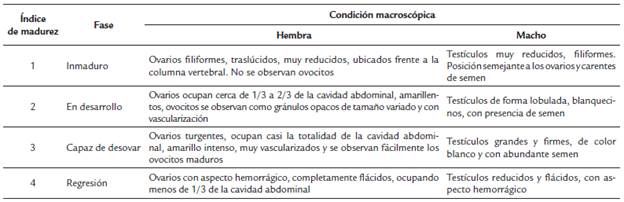
Se realizó un análisis macroscópico de las gónadas para determinar el sexo y el estado de desarrollo gonadal de cada individuo según la escala propuesta por Vazzoler (1981) y Brown-Peterson et al. (2011) modificada para S. melanocheir (Tabla 1). Las gónadas de cada individuo se pesaron en una balanza analítica de 0,0001 g de precisión. Se calculó el índice gonadosomático IGS = (Wg/We)*100, en donde Wg es el peso de las gónadas y We el peso del pez eviscerado; y el factor de condición K = (W/Lt3)*100 para cada sexo. Se evaluaron diferencias entre meses de los índices calculados con una prueba de Kruskal-Wallis, y para identificar las diferencias significativas se realizaron comparaciones de rangos medios. Se evaluó si la proporción de sexos fue significativamente diferente a una proporción 1:1 con una prueba de ji-cuadrado (X2). La talla media de madurez (L50) se estimó a partir de la distribución de frecuencia de tallas de machos y hembras en estadio de maduración gonadal 2, 3 y 4 (Tabla 1), ajustado por el modelo logístico P = 1/[1+e(a-b*Lt)] (Sokal y Rohlf, 1995), en donde P es la proporción estimada de individuos maduros por clase de talla, Lt es la marca de clase del intervalo de talla, a y b son constantes del modelo. Por último, se calculó la Lt en la que el 50 % de la población es madura mediante la ecuación L50 = a/b.
Hábitos alimentarios
Se realizó un análisis cuantitativo y cualitativo del contenido estomacal de S. melanocheir a partir de una submuestra (n = 324) seleccionada al azar del total de individuos recolectados en cada mes. Se identificaron y contaron las diferentes presas (ítems) por grandes grupos taxonómicos (camarones, copépodos, etc.). El material que no pudo ser identificado por evidencia de digestión, se asignó a un grupo nombrado material digerido. Posteriormente, cada ítem alimentario se pesó en una balanza analítica de 0,0001 g de precisión para calcular los índices usados por Bizarro et al. (2007). Estos índices se obtuvieron para adultos y juveniles por separado, considerando la L50.
Porcentaje en peso: %P = (P/Pt)*100 en donde: P es el peso total de una presa y Pt el peso total de todas las presas.
Indice de frecuencia de ocurrencia: %FO = (n/N)*100 en donde: n es el número de peces que contiene cada tipo de presa y N el número de estómagos que contienen presas.
Porcentaje en número: %N = (Nn/Np)*100 en donde: Nn es el número total de una presa y Np el número total de las diversas presas.
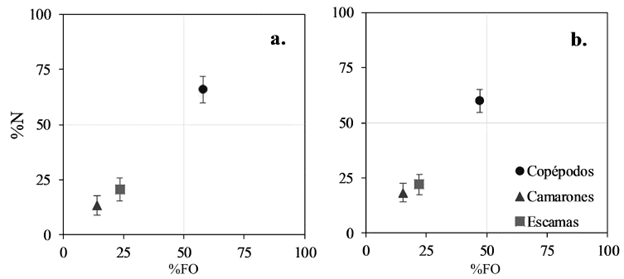
Para establecer la importancia general de las presas se estimó el índice de importancia relativa IRI = (%N+%P)*%FO (Pinkas et al., 1971). El IRI fue representado en porcentaje para facilitar comparaciones entre tipo de presas (Bizarro et al., 2007). La estrategia de alimentación fue evaluada con el método gráfico de Amundsen et al. (1996) utilizando el %N vs. %FO.
RESULTADOS
Se analizaron 751 individuos de los cuales 540 fueron hembras, 187 machos y 24 no pudieron ser sexados. Se encontró una proporción de sexos estadísticamente diferente con 2,9 hembras por cada macho capturado (X2 = 171,4, p < 0,05). En los meses de muestreo las hembras fueron más abundantes que los machos, excepto en septiembre y noviembre (Tabla 2). La Lt de las hembras osciló entre 7,9 y 17,1 cm (Media = 12,15, DE = 1,57) y la de los machos entre 8,5 y 15 cm (Media = 11,27, DE = 1,25) (Fig. 1). Durante el periodo de estudio las hembras fueron significativamente más pesadas (Z = 7,56, p < 0,001) y más grandes (Z = 7,46, p < 0,001) que los machos. A pesar de la disimilitud en W y Lt entre machos y hembras no se encontraron diferencias significativas en la relación W/Lt entre sexos (ANCOVA F = 2,70, p = 0,1). Por lo tanto, se estableció una relación común para machos y hembras de la especie, representada por la ecuación y = 0,0028a3,5565 con un coeficiente de determinación (r2) de 0,97 (Fig. 2). S. melanocheir presentó un crecimiento alométrico positivo (t = 26,36, p < 0,05) con un parámetro exponencial (b) entre 3,538 y 3,625 con el 95 % de confianza. A partir de los parámetros obtenidos (L∞ = 17,8 cm, K = 0,62/año, t0 = -0,34), se definió el modelo de crecimiento de Von Bertalanffy para S. melanocheir como Lt = 17,8(1-e[-0,62(t+0,34)]), el cual predice que la talla media de madurez calculada de las hembras (Lt = 11,7 cm) se alcanza a los 1,5 años de vida (Fig. 3).
Tabla 2 Frecuencia relativa de los estadios gonadales (1 = inmaduro, 2 = en desarrollo, 3 = capaz de desovar) y total de individuos examinados de Stellifer melanocheir por sexo, para cada mes evaluado, en el Golfo de Tortugas, Colombia.
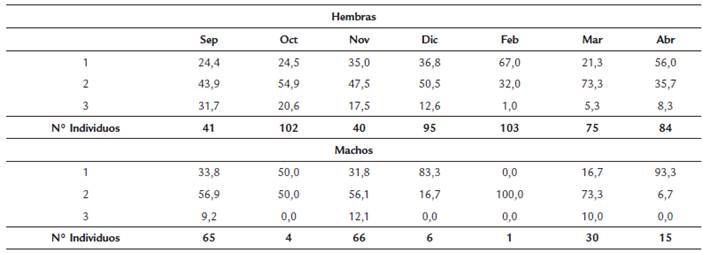
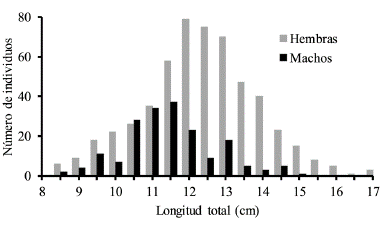
Figura 1 Distribución de la frecuencia de tallas de machos y hembras de Stellifer malanocheir en el Golfo de Tortugas, Colombia.
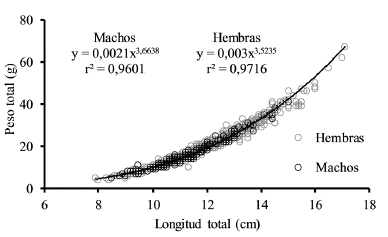
Figura 2 Relación peso/longitud (W/Lt) para Stellifer melanocheir por sexos, en el Golfo de Tortugas, Colombia. Las líneas de tendencia para cada sexo se muestran superpuestas.
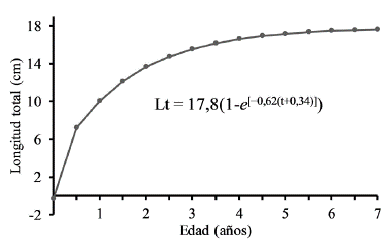
Figura 3 Curva de crecimiento de Stellifer melanocheir, en el Golfo de Tortugas, Colombia, según el modelo de Von Bertalanffy.
El 47,96 % de las hembras capturadas se encontraron en estadio de desarrollo gonádico 2, seguidas de hembras inmaduras (estadio 1) con el 40 % y por último hembras maduras o en capacidad de desovar (estado 3) con el 12 %.
Durante el periodo de estudio no se encontraron hembras en estadio 4 (Tabla 2). Octubre presentó el mayor número de hembras en estadio 2 y 3, a diferencia de febrero y abril con el mayor número de hembras inmaduras (estadio 1). La mayoría de los machos en estadios 2 y 3 se encontraron en noviembre, seguido del mes de marzo (Tabla 2). El IGS para las hembras fue significativamente diferente entre meses (KW H6 540 = 99,35, p < 0,001), siendo la fuente de variación el mes de septiembre (p < 0,05), cuando se registró el IGS más alto, que disminuyó paulatinamente hasta diciembre (Fig. 4). Durante marzo se registró un segundo incremento significativo del IGS (p < 0,001), lo que sugiere un segundo pulso reproductivo de menor magnitud. El IGS para los machos presentó una tendencia similar al de las hembras, siendo significativamente diferente entre meses (KW H6 187 = 57,68, p < 0,001). Al igual que para las hembras, el mayor registro de IGS en los machos fue durante septiembre y el más bajo en diciembre, identificándose un segundo incremento durante el mes de marzo (Fig. 4).
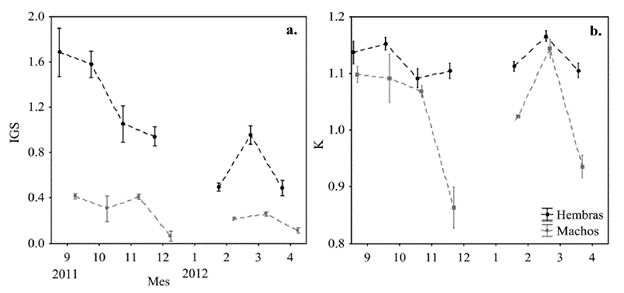
Figura 4 Variación de la media mensual (±SE) del a. índice gonadosomático (IGS) y b. factor de condición (K) de machos y hembras de Stellifer melanocheir, en el Golfo de Tortugas, Colombia.
El coeficiente de crecimiento (K) varió significativamente entre los meses de estudio, tanto en hembras (KW H6 = 29,67, p < 0,001) como en machos (KW H6 187 = 49,66, p < 0,001), describiendo para ambos grupos un mayor registro durante marzo (Fig. 4). Se calculó que la Lt en la que el 50 % de las hembras estuvieron maduras (L50) fue de 11,7 cm (α = 13,66, b = 1,16), mientras que para los machos fue de 10,9 cm (α = 22,5, b = 2,07) (Fig. 5).
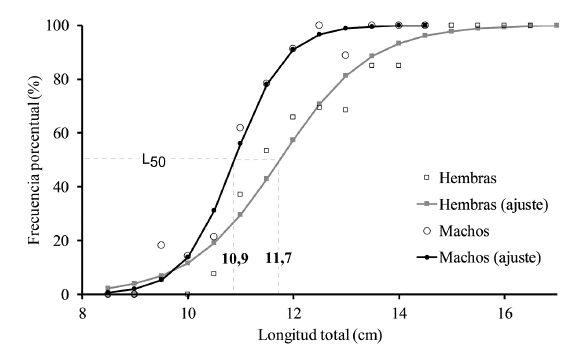
Figura 5 Proporción de individuos maduros por intervalos de tallas y talla media de madurez sexual de Stellifer melanocheir (Hembras: L50 = 11,7 cm, machos: L50 = 10,9 cm), en el Golfo de Tortugas, Colombia.
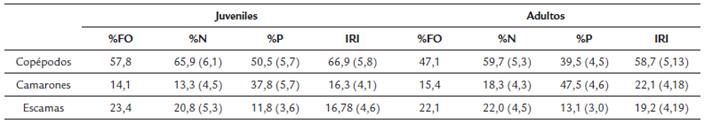
De los 324 estómagos analizados, 148 estuvieron vacíos (45,7 %); de estos, 39 fueron de individuos juveniles (26,4 %) y 109 adultos (73,6 %). En los estómagos con contenido estomacal de juveniles (64) y adultos (112) se encontraron las mismas categorías alimenticias conformadas por copépodos, camarones y escamas, lo cual sugiere una dieta semejante a lo largo de sus etapas juvenil y adulta. 33 estómagos contuvieron material vegetal, principalmente restos de madera, probablemente ingeridos de manera accidental. Los copépodos fueron la presa más frecuente en juveniles (%FO = 57,8) y adultos (%FO = 47,1). Sin embargo, de acuerdo con el porcentaje en peso (%P) del alimento ingerido, los copépodos fueron la presa más consumida en los juveniles (50,5 %) mientras que los camarones lo fueron en los adultos (47,5 %). Aunque los camarones dominaron la dieta en %P en los adultos, los copépodos fueron las presas más abundantes en adultos (%N = 59,7) y también en juveniles (%N = 65,9), seguidos por las escamas en adultos (%N = 22,0) y en juveniles (%N = 20,8) (Tabla 3). Al establecer el valor de importancia relativa de los diferentes ítems alimentarios se encontró que para S. melanocheir en el Golfo de Tortugas los copépodos fueron el alimento más importante tanto en juveniles (66,9 %) como en adultos (58,7 %), seguidos de los camarones en adultos y las escamas en juveniles (Tabla 3). De acuerdo con el método gráfico de Amundsen et al. (1996), S. melanocheir presentó una estrategia alimenticia especializada de copépodos durante su desarrollo postlarval, con una menor contribución ocasional de camarones y escamas en algunos individuos (Fig. 6).
Tabla 3 Media y error estándar (SE) del porcentaje en número (%N), porcentaje en peso (%P) y el índice de importancia relativa (IRI); Índice de frecuencia de presas (%FO) de juveniles y adultos de Stellifer melanocheir, en el Golfo de Tortugas, Colombia.
DISCUSIÓN
En la presente investigación se registró el individuo de mayor longitud total reportado hasta el momento para S. melanocheir con un Lt de 17,1 cm, superando en más de 2 cm el máximo reporte de Lt realizado por Chao (1995) para la especie. El patrón de crecimiento entre ambos sexos fue similar y alométrico (Fig. 2), lo que indica que no hay diferencias morfométricas en la especie durante su desarrollo ontogénico postlarval. Un crecimiento de tipo alométrico con un valor de b mayor a tres, sugiere que la especie presenta una tendencia a aumentar más en peso que en longitud. Al comparar las estimaciones de los parámetros de crecimiento establecidos para S. melanocheir en la presente investigación (L∞ = 17,3 cm y K = 0,71/año) con otros congéneres como S. lanceolatus en el golfo de México (L∞ = 18,5 cm, K = 0,4/año) (Ramos-Miranda et al., 2009) y S. rastrifer en el sur de Brasil (L∞ = 20,9 cm, K = 0,37/año) (Pombo et al., 2013), la tasa de crecimiento establecida para S. melanocheir fue mayor, pero la talla asintótica fue menor. Para confirmar diferencias en el crecimiento de las especies se calculó el valor de Φ' para S. lanceolatus y S. rastrifer con valores de 2,14 y 2,21 respectivamente. Esto confirma que S. melanocheir tiene un crecimiento relativamente más rápido (Φ' = 2,29), posiblemente debido a que se distribuye cerca del Ecuador en el Pacífico Oriental Tropical (POT), diferente de S. lanceolatus y S. rastrifer que se distribuyen más alejadas de la línea ecuatorial, donde prevalece mayor variabilidad estacional de la temperatura.
La baja proporción de individuos maduros y la alta de inmaduros y en maduración en la muestra analizada del Golfo de Tortugas, sugiere que la especie puede tener una distribución estratificada en donde la zona de estudio podría ser una región de importancia ecológica para juveniles y preadultos de esta especie. Por lo tanto, sería de esperar que los procesos reproductivos estén ocurriendo por fuera de las zonas de la pesca artesanal de arrastre de camarón, quizás en zonas más alejadas de la costa, con mayor profundidad, salinidad u otro factor que les permita inalizar su ciclo de desarrollo. Algunos congéneres como S. brasiliensis, S. colonensis, S. lanceolatus, S. naso, S. rastrifer y S. stellifer (Yáñez-Arancibia y Sánchez-Gil, 1988; Camargo e Isaac, 2005; Ramos-Miranda et al., 2009; Pombo et al., 2012) presentan cambios de distribución relacionados con su ciclo de vida, en donde los juveniles habitan principalmente cerca de la costa y los adultos se mueven hacia zonas más profundas y salinas, en donde se reproducen. Esta tendencia probablemente la está exhibiendo S. melanocheir en el Golfo de Tortugas.
A esta hipótesis de la distribución estratiicada se le puede sumar una migración diferencial de sexos. Lo anterior se plantea debido a que las hembras fueron más grandes y 2,9 veces más abundantes que los machos, lo cual podría ser explicado por una migración temprana de los machos hacia zonas más profundas en el momento que han alcanzado su talla de media madurez. Lo anterior se apoya en que los machos superiores a su talla media de madurez disminuyeron sustancialmente en comparación a las hembras (Fig. 1). Dado que las hembras presentan un L50 mayor que los machos, más hembras y con mayor tamaño permanecen más tiempo en el área de estudio hasta que alcanzan su talla de maduración y posterior migración para reproducirse, todo esto considerando que ambos sexos presentan una tasa de crecimiento similar. Aunque este comportamiento no se ha observado en congéneres sí se ha registrado en otros miembros de la familia Sciaenidae (Fennessy, 2000; Vicentini y Araújo, 2003). Todo lo anterior debe tomarse como hipótesis que requiere ser demostrada mediante un análisis temporal más amplio de capturas que involucren gradientes salinos y batimétricos.
De acuerdo con lo anterior, y considerando que las hembras son uno de los principales factores que influencia el potencial reproductivo de una especie, la pesca artesanal de CAS, la cual se realiza muy cerca a la costa (4-10 m de profundidad), puede afectar negativamente el reclutamiento larval de S. melanocheir debido a que más del 60 % de la población capturada aún no ha alcanzado la talla media de madurez.
Durante todo el periodo de estudio se encontraron hembras maduras, lo cual sugiere que la especie se reproduce a lo largo del año. La mayor cantidad de hembras en estadio 3 se encontraron en octubre y los valores más altos del IGS entre septiembre y noviembre, en ambos sexos, lo cual sugiere que entre septiembre y noviembre hay un periodo máximo reproductivo, resultado que coincidió parcialmente con lo descrito por Chao (1995), quien reporta hembras maduras en noviembre. Los resultados también sugieren otro periodo reproductivo menor durante marzo. Estos pulsos reproductivos son típicos de especies tropicales, en los cuales se encuentran gónadas con un desarrollo asincrónico con desoves parciales a lo largo del año (Lowerre-Barbieri et al., 2011). Es importante mencionar que faltaron cuatro meses de muestreo para cerrar el ciclo anual en los cuales pudieron haber ocurrido otros eventos reproductivos. El periodo máximo reproductivo encontrado coincide con la época de mayor precipitación (octubre) en la zona de estudio (Enríquez et al., 2014). El segundo pulso reproductivo coincide con el inicio del aumento de las lluvias en el primer semestre del año. Por lo anterior, es posible que los aumentos en la precipitación estimulen la velocidad de desarrollo reproductivo de S. melanocheir. El factor de condición (K) presentó una tendencia similar al IGS, estando relacionados los valores altos de estos atributos con los periodos reproductivos de la especie (Bolger y Connolly, 1989), lo cual reafirma que el estado de condición de una especie está fuertemente influenciado por el esfuerzo reproductivo.
El alto porcentaje de estómagos vacíos puede deberse a un reflejo de regurgitación por estrés, debido a la presión que ejerce la captura dentro de la red durante el arrastre. Sin embargo, el alto número de estómagos vacíos, aunado al alto número de estómagos con material avanzado en digestión, sugiere que la especie se alimenta principalmente durante la noche o en las primeras horas de la madrugada. De acuerdo con el IRI, los copépodos son la presa más consumida, seguido por los camarones. Esta dieta es similar a la de sus congéneres S. lanceolatus y S. rastrifer, especies que se alimentan de copépodos, decápodos no-braquiuros, otros crustáceos y peces (Stickney et al., 1975; Chavez y Vendel, 1998). Neuta y Perdomo (2004) muestran que S. ericymba, S. furthii, S. mancorensis, S. oscitans y S. zestocarus y se alimentan de copépodos y camarones Peneidos. Esto demuestra que, de igual manera que algunos integrantes del género, S. melanocheir presenta un espectro trófico estrecho, carcinófago con hábitos bentopelágicos. En este trabajo no se identificó la asociación ecológica de los copépodos por lo cual no fue posible determinar si S. melanocheir permanece más tiempo cerca del fondo o a media agua, considerando que los copépodos son el ítem alimentario más importante.
La poca variación encontrada en cuanto a la importancia de los ítems alimentarios durante el periodo de estudio muestra una alimentación similar durante su etapa juvenil y adulta, y sugiere pocos cambios en la disponibilidad de alimento, a pesar de las fluctuaciones ambientales debidas principalmente a cambios en los regímenes de precipitación (Wakabara et al., 1993). Aunque la especie presentó una dieta principalmente de copépodos durante sus etapas juvenil y adulta, los adultos consumieron más camarones, probablemente debido a que individuos más grandes presentan una cavidad bucal y capacidad de deglución mayor que les permite capturar presas más grandes.
La importancia de las escamas fue similar a la de los camarones y fue mayor en los adultos. Al no encontrar restos óseos o de piel que puedan dar indicios de una dieta piscívora o lepidófaga, la ingesta de escamas se atribuye como un complemento en su dieta durante todo su desarrollo ontogénico, las cuales puede comer removiéndolas directamente del fondo, dado que en algunos estómagos se encontró sedimento. En los estómagos también se encontró material vegetal en pequeñas proporciones, tal vez consumido incidentalmente como parte del proceso de captura de los camarones o de las escamas, debido a que los fondos de esta zona presentan mucho material vegetal en descomposición proveniente de los ríos que desembocan en la región.
CONCLUSIONES
Este trabajo permitió conocer diferentes aspectos biológicos importantes de S. melanocheir. Se destaca que esta especie presentó un crecimiento relativamente rápido con respecto a especies congéneres. Las hembras alcanzan la talla media de madurez en 11,7 cm y los machos en 10,9 cm. Su reproducción es continua, pero con dos periodos importantes, un periodo máximo reproductivo entre septiembre y noviembre y uno menor en marzo, posiblemente aprovechando las temporadas con aumento de precipitación. Durante sus etapas juvenil y adulta la especie se alimenta principalmente de copépodos y en menor cantidad de camarones, que aumentan en los individuos más grandes. Con base en los resultados obtenidos en la presente investigación, y teniendo en cuenta que las hembras son uno de los principales factores que influencia el potencial reproductivo de una especie, es probable que la pesca artesanal de camarón de aguas someras, actividad que se realiza cerca a la costa entre 4 a 10 m de profundidad, esté teniendo un efecto negativo sobre S. melanocheir, ya que más del 60 % de los individuos evaluados aún no han logrado su talla media de madurez. Sin embargo, para validar esta conjetura se requiere establecer al menos el tamaño del stock y conocer el volumen de captura de esta especie asociado a la pesquería del camarón de aguas someras.
Aunque este trabajo brinda información biológica importante de S. melanocheir, se recomienda realizar estudios de crecimiento con estructuras duras, análisis histológico de gónadas y valoración de la dieta específica mediante isótopos estables, a in de contrastar y profundizar en los resultados obtenidos. Además, se requiere realizar análisis de abundancia y distribución de la especie que soporten las hipótesis planteadas. En general, es necesario realizar estudios sobre las historias de vida y la distribución espacio-temporal de las especies incidentales en la pesca de arrastre de CAS, asociados a la medición de parámetros físico-químicos, que permitan explicar la dinámica de estas poblaciones en la región. Esta información es importante para que la autoridad competente regule de manera efectiva la pesca de arrastre de CAS, con la cual se capturan adicionalmente individuos inmaduros de una gran variedad de especies.