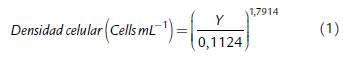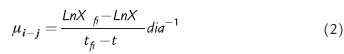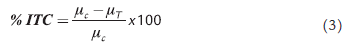INTRODUCCIÓN
Actualmente estudios e investigaciones sobre los efectos negativos de sustancias tóxicas presentes en el ambiente han tomado gran relevancia debido a que la mayoría de estas sustancias tiene un efecto directo sobre los individuos, causando alteraciones a nivel individual, poblacional y de comunidades (Gómez y Ramírez, 2004). La presencia de hidrocarburos aromáticos policíclicos (HAPs) en el medio ambiente se ha documentado ampliamente debido a que estos compuestos constituyen parte de los componentes tóxicos del petróleo asociados a efectos genotóxicos que pueden ser bioacumulados por organismos acuáticos (Corner et al., 2009; Manahan, 2009). Los hidrocarburos aromáticos tienen un potencial carcinogénico, por lo que su toxicidad en los organismos acuáticos es de gran importancia (Zhang et al., 2004; Echeveste et al., 2010). Estos compuestos son químicamente estables, poco degradables y de elevada toxicidad. Dentro de los HAPs más comunes se encuentran el pireno, naftaleno y fenantreno, siendo este último, uno de los hidrocarburos más prevalentes en el ambiente (Khan et al., 2019). El fenantreno (PHE) es un HAP de tres anillos incluido entre los 16 HAP prioritarios de la US Environmental Protection Agency (EPA) y está presente en el medio acuático como resultado de fuentes tanto petrogénicas como pirogénicas (Lima et al., 2003).
Dentro de los organismos utilizados en bioensayos de toxicidad se encuentran los microorganismos acuáticos, cuya principal ventaja de su uso en ecotoxicología, es que permiten demostrar los efectos del tóxico a nivel individual y sus consecuencias posteriores sobre niveles superiores (Alayo y lannacone, 2002). En la última década, se han realizado estudios que buscan determinar el efecto de los xenobióticos presentes en el agua y las microalgas han sido consideradas como los organismos más sensibles y relevantes para aplicarlos en estudios de toxicidad (Ma et al., 2004; Ma, 2005; Abou-Shanab et al., 2013; Otero-Paternina et al., 2013; Rai et al., 2013). El efecto producido en las microalgas por xenobióticos dentro de un cuerpo receptor o a nivel de laboratorio, ha sido reportado en diversas investigaciones a través de diferentes variables como crecimiento poblacional, inhibición de crecimiento, densidad algal y contenido de clorofila a y otros pigmentos (Kong et al., 2010; McGinn et al., 2012; Otero-Paternina et al., 2013). Chlorella vulgaris fue seleccionada, por ser una de las especies de algas dominantes en el agua, además de tener un uso potencial para degradar o absorber una variedad de contaminantes orgánicos (Kong et al., 2010).
El estudio de biomarcadores, a nivel ecotoxicológico, se ha convertido en una importante alternativa que permite obtener información precisa de los efectos celulares, subcelulares y enzimáticos en los microorganismos afectados. En un contexto toxicológico, los biomarcadores se consideran indicadores sensibles a efectos tempranos que demuestran que las sustancias tóxicas han ingresado a un organismo y se han distribuido en sus tejidos produciendo efectos deletéreos (van der Oost et al., 2003). La determinación de enzimas antioxidantes, que actúan contrarrestando el impacto producido por las especies reactivas de oxígeno (ROS), son una importante herramienta para la detección de perturbaciones fisiológicas sobre los microorganismos (Wang y Zheng, 2008; Kong et al., 2010; Soto et al., 2011). Las ROS son átomos o moléculas libres e inestables, que debido a la carencia de un electrón en su órbita provocan un desequilibrio al intentar reaccionar con biomoléculas estables en la microalga (proteínas, lípidos, etc.) (Alscher et al., 2002). La respuesta de los sistemas antioxidantes en los organismos puede considerarse biomarcadores de la exposición a contaminantes como los HAPs. Una inducción del sistema antioxidante puede considerarse como una adaptación, mientras que la deficiencia del mismo puede inducir a un estado de fragilidad y susceptibilidad (Lei et al., 2006).
Este estudio se realizó principalmente para evaluar la toxicidad en C. vulgaris expuesta a fenantreno, evaluando parámetros fisiológicos como la tasa de crecimiento, el contenido de clorofila a y clorofila b, el diámetro celular y la actividad de superóxido dismutasa (SOD) y catalasa (CAT), para definir las respuestas tóxicas a corto plazo, lo que facilitaría comprender cómo este HAP afecta a los organismos y proporcionando una visión más completa sobre la evaluación del riesgo ecológico.
MATERIALES Y METODOS
Productos químicos
El fenantreno (PHE) se obtuvo de Sigma Aldrich Co. (Alemania) con una pureza > 98 %, Acetona y Metanol grado analítico (Merck, Darmstadt, Alemania). A partir de una solución stock a 2 g L-1 (PHE con acetona), se realizaron diferentes diluciones con el fin de no exceder el 0,05 % (v/v) de acetona en cada unidad experimental, esta concentración no presenta toxicidad en los microorganismos (Otero-Paternina et al., 2013). Esta dosis también se añadió al cultivo de control (control solvente).
Organismo de estudio
C. vulgaris es un alga verde unicelular, frecuentemente utilizada como bioindicador debido a su alta sensibilidad a sustancias tóxicas (Ma et al., 2004). El laboratorio de Alimento Vivo de la Universidad de Córdoba (Córdoba, Colombia) proporcionó la microalga en un medio f/2. El alga se muestreó en la fase exponencial y las células algales se contaron antes del experimento usando una cámara de Neubauer (BOECO® Bright-line, Alemania) bajo un microscopio triocular (ZEUSS® Primo Start, Alemania).
Condiciones de cultivo
Las microalgas se mantuvieron bajo condiciones controladas de laboratorio con iluminación constante (lámparas fluorescentes blancas de 9 W) e intensidad de luz de 36,8±4,2 µmol m-2 s-1, temperatura de 20±1 °C y agitación permanente entre 160-170 rpm en un agitador rotatorio (Thermo Scientific® MaxQ-2000), dentro de una cabina de seguridad en acrílico para conservar un entorno axénico. Como medio de cultivo se utilizó un medio inorgánico de complejo NPK (REMITAL® M 17-6-18) a razón de 1 g L-1 que contiene 17 % de nitrógeno total, fósforo asimilable 6 %, potasio soluble en agua 18 %, magnesio 2 %, azufre total 1,6 %, boro 0,2 % y 0,1 % de zinc, el cual ha mostrado los mejores resultados con respecto al crecimiento poblacional para especies del género Chlorella, según lo reportado por Muñoz-Peñuela et al. (2012) y Ortiz-Moreno et al. (2012).
Protocolo de exposición
El gradiente de concentración de PHE (Sigma Aldrich Co., Alemania) se determinó en una investigación previa basada en su toxicidad aguda en C. vulgaris (Otero-Paternina et al., 2013). Se prepararon diferentes diluciones para los tratamientos (0,1; 1,0; 10; 100 y 1000 µg L-1) a partir de la solución stock (2 g PHE. L-1 acetona); adicionalmente se implementó un control solvente (0,05 % acetona v/v) y un control negativo sin adición de PHE y acetona. Se implementaron tres replicas en matraces de 0,25 L para cada tratamiento. En todos los matraces se inoculó una concentración algal de 9,0 x 105 células mL-1 de medio de cultivo. El tiempo de exposición fue de siete días como una fase crónica donde fueron determinadas diariamente variables de crecimiento como densidad algal mediante espectrofotometría, tasa promedio de crecimiento, el porcentaje de inhibición de la tasa de crecimiento (OECD, 2011). Al inicio y final del ensayo se midió el diámetro celular. Adicionalmente, a las 48 y 96 horas se adicionó medio de cultivo inorgánico a todos los tratamientos a una concentración de 1 g L-1.
Densidad celular
La densidad celular fue determinada mediante absorbancia según lo descrito por Rodrigues et al. (2011). Se realizó un escaneo espectral de absorbancia entre los 600 y los 800 nm de diferentes muestras de cultivo de la microalga C. vulgaris para determinar el pico máximo de absorbancia en el lector multimodal Cytation 3 (Biotek®, USA). Se observó el pico máximo de absorbancia a 681 nm, lo cual representó la longitud de onda de máxima sensibilidad para cuantificar muestras de C. vulgaris. Posteriormente, se realizaron 25 diferentes diluciones de cultivo celular y se realizó la medición de absorbancia y conteo celular con cámara de Neubauer bajo microscopio óptico. La relación entre la absorbancia y la densidad celular de Chlorella vulgaris fue obtenida a partir de un ensayo preliminar en condiciones normales de laboratorio. Se realizó un función de potencia buscando disminuir el error relacionado con el sombreado celular en densidades altas (Rodrigues et al., 2011); a partir de esta función se obtuvo un valor de R2 > 0,98 y por tanto, todas las muestras del experimento fueron medidas con esta longitud de onda, debido a su alto grado de correlación entre el conteo celular ocular y la absorbancia óptica medida para cada dilución.
Dónde:
Y: valor de absorbancia de la muestra
Tasa promedio de crecimiento diario
Según los criterios establecidos por la OECD (2011), la tasa promedio de crecimiento diario es calculada mediante el incremento logarítmico de la biomasa durante el ensayo, para lo cual se emplea la siguiente ecuación:
Dónde:
µij = Promedio de tasa de crecimiento especifico desde el tiempo i a j
Xi = Densidad celular al tiempo i
Xf = Densidad celular al tiempo f
t = Tiempo de medición, sea i o j
Porcentaje de inhibición de tasa de crecimiento
Se calculó teniendo en cuenta la tasa específica de crecimiento así:
Dónde:
% I T = porcentaje de inhibición del promedio de la tasa especifica de crecimiento
µc = promedio de la tasa especifica de crecimiento (µ) en el grupo control
µT = promedio de la tasa especifica de crecimiento en el tratamiento
Contenido de clorofila a y clorofila b
Para cada réplica, 40 mL del medio con las microalgas fue filtrado, posteriormente el filtro fue transferido a tubos de ensayo protegidos de la luz, en cuyo interior se habían adicionado previamente 10 mL de metanol al 100 %. Posteriormente, el filtro fue macerado y las muestras mantenidas bajo refrigeración (4 °C) durante 24 horas. Transcurrido este tiempo, se determinó la absorbancia del sobrenadante en un lector de placas (Cytation 3, BioTek®). Para estandarizar la medición por medio de placa, también se realizaron lecturas utilizando celdas de cuarzo de longitud de paso de 1 cm (Warren, 2008).
Las absorbancias a 652 y 665 nm de las muestras de microalgas en la microplaca fueron convertidas a la longitud de paso de 1 cm, corrigiendo la absorbancia, usando la medida de longitud de paso (pathlength) de la celda de cuarzo:
La concentración de clorofila fue calculada a partir de la longitud de paso corregida a 1 cm usando la formula reportada por Warren (2008).
Determinación de la actividad antioxidante
Se utilizaron 50 ml de cultivo para la determinación de la actividad enzimática, las microalgas se cosecharon por medio de centrifugación a 5000 gravedades por diez minutos según lo reportado por Gao y Tam (2011). Las muestras de algas se almacenaron a -20 °C hasta la determinación en laboratorio. La colecta de muestras se realizó a las 0,72 y 168 horas con el fin de evaluar la variación que presenten las enzimas antioxidantes ante la exposición a fenantreno.
Fue utilizado un homogeneizador (Polytron PT 1200E) para romper las paredes celulares de las células algales. Los extractos se homogenizaron con 0,05 M de buffer fosfatado sódico (pH 7,0) que contenía 0,1 M de EDTA y 1 % de polivinilpirrolidona (PVP); todo el proceso se realizó con cavas de hielo para evitar la activación de las enzimas. Cada muestra homogenizada se centrifugó a 15 000 gravedades por diez minutos a 4 °C y el sobrenadante obtenido se almacenó como alícuotas hasta la estimación de las enzimas.
Determinación de proteína
El contenido total de proteína total soluble fue determinado con el método descrito por Bradford (1976) con albúmina de suero bovino (BSA) como el estándar de proteína. Los resultados fueron utilizados para la expresión de la actividad enzimática con base en la estimación de proteína (mg proteína).
Determinación de catalasa (CAT)
La actividad de la CAT fue determinada por medio del método descrito por Aebi (1984). La tasa de descomposición de peróxido de hidrógeno fue medida a una longitud de onda de 240 nm a través del método espectrofotométrico y se calculó usando un coeficiente de extensión molar ε = 0,04 mM-1 cm-1. La mezcla de reacción consistió en buffer fosfatado sódico (pH 7,0), 0,1 mM de peróxido de hidrógeno y alícuota. Una unidad de actividad de la catalasa se asume como la cantidad de enzima que descompone 1 mmol de H2O2 por mg de proteína soluble por minuto a 30 °C. Para calcular CAT se tuvo en cuenta el valor de la absorbancia, la dilución realizada, el factor entre el volumen de muestra y volumen final y el factor entre el coeficiente de extinción del peróxido y la proteína.
Determinación de la superóxido dismutasa (SOD)
La actividad de la SOD busca medir la habilidad para inhibir la reducción fotoquímica del Nitroazul de tetrazolio (NBT) y el cambio en la absorbancia, se utilizó el método descrito por Beauchamp y Fridovich (1971). La reacción de mezcla consistió en 40 mM búfer fosfatado sódico (pH 7,8), 75 µM NBT, 2 µM riboflavina, 13 mM metionina, 0,1 mM EDTA y alícuota. La placa preparada con la mezcla de reacción se expuso bajo una fuente de luz artificial durante 30 minutos y posteriormente se midió la absorbancia a 560 nm. Una unidad de actividad de SOD (U) se definió como la cantidad enzimática usada para inhibir la velocidad de partida del reactivo al 50 %. Para el cálculo de SOD se tuvo en cuenta el factor entre el delta de absorbancias a los cero y treinta minutos entre el blanco y la muestra, también se tiene en cuenta el factor entre el volumen final y el valor de la proteína.
Análisis estadístico
Se realizó un análisis estadístico descriptivo y los datos se expresaron como media ± SEM. Para cada parámetro se realizó un análisis de dos vías para evaluar el efecto del tratamiento y del tiempo de exposición. Los datos que no cumplieron los supuestos de normalidad (prueba de Kolgomorov-Smirnov) y homogeneidad de varianza (Prueba de Bartlett), se procedieron a transformar para realizar el respectivo análisis. Posteriormente, para analizar todas las variables evaluadas en el estudio, se realizó un post-test de Bonferroni de comparaciones múltiples. En todos los casos se utilizó un valor de p < 0,05 como el nivel para considerar diferencias estadísticas significativas. Los procedimientos estadísticos fueron realizados por medio del software SAS® for Windows versión 9,02 (2002-2006, SAS Institute, Cary, NC, USA) y para realizar el análisis grafico se utilizó el software Graph Pad Prism 5,0 (San Diego, CA, USA)
RESULTADOS
Densidad celular de C. vulgaris expuesta a fenantreno
En la Figura 1 se ilustra el efecto de diferentes concentraciones de fenantreno sobre la densidad celular a lo largo de siete días de exposición. El tratamiento control evidenció un crecimiento constante a lo largo del experimento, mientras que todos los tratamientos evaluados presentaron variaciones en su crecimiento. Todos los tratamientos con fenantreno mostraron una disminución en la densidad celular hasta las 48 horas, como resultado de la exposición al hidrocarburo, siendo inferior la densidad celular para las concentraciones de fenantreno más altas. A las 72 horas, producto de la adición de medio de cultivo, se observó un incremento en el crecimiento de todos los tratamientos con densidades de 2,1 ± 0,08 x106 y 1,7 ± 0,09 x106 cel mL-1 para el tratamiento control y la concentración más alta, respectivamente. A las 96 horas, todos los tratamientos presentaron densidades celulares más bajas con respecto al control y muestreo previo.
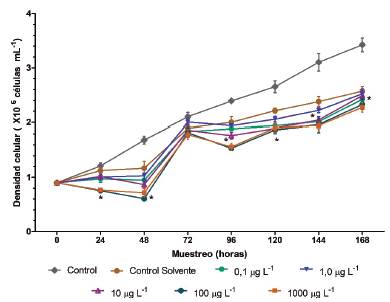
Figura 1 Densidad celular de C. vulgaris expuesta a diferentes concentraciones de fenantreno durante siete días. Los valores son expresados como media ± error estándar de la media (SEM). * Para cada tiempo de exposición, asterisco indica diferencias significativas con respecto al control (p < 0,05, Test de Bonferroni).
Variables de crecimiento
Para calcular las variables de crecimiento se tuvo en cuenta la densidad inicial a las cero horas, la cual fue de 9x105 cel mL-1 en todos los tratamientos. La tasa de crecimiento de las microalgas fue menor en todos los tratamientos cuando comparado con el control (Tabla 1). El porcentaje de inhibición se incrementó a medida que aumentó la concentración de fenantreno en el medio de cultivo, a excepción de la concentración de 0,1 µg L-1.
Tabla 1 Tasa promedio de crecimiento diario (TPCD) y porcentaje de inhibición de la tasa de crecimiento (% ITC) de Chlorella vulgaris expuesta a diferentes concentraciones de fenantreno.
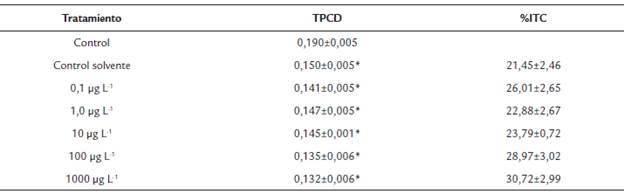
Los valores son expresados como media ± error estándar de la media (SEM). * Indica diferencias significativas con respecto al control. a, b, c Medias con letras distintas son estadísticamente diferentes. (p < 0,05, Test de Bonferroni).
Diámetro celular
Las microalgas expuestas a las diferentes concentraciones de fenantreno mostraron una disminución significativa en el tamaño del diámetro celular con respecto a las microalgas del tratamiento control al finalizar el experimento (Fig. 2). A los siete días de exposición las microalgas expuestas a la concentración más alta de fenantreno (1000 µg L-1) presentaron un diámetro celular de 4,36 ± 0,03 µm, mientras que el diámetro de las microalgas del tratamiento control a las 0 horas, no presentó diferencias significativas con el control al finalizar el experimento.
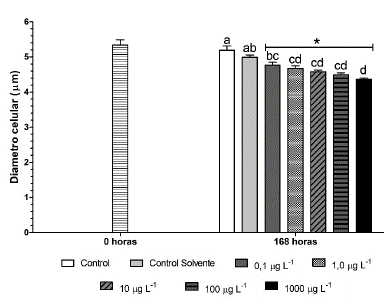
Figura 2 Diámetro celular de Chlorella vulgaris expuesta a diferentes concentraciones de fenantreno. Los valores son expresados como media ± error estándar de la media (SEM). * Indica diferencias significativas con respecto a la hora cero. a, b, c, d Medias con letras distintas son estadísticamente diferentes (p < 0,05, Test de Bonferroni).
Concentración de clorofila a y b
La concentración de la clorofi la α y b se vio afectada por las diferentes concentraciones de fenantreno a los tres y siete días de exposición (Fig. 3). A las 72 horas, se evidencio una disminución significativa de los tratamientos expuestos a fenantreno cuando comparados con el control; así mismo, la concentración disminuyo en todas las concentraciones con respecto a la hora cero tanto para clorofila a y b. Aunque al finalizar el experimento hubo un aumento en las concentraciones de clorofila a y b en todos los tratamientos con fenantreno, estos valores fueron significativamente menores a los del tratamiento control.
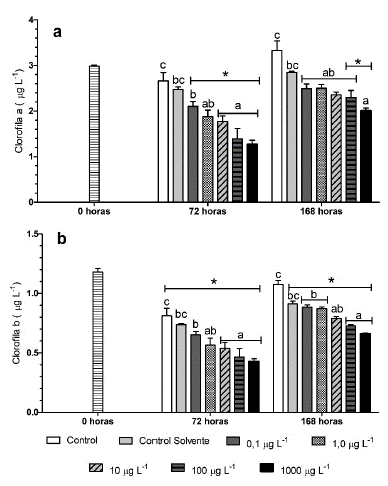
Figura 3 a.) Concentración de clorofila a. b.) Concentración de clorofila b de Chlorella vulgaris expuesta a diferentes concentraciones de fenantreno. Los valores son expresados como media ± error estándar de la media (SEM). Medias con letras distintas son estadísticamente diferentes entre tratamientos. * Representa diferencias estadísticas con respecto a la hora cero (p < 0.05).
Actividad de la catalasa (CAT)
A las 72 horas se evidenció una disminución significativa en los niveles de catalasa en los tratamientos con fenantreno con respecto al control y a la hora cero. Sin embargo, al finalizar el experimento todos los tratamientos, incluido el tratamiento control presento diferencias significativas respecto a la hora cero (Fig. 4a).
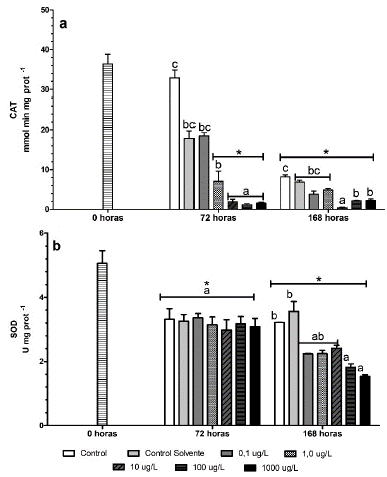
Figura 4 a.) Actividad de la catalasa (CAT). b.) Actividad de la superóxido dismutasa (SOD) de Chlorella vulgaris expuesta a diferentes concentraciones de fenantreno. Los valores son expresados como media ± error estándar de la media (SEM). Medias con letras distintas son estadísticamente diferentes entre tratamientos. * Representa diferencias estadísticas con respecto a la hora cero (p < 0,05).
Actividad de la superóxido dismutasa (SOD)
A diferencia de CAT, la actividad de SOD de las microalgas con fenantreno no presentó diferencias significativas a las 72 horas de exposición con respecto al grupo control. Sin embargo, a los siete días del experimento, todas las concentraciones con fenantreno presentaron niveles significativamente más bajos que el control en ese muestreo y con respecto a la hora cero (Fig. 4b).
DISCUSIÓN
En numerosos estudios se han descrito los efectos tóxicos que pueden producir la exposición a hidrocarburos sobre diferentes organismos en la cadena trófica, principalmente quienes hacen parte de la productividad primaria (p.e. fitoplancton y zooplancton) (Juhasz y Naidu, 2000; van der Oost et al., 2003). Respuestas fisiológicas como crecimiento, respuestas fotosintéticas, estrés oxidativo, comportamiento, entre otros han sido evaluados a diferentes niveles de letalidad con exposición a varios tipos de xenobióticos en microalgas (p.e. metales pesado, HAPs, derivados del petróleo) (Otero-Paternina et al., 2013; Polonini et al., 2015; Ramadass et al., 2017). En este estudio, la exposición crónica realizada a C. vulgaris evidenció inicialmente una disminución de la densidad celular para las concentraciones de fenantreno más elevadas, mientras que el tratamiento control presentó una tasa de crecimiento positiva. La determinación de variables como densidad celular, la tasa de crecimiento y el porcentaje de inhibición, son el primer reporte para evidenciar efectos deletéreos sobre el comportamiento del fitoplancton. La exposición a otros hidrocarburos o metales pesados como fluoranteno o el cobre ha evidenciado disminución en la densidad celular en P. tricornutum cuando las concentraciones de los xenobióticos incrementaron (Wang y Zheng, 2008; Fawaz et al., 2018), un comportamiento similar al reportado de este estudio. Con la adición de medio de cultivo en todos los tratamientos incrementó la densidad celular incremento substancialmente a las 72 horas y 120 horas, con respecto al muestreo anterior. Un crecimiento constante puede observarse en células algales que se encuentren en medios de cultivo ricos en nutrientes, a pesar de la presencia de contaminantes; Polonini et al. (2015) evidenciaron crecimiento de Chlorella vulgaris en diferentes medios de cultivo inorgánico, a pesar de la evidente toxicidad presentada por las partículas de titanato de bario. lncluso ensayos de exposición con diferentes concentraciones de petróleo evidenciaron un incremento en la biomasa seca después de siete y 14 días de estudio (Kalhor et al., 2017). A diferencia de lo reportado por Otero-Paternina et al. (2013), fue posible evidenciar que la acetona (0,05 % v/v) provocó una disminución en la tasa de crecimiento de las microalgas (Tabla 1) y la densidad celular fue inferior que la reportada por el tratamiento control.
La clorofila a es un pigmento fotosintético que funciona como indicador de biomasa y además es un parámetro bioquímicos frecuentemente utilizado para estudiar el efecto de la contaminación ambiental (Bellinger y Sigee, 2010). Una mayor concentración de un xenobiótico genera una disminución significativa en la concentración de clorofila de C. vulgaris.Carrera-Martinez et al. (2011) observaron que mientras más alta era la concentración de petróleo a la cual eran expuestas las microalgas, la concentración de la clorofila disminuyó considerablemente, similar a la exposición con fenantreno en este estudio. De igual manera, Echeveste et al. (2010) observaron en una variedad de fitoplancton marino expuesto a fenantreno como la concentración de clorofila disminuía con el incremento en la concentración de este hidrocarburo, al igual que la disminución de abundancia celular de Synechococcus. Este mismo comportamiento fue posible evidenciarlo en este estudio, la concentración de clorofila presentó un comportamiento dosis dependiente con el fenantreno. Se ha evidenciado que concentraciones altas de xenobióticos (agua de producción, HAPs o metales) suprimen el crecimiento de las microalgas por la reducción del rendimiento fotoquímico primario, deterioro en la capacidad de transporte de electrones, disminución de la actividad de liberación del centro de oxígeno y daño en la estructura y el funcionamiento del fotosistema II, lo cual conlleva a una destrucción y reducción de los pigmentos fotosintéticos (Elstner y Osswald, 1994; di Toppi et al., 2004). Calderón-Delgado et al. (2019) evidenció una disminución en la concentración de clorofila a y b de C. vulgaris expuesta a agua de producción, respuesta similar a la reportada por este estudio, lo cual puede evidenciar la presencia de fenantreno en el agua de producción.
El diámetro celular también juega un factor importante en la absorción, depuración y bioacumulación de xenobióticos en las microalgas (Echeveste et al., 2010). Predicciones dependientes del tamaño del microorganismo determinaron que las cinéticas de absorción y depuración son inversamente proporcionales al tamaño celular (Del Vento y Dachs, 2002). Por lo tanto, microorganismos más pequeños pueden tener una mayor transferencia de xenobióticos entre el agua y el microorganismo. En este estudio fue posible observar que al final de siete días de exposición el diámetro celular de C. vulgaris disminuyó significativamente con respecto al control y al inicio del experimento, esta es una posible respuesta de la adaptación de la microalga en la presencia del hidrocarburo, lo cual incrementaría la absorción y biotransformación o bioacumulación del xenobiótico. Similar respuesta fue encontrada en C. vulgaris expuesta al agua de producción, evidenciando una disminución del diámetro celular, demostrando una adaptación a los xenobióticos en el agua de producción (Calderón-Delgado et al., 2019), similar a la respuesta encontrada en este estudio como adaptación a la presencia del fenantreno en el medio.
Cuando las algas están expuestas a diferentes fuentes de estrés, la tasa de producción de especies reactivas de oxígeno (siglas en ingles ROS) aumenta significativamente, lo cual se debe a la acumulación de nicotinamida adenina dinucleótido fosfato reducida (NADPH), generando un incremento en la actividad antioxidante (Aguilera y Rautenberger, 2011). La enzima Superóxido dismutasa es la primera línea de defensa contra las ROS, debido a que cataliza y neutraliza la conversión del anión superóxido reactivo a peróxido de hidrógeno, convirtiéndola en una de las enzimas más activas (Mallick y Helmuth, 2000). A pesar de lo anterior, en este estudio fue posible evidenciar una disminución en la actividad de SOD a las 72 horas de exposición con respecto a la hora cero, incluso el tratamiento control evidenció esta disminución. Esta respuesta puede deberse a causa de una exposición lumínica constante y una alta actividad fotosintética durante el ensayo, es posible que se presente una desactivación de la clorofilas excitadas triplete (3Chl*), lo cual genera en exceso oxígeno singlete, produciendo una inhibición de los antioxidantes (enzimáticos y no enzimáticos) (Aguilera y Rautenberger, 2011); sin embargo, a las 168 horas es posible apreciar para el tratamiento control y control solvente, una estabilización de la SOD, mientras que en todos los demás tratamientos se observa un comportamiento dosis dependiente con la concentración de fenantreno, reduciendo su actividad antioxidante por efecto de la toxicidad del hidrocarburo. Lei et al. (2006) no lograron concluir que la exposición más alta de Pireno (0,1 mg. L-1) inhibiera la actividad de SOD en cuatro diferentes especies de microalgas; sin embargo, Yin et al. (2010) observaron toxicidad de fenantreno cuando expusieron Ceratophyllum demersum L. durante diez días y SOD fue inhibida gradualmente con el incremento en la concentración de fenantreno. Con este estudio, podemos afirmar que SOD respondió como un marcador de toxicidad resultante de la generación excesiva de ROS por la exposición a fenantreno.
La catalasa tiene una gran peculiaridad para degradar el peróxido de hidrógeno, ya que lo realiza sin consumir los equivalentes reductores celulares. Por tanto, esta enzima proporciona a la célula de un mecanismo eficiente energéticamente para remover el peróxido (Mallick y Helmuth, 2000); aunque hay complementos enzimáticos, como glutatión reductasa (GR) y Ascorbato peroxidasa (APX) las cuales también realiza el proceso de detoxificación para remover peróxido de hidrogeno. En este estudio fue posible observar una inhibición en la actividad de CAT para todos los tratamientos incluidos el control positivo y negativo; debido a que esta enzima no se encuentra en todos los orgánulos celulares puede existir una inhibición de la misma y al mismo tiempo otras enzimas actúan para contrarrestar el efecto ocasionados por el incremento excesivo de las ROS a causa de la exposición al hidrocarburo (Mallick y Helmuth, 2000). Además, la generación de H2O2 en los peroxisomas producto la oxidación del glicolato en la ruta fotorespiratoria podría acrecentar el problema del sistema enzimático para eliminar este compuesto. Disminución y/o inhibición de la CAT ha sido observado por Lei et al. (2006) en tres diferentes especies de microalgas cuando se expusieron a Pireno durante siete días y al mismo tiempo se observó un incremento en la actividad de GPX y GR; lo cual reafirma lo postulado anteriormente, observando que los sistemas enzimáticos son complementarios y ante la inhibición de una enzima o sistema antioxidante, se activa la respuesta celular para disminuir el número de ROS y los daños ocasionados por la exposición a algún xenobiótico.
CONCLUSION
Fue posible evidenciar una toxicidad por la exposición de fenantreno en Chlorella vulgaris donde la respuesta dosis dependiente de procesos fisiológicos (densidad celular, tasa de crecimiento, clorofi la y diámetro) con el incremento en la concentración de fenantreno, demostraron que esta especie de microalga es sensible a este xenobiótico, siendo interesante evaluar en próximos estudios las respuestas fisiológicas con HAPs de mayor grado de toxicidad. Enzimáticamente, tanto SOD como CAT no evidenciaron un incremento en su actividad, debido posiblemente a la inhibición ocasionada por la excesiva producción de ROS a causa de la exposición al hidrocarburo; sin embargo, teniendo como referencia otras investigaciones es posible que la microalga contrarreste a las especies reactivas de oxígeno por medio de otras enzimas y estabilice el estrés oxidativo ocasionado. Por tanto, en futuras investigaciones sería necesario evaluar en conjunto otros sistemas antioxidantes de tipo enzimático y no enzimático que involucren y proporcionen más información al respecto. A pesar de la toxicidad evidente observada en este estudio a causa de la exposición al hidrocarburo, la microalga C. vulgaris presenta una alta resistencia y adaptación a este contaminante. Los resultados de esta investigación permiten identificar los posibles efectos ocasionados en el ambiente por vertimientos que incluyen fenantreno en su composición, lo cual contribuye con un mayor entendimiento sobre las respuestas encontradas en estudios de monitoreo ambiental.