INTRODUCCIÓN
Juniperus flaccida Schltdl. es una especie endémica de México, pertenece a la familia Cupressaceae sección Sabina, árbol de 5 a 15 (20) m de alto, tronco de 30 a 70 (100) cm de diámetro, corteza rasgada longitudinalmente, con fibras largas que se entrelazan, de color café claro a rojizo. Se encuentra distribuido en pequeños manchones entre los bosques templados de pino y encino, o bien formando parches en zonas perturbadas por la tala en la Mixteca Alta del estado de Oaxaca (García et al., 1994; Zamudio y Carranza, 1994; Ayerde et al., 2002; Fonseca, 2006).
El estado de Oaxaca es uno de los estados más biodiversos de México (García et al., 2004), y los líquenes son un componente importante de esta diversidad (Herrera et al., 2014). Para el estado, se ha documentado la riqueza de líquenes foliícolas (Herrera y Lücking, 2003; Herrera et al., 2004; 2005) y cortícolas (Pérez y Herrera, 2004), y se han hecho estudios sobre el impacto del manejo forestal en la riqueza de macrolíquenes cortícolas (Pérez et al., 2011), así como estudios taxonómicos (Herrera et al., 2016). La mayoría de estos trabajos se han llevado a cabo principalmente en los bosques de pino y encino (Herrera et al., 2014).
Los estudios en los que se hace referencia al género Juniperus se han desarrollado en países europeos. Los autores mencionan que la importancia del estudio de la flora liquénica asociada al género Juniperus radica en que son árboles resistentes, relictos de ecosistemas antiguos e incluso en algunos paises ciertas especies son consideradas como vulnerables; no obstante han sido muy poco estudiados (Crespo y Vezda, 1985; Monsó, 1991; Gallego y Díaz, 1997; Christensen, 2000; Fos, 2000; Zedda y Sipman, 2001; Aragón et al., 2004; Cataldo y Minissale, 2015; Jüriado et al., 2015). En México se tienen pocos registros en Juniperus en bosques templados (Herrera et al., 2016). Los estudios llevados a cabo en otras latitudes indican que el género Juniperus alberga una gran riqueza liquénica, por lo que se espera que en J. flaccida la situación sea similar. De ahí el interés en documentar a la comunidad de líquenes epífitos asociados a Juniperus flaccida y analizar si la riqueza que presenta está influenciada por el diámetro altura pecho (DAP) de los forofitos seleccionados.
MATERIALES Y MÉTODOS
Área de estudio
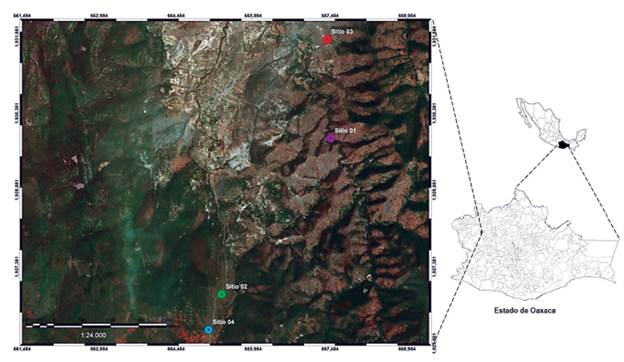
Los muestreos se realizaron en la comunidad de San Vicente Nuñú, Teposcolula, Oaxaca, México (Fig. 1), la cual tiene una superficie de 91,44 km2 (corresponde al 0,1 % del estado). Se encuentra entre las coordenadas 17°27' N y 97°27' W, a una altitud que varía de 2200 a 3200 m.s.n.m. Posee un clima templado subhúmedo con lluvias en verano, con una temperatura media anual de entre 12 °C a 18 °C y una precipitación de 800 a 1000 mm anuales. La localidad pertenece a la Provincia Sierra Madre del Sur y a las subprovincias Sierras Centrales de Oaxaca y Mixteca Alta. El tipo de vegetación corresponde a bosques de Pinus, Quercus y Pinus-Quercus (Torres, 2004; INEGI, 2010).
MUESTREO E IDENTIFICACIÓN DE LÍQUENES
Se realizaron cuatro salidas de campo, entre noviembre de 2017 a marzo de 2018. Durante el recorrido de la primer salida y debido a lo accidentado del terreno, solo fue posible muestrear en 11 forofitos de J. flaccida. Se seleccionó el mismo número de individuos en el resto de los sitios para tener el mismo tamaño de muestra (n = 44). Los forofitos quedaron dispuestos en cuatro transectos que tuvieron en promedio 1,7 km de longitud. Los forofitos se seleccionaron considerando la abundante presencia de líquenes. Se hizo un muestreo oportunista a lo largo del tronco y en las ramas bajas (Sipman, 1996). Posteriormente, a cada forofito se le midió el diámetro altura pecho (DAP). Para complementar la recolecta de la comunidad liquénica presente en los manchones de bosque de J. flaccida, se tomaron muestras de líquenes edafolícolas, saxícolas y en las ramas caídas alrededor del forofito seleccionado (Cataldo y Minissale, 2015). Las muestras se identificaron utilizando la literatura especializada, para lo cual se hizo la revisión detallada de los caracteres morfológicos y anatómicos, se hicieron pruebas de tinción (hidróxido de potasio al 10 % (KOH), hipoclorito de sodio (NaOCl) y p-felilendiamina (P)), y se observaron bajo la lámpara de luz ultravioleta de onda larga (UV 365 nm). Es importante mencionar que los talos muy pequeños o sin estructuras se identificaron a nivel de género (Sipman, 2005; Cáceres, 2007; Mongkolsuk et al., 2015; Brodo, 2016; Herrera et al., 2016). Las muestras recolectadas están depositadas en el Herbario de la Facultad de Ciencias Biológicas de la Benemérita Universidad Autónoma de Puebla.
Análisis de datos
Para agrupar y ordenar los valores de DAP de los 44 forofitos en intervalos de clases diamétricas, se aplicó la regla de Sturges, cuya expresión es K = 1 + 3,3 Logn; donde K es el número de intervalos; n es el número de datos, log es el logaritmo en base 10 (Céspedes et al., 2011). Una vez obtenidas las clases, se comparó la riqueza de especies de hongos liquenizados entre las clases diamétricas, para lo cual se utilizó la prueba de Mann-Whitney U-test (Prinzing, 1999). La riqueza de especies se estimó con la prueba no paramétrica deJackknife de primer orden (Neitlich y McCune, 1997; McCune y Grace, 2002; Córdova et al., 2016). La diversidad alfa se calculó como la riqueza de especies para cada clase; la diversidad gamma fue el número total de especies presentes en el conjunto de individuos de J. flaccida muestreados. Para analizar la diversidad de la comunidad liquénica se utilizó el índice de diversidad de Shannon-Wiener (Watteijne y Pérez-Quintero, 2009; Jost, 2010; Pérez et al., 2015); para conocer la disimilitud entre los grupos se aplicó el índice de diversidad beta de Whittaker (Bw); dependiendo de los resultados la diversidad se considera baja si < uno, moderada si < cinco y alta si > cinco (McCune y Grace, 2002). Para conocer la similitud entre las clases diamétricas de acuerdo a la composición de especies, se utilizó el análisis de conglomerados de doble vía, el cual combina las unidades de muestreo (clases diamétricas) y la presencia/ausencia de líquenes dentro de un solo diagrama; los rangos de similaridad entre los grupos va de 0 (disimilares) al 100 % (totalmente similares), teniendo como método de clasificación el coeficiente relativo de disimilitud de Sorensen; se utilizo un Beta flexible de -0,25 como algoritmo de agrupamiento (McCune y Grace, 2002; Cáceres et al., 2008; Peck, 2010). Los análisis estadísticos se llevaron a cabo con los programas PC-ORD 7,07® (McCune y Mefford, 2018) y STATISTICA 7® (StatSoft, 2004).
RESULTADOS
Los valores de DAP de los 44 forofitos de J. flaccida oscilaron entre 7,6 y 94,9 cm de diámetro. Después de aplicar la regla de Sturges se formaron siete clases diamétricas, de las cuales, las clases dos y tres fueron las que tuvieron mayor número de individuos (13 y diez respectivamente) así como la mayor riqueza liquénica (44 y 33 especies respectivamente) (Fig. 2). Las clases del cinco al siete fueron las que exhibieron el rango mayor de DAP; sin embargo, presentaron menos individuos y exhibieron menor riqueza de líquenes (Tabla 1). A pesar de estas diferencias que se observan en cuanto al DAP y la riqueza de líquenes, la prueba Mann-Whitney-Wilcoxon U-test indicó que no existieron diferencias significativas en la riqueza de líquenes considerando las diferentes clases diamétricas (U(6) = 10,99, p = 0,089, n = 44). En la Tabla 1 se puede observar que los valores más bajos del índice de diversidad de Shannon-Wiener correspondieron a las clases uno, cuatro y siete, que fueron las que presentaron menor número de forofitos; no obstante los valores que corresponden a la equitatividad para todas las clases fueron cercanos a uno, lo que indica que la mayoría de las especies presentes en las diferentes clases diamétricas de J. flaccida poseyeron una cantidad similar de individuos.
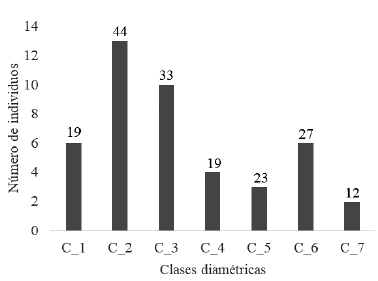
Figura 2 Número de individuos de Juniperus flaccida distribuidos en las diferentes clases diamétricas. Los números arriba de las barras indican el número de líquenes encontrados en cada clase.
Tabla 1 Clases diamétricas de los forofitos de Juniperus flaccida obtenidos después de aplicar la Regla de Sturges, en donde se indica el número de individuos, el promedio de DAP y los valores de diversidad de la comunidad liquénica presente.
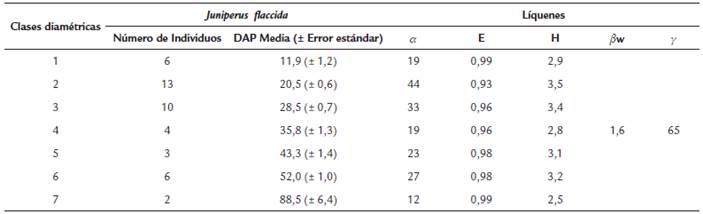
α = riqueza de especies en cada grupo
E = Equitatividad H / In (Riqueza)
H = Indice de diversidad de Shannon-Wiener
βw= Indice de diversidad beta de Whittaker
y = Diversidad gamma
Tabla 2 Flora liquénica presente en Juniperus flaccida, así como en todos los sustratos disponibles alrededor de los forofitos seleccionados en San Vicente Nuñú, Teposcolula, Oaxaca, México. Los nombres en negritas corresponden a los nuevos registros para el estado (+) y para el país (++).
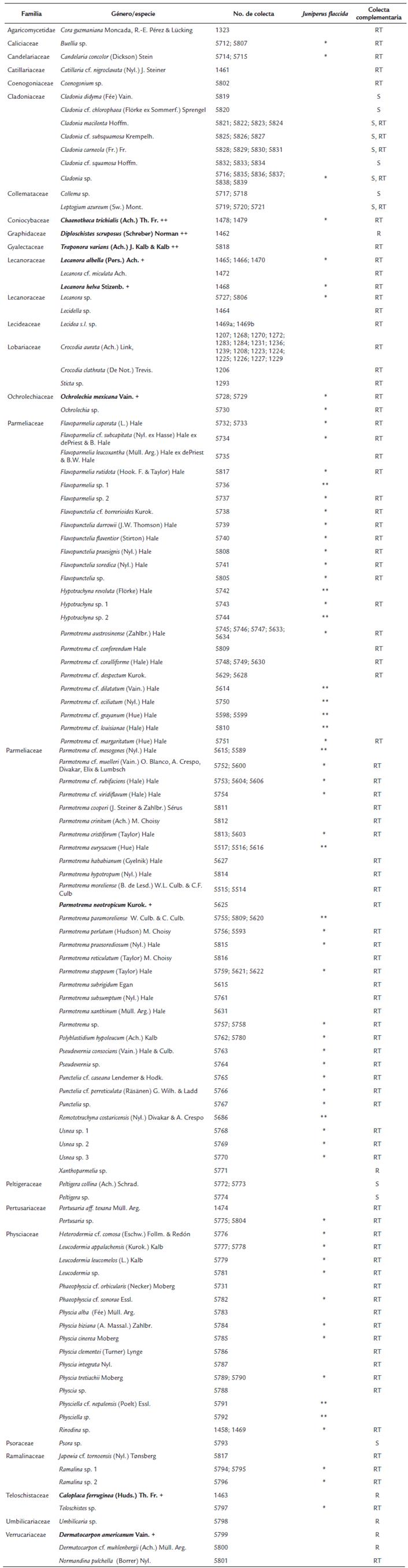
* Especies colectadas en J. flaccida y en la colecta complementaria
** Especies colectadas únicamente en J. flaccida
RT = Ramas Tiradas
S = Suelo
R = Roca
+ Nuevos registros para Oaxaca
++ Nuevos registros para México
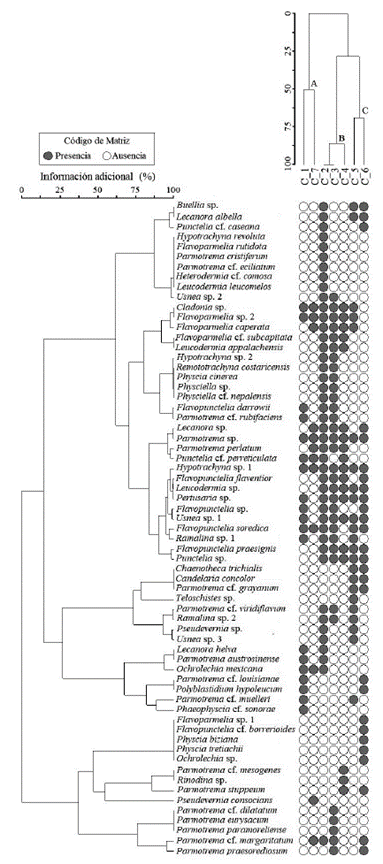
En la tabla 2, se enlista a la comunidad líquenica de San Vicente Nuñú, Teposcolula, Oaxaca, México; se indican cuáles fueron los líquenes recolectados en J. flaccida y cuáles estuvieron alrededor de los forofitos seleccionados, lo que permite visualizar qué especies se encontraron en ambas colectas. La prueba de Jackknife de primer orden estimó que la comunidad liquénica asociada a J. flaccida podría ser de 81 especies; no obstante, las especies recolectadas fueron 65 (80 %). Es importante hacer notar que de éstas, 52 especies estuvieron presentes en la colecta adicional y 13 especies solo se encontraron en J. flaccida (p. ej. Hypotrachyna revoluta, Parmotrema cf. dilatatum, Parmotrema eurysacum, Remototrachyna costaricensis, Physciella cf. nepalensis). El índice de diversidad beta de Whittaker arrojó un valor de 1,6; de acuerdo con la escala (Bw < 5), se puede considerar que el recambio de especies entre las clases diamétricas es de moderado a bajo, es decir, que la composición de especies entre las diferentes clases es muy similiar. La similitud que tienen las clases se puede observar con más detalle en la Fig. 3, en la que se enlistan las especies asociadas a J. flaccida y se muestra la distribución de los líquenes en las diferentes clases diamétricas. En el dendrograma se pueden observar tres clados principales: en el clado A (clase 1 y 7) la similitud fue del 50 %, el clado B (clase 2-3 y 4) presentó una similitud aproximada del 80 % y el clado C (Clase 5 y 6) tuvo una similitud aproximada del 70 %, esto dado por el alto número de especies compartidas. De las 65 especies, solo 19 (29 %) no fueron compartidas entre las diferentes clases. Por otro lado, considerando a las especies recolectadas alrededor de los forofitos seleccionados, se tuvo un total de 101 especies, de las cuales 52 se compartieron con J. flaccida. Las familias con el mayor número de especies, tanto en J. flaccida como en la colecta complementaria, fueron Parmeliaceae (41 y 45 especies) y Physciaceae (11 y 14 especies respectivamente).
DISCUSIÓN
Sin duda, la riqueza de especies en un forofito es algo complejo que esta influenciado por factores a diferentes escalas, como puede ser la historia del manejo del bosque (Ellis y Coppins, 2009), así como de una serie de condiciones complejas e interrelacionadas que incluyen desde las propiedades del sustrato y las características del entorno hasta aspectos biogeográficos (Gallego y Díaz, 1997; Christensen, 2000; Aragón et al., 2004; Galloway, 2008; Jüriado et al., 2015). De aquí que los resultados de este estudio difieran con los obtenidos en los trabajos que se han llevado a cabo en Europa, ya que se está hablando de áreas geográficas y condiciones de bosque diferentes.
Después de haber recopilado el nombre de las especies reportadas para España, Estonia, Italia y Grecia (Crespo y Vezda, 1985; Monsó, 1991; Gallego y Díaz, 1997; Christensen, 2000; Fos, 2000; Zedda y Sipman, 2001; Aragón et al., 2004; Cataldo y Minissale, 2015; Jüriado et al., 2015) se tiene un listado de aproximadamente 250 especies en 65 géneros. Considerando las 65 especies reportadas en este estudio, solo se presentan tres especies en común: Candelaria concolor (Dicks.) Arnold, Flavoparmelia caperata (L.) Hale y Physcia biziana (A. Massal.) Zahlbr.). Esto varía cuando se hace la revisión a nivel de género, ya que se comparten 14 ( Buellia, Candelaria, Chaenotheca, Cladonia, Flavoparmelia, Lecanora, Ochrolechia, Pertusaria, Physcia, Phaeophyscia, Pseudevernia, Ramalina, Rinodina y Usnea), lo cual no es raro si se considera que algunos de ellos pertenecen a las familias Parmeliaceae y Physciaceae, que son consideradas cosmopolitas (Galloway, 2008).
Una de las características distintivas de J. flaccida es su corteza rasgada longitudinalmente, con fibras largas que se entrelazan (Zamudio y Carranza, 1994), por lo que se podría pensar que esto es un factor limitante para el establecimiento de los líquenes; sin embargo, Monsó (1991) indica que este tipo de corteza permite el asentamiento de diversas especies de líquenes, lo cual coincide con los resultados obtenidos en este estudio. Por otro lado, Jüriado et al. (2015) mencionan que la comunidad liquénica se incrementa cuando aumenta la altura y el diámetro de los forofitos; los resultados obtenidos en este estudio difieren en parte con esto, dado que no se encontraron diferencias significativas en la riqueza liquénica entre los grupos de DAP. Sin embargo, es importante considerar que los forofitos de J. flaccida se encuentra dispersos y en pequeños parches, resultado de la extracción local (García et al., 1994), por lo que no es raro que los árboles con clases diamétricas pequeñas (ver Tabla 1) sean los más abundantes.
Diversos autores coinciden en la diversidad liquénica del género Juniperus; no obstante su importancia, dicha diversidad ha sido muy poco estudiada (Christensen, 2000; Zedda y Sipman, 2001; Aragón et al., 2004; Jüriado et al., 2015). En México, este es el primer reporte que se hace sobre la flora liquénica deJ. flaccida. Los resultados indican que se tienen 65 especies en nueve familias y 23 géneros. De las 13 especies previamente reportadas en México asociadas al género Juniperus (Herrera et al., 2016), solo seis se recolectaron en este estudio, lo que indica que se tienen 59 nuevos registros asociados a J. flaccida. Ahora bien, si se consideran las siete especies que no se encontraron en este sitio (Hypotrachyna horrescens (Taylor) Krog & Swinscow, H. rockii (Zahlbr.) Hale, Parmotrema cetratum (Ach.) Hale, P. reticulatum (Taylor) M. Choisy, P. subrigidum Egan, P. subtinctorium (Zahlbr.) Hale y Usnea rubicunda (Stirt.)), la comunidad liquénica asociada a forofitos del géneroJuniperus aumenta a 72 especies. Al igual que Cataldo y Minissale (2015), aquí también se tiene un registro adicional de especies, en este caso de las que estuvieron alrededor de los forofitos seleccionados y en todos los sustratos disponibles. Algunas de ellas bien podrían haber estado en los forofitos de estudio, lo que sugiere que la comunidad liquénica de J. flaccida puede ser aún mayor.
Herrera et al. (2014) reportan que de las 5000 especies de líquenes que probablemente existan en México, se tienen registradas 2722 especies, de las cuales 440 se han reportado para el estado de Oaxaca. Con este estudio se hace una pequeña contribución al conocimiento de la flora liquénica del país, al reportar seis nuevos registros para Oaxaca: Caloplaca ferruginea (Huds.) Th. Fr., Dermatocarpon americanum Vain., Lecanora albella (Pers.) Ach., Lecanora helva Stizenb., Ochrolechia mexicana Vain. y Parmotrema neotropicum Kurok. y tres nuevos registros para México: Diploschistes scruposus (Schreber) Norman, Traponora varians (Ach.) J. Kalb & Kalb y Chaenotheca trichialis (Ach.) Hellb.
CONCLUSIONES
El estudio de la flora liquénica epífita en Juniperus flaccida permitió el registro de 65 especies recolectadas en 44 forofitos con diferentes valores de diámetro altura pecho (DAP). No obstante a que J. flaccida está distribuido en pequeños manchones y a exhibir diferentes DAPs, la flora liquénica asociada a este forofito parece ser mayor a lo reportado, sobre todo considerando el número de especies encontradas alrededor de los forofitos seleccionados, por lo que bien vale la pena ampliar el muestreo a otras zonas de bosque, sobre todo considerando que de las especies muestreadas tanto en los forofitos como en su entorno, 59 fueron nuevos registros para J. flaccida, seis nuevos registros para Oaxaca y tres para México.