INTRODUCCIÓN
La temperatura es un factor ambiental clave en la biología de los organismos ectotermos, como los reptiles, anfibios, peces y la mayoría de los invertebrados, debido a su baja capacidad de producir calor de manera interna (Bennett y Dawson, 1976). Así, estos organismos dependen de fuentes externas de calor, de adaptaciones morfofisiológicas y de estrategias conductuales para mantener constante su temperatura corporal y dentro de los niveles térmicos óptimos para realizar sus actividades y procesos fisiológicos (Huey y Slatkin, 1976). La regulación de la temperatura implica procesos fisiológicos complejos que involucran la detección térmica del medio ambiente y el procesamiento de esta información; aquí el complejo pineal es fundamental en el ritmo de termorregulación de los reptiles y opera directamente en la sincronización de procesos fisiológicos con respecto a la luminosidad ambiental (Firth y Turner, 1982). Posterior a la termorrecepción y al procesamiento de las señales térmicas dentro del sistema nervioso central, la temperatura corporal es controlada conductualmente (e.g., posturas, ángulo de orientación, altura de percha) y depende de múltiples factores extrínsecos (e.g., oferta térmica y complejidad del hábitat) e intrínsecos (e.g., requerimientos térmicos y tolerancia al calor) (Bennett y Dawson, 1976; Firth y Turner, 1982; Huey, 1982).
Así, la termorregulación de los reptiles es producto de una compleja red de variables espacio-temporales, las cuales proporcionan costos y beneficios (Huey y Slatkin, 1976). Por esta razón, una estrategia conductual de termorregulación adecuada les permite aprovechar la energía calorífica disponible para tener un mejor rendimiento y realizar los procesos y actividades biológicas vitales tales como la alimentación, el crecimiento, la reproducción, el desempeño locomotor y el escape de depredadores, siendo determinantes en la supervivencia (Díaz de la Vega-Pérez et al., 2014). Actualmente, existe una vasta literatura sobre el comportamiento termorregulador de reptiles y se ha documentado que ante ambientes térmicamente adversos o desfavorables este comportamiento juega un papel importante para compensar las temperaturas extremas (Cowles y Bogert, 1944; Avery, 1982; Gans y Pough, 1982). Por ejemplo, una estrategia en reptiles diurnos es refugiarse en los momentos más desfavorables del día (por competencia, depredación, para termorregulación, etc.) y posteriormente ampliar su período de actividad hacia el crepúsculo o la noche para mantener su balance energético (Huey, 1982).
Recientemente, ha habido muchos trabajos, principalmente notas aisladas de historia natural, que documentan conductas nocturnas o crepusculares en especies catalogadas como exclusivamente diurnas (e.g., Klauber, 1939; Williams, 1959; Mays y Nickerson, 1968; Adest et al., 1988; Levy et al., 2019). Esta estrategia puede tener implicaciones ecofisiológicas importantes en los intervalos de temperaturas óptimas de actividad, umbrales de tolerancia térmica, periodo de actividad, hipotermia voluntaria, catemeralidad y ante cambios climáticos extremos. Además, el potencial de actividad nocturna de muchas especies diurnas es poco conocido. Por lo anterior, los objetivos de este trabajo son: 1) revisar los eventos de actividad nocturna en reptiles considerados exclusivamente diurnos; 2) discutir las implicaciones ecofisiológicas sobre este tópico; 3) identificar los aspectos que aún no han sido abordados a profundidad; y 4) proponer posibles direcciones para futuras líneas de investigación.
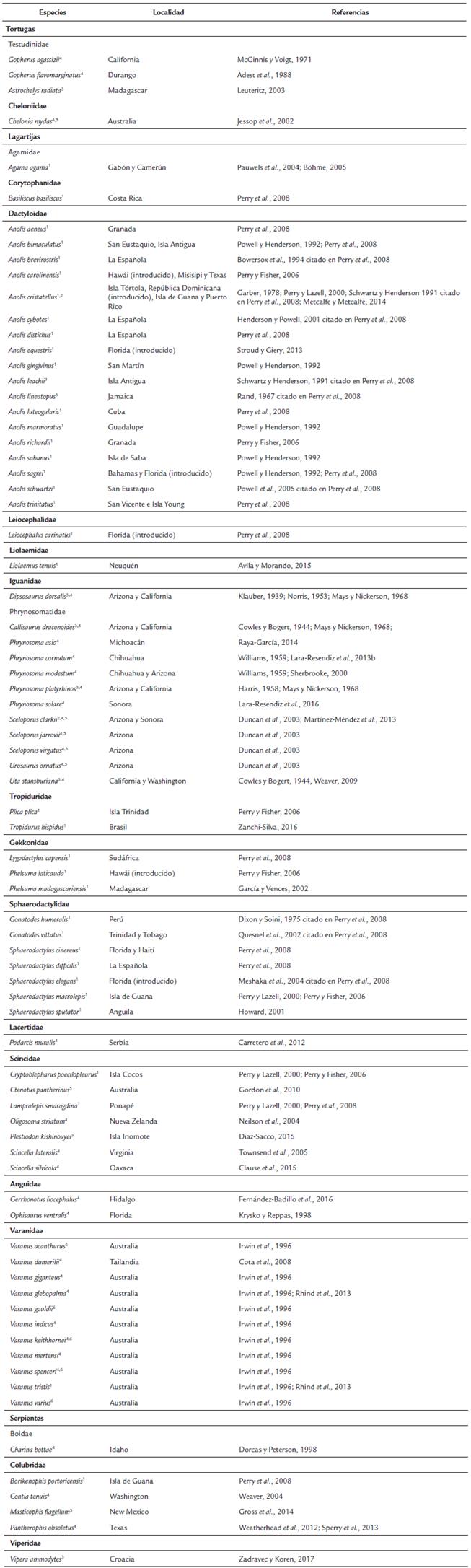
Para esta revisión se realizó una búsqueda bibliográfica en Web of Science para las publicaciones que documentaron la actividad nocturna en especies diurnas de reptiles. Las palabras de búsqueda fueron: crepuscular-nocturnal-activity-behavior-reptile y sus variantes en español. También se realizó una búsqueda en Google Scholar. Asimismo, se incluyeron estudios que se encontraron en el proceso de contacto con autores y lectura de otros artículos. Todas las especies y publicaciones están incluidas en la tabla 1.
ACTIVIDAD NOCTURNA EN ESPECIES CATALOGADAS COMO DIURNAS
La actividad nocturna en reptiles diurnos ha sido documentada en medio silvestre (Klauber, 1939), bajo condiciones de laboratorio (Regal, 1967), indirectamente por la evidencia de depredación por aves rapaces nocturnas (Duncan et al., 2003), debido a iluminación artificial (Perry y Fisher, 2006) y también ha sido ampliamente documentada en carreteras durante la noche (Trombulak y Frissell, 2000). Varios autores sugieren que la herpetofauna diurna se siente atraída por sitios térmicamente óptimos durante la noche para elevar la temperatura corporal durante los períodos más fríos, ocupándolas como "islas" o parches de calor (Mays y Nickerson, 1968; Ruben, 1976; Dodd et al., 1989) ya que una temperatura corporal nocturna más elevada puede promover y aumentar la eficiencia de procesos fisiológicos críticos (e.g., digestión; Harlow et al., 1976).
Muchos autores han reportado un gran número de avistamientos anecdóticos sobre conductas nocturnas en reptiles considerados exclusivamente diurnos (Tabla 1). Estas observaciones han sido principalmente en lagartijas de los géneros Agama (Pauwels et al., 2004; Bóhme, 2005), Anolis (Garber, 1978; Powell y Henderson, 1992; Perry y Lazell, 2000; Perry y Fisher, 2006; Perry et al., 2008; Stroud y Giery, 2013; Metcalfe y Metcalfe, 2014), Callisaurus (Mays y Nickerson, 1968), Ctenotus (Gordon et al., 2010), Dipsosaurus (Klauber, 1939; Norris, 1953; Mays y Nickerson, 1968), Gerrhonotus (Fernández-Badillo et al., 2016), Liolaemus (Avila y Morando, 2015), Ophisaurus (Krysko y Reppas, 1998), Phrynosoma (Harris, 1958; Williams, 1959; Mays y Nickerson, 1968; Sherbrooke, 2000; Lara-Resendiz et al., 2013b; Raya-García, 2014; Lara-Resendiz et al., 2016), Oligosoma (Neilson et al., 2004), Plestiodon (Diaz-Sacco, 2015) , Podareis (Carretero et al., 2012), Sceloporus (Duncan et al., 2003; Martínez-Méndez et al., 2013), Scincella (Townsend et al., 2005; Clause et al., 2015), Tropidurus (Zanchi-Silva, 2016) , Varanus (Rhind et al., 2013) y Uta (Weaver, 2009). También se ha documentado en serpientes de los géneros Charina (Dorcas y Peterson, 1998), Contia (Weaver, 2004), Masticophis (Gross et al., 2014), Pantherophis (Sperry et al., 2013) y Vipera (Zadravec y Koren, 2017). Asimismo, en tortugas de los géneros Gopherus (McGinnis y Voigt, 1971; Adest et al., 1988), Geochelone (Leuteritz, 2003) y tortugas marinas como Chelonia (Jessop et al., 2002). Del mismo modo, Perry y Fisher (2006) proveen una lista de las especies de reptiles considerados diurnos que utilizan lugares con iluminación artificial nocturna, en la que destacan algunas especies de los géneros de lagartijas Anolis, Agama, Basiliscus, Cryptoblepharus, Gonatodes, Lamprolepis, Leiocephalus, Lygodactylus, Phelsuma, Sphaerodactylus, Tropidurus y la serpiente Borikenophis (ver también Perry et al., 2008, incluido en este trabajo). También la actividad nocturna de reptiles "diurnos" se ha registrado indirectamente, por medio de evidencias del comportamiento alimentario de aves rapaces nocturnas (Ligon, 1968). Por ejemplo, Duncan et al. (2003) documentaron que dos especies de búhos nocturnos (Otus trichopsis y Glaucidium gnoma) se alimentan de lagartijas consideradas diurnas como Sceloporus jarrovi, S. clarki, S. virgatus y Urosaurus ornatus. En estos estudios, ninguna lagartija Aspidoscelis fue capturada u observada en la noche, por lo que es probable que este género no presente actividad nocturna ocasional.
Es importante destacar que el tema abordado en la presente revisión también ha sido discutido en otros vertebrados terrestres como anfibios (Andreone, 2002; Hilje, 2010; Gómez-Hoyos et al., 2018), aves (Ward et al., 2014) y mamíferos (Donati et al., 2013). En el caso particular de los anfibios, existen grupos taxonómicos considerados principalmente como diurnos; tal es el caso del género Atelopus, del cual se ha documentado el comportamiento nocturno como inusual en A. nahumae, A. laetissimus y A. varius. Incluso A. nocturnus ha sido nombrada en referencia a su marcada actividad nocturna (Bravo-Valencia y Rivera-Correa, 2011; Gómez-Hoyos et al., 2018).
HÁBITO DIURNO/NOCTURNO Y SUS REQUERIMIENTOS TÉRMICOS
Los reptiles habitan una amplia variedad de ambientes térmicos que incluyen sitios tropicales, desiertos, hábitats fríos y lugares altamente estacionales en altas latitudes o elevaciones, y es probable que esta variación en el ambiente térmico cause parte de la variación en su periodo de actividad (Avery, 1982). Se ha demostrado que los reptiles tienen complejas estrategias fisiológicas y conductuales (Bennett y Dawson, 1976; Firth y Turner, 1982) y su periodo de actividad puede variar dependiendo de factores extrínsecos asociados a las características ambientales y geográficas (e.g., latitud, altitud) o a factores intrínsecos (e.g., requerimientos y límites térmicos) (Huey y Slatkin, 1976; Avery, 1982; Huey, 1982). De hecho, la modificación del tiempo y del periodo de actividad son de los principales mecanismos conductuales que utilizan los reptiles para termorregular y mantener su metabolismo a tasas óptimas para diferentes funciones fisiológicas, como la digestión, la reproducción y la locomoción (Bennett y Dawson, 1976). En muchos casos puede ser difícil establecer los límites entre el periodo de actividad o inactividad, ya que se sabe que algunas especies se involucran oportunamente en condiciones ambientales subóptimas y los requerimientos térmicos pueden variar a diferentes niveles, incluso poblacionalmente (Huey, 1982; Catenazzi et al., 2005).
La ubicación geográfica y la variabilidad térmica del ambiente, así como los requerimientos térmicos propios de las especies, mantienen una relación con el periodo de actividad. Por ejemplo, las especies tropicales son consideradas termo-especialistas, con capacidades limitadas de aclimatación y habitan sitios con temperaturas homogéneas y relativamente constantes, mientras que las especies que habitan en sitios de mayores latitudes son generalistas térmicos, ya que han evolucionado en sitios térmicamente heterogéneos (Tewksbury et al., 2008). Es por esto por lo que, basados en su amplitud de requerimientos térmicos, los ectotermos se pueden clasificar estrictamente en estenotermos o euritermos. Los estenotermos o especialistas térmicos son los organismos que están adaptados a vivir en un margen estrecho de temperaturas, mientras que los euritermos o generalistas térmicos son aquellos que tienen la capacidad de vivir en un amplio margen de temperaturas. Acorde con lo anterior, en esta sección se exploran las implicaciones de dos variables principales para extender o ampliar el periodo de actividad, en primer lugar, la ubicación latitudinal geográfica (tropical/altas latitudes), y en segundo lugar, el intervalo de requerimientos térmicos (estenotermo y euritermo).
Muchos reptiles tropicales y subtropicales son considerados estenotermos, ya que viven debajo del dosel dentro de bosques ampliamente sombreados, donde las temperaturas son relativamente bajas y homogéneas, lo que dificulta la termorregulación activa (Huey y Slatkin, 1976). De hecho, las lagartijas del bosque tropical rara vez se asolean, están activas a temperaturas corporales relativamente bajas y explotan la temperatura del aire por medio de la convección y tienen una estrategia de termorregulación pasiva o termoconformista (Huey et al., 2009). Además, Tewksbury et al. (2008) sugieren que las especies tropicales que viven en climas estacionales estables tienen tolerancias térmicas estrechas y que están más cerca de sus óptimos fisiológicos en comparación con las especies euritermas que habitan en latitudes altas o ambientes altamente variables, como desiertos o altas elevaciones.
Por otro lado, los reptiles que están activos durante el día tienden a exhibir temperaturas corporales relativamente altas y constantes durante el periodo de actividad, mientras que los taxones nocturnos muestran temperaturas más bajas y variables, es decir, tendencia hacia la euritermia (Llewelyn et al., 2005). En este caso particular, las especies nocturnas pueden termorregular indirectamente durante la "inactividad" (Lara-Resendiz et al., 2013a). En este sentido, Avery (1982) propone que las actividades y procesos fisiológicos podrían tener temperaturas óptimas distintas en la fotofase (día) y escotofase (noche); esta hipótesis es apoyada por la existencia de un ritmo circadiano en la selección de temperatura en ectotermos nocturnos (Refinetti y Susalka, 1997) y por estudios sobre biología térmica (Lara-Resendiz et al., 2013a). La selección de diferentes temperaturas ambientales durante cada fase tiene implicaciones ecofisiológicas y evolutivas en los reptiles nocturnos (Autumn et al., 1994), los cuales son fisiológicamente activos durante el día, ya que presentan conductas termorreguladoras seleccionando sitios de refugio con una mayor temperatura ambiental y adoptando posturas especiales con respecto a la temperatura dentro del refugio. De esta manera, las lagartijas nocturnas consiguen alcanzar altas temperaturas corporales permitiendo la máxima eficiencia de los procesos de digestión, reproducción y crecimiento (Bustard, 1967; Dial, 1978; Autumn y De Nardo, 1995; Cruz et al., 2004; Aguilar y Cruz, 2010).
Por el contrario, en el caso de las especies consideradas heliotérmicas, y que por consiguiente serían exclusivamente diurnas, se ha demostrado que la actividad nocturna oportunista se asocia con condiciones ecológicas y/o fisiológicas adecuadas durante la noche, como un alto nivel de humedad, menor riesgo de depredación y mayor disponibilidad de presas (Neilson et al., 2004; Gordon et al., 2010). Así, la capacidad de usar la termorregulación conductual, en este caso cambiando a la estrategia tigmotérmica, a escala fina (es decir, el uso selectivo de hábitats y microclimas), puede lograr resultados similares en un gradiente latitudinal y climático tan amplio como sea posible gracias a las grandes diferencias en el momento de la actividad. Por ejemplo, Weatherhead et al. (2012) encontraron que la culebra Pantherophis obsoletus cambia de actividad diurna a nocturna durante el verano, mientras que, a mayores latitudes, la actividad máxima de la serpiente es exclusivamente diurna durante todo el verano (ver también Sperry et al., 2013). Asimismo, Dorcas y Peterson (1998) encontraron evidencias de que el bóido Charina bottae puede estar ocasionalmente activo durante la noche, incluso cuando las temperaturas son subóptimas, para sincronizar su actividad con las presas, o alternativamente, para reducir su propio riesgo de depredación al evitar a los depredadores diurnos.
Con base en esto, las especies estenotérmicas que ocupan hábitats estables podrían tener menor oportunidad térmica para aumentar o extender el tiempo de forrajeo hacia el crepúsculo o la escotofase. Al contrario, una especie euritérmica de ambientes heterogéneos térmicamente podría tener mayores oportunidades de extender su periodo de actividad debido a su capacidad de estar activa en un intervalo amplio de temperaturas corporales. Sin embargo, esta hipótesis aún no ha sido estudiada a profundidad, aunque destacan estudios comparativos a nivel poblacional (Huey y Webster, 1975; Catenazzi et al., 2005). Por ejemplo, en el caso de S. clarkii, las temperaturas ambientales altas durante el día (hasta 43 °C) proveen, a escala de microhábitat, temperaturas altas del aire y sustratos suficientes para mantener su temperatura corporal en el rango de actividad, por lo menos hasta la medianoche (Martínez-Méndez et al., 2013); así, el medio ambiente térmico puede poner a su alcance temperaturas adecuadas para la actividad. Lo mismo ocurre en otras especies de phrynosomátidos de ambientes desérticos cuando la temperatura microambiental se mantiene ~40 °C (Lara-Resendiz et al., 2014; Lara-Resendiz et al., 2015).
Otro ejemplo, en el caso contrario, es el de la familia Xantusiidae; los tres géneros Cricosaura, Lepidophyma y Xantusia son considerados nocturnos y comprenden en conjunto al menos 35 especies que exhiben patrones de actividad nocturna. La actividad diurna ha sido documentada regularmente para ciertas poblaciones que son consideradas como usualmente nocturnas (Van Denburg, 1919; Lee, 1974; Grismer, 2002; Arenas-Moreno et al., 2018). Incluso, Regal (1967) y Arenas-Moreno et al. (2018) sugieren que los xantúsidos termorregulan activamente durante el día, pero no es evidente debido a sus hábitos. Lo anterior sugiere que estos organismos, al igual que los gecos nocturnos como Phyllodactylus o Coleonyx, ocupan las partes más cálidas o soleadas de una grieta o refugio para absorber parte de la radiación solar durante el día (Brattstrom, 1965; Lara-Resendiz et al., 2013a). De acuerdo con los experimentos de Lee (1974), estos organismos funcionan en un sistema dual, ya que la temperatura y el fotoperiodo son importantes en el control de la actividad; por lo tanto, a medida que la temperatura y el fotoperiodo se desvían dentro del ciclo de 24 horas, el periodo de actividad se vuelve bimodal, pero cuando coinciden las temperaturas altas y los períodos de iluminación tenue se produce la actividad máxima. En este caso, este comportamiento podría tener connotaciones estacionales importantes; por ejemplo, Xantusia henshawi opta por una conducta diurna durante el invierno (Mautz y Case, 1974; Grismer, 2002). Además, se han reportado que las agregaciones facultativas de Xantusia vigilis en el invierno tienen beneficios térmicos y reproductivos (Rabosky et al., 2012).
CATEMERALIDAD, FACTORES AMBIENTALES E HIPOTERMIA VOLUNTARIA
Es claro que la clasificación tradicional de diurno y nocturno es insuficiente para describir los patrones de actividad de los organismos (Hill, 2006). La definición de catemeral fue acuñada por Tattersall (1987) para describir especies que exhiben cantidades significativas de actividad durante las dos fases dentro del ciclo de 24 horas. Como estrategia de comportamiento, se piensa que la catemeralidad confiere considerables ventajas al permitir que los animales extiendan la actividad de manera flexible hacia la fase diurna o nocturna en respuesta a las condiciones ecológicas prevalecientes. Factores como la temperatura, el acceso a las fuentes de alimento y la minimización del riesgo de depredación se consideran importantes para promover la catemeralidad (Hill, 2006). Un número importante de reptiles regularmente explotan tanto el nicho diurno como el nocturno (e.g. Lepidophyma flavimaculatum y L. smithii,Arenas-Moreno et al., 2018, Phyllopezus pollicaris,Diele-Viegas et al., 2018).
La actividad nocturna en especies diurnas, como se mencionó arriba, está relacionada positivamente con las temperaturas diurnas y nocturnas, pero también con la humedad (Neilson etal., 2004; Gordon etal., 2010). Además, se ha discutido que las noches con luna o los patrones lunares también podrían influenciar el periodo nocturno de actividad, ya que incrementan la visibilidad (Perry y Fisher, 2006; Lillywhite y Brischoux, 2012; Zadravec y Koren, 2017). Sin embargo, en otras especies no existe una correlación entre el periodo lunar y la actividad nocturna (e.g., Pantherophis;Sperry et al., 2013). Esto sugiere que, para el comportamiento nocturno, la temperatura puede ser más importante que la detección visual nocturna de presas o la evasión de depredadores. En el caso particular de las serpientes que se mantienen mayormente activas en noches oscuras, éstas pueden reducir su riesgo de depredación por búhos o grandes mamíferos (Klauber, 1939).
Con respecto a la iluminación, los patrones de actividad pueden ser alterados por la presencia de luz de origen antropogénico, conocida también como contaminación lumínica (Perry y Fisher, 2006). De acuerdo con la revisión de Perry y Fisher (2006), la luz artificial puede promover la actividad nocturna en reptiles diurnos y esto puede tener repercusiones considerables. En efecto, la luz artificial puede favorecer la disponibilidad de alimento, ya que muchos invertebrados incrementan considerablemente su actividad y los reptiles toman ventaja para aumentar o extender sus oportunidades de forrajeo. Sin embargo, esta luz puede aumentar la competencia o el riesgo de depredación por otros reptiles, mamíferos o aves rapaces de hábitos nocturnos. Además, ha sido bien documentado que esta contaminación lumínica debida a la urbanización puede causar el decline de especies nocturnas sensibles como las serpientes (e.g. Rhinocheilus lecontei,Perry y Fisher, 2006) y las tortugas marinas (Salmon, 2005).
Las temperaturas ambientales subóptimas durante la noche impiden la actividad de muchas especies de ectotermos, ya que en ese momento la temperatura corporal podría estar cerca o por debajo del límite térmico inferior para la actividad; cuando esto sucede muchos reptiles se refugian inmediatamente antes de que el hábitat se vuelva térmicamente desfavorable. No obstante, según Huey (1982), algunos reptiles pasan la noche afuera de sus madrigueras para prolongar el tiempo potencial de actividad y seleccionar activa y voluntariamente una temperatura corporal baja (i.e., hipotermia voluntaria). Se ha sugerido que esta estrategia puede ser una respuesta alternativa para los individuos que no obtuvieron suficiente alimento durante el día, es decir, para extender el tiempo de forrajeo incluso a la mañana siguiente (McGinnis y Voigt, 1971); también puede ser una alternativa para los organismos que no se alimentaron recientemente para conservar energía (Huey, 1982); de igual forma, para propiciar alguna actividad biológica fundamental (e.g., apareamiento). En este último caso, las especies diurnas pueden aumentar la posibilidad de cópula o de aumentar el número de ellas durante el crepúsculo o el anochecer (Lara-Resendiz et al., 2013b), o incluso favorecer la excavación de nidos y la oviposición (Sherbrooke, 2000).
IMPLICACIONES ANTE EL CAMBIO CLIMÁTICO GLOBAL
El cambio climático global y las alteraciones del nicho térmico ejercen presiones selectivas y afectan las poblaciones naturales en varios grupos de reptiles (Winter et al., 2016). Los reptiles, al igual que otros ectotermos, dependen directamente de la calidad térmica del hábitat y de la plasticidad conductual para mantener su temperatura corporal dentro de los niveles óptimos, pero en ambientes cambiantes con altas temperaturas se incrementa el riesgo de sobrecalentamiento, se acorta el periodo de actividad diurna, se fuerza a la inactividad y en consecuencia se eleva drásticamente su vulnerabilidad poblacional (Lara-Resendiz et al., 2014; Lara-Resendiz et al., 2015). Estudios previos han documentado que los reptiles son sensibles a la modificación de su nicho térmico debido a las horas de restricción o inactividad forzada, ya que la ganancia energética neta llega a ser insuficiente para realizar sus procesos fisiológicos (Dunham, 1993; Huey et al., 2010). Por ejemplo, se ha observado que el periodo de actividad diurna de la lagartija Sceloporus serrifer en la Península de Yucatán está limitado debido a que las temperaturas ambientales son extremadamente altas durante la época de reproducción (Sinervo et al., 2010; Sinervo et al., 2011).
En este punto es importante destacar que la vulnerabilidad de los reptiles frente al cambio climático difiere dependiendo de su adaptabilidad y sensibilidad. Es decir, el nivel de afectación será diferencial debido a que tienen diversas estrategias de reproducción, amplitud de distribución, historia de vida y patrones de termorregulación complejos. Sin embargo, si el ambiente térmico donde habitan es homogéneo, las poblaciones pueden responder por plasticidad fisiológicas o adaptación evolutiva, pero si el ambiente térmico es heterogéneo, entonces las especies pueden regular su temperatura corporal conductualmente. Por consiguiente, en estos últimos las estrategias termorreguladoras (e.g. euritermia, tigmotermia, actividad crepuscular, hipotermia voluntaria, patrones de actividad oportunistas) son fundamentales para equilibrar la temperatura corporal y prevenir la extinción. Por esta razón, las investigaciones apuntan a que las especies tropicales son más susceptibles ante el cambio climático que las especies de latitudes más altas, debido a que los ectotermos tropicales actualmente están mucho más cerca de las temperaturas que exceden sus niveles térmicos óptimos (Tewksbury et al., 2008; Huey et al., 2009), mientras que las especies que habitan en sitios de mayores latitudes son generalistas térmicos, han evolucionado en sitios térmicamente heterogéneos y son más tolerantes a las temperaturas altas (Tewksbury et al., 2008).
En definitiva, la actividad nocturna oportunista podría ser una respuesta conductual adaptativa ante el incremento de temperatura, ya que permitiría ampliar el periodo de actividad para completar sus actividades biológicas cotidianas en estaciones particulares y térmicamente propicias del año, hacia la colonización de nuevas latitudes o altitudes favorables. Incluso, como se mencionó arriba, las poblaciones que actualmente exhiben algún comportamiento nocturno incrementan sus oportunidades ecológicas (mayor alimentación y menor competencia y depredación). Gordon etal. (2010) afirman que la disponibilidad del alimento y el menor riesgo de depredación en la noche favorecen la actividad nocturna oportunista de la lagartija de desierto Ctenotuspantherinus y esto, en consecuencia, podría contribuir a determinar el tamaño de su distribución geográfica.
PROPUESTAS Y ESTUDIOS FUTUROS
Hasta el momento, se ha documentado que la actividad nocturna en reptiles diurnos tiene implicaciones biológicas destacadas, sin embargo, aún son necesarios estudios futuros a nivel fisiológico y ecológico. Por un lado, la tasa metabólica y las preferencias térmicas son excelentes variables fisiológicas para explorar los factores que promueven la actividad nocturna en especies diurnas, por lo que se requiere probar si difieren durante la fase de actividad y de "inactividad" (Mautz, 1979; Autumn et al., 1999; Gordon et al., 2010; Lara-Resendiz et al., 2013a). Las respuestas térmicas y metabólicas durante la fotofase y escotofase podrían desarrollarse bajo un enfoque de curva de desempeño. De igual manera, resulta fundamental explorar detalladamente el nicho térmico (e.g. modelos operativos nulos) con un enfoque estacional para documentar bajo qué características ocurren los cambios estacionales en la actividad de diurno a nocturno, por ejemplo, monitorear la temperatura durante las seis horas posteriores a la puesta de sol durante el verano con respecto a los requerimientos térmicos de las especies.
Por otro lado, los organismos poco conspicuos como los géneros Anniella, Bipes (fosoriales) o Xenosaurus (saxícola) son considerados diurnos (Papenfuss, 1982; Ballinger et al., 1995; Grismer, 2002), a pesar de que se desconoce ampliamente el inicio y duración del periodo de actividad. Por esta razón, los métodos y tecnología para rastrear los movimientos de estos organismos (e.g. PIT-tags) permitirían monitorear la actividad de los individuos en su ambiente subterráneo o saxícola sin recapturarlos (MacGregor y Reinert, 2001, para un estudio de telemetría ver también Sperry et al., 2013), posiblemente con menos sesgos para detectar los picos de actividad o movimientos nocturnos a través del ciclo 24 horas, a lo largo del año, entre estaciones o a diferentes profundidades en relación con la temperatura. En el caso de otras especies diurnas en las que se ha documentado el comportamiento nocturno, estas técnicas son excelentes herramientas para explorar los factores que promueven la actividad nocturna.
Por otro lado, es importante incrementar los estudios sobre la relación de la masa corporal y la tasa de intercambio de calor (Herczeg et al., 2007), ya que pueden proporcionar evidencias de la importancia de la retención de calor en periodos fríos para permitir la actividad nocturna durante varias horas después del atardecer. Asimismo, la detección de presas usando una combinación de señales olfativas, auditivas y visuales, medida en experimentos durante el forrajeo nocturno, ofrecerá información concluyente sobre los costos y beneficios de la actividad nocturna con visión limitada (Cooper et al., 1998; MacGregor y Reinert, 2001). Además, resultan necesarios los estudios sobre depredación por medio de modelos para cuantificar cuándo la depredación es mayor o menor en el ciclo de 24 horas y poner a prueba si las noches son menos peligrosas y si la depredación afecta considerablemente su densidad poblacional (Duncan et al., 2003; Gordon et al., 2010; Díaz de la Vega-Pérez et al., 2014).
Finalmente, frente al cambio climático dos respuestas naturales compensatorias son posibles: por un lado, las especies pueden migrar en busca de ambientes térmicamente favorables, o por otro lado, pueden adaptarse a los nuevos ambientes por plasticidad fisiológica o conductual. En este campo, los modelos de distribución de especies han sido una herramienta para proyectar los efectos (extirpación, contracción, expansión) ante el cambio climático (Sinervo et al., 2010). Sin embargo, la no consideración de los cambios en los rasgos fisiológicos y conductuales pueden provocar que los modelos sobreestimen los impactos del cambio climático (Lara-Resendiz et al., 2015). En este sentido, las ventajas fisiológicas y ecológicas de la actividad nocturna en especies diurnas, así como otras conductas termorreguladoras, pueden ser importantes para las especies ante el calentamiento global (Lara-Resendiz et al., 2015; Levy et al., 2019), ya que se ha documentado que la flexibilidad del comportamiento y la modificación de los periodos de actividad podrían servir como una respuesta mecánica para minimizar el riesgo de sobrecalentamiento durante el forrajeo diurno (Kearney et al., 2009; Ortega et al., 2016; Kirchhof et al., 2017; Huey et al., 2018).
En conclusión, varias especies de reptiles pueden estar activas tanto de día como de noche y también cambiar su periodo de actividad en respuesta a la presencia de competidores, depredadores, condición nutricional o factores ambientales como temperatura, humedad o intensidad de luz. Los beneficios de la actividad diurna oportunista pueden incluir la ganancia de recursos, el acceso a parejas y las cópulas o interacciones sociales en general; también la evasión de la competencia y de la depredación, que pueden tener importantes consecuencias para la adecuación. En este caso, se necesitan estudios adicionales para documentar el comportamiento activo durante la noche desde las perspectivas fisiológica, biofísica, ecológica y adaptativa, particularmente en especies o poblaciones donde se ha documentado dicha actividad nocturna. Esto ayudará a determinar la frecuencia de la actividad nocturna oportunista y en qué especies es más común, y a comprender los factores ambientales que la favorecen y los alcances ante ambientes cambiantes.