INTRODUCCIÓN
Debido a la complejidad y dificultad de entender en muchas ocasiones las enfermedades de una manera integral, buscando estrategias de control y prevención efectivas y eficientes, surge una tendencia que busca analizar el problema como un todo y no de manera puntual o causal. Como resultado de esto se desarrolló el concepto de "One Health" (Una Salud) como una estrategia que se basa en una mirada interdisciplinaria haciendo énfasis en la relación que existe entre la salud humana, la animal y el ambiente. El enfoque de Una Salud fue reconocido por primera vez por la Asociación Americana de Medicina Veterinaria en 2007 (Bailey et al., 2018), siendo adoptado y reconocido actualmente como indispensable para implementar acciones efectivas que respondan a las diversas amenazas que representa el virus de influenza. De igual manera, esta aproximación ha sido de gran relevancia en los últimos años con referencia a enfermedades zoonóticas ocasionadas por agentes virales, incluyendo West Nile, Nipah, Hendra, Ébola, Zika y Fiebre Amarilla, entre otras (Short et al., 2015; Rabinowitz et al., 2018). Con respecto a la influenza, a pesar de que en 2018 se conmemoró un siglo de la primera pandemia ocasionada por este virus, la cual tuvo un gran impacto en salud y ocasionó pérdidas económicas y desafíos en cuanto a la capacidad de respuesta, la disponibilidad de infraestructura hospitalaria y de laboratorios de diagnóstico especializado, y en cuyo estudio se ha invertido gran cantidad de recursos tanto de tipo económico como de potencial humano, aún se mantienen múltiples interrogantes que hasta el momento permanecen sin resolver (Nunn, 2018). Dichos interrogantes involucran desde la ubicación exacta en cuanto al origen geográfico del virus que ocasionó esta pandemia, acerca del cual aún se tienen algunas incógnitas, hasta aspectos relacionados con el agente causal, un virus de influenza A del subtipo H1N1 de origen aviar. Se postula que probablemente resultó de una mutación, cuyas características llevaron a la aparición de la primera pandemia, con la existencia desde ese momento de huéspedes diferentes al humano. Se desconoce sin embargo el papel que tuvieron factores ecológicos, ambientales y de otros tipos en la generación o mantenimiento de la infección por virus de influenza, lo cual aún representa un reto para la comunidad científica.
Otro aspecto interesante, relacionado con la edad del huésped y con diferencias en la susceptibilidad o severidad como resultado de la infección por virus de influenza, fueron las mayores tasa de mortalidad y de afección a jóvenes adultos entre los 20 y 40 años principalmente, lo cual se puede relacionar con un estatus de susceptibilidad inmunológica a consecuencia de la ausencia de una respuesta de memoria al ser ocasionada por un virus con características nuevas (Humphreys, 2018). Así mismo, aparentemente hubo una mayor susceptibilidad a morir como resultado de infecciones bacterianas secundarias que se presentaron en algunos pacientes, particularmente de áreas rurales, lo cual señala la posible participación de factores socioeconómicos en la diseminación de la infección. Estos eventos ponen de manifiesto la complejidad de la infección por virus de influenza y la participación de factores derivados del huésped y del ambiente como determinantes clave del resultado y magnitud de la infección.
ASPECTOS GENERALES DEL VIRUS DE INFLUENZA CON RELEVANCIA PARA EL TEMA
La influenza es ocasionada por el virus de Influenza tipo A (IAV) o Alfainfluenzavirus, perteneciente a la familia Orthomyxoviridae, la cual incluye también los géneros Betainfluenzavirus, Gammainfluenzavirus y Deltainfluenzavirus (Hause et al., 2014). Dentro de los cuatro tipos de "Influenzavirus" existentes, el IAV es el de mayor importancia desde el punto de vista de su manejo y entendimiento dentro del concepto de Una Salud. Lo anterior teniendo en cuenta la capacidad de ocasionar infección en multiplicidad de hospedadores, incluyendo mamíferos y aves, su presencia en otras clases de animales como reptiles y anfibios (Mancini et al., 2004; Temple et al., 2015), las dinámicas de transmisión zoonótica bidireccional (Anfixenosis), una alta capacidad de presentar rearreglos en su genoma, así como una elevada tasa de mutación (Sobel Leonard et al., 2017; Lyons y Lauring, 2018). Todo esto influenciado además por efecto del cambio climático y por factores socioeconómicos asociados en las poblaciones afectadas por la generación de las principales pandemias de los últimos siglos (Rabinowitz et al., 2018; Snyder y Ravi, 2018; Nickol y Kindrachuk, 2019).
En cuanto al virus de IAV, su genoma está constituido por ocho segmentos de RNA de cadena sencilla y polaridad negativa (-ssRNA), los cuales se identifican como: PB2, PB1, PA, HA, NP, NA, M y NS (Fig. 1). En la actualidad estas ocho secuencias génicas codifican para un total de 19 proteínas (Yamayoshi et al., 2016).
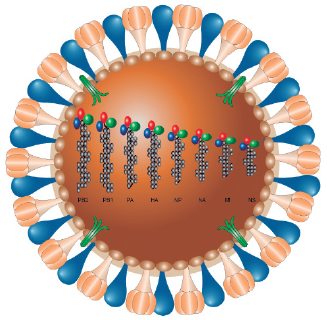
Figura 1 Representación esquemática del virus de influenza A (IAV). Se muestra la organización del genoma RNA de ocho segmentos: PB2: Polimerasa básica 2; PB1: Polimerasa básica 1; PA: Polimerasa ácida; HA: Hemaglutinina; NP: Nucleoproteína; NA: Neuraminidasa; M: Proteína de matriz; NS: Proteína no estructural.
El tipo de ácido nucleico y el carácter segmentado del genoma de los virus de influenza le confieren características de variabilidad, lo que resultan en algunos cambios de manera natural relacionados con procesos de evolución viral. Sin embargo, otros cambios mayores pueden dar como resultado la aparición de IAV con características nuevas. Dependiendo del cambio que sufra el genoma, se pueden afectar determinantes antigénicos que ocasionan disminución o ausencia de efectividad de la respuesta inmune de memoria presente en el huésped afectado o modificaciones a la respuesta desencadenada como resultado de un proceso de inmunización a través del uso de vacunas. Bajo determinadas circunstancias los cambios pueden llevar incluso a una ampliación en el rango de huéspedes susceptibles (Root et al., 2015). Es así como dentro de los subtipos de IAV que infectan a las aves acuáticas, que de manera natural poseen características de virus de baja patogenicidad (LPAIV), se encuentran algunos virus, principalmente de los subtipos H5, H7 y H9, que tienen la capacidad de transmitirse de aves silvestres acuáticas a aves domésticas (Galliformes). Estos subtipos a su vez pueden mutar y cambiar su carácter de baja patogenicidad, convirtiéndose en formas virulentas de alta patogenicidad (HPAIV) que ocasionan una infección generalizada de rápida diseminación, con altas tasas de mortalidad en las unidades productivas de aves comerciales afectadas (Pantin-Jackwood et al., 2017). En consecuencia, no solo hay un riesgo mayor para las poblaciones de aves sino que incluso es posible la transmisión a otros huéspedes, incluido el humano.
EL VIRUS DE INFLUENZA EN EL CONTEXTO HISTÓRICO, COMO CAUSANTE DE PANDEMIAS Y EPIDEMIAS.
El virus de la Influenza tipo A (IAV) es un agente infeccioso de carácter principalmente respiratorio, que puede afectar tanto poblaciones humanas como animales. En el caso del humano, la influenza se presenta tradicionalmente en forma epidémica, asociada a cuadros respiratorios y exacerbada por condiciones climáticas adversas. La organización mundial de la salud (WHO) estima 1 billón de infecciones humanas, 3-5 millones de cuadros clínicos severos y de 300 000 a 500 000 muertes como resultado de las epidemias anuales generadas por IAV. Adicionalmente, a consecuencia del increíble potencial de diseminación del virus, éste ha ocasionado las principales pandemias de los últimos siglos (Snyder y Ravi, 2018; Nickol y Kindrachuk, 2019). Es así como a inicios el siglo XX, en 1918, ocurrió la primera y más grande pandemia generada por este agente viral, que dejó como resultado más de 40 millones de personas muertas; le siguieron posteriormente la pandemia asiática en 1957 y la de Hong Kong en 1968. En el siglo XXI se presentó la pandemia ocasionada por un virus de influenza de origen porcino en el 2009 (Christman et al., 2011), que representó un evento muy importante por las características y composición particular del virus causante, cuyo genoma incluye segmentos génicos provenientes de virus de influenza de origen humano, de cerdos y de aves. Esto demostró el potencial pandémico y adaptativo que tienen los virus de influenza, corroborando así su capacidad recombinante y su alta variabilidad antigénica (Taubenberger y Morens, 2010).
En poblaciones animales el impacto de la infección por IAV involucra, además de las alteraciones en la salud de los animales, consecuencias económicas relacionadas con los efectos negativos en los parámetros productivos de las especies comerciales, principalmente de aves y cerdos, además de aquellas resultantes de las restricciones al comercio internacional de productos o subproductos procedentes de países en los que la infección está presente. En la producción avícola de una nación los efectos generados por un brote de influenza aviar pueden ser de gran trascendencia socioeconómica y epidemiológica y pueden poner en riesgo la oferta de una fuente importante de proteina animal para consumo humano. Se afecta no solo el rendimiento productivo neto de huevos o de carne proveniente de diferentes especies comerciales como consecuencia de las alteraciones orgánicas o de la tasa de mortalidad, sino también hay riesgo de cierre de las fronteras comerciales (importación / exportación), lo que desencadena considerables pérdidas económicas. En países tropicales con condiciones agroecológicas similares a las de Colombia se ha demostrado el fuerte impacto ocasionado por los brotes de influenza aviar de alta patogenicidad (HPAI), tanto sicosocial como en la salud pública y en la economía nacional, con pérdidas de hasta USD 2,2 billones anuales (Fasanmi et al., 2018). Igualmente, en Estados Unidos se han reportado pérdidas de 50 millones de pollos y pavos, lo que constituye el 12 % de la población nacional de aves de postura y el 8 % de los pavos para carne (Ramos et al., 2017). A pesar de esto, en términos generales se desconoce la magnitud y el efecto real, desde el punto de vista económico, que tiene la infección por virus de influenza al considerar el impacto negativo que ejerce en los parámetros productivos y aquellos costos relacionados con las infecciones concomitantes.
Una situación similar se observa en la industria porcícola, donde en países latinoamericanos como México el impacto de la más reciente pandemia de IAV en el 2009 generó pérdidas económicas, disminuyó la producción nacional considerablemente y generó un déficit comercial de carne de cerdo de 27 millones de USD (Rassy y Smith, 2013).
De la misma manera, para la población humana el virus de influenza A de diferentes orígenes es un patógeno que tiene un impacto económico importante, representado en las pérdidas asociadas a incapacidad médica, costos de tratamientos e infecciones concomitantes, además de las implicaciones sanitarias, como la transmisibilidad zoonótica, que ha generado múltiples casos respiratorios en humanos (Mostafa et al., 2018). Un ejemplo de esto es lo reportado recientemente en China, país desarrollado con un sistema de vigilancia epidemiológica tanto pasiva como activa, donde se presentaron tan solo entre diciembre del 2016 y enero del 2017, 918 casos confirmados de IAV de origen aviar del subtipo H7N9 en humanos, con un total de 359 muertes (WHO, 2017).
Si se mira la infección por IAV como un todo en un contexto general, teniendo en cuenta su potencial zoonótico y antropo-zoonótico, los cambios constantes del virus, el amplio rango de huéspedes susceptibles, el efecto del cambio climático en la eco-biología del virus y las interacciones virus-huésped, así como la amenaza pandémica potencial que representa, es evidente que se requiere un análisis desde el punto de vista de Una Salud, que involucre factores relacionados tanto con el medio ambiente como con su comportamiento y distribución en poblaciones humanas y animales, para que con base en esta perspectiva se generen políticas efectivas de manejo, control y prevención.
INFLUENZA EN DIFERENTES ESPECIES
Una característica relevante del influenzavirus A es su continua evolución y adaptación a nuevas y diversas especies, lo cual representa un problema y constituye un reto mayor. Las aves acuáticas en particular se consideran los principales reservorios de todos los virus de influenza para otras especies de aves y mamíferos. A su vez, los entornos que favorecen el mantenimiento de IAV incluyen, además de las aves, cerdos, perros (Bowman et al., 2012), caballos (Xie et al., 2016) y, más recientemente, murciélagos (Tong et al., 2012) (Fig. 2). Igualmente, se dispone de evidencia de que aquellos ambientes que facilitan la interacción de humanos y especies de aves, tales como los mercados de aves vivas, a menudo incrementan el riesgo de transmisión hacia los humanos. La WHO reportó por primera vez en febrero de 2018 la detección de un IAV aviar (H7N4) en un paciente con antecedentes de contacto directo con aves vivas, lo que generó una alerta por considerar este evento como un riesgo con potencial pandémico. De manera similar, se ha encontrado evidencia de la transmisión, en este caso bidireccional, de IAV en la interfase del humano y poblaciones porcinas, principalmente en ferias agrícolas como resultado de la exposición de animales clínicamente sanos a virus de origen humano (Bowman et al., 2012; Gray et al., 2012).
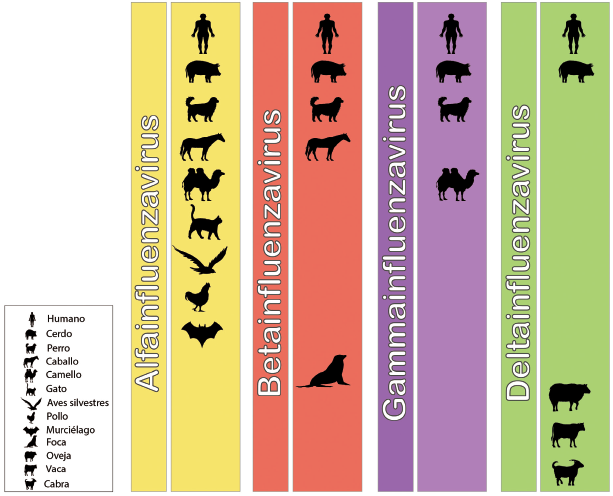
Figura 2 Diversidad de hospedadores susceptibles para los cuatro tipos de Influenzavirus. Compilado de hospedadores susceptibles a los géneros Alfainfluenzavirus (Naranja), Betainfluenzavirus (Rojo), Gammainfluenzavirus (Morado) y Deltainfluenzavirus (Verde).
Un aspecto fundamental a considerar en la interacción virus-huésped para IAV se relaciona con la distribución y conformación de receptores de ácido siálico en las células del tracto respiratorio, lo cual determinará una predilección por la unión a receptores de ácido siálico del tipo alfa 2,3 neuramínico en el caso de virus de influenza aviar, mientras que los virus de influenza humana y de otros mamíferos muestran una predilección de unión a receptores del tipo alfa 2,6 neuramínico (Kimble etal., 2010). Aunque tradicionalmente se asignaba al cerdo la capacidad de actuar como vaso mezclador de virus de influenza de origen aviar y humano por poseer receptores de ambos tipos en su tracto respiratorio, actualmente se sabe que también algunas especies de aves presentan características similares, lo que las convirte en fuentes potenciales para la generación de virus con características nuevas. Es por esta y otras razones por lo que se deben valorar de una manera global e interdisciplinaria los aspectos relacionados con las características biológicas y moleculares de los virus de influenza, los factores concernientes a su ecología y epidemiología, así como aquellos referidos a los diferentes huéspedes y su papel en el ciclo de infección por virus de influenza.
Otro componente determinante en la relación virus-huésped para los influenzavirus A es la participación que tienen las dos proteínas de superficie, la hemaglutinina (HA) y la neuraminidasa (NA), las cuales además de ser los mayores determinantes antigénicos son responsables primarios de la interacción virus-hospedador y por tanto desempeñan un papel importante en la restricción del rango de huéspedes susceptibles a la infección por IAV. Al ser un patógeno zoonótico cuyo reservorio natural son las aves acuáticas silvestres, gracias a los múltiples estudios y ampliación en el conocimiento de los virus de influenza, actualmente se sabe que 16 subtipos de HA y nueve subtipos de NA circulan dentro de ecosistemas en los cuales las aves silvestres desempeñan un papel preponderante. Gracias a esto y a la posibilidad que representa un total de 144 posibles combinaciones diferentes entre estos subtipos, debido a su alto potencial de recombinación in situ y a las más de 10 000 especies de aves encontradas en casi todos los hábitats acuáticos y terrestres, el virus de influenza se constituye en un patógeno importante de distribución mundial que requiere la participación de profesionales de las ciencias biológicas y médicas para entender y afrontar los retos que el virus representa para las poblaciones humanas y animales. Debe tenerse en cuenta que los virus de influenza se mantienen en aves silvestres, muchas de las cuales migran moviéndose en el hemisferio norte desde el ártico al trópico y viceversa; durante estos recorridos, las aves se congregan e interactúan y esto propicia un intercambio de virus de influenza y favorece la diseminación fecal-oral a través de aguas y suelos contaminados. Esto hace posible la infección de aves domésticas y mamíferos incluyendo murciélagos, caballos, cerdos y humanos (Humphreys, 2018), lo cual denota su importancia epidemiológica, dado que hay pocos lugares en la tierra en donde no se encuentren aves y por ende IAV con potencial transmisión a poblaciones humanas y de otros animales.
Aunque este artículo de reflexión se centra en el influenzavirus A, no se puede pasar por alto la importancia que desde el punto de vista Una Salud tienen los influenzavirus tipo B, C y D, particularmente en lo relacionado con el rango de huéspedes susceptibles y el papel de diferentes especies domésticas y silvestres como reservorios de estos virus de influenza. En el caso del virus de influenza B, aunque asociado principalmente con infección en humanos, se ha reportado también en cerdos, los cuales se convirtieron en un reservorio natural (Ran et al., 2015); así mismo se han detectado anticuerpos en caballos y perros. Se ha demostrado además que un virus de influenza B de origen humano fue el causante de mortalidad en focas en Holanda en 1999 (Osterhaus et al., 2000). En cuanto al virus de influenza tipo C, cuyo principal reservorio son los humanos, vale la pena mencionar que los cerdos y perros salvajes también pueden infectarse y actuar como reservorios. La demostración reciente de la presencia de anticuerpos contra virus de influenza C en camellos en Kenia (Salem et al., 2017), sugiere que existe un mayor espectro de reservorios para otros tipos de virus de influenza diferentes al tipo A. Se amerita entonces una mirada y un planteamiento para su seguimiento a nivel de poblaciones animales y del ambiente en el marco de Una Salud. Finalmente, en 2011 se aisló un virus de influenza tipo D en cerdos, el cual mostró homología con el virus de influenza C humano, se establecio y presentó una mayor prevalencia en bovinos que sufren enfermedad respiratoria (Hause et al., 2014; Ferguson et al., 2016); se encontró además presencia de anticuerpos contra este tipo de virus en cerdos, bovinos, cabras y ovejas.
Existe multiplicidad de hospedadores silvestres para los influenzavirus tipo A (IAV), incluyendo diferentes clases de mamíferos terrestres y acuáticos, reptiles, anfibios y diversas especies de aves como sus reservorios naturales. La presencia de IAV en mamíferos marinos, tanto pinnípedos como cetáceos, no se ha reportado tan frecuentemente en la literatura como los IAV aviares, porcinos o humanos, pero la afectación de pinnípedos se ha evidenciado con la detección de reactividad serológica frente al subtipo H10N7 en la foca común (Phoca vitulina Linnaeus, 1758) y en la foca gris (Halichoerusgrypus Fabricius, 1791), con individuos afectados en las costas de Alemania, Suecia, Dinamarca y los Países Bajos (Bodewes et al., 2015). Estos hallazgos indican que, a pesar de la baja mortalidad, la infección de IAV en focas podría tener una amplia distribución geográfica. Los reportes de presencia de IAV en pinnípedos suramericanos se limita a lobos marinos (Arctocephalus australis Zimmermann, 1783) en costas de Uruguay, los cuales resultaron reactivos serológicamente al subtipo H1N1 (Blanc et al., 2009). También se ha reportado la presencia de IAV en diversas especies de los cetáceos, con el aislamiento de 14 IAV en ballenas aparentemente sanas de la familia Balaenopteridae en Rusia y la detección de los subtipos H13N2 y H13N9 en muestras de ballenas piloto (Globicephala macrorhynchus Gray, 1846) enfermas en costas de Eastham y Wellfleet, Massachusetts, US (Hinshaw et al., 1986) e IAV en la marsopa de Dall (Phocoenoides dalli True, 1885) y en la ballena enana (Balaenoptera acutorostrata Lacépéde, 1804) en áreas costeras de Japón (Ohishi et al., 2006). En pinnípedos se registran a la fecha los subtipos H7N7, H4N5, H4N6 y H3N3 relacionados con IAV aviares y en cetáceos se reportan los subtipos H1N3, H13N2 y H13N9, estrechamente relacionados también con IAV circulantes en gaviotas (Fereidouni et al., 2014).
A pesar de la diversidad de fauna acuática y semiacuática que posee Colombia, con 31 especies registradas del Orden Cetácea, dos del Orden Sinrenia y siete del Orden Carnívora (Familias Mustelidae, Otariidae y Phocidae), a la fecha no se ha determinado la presencia o ausencia de IAV en ninguna de estas especies en las costas Caribe ni Pacífica del territorio nacional colombiano.
En cuanto a la susceptibilidad a la infección o exposición al IAV en mamíferos terrestres silvestres, también se ha verificado el aislamiento posmortem del subtipo aviar H5N1 en muestras de pulmón de tigres (Panthera tigris Linnaeus, 1758) y leopardos (Panthera pardus Linnaeus, 1758) en la colección zoológica de Suphan Buri, Tailandia (Keawcharoen y Oraveerakul, 2004) y el aislamiento del subtipo H1N1 en descargas nasales de osos hormigueros gigantes (Myrmecophaga tridactyla Linnaeus, 1758) del zoológico de Nashville, Tennessee, Estados Unidos (Nofs et al., 2009).
INFLUENZA EN EL CONTEXTO NACIONAL
A pesar de la gran cantidad de información disponible a nivel mundial con respecto al IAV y los múltiples estudios que buscan entender al virus de influenza, el panorama en Latino América y particularmente en Colombia es preocupante en lo que respecta a estudios sobre la relación virus-huésped, los mecanismos relacionados con diferencias en patogenicidad, el rango de huéspedes susceptibles y la búsqueda de una vacuna universal que ayudaría a prevenir o controlar los efectos devastadores de las infecciones epidémicas, así como sobre mecanismos para una acción pronta ante la aparición de nuevos virus con potencial pandémico. La información disponible es escasa y hay un desconocimiento de los orígenes y características de los virus circulantes en poblaciones de cerdos y de humanos.
En cuanto al IAV en cerdos, se conoce la existencia de reactividad serológica desde finales de años 70s, cuando se reportó una tasa de positividad entre el 14 % y el 34 % en algunas regiones del país, lo que se corroboró posteriormente, demostrándose reactividad a los subtipos clásicos H1N1 y H3N2 en cerdos (Mogollon et al., 2003). Más recientemente, durante 2008 y 2009, además de detectar nuevamente la reactividad serológica para virus de los tipos H3N2 y H1N1 en tres regiones del país (Antioquia, área Occidental y zona Central), se reportó el aislamiento por primera vez de virus de influenza en cerdos en Colombia, tanto del tipo H1N1 clásico como del tipo pandémico del 2009 (Ramirez-Nieto et al., 2012). Estudios posteriores demostraron que el virus del tipo H1N1pdm2009 se estableció y continúa circulando de manera endémica en las poblaciones de cerdos. De manera similar, se sabe de la circulación de este virus en la población humana, pero se desconoce si existen nuevas combinaciones producto de rearreglos entre los IAV circulantes previamente y el virus pandémico del 2009, como se ha reportado en otras partes del mundo. Por otra parte, aunque tradicionalmente se consideraba que existía un riesgo de transmisión de virus de influenza del cerdo hacia el humano, actualmente se sabe que el riesgo es bidireccional, ya que también ocurre transmisión de virus de influenza del humano hacia el cerdo (Nelson et al., 2014). Por tanto, dada la existencia de virus de influenza circulando en las poblaciones de cerdos y de humanos en Colombia, tal situación plantea interrogantes adicionales que es necesario resolver.
Con respecto al virus de influenza en aves, Colombia se declara libre de la presencia de virus de alta patogenicidad (HPAIV), no obstante la detección de virus de influenza aviar de baja patogenicidad (Karlsson et al., 2013). La ubicación geográfica del país atravesado por diferentes rutas de aves migratorias, la riqueza en biodiversidad, los sistemas de producción animal y su estrecha interacción con el humano, constituyen factores de riesgo que es necesario analizar y afrontar involucrando a los diferentes actores bajo el concepto de Una Salud. A lo anterior se debe añadir que se han obtenido resultados preliminares que indican la presencia de Orthomyxovirus en murciélagos del territorio nacional (Uribe-Soto, 2018), lo cual enciende una alerta en el sentido de que existe la necesidad sentida y urgente de realizar estudios inter y transdisciplinarios que conduzcan a un conocimiento real del virus de influenza y de su situación en el país.
INFLUENZA Y FACTORES AMBIENTALES
Es importante considerar el papel que desempeña el ser humano por el efecto que sus diferentes acciones tienen en el equilibrio del ecosistema, como la deforestación, el incremento de la contaminación y el cambio climático, lo cual resulta en la amenaza o extinción de especies de plantas y animales, brotes de enfermedades zoonóticas e impactos sobre la salud, el bienestar y la sostenibilidad de diferentes especies, incluido el humano (Rabinowitz et al., 2018).
Una de las causas del incremento en el número y frecuencia de eventos de enfermedades zoonóticas está directamente relacionada con la forma desacertada como el ser humano hace uso de la tierra y de las poblaciones de animales domésticos y silvestres, lo cual continuará ocurriendo a menos que se tomen medidas al respecto. No hay soluciones sencillas y es necesario trazar estrategias que garanticen la coexistencia de animales y humanos. Se hace necesario identificar alertas a través de cambios en poblaciones animales o eventos de salud en los mismos que puedan reflejar la presencia de riesgos para la salud humana y ambiental, así como afrontar aspectos relacionados con la conservación de las especies silvestres y su papel en la sociedad.
La actual existencia de cepas resistentes a antimicrobianos es uno de los mayores retos que enfrenta la salud humana y animal. Un aspecto importante que no puede pasar desapercibido es la aparición de cepas de IAV de origen aviar que han desarrollado resistencia a antivirales y circulan naturalmente en el medio (Järhult, 2018). Teniendo en cuenta la estrecha relación de especies de aves como reservorios del IAV y su relación con los humanos, y antes de disponer de una vacuna efectiva para inmunización masiva, es fundamental disponer de antivirales que puedan utilizarse como primera línea de acción en caso de presentarse una nueva pandemia o de la aparición de nuevos virus. Hasta el momento, los inhibidores de neuraminidasa constituyen los principales medicamentos utilizados contra el IAV, pero existe el riesgo potencial de que los patos (reservorios naturales) puedan estar expuestos a residuos de estos antivirales en su ambiente acuático natural. Lo anterior se basa en evidencia demostrada de la presencia de inhibidores de neuraminidasas en agua de ríos, en las que se han detectado concentraciones de hasta 865 ng/L de Carboxilato de Oseltamivir y 59 ng/L de Zanamivir (Takanami et al., 2010; Takanami et al., 2012). Aunque los niveles más altos se han encontrado en Japón, también se han detectado residuos en agua de ríos de Europa y se desconoce la situación en otras partes del mundo. Teniendo en cuenta lo anterior, el uso apropiado y responsable de antivirales por parte de los médicos y profesionales del área de la salud y su participación como actores fundamentales dentro del manejo desde la perspectiva de Una Salud para afrontar los retos de la infección por IAV, constituyen factores fundamentales. Estos deben acompañarse de una política de regulación de venta de antivirales unicamente bajo prescripción médica. En este contexto, cobra relevancia la participación de los sistemas de salud locales, las autoridades sanitarias y los profesionales de las áreas de ciencias sociales, salud pública, veterinaria y epidemiología. Igualmente, los expertos en comunicación en salud deben contribuir a difundir conceptos que permitan la apropiación y el entendimiento por parte de la comunidad en general.
Puesto que la transmisión de IAV es posible a través de fómites en condiciones de alta concentración del virus, la permanencia y viabilidad de IAV en el medio ambiente a partir de cualquier tipo de hospedero, en diferentes superficies y materiales, es un punto importante a tener en cuenta en la eco-epidemiología viral. Este es un punto crítico para el control y prevención en explotaciones comerciales de animales, en mercados y ferias y en hospitales y lugares de alta densidad poblacional humana y animal, donde puede haber detonantes potenciales de brotes, epidemias o pandemias generadas por IAV medioambiental (Sooryanarain y Elankumaran, 2015). Otros estudios han demostrado viabilidad del IAV en superficies de acero inoxidable hasta por dos semanas, en algodón y microfibra por una semana, y la posibilidad de detección de IAV medioambiental mediante PCR por más de seis semanas (Thompson y Bennett, 2017). Estos hallazgos son de vital importancia al momento de establecer protocolos de control, regímenes de limpieza y métodos de muestreo efectivos para IAV.
CONCLUSIONES
La influenza es un ejemplo claro de un problema que requiere una aproximación desde la prespectiva de Una Salud, lo cual implica tener una visión global antes que local, buscando la salud, bienestar, sostenibilidad y equilibrio entre los seres humanos, los animales y el medio ambiente. Con la participación de múltiples entidades y organizaciones a nivel mundial y la mayor aceptación del concepto de Una Salud, esta aproximación requiere involucrar de una manera más directa a expertos en áreas relacionadas no solo con la salud y el medio ambiente, si no también en ecología, ciencias sociales, biología, economía, epidemiología, política pública y gobernanza, entre otras. En este contexto, Colombia cuenta con un Programa Nacional para la prevención, manejo y control de la infección respiratoria aguda en humanos, respaldado por el Ministerio de Salud y Protección Social; en este programa se hace énfasis particular a la influenza y los esfuerzos se dirigen primordialmente a la población colombiana. Por su parte, el Instituto Colombiano Agropecuario (ICA) encargado de la sanidad animal, desarrolla el proyecto de prevención y control de la influenza aviar, lo que ha permitido autodeclarar al país como libre de influenza aviar, pero reconociendo la existencia de virus de influenza en cerdos. Se requiere entonces una articulación entre estas instituciones y los demás organismos responsables del manejo de la salud humana y animal con el fin de visualizar en un contexto real el desafío que representa la influenza en el país. Ésta debe mirarse desde diferentes ángulos e involucrar a todos los actores y protagonistas que participan en este problema (profesionales en diferentes áreas, educadores y capacitadores a distintos niveles, comunidades, gobierno nacional y local, etc). Son evidentes la presencia del virus en la población humana y animal (equinos y porcinos) y la falta de información del papel que desempeñan reservorios silvestres propios de la región y de las características moleculares y biológicas particulares de dichos virus, condiciones que revelan un vacío en el conocimiento en este aspecto que es necesario llenar. Con el fin de prevenir la ocurrencia de infecciones zoonóticas emergentes ocasionadas por IAV, se deben reforzar las estrategias de vigilancia en la interfase humano-animal, en la que existe una mayor probabilidad de que surjan nuevos subtipos del virus que representen un riesgo para la población humana. Asumir una política de acción bajo el concepto de Una Salud implica aunar esfuerzos y establecer prácticas que inicialmente pueden implementarse a la escala de animales de granja, lo cual resultará en la optimización de la salud y el bienestar del ser humano (trabajadores, miembros de la comunidad, consumidores), de los animales (bienestar animal) y del medio ambiente (bosques y fuentes de agua). Se requiere a la vez buscar alternativas para reducir el consumo de energía y la emisión de gases con efecto invernadero, de manera que la replicación de estas estrategias a mayor escala ayude a mitigar los efectos ambientales generados por la producción agropecuaria.
Es importante tener presente la existencia y aparición de IAV que han desarrollado resistencia a antivirales, lo cual reduce las opciones terapéuticas a utilizar en determinadas circunstancias. De la misma manera, es necesario tener presente las limitaciones y dificultades relacionadas con la utilización de vacunas para la prevención de infección por IAV. Lo anterior debido a las características propias del virus de influenza, su variabilidad, el número de subtipos existentes y la necesidad de conocer los virus circulantes en poblaciones humanas y animales, todo lo cual demanda una actualización permanente para determinar los componentes de los biológicos utilizados en la inmunización que obstaculizan el diseño de una vacuna universal para la prevención de la infección por virus de influenza. Con base en lo anterior, la elección y composición de las vacunas utilizadas en la prevención de la influenza deben concebirse desde la perspectiva de Una Salud, teniendo en cuenta información derivada de nuevas cepas del virus y de aquellas provenientes de diferentes especies de animales que puedan representar un riesgo pandémico potencial.















