INTRODUCCIÓN
En el proceso de fermentación de cacao participan microorganismos que son fundamentales para que se den los cambios en la composición química que originan las características organolépticas de la semilla. Entre estos están las bacterias ácido lácticas (BAL), dentro de las cuales predomina el género Lactobacillus, siendo las especies L. fermentum y L. plantarum las más sobresalientes (Saito et al., 2014). Los Lactobacillus spp. son el principal grupo de BAL y se caracterizan por producir ácido láctico como producto del metabolismo de los carbohidratos. Este género tiene una morfología de bacilos o cocobacilos, Gram positivos y no formadores de esporas. Sus requerimientos nutricionales son complejos y se encuentran principalmente en plantas o frutos, en alimentos fermentados y en el organismo de los animales (Sun et al., 2015). Se considera como el taxón de mayor potencial comercial debido a la capacidad de sus especies para realizar biotransformaciones de carbohidratos, y recientemente se ha estudiado su sistema basado en CRISPR-Cas, para explorar su potencial para edición genética (Sun et al., 2015). Estas bacterias se reconocen como seguras por la FDA (Food and Drug Administration) y como presuntamente cualificadas como seguras por la EFS (European Food Safety) (Sun et al., 2015).
De acuerdo a diversos autores (Ibrahim et al., 2006; Halttunen et al., 2007a; Halttunen et al., 2007b; Singh y Sarma, 2010; Bhakta etal., 2012; Monachese, 2012; Kinoshita et al., 2013; Zhai et al., 2013; Gerbino et al., 2014), se ha confirmado que los Lactobacillus spp. tienen alto potencial para retener metales y metaloides tóxicos, como Cd(II) y As(III), respectivamente. Por ejemplo, se han reportado porcentajes de remoción de Cd(II) hasta del 100 % en medio acuoso por acción de L. kefir JCM 5818 (Gerbino et al., 2014) y hasta del 60 % de As(III) por una cepa de L. acidophilus (obtenida del IMTECH, India) (Singh y Sarma, 2010). Por lo anterior, es importante la obtención de Lactobacillus spp. nativos con capacidad de tolerar elementos tóxicos que puedan aplicarse en procesos biotecnológicos de mitigación de estos elementos en sistemas biológicos.
La exposición a Cd(II) en los seres humanos genera estrés oxidativo y una respuesta inflamatoria, con daños en diferentes órganos del cuerpo, como el hígado, los riñones, el sistema cardiovascular y la piel (Das y Al-Naemi, 2019). La contaminación ambiental por Cd(II) está presente principalmente en China, Japón, Estados Unidos, Canadá, México, Bélgica, Alemania, Rusia y Australia (Das y Dash, 2017). En Colombia se han reportado concentraciones de Cd(II) en sangre superiores a los valores de referencia (entre 0,3 y 6,2 Mg/L) en poblaciones cercanas al río Bogotá (Arias et al., 2018).
El arsénico tiene dos formas químicas: arseniato (AsO4 3-o As(V)) y arsenito (AsO2- o As(III)), la cual es más tóxica (Spiro y Stigliani, 2007). En humanos, este elemento ocasiona lesiones cutáneas, neurotoxicidad, enfermedades cardiovasculares, diabetes y problemas de desarrollo (Arias et al., 2018). Se encuentra y representa una problemática en países como Argentina, Bangladesh, Chile, China, India, México y Estados Unidos; en Colombia, se han encontrado concentraciones considerables del metaloide en suelos, sedimentos, hortalizas y aguas de riego (Alonso et al., 2014).
En este trabajo se aislaron bacterias a partir de fermento de cacao, particularmente Lactobacillus spp., y se evaluó su resistencia a Cd(II) y As(III) y su tolerancia a condiciones de acidez y a diferentes concentraciones de sales biliares. Esto se realizó con el fin de establecer el potencial futuro de aplicación de estos microorganismos en procesos biotecnológicos de mitigación de estos elementos tóxicos en el ambiente o para detoxificación al disminuir su biodisponibilidad en el organismo humano.
MATERIALES Y MÉTODOS
Aislamiento e identificación de Lactobacillus spp. recuperados de fermento de cacao
Muestreo
El lugar de muestreo fue la finca Granja Luker, en el municipio de Palestina, departamento de Caldas, Colombia. Se tomaron muestras de grano de cacao (200 g) durante un proceso regular de fermentación en cajones de madera con una masa total de 200 kg. Las muestras se tomaron en tres tiempos diferentes del proceso de fermentación, cada una después de realizar un volteo (mezcla manual del grano y cambio de cajón): (i) 48 h, (ii) 72 h, y (iii) 120 h después del inicio del proceso. Las muestras se sumergieron en 300 mL de NaCl 0,85 % estéril y se almacenaron a 4 °C para su transporte al laboratorio donde se procesaron. Se autorizó la colecta de material biológico para el proyecto por la Resolución 0699 del 26 de abril de 2018, del Ministerio de Ambiente y Desarrollo Sostenible, previamente amparado por el otrosí No. 5 al Contrato Marco de Acceso a Recursos Genéticos y sus Productos Derivados, para la ejecución de actividades de acceso a los recursos genéticos y sus productos derivados.
Aislamiento
Se realizó un enriquecimiento de los microorganismos aerotolerantes usando el sobrenadante de cada muestra como inóculo en medio MRS1/2 (Man-Rogosa-Sharpee broth, OXOID, diluido 1/2), de acuerdo con Gerbino et al. (2014), preparado para mantener condiciones de aerotolerancia. Se hirvió el medio de cultivo, se burbujeó 10 min con nitrógeno para enfriamiento y se pasó un volumen de 9 mL por tubo de cultivo, sellando con tapas de caucho. Posteriormente, el medio se purgó con nitrógeno, previo a ser inoculado con 1 mL de muestra, utilizando una jeringa previamente purgada con nitrógeno. Los cultivos se incubaron por 48 h a 37 °C, sin agitación. Se prepararon diluciones seriadas de los cultivos hasta diez en NaCI 0,85 % y estas se sembraron en MRS/ agar (1,7 %) con presencia de indicador de pH (púrpura de bromocresol 0,017 %) (Bhakta et al., 2012) y para cada metal se adicionó 1,0 mg/L de Cd(II) (Cd(NO3)2) o 0,1 mg/L de As(III) (NaAsO2). Después de 48 h de incubación a 37 °C, se seleccionaron las colonias que mostraron la aparición de un halo amarillo característico que indica un cambio de pH en el medio de color púrpura.
Selección por morfología
Se realizó tinción de Gram y observación por microscopía óptica de las colonias aisladas. Las que presentaron morfología de bacilos Gram positivos se seleccionaron para posteriores ensayos.
Pruebas de catalasa y oxidasa
Para confirmar la presencia de actividad catalasa se colocó una colonia de cada aislado, crecido por 48 h en MRS/, en contacto con una gota de peróxido de hidrógeno comercial (4 % v/v). El peróxido de hidrógeno en presencia de catalasa reacciona produciendo agua y oxígeno, el cual se evidencia mediante la formación de burbujas (Reiner, 2010). La ausencia de esta reacción indicó microorganismos sin actividad catalasa, característica de Lactobacillus spp. Se utilizaron, respectivamente, como controles positivo y negativo, Staphylococcus aureus ATCC 6538 y Lactobacillus plantarum JCM1055 (Bhakta etal., 2012). Para detectar actividad oxidasa, se utilizaron tiras Bactident® Oxidase (OXOID), que tienen 1-naftol y dimetilparafenileno amina, la cual, en presencia de citocromo oxidasa, reacciona para formar azul de indofenol (Nachlas et al., 1958). Se emplearon como controles positivo y negativo las cepas Pseudomonas aeruginosa ATCC 9027 y Escherichia coli ATCC 8739, respectivamente. La ausencia de un cambio de coloración en la cinta permitió identificar microorganismos sin actividad oxidasa, entre los cueles se encuentra el grupo Lactobacillus spp. (Bratcher, 2018).
Preservación
Los aislados catalasa y oxidasa negativos se preservaron a -80 °C en crioviales con MRS/ suplementado con 20 % (v/v) de glicerol. Después de seis meses y un año de preservación se revisó su viabilidad siguiendo protocolos establecidos (Stephen, 1995).
Microorganismos de referencia
Se utilizaron las cepas Lactobacillus plantarum JCM 1055, Lactobacillus rhamnosus JCM 1136 y Lactobacillus kefir JCM 5818, de la Colección Japonesa de Microorganismos (JCM), como referencia en los ensayos de tolerancia a la acidez y la salinidad.
Identificación molecular
Se realizó la extracción y purificación de ADN genómico de los aislados seleccionados mediante un método enzimático previamente establecido (Montaño-Salazar et al., 2018). Una vez rectificada la pureza del ADN genómico extraído (NanoDrop 2000c, ThermoScientific), se amplificó la región V4-V5 del gen 16S rRNA con los iniciadores Com1 y 909R (Dohrmann et al., 2004) para realizar un análisis por Single-Stranded Conformational Polymorphism (SSCP), para lo cual se emplearon los procedimientos establecidos previamente (Montaño-Salazar et al., 2018). El desplazamiento de las bandas permitió establecer el perfil característico de cada cepa de acuerdo a la secuencia de dicha región; los aislados que presentaron perfiles electroforéticos idénticos se agruparon (Tabla 2). Se seleccionó un aislado de cada grupo y se identificó por técnicas moleculares. Para esto, se realizó la amplificación del gen 16S rRNA completo con los iniciadores 27F y 1492R (Weisburg et al., 1991); esta región se secuenció mediante el servicio comercial suministrado por Macrogen® (Corea del Sur). Posteriormente, las secuencias se analizaron en el programa GENEIOUS (versión 11.1) y se compararon con el programa BLASTn en la base de datos GenBank (https://blast.ncbi.nlm.nih.gov/). Los aislados seleccionados en los ensayos descritos a continuación se depositaron en la Colección de Microorganismos del Instituto de Biotecnología de la Universidad Nacional de Colombia - sede Bogotá (IBUN) con los códigos IBUN-090-03775 a IBUN-090-03813.
Ensayos de resistencia a Cd(II) y As(III)
Se determinó la concentración mínima inhibitoria (CMI) de Cd(II) y As(III) de los aislados criopreservados. Para esto, a partir de crioviales se cultivaron y se ajustaron los inóculos para el ensayo a 0,5 unidades de absorbancia 600 nm (OD600). Posteriormente, se cultivaron en MRS/ suplementado con Cd(II) (Cd(NO3)2) o As(III) (NaAsO2) en 8 concentraciones diferentes dentro del rango de 0 a 300 mg/L, en placas de 96 pozos, con un pH inicial de 5,6 y se incubaron por 48 h, a 37 °C y 180 rpm. Se determinó la OD600 con un lector espectrofotométrico de placas de Elisa (Bio-Rad/ ELISA iMark™) (Bhakta et al., 2012). Los aislados que presentaron el mayor crecimiento a las concentraciones más altas de los elementos evaluados se consideraron los más tolerantes y se seleccionaron para ensayos posteriores.
Ensayos de tolerancia a acidez
Con el fin de evaluar la capacidad de tolerar las condiciones ácidas de los aislados más resistentes a Cd(II) y As(III), se evaluó su viabilidad antes y después de permanecer en contacto con un medio sintético que simula las condiciones ácidas del sistema digestivo humano. Para esto, se centrifugó (13 000 g, cinco min) un cultivo líquido de 48 h a 37 °C en MRS/ de cada aislado, con una OD 600 de 0,5 para obtener un pellet de biomasa que se resuspendió en 1 mL de buffer fosfato salino (PBS), ajustado a pH 2,5 con HCl 5 M. Se incubó a 37 °C por dos h yse realizó el conteo de Unidades Formadoras de Colonia por mililitro (UFC/mL); para esto se prepararon diluciones seriadas de los cultivos hasta 10-7 y se sembraron en medio agar MRS1, a 37 °C por 48 h. Se realizó el conteo de colonias para cada dilución y se determinó la relación de UFC/mL antes y después del tratamiento con condiciones ácidas. Se determinó la relación de viabilidad, antes y después de colocar las células en contacto con el buffer en condiciones ácidas, de acuerdo a la Ecuación 1. Se seleccionaron los aislamientos que presentaron un valor mayor de esta relación (Bhakta et al., 2012).
Ensayos de tolerancia a sales biliares
Los aislados que mostraron mayor tolerancia a la acidez se cultivaron 48 h a 37 °C en MRS// hasta OD600 de 0,5. A partir del cultivo se prepararon diluciones seriadas hasta 10-7, se sembraron en agar MRS½ sin y con sales biliares en concentraciones de 1, 2 y 4 g/L y se incubaron por 48 h a 37 °C. Los aislados que al final del ensayo mostraron un número de UFC/mL más alto a una mayor concentración de sales biliares se seleccionaron como los más tolerantes a condiciones de salinidad (Bhakta et al., 2012).
RESULTADOS
Aislamiento e identificación de Lactobacillus spp. aislados a partir de fermento de cacao
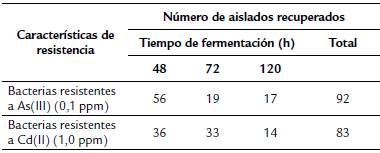
La Tabla 1 resume el número de aislados recuperados a partir de las muestras de grano de cacao con diferentes tiempos de fermentación, seleccionados en MRS1 suplementado con Cd(II) o As(III) y con purpura de bromocresol. El halo presente alrededor de las colonias generado por el cambio de pH producido por la fermentación de los azúcares presentes, permitió seleccionar 175 colonias que presentaron este metabolismo. Se eligieron el 52 %, el 31 % y el 17 % de muestras colectadas en los tiempos 48, 72 y 120 h, respectivamente (Tabla 1). El número de aislados se redujo a 49 por selección morfológica, restringiendo la selección a bacilos Gram-positivos. Posteriormente, los ensayos con resultado negativo para actividades catalasa y oxidasa permitieron escoger los aislados para uso en las siguientes pruebas, los cuales se criopreservaron a -80 °C y se reactivaron para verificar su viabilidad. En esta etapa no se tomaron en cuenta los aislados con baja viabilidad después de la criopreservación.
Tabla 1 Número de colonias resistentes a Cd(II) o As(III) recuperadas de fermento de cacao, con diferentes tiempos de fermentación, de acuerdo a cambio de color en medio agar MRS%.
De acuerdo con los criterios de morfología, de actividades catalasa y oxidasa y de viabilidad después de su criopreservación, se seleccionaron finalmente 36 aislados, los cuales se identificaron molecularmente. El análisis de perfiles electroforéticos con la técnica SSCP dio como resultado la amplificación, secuenciación y análisis bioinformático de 22 microorganismos, a los cuales se les asignó la clasificación taxonómica asociada a dichos perfiles electroforéticos (Tabla 2). Los resultados indican que, con la metodología de aislamiento y selección utilizada, el 97,5 % de las bacterias aisladas correspondieron al género Lactobacillus. Entre las especies más predominantes se encontraron L. plantarum y L. brevis. El análisis filogenético de las secuencias obtenidas, junto con secuencias reportadas para microorganismos de referencia reportados en las bases de datos, mostró una gran cercanía evolutiva entre las mismas (Fig. 1).
Tabla 2 Identificación molecular de bacterias aisladas de fermento de cacao.
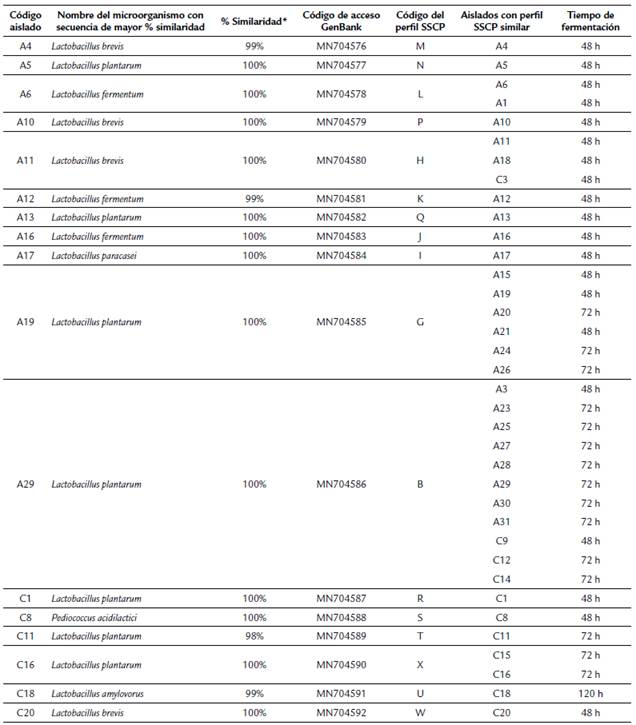
Los códigos de acceso de GenBank para el gen 16S rRNA y el código del perfi l SSCP se muestra para cada aislado, el cual se determinó de acuerdo a la metodología descrita. Las bacterias aisladas en medios suplementados con As(III) se identifican con letra A mientras que los aislados en medios suplementados con Cd(II) se identifican con la letra C, en su código.
*Los porcentajes de similaridad para secuencias desconocidas fueron determinados por BLASTn en comparación con secuencias presentes en GenBank.
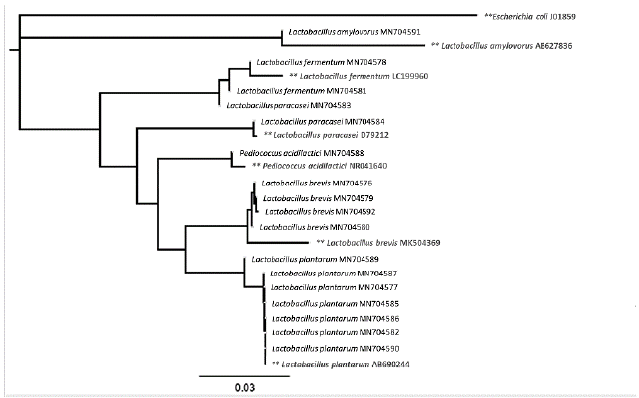
Figura 1 Análisis filogenético basado en las secuencias del gen 16S rRNA de 17 bacterias ácido lácticas aisladas a partir de fermento de cacao, representantes de los perfiles SSCP electroforéticos identificados. Las cepas están identificadas con los respectivos códigos de acceso de GenBank mostrados en la Tabla 2. Los nombres marcados con ** representan las secuencias de las cepas referencia reportadas en GenBank. La secuencia de la cepa E. coliJ01859 fue usada como outgroup para el análisis. El árbol fue construido usando el método Neighbor-Joining method y las distancias fueron estimadas usando el modelo Kimura 2-parameter, en el programa GENEIOUS.
Ensayos de resistencia a Cd(II) y As(III)
Como se observa en la Figura 2, las bacterias evaluadas se clasificaron en grupos de acuerdo a su crecimiento en presencia de diferentes concentraciones de Cd(II) y As(III). La mayoría presentaron una CMI entre 10 y 50 mg/L para Cd(II) y de más de 300 mg/L para As(III) (Fig. 2). Todos los microorganismos toleraron concentraciones de As(III) superiores a 100 mg/L, mientras que para Cd(II) toleraron concentraciones inferiores a 50 mg/L. De acuerdo con la resistencia a los elementos tóxicos, se seleccionaron las cepas L. plantarum JCM 1055, A15, A19, A23, A26, A29, C9, C16, L. kefir JCM 5818, L. rhamnosus JCM 1136 y L. paracasei A17 para los siguientes ensayos.
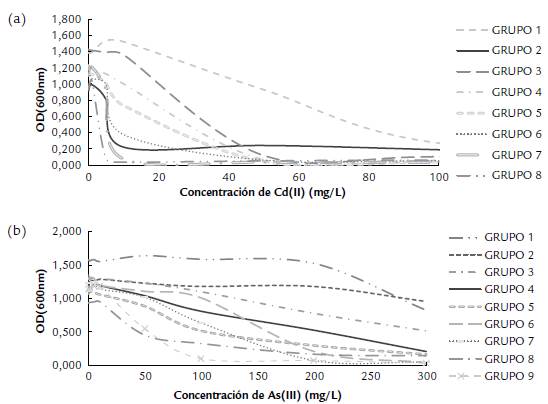
Figura 2 Crecimiento de cepas de trabajo en los medios de cultivo MRS// suplementados con diferentes concentraciones de (a) Cd(II) (0 a 100 mg/L) o (b) As(III) (0 a 300 mg/L). Las bacterias fueron agrupadas de acuerdo a la similitud de comportamiento de las curvas de OD(595nm) vs concentración de metal(oide) en los siguientes grupos: (a) para Cd(II): G1: JCM 1136; G2: JCM 1055, JCM 5818, C16, A15, A23, A29; G3: C3, C9, C11, C14, C15, C18, A5, A13, A19, A20; G4: A4, A10, A21, A24, A26, A30; G5: A11, A25, A27, A28; G6: C1, C12, A3, A6, A12, A17, A18, A31; G8: C20, A1, A14; (b) para As(III): G7: JCM 1055, JCM 5818; G2: A17; G3: C9, A15, A19, A20, A26, A29; G4: C1, C18, A3, A5, A23, A25; G5: C16, A1, A6, A11, A18, A27, A28, A30, A31; G6: JCM 1136, A13, A24; G7: C11, C15, A12, A14, A21; GS: C12, C14, C20, A10; G9: C3, A4.
Ensayos de tolerancia a la acidez
Los microorganismos más resistentes a Cd(II) y As(III) que presentaron mayor viabilidad después del tratamiento ácido (pH 2,5) fueron L. plantarum JCM 1055, L. plantarum A19, L. plantarum A26 y L. plantarum C16 (Fig. 3). Estos se evaluaron en los ensayos de tolerancia a sales biliares.
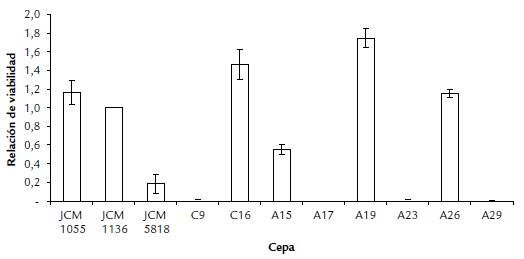
Figura 3 Relación de viabilidad de bacterias antes y después del contacto por 2 h con buffer PBS ácido (pH 2,5) en ensayo de tolerancia a condiciones de acidez de Lactobacillus spp. aislados de fermento de cacao y cepas de referencia. Desviación estándar (n=3). Las siglas del eje X corresponden a los códigos establecidos en la Tabla 2.
Ensayos de tolerancia a sales biliares
Los ensayos de tolerancia a diferentes concentraciones de sales biliares mostraron que todos los microorganismos evaluados presentaron crecimiento hasta 4 g/L (Fig. 4).
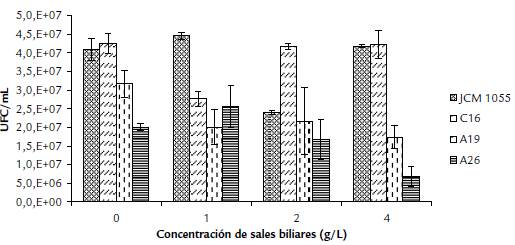
Figura 4 Crecimiento (UFC/mL) de Lactobacillus spp. aislados de fermento de cacao y cepa de referencia, en medio MRS// suplementado con diferentes concentraciones de sales biliares en ensayo de tolerancia a condiciones de salinidad, por 48 h a 37 °C. Desviación estándar (n=3). Las siglas de las etiquetas internas corresponden a los códigos establecidos en la Tabla 2.
DISCUSIÓN
En esta investigación se aislaron y caracterizaron BAL, principalmente Lactobacillus spp., a partir de fermento de cacao. El uso de un medio del cultivo con presencia del indicador púrpura de bromocresol permitió seleccionar los aislados con capacidad de producir metabolitos ácidos, provenientes de la fermentación de azúcares sencillos presentes en el medio de cultivo, entre los cuales se encuentran los lactobacilos (De Vuyst et al., 2010). La presencia de BAL durante las primeras horas del proceso de fermentación de cacao se debe a la mayor producción de azúcares sencillos, que son su principal fuente de carbono (De Vuyst et al., 2010); de esta manera, crecen en paralelo con las levaduras y asimilan ácido cítrico de la pulpa fresca (De Vuyst y Weckx, 2016). Se ha reportado la presencia de BAL heterofermentativas, las cuales producen ácido láctico, etanol, ácido acético y CO2, además de la producción de manitol, que es el causante de los sabores dulces en el grano seco (Papalexandratou et al., 2019). Adicionalmente, a las BAL también se les atribuye la prevención del crecimiento de microorganismos patógenos en el fermento, lo que incrementa la higiene del proceso debido a la producción de metabolitos ácidos que juegan el papel de agente inhibidor (Fahrurrozi et al., 2019).
Dentro del grupo de las BAL se encuentra la familia Lactobacillaceae, conformada por los géneros Lactobacillus, Paralactobacillus y Pediococcus, los cuales se consideran citocromo oxidasa-negativos, y en algunos casos catalasa-negativos. Recientemente se ha publicado la capacidad de algunas cepas de BAL para descomponer el peróxido mediante el uso de catalasas o pseudocatalasas (De Vos et al., 2009). A pesar de esto, en este estudio se seleccionaron solamente las bacterias catalasa-negativas, con el fin de aumentar la probabilidad de aislar Lactobacillus spp.
Durante el desarrollo de la investigación se encontró que parte de los microorganismos seleccionados perdieron viabilidad posterior a la criopreservación, lo que sugiere que no todos presentan resistencia a las condiciones de almacenamiento de -80 °C utilizando glicerol como criopreservante. Resultados similares fueron registrados por Chou y Weimer (1999), quienes consideran la tolerancia a condiciones de preservación fundamental para la selección de posibles probióticos. Un procedimiento recomendado por otros autores es la liofi lización (Kocha et al., 2008).
El análisis SSCP permite distinguir variaciones genéticas características entre especies (Brandão et al., 2002). De acuerdo a esta diferenciación se pueden seleccionar los perfi les electroforéticos únicos y así realizar la identificación de aislados con el mismo perfil mediante la amplificación y secuenciación del gen 16S rRNA de un microorganismo con un perfil específico. Se asocia la identidad de las cepas analizadas con otras cepas caracterizadas con el mismo perfi l y de esta manera se asigna la clasificación taxonómica para la totalidad de los aislados (Dohrmann et al., 2004).
Como se evidencia en los resultados (Tabla 2; Fig. 1), la mayor parte de las cepas aisladas del fermento de cacao se asoció con la especie Lactobacillus plantarum. Esta especie se ha reportado como una de las más dominantes del género Lactabacillus en procesos de fermentación de Brasil, Nigeria, Ghana, República Dominicana y Bolivia (Serra et al., 2019). Otros microorganismos recuperados de esta matriz fueron L. brevis, L. fermentum, L. amylovorus, L. paracasei y Pediococcus acidilactici, cuya presencia en procesos de fermentación ya se había reportado en Brasil y República Dominicana (Grumezescu y Holban, 2019).
En un estudio de metagenómica publicado recientemente por Serra et al. (2019), se evaluaron muestras de grano de cacao durante el proceso de fermentación colectadas en la amazonia brasilera (estados de Pará y Bahía), donde se encontró que los consorcios presentes a lo largo de este proceso se componen principalmente de levaduras (Pichia y Candida), hongos filamentosos (Aspergillus, Penicillium y Fusarium), bacterias acido lácticas (Leuconostoc, Lactococcus y Lactobacillus), bacterias ácido acéticas (Acetobacter y Gluconobacter), enterobacterias y bacilos. Aunque la mayor parte de los géneros presentes en los granos de cacao fermentado son reportados en el mismo tipo de matriz de diferentes continentes, algunas especies sólo están presentes en las muestras regionales y se cree que pueden ser responsables de las características sensoriales específicas para el cacao de cada zona (Serra et al., 2019). En una publicación de Papalexandratou et al. (2019), se concluyó que las distintas características sensoriales se deben, además, a la diferencia en la genética de las variedades de cacao y al manejo post cosecha (condiciones ambientales). Papalexandratou et al. (2019) indican que la presencia de algunos taxones específicos favorece la presencia de características organolépticas particulares.
No se conocen reportes del aislamiento de Lactobacillus spp. resistentes a Cd o As a partir de fermento de cacao. Se ha reportado previamente la presencia de Cd en cacao y su dinámica en el proceso de fermentación del grano, el cual está relacionada con la presencia de microorganismos (Vanderschueren et al., 2020). Por otro lado, no hay estudios sobre concentraciones altas de As en muestras de cacao, aunque se conoce que los microorganismos que hacen parte del proceso de fermentación provienen de fuentes ambientales (Serra et al., 2019), las cuales pueden contener genes de resistencia a Cd(II) y/o As(III). Por ejemplo, Evanovich et al. (2019) hallaron la presencia de los genes arsC y arsR en el genoma de una cepa de Lactobacillus plantarum. Se han encontrado también genes de resistencia a Cd y As en plásmidos extraídos a partir de la Lactobacillus spp. (van Kranenburg et al., 2005).
Al evaluar la capacidad de tolerar Cd(II) y As(III) de los aislados de fermento de cacao, se obtuvieron resultados similares a los descritos por Monachese (2012). Se observó la disminución del crecimiento de los Lactobacillus spp. en contacto con Cd(II) o As(III), con un comportamiento diferente entre las cepas (Fig. 2). Se encontró que para todos los aislados la CMI con Cd(II) fue menor que con As(III), lo cual se debe a que el comportamiento de Cd y As con el pH es diferente. El Cd(II) se presenta como un catión que puede interactuar con las cargas negativas de la membrana celular de las bacterias (Halttunen et al., 2007a), mientras que el As(III) ocurre en su forma de H3AsO3 con carga neutra, por lo que su interacción es menor (Halttunen et al., 2007b). Los mecanismos de resistencia de estas bacterias en presencia de Cd(II) son, por ejemplo, la activación de mecanismos de conservación de energía (los cuales consisten en la alteración de las rutas metabólicas) y la producción de moléculas que aumentan la hidrofobicidad de la pared celular y de proteínas de membrana (Zhai et al., 2017) o proteínas de superficie (capa S) (Gerbino et al., 2011) capaces de capturar el Cd(II). En cuanto al As en su forma trivalente (As(III)), puede ser transformado químicamente mediante reacciones de metilación, e incluso puede cambiar su estado de oxidación. El As(III) interacciona con las proteínas (con grupos tiol) cambiando su estructura e inhibiendo su función (Shen et al., 2013). El As(III) puede ingresar a las bacterias mediante proteínas transportadoras de membrana llamadas acuagliceroporinas (Shen et al., 2013), las cuales se encuentran presentes en el género Lactobacillus spp. (Bienert et al., 2013).
Finalmente, la evaluación de la capacidad de los microorganismos con mayor CMI de Cd(II) y As(III) para tolerar condiciones de acidez, permitió seleccionar la cepa tipo L. plantarum JCM 1055 y los aislados L. plantarum A19, A26 y C16, que presentaron mayor valor de relación de viabilidad después de estar expuestos a un pH ácido (Fig. 3), lo cual se debe a mecanismos de tolerancia característicos de estas bacterias. Previamente se reportó que estos mecanismos están relacionados con la producción de metabolitos para mantener condiciones estables a nivel celular y con la protección y reparación macromolecular, entre otros (De Angelis et al., 2011; Liu et al., 2015). Las cepas de L. plantarum seleccionadas por su tolerancia a condiciones de acidez también fueron tolerantes a concentraciones hasta de 4 g/L de sales biliares (Fig. 4). Las condiciones de acidez en el estómago y la presencia de componentes del intestino, como las sales biliares, tienen influencia en la selección de los probióticos que permanecen en el sistema gastrointestinal de los animales. La habilidad de las cepas de L. plantarum seleccionadas para tolerar estas condiciones de acidez y de altas concentraciones de sales biliares, dan indicios de su potencial para uso futuro como probióticos. Además, debido a su resistencia a Cd(II) y As(III), se puede evaluar su capacidad de absorber estos elementos tóxicos para una futura aplicación en la detoxificación del sistema digestivo humano. Es decir, es posible que al ser consumidas disminuyan la biodisponibilidad de los elementos tóxicos y eviten su acumulación (Kumar et al., 2017).
CONCLUSIONES
Mediante la metodología utilizada fue posible aislar y caracterizar 36 BAL del género Lactobacillus a partir de cacao fermentado en el departamento de Caldas, Colombia. Se seleccionaron bacterias productoras de metabolitos ácidos y resistentes a Cd(II) o As(III) en medios de cultivo selectivos MRS/, con morfología de bacilos Gram-positivo y actividad catalasa y oxidasa negativa. Se confirmó su identidad mediante la secuenciación del gen 16S rRNA y se encontró predominantemente las especies L. plantarum y L. brevis. Estos Lactobacillus spp. podrían tener potencial de detoxificación de Cd(II) y As(III), ya que la CMI para estos elementos fue de 10 mg/L y >300 mg/L, respectivamente. Las cepas Lactobacillus plantarum JCM 1055, A19, A26 y C16, las cuales presentaron las más altas CMI para Cd(II) y As(III), también toleraron condiciones de acidez (pH 2,5) y alta concentración de sales biliares (4 g/L), similares a las del sistema digestivo humano. Estos microorganismos presentan gran potencial para aplicaciones biotecnológicas relacionadas con la mitigación de Cd(II) y As(III).
















