INTRODUCCIÓN
El estudio de la diversidad de especies representa uno de los mayores intereses en la ecología y es intuitivamente simple pero conceptualmente complejo (Chiarucci et al., 2011), al punto que existe un fuerte debate sobre si actualmente está cambiando la diversidad biológica (González et al., 2016; Cardinale et al., 2017), disminuyendo (Barnosky et al., 2011) u homogenizándose (Sax y Gaines, 2003). Esta discusión está, en muchos casos, relacionada con la presencia de especies invasoras. En la actualidad se reportan la introducción de más de 3500 especies de peces no nativos a través de los ríos del mundo (Kuczynski et al., 2018).
Los principales efectos negativos de la introducción de especies son la alteración del hábitat, la hibridación, la competencia, la depredación y el parasitismo, así como también cambios en la estructura de las redes alimenticias comunitarias, en el ciclo de nutrientes y, en consecuencia, permutas en la función del ecosistema (Gubiani et al., 2018).
En el extremo noroccidental del Ecuador se forman drenajes que nacen en altitudes bajas, no mayores a los 300 m.s.n.m. y que desembocan en el mar. Estos drenajes de baja altitud son perennes porque responden a patrones climáticos extremos como alta humedad relativa, elevada precipitación y aporte de aguas subterráneas. Los estudios sobre la riqueza ictiológica de ríos en esta área son escasos y se han centrado principalmente en la descripción de su taxonomía con referencia a las grandes cuencas hidrográficas regionales. Su condición de aislamiento podría ocultar una diversidad o un endemismo aún desconocidos (Jiménez-Prado et al., 2015). Por otra parte, conocer la diversidad y sus cambios a través el tiempo es fundamental para entender el funcionamiento y la resiliencia de los ecosistemas fluviales (Hooper et al., 2005), ya que tales dinámicas son importantes para el ser humano debido, entre otros factores, a los servicios ecosistémicos que se derivan de ellas, como la producción de alimentos, el control de plagas y las pesquerías (Cardinale et al., 2012).
El objetivo de este estudio fue describir la variación en la composición y la estructura de la comunidad de peces del río Atacames, ubicado al noroccidente del Ecuador, en periodos de alta precipitación (enero a junio), en los años 2012 y 2017, en tres sitios del gradiente altitudinal, con un seguimiento a la presencia de dos especies introducidas.
MATERIALES Y MÉTODOS
El estudio se realizó en el río Atacames, vertiente Pacífico de la república del Ecuador, cuyo nacimiento se da a una altitud no mayor de los 200 m. s. n. m., con una extensión del cauce de 40 km y una cuenca hidrográfica con área cercana a los 300 km2. En mayo de 2010 se inició la construcción de dos represas en este río, las cuales se diseñaron inicialmente para el control de inundaciones y como sistemas de riego. A pesar de que su construcción no ha concluido, se han originado represamientos de agua que funcionan como barreras artificiales (con una altura aproximada de tres metros) que actualmente están siendo aprovechadas como grandes "estanques" para recreación y turismo local (Fig. 1).
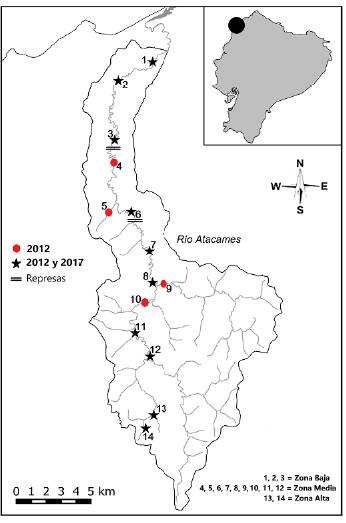
Figura 1 Área de estudio en el río Atacames con localización de las estaciones de muestreo, ubicación de las represas y separación por zonas de estudio.
Para este trabajo se utilizó la información de muestreos de peces registrados en dos periodos. El primero de ellos se hizo entre febrero y agosto de 2012 (Jiménez-Prado, 2012a) y el segundo (este trabajo) entre enero y agosto de 2017. Ambos periodos corresponden a la época de mayor precipitación en la zona (Molinero, 2019). En el primer periodo se analizaron 14 estaciones distribuidas a lo largo de todo el cauce, con un total de 26 unidades muestrales; en el segundo periodo se analizaron diez de las mismas estaciones anteriores, pero con un total de 30 unidades de muestreo (Fig. 1). En ambos casos, los ejemplares se recolectaron con una red de arrastre (6 m de largo x 1,20 m de alto y luz de 3 mm) y una atarraya (2,10 m de radio y una luz o diámetro de poro de 10 mm) en tramos de aproximadamente 75m de longitud, y en un lapso de dos horas/faena, con el esfuerzo de dos personas.
Los individuos recolectados se fijaron in situ en una solución de formaldehído al 10 % y se almacenaron durante una semana. En el laboratorio los peces se determinaron con ayuda de bibliografía especializada (Glodek, 1978; Maldonado-Ocampo et al., 2012; Jiménez-Prado et al., 2015), y se depositaron en etanol al 70 % en la colección de peces del museo de la Escuela de Gestión Ambiental de la Pontificia Universidad Católica del Ecuador, Sede Esmeraldas (CEMZ-p-002-224; 352-368). En cada uno de los puntos de recolecta se tomaron seis parámetros ambientales [pH, temperatura del agua (°C), oxígeno disuelto (mg/l), dureza (mg/l), fosfatos (mg/l), nitritos (mg/l)], que se utilizaron para comparar los dos periodos del estudio.
Para evaluar los cambios en la composición y estructura de la comunidad de peces a lo largo del gradiente altitudinal, el río se subdividió en tres zonas (alta, media y baja), según sus características geomorfológicas (Montaño, 2018) y el orden del río (Strahler, 1957) (Fig. 1). La parte alta del río se caracteriza por presentar mayor pendiente y altura (colinas altas con drenaje promedio de 2,65 Km2), lo que forma vertientes de agua con corriente moderada, aunque de cauces pequeños (órdenes de río uno y dos). La zona media del río se caracteriza por tener menor pendiente y ancho del río (colinas bajas con drenaje promedio de 61,06 Km2), lo que da lugar a cauces de agua con caudales y ancho del río moderados (órdenes de río tres y cuatro). La zona baja del río tiene pendientes y altitudes leves (llanura con drenaje promedio de 111,80 Km2), por lo que se forman cauces de agua con poca velocidad y ancho de río moderado a grande (órdenes de río cuatro a seis).
La riqueza se analizó mediante las abundancias absolutas y relativas para cada zona y para cada periodo de muestreo. Para determinar los cambios ocurridos con la composición y distribución altitudinal, entre los dos años de estudio, se diseñaron gráficos de abundancia relativa (porcentual acumulado, para cada especie por cada zona del río). Se analizaron también rangos de abundancia relativa, expresados como la raíz cuadrada de la relación entre cada una de las abundancias y la abundancia total de las especies (VPi).
Las especies se han diferenciado también según el hábitat que ocupan (Myers, 1949), como primarias cuando son estrictamente de agua dulce o secundarias cuando habitan mayoritariamente estuarios. Este estudio toma en cuenta esta diferencia, ya que pueden presentarse grandes variaciones en la presencia de especies secundarias en el río, debido a que toleran la salinidad, lo cual les permite migrar hacia el mar, no así para las especies primarias.
Finalmente, se realizó un análisis de correspondencia canónica para establecer la relación entre la abundancia relativa de las especies en cada zona y sus parámetros ambientales. Con el fin de entender la posible interacción entre estos parámetros y la composición de especies, se consideraron solamente las 11 especies de peces primarios (exclusivos de agua dulce, Myers, 1949), ya que son los únicos que no pueden abandonar este hábitat, a diferencia de las especies secundarias (que habitan mayoritariamente estuarios, Myers, 1949) que podrían ingresar en el mar y eventualmente penetrar en otros ríos.
RESULTADOS
Se recolectaron 2570 individuos, 831 en 2012 y 1739 en 2017, pertenecientes a 16 especies y nueve familias (Tabla 1). La mayoría (81,25 %) de las especies encontradas en 2012 también se hallaron en 2017. Las dos etapas de análisis mostraron equilibrio asintótico en el número de especies colectadas, al 99 % de confianza para la riqueza global de río y al 95% de confianza para la riqueza específica por zona (alta, media y baja); por lo tanto, es baja la probabilidad de que hubiera alguna otra especie que no hubiera sido colectada.
Tabla 1 Comunidades de peces para el río Atacames, donde se muestran las frecuencias absolutas en las zonas del río para los años 2012 y 2017. ZB = Zona baja; ZM = Zona media; ZA = Zona alta.
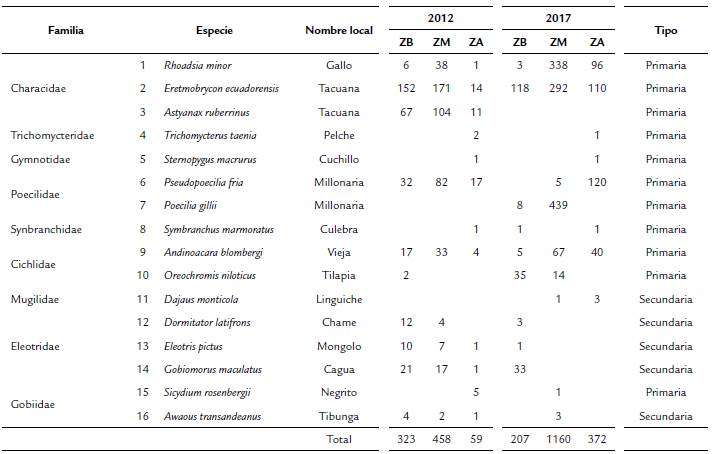
Se destaca la presencia de Astyanaxruberrinus (Eigenmman, 1913) que en 2012 presentó un registro constante a lo largo del todo el cauce. Esta especie tuvo un 21,57 % de la abundancia total de peces registrada en el primer estudio, pero pasó a estar ausente en 2017.
La variación en la composición de las especies secundarias es un patrón que puede interpretarse como normal (Fig. 2) por la posibilidad que tienen de acceder al mar. Esta propiedad les permite tener contacto con comunidades de otros ríos e incluso de otras regiones. Las especies secundarias del rio Atacames tienen una amplia distribución a lo largo de la costa oriental de la cuenca del Pacífico y la distribución de algunas de ellas (Dajaus montícola Bancroft, 1834, Dormitator latifrons Richardson, 1844, Eleotris pictus Kner, 1863 y Gobiomorus maculatus Günther, 1859) llega hasta California (Fricke et al., 2020). En el caso de las especies primarias, durante el 2012, se pudo registrar la presencia de A. ruberrimus y Pseudopoecilia fria Eigenmann y Henn, 1914 a lo largo de todo el cauce, de Oreochromis niloticus (Linnaeus, 1758) exclusivamente en la zona baja y la ausencia total de Poecilia gillii Kner, 1863 en toda la cuenca. Para el 2017 se registró a P. gillii como nueva especie en la región, lo que indica su carácter de especie introducida, cuya distribución original se limitaba a Centroamérica (Froese y Pauly, 2019). Por otra parte, la especie nativa P. fria está restringida casi exclusivamente a la parte alta, pero también se encontró en la zona media del río y solamente se registró entre las represas, conviviendo junto a P. gillii, con abundancias bajas (Fig. 2). La especie O. niloticus amplió su distribución a la zona media. Se aprecia también un aumento en la abundancia de Rhoadsia minor Eigenmann y Henn, 1914, Eretmobrycon ecuadorensis Román-Valencia, Ruiz-C., Taphorn B., Jiménez-Prado y García-Alzate, 2015 y A. blombergi Wijkamark, Kullander y Barriga, 2012 en la zona alta, así como una disminución de su presencia en la zona baja (Fig. 2).
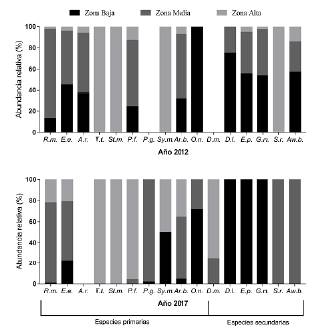
Figura 2 Abundancia relativa de las comunidades de peces en el río Atacames. R.m. = Rhoadsia minor; E.e. = Eretmobrycon ecuadorensis; A.r. = Astyanaxruberrimus; T.t. = Trichomyterus taenia; St.m. = Sternopygus macrurus; P.f. = Pseudopoecilia fria; P.g. = Poeciliagillii; Sy.m. = Symbranchus marmoratus; An.b. = Andinoacara blombergi; O.n. = Oreochromis niloticus; D.m. = Dajaus montícola; D.l. = Dormitator latifrons; E.p. = Eleotris pictus; G.m. = Gobiomorus maculatus; S.r. = Sicydium rosenbergii; Aw.t. = Awaous transandeanus.
Los rangos de abundancia confirman los cambios en la composición de las especies (Fig. 3). En 2012 la ictiofauna estaba dominada por E. ecuadorensis, siendo A. ruberrimus la segunda más abundante y P. fria la tercera. Para el 2017, aunque E. ecuadorensis siguió dominando, su abundancia relativa fue menor, A. ruberrimus no se capturó y se registró otra especie introducida (P. gilii) como la segunda más abundante. En este año se evidenció además una fuerte disminución en la abundancia de P. fria, que descendió a la cuarta posición.
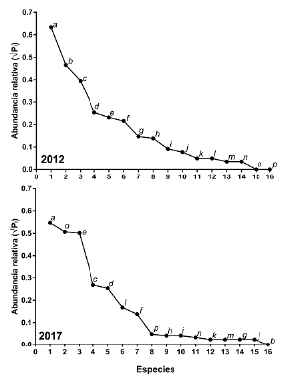
Figura 3 Rangos de abundancia relativa entre muestreos de 2012 y 2017. El eje horizontal corresponde a las especies organizadas desde la más abundante a las ausentes de izquierda a derecha.; a = Eretmobrycon ecuadorensis; b = Astyanax ruberrimus; c = Pseudopoecilia fria; d = Andinoacara blombergi; e = Rhoadsia minor; f = Gobiomorus maculatus; g = Eleotris pictus; h = Dormitator latifrons; i = Awaous transandeanus; j = Sicydium rosenbergii; k = Trichomyterus taenia; l = Oreochromis niloticus; m = Sternopygus macrurus; n = Symbranchus marmoratus; o = Poecilia gillii; p = Dajaus montícola.
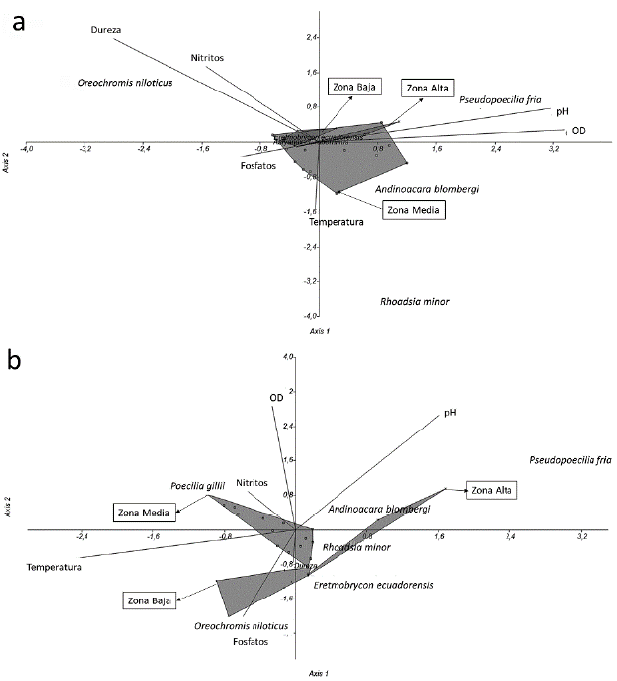
El análisis de correspondencia canónica (ACC) indica que en 2012 los parámetros físico-químicos tuvieron cierta estabilidad a lo largo del cauce, es decir, fueron relativamente homogéneos entre las diferentes zonas del río (Fig. 4a), y la abundancia de las especies estuvo caracterizada por Sternopygus macrurus Bloch y Schneider, 1801, Trichomyterus taenia Kner, 1863, Symbranchus marmoratus Bloch, 1795, Sicydium rosenbergiii Boulenger, 1899 y P. fria en áreas con mayor concentración de oxígeno disuelto (8,5-9,9 mg/l) y pH alto (8,2-8,8), lo que corresponde a las zonas alta y media. Por otra parte, R. minor se encontró en sitios con mayor temperatura y O. niloticus en lugares con valores altos de dureza (4,3-4,9 mg/l), fosfatos (2,2-2,9 mg/l) y nitritos (0,05-0,09 mg/l), que corresponden a la zona baja.
La presencia de las demás especies (E. ecuadorensis, R. minor y A. blonbergii) no estuvo determinada por las condiciones ambientales en las diferentes zonas del río, y su presencia fue constante a todo lo largo el cauce. No obstante, en 2017 las condiciones ambientales presentaron mayor heterogeneidad a lo largo de las diferentes zonas del río (Fig. 4b): S. macrururs, T. taenia, S. marmoratus y P fria se encontraron en áreas con pH más alto (8,1-8,3) hacia la zona alta, S. rosenbergiii ocupó ambientes con mayor concentración de oxígeno disuelto (7,7-8,6 mg/l) en la zona media y O. niloticus tuvo su mayor presencia en sitios con mayor carga de fosfatos (1,2-1,5 mg/l) en la zona baja.
DISCUSIÓN
Es difícil demostrar la extinción local de A. ruberrimus para el año 2017 sin datos específicos; sin embargo, existen factores que podrían estar relacionados con procesos de extinción en peces de agua dulce al afectar sus características biológicas. Uno de estos factores es la interrupción o la modificación del canal del río, lo que afecta directamente a las especies migratorias y causa el aislamiento entre poblaciones, con un aumenta en el riesgo de su extinción local (Shields et al., 1994; Angermeier 1998). Es poco lo que se conoce sobre la biología de A. ruberrimus en estos ríos, pero se observó una subienda a mediados de julio de 2012 (Jiménez-Prado, 2012b), en la cual los individuos adultos no lograron superar la barrera establecida por la primera represa. Si se consideran estudios realizados en especies afines, en las que los periodos reproductivos coindicen con la época de lluvias (Mora et al., 1997; Loaiza-Santana et al., 2018) y las migraciones ascendentes de los individuos adultos son una respuesta reproductiva (Menezes y Vazzoler, 1992) o una forma de dispersión de huevos y larvas (Mazzoni et al., 2004), es factible pensar que la barrera impuesta por la primera represa podría ser una posible causa de extinción de la especie a nivel local (De la Vega-Salazar et al., 2003).
Por otro lado, la introducción de la tilapia O. niloticus se produjo a partir de la década de los noventa, cuando se inició el desarrollo de piscicultura de la especie en piscinas construidas como una alternativa a las piscícolas camaroneras afectadas por la enfermedad de la mancha blanca (Schwarz, 2005). Con respecto a la introducción de P. gillii, no se tiene claridad sobre su origen, pero posiblemente esté relacionado con la liberación de peces ornamentales. Su presencia actual en aguas fluviales probablemente contribuye a ejercer presión sobre las especies locales. Al parecer la aparición de P. gilli, que fue posterior al 2012, está generando cambios sobre la especie nativa P. fria, incluso de tipo morfológico, como la disminución del tamaño del cuerpo y el desplazamiento anterior de su aleta pectoral (Jiménez-Prado et al., 2020).
Es importante comprender que muchas especies introducidas en un nuevo hábitat no logran establecer una población estable (Williamson y Fitter, 1996), pues su éxito como invasoras depende de superar al menos tres etapas (Deacon y Magurran, 2016): transporte (posibilidad de llegar a un lugar nuevo), establecimiento (capacidad para adaptarse al nuevo lugar, incluyendo la capacidad reproductiva) y movilización (capacidad de dispersarse a lo largo de nuevas áreas). En este sentido, para facilitar su establecimiento, las especies que llegan a un nuevo hábitat tienden a asociarse con una especie local cuando existe un "proyecto conjunto" (por ejemplo, buscar comida, explorar el entorno o evitar depredadores), lo que en principio brinda beneficio a las dos especies (Leimar y Hammerstein, 2010). Originalmente, la especie introducida P. gillii debió encontrarse en bajas densidades, por lo que una asociación heteroespecífica pudo haber mejorado sus condiciones de supervivencia (Stephen y Sutherland, 1999). En el río Atacames, esta asociación se ha podido evidenciar en el único lugar con registro de las dos especies viviendo juntas, que corresponde a la zona comprendida entre las dos represas. Sin embargo, por debajo e inmediatamente por encima de ellas solo habita P. gilli, dejando la presencia de P fria restringida solo a la zona alta del río.
Los cambios en la distribución altitudinal de las especies fluviales, generados por la presencia de especies introducidas, se han reportado en otros lugares similares. En el Perú, en la cuenca baja del Río Grande, región costera de Ica, la presencia de Poecilia reticulata y O. niloticus es exclusiva de la zona baja del río, segregando a otras especies a lo largo de los diez primeros kilómetros del cauce (Ortega et al., 2007).
El cambio en Rhoadsia minor para el presente estudio, que pasó de ser la quinta especie más abundante en 2012 a ser la tercera en 2017, posiblemente se deba a que su dieta herbívora exclusiva podría favorecer su desarrollo. Esto ocurriría no solo por cambios ambientales (como el incremento de la materia orgánica de origen antropogénico en la zona de estudio) en 2017, sino también por las modificaciones provocadas por O. niloticus, la cual también incrementó su abundancia en el segundo periodo del estudio debido, entre otros factores, a la mayor cantidad de fosfatos. Al respecto, se ha comprobado que O. niloticus modifica los regímenes de nutrientes al aumentar la disponibilidad de nitrógeno y fósforo a través de la excreción, lo cual promueve el crecimiento de algas y contribuye a la eutrofización del agua (Figueredo y Giani, 2005). Los peces omnívoros y exóticos, como la tilapia, pueden también afectar la producción primaria (Simon y Townsend, 2003) e incluso el intercambio con ecosistemas vecinos (Baxter et al., 2004); además, producen bioturbación debido a la excreción, afectan el acceso a la luz y la disponibilidad de nutrientes para otros organismos (Parkos et al., 2003; Simon y Townsend, 2003) y pueden ser vectores de enfermedades (Castro et al., 2014).
Aunque las especies introducidas son una amenaza para la biodiversidad nativa (Tittensor, et al., 2014; Bellard et al., 2016), es aun discutible el grado y la magnitud de sus efectos en casos de desplazamiento competitivo (Thomas, 2013; Hulme, et al., 2015). Sin embargo, es evidente que en el río Atacames se han presentado cambios en la diversidad y distribución de las comunidades de peces a lo largo del gradiente altitudinal en el transcurso de seis años con la presencia de dos especies introducidas.