INTRODUCCIÓN
Los hongos comestibles medicinales se han utilizado desde épocas remotas como parte integral de la dieta normal del hombre. Por ello pueden considerarse como alimentos funcionales con beneficios a la salud humana, además de sus propiedades nutricionales (Rathore et al., 2017). Al respecto, se ha propuesto un modelo en pirámide para el uso de este tipo de hongos en cuanto a sus cualidades como alimento, suplementos dietéticos y atributos medicinales (Chang y Wasser, 2012).
De manera general, los hongos contienen una serie de componentes que contribuyen a su valor nutricional, tales como proteínas, vitaminas y minerales. Además, presentan fibra dietética y abundancia de aminoácidos esenciales (Suárez y Nieto, 2013). También contienen compuestos de interés terapéutico, que incluyen moléculas de alto peso molecular como polisacáridos (principalmente β-D- glucanos), heteroglucanos, quitina, peptidoglucanos, proteoglucanos, lectinas y ácido ribonucleico, así como moléculas de bajo peso molecular como lactonas, fenoles, terpenoides y alcaloides, antibióticos y agentes quelantes de metales (Gargano et al., 2017).
La amplia gama de metabolitos secundarios identificados está relacionada con los procesos de biogénesis de los hongos comestibles, en los cuales influyen principalmente la naturaleza de los nutrientes que conforman el sustrato donde se desarrollan (Suárez y Nieto, 2013), además de las condiciones climáticas. Ello conlleva a que hongos presentes en regiones diferentes o que crezcan en sustratos que varíen en composición, puedan modificar su metabolismo (Sakamoto, 2018).
Los hongos comestibles se incluyen o clasifican dentro de los Basidiomicetos. Dentro de ellos, el género Pleurotus está ampliamente distribuido y se cultiva en muchos países (Carrasco-González et al., 2017). Este género resulta interesante desde el punto de vista nutricional debido a su contenido de proteínas, lípidos, niveles tolerables de ácidos nucleicos y por la presencia de vitaminas, minerales, fibra dietética y beta-glucanos (Golak-Siwulska et al., 2018), además, de su valor medicinal (Caz et al., 2015; Morris et al., 2017).
En la actualidad, el análisis comparativo de las propiedades funcionales y medicinales de los hongos es una problemática, y una de las causas reside en la heterogeneidad de la composición química y en los métodos de preparación de los productos, entre ellos los extractos y la purificación de los compuestos (Meneses et al., 2016). De ahí la necesidad de explorar la composición micoquímica de los bioproductos de estas setas en sus diferentes estados de crecimiento, ya sea durante la fermentación sólida o en el cultivo sumergido, ya que pueden utilizarse en el diseño de nuevas formulaciones nutracéuticas para el mejoramiento de la salud humana. Se requieren nuevos productos de origen natural, que además de contener nutrientes, tengan un efecto preventivo y terapéutico para diferentes desórdenes patológicos asociados al desbalance redox en el organismo, tales como cáncer, artritis reumatoide, aterosclerosis y procesos degenerativos asociados con la edad (Liguori et al., 2018).
Tomando en cuenta estos elementos, en el presente trabajo se determinaron los componentes macromoleculares mayoritarios, así como el contenido de compuestos fenólicos y la actividad antioxidante de extractos acuosos obtenidos de la especie Pleurotus ostreatus (Jacq. ex Fr.) P.Kumm. (1871), en diferentes estados de crecimiento durante la fermentación sólida.
Los trabajos publicados en este tema evidencian una amplia variación de la composición bioquímica y de las actividades biológicas de Pleurotus spp., influenciadas por las condiciones de cultivo. En este sentido, y al menos hasta la revisión realizada, este es el primer trabajo que aborda este aspecto, utilizando como sustrato la pulpa de café residual que se genera en grandes volúmenes en países caficultores de América Latina. Los resultados sientan las bases para la aplicación de los bioproductos obtenidos de esta seta, en las fases de crecimiento estudiadas, en las industrias alimentaria y médico-farmacéutica.
MATERIALES Y MÉTODOS
Material biológico
La investigación se desarrolló en la Planta de Investigación-Producción de Setas Comestibles del Centro de Estudios de Biotecnología Industrial (CEBI) de la Universidad de Oriente, Cuba. Se utilizó la cepa de P. ostreatus CCEBI 3024, depositada en la Colección de Cultivos del CEBI. Los primordios y cuerpos fructíferos maduros se obtuvieron por fermentación en estado sólido, utilizando como único sustrato pulpa de café (Coffea canephora), bajo las condiciones de cultivo referidas por Bermúdez et al. (2001). El estudio fue realizado de enero a junio de 2017.
Obtención de los extractos a partir de primordios y cuerpos fructíferos de P. ostreatus
Una vez colectados, los primordios y cuerpos fructíferos maduros se fragmentaron en trozos pequeños. Se utilizaron 500 g de material fresco, a los que se les adicionó 3 mL de agua destilada por cada gramo de biomasa. Los extractos se obtuvieron mediante tratamiento térmico de la biomasa durante diez horas a 90-95 °C.
Ambos extractos se centrifugaron a 3000 rpm durante diez min y se filtraron a través de una membrana de 0,22 μm. Se determinó el contenido de materia seca en cada caso. Los extractos resultantes se conservaron a 4 °C durante el período experimental.
En la presente investigación se establecieron las condiciones de cultivo y la obtención de los extractos de P. ostreatus referidas al tipo de solvente, la temperatura y el tiempo de extracción, las cuales se contemplan en la patente de invención, descrita por Morris et al. (2011). "Procedimiento para la obtención de un preparado inmunocéutico de Pleurotus spp". Certificado No. 23717 (Resolución 1754/2011) Ref: 2011/1337 de la República de Cuba.
Composición micoquímica de los extractos
Cuantificación de proteínas
La determinación de proteínas se realizó según Lowry et al. (1951). Las absorbancias se midieron a 595 nm en espectrofotómetro (T60 UV-Visible Spectrophotometer). Se utilizó albúmina de suero bovino, BSA (BDH, Alemania) para la curva patrón (y = 0,0018x + 0,0249; R2 = 0,9927). Los resultados se expresaron como μg en equivalentes de BSA por mL del extracto y como g en equivalente de BSA por 100 g del extracto (base seca).
Cuantificación de carbohidratos
Los carbohidratos totales se cuantificaron de acuerdo con el método del fenol-sulfúrico (Dubois et al., 1956). Se determinó la absorbancia en espectrofotómetro (T60 UV-Visible Spectrophotometer) a una longitud de onda de 490 nm. Se utilizó glucosa (Sigma) para la curva de calibración (y = 0,0033x - 0,0408; R2 = 0,995). Los resultados se expresaron como μg en equivalentes de glucosa por mL del extracto y como g en equivalente de glucosa por 100 g del extracto (base seca).
Determinación de azúcares reductores
Los azúcares reductores se determinaron mediante el método del ácido 3,5-dinitrosalisílico (DNS) (Miller, 1959). La absorbancia se determinó a 540 nm en espectrofotómetro (T60 UV-Visible Spectrophotometer). La glucosa (Sigma) se utilizó para la curva de calibración (y = 0,0004x - 0,007; R2 = 0,9942). Los resultados se expresaron como g en equivalente de glucosa por 100 g del extracto en seco.
Cuantificación de fenoles totales
La determinación del contenido de fenoles totales se llevó a cabo según Slinkard y Singlenton (1977) con el empleo del reactivo de Folin-Ciocalteu al 50 % (MERK). Se determinó la absorbancia a 765 nm en espectrofotómetro (T60 UV-Visible Spectrophotometer) y se comparó con una curva de calibración de ácido gálico (Sigma) (y= 15,944x - 0,0475; R2 =0,9983). Los resultados se expresaron como mg en equivalentes de ácido gálico por 100 g del extracto (base seca).
Determinación del contenido de flavonoides
La estimación del contenido de flavonoides se realizó por el método descrito por Zhishen et al. (1999). Se tomaron 250 μL de los extractos, los cuales se mezclaron con 1,25 mL de agua destilada y 75 μL de una solución al 5 % de NaNO2 (Riedel-de Haén). Luego de cinco min se añadieron a la mezcla 150 μL de una solución acuosa de AlCl3 (Reachim) al 10 %. Después de transcurridos seis min, se añadieron 500 μL de NaOH (Riedelde Haén) 1 M y 275 μL de agua destilada. La solución se mezcló bien y se leyó a 510 nm en un espectrofotómetro (T60 UV-Visible Spectrophotometer). Se utilizó catequina (Sigma) para la curva de calibración (y=0,9629x- 0,0002; R2=0,9999). Los resultados se informaron como mg en equivalentes de catequina por 100 g del extracto (base seca).
Actividad antioxidante de los extractos
El efecto antioxidante in vitro de los extractos se evaluó mediante el ensayo de captación del radical 2,2-difenil-1-picrilhidracilo (DPPH) según Shimada et al. (1992). Se empleó el radical 2,2 difenil -1-picrilhidracilo (DPPH) (MERCK) a una concentración de 1 mM. A 0,25 mL de los extractos a diferentes concentraciones (0,06-1 mg/mL), se le adicionó 1,5 mL de la solución etanólica de DPPH. Se agitó con vórtex (Heidolph REAX2000) y se mantuvo en la oscuridad por 20 minutos. Posteriormente se procedió a leer las absorbancias en espectrofotómetro (T60 UV-Visible Spectrophotometer) a 517 nm. La capacidad de secuestro del radical se determinó por el cálculo del porciento de inhibición de dicho radical mediante la ecuación: Ip DPPH % = (AP-AM) /AP *100, donde AP= Absorbancia del Blanco y AM= Absorbancia de la muestra. Se expresó además la capacidad de secuestro de este radical en función de las concentraciones de los extractos a las que se alcanza el 50 % de la inhibición (EC50).
Por otra parte, se estimó el poder reductor según Huang y Mau (2006). A 2,5 mL de los extractos se le añadió 2,5 mL de ferricianuro de potasio (Reachim) (1 %). La mezcla se incubó durante 20 min a 50 °C y una vez frías se les adicionó 2,5 mL de ácido tricloroacético (10 %). Se centrifugó (Tehtnica ŽELESNI) a 2000 rpm durante diez min. Posteriormente se tomaron 5 mL del sobrenadante y se añadió 5mL de agua destilada y 1 mL de cloruro férrico (Sigma Aldrich) (1 g/L). Luego la absorbancia se midió en espectrofotómetro (T60 UV-Visible Spectrophotometer) a 700 nm. Se utilizó el ácido ascórbico como sustancia antioxidante de referencia para el ensayo de poder reductor. El poder reductor se expresó como la concentración de los extractos a los que se alcanza el 50 % de la absorbancia máxima (EC50).
Análisis estadístico
Las muestran se procesaron por triplicado en experimentos independientes. Los resultados se expresaron como la media aritmética ± desviación estándar. Se utilizó la prueba t-Student para todos los ensayos con una p <0,05. El análisis estadístico se realizó con el programa STATGRAPHICS Centurion XV (Statgraphics Technologies, Inc, E.U.A).
RESULTADOS
En la figura 1 se muestran las características morfológicas de P. ostreatus en las fases de crecimiento de primordios y cuerpos fructíferos maduros cultivada sobre pulpa de café a los 17 y 20 días, respectivamente.

Figura 1 Fases de crecimiento correspondientes a primordios y cuerpos fructíferos maduros de Pleurotus ostreatus. a) primordios y b) cuerpos fructíferos maduros, creciendo sobre pulpa de café. Foto tomada por los autores en la Planta de Investigación- Producción de Setas Comestibles del Centro de Estudios de Biotecnología Industrial.
Composición micoquímica de los extractos
La composición macromolecular referida a proteínas presentes en los extractos mostró una concentración de 48,7±0,05 g/100 g de materia seca en el extracto de cuerpos fructíferos maduros obtenido a altas temperaturas, mientras que el extracto de primordios tuvo un valor de 45,3±0,01 g/100 g de materia seca (Tabla 1). Existen diferencias estadísticas significativas para p<0,05.
Tabla 1 Composición micoquímica de los extractos acuosos de Pleurotus ostreatus
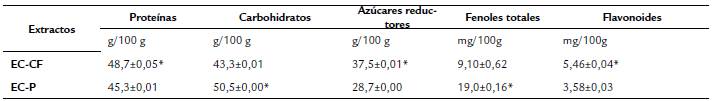
*Indica diferencias estadísticamente significativas. t- Student (p<0,05).
Cuerpos fructíferos: EC-CF; primordios: EC-P
Por otra parte, la concentración de carbohidratos totales en el extracto de primordios presentó un valor de 50,5±0,00 g/100 g de materia seca. En el caso del extracto de cuerpos fructíferos maduros, el valor fue de 43,3±0,01 g/100 g de materia seca (Tabla1). Estos valores presentaron diferencias estadísticamente significativas para p<0,05.
En cuanto a los azúcares reductores, el extracto de cuerpos fructíferos maduros mostró una concentración de 37,5±0,01 g/100 g de materia seca, mientras que la concentración en el extracto de primordios fue de 28,7±0,00 g/100 g de materia seca. Estos valores presentaron diferencias estadísticamente significativas para p<0,05.
Los resultados correspondientes al contenido de fenoles totales en los extractos de P. ostreatus en diferentes etapas de crecimiento durante la fermentación sólida se presentan en la Tabla 1. Los resultados indicaron la existencia de una concentración de compuestos fenólicos en el extracto de primordios (19±0,16 mg/100 g), con valores más altos, en comparación con los obtenidos en el extracto de cuerpos fructíferos maduros (9,1±0,62 mg/100 g). Estos valores presentaron diferencias estadísticamente significativas para p<0,05.
El extracto de cuerpos fructíferos maduros a altas temperaturas mostró un valor de flavonoides de 5,46±0,04 mg/100 g y el extracto de primordios de 3,58±0,03 mg/100 g, existiendo diferencias estadísticamente significativas para p<0,05 (Tabla 1).
Evaluación de la actividad antioxidante
En la figura 2 se muestran los porcientos de captación del radical DPPH y los valores de EC50 de ambos extractos acuosos de P. ostreatus en las diferentes etapas de crecimiento de la fermentación sólida. Los resultados mostraron que, en el extracto de primordios, los porcientos de captación del radical estuvieron en el rango de 15-35 %, superiores a los mostrados por el extracto caliente de cuerpos fructíferos maduros (16-26 %). Los valores de EC50 se estimaron en función de las concentraciones de los extractos a las que se alcanza el 50 % de la captación máxima. Se obtuvo un valor de 3,27 mg/mL en el extracto de cuerpos fructíferos maduros, con diferencias estadísticamente significativas (p<0,05) frente al del extracto de primordios, que resultó de 1,72 mg/mL.
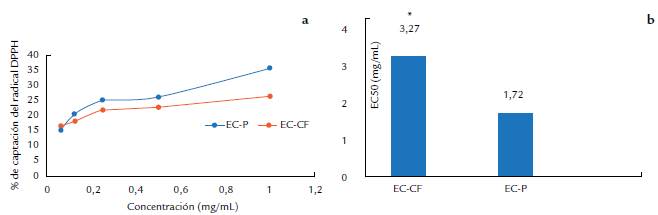
Figura 2 a. Captación del radical DPPH de extractos acuosos de cuerpos fructíferos de Pleurotus ostreatus en diferentes etapas de crecimiento. b. Valores de EC50 de los extractos. *indica diferencias estadísticamente significativas (t-student, p<0,05). Cuerpos fructíferos: EC-CF; primordios: EC-P
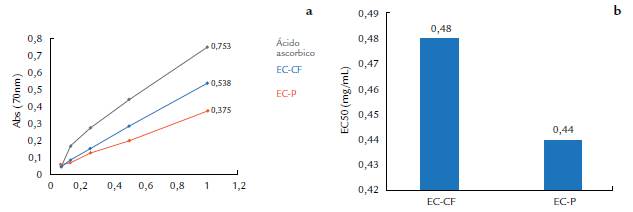
Las curvas representativas del poder reductor de los extractos acuosos en diferentes etapas de crecimiento durante la fermentación sólida de P. ostreatus se presentan en la figura 3. Los valores de EC50 obtenidos en nuestro estudio fueron de 0,48 ± 0,02 mg/mL para el extracto de cuerpos fructíferos maduros y de 0,44 ± 0,03 mg/mL en el extracto de primordios, sin diferencias significativas en el análisis estadístico realizado (p< 0,05).
DISCUSIÓN
Dentro de los hongos basidiomicetos se distinguen dos fases de crecimiento, la fase reproductiva (cuerpos fructíferos) y la fase vegetativa (micelio o crecimiento micelial). Durante la colonización del sustrato, las hifas crecen y se ramifican hasta formar el micelio (Sánchez, 2017). Este último, bajo condiciones favorables de humedad y temperatura, se extiende sobre un sustrato adecuado y se transforma en pequeños conglomerados denominados primordios, que van aumentando de tamaño hasta formar los cuerpos fructíferos maduros (Pelkmans et al., 2016).
Los estudios previos documentan que las esporas inmaduras y la fructificación madura de estos hongos poseen concentraciones variables de los metabolitos secundarios (Soares et al., 2009). Al respecto, Barros et al. (2007a) refirieron que en la fase de primordios las esporas de las setas son fuentes potenciales de metabolitos. El comportamiento en términos del metabolismo secundario, en general, varía con los géneros, las especies, las cepas e incluso las diferentes fases fisiológicas de crecimiento.
En el presente trabajo se observó que la composición de proteínas, azúcares reductores y flavonoides de P. ostreatus fue superior en el extracto acuoso de los cuerpos fructíferos maduros.
La extracción con un solvente polar como el agua, ofrece una serie de ventajas referidas a seguridad, economía y flexibilidad. En general, su naturaleza polar permite su uso como solvente de extracción de muchos productos, como proteínas, alcoholes, azúcares, sustancias inorgánicas y ácidos orgánicos, ente otros (Chemat et al., 2012).
El contenido de proteínas de los hongos depende de la composición del sustrato, el tamaño del píleo, el tiempo de cosecha y las especies de hongos (Salata et al., 2018). Al respecto, se ha reportado que no solo el contenido y naturaleza de proteínas en el sustrato tienen influencias en el contenido de proteínas en los cuerpos fructíferos (Wang et al., 2001).
El contenido de las proteínas de las setas comestibles resulta intermedio entre las de animales y vegetales, pero su calidad es superior por la presencia de todos los aminoácidos esenciales (Kinge et al., 2016). De acuerdo con Khan y Tania (2012), las especies de Pleurotus son reconocidas como buena fuente de proteínas, con valores de 11 a 42 g/ 100 g peso seco. En este sentido, Rodrigues et al. (2015) refirieron que el contenido de proteínas en cinco especies de Pleurotus cultivadas de forma similar osciló entre 16,2 y 26,6 g/100 g de peso seco. Los valores obtenidos en el presente estudio resultan superiores a los reportados por esos autores.
En estudios realizados por Okwulehie et al. (2014) con la especie Pleurotus pulmonarius Quél (1872) cultivada en diferentes sustratos (serrín de Khaya invorensis Chev y paja de Andropogon gayanus Kunth), se analizó la composición química y los valores nutricionales de dos estados de crecimiento de los cuerpos fructíferos (primordios y cuerpos fructíferos maduros). El contenido de proteínas mostró valores superiores (7,06±0,10 % y 8,51±0,10 %) en los cuerpos fructíferos maduros para ambos sustratos, respectivamente.
Algunas investigaciones refieren que en los extractos obtenidos a altas temperaturas se produce la agregación y precipitación de estas biomoléculas, fundamentalmente como resultado de las interacciones hidrofóbicas (Chávez et al., 1990). Luego, ocurre una pérdida durante las etapas de filtración y de centrifugación. Ello favorecerá el aislamiento y posterior purificación de sustancias estables al calor, como los glucanos.
Las proteínas de las setas comestibles también contribuyen a potenciar determinadas actividades biológicas de interés para el tratamiento de diversas patologías. De ahí que algunos investigadores como Liu et al. (2013), informaron la capacidad de barrido de radicales superóxido e hidroxilo con relación a la cantidad de proteínas presentes en complejos polisacáridos-proteínas. Los autores demostraron que en las muestras polisacarídicas, donde las concentraciones de proteínas son casi nulas (trazas), la actividad antioxidante es muy baja, no así en aquellas muestras ricas en proteínas. Lo anterior correlaciona positivamente la presencia de proteínas junto a otros compuestos, con las propiedades antioxidantes de un preparado biológico.
Por otra parte, los carbohidratos constituyen los componentes prevalecientes de la materia seca de los hongos comestibles, alrededor de un 55-81 % (Valverde et al., 2015). Se ha comprobado que la composición del sustrato utilizado para los cultivos de los hongos juega un papel primordial en su riqueza metabólica y dentro de ella se destacan los carbohidratos (García, 2008). El contenido total de carbohidratos de las setas, incluyendo los digeribles y los no digeribles, varía con la especie en un 35-70 % del peso seco (Díez y Álvarez, 2001). En las especies de Pleurotus, el contenido de carbohidratos con base en el peso seco se encuentra en un intervalo de 46,6 a 81,8 % (Rahi y Malik, 2016).
Según Kalac (2013), el contenido de carbohidratos constituye aproximadamente la mitad de la materia seca de los hongos y está presente principalmente como polisacáridos y glicoproteínas. Por ello, resultan adecuados para su incorporación a dietas bajas en calorías.
Los carbohidratos desempeñan un papel esencial durante el crecimiento y la fructificación de las setas comestibles (Zhou et al., 2016). En estudios realizados por Barros et al. (2007b), se evaluaron los efectos de la maduración de los cuerpos fructíferos de Lactarius deliciosus L. ex Fr. Gray, 1821 y Lactarius piperatus (L.) Pers. 1797 en su composición química. Los resultados mostraron que el contenido de carbohidratos decreció en ambas especies a medida que se incrementaba la maduración de sus cuerpos fructíferos. Esto puede estar basado en el papel energético de los carbohidratos, que son catabolizados por la producción de energía a lo largo del crecimiento de la seta. Nuestros resultados apoyan este hallazgo, pues los mayores valores se detectaron en la fase de primordio.
En cuanto a los azúcares reductores, resulta de interés su determinación, pues al poseer un grupo OH hemiacetálico libre, pueden reaccionar como reductores con otras moléculas. Los extractos de polisacáridos contienen glucosa como el componente monosacarídico mayoritario en la cadena principal y en una proporción variable con respecto a otros azúcares (Klaus et al., 2011). De igual forma, otras moléculas de azúcares pueden encontrarse unidas lateralmente a polisacáridos del tipo β-D-glucanos, tales como manosa, xilosa y galactosa (Wasser, 2002).
Los azúcares reductores son solo una pequeña parte del contenido de los carbohidratos, porque los polisacáridos como la quitina y el almidón son los más abundantes de los carbohidratos de los hongos (Manzi et al., 2001). Al respecto, en un estudio realizado por Shukla y Jaitly (2011) con cinco especies de setas comestibles, el contenido de azúcares reductores varió entre 0,026 y 0,035 % con respecto al peso seco. El máximo contenido de azúcares reductores se encontró en las especies P. citrinopilatus (0,035 %) y P. florida (0,033 %), seguidas por P. sajor-caju (0,032 %), P. djamor (0,031 %) y Hypsizygus ulmarius Bull (0,026 %).
Otra de las determinaciones realizadas en la presente investigación fue la concentración de fenoles totales y flavonoides. Estas biomoléculas guardan relación con la actividad antioxidante de un producto. En particular, se considera que los polifenoles pueden ser los principales compuestos antioxidantes en hongos comestibles (Valverde et al., 2015). Sin embargo, es importante evaluar el tipo particular de fenol presente en los hongos y su contribución individual a la capacidad antioxidante total.
El extracto acuoso de primordios mostró una mayor concentración de fenoles totales en comparación con el de cuerpos fructíferos maduros (Tabla 1). Este resultado concuerda con el reportado por Nattoh et al. (2016), quienes realizaron un estudio con cuatro fases de crecimiento de P. djamor R22; las fases primordiales de esta seta registraron los valores más altos para los extractos etanólico y acuoso (13,803±0,797 y 8,726±0,801 mg GAE/g peso seco, respectivamente), en cuanto a la concentración de polifenoles. Al respecto, reportaron que las setas comestibles poseen moléculas fenólicas, cuyas concentraciones variaban en las cuatro fases de crecimiento del hongo seleccionadas. Una explicación para esta observación se relaciona con la posible implicación de estos compuestos en el mecanismo de defensa, lo que reduce sus concentraciones con la maduración de los cuerpos fructíferos, como fue descrito por Radzki et al. (2014).
No obstante, otros trabajos refieren resultados contradictorios a los nuestros. Tal es el caso de González et al. (2016), quienes evaluaron de la actividad antioxidante de extractos acuosos y metanólicos de P. ostreatus en diferentes estados de crecimiento. Dichos autores encontraron valores de 4,21±0,01 mg GAE/g en el extracto de primordios a altas temperaturas, y 9,92±0,05 mg GAE/g en el extracto de cuerpos fructíferos. Estos valores reafirman la diferencia de concentración en dependencia de la etapa de crecimiento. Al respecto, Koutrotsios et al. (2017) realizaron un estudio en los basidiocarpos de dieciséis cepas de P. ostreatus y encontraron un contenido variable de fenoles totales que fluctuaron entre 1,27 y 8,62 mg GAE/100 g de peso fresco. En estudios realizados en L. piperatus se demostró que en el estado de cuerpos fructíferos maduros con esporas inmaduras se presentan altos contenidos de fenoles y flavonoides, en comparación con aquellos donde la madurez está presente, tanto en los carpóforos como en las esporas (Barros et al., 2007b).
Palacios et al. (2011) reportaron que la concentración de flavonoides depende de la especie en cuestión y no se correlaciona necesariamente con el contenido de compuestos fenólicos totales. En este sentido, los hongos podrían tener una aplicación comercial interesante como fuente de flavonoides, ya que en plantas están presentes en grandes concentraciones solo bajo condiciones fisiológicas específicas, como en las primeras etapas de desarrollo (Jourdan et al., 1985). Al respecto, se conoce que la acumulación de metabolitos secundarios como flavonoides y fenoles, es una repuesta de hongos y plantas al estrés biótico y abiótico (Selvamani et al., 2018). En particular, los ácidos fenólicos son producidos por hongos y plantas para la protección contra la luz ultravioleta, insectos e infecciones de patógenos y parásitos, entre otros. De ahí que el nivel de compuestos fenólicos depende de varios factores como técnicas de cultivo, condiciones de crecimiento, proceso de maduración, cosecha y condiciones de almacenamiento (Barros et al., 2009).
Consideramos que en las preparaciones de los extractos de la presente investigación no solo se valorizan los compuestos de bajo peso molecular. Estudios previos muestran que el tiempo de extracción y los solventes polares pueden favorecer la presencia de compuestos de alto peso molecular como los polisacáridos, lo cuales se han reportado como estimuladores o supresores de componentes específicos del sistema inmune. Además, tienen la capacidad de secuestrar radicales libres y pueden tener actividades antioxidante y antienvejecimiento.
La actividad antioxidante de los extractos evaluados mostró que los porcientos de captación del radical DPPH en el extracto de primordios fueron superiores (35,6 %) a los mostrados por el extracto de cuerpos fructíferos maduros (26,25 %). El valor de EC50 resultó ser menor en el extracto de primordios, lo que sugiere una mejor captación del radical en este bioproducto. Alispahic et al. (2015), en un estudio sobre la actividad antioxidante de extractos de hongos del mercado de Bosnia, reportaron un 43,88 % de captación de este radical en un extracto metanólico de cuerpos fructíferos de P. ostreatus. Por su parte, Sudha et al. (2012) informaron para P. eous valores de 12,42-70,21 % de captación del radical DPPH en un extracto acuoso por decocción a concentraciones de 2-10 mg/mL.
El poder reductor de los hongos medicinales podría estar relacionado con la capacidad de actuar como donantes de hidrógeno (Shimada et al., 1992). Dicho poder reductor es dependiente de la concentración, donde a medida que aumenta esta, si posee capacidad reductora, se incrementará la absorbancia. En nuestros resultados, a medida que aumentó la concentración de los extractos se incrementó la absorbancia a 700 nm. El incremento de la absorbancia a esta longitud de onda es proporcional a la cantidad de Fe3+ reducido a Fe2+ por la especie antioxidante evaluada.
Sudha et al. (2012), en un estudio sobre la actividad antioxidante de extractos de P. eous, obtuvieron para un extracto acuoso por decocción a 2 mg/mL, una absorbancia de 0,673. En nuestro trabajo, con 1 mg/mL, se obtuvo un valor de absorbancia de 0,538 para el extracto de cuerpos fructíferos maduros. Por otro lado, Boosong et al. (2016) obtuvieron una absorbancia de 0,37 a una concentración de 0,5 mg/mL en un estudio con extractos de cuerpos fructíferos de P. sajor-caju. Las propiedades del poder reductor, de este modo, pueden ser un indicador del potencial antioxidante de los compuestos que se evalúan (Meir et al., 1995). En general, los valores de EC50 referidos al poder reductor de los extractos de la presente investigación (Fig. 3) no mostraron diferencias significativas entre sí, en el análisis estadístico realizado.
Los resultados obtenidos sugieren que la fase de primordio en la biogénesis de compuestos bioactivos en la seta comestible P. ostreatus, cultivada sobre pulpa de café, también podría considerarse para realizar otros estudios in vitro o in vivo que sustenten sus propiedades antioxidantes con las consiguientes aplicaciones prácticas. La investigación genera nuevos interrogantes para el estudio de los mecanismos moleculares involucrados en la regulación de la formación y maduración de los cuerpos fructíferos de esta especie de seta.
CONCLUSIONES
La composición macromolecular de los extractos alcanzó valores superiores en la fase de crecimiento de cuerpos fructíferos maduros, con respecto al contenido de proteínas, azúcares reductores y flavonoides. Los resultados obtenidos a partir del estudio de las propiedades antioxidantes, particularmente los fenoles (2,1 veces superior en el extracto de primordios), sugieren variaciones en la concentración de moléculas bioactivas, atribuibles a la fisiología de las fases de crecimiento. Estos resultados revisten importancia para la identificación y cuantificación del perfil individual de estas moléculas con futuras aplicaciones en las industrias alimentaria y médico-farmacéutica y para el diseño y formulación de nuevos productos terapéuticos relacionados con el desbalance redox.